抗体的包被工艺以及该工艺制成的肌红蛋白测定试剂盒的制作方法
本发明涉及一种包被工艺,具体涉及一种抗体的包被工艺,并提供了该工艺制成的肌红蛋白测定试剂盒。
背景技术:
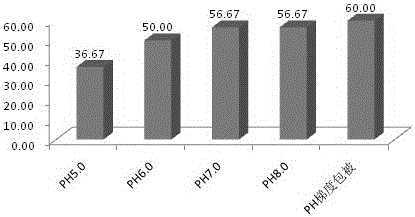
:肌红蛋白是一种小分子蛋白质,其分子结果与血红蛋白相似,具有在肌细胞内转运和贮存氧的功能。人体心肌、骨骼肌内含有大量肌红蛋白,正常人的血液中很少,主要由肾脏代谢并排泄。当心肌或横纹肌有损伤时,肌红蛋白便释放入血中,血清中的肌红蛋白即可明显升高,因此肌红蛋白测定可用于某些肌病和心脏病的诊断,如急性心肌梗死(AMI)、急性肌损伤、急慢性肾衰竭、严重充血性心力衰竭、长时间休克、肌营养不良、肌萎缩和多发性肌炎等疾病。胶乳增强免疫比浊法中,需采用物理或化学的方法将抗体吸附或偶联到胶乳微球的表面。其中物理吸附法存在稳定性不佳,抗体容易脱落下来,同时对于样本中的干扰物质的抗性差,容易产生假阳性的测定结果。化学偶联法将抗体随机偶联到微球表面,因偶联的随机性,可能导致部分抗体损失结合力,大大增加了试剂的成本。而现有采用化学偶联的方法制备的肌红蛋白测定试剂盒中,抗体与微球之间通常是采用多种化学物质搭桥来提高偶联效率,该方式会导致抗体微球的配制工艺更加复杂、成本更高。技术实现要素:本发明所要解决的技术问题是:现有抗体与微球的偶联效率通常是通过多种化学物质搭桥来提高,该方式导致抗体微球的配制工艺更加复杂、成本更高;本发明的目的在于提供仅仅只使用一种活化剂即可有效提高抗体与微球之间偶联效率的抗体包被工艺,并提供了包括该工艺制备的抗体微球的肌红蛋白测定试剂盒。本发明通过下述技术方案实现:一种抗体的包被工艺,包括:步骤一、将微球和活化剂分别溶于pH6.0的缓冲液中;步骤二、利用活化剂对微球表面的羧基进行活化得到活化微球;步骤三、将抗体加入到活化微球中进行偶联;步骤四、再将pH8.0的缓冲液加入到抗体偶联的活化微球中继续反应;步骤五、反应完成后加入封闭剂完成封闭即可。本发明采用的是不同于常规的抗体与聚苯乙烯微球化学偶联的方法,在常规的化学偶联的工艺上对包被过程中的pH值进行调整,将抗体与聚苯乙烯羧基微球有效连接,提高抗体与微球之间的有效结合,大大提高了化学偶联的效率,同时有效节约成本。进一步,所述缓冲液采用磷酸二氢钾-氢氧化钠缓冲液,所述微球采用聚苯乙烯胶乳微球,所述活化剂为EDAC。EDAC或EDC为同一物质,均为常用的水溶性碳二亚胺,是1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐。1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐(EDC)能够催化羧基,使其与氨基缩合形成酰胺键,反应条件温和、方便易行,只要蛋白质与要偶联的标记分子及EDC按一定比例混合到一起,室温下中性pH即可反应,一般1-2小时即可完成。更进一步地,所述步骤二中微球活化时间为30min,所述步骤三中抗体与微球的偶联时间为1h,所述步骤四中反应时间为1h。优选地,所述步骤五中封闭剂为酪蛋白或/和甘氨酸。为了能提高试剂的稳定性能,所述步骤五的封闭时间为30min,封闭完成后再加入pH8.0的缓冲液,调节pH后加入保护剂。优选地,所述保护剂为海藻糖或/和木糖醇。一种肌红蛋白测定试剂盒,包括R1试剂和R2试剂,所述R1试剂的配比为:磷酸二氢钾-氢氧化钠缓冲液50-150mmol/L,酪蛋白1-10g/L,TritonX-1005-10g/L,氯化钾15-30g/L,聚乙二醇5-30g/L,叠氮钠1g/L;所述R2试剂的配比为:磷酸二氢钾-氢氧化钠缓冲液50-150mmol/L,酪蛋白1-10g/L,叠氮钠1g/L,海藻糖20-50g/L,木糖醇20-50g/L,甘氨酸1-10g/L,采用上述工艺制成的结合有肌红蛋白抗体的聚苯乙烯胶乳微球,所述结合有肌红蛋白抗体的聚苯乙烯胶乳微球占R2试剂总体积的3-5%。本发明与现有技术相比,具有如下的优点和有益效果:1、本发明通过对包被过程中pH值的调整,使抗体与聚苯乙烯羧基微球有效连接,大大提高了化学偶联的效率;2、本发明仅仅只采用一种活化剂即可实现抗体与聚苯乙烯羧基微球之间的偶联,且偶联效率明显高于现有方法偶联的效率,操作更加简单、成本更加低廉,效果更加显著。具体实施方式为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。实施例1一种抗体的包被工艺,具体过程如下:步骤一、将微球和活化剂分别溶于pH6.0的缓冲液中;本步骤中所述缓冲液采用磷酸二氢钾-氢氧化钠缓冲液,所述微球采用聚苯乙烯胶乳微球,所述活化剂为EDAC。步骤二、利用活化剂对微球表面的羧基进行活化;即将包含有EDAC的缓冲液加入到溶解后的微球中进行微球表面羟基的活化,活化时间为30min。步骤三、然后将抗体加入到活化后的微球中进行偶联,偶联时间为1h;步骤四、再将pH8.0的磷酸二氢钾-氢氧化钠缓冲液加入到抗体偶联的微球中继续反应,反应时间为1h;步骤五、反应完成后加入酪蛋白和甘氨酸完成封闭,封闭时间为30min;封闭完成后再加入pH8.0的磷酸二氢钾-氢氧化钠缓冲液并调整pH值至7.5,然后加入海藻糖和木糖醇作为保护剂后保存即可。由于微球和抗体的添加量,以及封闭剂和保护剂的类型与添加量均与现有技术相同,因此上述各物质的添加量和添加种类不再一一赘述。本发明中仅仅只采用一种活化剂,即EDAC,并通过整个过程中pH梯度包被的方式有效实现抗体与微球之间偶联效率的增加,其检测结果如表1和图1所示。实施例2本实施例为实施例1的对照实施例,本实施例与实施例1的区别在于,本实施例修改了步骤三以后的具体操作过程,同时,本实施例整个过程中的pH值不同,该步骤三以后的具体过程如下:步骤三、然后将抗体加入到活化后的微球中进行偶联,偶联时间为2h;步骤四、反应完成后加入酪蛋白和甘氨酸完成封闭,封闭时间为30min;封闭完成后再加入与步骤一中pH值相同的磷酸二氢钾-氢氧化钠缓冲液,并调整pH值至7.5,然后加入海藻糖和木糖醇作为保护剂后保存即可。本实施例分别采用不同pH值的缓冲液进行试验,检测出不同pH包被后校准曲线的数值,检测出的数值结果如表1所示。表1浓度(ng/ml)pH5.0pH6.0pH7.0pH8.0pH梯度包被0142511221510010520027824534520025438758751171140054875411521015148280010101584227521012904并检测出不同PH条件下抗体与微球之间的偶联效率图,如图1所示。通过图1中偶联效率的显示可知,采用实施例1中pH梯度包被的方式,能极大地增加偶联效率,效果十分显著。实施例3本实施例与实施例1和实施例2的区别在于,本实施例中采用的活化剂选择为EDAC和Sulfo-NHS两种,即在活化过程中,同时采用EDAC和Sulfo-NHS对微球进行活化,其他操作步骤与实施例1和实施例2完全相同。本实施例同时给出了采用实施例1和实施例2中两种活化包被方法进行包被后的校准曲线的数值,该数值如表1所示,并检测出不同pH条件下的偶联效率图,如图2所示。表2通过图2的结果显示可知,采用本发明中pH梯度包被的方式相对pH固定值而言,抗体与微球之间的偶联效率有一定的提高。但通过实施例2与实施例3的试验数据对比可知:仅仅采用一种活化剂时,其偶联效率明显高于同时使用两种活化剂时,因而证明本发明的方法非常适用于仅仅采用一种活化剂时的微球偶联效率的提高,尤其适用于仅仅采用EDAC作为活化剂的微球偶联效率的提高。实施例4本实施例与实施例1的区别在于,本实施例对步骤2中的活化时间进行了调整,即把活化时间分别设定为15min,30min,45min,其他操作步骤与实施例1完全相同。本实施例同时给出了在不同活化时间条件下进行活化包被后的校准曲线的数值,该数值如表3所示。表3浓度(mg/ml)15min30min45min0301544100333345327200387711399400139714821411800286729042879通过上述表3可知,活化时间对抗体与微球之间的偶联效率无显著影响。实施例5本实施例与实施例1的区别在于,本实施例对步骤3中的抗体与微球的偶联时间设定为0.5h,1h,1.5h,或在步骤4中的中的继续反应时间设置为0.5h,1h,1.5h,其他操作步骤与实施例1完全相同。本实施例同时给出了在步骤3中,不同偶联时间条件下的校准曲线的数值,其他操作步骤与实施例1完全相同,该数值如表4所示。表4浓度(mg/ml)0.5h1.0h1.5h0141525100331345341200698711725400141114821433800287729042914本实施例中同时给出了在步骤4中,将pH8.0的缓冲液加入到抗体偶联的活化微球中后,不同反应时间的校准曲线数值,其他操作步骤与实施例1完全相同,该数值如表5所示.表5通过上述表4、表5可知,步骤3、步骤4的反应时间对偶联效率无显著影响。实施例6本实施例还公开了一种肌红蛋白测定试剂盒,该试剂盒包括R1试剂和R2试剂,所述R1试剂的配比为:磷酸二氢钾-氢氧化钠缓冲液50-150mmol/L,酪蛋白1-10g/L,TritonX-1005-10g/L,氯化钾15-30g/L,聚乙二醇5-30g/L,叠氮钠1g/L;所述R2试剂的配比为:磷酸二氢钾-氢氧化钠缓冲液50-150mmol/L,酪蛋白1-10g/L,叠氮钠1g/L,海藻糖20-50g/L,木糖醇20-50g/L,甘氨酸1-10g/L,采用实施例1的工艺制成的结合有肌红蛋白抗体的聚苯乙烯胶乳微球,所述结合有肌红蛋白抗体的聚苯乙烯胶乳微球占R2试剂总体积的3-5%。本发明采用上述试剂盒对肌红蛋白的含量进行检测,同时,采用日本生研肌红蛋白测定试剂盒作为对照试剂盒,检测结果如表6所示。表6通过上述表6可知,本发明最终试剂性能与日本生研肌红蛋白测定试剂盒性能一致,效果十分显著。以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1