采用CD137表达量检测淋巴细胞抗大肠癌活性的方法与流程
本发明涉及临床检测领域,具体为检测外周血单个核细胞表面的CD137表达量来检测淋巴细胞抗大肠癌的活性。
背景技术:
外周血单个核细胞,PBMC(peripheral blood mononuclear cell),指外周血中具有单个核的细胞,包含淋巴细胞、单核细胞、树突状细胞和其它少量细胞(造血干细胞等)。
流式细胞术(FlowCytometry,FCM)是利用流式细胞仪对细胞等生物粒子的理、化及生物学特性进行分析的方法。它集中了单克隆抗体技术、激光技术、计算机技术、细胞化学和免疫化学技术。利用流式细胞仪可以对细胞等生物粒子的理化及生物学特性(细胞大小、DNA含量、细胞表面抗原表达等)进行定量、快速、客观、多参数相关的检测。流式细胞仪的基本原理是采用流体动力学聚焦以保证细胞按同一方式逐一通过激光束(检测区)。当样本流中的细胞经过流动室中的检测区时,椭圆形的激光束即可检测到细胞信号。包括细胞的散射光以及细胞上标有的荧光染料发出的激光。T细胞及N K细胞是肿瘤免疫的重要效应细胞,是宿主抵抗肿瘤细胞生长的第一道防线。机体正常的免疫机制有赖于辅助性T细胞与抑制性T细胞比值的协调,故NK细胞、T淋巴细胞及其亚群能够直接反映机体细胞免疫的状态。研究发现,大肠癌患者C D 4+细胞值、C D 4+/C D 8+比值及N K细胞活性低于正常人,该变化趋势随D u k e s分期的进展而更明显,提示直肠癌患者的细胞免疫功能低下,随着肿瘤的进展机体抗肿瘤作用不断削弱,致使肿瘤在体内繁殖并迅速扩散。在肿瘤的发展过程中,肿瘤细胞分泌多种免疫抑制因子,诱导和激发产生抑制性T淋巴细胞,使C D 4+/CD8+比值下降。不利于T淋巴细胞和N K细胞的免疫监视作用,导致不能发挥有效的抗肿瘤作用,而导致肿瘤的迅速增大、扩散的发生。
免疫应答过程中T细胞的活化需要双信号的刺激。第一信号由T细胞上的抗原受体(TCR)与抗原递呈细胞(APC)表面的抗原肽-主要组织相容性复合物(MHC)的特异性结合提供:第二信号(又称为协同刺激信号)则来自T细胞与APC表面刺激协同分子在之间的相互结合。增强T淋巴细胞活化所需要的协同刺激信号是增强抗肿瘤免疫的重要方法。CD137(hu4-1BB)是一种新近发现的NTFR超家族新成员,存在于细胞膜表面的Ⅱ型跨膜蛋白,其胞外区富含半胱氨酸,胞内区含有5个氨基酸保守序列。近期发现CD137仅表达于活化的T细胞表面,静止的淋巴细胞不表达。CD137作为一种共刺激分子广泛存在于免疫细胞、组织细胞和肿瘤细胞表面,通过多种途径调节CD8+T、CD4+T细胞的增殖、分化与细胞因子的分泌,调节NK细胞的增殖与效应,进而促进机体的抗肿瘤免疫应答。研究进一步分析发现CD137在CD4+和CD8+T细胞上均表达。CD137在自身免疫病、某些肿瘤细胞中的表达及T细胞亚群的活化中都发挥了作用。同时CD137是继CD28/B7之外新发现的另一重要的T细胞协同刺激分子,CD137与CD137配体在维持T细胞,尤其是CTL细胞的活化/增殖等方面具有重要的意义。鉴于CD137-CD137L在免疫应答和免疫调节中所起的特殊作用,它们在肿瘤免疫、自身免疫病以及移植排斥中都具有重要的应用价值。
Cetuximab(中文参考商品译名:爱必妥,分子结构名:西妥昔单抗)西妥昔单抗属于嵌合型IgG1单克隆抗体,分子靶点为表皮生长因子受体(EGFR)。EGFR信号途径参与控制细胞的存活,增殖、血管生成、细胞运动、细胞的入侵及转移等。是大肠癌生物靶向治疗新药是免疫治疗药或免疫活化剂。首个获准上市的靶向单克隆抗体,治疗转移性结直肠癌。靶向的生物导弹,打击肿瘤细胞而很少伤及正常细胞。阻断肿瘤细胞信号传导,抑制癌细胞增殖,透导肿瘤细胞凋亡。
检测淋巴细胞抗肿瘤作用非常重要:首先发病初期淋巴细胞抗肿瘤作用较弱,可预测患者可能预后不佳,肿瘤侵袭度高。其次药物干预过程中,尤其是免疫药物干预过程中,患者淋巴细胞抗肿瘤作用的变化代表治疗的是否有效,及评估是否需要停药或换药。
现有技术中,细胞MTT(噻唑蓝)测试,只能通过检测一种活细胞的细胞数量用于检测药物对细胞的毒性作用,不能检测一种活细胞对肿瘤细胞的杀伤能力,对凋亡细胞的也不能检测。该方法在大肠癌疾病的早期诊断中的应用也尚未明确提出。另外由于MTT法操作步骤繁琐,过程不易实施,耗时,计算较复杂,检测方法的直观性也尚待进一步加强。因此急需找到一种新的发明来检测淋巴细胞抗大肠癌活性。
技术实现要素:
本发明要解决的技术问题是提供一种采用CD137表达量检测淋巴细胞抗大肠癌活性的方法。
为解决技术问题,本发明提供一种采用CD137表达量检测淋巴细胞抗大肠癌活性的方法,包括以下步骤:
(1)、采用以下任一方案:
方案①、从已分离于人体的外周血全血中分离出外周血单个核细胞PBMC;利用PBMC通过流式细胞术检测NK细胞上CD137的表达量;
方案②、利用已分离于人体的外周血全血,通过流式细胞术检测NK细胞上CD137的表达量;
(2)、根据CD137表达量判定淋巴细胞抗大肠癌的活性。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的改进,步骤(2)为:
当CD137占淋巴细胞的比例为(8.16±0.34)%,表示外周血单个核细胞中淋巴细胞的活性处于正常范围;
当CD137占淋巴细胞的比例高于(8.16±0.34)%时,表示外周血单个核细胞中淋巴细胞被活化(抗大肠癌活性更强);
当CD137占淋巴细胞的比例低于(8.16±0.34)%时,表示外周血单个核细胞中淋巴细胞处于免疫抑制状态(淋巴细胞的抗肿瘤功能受到了抑制)。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的进一步改进,方案①为包括以下步骤:
A、将收集的PBMC用改良RPMI 1640培养液稀释成1×106/L,于37℃、5%CO2的细胞培养箱中培养23~25小时(较佳为24小时),得细胞悬液;
改良RPMI 1640培养液为:在RPMI 1640培养液中加入10%体积量的FBS,以及加入青霉素直至浓度为100IU/L、加入链霉素直至浓度为100g/L;简述为RPMI 1640培养液(含10%FBS、100IU/L青霉素、100g/L链霉素);
B、取1ml的细胞悬液离心后去除上清,将所得的沉淀(即细胞)打散后,用PBS缓冲液(pH7.2~7.4)清洗,后将细胞打散,加入流式细胞仪专用鞘液(例如为Beckman coulter公司生产的8546733)100μl重悬,混匀于室温中静置至少1分钟,再加入连接有荧光素的抗体进行免疫标记反应,从而进行多标染色;
所述抗体为CD3、CD56、CD137;
所述免疫标记反应为于4℃孵育20分钟,然后用PBS缓冲液(pH7.2~7.4)清洗(1-2次),最后加入流式细胞仪专用鞘液400μl重悬;
C、流式细胞仪上观察细胞分子标记物CD137占淋巴细胞的百分比(分析流式图,处理数据)。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的进一步改进:方案①的步骤B中,抗体还包括CD4、CD8。
备注说明:CD4、CD8作为流式细胞仪的方案中调节补偿时候用到的;防止荧光色窜色到其他通道里面。
CD3、CD56、CD137、CD4、CD8,上述抗体标记不同颜色的荧光素。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的进一步改进,方案①的步骤B中,抗体CD3、CD56、CD137、CD4、CD8的用量分别为5ug、10ug、5ug、5ug、5ug。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的另一种改进,
方案②为包括以下步骤:
A、取肝素钠抗凝的外周血全血(即,静脉血)50ul静置于室温下的阴暗处,加入染色抗体,充分混匀,从而使抗体和全血充分接触;室温阴暗处静孵育20分钟;
所述抗体为CD3、CD56、CD137;
B、加入溶血素0.5ml,室温暗处孵育20分钟,离心(5分钟),弃上清,在离心所得沉淀中加入400μl流式细胞仪专用鞘液,混匀;
溶血素例如可选用BD FACS Lysing Solution溶血素,亦名红细胞裂解液,货号:349202;
C、流式细胞仪上观察细胞分子标记物CD137占淋巴细胞的百分比(分析流式图,处理数据)。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的进一步改进,方案②的步骤A中,抗体还包括CD4、CD8。
备注说明:CD4、CD8作为流式细胞仪的方案中调节补偿时候用到的;防止荧光色窜色到其他通道里面。
CD3、CD56、CD137、CD4、CD8,上述抗体标记不同颜色的荧光素。
作为本发明的采用CD137表达量检测淋巴细胞抗大肠癌活性的方法的进一步改进,所述方案②的步骤A中,抗体CD3、CD56、CD137、CD4、CD8的用量分别为10ul、10ul、10ul、6ul、8ul。
本发明的方法,可用于判断药物对大肠癌患者是否产生效果。当CD137占淋巴细胞的比例≤9.5%时,可判定属于无效。反之,判定有效。
备注说明:
外周血单个核细胞,PBMC(peripheral blood mononuclear cell),指外周血中具有单个核的细胞,包含淋巴细胞、单核细胞、树突状细胞和其它少量细胞(造血干细胞等)。
流式细胞分析仪根据淋巴细胞表面标志的不同来检测各淋巴细胞亚群。
淋巴细胞主要包括T淋巴细胞(CD3+),B淋巴细胞(CD19+),NK细胞(CD16+CD56+);自然杀伤细胞(natural killer cell,NK)是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生。
本发明中NK细胞作为免疫细胞,在淋巴细胞中对肿瘤细胞的杀伤能力是最强的,而CD137又是NK细胞上重要的表面标记物,所以采用CD137表达量检测淋巴细胞抗大肠癌活性的方法。
本发明具有如下技术优势:
本发明通过检测大肠癌患者外周血液内淋巴细胞上CD137的表达量来指示患者淋巴细胞抗大肠癌活性的能力,能够更直观精准地提示患者淋巴细胞的活性,进而更明确的说明淋巴细胞抗肿瘤细胞的活性的强度。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1为流式细胞仪检测,大肠癌患者(CRC)未经西妥昔单抗药物活化的外周血分离的PBMC中淋巴细胞以及体检中心健康成年人(HC)淋巴细胞上CD137的表达水平图。
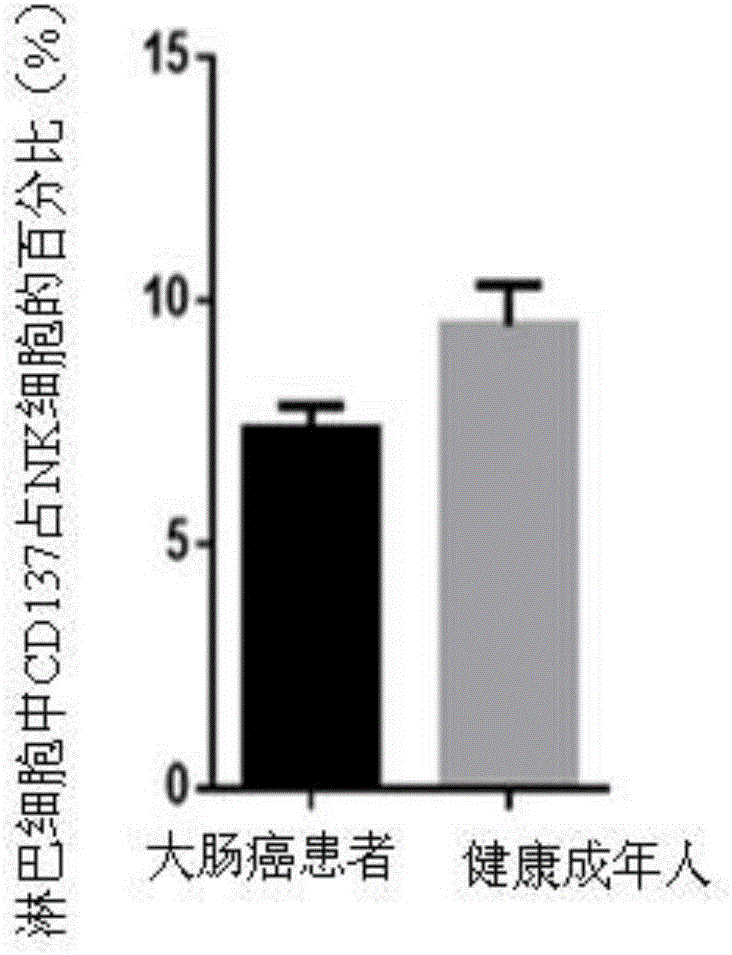
图2为健康成年人以及大肠癌患者CD137在NK细胞中所占的比例对比图;
图3为治疗前后的大肠癌患者的CD137在NK细胞中所占的含量,即,未经药物干预和应用过西妥昔单抗药物的大肠癌患者的淋巴细胞中的CD137的比例。
图4应用过西妥昔单抗药物的大肠癌患者,分组为药物有效和无效的淋巴细胞中CD137的比例与健康成年人中的淋巴细胞中的CD137的比例;即,西妥昔单抗药物治疗有效和无效的大肠癌患者的CD137在NK细胞中所占的比例。
具体实施方式
下面结合具体实施进一步阐述本发明,应理解,以下实施例仅用于说明本发明而不用于限制本发明的保护范围。
本发明实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
图像处理软件:Image Pro Plus6.0。
统计学方法:采用SPSS19.0统计分析软件分析,各样本均数的比较采用Student t test分析。
全血样本来自于浙江大学第一医院肝胆外科大肠癌患者血液样本,CD137及CD3、CD56、CD483等单抗购自美国BD公司以及美国Biolegend公司,流式细胞仪为美国贝克曼库尔特有限公司(Beckman Coulter,Inc.)的cantoII型号。离心管和离心机购自Thermo公司,淋巴细胞分离液,淋巴细胞冻存液等生化试剂均购自上海盛兆生物科技有限公司及上海达科为生物技术有限公司。荧光显微镜购自Olympus。
实施例1、一种流式细胞仪法检测CD137表达量评估淋巴细胞抗大肠癌活性的方法,依次进行以下步骤:
(1)从已脱离大肠癌患者的外周血中全血分离出外周血单个核细胞PBMC;
该步骤具体包括:
A、大肠癌患者血的收集:
由浙一医院提供已分离于大肠癌患者人体的外周血全血样本58例(患者已通过年龄,症状,病理切片金标准,影像学诊断等指标及根据临床表现评估的TNM分期的评分明确诊断患有大肠肿瘤);且由浙一医院国际健康保健中心提供已分离于健康体检对照者人体的外周血全血。
B、患者PBMC的分离:
将收集到的全血样本,置于离心机中3000rpm离心5分钟。吸出血浆后,将剩余血细胞液加入到已放入等体积PBS的15毫升离心管中充分混匀。将混匀后的液体沿离心管壁缓慢加入到已放入与PBS等体积的人淋巴细胞分离液(例如为天津市灏洋生物制品科技有限责任公司生产的货号LTS1077N),注意不要与人淋巴细胞分离液混合。上述操作完成后,将离心管置入离心机2000rpm离心20分钟(备注说明:离心后会形成由上至下细胞分四层。第一层为胎牛血清液层。第二层;为环状乳白色淋巴细胞。第三层;为透明分离液层。第四层;为红细胞层),收集第二层细胞放入PBS 4-5毫升的试管中,充分混匀后,以1500-2000转/分离心5分钟。沉淀经反复洗2次(采用PBS进行洗涤)即得所需细胞PBMC。
PBS,即,PBS缓冲液(pH7.2~7.4)。
(2)通过流式细胞仪检测淋巴细胞中CD137的表达量;
该步骤具体包括:
A、细胞膜上免疫荧光直接标记法:将收集的PBMC用RPMI 1640培养液(含10%FBS、100IU/L青霉素、100g/L链霉素)稀释成1×106/L各取1ml细胞悬液分别加入24孔板中,每个样本设4个组(即,PBMC的来源分别为如下4种情况):
①健康成年人对照组;
②Cetuximab(中文参考商品译名:爱必妥,分子结构名:西妥昔单抗)刺激24小时组;即,大肠癌患者细胞中加入4ul西妥昔单抗药物刺激(细胞终浓度为100mg/L),放入细胞培养箱中24小时后收集细胞;
③Cetuximab刺激48小时组;即,大肠癌患者细胞中加入4ul西妥昔单抗药物刺激(细胞终浓度为100mg/L),放入细胞培养箱中48小时后收集细胞;
④未加任何刺激的大肠癌患者组;
在37℃、5%CO2的细胞培养箱中培养。
备注说明:RPMI 1640培养液(含10%FBS、100IU/L青霉素、100g/L链霉素),即,在RPMI 1640培养液中加入10%体积量的FBS,以及加入青霉素直至浓度为100IU/L、加入链霉素直至浓度为100g/L。
B、温箱中孵育24h后,取1ml的孵育所得的细胞悬液离心(1200的转速离心5分钟)后去上清,将细胞打散后,用PBS缓冲液(pH7.2~7.4)洗一遍,后将细胞打散,加入流式细胞仪专用的鞘液(例如为Beckman coulter公司生产的8546733)100μl重悬,混匀于室温中静置1分钟,再直接加入连接有荧光素的抗体进行免疫标记反应,做多标染色,把几种标记有不同荧光素的抗体同时加入。标记有不同荧光素的抗体具体为CD3、CD56、CD137、CD4、CD8,用量分别为5ug、10ug、5ug、5ug、5ug。
4℃冰箱孵育20分钟后,用PBS缓冲液(pH7.2~7.4)洗1-2次,加入流式细胞仪专用的鞘液400μl重悬。
备注说明:CD137是用来标记淋巴细胞上NK细胞的表达量的,NK细胞等淋巴细胞可以通过免疫反应杀伤肿瘤细胞,所以通过淋巴细胞上CD137的表达量(即CD137占淋巴细胞的百分数),就可以知道不同淋巴细胞杀伤肿瘤细胞的能力强弱。CD137是NK细胞上的分子标记物。
加入不同荧光素的抗体的目的是标记外周血单核细胞中不同淋巴细胞上的分子,从而标记出T淋巴细胞和B淋巴细胞等。
C、流式细胞仪上观察细胞分子标记物CD137占淋巴细胞的百分比,分析流式图,处理数据。
本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
(3)具体结果如下:
健康成年人对照组,细胞培养后经过流式细胞仪检测后,CD137占外周血单个核细胞PBMC中淋巴细胞的比例范围在(8.16±0.34)%(是指P<0.05,该数值有统计学意义)时,表示外周血单个核细胞中的淋巴细胞的CD137表达量处于正常范围;
Cetuximab刺激24小时或者48小时后,CD137占外周血单个核细胞PBMC中淋巴细胞的比例高于(8.16±0.34)%(是指P<0.05,该数值有统计学意义)时,表示外周血单个核细胞中淋巴细胞抗大肠癌的活性被激活或者增强;
未加任何刺激的大肠癌患者,CD137占外周血单个核细胞PBMC中淋巴细胞的比例低于(8.16±0.34)%的均值。并且,该比例数据与大肠癌患者应用靶向药物西妥昔单抗的时间长度呈正态分布。
在该案例中,据以判断的数据来源是:从2014年10月到2015年12月共收集健康人、肝胆外科病人(大肠癌患者)共580例,两组群体年龄呈正态分布,实验比较,组间特异性指标后归纳总结得出大肠癌患者的CD137的表达量是低于正常范围均值的(8.16±0.34)%(是指P<0.05,该数值有统计学意义),而用西妥昔单抗治疗后的大肠癌患者的淋巴细胞上CD137的表达量是高于正常范围均值得。被视为淋巴细胞的抗大肠癌活性被激活,抗大肠癌活性增强。健康成年人的淋巴细胞上的CD137的表达量也在正常范围内。
实施例2、一种流式细胞仪法检测CD137表达量评估淋巴细胞抗大肠癌活性的方法,依次进行以下步骤:
1)、应用流式细胞仪检测淋巴细胞中CD137的表达量:
该步骤具体包括:
A、收获细胞:肝素钠抗凝的外周血全血(即,静脉血),分为5个BD流式管,每个流式管50μl全血,静置于室温下的阴暗处进行细胞表面染色,即,在每个BD流式管同时加入细胞染色抗体----10ul的CD137,10ul的CD3,10ul的CD56,6ul的CD4,8ul的CD8等抗体;上述抗体标记不同颜色的荧光素。充分混匀(血细胞浓度约为2×106/ml),从而使抗体和全血充分接触,室温阴暗处静静孵育20分钟。
B、加入溶血素(每个BD流式管加入0.5ml),室温暗处孵育20分钟,离心(1200rpm,5分钟),弃上清。加入400μl流式细胞仪专用鞘液,混匀细胞。
溶红素例如可选用:BD FACS Lysing Solution溶血素,亦名红细胞裂解液货号:349202。
C、流式细胞仪上观察细胞分子标记物CD137占淋巴细胞的百分比,分析流式图,处理数据。
(3)大肠癌患者的淋巴细胞中的CD137的表达量低于正常范围(8.16±0.34)%(是指P<0.05,该数值有统计学意义),说明大肠癌患者有免疫功能的缺陷,淋巴细胞上的CD137的功能未活化,低于正常范围;经过化疗或西妥昔单抗药物干预后的大肠癌患者与健康成年人相比较,CD137占外周血的淋巴细胞的比例高于(8.16±0.34)%(是指P<0.05,该数值有统计学意义)时,表示经过药物干预后大肠癌患者的免疫细胞功能有所恢复,外周血中淋巴细胞抗大肠癌的活性被激活或者增强;并且,该比例数据与大肠癌患者应用靶向药物西妥昔单抗的时间长度呈正态分布。
在该案例中,据以判断的数据来源与具体实施例1一致。
实验1:
按照实施例1所述方法,收集浙江大学医学院附属第一医院肝胆外科就诊大肠癌患者20例(未做过任何治疗)的全血样本。以及浙大一院国际体检中心的健康体检者20例。经检测,大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量的均值为7.43%,其数据显著低于健康成年人的淋巴细胞中CD137的正常范围的表达量的均值8.5%这一数据(结果如图1和图2所示)。
基于该分析结论,可以对大肠癌患者的早期淋巴细胞的活性加以判断,为后续采取相应减少患者肿瘤发生发展转移的措施提供量化依据。
实验2:
按照实施例2所述方法,收集浙江大学医学院附属第一医院肝胆外科就诊大肠癌患者(应用西妥昔单抗免疫活化剂治疗后,治疗期为至少2个月)20例全血样本;以及未使用任何药物治疗的大肠癌患者20例的全血样本。
经检测,药物治疗前的大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量均值为7.43%,免疫活化剂西妥昔单抗用药后的大肠癌患者的表达量均值为12.48%(结果如图3所示)。
基于该分析结论,可以对大肠癌患者的早期淋巴细胞抗大肠癌的活性加以判断,为后续采取相应措施减少患者肿瘤发生发展转移提供量化依据。
实验3:按照实施例1所述方法,收集浙江大学医学院附属第一医院肝胆外科就诊大肠癌患者(应用西妥昔单抗靶向药物治疗后,治疗期为至少2个月)40例全血样本;分为用药后有效组以及用药后无效组(治疗期后停止应用西妥昔单抗30天后视为无效组,用药后肿瘤变大视为无效组)两组。2周后经检测,治疗有效的大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量均值为12.48%,其数据高于用药后无效组的大肠癌患者的淋巴细胞中的CD137的表达量9.28%这一数值。
实验4、
按照实施例2所述方法,收集浙江大学医学院附属第一医院肝胆外科就诊大肠癌患者(应用西妥昔单抗靶向药物治疗后,治疗期为至少2个月)40例全血样本;分为用药后有效组以及用药后无效组(治疗期后停止应用西妥昔单抗30天后视为无效组,用药后肿瘤变大视为无效组)两组。2周后经检测,治疗有效的大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量均值为12.48%,其数据高于用药后无效组的大肠癌患者的淋巴细胞中的CD137的表达量9.28%这一数值(结果如图4所示)。
备注说明:坚持服用药物最少半年以上,肿瘤的体积,在影像学的检测手段下检测,大于原数据的5-10%,即为用药后肿瘤变大。
基于该分析结论,可以对大肠癌患者的早期淋巴细胞抗大肠癌的活性加以判断,为后续采取措施相应减少患者肿瘤发生发展转移提供量化依据。
对比例1、将实施例1中的细胞悬液用生理盐水稀释一倍后,取1ml进行后续步骤的操作。其余等同于实施例1。
对比例、将实施例2步骤B)中的“加入溶血素0.5ml,室温暗处孵育20分钟,离心(1200rpm,5分钟),弃上清;加入400μl流式细胞仪专用鞘液”改成“加入溶血素1ml,室温暗处孵育10分钟,离心(1200rmp,5分钟),弃上清。加入500μl流式细胞仪专用鞘液”;其余等同于实施例2。
按照此对比例所述方法对“实验2”中的样本进行检测,所得结果为:药物治疗前的大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量均值为10.08%(百分率比例明显变大),免疫活化剂西妥昔单抗用药后的大肠癌患者的表达量均值为14.21%。
按照此对比例所述方法对“实验4”中的样本进行检测,所得结果为:治疗有效的大肠癌患者的外周血单个核细胞的淋巴细胞中CD137表达量均值为13.98%,用药后无效组的大肠癌患者的淋巴细胞中的CD137的表达量为11.42%。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!