用于预测辅助受精中植入成功性的测定法和试剂盒的制作方法
技术领域
本发明涉及用于预测辅助受精中植入成功性的测定法和试剂盒。
背景技术:
辅助受精,例如体外受精(in vitro fertilization,IVF)或细胞质内精子注射(intracytoplasmic sperm injection,ICSI)成功用于患有不育症的人患者已有三十年。尽管进行了广泛的研究,但是这仍然是一个困难且昂贵的操作,并且通常观察到每移植胚胎的植入率低(15-20%)。
提供辅助受精服务的医院和私人机构基于所产生胚胎的特征进行卵母细胞受精后的选择。例如,选择可基于胚胎的形态(Guerif F et al.,2007,Hum Reprod22(7):1973)或者基于胚胎产生可溶性HLA-G的情况(Fuzzi B,et al.,2002,Eur J Immunol.Feb;32(2):311-5.)。这两种技术都要求胚胎的介入。
为了增加妊娠的成功率,所移植胚胎的数目通常大于一个。在欧洲,通常移植两个胚胎到子宫腔内。在美国则更多,经常移植三个或四个胚胎。此策略的不利作用是增加了多胎妊娠数以及随后的相关产科疾病,例如早产和低出生率。
另外,辅助受精是一个昂贵的过程,并且还可造成患者的精神创伤。手术过程需要收集用于辅助受精的卵,受精之后需要另外的手术将受精卵植入子宫。然后,接受者必须等待一段时间,然后才可确定妊娠是否已经建立。在一些情况下,尽管重复多次,仍可能无法建立妊娠,这些情况在经济和人力方面都给社会带来了巨大耗费。
因此,希望提供可在受精之前指示卵母细胞植入潜力的测定法和试剂盒,使得成功植入胚胎的机会最大化,并允许低成功率指征以用于避免辅助受精的上述创伤和花费。
附图说明
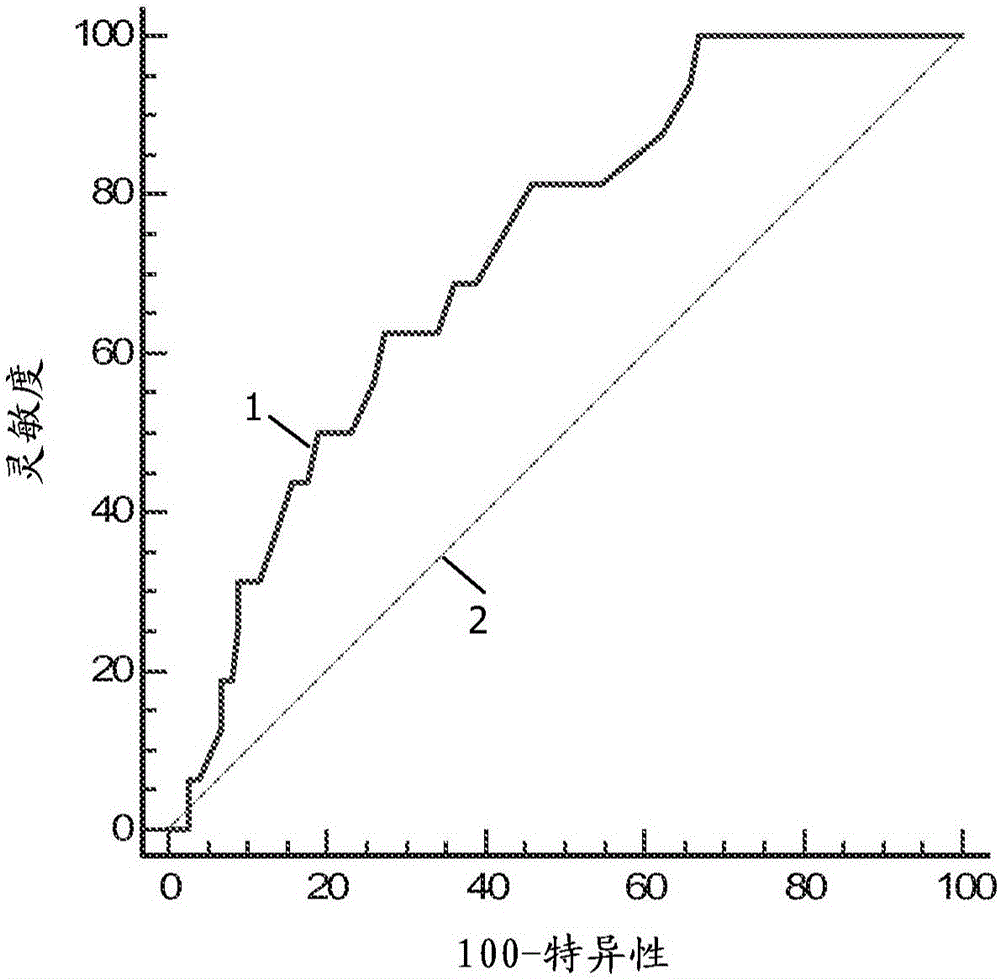
图1.来自使用Biorad Luminex试剂盒检测FF G-CSF的Luminex实验的ROC曲线。针对FF-GCSF浓度的不同截断点,将真阳性率(灵敏度)作为假阳性率(100-特异性)的函数作图。ROC曲线上的每个点代表对应于特定判别阈值的灵敏度/特异性对。ROC曲线下方的面积是FF-G-CSF能在何种程度上区分两个主要诊断组(确定植入/未植入)的量度。线1:曲线下面积是0.82,表明在82%的时间里来自阳性组的随机选择个体的测试值大于来自阴性组的随机选择个体的测试值。线2:ROC曲线下面积是0.5,代表无效假设。
图2.来自使用R&D Luminex试剂盒检测FF G-CSF的Luminex实验的ROC曲线。线3:曲线下面积是0.72,表明在72%的时间里来自阳性组的随机选择个体的测试值大于来自阴性组的随机选择个体的测试值。线4:ROC曲线下面积是0.5,代表无效假设。
图3.显示获得自多个受试者的同一组胚胎的个体卵泡液中浓度的变异。每个柱显示在所产生之同一组胚胎中个体卵泡液相对于平均值的变异。
技术实现要素:
本发明基于发明人的如下意外发现,即卵巢过度刺激(ovarian hyperstimulation)下提供多个卵母细胞的雌性受试者会表现出在每个卵母细胞所来源的卵泡之卵泡液(follicle fluid,FF)中存在的多种细胞因子和生长因子水平的变异。另外,本发明人发现在卵母细胞所来源之个体卵泡的卵泡液中存在的高水平粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)与由所述卵母细胞受精所得胚胎的高植入潜力之间存在高度相关性。此前从未证明,对于同一受试者,围绕每个卵母细胞的卵泡液可能在组成上发生变异,并且所述组成指示随后受精卵植入的成功性。此发现允许对获自单个患者的多个胚胎按照植入潜力进行排序。首次发现,使用卵母细胞平均受精率标志物(例如11-β HSD)之指标显示出临界受精潜力(borderline fertility potential)的患者可能会具有显示出高植入潜力的卵母细胞,尽管总体平均值较差;这为之前显示不孕的雌性提供了新的机会。另外,所述方法提供了在不干扰胚胎或卵母细胞的情况下对每个卵母细胞单个分级并由此对胚胎单个分级的可能性。
本发明涉及用于确定通过对雌性受试者卵母细胞进行辅助受精获得或将获得的多个胚胎各自的植入潜力的测定法,所述测定法包括测量每个卵母细胞所来源的卵泡中存在的卵泡液中G-CSF水平,以及从所测量的卵泡液G-CSF水平确定每个胚胎的植入潜力。来自具有最高卵泡液G-CSF水平之卵泡的卵母细胞将得到具有最大植入潜力的胚胎。
本发明涉及可用于预测雌性患者中辅助受精结果的检测试剂盒。本发明还涉及用于受精处理方法以改善植入的测定法和试剂盒。
本发明的一个实施方案是用于确定雌性受试者通过辅助受精获得或将获得的胚胎的植入潜力的测定法,其包括:
(i)针对收集自所述受试者的多个卵母细胞,测量每个所收集卵母细胞的卵泡的卵泡液中存在的卵泡液粒细胞集落刺激因子(G-CSF)水平;和
(ii)从所测量的FF G-CSF水平确定通过所述卵母细胞的辅助受精获得或将获得的胚胎的植入潜力。
本发明的另一个实施方案是如上所述的测定法,其中具有最高FF G-CSF水平的卵母细胞具有最高的植入潜力。
本发明的另一个实施方案是如上所述的测定法,其中每个FF样品获得自卵泡吸出物。
本发明的另一个实施方案是如上所述的测定法,其中在收集卵泡吸出物的20小时内测量各自的FF G-CSF水平。
本发明的另一个实施方案是如上所述的测定法,其中FF-CSF水平等于或小于20.6pg/ml确定为没有植入潜力或具有低植入潜力。
本发明的另一个实施方案是如上所述的测定法,其中FF-CSF水平等于或大于24.0pg/ml确定为具有高植入潜力。
本发明的另一个实施方案是如上所述的测定法,其中使用免疫测定法测量各自的FF G-CSF水平。
本发明的另一个实施方案是如上所述的测定法,其中使用竞争性或免疫测量测定法如RIA、IRMA、ELISA或ELISPOT测定来测量各自的FF G-CSF水平。
本发明的另一个实施方案是如上所述的测定法,其中使用Luminex测定来测量各自的FF G-CSF水平。
本发明的另一个实施方案是如上所述的测定法,其中所述Luminex测定使用Biorad或者R&D Luminex试剂盒。
本发明的另一个实施方案是如上所述的测定法,其中通过测定FF G-CSF mRNA水平测量各自的FF G-CSF水平。
本发明的另一个实施方案是如上所述的测定法,其中通过表面等离子共振、荧光共振能量转移、生物发光共振能量转移、荧光淬灭荧光、荧光偏振法、MS、HPLC、HPLC/SM、HPLC/MS/MS、毛细管电泳、柱凝胶电泳或板式凝胶电泳中的任意方法来测量各自的FF G-CSF水平。
本发明的另一个实施方案是用于实施如上所述测定的试剂盒,其包含适于检测FF G-CSF或FF G-CSF mRNA水平的至少一种试剂。
本发明的另一个实施方案是如上所述的试剂盒,其还包含一组FF G-CSF的浓度标准品。
本发明的另一个实施方案是如上所述的试剂盒,其还包含用于从受试者提取卵母细胞和卵泡液的多个吸取器尖端(aspirator tips)。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据如上所述测定法确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使与具有高植入潜力的胚胎相对应的卵母细胞受精,和
(iv)将由此获得的胚胎植入雌性受试者。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据如上所述测定法确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使卵母细胞受精以获得胚胎,和
(iv)植入具有高植入潜力的胚胎。
具体实施方式
除非另有指明,本文使用的所有科技术语具有与本领域技术人员通常所理解相同的含义。本文所引用的所有出版物通过参考并入本文。本文所引用的所有美国专利和专利申请通过参考以包括附图的整体并入本文。
本文所用的没有数量限定的物品指一个或多于一个,即至少一个该物品的语法客体。例如,“样品”指一个样品或多于一个样品。
带有端点的数值范围的记载包括此范围内的所有整数以及适当时包括此范围内所包含的分数(例如1至5,例如当指样品数时可包括1、2、3、4,例如当指浓度时还可包括1.5、2、2.75和3.80)。端点的记载也包括端点值自身(例如1.0至5.0包括1.0和5.0)。
如其它部分所述,本发明涉及本发明人的下述意外发现,即过度刺激卵巢时提供多个卵母细胞的雌性受试者会表现出每个卵母细胞所来源的卵泡之卵泡液中存在的多种细胞因子和生长因子水平的变异。另外,本发明人发现,在卵母细胞所来源个体卵泡之卵泡液中存在的高水平粒细胞集落刺激因子(G-CSF)与由所述卵母细胞受精所得胚胎的高植入潜力之间存在高度相关性。此前从未证明,对于同一受试者,围绕每个卵母细胞的卵泡液可能在组成上发生变异,所述组成指示随后受精卵的成功植入。此发现允许对获自单个患者的多个胚胎按照植入潜力进行排序。首次发现,使用卵母细胞平均受精率标志物(例如11-β HSD)之指标显示出临界受精潜力的患者可具有显示出高植入潜力的卵母细胞,这与总体平均值较差相反;这为之前显示不孕的雌性提供了新的机会。另外,所述方法提供了在不干扰胚胎或卵母细胞的情况下对每个卵母细胞单个分级并由此对胚胎单个分级的可能性。
因此本发明涉及可用于预测雌性患者中辅助受精结果的测定方法和测定试剂盒。本发明还涉及用于受精处理方法以改善植入的这种测定法和试剂盒。尽管下述本发明是从针对人女性患者的研究中开发出来的,但是它可用于任何雌性哺乳动物并可用于增加例如濒危物种圈养繁殖计划的成功率或者通过家畜(如牛或马)辅助受精的商业繁殖的成功率。优选地,所述受试者已经历了受精预处理(例如卵巢过度刺激)以增加每个月经周期产生的卵子数。本文所使用的辅助受精指卵母细胞在雌性体外受精的离体受精方法,例如体外受精(in vitro fertilization,IVF)或细胞质内精子注射(intracytoplasmic sperm injection,ICSI)。
本发明的一个实施方案是用于确定通过对雌性受试者卵母细胞进行辅助受精获得或将获得的多个胚胎中每个的植入潜力的测定法,其包括测量每个卵母细胞所来源的卵泡中存在的卵泡液中G-CSF的水平,以及从所测量的卵泡液G-CSF水平确定每个胚胎的植入潜力。
本发明的另一个实施方案是用于确定雌性受试者通过辅助受精获得或将获得的胚胎的植入潜力的测定法,其包括:
(i)针对收集自所述受试者的多个卵母细胞,测量每个所收集卵母细胞的卵泡的卵泡液(FF)中存在的卵泡液粒细胞集落刺激因子(G-CSF)水平;和
(ii)从所测量的FF G-CSF水平确定通过所述卵母细胞的辅助受精获得或将获得的胚胎的植入潜力。
来自具有最高卵泡液G-CSF水平之卵泡的卵母细胞产生具有最大植入潜力的胚胎。
粒细胞集落刺激因子(G-CSF)是天然产生的细胞因子,其属于造血细胞生长因子家族(Clark,et al.,1987,Science 236(4806):1229)。所描述的其主要作用是作用于中性粒细胞谱系的造血细胞的增殖、分化和活化(Mielcarek et al.,1996.,Blood 87(2):574,Visani et al.,1995,18(5-6):423)。主要由造血细胞产生的G-CSF也由非造血细胞产生,例如在生殖道中:人黄素化卵巢颗粒细胞(Salmassi A,et al,2004,Fertil Steril,81Suppl 1:786.)、子宫内膜细胞(Giacomini G,et al.,1995,Hum Reprod 10(12):3259.)、蜕膜和胎盘(Duan J.S.,1990,Osaka City Med J 36(2):81;Miyama M et al.,1998,Osaka City Med J.,44(1):85)以及多种胎儿组织(Calhoun et al.,1999.Pediatr Res 46(3):333)。在卵巢中,G-CSF蛋白及其受体主要定位(Western印迹和免疫组化)于卵泡的颗粒细胞(颗粒细胞)以及黄体细胞中(Salmassi,et al.,2004)。
优选地,在收集卵母细胞当天测量卵泡液G-CSF(FF G-CSF)水平。如本领域技术人员所知的,在局部或全身麻醉后使用穿阴道超声检查引导卵泡吸取。分别吸取与通过阴道超声检查显现的一个卵泡所对应的每份卵泡液。对每个卵母细胞的捕获不需要任何其它操作,因为围绕着卵母细胞的卵泡液与卵母细胞一起被吸取。在显微镜下检查卵泡液能够立刻鉴定出卵母细胞的存在。不汇集卵泡液及各个卵母细胞,而是在收集时将卵母细胞分开,从而可以分别测量各自的FF G-CSF水平。根据本发明的一个方面,在收集卵母细胞的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20小时内测量FF G-CSF的水平,或者在任意两个上述值之间的时间内测量。优选地,在收集卵母细胞的1至20小时内测量FF G-CSF的水平。
可使用任何合适的定量测定法测量与卵母细胞相关的FF G-CSF水平。可以例如使用选自生化测定(例如固相或液相免疫测定法)、表面等离子体共振、荧光共振能量转移、荧光淬灭和荧光偏振的方法来实施所述测量。这些技术是本领域已知的,并且在下文简略描述。
生化测定一般依赖于将分析物组分固定于例如膜或其它固体支持物上,并暴露于配体。在洗去多余配体后,通过免疫测定法检测结合的配体,或者通过使用带标记配体(例如放射性标记配体、荧光标记配体、颗粒物标记配体等)来检测结合的配体。在本领域中确定和获得以高亲和力结合到特定分析物的配体的方法也是可用的,参见例如名称为“Paralog Affinity chromatography”的WO80/09088。在免疫测定法的一个例子中,抗G-CSF抗体可被固定在磁珠上并暴露于卵泡液样品。可使用一抗和二抗免疫测定法来检测结合的G-CSF以得到其浓度。通常,使用一组标准品校正免疫测定法。固相免疫测定法描述于例如US 4,376,110。在本发明范围内的免疫测定法的变型包括任何使用抗G-CSF抗体的竞争性或免疫测量测定法形式,例如RIA(放射性免疫测定)、ELISA(酶联免疫吸附测定)、ELISPOT(酶联免疫吸附斑点)或Luminex(基于珠的多重夹心免疫测定法)。
优选地,通过使用Luminex技术测量FF G-CSF水平。Luminex是一种用于同时测量系统中特定组分水平的高灵敏度方法。其使用足够小到几乎表现为液体中溶液的固相有色(染料)编码的微球。用对所检测组分(例如FF C-GSF)有特异性的抗体或其它配体结合试剂包被每个微球。在所述微球上捕获并检测所述样品的组分。在分析仪中,激光激发标识每种微球颗粒身份的内部染料,以及测定过程中所捕获的任何报告物染料。对每组珠进行多次读值以验证其结果。这样,得到了既快速又准确的灵敏的多重测定法。优选地,使用或R and制造的试剂盒来测量FF C-GSF水平。在一个优选实施方案中,所述试剂盒是人细胞因子荧光珠免疫测定试剂盒,Bio-PlexTM(Hercules,CA,USA,17A11127)。在另一个实施方案中,所述R and D试剂盒是LUH000,LUH279,LUH270,LUH271,LUH278,LUH208,LUH214,LUH215B,LUH285,LUH200,LUH280,LUH201,LUH202,LUH204,LUH205,LUH206,LUH217,LUH317,LUH210,LUH293,LUB000,LUB320,LUB294,LUB219,和/或LUB213试剂盒。
对于本发明的目的,除非另有指明,术语“抗体”包括单克隆抗体、多克隆抗体和保持结合靶抗原活性的完整抗体的片段。这些片段包括Fv、F(ab’)和F(ab’)2片段以及单链抗体。另外,所述抗体及其片段可以是人源化抗体,例如EP-A-239400(Winter)所述的。
抗FF G-CSF抗体可以是单克隆或多克隆抗体。可以通过常规杂交瘤技术使用蛋白质或其肽片段作为免疫原制备单克隆抗体。还可以通过常规手段制备多克隆抗体,所述手段包括用本发明的肽接种宿主动物(例如大鼠或兔子)然后回收免疫血清。
作为替代,可通过分析颗粒细胞中FF G-CSF mRNA的水平估计FF G-CSF的水平。可以在每个卵母细胞的去冠化(decoronisation)阶段保存放射冠(corona radiate)周围的颗粒细胞,并且其可保存于RNA稳定剂(例如在80℃)中待用。可设计FF G-CSF基因的探针以用作探针,例如用于核酸(PCR)扩增测定和/或杂交中。实施PCR和杂交反应的方法和条件是本领域已知的,可见于例如Molecular Cloning:A Laboratory Manual(第三版)(Joseph Sambrook,Peter MacCallum,David Russell,Cold Spring Habor Laboratory Press)或者可通过QuantiGene Plex测定来实施,QuantiGene Plex测定法设计用于定量多重靶标特异性的RNA分子(Panomics)。
作为替代,表面等离子体共振测定法可用作测量卵泡液样品中G-CSF水平的定量方法。用卵泡液与芯片上结合的抗G-CSF抗体反应,然后测量表面等离子体共振。使用标准浓度进行结合反应以得到卵泡液中的G-CSF水平。
FRET(fluorescence resonance energy transfer,荧光共振能量转移)也可用于测量卵泡液样品中的G-CSF水平。用供体和受体荧光团的互补对标记G-CSF和抗G-CSF抗体。在通过G-CSF:抗G-CSF抗体相互作用紧密结合在一起时,通过激发供体荧光团所发射的荧光将具有与G-CSF和抗G-CSF抗体不结合时响应于该激发波长所发射之荧光不同的波长,从而提供了通过测量每个波长下的发射强度对结合与非结合分子的定量。结合反应可以与一组标准品进行比较而得到卵泡液中的G-CSF水平。
BRET(bioluminescence resonance energy transfer,生物发光共振能量转移)也可用于测量卵泡液样品中的G-CSF水平。当受体紧邻供体时,即当形成G-CSF:抗G-CSF抗体相互作用复合物时,受体将发光。通过将所述相互作用与一组标准品进行比较,确定卵泡液中的G-CSF水平。
荧光淬灭荧光类似地提供了对G-CSF水平的测量。一般地,所标记抗G-CSF抗体荧光的减少指示带有淬灭剂的G-CSF已经结合。当然,当G-CSF带荧光标记而抗G-CSF抗体带有淬灭剂时会发生类似的效应。通过将所述相互作用与一组标准品进行比较,测量卵泡液样品中的G-CSF水平。
荧光偏振测量法也可用于测定卵泡液样品中G-CSF的水平。复合物(例如G-CSF与发荧光的抗G-CSF抗体相结合所形成的复合物)会比非复合的带标记抗G-CSF抗体具有更高的偏振值。这构成了测定卵泡液样品中G-CSF水平的基础,这种测量通常与一组标准G-CSF浓度一起进行。
其它可用于定量检测FF中G-CSF的方法包括质谱(MS)、高效液相色谱(HPLC)、HPLC/MS、HPLC/MS/MS、毛细管电泳和与图像分析相结合的柱式或板式凝胶电泳。这些技术是本领域公知的,其描述于例如Modern HPLC for Practicing Scientists(Dong,M,Wiley-Interscience,June 2006),Tandem Mass Spectrometry(McLafferty F.W.John Wiley&Sons Inc,November,1983),Mass Spectrometry for Biotechnology(Siuzdak,G.,Academic Press,February 1996),Clinical Applications of Capillary Electrophoresis(Methods in Molecular Medicine)(Palfrey S.M.,HumanaPress,June 1999),Handbook of Capillary Electrophoresis,Second Edition,(Landers J.P.CRC;December 1996),High-Resolution Electrophoresis and Immunofixation:Techniques and Interpretation(Keren,D.F.Hodder Arnold,January,1994)中。
一旦测量了来自单个患者的多个卵母细胞的FF G-CSF水平,其结果就可用于建立通过对所述卵母细胞受精得到的胚胎的相对植入潜力,即排名顺序。FF G-CSF水平可用于确定在接受辅助受精处理的雌性受试者中是全部、部分还是没有卵母细胞会在受精后建立植入。另外,FF G-CSF水平可用于确定在接受辅助受精处理的雌性受试者中是否全部、部分胚胎会植入还是没有胚胎会植入。
在我们的研究中,我们使用免疫测定法测量了FF G-CSF水平,特别是使用了Biorad和R&D的Luminex技术。我们已发现来源于FF-CSF浓度等于或低于20.0pg/ml的卵母细胞的胚胎显示出低的植入成功率或无植入成功。相反地,来源于FF-CSF浓度等于或高于24pg/ml的卵母细胞的胚胎显示出确定植入。
本领域技术人员会了解,尽管在我们的研究中,我们确定了FF G-CSF的“阈值”水平,在其之下胚胎不植入(在其之上患者具有显著提高的植入概率),但是此值是统计量,还可使用其它的测量方式和阈值。在实施本发明中,最重要的是实现测定的一致性,从而使每个操作员(或辅助受精团队)能够建立他们自己的具体测定方法并确定他们自己的阈值水平。这可以通过首先对来自之前患者的样品进行历史性研究来建立。
因此,上文所述FF G-CSF水平代表我们在我们自己的研究中用作合适限定值的测量值。但是,如果准备对FF G-CSF水平以上文所述任何其它方式测量,那么需要使用常规方法来进行使用我们的测定方法进行的对照实验,以确定我们的结果和其它方法的结果的关系,从而进行直接比较。
根据本发明的一个方面,在卵母细胞的卵泡中FF G-CSF水平等于或小于21.6pg/ml,21.4pg/ml,21.2pg/ml,21.0pg/ml,20.8pg/ml,20.6pg/ml,20.4pg/ml,20.2pg/ml,20.0pg/ml,19.8pg/ml,19.6pg/ml,19.4pg/ml,19.2pg/ml,19.0pg/ml,18.8pg/ml,18.6pg/ml,18.4pg/ml,18.2pg/ml,18.0pg/ml 17.8pg/ml,17.6pg/ml,17.4pg/ml,17.2pg/ml,17.0pg/ml,16.8pg/ml,16.6pg/ml,16.4pg/ml,16.2pg/ml,16.0pg/ml,15.8pg/ml,15.6pg/ml,15.4pg/ml,15.2pg/ml,15.0pg/ml或任意两个上述值之间的水平时,预测该卵母细胞来源的胚胎具有低植入潜力。优选地,FF-CSF水平等于或低于15.0pg/ml至20.0pg/ml,更优选地等于或低于19.8至20.6pg/ml,最优选低于20.6pg/ml时,被预测为没有植入潜力或植入潜力低。此实施方案的水平被作为辅助受精方法的阈值水平(下文)。低水平植入是指10%、9%、8%或更低的植入概率。
根据本发明的一个方面,在卵母细胞的卵泡中FF G-CSF水平等于或低于34.0pg/ml,33.5pg/ml,33.0pg/ml,32.5pg/ml,32.0pg/ml,31.5pg/ml,31.0pg/ml,30.5pg/ml,30.0pg/ml,29.5pg/ml,29.0pg/ml,28.5pg/ml,28.0pg/ml,27.5pg/ml,27.0pg/ml,26.5pg/ml,26.0pg/ml,25.5pg/ml,25.0pg/ml,24.5pg/ml,24.0pg/ml,23.5pg/ml,23.0pg/ml,22.5pg/ml,22.0pg/ml,21.5pg/ml,21.0pg/ml,20.5pg/ml,20.0pg/ml,19.5pg/ml,19.0pg/ml,18.5pg/ml,18.0pg/ml,17.5pg/ml,17.0pg/ml,16.5pg/ml,16.0pg/ml,15.5pg/ml,15.0pg/ml或任意两个上述值之间的水平时,预测来源于所述卵母细胞的胚胎具有可能成功的植入。优选地,FF-CSF水平在15.0pg/ml至34.0pg/ml范围、更优选在20.0pg/ml至24.0pg/ml范围时被预测为可能被植入。可能被植入意思是指比不确定植入更高的成功机会;可能的植入潜力意思是指15%至25%的植入概率。此实施方案的水平被作为辅助受精方法的阈值水平(下文)。
根据本发明的一个方面,在卵母细胞的卵泡中FF G-CSF水平等于或高于22.0pg/ml,22.1pg/ml,22.2pg/ml,22.3pg/ml,22.4pg/ml,22.5pg/ml,22.6pg/ml,22.7pg/ml,22.8pg/ml,22.9pg/ml,23.0pg/ml,23.1pg/ml,23.2pg/ml,23.3pg/ml,23.4pg/ml,23.5pg/ml,23.6pg/ml,23.7pg/ml,23.8pg/ml,23.9pg/ml,24.0pg/ml,24.1pg/ml,24.2pg/ml,24.3pg/ml,24.4pg/ml,24.5pg/ml,24.6pg/ml,24.7pg/ml,24.8pg/ml,24.9pg/ml,25.0pg/ml,25.1pg/ml,25.2pg/ml,25.3pg/ml,25.4pg/ml,25.5pg/ml,25.6pg/ml,25.7pg/ml,25.8pg/ml,25.9pg/ml,26.0pg/ml,26.1pg/ml,26.2pg/ml,26.3pg/ml或任意两个上述值之间的水平时,预测来源于所述卵母细胞的胚胎具有高植入潜力。优选地,FF-CSF水平等于或高于24.0pg/ml,更优选高于35pg/ml被预测为具有高植入潜力。此实施方案的水平被作为辅助受精方法的阈值水平(下文)。高植入水平是指植入概率为30%、35%、40%、43%、44%或更高。
如果这些患者中的FF G-CSF水平显著低于在所有收集的卵母细胞中与可能植入或确定植入相关的水平,则不进行植入节省了患者的时间、金钱和压力。在这些情况下,医师(或辅助受精医生)将有可能来决定甚至是否进行第一次植入尝试。另一方面,如果一个或多个卵母细胞显示高植入确定性或完全植入确定性,那么这些卵母细胞可单独受精,并植入如此获得的胚胎,从而通过仅仅使这些有可能建立为胚胎的卵母细胞受精而节省了金钱和资源。作为替代,可使所有卵母细胞受精,然后仅植入来源于显示出高植入确定性或完全植入确定性的卵母细胞的胚胎;这带来较高的成功机会,因为植入的适应症不一定与受精机会相关。
本发明显著增加了植入率,同时降低了移植回的胚胎数。其还允许专业人员更有效的预防多胎妊娠以及所有相关的胎儿和母亲疾病。具有最高潜力的卵母细胞及由此产生的胚胎可被植入,因此允许实施单胚胎移植的策略同时不降低总妊娠率。
本文所述检测法还可用于辅助雌性受试者受精的方法中。本发明的一个实施方案是雌性受试者辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)测定每个所收集卵母细胞的卵泡中FF G-CSF的水平,
(iii)使具有最高FF G-CSF水平的卵母细胞受精,和
(iv)将由此获得的胚胎植入雌性受试者。
接受进一步受精的卵母细胞数可以是1、2、3、4或5或更多。作为替代,50%、40%、30%、20%或10%的卵母细胞被受精,该百分比具有最高水平的FF G-CSF。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)测定每个所收集卵母细胞的卵泡中FF G-CSF的水平,
(iii)使卵母细胞受精以获得胚胎,和
(iv)植入来源于具有最高FF G-CSF水平的卵母细胞的胚胎。
植入的胚胎数可以是1、2、3、4或5或更多。作为替代,50%、40%、30%、20%或10%的胚胎被植入,该百分比具有最高水平的FF G-CSF。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)测定每个所收集卵母细胞的卵泡中FF G-CSF的水平,
(iii)使卵母细胞受精以获得胚胎,和
(iv)植入来源于具有高于预定阈值的FF G-CSF水平之卵母细胞的胚胎。
植入的胚胎数可以是1、2、3、4或5或更多。作为替代,50%、40%、30%、20%或10%的胚胎被植入,该百分比具有最高水平的FF G-CSF。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据如上所述测定法确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使与具有高植入潜力的胚胎相对应的卵母细胞受精,和
(iv)将由此获得的胚胎植入雌性受试者。
本发明的另一个实施方案是对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据如上所述测定法确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使卵母细胞受精以获得胚胎,和
(iv)将具有最高植入潜力的胚胎植入。
上文关于测定法所述的实施方案适用于辅助受精方法的相应实施方案。阈值在本文中别处指示。本领域技术人员会理解可存在插入步骤,例如收集卵母细胞之后的冷冻。通过使用本发明,辅助受精医生有可能更有效的分配资源,这样使得在所回收卵母细胞的卵泡中具有低水平FF G-CSF的通过辅助受精处理不能妊娠的患者不再进行该处理。
本发明可提供用于实施本发明测定法的试剂盒。这些试剂盒包含至少一种用于检测FF G-CSF的试剂。合适的试剂包括抗FF G-CSF的抗体或者其它合适的配体结合试剂,任选地其连有标记物。通常的标记物是免疫测定法常用的那些,例如辣根过氧化物酶。所述试剂盒还可包含标准品,例如预定量的FF G-CSF(例如蛋白质或RNA)可用可检测标记物进行标记。所述试剂盒还可含有用于吸取卵母细胞和卵泡液的可弃式吸取器尖端。
所述试剂盒可用于测量FF G-CSF,以用于对雌性受试者的诊断、预后和/或辅助受精处理的方法中。本发明还提供了检测FF G-CSF的试剂用于预测(prognosis)在雌性受试者中通过辅助受精而建立妊娠之可能性的用途。
任选地用可检测标记物进行标记的上述抗体、其片段和变体以及其它合适的配体结合试剂可用于制备在治疗或诊断辅助受精适宜性中使用的试剂盒。
FF G-CSF水平还可通过分析所得样品中FF G-CSF mRNA的水平来检测。为了实现此目的,FF G-CSF或其片段可用作测定卵泡液中G-CSF水平的探针。作为替代,可通过分析卵泡液中或颗粒细胞中表达的FF G-CSF mRNA的水平来推测FF G-CSF的水平。可以在每个卵母细胞的去冠化阶段保存放射冠周围的颗粒细胞,其可保存于RNA稳定剂(例如在80℃)中待用。这些探针还可以以类似于抗体所述的方式配制成试剂盒,并且可以含有对照核酸。FF G-CSF基因的探针可设计成用作探针,例如在核酸扩增测定中使用的探针。
实施例
下述非限制性实施例举例说明本发明的某些实施方案。
实施例1:实验设计
患者
在2005年1月至2007年3月间募集了280位表现出不育且包括在ICSI项目中的女性患者。包括在ICSI中的原因主要是雄性不育,以及之前的IVF失败或之前常规IVF中的低受精率。我们在加入时进行随机化处理,以便不在临床患者选择上引入偏好。在研究期间,每个患者加入一次。所有患者都完全知情,并且学院审查委员会批准了该研究(Comité Consultatif de Protection des personnes Poissy-St germain en Laye,)。
预处理
患者接受经典的卵巢过度刺激操作。我们采取她们的医生所提供的方案。通过连续的血液检验和超声评价来控制对刺激的反应,以控制卵泡和子宫内膜的生长。当至少5个卵泡达到16毫米时,达到引发排卵的标准。在引发排卵后35至36小时收集卵母细胞。在研究组中,在全身或局部麻醉下借助阴道超声检查使用各自的10毫升注射器对每个卵泡进行卵母细胞抽吸。因此,我们适应性修改了经典的卵母细胞抽吸方法以个体化对待每个所收集卵母细胞的卵泡液。
卵泡液样品
立即评价每个卵泡中是否存在卵母细胞,弃去没有卵母细胞的卵泡。在研究组中,单个收集卵泡液样品,其每个对应于一个成熟卵母细胞。记录每个卵泡液样品的体积和形态(柠檬黄、橙色或血液性)。单独离心卵泡液样品,在根据数据库对每个样品匿名处理之后将上清分为等分试样,以盲化接下来的分析。最初将样品保存于-20℃,然后在-80℃待用。在数据库(Medifirst)中实时记录所有临床和生物学信息。
卵母细胞受精和胚胎培育至第2天
收集卵母细胞,用透明质酸酶80IU(Fertipro)除去卵丘和放射冠细胞。将卵母细胞注入一滴5微升冲洗介质(JCD)中,其中有用PVP介质(fertopto)减慢的精子样本。所注射的卵母细胞在37℃下单独培育在处于油下的40微升ISM1(Medicult,france)微滴中。在20小时后根据Gianaroli标准评估受精卵原核(pronuclei)的数目和形态。在第2天,记录每个卵裂球的数目、断裂和规则性。在第2天进行胚胎移植计划。
我们将所移植的胚胎分为两类以进行分析:
1、由第2天4-5个细胞,第3天8-9个细胞以及少于10%断裂且规则的细胞定义为最佳质量的胚胎(高质量胚胎),
或
2、任何其它模式(低质量胚胎)
使用Luminex方法仅仅分析对应于所移植胚胎的卵泡液。
评价植入潜力
将每个样品与植入概率(此处描述为植入率)相关联。对于每个测试样品而言胚胎的临床植入率定义如下:卵黄囊数目/所移植胚胎数目。在停经8周时通过超声检查卵黄囊来确定临床植入。
因此结果主要分为三类:
-未植入:植入率=0
-确定植入:所移植胚胎的数目等于通过超声在停经8周时观察到的卵黄囊数目(1个移植胚胎和单胎妊娠,2个移植胚胎和双胎妊娠):植入率=1
-可能植入,其是由于卵黄囊数目低于所植回胚胎数目(例如2个中有1个,3个中有1个,3个中有2个,因此植入率=0.5、0.33、0.66)而导致的植入概率。
为了构建ROC(受试者工作特征,Receiver Operating Charateristics)曲线,我们仅仅考虑两个类别
-未植入,
-确定植入:所植回胚胎的数目等于通过超声在停经8周时观察到的卵黄囊数目(放回1个胚胎和单胎妊娠,放回2个胚胎和双胎妊娠)
使用ROC曲线分析(MedCalc Software,Mariakerke,Belgium)作为每个样品中G-CSF浓度的函数评价在未植入和确定植入之间的区别。获得三种检测方法的灵敏度、特异性和ROC曲线下面积(AUC)。在ROC曲线中,作为假阳性率(100-特异性)的函数针对每个截断点对真阳性率(灵敏度)作图。ROC曲线上的每个点代表对应于特定判别阈值的灵敏度/特异性对。具有完美区分度(在两种分布中没有重叠)的检验具有穿过左上角(100%灵敏度、100%特异性)的ROC曲线。因此,ROC曲线越接近左上角,检验的总准确度就越高(Zweig&Campbell,1993)。
对AUC-ROC的计算提供了准确度的定量,即G-CSF区分植入和未植入的能力。
但是,大多数植入的胚胎由植入概率来定义。例如,如果移植两个胚胎而仅有一个植入,则每个样品的特征是50%植入概率。
因此我们对每种方法进行定义
-由来自AUC-ROC曲线的100%阴性预测值所定义的低端植入阈值。
-由植入的最高阳性预测值所定义的高端植入阈值。
对FF样品实施G-CSF测定
对所移植胚胎来源的个体卵泡液样品依次施用两种Luminex检测方法。
从2005年1月至2005年6月
-用Biorad试剂盒(Hercules,Ca,USA,17A11127,人细胞因子,27重试剂盒)实施Luminex技术。
从2005年9月至2007年3月
80个样品与之前Luminex biorad相同,120个是新收集的样品。
-用R and D试剂盒(Minneapolis,MN,USA,LUH000,LUH279,LUH270,LUH271,LUH278,LUH208,LUH214,LUH215B,LUH285,LUH200,LUH280,LUH201,LUH202,LUH204,LUH205,LUH206,LUH217,LUH317,LUH210,LUH293,LUB000,LUB320,LUB294,LUB219,LUB213)实施Luminex技术。
实施多变量和单变量分析。低于0.05的p值被认为是显著的。表1总结了相继用两种研究方法分析的样品群体和样品数目。
表1:相继用两种研究方法分析的样品群体和样品数目
使用和R andLuminex试剂盒的评价在实施例2和3中描述。
实施例2:使用所产Luminex试剂盒的评价
针对对应于之后132个所移植胚胎的132个卵泡液样品,分析其某些细胞因子和趋化因子的水平。具体地,使用Luminex技术借助试剂盒评价了IL-1β、IL-1Ra、IL-2、IL-4、IL-5、IL-6、IL-8、IL-9、IL-10、IL-12、IL-13、IL-15、IL-17、IFNα、TNF-α、G-CSF、GM-CSF、VEGF、PDGF、FGF、IP-10、MCP-1、RANTES、EOTAXIN、MIP-1α和MIP-1β的浓度。
得到下述结果:
1)在所有卵泡液样品中检测到LIF、IL-1ra、IL-4、IL-6、IL-8、IL-10、IL-12、IL-13、G-CSF、VEGF、IP-10、MCP-1、Eotaxin和MIP-β,
2)在任何卵泡液样品中未检测到IL-1β、IL-5、IL-7、IL-17、TNFα和MlP-α,
3)分别在95%、94%、88%、81%、76%、65%、60%、48%和22%的卵泡液样品中检测到IL-15、GM-CSF、Rantes、PDGF、IFN-γ、IL-9、IL-2、IL-15和FGF。
如果针对所述两类进行最佳胚胎质量相对于其它的比较,G-CSF与胚胎形态不相关。因此,G-CSF和胚胎形态质量(高质量对比其它质量的移植胚胎)没有相关性。
细胞因子、生长因子和植入率
在单变量和多变量分析中仅有一种细胞因子与相应胚胎的植入潜力相关,其为粒细胞集落刺激因子(G-CSF)
根据其植入率对胚胎分类
为了构建针对G-CSF的AUC-ROC,我们考虑未植入的胚胎(n=89)以及表现出植入的胚胎(n=13)。当所有放回的胚胎导致卵黄囊时,定义为确定植入。
ROC曲线下面积是0.82[0.73-0.89],具有高显著性(p=0.0001)(图1)。因此,G-CSF与植入率相关(r=0.40,p<0.0001)。
我们还发现在确定植入的胚胎和未植入的胚胎之间(p=0.0002)以及在确定植入的胚胎和可能植入的胚胎之间(p=0.001)的显著差异(表2)。
表2、植入成功率与使用Biorad所产Luminex试剂盒所测量的FF G-CSF水平和FF IL-1ra水平之间的相关性。
根据AUC-ROC曲线,我们定义了G-CSF的低端阈值和高端阈值来评价G-CSF浓度是否可用于评价每个胚胎的“植入潜力”以便确定我们应放回胚胎的数目。
低端阈值由较强的阴性预测植入值来定义。如果G-CSF低于20pg/ml,则来自AUC-ROC的阴性预测值是100%。如果G-CSF高于24,则阳性预测值达到其最大值:40%。
如果根据G-CSF水平评价所有的放回胚胎,我们可以观察到随后的植入率差异(表3)。
表3、植入成功率与使用Biorad所产Luminex试剂盒所测量的FF G-CSF水平之间的相关性;在中G-CSF和低G-CSF之间*p=0.003;在高G-CSF和低G-CSF之间**p<0.001。
实施例3:使用R and D所产Luminex试剂盒评价卵泡液
分析对应于之后200个所移植胚胎的200个卵泡液样品。使用R&D所产试剂盒利用Luminex技术评价下述细胞因子和趋化因子的浓度:IL-1α、IL-1β、IL-1Ra、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-17、IFNα、TNF-α、G-CSF、GM-CSF、MIP-1α、MIP-1β、RANTES、MCP-1和VEGF。
检测细胞因子和趋化因子
在95至100%的所测卵泡液样品中检测到G-CSF、IL-1Ra、IL-6、IL-8、MlP-β、RANTES、MCP-1和VEGF:
-在75%至94%的所测卵泡液样品中检测到IL-4、TNF-α、GM-CSF和IL-5,
-在50%至74%的所测卵泡液样品中检测到IL-1α、IL-1β、IL-10和MlP-α。
在少于50%的所测卵泡液样品中检测到IL-2、IFN-γ和IL-17。
细胞因子、趋化因子和植入率
为了构建针对G-CSF的AUC-ROC,我们考虑未植入的胚胎(n=146)以及确定植入的胚胎(n=16)。ROC曲线下面积是0.72[0.65-0.79],具有高显著性(p=0.0025)(图2)。
在确定植入的胚胎和未成功植入的胚胎之间(p=0.01)以及在确定植入的胚胎和可能植入的胚胎之间(p=0.03)观察到G-CSF的显著差异(表4)。
表4、植入成功率与使用R and D所产Luminex试剂盒所测量的FF G-CSF水平之间的相关性。
在所有卵泡液中检测到G-CSF,并且在样品之间具有低的标准差异,其是鉴定生物标志物的迫切要求。根据AUC-ROC曲线,我们定义了G-CSF的低端阈值和高端阈值来评价G-CSF浓度是否可用于评价每个胚胎的“植入潜力为以便帮助我们决定应移植胚胎的数目。低端阈值定义为较强的阴性预测植入值。如果G-CSF低于15pg/ml,则来自AUC-ROC的阴性预测值是100%。如果G-CSF高于34,则阳性预测值达到其最大值27.8%。
如果根据G-CSF之AUC-ROC所定义的水平分类评价所有所放回的胚胎,我们能观察到随后的植入潜力差异(表5)。
表5、植入成功与使用R and D所产Luminex试剂盒所测量的FF G-CSF水平之间的相关性;在中、低和高G-CSF之间**p<0.001。
实施例4:合并卵泡液中G-CSF的平均值不反映个体卵泡液中所观察到的变异
对于同一组中的15位患者,独立于其结局来评价所有导致胚胎的卵泡液。使用Biorad所产的Luminex试剂盒评价76个样品。
对于每个样品,我们评价了下述比例。合并卵泡液中平均G-CSF减去个体FF中G-CSF浓度(n=76)。
图3显示获得自10个受试者的同一组胚胎的卵泡液个体浓度的变异。每个柱显示个体卵泡液相对于所产生的同一组胚胎中平均值的变异。这些观察结果提示产生的所有胚胎在FF-GCSF上不是等同的,因此它们的植入潜力也不等同。
以下内容对应于母案申请中的原始权利要求书,现作为说明书的一部分并入此处:
1.一种用于确定雌性受试者通过辅助受精获得或将获得的胚胎的植入潜力的测定法,其包括:
(i)针对收集自所述受试者的多个卵母细胞测量每个所收集卵母细胞的卵泡的卵泡液(FF)中存在的卵泡液粒细胞集落刺激因子(G-CSF)的水平;和
(ii)从所测量的FF G-CSF水平确定通过所述卵母细胞的辅助受精获得或将获得的胚胎的植入潜力。
2.根据项1的测定法,其中具有最高FF G-CSF水平的卵母细胞具有最高的植入潜力。
3.根据项1或2的测定法,其中每个FF样品获得自卵泡吸出物。
4.根据项1至3任一项的测定法,其中在卵泡吸出物收集的20小时内测量各自的FF G-CSF水平。
5.根据项1至4任一项的测定法,其中FF-CSF水平等于或小于20.6pg/ml确定为没有植入潜力或具有低植入潜力。
6.根据项1至4任一项的测定法,其中FF-CSF水平等于或大于24.0pg/ml确定为高植入潜力。
7.根据项1至6任一项的测定法,其中使用免疫测定法测量各自的FF G-CSF水平。
8.根据项1至7任一项的测定法,其中使用竞争性或免疫测量测定法如RIA、IRMA、ELISA或ELISPOT测定法来测量各自的FF G-CSF水平。
9.根据项1至7任一项的测定法,其中使用Luminex测定法来测量各自的FF G-CSF水平。
10.根据项9的测定法,其中所述Luminex测定法使用Biorad或者R and D的Luminex试剂盒。
11.根据项1至6任一项的测定法,其中通过测定FF G-CSF mRNA水平来测量各自的FF G-CSF水平。
12.根据项1至6任一项的测定法,其中通过表面等离子体共振、荧光共振能量转移、生物发光共振能量转移、荧光淬灭荧光、荧光偏振法、MS、HPLC、HPLC/SM、HPLC/MS/MS、毛细管电泳、柱式或板式凝胶电泳中的任意方法来测量各自的FF G-CSF水平。
13.用于实施根据项1至12任一项所述测定法的试剂盒,其包含至少一种适于检测FF G-CSF或FF G-CSF mRNA水平的试剂。
14.根据项13的试剂盒,其还包含一组FF G-CSF的浓度标准品。
15.根据项13或14的试剂盒,其还包含用于从受试者获取卵母细胞和卵泡液的多个吸取器尖端。
16.一种对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据项1至12任一项所述测定法来确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使与具有高植入潜力的胚胎相对应的卵母细胞受精,和
(iv)将由此获得的胚胎植入雌性受试者。
17.一种对雌性受试者进行辅助受精的方法,其包括:
(i)从所述受试者收集多个卵母细胞,
(ii)根据项1至12任一项所述测定法来确定来源于每个卵母细胞的胚胎的植入潜力,
(iii)使卵母细胞受精以获得胚胎,和
(iv)植入具有高植入潜力的胚胎。
- 还没有人留言评论。精彩留言会获得点赞!