一种采用高效液相色谱法测定盐酸考尼伐坦含量的方法与流程
本发明涉及药物分析技术领域,具体涉及一种采用高效液相色谱法测定盐酸考尼伐坦原料药含量的方法。
背景技术:
盐酸考尼伐坦的化学名为N-{4-[(2-甲基-4,5-二氢咪唑并[4,5-d][1]-苯并氮杂卓-6(1H)-基)羰基]苯基}联苯基-2-甲酰胺盐酸盐,CAS号为168626-94-6,英文名称为Conivaptan Hydrochloride。盐酸考尼伐坦是精氨酸加压素(AVP)V1a和V2受体的一种非肽类双重抑制剂。FDA最早于2005年12月29日批准Astellas Pharma US公司的盐酸考尼伐坦上市,商品名Vaprisol,为20mg/4mL的注射液,其适应症主要用于血容量正常的低钠血症(常伴发于抗利尿激素异常分泌综合征患者、甲状腺机能减退患者、肾上腺机能减退患者或肺部疾病患者)和高容量性低钠血症住院病人的治疗。2007年FDA批准考尼伐坦增加适应症—高血容量性低钠血症,2008年又批准增加新的剂型-20mg/100mL的大输液。
现有技术采用电位滴定法测定盐酸考尼伐坦原料药含量。该方法中选用甲酸、冰醋酸、醋酸汞、高氯酸等试剂,毒性相对较大,另外操作也繁琐,特别是对多批原料同时检测,劳动量也是成倍增长。
为此,需要找到一种有效降低工作量,所用试剂毒性小或者用量少的,同时能够准确检测其含量的方法。
技术实现要素:
为克服现有技术不足,本发明提供一种采用高效液相色谱法测定盐酸考尼伐坦原料药含量的方法,用以控制产品质量。
本发明技术方案如下:
一种采用高效液相色谱法测定盐酸考尼伐坦含量的方法,包括以下色谱条件:
流动相A为乙腈,流动相B为磷酸缓冲液;其中,所述磷酸缓冲液中磷酸二氢钠的浓度为0.02mol/L、十二烷基硫酸钠的质量浓度为0.5%、pH值2.8-3.2。
优选地,流动相A与流动相B的体积比为55-59:45-41,例如55:45、59:41或57:43,更进一步优选为57:43。
优选地,所述磷酸缓冲液pH值3.0。
所述磷酸缓冲液的制备方法包括将适量磷酸二氢钠和十二烷基硫酸钠加水溶解,用磷酸调节至所需pH值。
优选地,所用色谱柱为硅烷键合硅胶柱,进一步优选为十八烷基硅烷键合硅胶柱(C18色谱柱);更进一步优选为
C18,规格5μm 250×4.6mm(Cat.no.:99603)或
Phenomenex C18,规格5μm 250×4.6mm或
Agilent C18,规格5μm 250×4.6mm。
优选地,洗脱方式为等度洗脱。
优选地,流动相流速0.9-1.1mL/min,进一步优选1.0mL/min。
优选地,柱温22-28℃,进一步优选25℃;
优选地,进样体积:10μL;
检测器为紫外检测器;优选为Agilent G1315B DAD检测器或Agilent G1315B VWD检测器。
优选地,检测波长为200-280nm,进一步优选为204nm±2nm、241nm±2nm或276nm±2nm;更进一步优选为240nm。
上述测定方法,其中:
优选地,包括将盐酸考尼伐坦待测样品和对照品分别用流动相稀释成供试品溶液和对照品溶液,然后进行检测。
优选地,采用Agilent 1260高效液相色谱仪或Agilent 1100高效液相色谱仪。
优选地,采用Agilent Chemstation色谱工作站。
上述测定方法,还包括供试品溶液的制备、对照品溶液的制备。
所述供试品溶液的制备包括:取样品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为供试品溶液。
所述对照品溶液的制备包括:取盐酸考尼伐坦对照品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为对照品溶液。
上述制备供试品溶液和对照品溶液的溶剂为上述流动相,具体为将流动相A与流动相B按照洗脱的起始体积比组成的混合物(流动相A与B的体积比为55-59:45-41,例如55:45、59:41或57:43,优选为57:43)。
本发明采用高效液相色谱法测定盐酸考尼伐坦含量的方法,具体包括以下步骤:
1)设置以下色谱条件:
色谱柱: C18,规格5μm 250×4.6mm(Cat.no.:99603);或Phenomenex C18,规格5μm 250×4.6mm;或Agilent C18,规格5μm 250×4.6mm;
流动相:流动相A为乙腈,流动相B为磷酸缓冲液,二者体积比为57:43;
其中,所述磷酸缓冲液的制备方法包括将磷酸二氢钠和十二烷基硫酸钠加水溶解,用磷酸调节pH值至3.0;所述磷酸缓冲液中磷酸二氢钠的浓度为0.02mol/L,十二烷基硫酸钠的质量浓度为0.5%;
洗脱方式为等度洗脱;
流动相流速:1.0mL/min,柱温:25℃,进样体积:10μL;
检测器为Agilent G1315B DAD检测器或Agilent G1315B VWD检测器;
检测波长为240nm;
2)供试品溶液的制备:取样品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为供试品溶液;
对照品溶液的制备:取盐酸考尼伐坦对照品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为对照品溶液;
所述溶剂为将流动相A与流动相B按照体积比57:43组成的混合物;
3)检测:精密吸取对照品溶液与供试品溶液各10μL,注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算供试品中盐酸考尼伐坦的含量。
本发明具有以下有益效果:
本发明对高效液相色谱条件进行了优化,确定了最佳检测条件。根据产品特性,在流动相的选择中优先选择酸性条件,让盐酸考尼伐坦尽可能以分子形态存在,确保紫外吸收的完全性。尤其是根据产品特性,摸索出最佳的有机相-无机相配比。
本发明采用的方法可以有效测定盐酸考尼伐坦原料药的含量,方法准确度和灵敏度高,重现性好。该方法适用于盐酸考尼伐坦原料药的含量测定,解决了目前盐酸考尼伐坦含量不稳定的问题,适用于盐酸考尼伐坦产品的质量控制。
附图说明
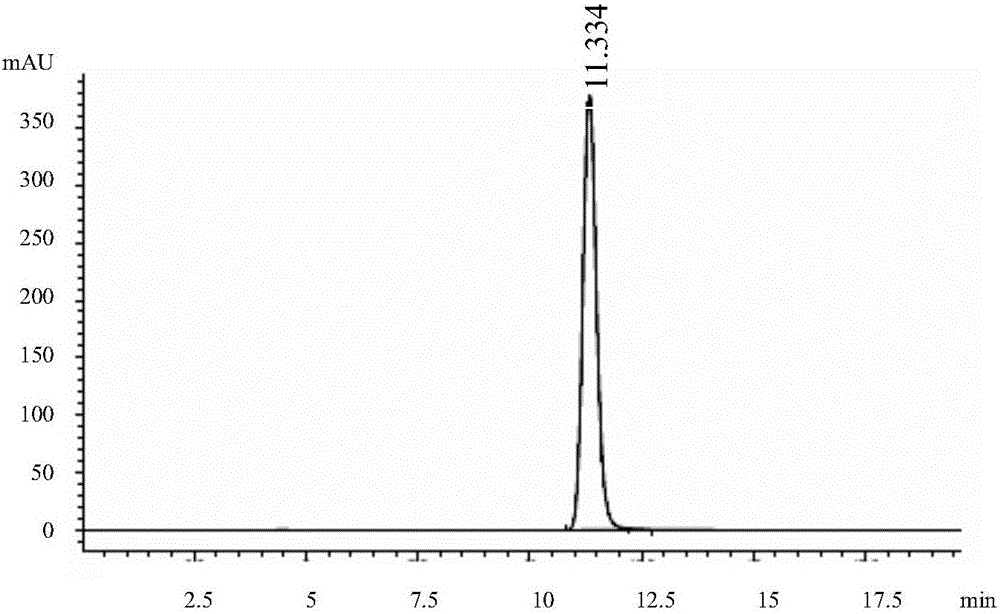
图1为实验例2中溶剂的HPLC色谱图;
图2为实验例2中盐酸考尼伐坦对照品的HPLC色谱图;
图3为实验例2中盐酸考尼伐坦供试品的HPLC色谱图;
图4为实验例3盐酸考尼伐坦标准曲线图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
其中,盐酸考尼伐坦原料药购自安庆沃德医药化工有限公司(含批号20130129、20130323、20130518、20130520、20130524)。所述盐酸考尼伐坦对照品购自深圳菲斯生物科技有限公司,批号1312326-94-6
本发明如无特殊说明,浓度一般指的是溶质与溶液的重量体积比g/mL。如果溶质是液体,则浓度是体积比,如0.1%三氟乙酸水溶液是指0.1mL的三氟乙酸溶于100mL的水中。
所述化学试剂纯度均为色谱纯级别,购自广州市信洪贸易有限公司(美国进口)。
所述高效液相色谱仪为:Agilent 1260高效液相色谱仪、Agilent 1100高效液相色谱仪。
检测器:Agilent G1315B DAD检测器Agilent G1315B VWD检测器。
色谱工作站:Agilent Chemstation色谱工作站。
若无特殊指明,以下所述溶剂为乙腈-磷酸缓冲液,乙腈与磷酸缓冲液的体积比为57:43。所述磷酸缓冲液的制备方法包括将磷酸二氢钠和十二烷基硫酸钠加水溶解,用磷酸调节pH值至3.0;所述磷酸缓冲液中磷酸二氢钠的浓度为0.02mol/L,十二烷基硫酸钠的质量浓度为0.5%。
若无特殊指明,采用以下所述色谱条件:
色谱柱: C18,规格5μm 250×4.6mm(Cat.no.:99603)或Phenomenex C18,规格5μm 250×4.6mm或Agilent C18,规格5μm 250×4.6mm;
流动相:流动相A为乙腈,流动相B为磷酸缓冲液,二者体积比为57:43;
其中,所述磷酸缓冲液的制备方法包括将磷酸二氢钠和十二烷基硫酸钠加水溶解,用磷酸调节pH值至3.0;所述磷酸缓冲液中磷酸二氢钠的浓度为0.02mol/L,十二烷基硫酸钠的质量浓度为0.5%;
洗脱方式为等度洗脱;
流速:1.0mL/min,柱温:25℃,进样体积:10μL;
检测器为Agilent G1315B DAD检测器或Agilent G1315B VWD检测器;
检测波长为240nm。
实验例1最大吸收波长及色谱条件的选择
取盐酸考尼伐坦原料药,加甲醇制成每1毫升甲醇中约含有20μg的盐酸考尼伐坦的溶液,照紫外分光光度法(中国药典2010版二部附录ⅣA)测定,在200-400nm波长范围内进行波长扫描,试验结果见下表1。
表1波长扫描结果
试验结果表明本品的甲醇溶液在204nm±2nm、241nm±2nm、276nm±2nm波长处有最大吸收,样品与对照品的紫外吸收图谱一致。考虑到204nm较易受到干扰,276nm吸收峰不明显,故优选采用240nm作为本品的含量测定吸收波长。
实验例2专属性
a、对照品溶液:取盐酸考尼伐坦对照品(批号:20130223)约20mg,精密称定,置100mL量瓶中,加溶剂(即乙腈-磷酸缓冲液,乙腈与磷酸缓冲液的体积比为57:43)溶解并稀释至刻度,摇匀,即得。
b、供试品溶液:取本品(批号:20130129)约20mg,精密称定,置100mL量瓶中,加溶剂溶解并稀释至刻度,摇匀,即得。
取溶剂、对照品溶液、供试品溶液各10μL注入高效液相色谱仪,记录色谱图(分别见图1-3);结果显示供试品溶液与对照品溶液在相同的位置出峰,而溶剂在此位置不产生任何色谱峰,说明溶剂不干扰本品中盐酸考尼伐坦的测定。
实验例3线性和范围
取干燥至恒重的盐酸考尼伐坦对照品50.12mg,精密称定,置25mL量瓶中,用溶剂溶解稀释至刻度,摇匀,作为对照品储备液;精密量取该对照品储备液0.4mL、0.8mL、1.0mL、1.2mL、1.4mL和1.6mL分别置10mL量瓶中,加溶剂稀释至刻度,摇匀,在上述色谱条件下,精密量取各溶液10μL注入高效液相色谱仪,记录色谱图;以进样浓度(mg/mL)为X,盐酸考尼伐坦峰面积(A)为Y,作线性回归方程,结果如下表2。图4为盐酸考尼伐坦标准曲线。
表2盐酸考尼伐坦含量测定标准曲线的制备
结论:盐酸考尼伐坦进样量在0.08019mg/mL~0.320768mg/mL范围内与峰面积呈良好的线性关系,线性回归方程为:y=36100x+92.11,y表示峰面积,x表示进样浓度(mg/mL);R2=0.999。
实验例4精密度试验
a、进样精密度试验
精密吸取实验例3中间浓度的对照品溶液10μL注入高效液相色谱仪,连续进样7针,记录色谱图,考察盐酸考尼伐坦主峰峰面积的变化情况,结果见下表3。
表3盐酸考尼伐坦进样精密度试验结果(n=6)
结论:进样精密度符合规定。
b、重复性试验
取同一批样品(批号:20130129),精密称定适量,加溶剂溶解并稀释制成每1mL中约含盐酸考尼伐坦0.2mg的溶液,作为供试品溶液,平行制备6份。另取盐酸考尼伐坦对照品适量,精密称定,加溶剂溶解并稀释制成每1mL中约含盐酸考尼伐坦0.2mg的溶液,作为对照品溶液,精密吸取对照品溶液和供试品溶液各10μL注入液相色谱仪,记录色谱图;按外标法以峰面积计算,结果如下表4。
表4盐酸考尼伐坦重复性试验结果
结论:本实验方法重复性符合规定。
c、中间精密度试验
按照“b、重复性试验”项下配制溶液,由两名分析人员使用不同的仪器,不同的时间进行测试,所得含量测定数据,结果如下表5:
表5盐酸考尼伐坦中间精密度试验结果
结论:本方法中间精密度良好。
实验例5含量测定待测溶液稳定性试验
取盐酸考尼伐坦原料药适量,精密称定,加溶剂溶解并稀释制成每1mL中约含盐酸考尼伐坦0.2mg的溶液,作为供试品溶液。分别在0、2、4、6、8、10、12和24小时进样测定,考察供试品溶液主峰面积的变化情况,试验结果见下表6:
表6盐酸考尼伐坦含量测定待测溶液稳定性试验
结论:由上述试验结果可知,供试品溶液在24小时内是稳定的。
实验例6耐用性试验
将色谱条件中的参数如流速、柱温、流动相pH值、流动相比例及不同的色谱柱等作适当的变化,考察盐酸考尼伐坦中主色谱峰情况,结果见下表7。
表7耐用性试验
结论:将色谱条件中的参数作适当变化后,盐酸考尼伐坦主峰的峰面积没有产生明显的变化,本色谱条件有较好的耐用性。
对比例1
分别采用本发明HPLC方法和电位滴定法,对盐酸考尼伐坦原料药含量进行对比检测试验。了解两种方法的差异性。结果见表下8。
表8两种方法测定结果比较
本发明HPLC方法包括以下步骤:
1)设置以下色谱条件:
色谱柱: C18,规格5μm 250×4.6mm(Cat.no.:99603)或Phenomenex C18,规格5μm 250×4.6mm或Agilent C18,规格5μm 250×4.6mm;
流动相:流动相A为乙腈,流动相B为磷酸缓冲液,二者体积比为57:43;
其中,所述磷酸缓冲液的制备方法包括将磷酸二氢钠和十二烷基硫酸钠加水溶解,用磷酸调节pH值至3.0;所述磷酸缓冲液中磷酸二氢钠的浓度为0.02mol/L,十二烷基硫酸钠的质量浓度为0.5%;
洗脱方式为等度洗脱;流速:1.0mL/min,柱温:25℃,进样体积:10μL;
检测器为Agilent G1315B DAD检测器或Agilent G1315B VWD检测器;检测波长为240nm;
2)供试品溶液的制备:取样品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为供试品溶液;
对照品溶液的制备:取盐酸考尼伐坦对照品适量,精密称定,加溶剂溶解并稀释制成约含盐酸考尼伐坦0.2mg/mL的溶液,作为对照品溶液;
所述溶剂为将流动相A与流动相B按照体积比57:43组成的混合物;
3)检测:精密吸取对照品溶液与供试品溶液各10μL,注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算供试品中盐酸考尼伐坦的含量。
电位滴定法:取本品约0.4g,精密称定,加5mL甲酸溶解后,加入20mL冰醋酸和5mL醋酸汞,照电位滴定法(中国药典2010年版二部附录ⅦA)用0.1mol/L高氯酸滴定液滴定,并将滴定的结果用空白试验校正。每1mL高氯酸滴定液(0.1mol/L)相当于盐酸考尼伐坦(C32H26N4O2·HCl)53.504mg。
表8结果表明,本品HPLC法含量测定结果与电位滴定法含量测定结果基本一致,说明两种方法均适用于盐酸考尼伐坦的含量测定。因含量测定(HPLC法)与有关物质检查色谱条件一致,为便于操作,确定采用HPLC法作为本品的含量测定方法。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!