一种检测HIV‑1p24抗原的试剂盒及其应用的制作方法
本发明涉及生物技术领域,具体地说是一种测定HIV-1 p24抗原的试剂盒及其应用。
背景技术:
艾滋病即获得性免疫缺陷综合征(AIDS),由人类免疫缺陷病毒(HIV)感染引起。HIV病毒体呈球型,直径100~120nm,病毒体外层为脂蛋白包膜,其中嵌有病毒特异的糖蛋白gp120与gp41;gp41是跨膜蛋白,gp120位于表面,构成包膜表面的刺突,并与gp41通过非共价作用结合。病毒内部为20面体对称的核衣壳,病毒核心含病毒RNA、逆转录酶和核衣壳蛋白。病毒基因组是两条相同的正链RNA,每条链长约9.2-9.8kb。特异性最高的衣壳蛋白p24是由gag基因编码的。p24是HIV-1的主要核心多肽,是核壳组成蛋白,构成病毒的核衣壳。gag基因能编码约500个氨基酸组成的聚合前体蛋白,经蛋白酶水解形成p17、p24核蛋白。p24核心抗原测定由于有良好的临床意义而被广泛用于临床早期诊断、艾滋病治疗效果评价、HIV感染细胞培养物中病毒生长的指示检测等。
众所周知,HIV传播迅速,危害极大,迄今尚无治愈方法。因此对高危人群跟踪检测,早期发现感染,及时用药,可延缓发病并能有效控制艾滋病毒传播。抗HIV抗体检测对诊断、治疗、控制HIV传播,起到了重要的作用。但是,在HIV感染早期,抗体尚未出现之前(也称“窗口期”),p24抗原已经存在,此时已有强传染性。因此,单用检测HIV抗体的方法进行诊断势必会造成HIV漏检。尤其是对于生物制品用血浆和献血者的筛查,这种漏检无疑会造成HIV更大范围播散。p24蛋白是HIV的核心抗原,具有较好的稳定性,是HIV的特异性蛋白,可以做为HIV诊断的指征,对它的检测,可以缩短在艾滋病感染初期HIV抗体出现前的“窗口期”,减少输血和输用血液制品的感染危险。
目前,HIV-1 p24抗原的检测采用血清学诊断方法,主要有双抗体夹心ELISA法、免疫复合物裂解检测法、超敏感EIA法、酶联免疫荧光法等。但是,这些方法中在实际应用中存在的问题是要么检出敏感性差、检测结果假阳性或假阴性较高,要么具有较好的敏感性和检出限,但是操作繁琐复杂,根本无法推广应用。
技术实现要素:
本发明的目的之一是提供一种检测HIV-1 p24抗原的试剂盒,以解决目前HIV-1 p24抗原检测存在检出敏感性差、检出结果准确性较差的问题。
本发明的目的之二是提供检测HIV-1 p24抗原的试剂盒的应用,以解决现有检测技术不仅精准性较差,而且检测过程繁琐复杂、费时费力的问题。
本发明是通过以下方式实现的:一种检测HIV-1 p24抗原的试剂盒,包括酶标板、样品稀释液、酶结合物、阴性对照物、阳性对照物、底物液、显色液、终止液以及洗涤液;
所述酶标板由鼠抗HIV-1 p24单克隆包被抗体包被,所述鼠抗HIV-1 p24单克隆包被抗体是2-C6抗体,所述2-C6抗体是保藏编号为CGMCC No.12981的杂交瘤细胞株2-C6分泌得到的;所述鼠抗HIV-1 p24单克隆包被抗体的包被量为4μg/mL;
所述样品稀释液中含有生物素标记鼠抗HIV-1 p24单克隆抗体,所述生物素标记鼠抗HIV-1 p24单克隆抗体是生物素标记的11-A4抗体;所述11-A4抗体是保藏编号为CGMCC No.12982的杂交瘤细胞株11-A4分泌得到的;所述生物素标记鼠抗HIV-1 p24单克隆抗体的含量为2μg/mL;
所述杂交瘤细胞株2-C6和杂交瘤细胞株11-A4均在中国微生物菌种保藏管理委员会普通微生物中心保藏,其保藏日为2016年9月2日。
所述酶结合物为含有体积比浓度为0.025%辣根过氧化物酶标记链霉亲和素的缓冲稀释液;所述阴性对照物为检测HIV-1 p24抗原为阴性的人血清;
所述阳性对照物为含200IU/mL重组HIV-1 p24抗原阳性对照品的稀释液;
所述显色液为含有四甲基联苯胺的柠檬酸缓冲液;
所述底物液为含有过氧化氢尿素的磷酸缓冲液;
所述终止液为浓度为2mol/L的H2SO4溶液,以及
所述洗涤液为20倍浓缩磷酸盐缓冲液。
本发明中每升所述底物液按如下方法配置:将35-37g Na2HPO4·12H2O、10-11g柠檬酸、0.5-0.6g过氧化氢尿素、0.8-1.0g 2-氯乙酰胺溶解于注射用水中,用注射用水定容至1000mL。
本发明中每升所述显色液按如下方法配置:将0.17-0.19g EDTA-2Na、1-2g柠檬酸、0.2-0.3g四甲基联苯胺、0.8-1.2g 2-氯乙酰胺溶解于注射用水中,用注射用水定容至1000mL。
本发明中所述酶结合物是将辣根过氧化物酶标记链霉亲和素溶于缓冲稀释液中形成的溶液,每升所述缓冲稀释液按如下方法配置:将12-13g Tris、9-11g BSA、1-1.2g酶稳定剂、10-12mL曲拉通、1-1.5mL Proclin 300、0.2-0.3mL质量比浓度为4%的固绿溶解于注射用水中,用注射用水定容至1000mL,所述Tris用盐酸调节pH值至7.5。
本发明中所述样品稀释液是指将生物素标记鼠抗HIV-1 p24单克隆抗体溶于缓冲液中形成溶液,每升所述缓冲液按如下方式配置:将11-12.5g的Tris、1-2g的酪蛋白钠、10-15mL的Tween-20、8-12mL质量百分比浓度为10%的番红花提取素和1-1.5g的硫柳汞溶解于注射用水中,用注射用水定容至1000mL,所述Tris用盐酸调节pH值至7.5。
本发明中的所述洗涤液为20倍的磷酸盐浓缩洗涤液。
本发明中如上所述的试剂盒在制备检测HIV-1 p24抗原试剂中的应用。
本发明所述的试剂盒在定性或定量检测或诊断HIV-1 p24抗原中的应用。
本发明提供的试剂盒的设计原理为:采用生物素-亲和素系统双抗体夹心法测定,即将抗HIV-1 p24的单克隆抗体固相于微孔板上,加入含有生物素标记的抗体的样品稀释液及待测样品;孵育后,若样品中含有HIV-1 p24抗原,则该抗原与液相及固相酶标板中抗体结合形成Ab-Ag-(Ab·B)三明治样的复合物,并固定于酶标板的表面;洗去未结合的成分,加入含有辣根过氧化物酶标记的链霉亲和素的酶结合物,利用生物素与亲和素的强结合力,将辣根过氧化物酶固相于酶标板上,再加入酶的底物液及显色液显色,终止反应后,用酶标仪测定OD值,确定反应的阴、阳性;并且可以确定样品中HIV-1 p24抗原的含量。
本发明的创新点在于通过使用了来自HIV-1B亚型和HIV-1E亚型的p24抗原片段来免疫小鼠,并通过改进免疫小鼠的次数及时间间隔,由此才制备出了高效价优势单克隆抗体,并通过筛选,最终筛选出2株配合性好的单克隆抗体,其不仅具有较高的敏感性,能够使试剂盒的敏感性、准确性大大得到提高,而且所筛选的抗体可以与多种类型HIV病毒裂解液反应,能够更全面地检测不同类型的HIV病毒;此外,本发明特定的酶标板包被及制备条件,使酶标板上的包被抗体保持良好的免疫学活性;样品稀释液及酶结合物试剂中优化筛选了特定比例的Tris-Hcl作为缓冲液、将酶稳定剂加入酶结合物的缓冲稀释液中,大大提高了酶的稳定性,同时也大大延长了试剂盒的有效期。可见,采用本发明提供的试剂盒不仅操作简单,而且检测结果准确、明了。通过大量的实验证明,使用该试剂盒检测HIV-1 p24抗原,能够使抗原敏感性达到了1.25IU/mL,显著优于现有试剂盒的检测敏感性。
本发明提供的试剂盒可于冰箱4℃的环境下保存备用。
本发明提供的试剂盒和检测方法不仅可以对HIV-p24抗原检测,还可以对HIV阳性母亲所生婴儿的早期辅助鉴别诊断,以及第4代HIV-1抗原/抗体ELISA试剂检测呈阳性反应时,抗HIV-1确认阴性者的辅助诊断;以及抗HIV药物治疗效果的评价和体外抗HIV药物的筛选等,操作简单、使用方便,其具有重要的实际应用价值。
附图说明
图1为本发明HIV-1 p24抗原测定原理图。
图2为本发明HIV-1 p24抗原定量检测的标准曲线。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。实施例中所用的试验材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1免疫小鼠获得单克隆包被抗体和单克隆抗体
(1)免疫小鼠
选用6-8周龄雌性Balb/c小鼠,用来自HIV-1BC亚型或HIV-1AE亚型的p24抗原片段免疫Balb/c小鼠,免疫小鼠的次数为5次(传统的免疫方法为3次),多点皮下、肌肉、腹腔免疫,50ug/只,时间间隔逐渐增加,从间隔15天到间隔40天,最后攻击2次(传统的攻击一次),抗原为30ug/只,最后1次攻击小鼠后2天,取小鼠脾用于细胞融合,制备单克隆抗体杂交瘤细胞株。
(2)免疫脾细胞和骨髓瘤细胞的制备
取经免疫Balb/c小鼠,摘除眼球放血。将小鼠处死,无菌摘取脾脏,研磨制取脾淋巴细胞悬液,洗涤调整细胞浓度为1~5×107/mL备用。
收取经倍比传代的骨髓瘤细胞Sp2/0,经洗涤后计数备用。
(3)细胞融合
将骨髓瘤细胞与小鼠脾细胞混合,将免疫脾细胞与准备好的同系骨髓瘤细胞Sp2/0按(2~10):1混合于50mL离心管内,1000rpm离心10分钟,弃上清,轻击管壁,使管底的细胞沉淀混匀如糊状,缓慢加入50%PEG4000约1mL,边加边摇动,1分钟内加完,再作用1.5分钟后,5分钟内缓慢滴入无血清培养液约10mL,终止PEG的作用,经洗涤去除融合剂后加入所需量的含质量比浓度为20%胎牛血清的HAT 1640细胞培养液,分种于96孔培养板孔内,100μL/孔。37℃,5%CO2孵箱内培养。
(4)杂交瘤细胞的选择培养
含质量比浓度为20%的胎牛血清的HAT 1640选择培养液,HAT选择培养1~2周,未融合的淋巴细胞虽具有次黄嘌呤-鸟嘌呤-磷酸核糖转移酶,但其本身不能在体外长期存活也逐渐死亡;只有骨髓瘤细胞与B淋巴细胞的杂交瘤细胞能增殖,并具有骨髓瘤细胞能无限增殖的特性,能在HAT培养基中存活和增殖,即杂交瘤细胞被选择培养出。
(5)杂交瘤细胞的筛选
HAT 1640选择培养液选择培养出的骨髓瘤细胞-B淋巴细胞融合细胞,并不是所有的这类融合细胞都分泌预期的抗体,需要进行特异性抗体的筛选。1μg/mL p24抗原包被酶标板,50μL/孔,4℃过夜。1×PBST洗液,洗板3次,100μL/孔,3%脱脂奶粉封闭,37℃孵育1小时。1×PBST洗液,洗板1次,加入待检细胞培养上清,50μL/孔,37℃孵育1小时。1×PBST洗液,洗板4次,加入HRP-羊抗鼠IgG,50μL/孔,37℃孵育30分钟。1×PBST洗液,洗板4次,加入底物液:显色液=1:1,50μL/孔,37℃孵育30分钟。2mol/L硫酸终止反应。酶标仪OD450nm读取OD值,参考波长630nm。阴性对照采用1640培养液,cutoff值=阴性对照均值×2.1。将筛选有抗体活性的细胞孔尽快克隆化,尽快冷冻保种。
(6)杂交瘤细胞的克隆化
采用有限稀释法,克隆前一天制备饲养细胞,采用无菌法收集小鼠腹腔渗出细胞,计数,调整饲养细胞浓度为1×106/mL,于96孔细胞培养板中每孔中植入100μL/孔细胞悬液,37℃,5%CO2孵箱内过夜。第2天,将待克隆的细胞从培养板孔内轻轻吹下,计算每毫升的活细胞数。连续稀释细胞悬液成10个细胞/mL。用滴管将细胞加入已有饲养细胞的培养板内,平均每孔加约100μL。第7天开始换培养液,当细胞长满孔底的1/10时,开始检测上清液中的抗体活性。将上清液中测到的有抗体活性的单克隆细胞孔中细胞取出置于24孔培养板或5mL培养瓶中继续扩大培养,尽快将所得之克隆进行冷冻保种。
(7)单克隆抗体的大量制备
体内诱生法:取Balb/c小鼠,首先腹腔注射0.5mL液体石腊或降植烷进行预处理。1-2周后,腹腔内接种杂交瘤细胞。杂交瘤细胞在小鼠腹腔内增殖,并产生和分泌单克隆抗体。约1-2周,可见小鼠腹部膨大。用注射器抽取腹水,即可获得大量单克隆抗体。
将产生抗体活性高的10个细胞株:2-C6株、2-B5株、11-A4株、10-A9株、5-D4株、11-C2株、12-A1株、9-F4株、2-G6株和2-E3株;分别扩大培养,1×106/mL注射Balb/c小鼠腹腔,0.5mL/只。7~10日后无菌抽取腹水。如(5)中测定抗体活性。将上述10株单抗采用盐析法纯化,得2-C6抗体、2-B5抗体、11-A4抗体、10-A9抗体、5-D4抗体、11-C2抗体、12-A1抗体、9-F4抗体、2-G6抗体和2-E3抗体。
(8)单克隆抗体的检定
将上述10株单抗采用盐析法纯化,纯化后单抗用改良过碘酸钠氧化法标记HRP,将一单抗作为包被抗体,另一单抗作为HRP检测抗体进行配对筛选,方法如下:4μg/mL抗p24抗体1包被酶标板,50μL/孔,4℃过夜。1×PBST洗液,洗板3次,100μL/孔,3%脱脂奶粉封闭,37℃孵育1小时。1×PBST洗液,洗板1次,加入p24抗原100ng/mL,50μL/孔,37℃孵育1小时。1×PBST洗液,洗板4次,加入HRP-抗p24抗体2,50μL/孔,37℃孵育30分钟。1×PBST 洗液,洗板4次,加入底物液:显色液=1:1,50μL/孔,37℃孵育30分钟。2mol/L硫酸终止反应。酶标仪OD450nm读取OD值,参考波长630nm。阴性对照采用1640培养液,cutoff值=阴性对照均值×2.1。从上述十株抗体中筛选出2株配合性好的单克隆抗体,其中1株用于包被,1株用于标记测定。
通过以上筛选,得到如表1所示的测定结果。
表1 10株抗体两两配对筛选测定结果
备注:Ncx=0.065;表中加粗数据表示两两配对OD450值≥1.0
从表1的测定结果可以选出配合性较好的2-C6抗体作为鼠抗HIV-1 p24单克隆包被抗体、11-A4抗体用于作为生物素标记鼠抗HIV-1 p24单克隆抗体,并将分泌2-C6抗体的杂交瘤细胞株2-C6保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.12981,保藏日为2016年9月2日;将分泌11-A4抗体的杂交瘤细胞株11-A4保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.12982,保藏日为2016年9月2日。
(9)将筛选到的作为鼠抗HIV-1 p24单克隆包被抗体2-C6固相于酶标板上,11-A4抗体用于作为生物素标记的单克隆抗体可以与多种类型HIV病毒裂解液反应:HIV A/E亚型、B亚型、C亚型、G亚型。具体操作步骤参照实施例3,其检测结果如表2所述。
表2制备的抗体测定HIV亚型
实施例2试剂盒的制备
1、酶标板的制备
(1)配置各溶液:
包被液:取1.59g的Na2CO3和2.93g的NaHCO3,用少量注射用水溶解后,再用注射用水定容至1000mL,其pH值为9.6;
洗涤液(20倍浓缩磷酸盐缓冲液):称取58.0g Na2HPO4·12H2O、5.93g NaH2PO4·2H2O、148g NaCl、10mL Tween-20和1g的2-氯乙酰胺,混合后用注射用水溶解后,定容至1000mL,即为20倍浓缩磷酸盐缓冲液;pH值为7.4;
封闭液:称取12.11g的Tris,加HCl调pH值至7.2、10g BSA、20g蔗糖、20g酪蛋白钠和0.1g叠氮钠,混合后用注射用水溶解后,定容至1000mL。
(2)以96孔的微孔板为底板,将鼠抗HIV-1 p24单克隆包被抗体(2-C6抗体)用包被液(0.05mol/L,CB,pH值9.6)稀释成浓度为4μg/mL,补加质量比浓度为1‰的2-巯基乙醇,包被微孔板,加样量为125μL/孔,在4℃下,包被24h;之后取洗涤液(pH值为7.4)100mL加入1900mL蒸馏水配成1倍洗涤液(pH值为7.4),将包被后的微孔板用1×洗涤液(pH值7.4)洗涤3次;在洗涤后的微孔内加入封闭液,150μL/孔,置于4℃下,封闭24h;弃去孔内的封闭液,拍干;将拍干后的包被微孔板放入干燥温度为20℃的干燥机内抽干6小时,干燥后即得由鼠抗HIV-1 p24单克隆包被抗体包被的酶标板,包被后的酶标板真空封口,置4℃保存,备用。
2、样品稀释液的制备
(1)制备生物素标记鼠抗HIV-1 p24单克隆抗体:采用生物素N-羟基琥珀酰亚胺酯(BNHS)的标记法制备生物素标记鼠抗HIV-1 p24单克隆抗体,用无水DMSO配制10mg/mL生物素N-羟基琥珀酰亚胺酯溶液;用碳酸盐缓冲液(0.1mol/L,pH值9.0)分别将鼠抗p24单克隆抗体(11-A4抗体)稀释为2mg/mL的抗体溶液;将鼠抗p24单克隆抗体(11-A4抗体)与BNHS按体积比为8:1混合,室温搅拌下反应4h;装入透析袋中,对0.05mol/L、pH值为7.2的PBS在4℃下透析过夜,得生物素标记鼠抗HIV-1 p24单克隆抗体(生物素标记11-A4抗体;Bio-11-A4);
(2)配制样品稀释液(pH 7.4)所用的缓冲液:取1.211g的Tris加HCL调pH值至7.4、0.1g的酪蛋白钠、1mL的Tween-20、1mL番红花T(质量百分比浓度为10%)和0.1g的硫柳汞,先用适量注射用水将Tris完全溶解后,加入浓盐酸调pH值至7.4,再加入Tween-20和其他溶剂,最后加注射用水至100毫升;
(3)在步骤(2)中配制的缓冲液100mL中加入200μL的Bio-11-A4(1:1000稀释),得样品稀释液。
3、酶结合物的制备
(1)辣根过氧化物酶标记链霉亲和素:用过碘酸钠-乙二醇法制备辣根过氧化物酶标记链霉亲和素。具体为:称取1mg辣根过氧化物酶(HRP)溶解于0.1mL蒸馏水中,4℃搅拌下加入0.1mL新配的0.06mol/L NaIO4溶液,室温下避光搅拌30分钟;加入0.16mol/L乙二醇0.1mL,室温避光轻轻搅拌30分钟;加入8ul 0.2mol/L碳酸盐缓冲液(pH值为9.5),使以上醛化HRP的pH值升高到9.0-9.5,然后立即加入1mg链霉亲和素,混匀后,装入透析袋中,对0.05mol/L碳酸盐缓冲液透析4小时,再加入40μL新配的5mg/mL NaBH4液,混匀,在4℃下静置2小时,将上述液装入透析袋中,对0.01mol/L、pH值为7.4的PBS透析,4℃过夜;即得辣根过氧化物酶标记链霉亲和素(HRP-SAV);
(2)配制酶结合物所用的缓冲稀释液:取12.11g Tris,用盐酸调pH值至7.5、10g BSA;1g酶稳定剂、10mL曲拉通、1mL Proclin 300、0.2mL固绿(质量比浓度4%);用注射水溶解上述溶剂后加注射水定容至1000mL;
(3)在1000mL缓冲稀释液中加入0.25mL HRP-SAV(1:4000稀释),除菌过滤后,得酶结合物。
4、阴性对照物的制备
阴性对照为正常人的血清,按血源筛查要求进行检测合格,检测HIV-1 p24抗原为阴性,混合5份以上检测合格的正常人血清,加入防腐剂,除菌过滤后分装,4℃保存。
5、阳性对照物的制备
①配置稀释液:取2.9g磷酸氢二钠、0.2g磷酸二氢钾、8g氯化钠、0.2g氯化钾、4g酪蛋白钠、10g BSA、1mL Proclin-300和1.25mL硫酸庆大霉素,用注射用水溶解后并定容至1000mL;
②取重组HIV-1 p24抗原阳性对照品(中国病毒预防控制中心病毒病预防控制所曾毅教授惠赠)加入到稀释液中稀释至200IU/mL,除菌过滤后,4℃保存备用。
6、显色液的制备
称取0.186g EDTA-2Na、1.05g柠檬酸、250mg四甲基联苯胺(TMB)和1g的2-氯乙酰胺,先将EDTA-2Na、柠檬酸和2-氯乙酰胺用少量注射用水溶解,再将TMB先用2mL DMSO(二甲基亚砜)溶解后,再逐滴加入溶液中,最后用注射用水定容至1000mL,其pH值为3.0。
7、底物液的制备
取36.82g Na2HPO4·12H2O、10.21g柠檬酸、0.6g过氧化氢尿素和1g的2-氯乙酰胺,用注射水溶解后定容至1000mL,其溶液的pH值为5.0。
8、终止液的制备
将10mL的浓硫酸用80mL的注射用水稀释即可。
9、按照以下组合方式配备一个试剂盒:包括96孔的酶标板一份、3.5mL的样品稀释液、7mL/瓶的阴性对照物、1mL/瓶的阳性对照物、13mL/瓶酶结合物、50mL/瓶的洗涤液、7mL/瓶的显色液、7mL/瓶的底物液、6mL/瓶的终止液;该试剂盒置于冰箱4℃保存。
实施例3 HIV-1 p24抗原的定性及定量检测方法
(1)将实施例2制备的试剂盒从冰箱取出后置于室温30分钟;
(2)稀释洗涤液:将50mL洗涤液用蒸馏水稀释至1000mL,得1倍洗涤液;
(3)定性测定:
A、取酶标板,将待测样品对应孔按序编号,空白1孔、每板应设阴性对照(NC)3孔、阳性对照(PC)两孔(10IU/mL)。如果测定样品为细胞培养上清液,则需用细胞培养液做阴性对照3孔;
B、先于每个反应孔中加入25μL样品稀释液,空白孔不加样品稀释液;
C、按照编号,将100μL待测样品、100μL稀释后的阴性对照物、阳性对照物(10IU/mL)分别加入到步骤B中加有样品稀释液的反应孔中,振荡30-60秒混匀,置37℃孵育1小时;空白孔不加;
D、用稀释后的洗涤液洗板4-5次,拍干后每孔加入酶结合物125μL/孔(空白孔不加),置37℃孵育30分钟
E、用所示洗涤液洗板4-5次,拍干后每孔先后加入底物液、显色液混合物(临用前配制)各62.5μL/孔,先加底物液或先加显色液均可;振荡30-60秒混匀、置37℃孵育30分钟;
F、加入终止液50μL/孔;
G、5min之内,用双波长酶标仪(测定波长450nm,参考波长630nm)读取各孔吸光度值;
H、根据阴性对照值所测得的吸光值,计算临界值=阴性对照OD值的平均值+0.095;如检测样品的OD值小于临界值为阴性;如检测样品的OD值大于或等于临界值为阳性。
I、其检测条件为:每次测定至少设置三孔阴性对照,两孔阳性对照进行质量控制,以确保每次测定结果的可靠性;且每次测试需同时满足以下五个条件,否则测定实验结果无效,需全部试验需重新测定。
a、试剂空白OD值应<0.050(空白校零前)。
b、阴性对照的正常范围:正常情况下,阴性对照OD值应≤0.100。
c、正常情况下,定性测定时阳性对照建议采用p24(10IU/mL)。
d、重复样本的测定结果相差在15%以内。
e、绘制的标准曲线的线性相关系数R值必须≥0.95。
以实施例2所述的试剂盒,测得三个阴性对照的OD值为:NC1=0.025 NC2=0.028 NC3=0.031 NCx=0.028,那么其临界值=0.028+0.095=0.123,如果采用该试剂盒所测得样品的OD值大于或等于0.123时,可初步判定该样品HIV-1 p24抗原为阳性,所测得OD值小于0.123时,可初步判定该样品HIV-1 p24抗原为阳性。可多次重复提高检测的准确性。
如果定性检测样品为阳性标本时,应以双复孔复测,若复测仍为阳性,需用HIV-1 p24确证试剂确证。其HIV-1 p24抗原的检测原理图见图1。
(4)定量测定:
a、取酶标板,将样品对应孔按序编号,空白1孔、每板应设阴性对照3孔、系列稀释阳性对照20IU/mL、10IU/mL、5IU/mL、2.5IU/mL、1.25IU/mL,每个稀释浓度做两个复孔;如果测定样品为细胞培养上清液,则需用细胞培养液做阴性对照3孔。
b、先于每个反应孔中加入25μL样品稀释液,空白孔不加样品稀释液;
c、稀释阳性对照:阳性对照(PC)含有200IU/mL的重组HIV-1p24抗原,用阴性对照物先稀释阳性对照成20IU/mL后,再配制系列稀释4个浓度,稀释梯度和方法见表3,如果定量测定的样品为细胞培养上清液,则需用未感染的细胞培养上清液进行系列稀释抗原,每个稀释浓度做两个复孔。
表3 HIV-1p24系列稀释方法
d、按照编号,将100μL待测样品(空白孔不加)、阴性对照物和以上稀释后的系列阳性对照物加入到酶标板上有加样品稀释液的反应孔中,振荡30-60秒混匀,置37℃孵育1小时;
e、拍干后每孔加入酶结合物125μL/孔(空白孔不加),置37℃孵育30分钟;
f、用稀释后的洗涤液洗板4-5次,拍干后每孔先后加入底物液、显色液混合物(临用前配制)各62.5μL/孔,先加底物液或先加显色液均可;振荡30-60秒混匀、置37℃孵育30分钟;
g、加入终止液50μL/孔;
h、5min之内,用双波长酶标仪(测定波长450nm,参考波长630nm)读取各孔吸光度值;其不同浓度的HIV-1 p24稀释系列样品的吸光值见表4。
表4不同浓度的HIV-1 p24系列稀释
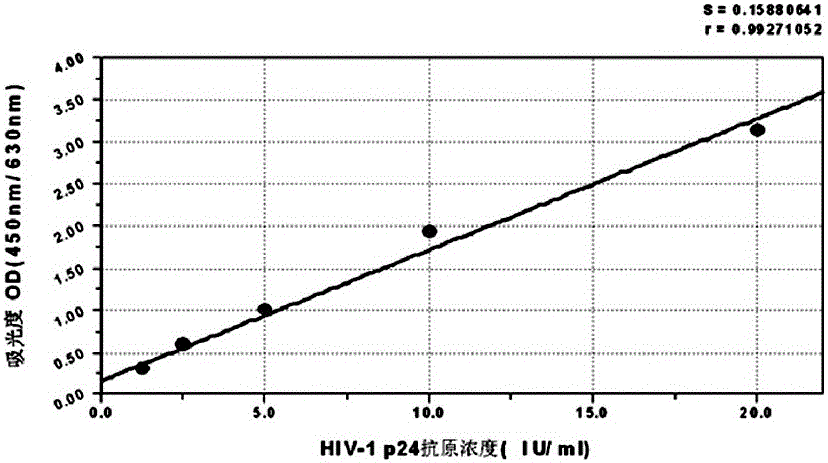
i、将表3所示的系列稀释的阳性抗原对照结果,以阳性对照物稀释系列浓度为横坐标,以横坐标浓度所对应检测到的OD值的平均值为纵坐标作图,得标准曲线如图2所示;检测样品时,以自阳性标本平均OD值在y轴上的刻度垂直于y轴划线至标准曲线,再自与标准曲线的交叉点垂直于x轴划线,读取x轴上HIV-1 p24抗原浓度,即为阳性标本中的HIV-1 p24的抗原含量;
j、其检测同时满足的条件同定性检测。
以上定性及定量检测可采用多次重复,以提高其检测的准确性。
实施例4该试剂盒在检测样品中的应用
采用实施例2制备的HIV-1 p24检测试剂盒以及实施例3所述的检测方法测定HIV-1 p24抗原国家参考品,具体步骤如下:
(1)将每个酶标板反应孔中加入25μL样品稀释液(含有Bio-11-A4);
(2)将100μL阴性对照、待测样品(稀释的不同浓度HIV-1 p24、HIV-1 p24抗原国家参考品中样品)加入到有样品稀释液的反应孔中,振荡30-60秒混匀,置37℃孵育1小时;
(3)洗板4次,拍干后每孔加入酶结合物125μL/孔(空白孔不加),置37℃孵育30分钟;
(4)洗板4次,拍干后每孔加入底物液和显色液混合物(底物液:显色液体积比为1:1,临用前配制,10分钟之内加入)共125μL/孔,置37℃孵育30分钟;
(5)加入终止液50μL/孔。
(6)5分钟之内,用双波长酶标仪(测定波长450nm,参考波长630nm)读取各孔吸光度值。
采用上述技术方案后,测定HIV-1 p24抗原国家参考品中20支HIV-1 p24抗原阴性参考品,全部检测为阴性(20/20);10支HIV-1 p24抗原阳性参考品,全部检测为阳性(10/10);10支线性及灵敏参考品最低检出量不高于1.25IU/mL;L10(基质血清)为阴性反应。L1-L5共5个样品测定值统计分析后,线性相关系数(R值)≥0.95;精密度参考品,平行测定(10孔)A值后,统计分析,精密度(CV值)≤15%。对p24抗原的定量准确,线性好。具体检测数据如表5所示。
表5本发明制备的试剂盒测定HIV-1 p24抗原国家参考品结果
- 还没有人留言评论。精彩留言会获得点赞!