用于确定患者的滤过率的方法和装置与流程
本公开涉及用于确定患者的滤过率、特别是患者的肾小球滤过率或等价的肌酐清除率的方法。其进一步涉及对应的装置并且涉及利尿剂。最后,本公开涉及计算机程序产品和计算机程序。
背景技术:
gfr(肾小球滤过率)的测量是用来在日常临床实践中评估肾功能的普遍应用的方法。患有慢性肾病或肾功能衰退的患者的管理很大程度上是通过gfr来确定的,并且因此,已经基于gfr来定义慢性肾病的阶段(ckd阶段)1-5。gfr(肾小球滤过率)是用于评估肾功能的重要临床参数。大多数所谓的床边方法(即,在临床实践中用于确定gfr的方法)是基于来自血液样本的肌酐(所谓的血清肌酐)的测量。
肌酐是由肾脏自由分泌的——如果已知血液和尿液中的肌酐浓度并且可以在24小时上测量尿液排出量,则可以确定gfr。为此,使用诸如肌酐清除率之类的技术来直接测量gfr是可能的,[rodrigoe等人的measurementofrenalfunctioninpre-esrdpatients(国际肾脏增刊,2002年5月;(80):11-17)]。要求尿液样本的确定gfr的方法要求可靠的尿液数据,这由于各种各样的原因而通常是成问题的,并且结果导致在仅要求肌酐的血液(或血浆)样本的方法上已经花费了大量努力。
在cockcroftdw,gaultmh的“predictionofcreatinineclearancefromserumcreatinine”(nephron,1976,16(1):31-41)中描述了仅要求肌酐的血液(或血浆)样本作为来自患者的样本的用于估计gfr的一个此类方法。
该方法以及仅依赖于肌酐的血液(或血浆)样本作为来自患者的样本的其它方法的一个缺陷在于,根据群体特定的参数(诸如年龄或性别)应用的方程的相关性。因此,按照患者所属于的群体部分来解释肌酐值。相应地,通过所述方法提供的肾小球滤过率的估计的准确度受限于将患者关联到群体的特定部分的准确度。
因此,本发明的主题是为了克服上面提到的缺陷并提供一种用于确定患者的肾小球滤过率或肌酐清除率的改进方法。
技术实现要素:
本主题通过根据独立权利要求的教导来处理。在从属权利要求中描述了有利实施例。
在一个实施例中,提供了一种用于确定或近似患者的肾小球滤过率或患者的肌酐清除率的方法。该方法包括以下步骤:确定该患者的血清肌酐浓度,确定该患者的瘠瘦(lean)组织质量,以及基于该患者的血清肌酐浓度和该患者的瘠瘦组织质量来确定该患者的肾小球滤过率或该患者的肌酐清除率。
在该方法的一个实施例中,确定瘠瘦组织质量的步骤包括测量瘠瘦组织质量。
在一个实施例中,测量瘠瘦组织质量的步骤包括应用生物阻抗测量。这提供了特别便利的方法。
在一个实施例中,确定血清肌酐浓度的步骤包括测量来自血液样本的血清肌酐浓度。这提供了特别可靠的方法。
在一个实施例中,滤过率
在另一实施例中,该方法包括基于所确定的该患者的肾小球滤过率或肌酐清除率来确定针对为该患者应用肾替代疗法的准则的步骤,所述肾替代疗法包括透析治疗、特别是血液透析治疗或腹膜透析治疗。该准则可以是是否要为该患者着手透析治疗的准则。该准则可以是是否要将对该患者应用的治疗模式从第一治疗模式改为第二治疗模式(例如从腹膜透析改为血液透析或相反)的准则。该准则可以是针对在应用肾替代疗法时应用某一剂量的准则,例如要从患者抽出的流体的量或者与血液透析工作段(session)相关联的目标清除率。
在一个实施例中,该患者是经受肾替代疗法的患者,该肾替代疗法包括腹膜透析或血液透析。在该实施例中,确定血清肌酐浓度的步骤包括确定肾替代疗法的各治疗工作段之间的在第一时间处的第一血清肌酐浓度以及确定肾替代疗法的各治疗工作段之间的在第二时间处的第二血清肌酐浓度。该第一时间可以是紧接在结束的肾替代疗法之后,在血液透析的情况中:hd后;该第二时间可以是在准备肾替代疗法时,在血液透析的情况中:hd前。在该实施例中,确定患者的gfr或肌酐清除率的步骤是基于该第一肌酐浓度以及基于该第二肌酐浓度。
在一个特定实施例中,该方法包括确定、特别是测量该患者在该第一时间与第二时间之间的体重增加的步骤,并且其中确定患者的gfr或肌酐清除率的步骤是基于该患者的体重增加。
在一个实施例中,该方法包括确定该患者的身体总水分(totalbodywater)、特别是通过应用患者的生物阻抗测量来测量身体总水分的步骤,并且其中确定患者的gfr或肌酐清除率的步骤是基于该患者的身体总水分。
在该方法的一个实施例中,该患者的gfr或肌酐清除率是在多个时间处确定的,并且其中确定该患者的gfr或肌酐清除率的时间平均(timelyaverage),并且其中从该时间平均的确定中丢弃一个或多个极端值或离群值。为此,可以应用中值滤波器以用于过滤时间序列。通过该方法,可以抑制源自于患者的饮食变化的对测量的影响。
在一个实施例中,该方法包括基于患者的所确定的肾小球滤过率或肌酐清除率来确定针对促进产生尿液以供罹患肾小球滤过率降低或肌酐清除率降低的患者的治疗中使用的药物(即,利尿剂)的订购的准则的步骤。例如,该准则可以是是否要为该患者着手利尿剂疗法的准则。替换地或附加地,该准则可以是用于确定针对患者的利尿剂剂量的准则。在一个实施例中,提供要给予患者的药物(优选地利尿剂),其中该药物的剂量和/或给药方案是基于所述所确定的准则来确定的。
在另一实施例中,提供了一种用于确定或近似患者的gfr或患者的肌酐清除率的装置。该装置包括被配置成确定该患者的血清肌酐浓度的第一确定单元,被配置成确定该患者的瘠瘦组织质量的第二确定单元,以及被配置成基于该患者的血清肌酐浓度和该患者的瘠瘦组织质量来确定该患者的gfr或该患者的肌酐清除率的处理单元。
该装置容许与上文公开的方法相同的有利修改或改进。
在一个实施例中,为该处理单元定义第一和第二操作模式,并且其中该处理单元在该第一操作模式中被配置成通过应用如上所述的公式
附图说明
图1描绘了用于确定患者的滤过率或清除率的方法的流程图。
图2描绘了用于确定患者的滤过率或清除率的另一流程图。
图3示出了根据本公开的第一装置,其包括用于实现根据本教导的方法的控制器。
图4示出了根据本公开的第二装置,其包括用于实现根据本教导的方法的控制器。
图5-7分别示出了比较确定肌酐清除率的各方法的统计分析的散点图。
图8-13分别示出了比较根据本教导的方法与确定gfr的常规方法的仿真测量结果。
具体实施方式
图1描绘了用于确定或近似患者的肾小球滤过率(gfr)或患者的肌酐清除率的方法100。
方法100包括确定患者的血清肌酐浓度的步骤101,在一个实施例中,步骤101之前有或者包括测量先前从患者取得的血液样本上的血清肌酐浓度的步骤111。替换地,手动地将血清肌酐浓度输入到系统300的用户接口中。
方法100进一步包括确定患者的瘠瘦组织质量的步骤102。在一个实施例中,步骤102之前有或者包括通过应用生物阻抗测量来测量瘠瘦组织质量的步骤112。
方法100还包括基于在步骤101中确定的患者的血清肌酐浓度以及基于在步骤102中确定的患者的瘠瘦组织质量来确定患者的gfr或患者的肌酐清除率的步骤103。
在一个实施例中,肌酐清除率
其中,
针对比例常数
在另一实施例中,在步骤103中如下确定肾小球滤过率
其中
针对无量纲比例常数
在一个实施例中,方法100包括基于患者的所确定的gfr或肌酐清除率来确定针对用于促进产生尿液以供罹患gfr降低或肌酐清除率降低的患者的治疗中使用的药物(即,利尿剂)的订购或剂量或给药方案的准则的步骤114。例如,该准则可以是是否要为该患者着手利尿剂疗法的准则。
在另一实施例中,方法100包括基于所确定的患者的gfr或肌酐清除率来确定针对为患者应用肾替代疗法的准则的步骤115,所述肾替代疗法包括透析治疗、特别是血液透析治疗或腹膜透析治疗。该准则可以是是否要为该患者着手透析治疗的准则。该准则可以是是否要将对该患者应用的治疗模式从第一治疗模式改为第二治疗模式(例如从腹膜透析改为血液透析或相反)的准则。该准则可以是针对在应用肾替代疗法时应用某一剂量的准则,例如要从患者抽出的流体的量或者与血液透析透析工作段相关联的目标清除率。
图2描绘了用于确定经受肾替代疗法的患者的肌酐清除率和/或gfr的方法200,所述肾替代疗法包括腹膜透析或hd(血液透析)治疗。方法200包括确定肾替代疗法的各治疗工作段之间的在第一时间处的第一血清肌酐浓度的步骤205,该第一时间优选地紧接在结束的肾替代疗法之后,在血液透析的情况中:hd后。接下来,在该第一时间处的血清肌酐浓度将被称为:c0=[cr]s(后)。
方法200进一步包括确定肾替代疗法的各治疗工作段之间的在第二时间处的第二血清肌酐浓度的步骤204,在血液透析的情况中:hd前。在该第二时间处的血清肌酐浓度将被称为:c=[cr]s(前)。
方法200进一步包括确定、特别是测量该患者在该第一时间与该第二时间之间的体重增加的步骤203。体重增加将被称为:
方法200进一步包括确定患者的身体总水分、特别是通过应用患者的生物阻抗测量来测量身体总水分的步骤201,其优选地是在第一时间处,更优选地紧接在进行肾替代疗法之后,即hd后。tbw(身体总水分)将被称为v0=tbw(后)。
此外,方法200包括从先前已通过应用生物阻抗测量确定的患者的瘠瘦组织质量来确定肌酐生成率的步骤202。
因此,肌酐生成率可以被表达为
最后,方法200包括基于在第一时间处(即,优选地在肾替代疗法之后)的血清肌酐浓度co、在第二时间处(即,优选地在肾替代疗法之前)的血清肌酐浓度c、肌酐生成率g=
为此,可以应用将肌酐清除率k=kcr关联到输入参数g、c、c0、v0和
其中,
并且其中,求解该式,优选地迭代地求解该式,以求出k。
肌酐清除率k的值是在步骤207处确定的,并且在步骤208中使用
来确定肾小球滤过率gfr=qgfr,其中
这样确定的肾小球滤过率
图3描绘了被适配成用于实现上文关于图1或图2描述的方法中的任何的系统309。系统309包括装置300。
装置300被连接到外部数据库302,外部数据库302包括对患者实行的测量的结果以及所描述的方法中的一个所需的全部其它数据。数据库302也可以是装置300的内部部件。
装置300可以可选地具有用于输入数据并将所述数据提供给处理单元306的部件304。此类数据可以是与关于图1或图2描述的方法有关地需要的任何数据。
装置300包括第一确定单元307,其被配置成基于测量或者基于从数据库302或从部件304接收到的数据来确定患者的血清肌酐浓度。
此外,装置300包括第二确定单元308,其被配置成基于测量或者基于从数据库302或从部件304接收到的数据来确定患者的瘠瘦组织质量。
仍另外,装置300包括处理单元306,其被配置成基于患者的血清肌酐浓度和患者的瘠瘦组织质量来确定患者的gfr或患者的肌酐清除率。
处理单元可以进一步被适配成实现上文关于图1或图2的描述而描述的方法中的任何。
可以将所述确定的结果显示在监视器305上或借助于数据库302或任何其它存储部件来存储所述确定的结果。
图4描绘了系统310,其是系统309的修改。如从图4中描绘的系统310可以看到的,装置300可以(借助于线缆或无线地)与生物阻抗测量部件317连接,生物阻抗测量部件317作为用于提供测量结果以用于为确定单元308确定患者的瘠瘦组织质量的一个测量部件。替换地或附加地,生物阻抗测量部件317可以提供测量结果以为处理单元306确定患者的身体总水分。
可以如wo2006/002685a1中描述的那样来执行从生物阻抗测量确定患者的瘠瘦组织质量和/或从生物阻抗测量确定患者的身体总水分,藉此通过引用将其公开内容明确地并入本申请中。
一般来说,可以除包括上文关于图1或图2描述的方法所需的数据和测量结果的数据库302之外或者替代所述数据库302而提供生物阻抗测量部件317。
生物阻抗测量部件317可以能够自动地补偿对阻抗数据(比如接触电阻)的影响。
生物阻抗测量部件317的示例是来自思创科技公司在商标hydratm之下分发的设备,其在wo92/19153中被进一步描述,藉此将其公开内容通过引用明确地并入在本申请中。
生物阻抗测量部件317可以包括用于附接到患者的各种电极。在图4中,仅示出了被附接到生物阻抗测量部件317的两个电极317a和317b。当然也可设想附加电极。
进而所隐含的每个电极都可以进而包括两个或更多个(“子”)电极。电极可以包括电流注入(“子”)电极和电压测量(“子”)电极。亦即,图4中所示的电极317a和317b可以包括两个注入电极和两个电压测量电极(即,总共四个电极)。
该装置可以进一步具有用于测量要由该装置实现的方法所需的患者的身体参数的部件319。用于测量身体参数的部件319可以是用于测量患者的体重的秤或者用于确定患者的血清肌酐浓度所需的任何实验室装备。
图5描绘了比较使用关于图1描述的方法与来自相关技术的基于使用血液和尿液样本二者的方法确定的肌酐清除率的结果的统计分析。将这两种方法应用于包括没有经受肾替代疗法的124位患者(所谓的预esrd(终末期肾病)患者)的患者群。来自相关技术的测量用作参考并被标示为“lab”。图5是绘出来自不同方法的测量结果之间的差异对比来自这两种方法的平均值的统计分析的绘图。在纵轴上绘出测量值之间的差异,其中在横轴上绘出平均值。来自关于图1描述的方法的结果被标示为“bcm”,而来自相关技术的方法的结果被标示为“lab”。比较后一方法与来自现有技术的应用bland-altman分析的方法的结果,这得出了-0.89±13.2ml/min的平均差异。
图6描绘了与图5中提供的统计分析类似的统计分析,其中比较了来自相关技术的另一方法(所谓的cockroftgault方法)的结果与基于血液和尿液样本的方法对相同的上文提到的患者群的结果,其中cockroftgault方法的结果被标为“cg”。bland-altman分析的结果提供了0.3±14.7ml/min的一致性。
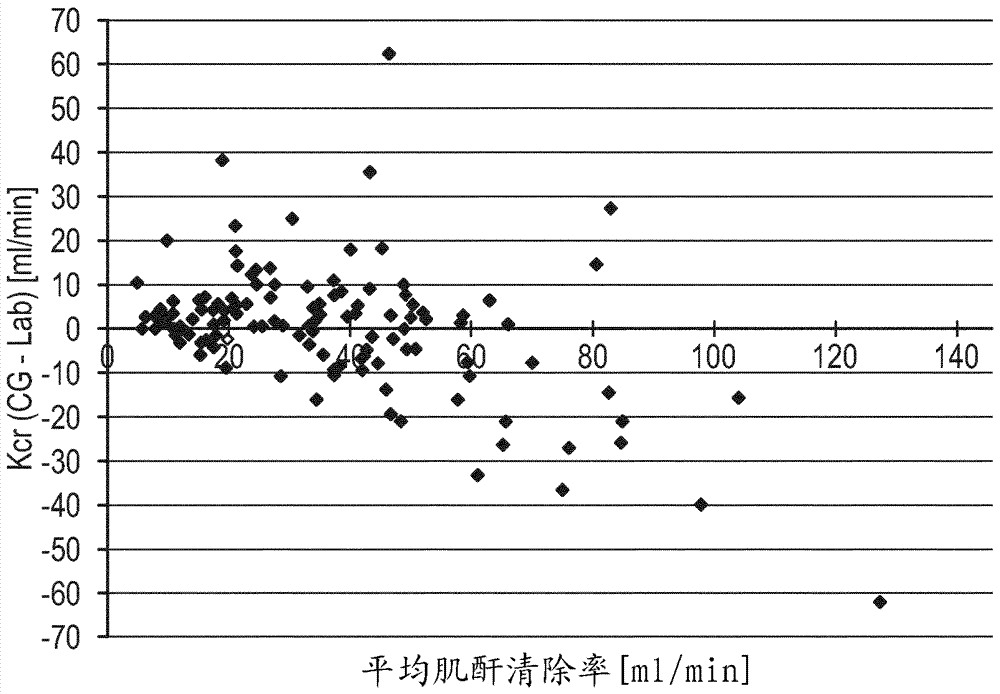
图7描绘了与在图5和图6中提供的统计分析类似的统计分析,其中比较了关于图1描述的方法的结果与来自cockroftgault方法的结果。如可以看到的,两个方法之间的差异可以归因于患者是否可以被诊断为“肥胖的”或“瘠瘦的”。
图8到13描绘了具有变化的身体组成和恒定的肾小球滤过率的患者身体模型的仿真结果。
特别地,图8描绘了用于仿真的具有不同的身体组成的两个受试者(即肥胖的受试者(上图)和瘠瘦的受试者(下图)),在图10-13中描绘了其结果。特别地,图8中的图表中的下面的一个表示被馈送到仿真中的身体组成,其结果被示出在图10和图12中。图8的上图表示用在图11中和在图13中描绘的仿真中的身体组成。
在图8的上图和下图中,都用椭圆形点来描绘不同的被仿真的天处的总体重的值。总体重包括mat(脂肪组织的质量或脂肪组织质量)和mlt(瘠瘦组织的质量或瘠瘦组织质量)。叉状点表示脂肪组织质量的演变,其基本上是恒定的;矩形点表示变化的瘠瘦组织质量。
图9描绘了仿真结果,其仿真了在图8的下图中描绘的模型身体中的肌酐浓度的时间演变。
肌酐浓度的时间演变的该仿真是基于以下假设:
肌酐质量随时间的改变率
针对d[cr]/dt重新整理,得出:
可以对该方程积分以仿真肌酐浓度取决于被馈送到该仿真中的身体组成参数和肌酐清除率
肌酐在身体中的分布空间被视为等价于身体总水分(vtbw),并且因此,这可以根据在wo2006/002685中描述的方法来确定,即,
其中,
mat是脂肪组织质量,
mlt是瘠瘦组织质量,
htw_lt和htw_at是瘠瘦和脂肪组织的水合系数,
mfo是流体超负荷(oh(水分过量)的质量,如果存在的话。
身体组成中的随时间(几周到几个月)的改变将修改整个身体,这改变了肌酐分布空间。因此,针对vtbv的微分方程得出:
随后将时间相关的肌酐浓度馈送到关于图1的方法描述的用于确定gfr的方法中。此外,从该时间相关肌酐浓度以及根据来自现有技术的用于确定gfr的估计的另外的方法(在后文中将被称为常规方法)的其它参数确定肾小球滤过率gfr。
以下的常规方法用于仿真gfr的估计,并且在图10-13中描绘来自所仿真的估计的结果。
来自在cockcroftdw、gaultmh的“predictionofcreatinineclearancefromserumcreatinine”(nephron1976,16(1):31-41)中描述的方法的结果被称为“cockroft-gault”并被绘出为三角形。
来自应用关于图1描述的方法的结果被称为“bcm”并被绘出为圆形。
来自在a.s.levitg、j.w.kusek、g.j.beck的“asimplifiedequationtopredictglomerularfiltrationratefromserumcreatinine”([摘要]jamsocnephrol2000,11:155a)中描述的方法的结果被称为“abbrev4varmdrd”(肾病中饮食的简短的4变量修改的简称)并被绘出为星形。
来自在rulead、larsonts、bergstralhej、slezakjm、jacobsensj、cosiofg的“usingserumcreatininetoestimateglomerularfiltrationrate:accuracyingoodhealthandinchronickidneydisease”(内科医学年报,2004,141(12):929-937)中描述的方法的结果被称为“quadmayo”(quadraticmayo临床的简称)并被绘出为方形。
来自在muratak、baumannna、saengerak、larsonts、rulead、lieskejc的“relativeperformanceofthemdrdandckd-epiequationsforestimatingglomerularfiltrationrateamongpatientswithvariedclinicalpresentations”(美国肾脏病学会临床杂志:cjasn2011,6(8):1963-1972)中描述的方法的结果被称为“ckdepi”并被绘出为菱形。
图10描绘了针对仿真具有肾小球滤过率
如果瘠瘦组织质量根据图8变化,那么图10的结果示出了在低肾小球滤过率处的瘠瘦的受试者中的结果,用于确定肾小球滤过率的常规方法低估了已被馈送到仿真中的参考gfr。显著地,常规方法示出了gfr的仿真测量中由于肌酐浓度的改变而导致的表面上的变化。针对这点的原因是用于确定gfr的常规方法没有针对瘠瘦组织的变化进行补偿。
图11描绘了针对仿真具有肾小球滤过率
图12描绘了针对仿真具有肾小球滤过率
图13描绘了针对仿真具有肾小球滤过率
图10-13与来自应用关于图1描述的方法的仿真结果相比较地描绘了使用在日常实践中使用的用于估计gfr的常规方法引入的误差的量值。所述仿真示出,假设在作为到仿真中的输入的肾功能以及因此的gfr中没有改变,则来自应用图1的方法的仿真测量结果也保持不变,而不管肌肉质量(mlt)中的变化。肌酐的浓度和其生成率将响应于mlt改变而变化,但是这不应影响gfr。换言之,gfr应与身体组成中的变化无关。这与用于估计gfr的常规方法形成对照,所述常规方法示出了取决于被输入到仿真中的身体组成的变化的gfr估计的变化。
公开了用于确定或近似患者的肾小球滤过率或患者的肌酐清除率的方法和装置。该方法包括以下步骤:确定该患者的血清肌酐浓度,确定该患者的瘠瘦组织质量,以及基于该患者的血清肌酐浓度和该患者的瘠瘦组织质量来确定该患者的肾小球滤过率或该患者的肌酐清除率。
- 还没有人留言评论。精彩留言会获得点赞!