用于胰腺癌的生物标志物的制作方法
本发明涉及胰腺癌以及生物样品中的生物标志物在诊断此类病症特别是胰腺导管腺癌中的用途。
背景技术:
胰腺导管腺癌(pancreaticductaladenocarcinoma,pdac)是最常见的外分泌胰腺恶性肿瘤,占发生在胰腺的恶性肿瘤的80%以上。它是西方世界中癌症相关死亡的第四最常见原因。在诊断时,大多数患者显示局部晚期疾病或具有确定的转移,因此外科手术仅在10-20%的患者中是可行的(seneretal.(1999)jamcollsurg,189:1-7)。虽然总体上的5-年生存率小于5%,但是在手术切除和辅助化疗之后患者的5-年生存率能够达到30%。
胰腺导管腺癌(pdac)是一种罕见的癌症,在过去的十年中,针对该病在诊断和治疗方法方面没有显著的改进。尽管在分子水平我们对该病的理解有了相当大的进步,但是新的发现尚未应用于临床且大多数患者仍然面临5至6个月的严峻的平均生存期。随着2013年在美国有超过38,000例pdac-相关死亡以及在欧洲有超过40,000例,这种恶性肿瘤目前是癌症相关死亡的第四主要原因,但是预计到2030年这种恶性肿瘤将会成为第二主要原因。
pdac是一种最难发现的癌症。胰腺的腹膜后位置、很多复杂潜在的分子异常和缺少明确的临床症状导致大多数患者在晚期才发现患病。因此,少于20%的患者会接受可能治愈性的手术,而剩余患者只能被提供姑息治疗。
这些令人担忧的数字将随着早期检测工具的改进而发生显著的改变,因为在阶段ipdac肿瘤的偶然诊断之后已经报导了接近70%的5-年存活,在阶段i时,pdac肿瘤仍然只限于胰腺内,尺寸<2cm。重要的是,对于早期诊断存在大约十年的相当长的机会“窗”(yachidas,etal.(2010)nature467(7319):1114-1117)。当可能治愈性的手术不再可行时,考虑到转移性疾病当前治疗的疗效不佳,在早期阶段进行检测也是至关重要的。
然而,pdac的及时检测受到若干因素阻碍:疾病早期阶段缺少具体的临床症状,尽管竭尽全力但是当前的显像模式的灵敏度不够,和早期阶段疾病缺少精确的基于体液的生物标志物(参见kauretal.(2012)biomarkmed6(5):597-612.)。早期阶段的pdac还难以区别于慢性胰腺炎(cp)、胰腺的良性炎性疾病和pdac的一个危险因素。血清糖类抗原19.9(carbohydrateantigen19.9,ca19.9)是目前广泛用于临床的唯一pdac生物标志物,其受如下问题困扰:在具有路易斯阴性基因型(lewis-negativegenotype)的患者中出现假阴性结果,在无症状人群中存在差的阳性预测值,和在有症状患者中的灵敏度低(79%-81%)。小于50%的早期疾病(肿瘤<2cm)病例具有升高的ca19-9水平,但是,在各种其它的良性和恶性的胰腺与肝胆疾病(包括慢性胰腺炎)以及不相关的囊性与炎性疾病中,ca19.9水平可能会升高(参见ballehaninnauk,chamberlainrs,"serumca19-9asabiomarkerforpancreaticcancer-acomprehensivereview",indianjsurgoncol,2011;2:88-100)。另外,路易斯a/b抗原(ca19.9识别该抗原)在大约10%的人群中不表达。
最近,蛋白质组技术已经用于研究胰腺癌组织、胰液和血清/血浆标本中蛋白质表达(例如参见koomenetal.(2005)clincancerres,11:1110-1118),但是,迄今为止,这些都没有导致发现适合于临床实践的生物标志物。
最近,尿作为生物标志物的可能来源而被研究,因为它是能够容易且无创地获得的生物流体(pieperefal.(2004)proteomics,4:1159-1174)。与血浆相比,尿蛋白较不复杂且热稳定性更好。此外,大部分的常见蛋白质(白蛋白、尿调素)包括比例较小的尿蛋白质组,所以样品处理需要较少的预清洗/分馏。大约49%的尿蛋白是血浆肾小球滤过的可溶性产物(barratetal.(2007)cmaj,177:361-368),因此,尿中相当数量的蛋白质来自于肾外来源(thongboonkerdetal.(2005)curropinnephrolhypertens,14:133-139)。
除了泌尿系统癌症之外,在肺癌、卵巢癌和乳腺癌患者的尿中还已经鉴定了几种癌症相关蛋白质。
wo2004/102189描述了用于诊断胰腺癌(pancreaticcancer)的生物标志物。将来自胰腺癌患者的血清样品与来自健康供体的血清样品进行比较,并且产生的生物标志物以其重量为特征。wo2004/099432实现了类似的方法,该专利文献提供了用于检测胰腺癌的另外的生物标志物。wo2000/34787描述了诊断上皮癌的方法,包括测量尿中生物标志物的水平。
目前,还没有用于胰腺癌(pancreaticadenocarcinoma)早期诊断的特异性的且灵敏的生物标志物。这是极其重要的,因为如果能够在早期(例如,阶段i)发现胰腺癌,那么此类患者的存活能够被极大提高(目前,大部分患者是在阶段lll/iv被诊断,5-年存活率<5%)。因此,用于早期检测的高度精确的生物标志物预计会显著影响患者的预后。
因此,需要一组灵敏的且特异性的标志物,这些标志物不仅能够早期诊断pdac,而且能够有助于区分pdac与其它肿瘤以及区分pdac与慢性胰腺炎(cp)。优选地,这些标志物在容易且无创获得的样品中能够被检测,并且它们是足够灵敏的以便在疾病早期阶段检测疾病。
发明概述
在本发明的第一方面,提供了用于诊断胰腺导管腺癌(pdac)的生物标志物组(panel),所述组包括lyve1、reg1和tff1。本文中reg1的参考包括reg1a和reg1b。在一些具体实施方式中,所述组可进一步包括ca19.9。
在本发明的第二方面,提供了筛选或检测胰腺导管腺癌(pdac)的方法,包括检测生物样品中蛋白质的表达水平或浓度,其中所述蛋白质选自lyve1、reg1(例如,reg1a和/或reg1b)和tff1或者其组合构成的组。在一些具体实施方式中,生物样品是尿样品。
在本发明的第三方面,提供了用于诊断胰腺导管腺癌的蛋白质,其选自lyve1、reg1(例如,reg1a和/或reg1b)和tff1或者其组合构成的组。还提供了蛋白质在检测或诊断pdac的方法中的用途,所述蛋白质选自lyve1、reg1(例如,reg1a和/或reg1b)和tff1构成的组。
在本发明的第四方面,提供了用于检测胰腺导管腺癌的试剂盒,包括用于检测生物样品中lyve1、reg1(例如,reg1a和/或reg1b)或tff1或者其组合的表达水平或浓度。
在本发明的另一方面,提供了区分pdac和慢性胰腺炎的方法,包括检测尿样品中lyve1、reg1(例如,reg1a和/或reg1b)和/或tff1的表达水平。所述方法可包括将每个蛋白的表达水平与参照进行比较。
在本发明的另一方面,提供了检测或诊断早期阶段pdac(例如,阶段i或阶段iipdac)的方法,包括检测生物样品中生物标志物组的蛋白质lyve1、reg1(reg1a和/或reg1b)和/或tff1的表达水平或浓度。所述方法可进一步包括将每个定量化的蛋白质的表达水平或浓度与参照进行比较。
在本发明的另一方面,提供了治疗患者pdac的方法,包括检测生物样品中蛋白质的表达水平或浓度,所述蛋白质选自lyve1、reg1(例如,reg1a和/或reg1b)和tff1或者其组合构成的组,可选地,将表达水平与对照/参照进行比较,以及,若诊断或怀疑患pdac则对pdac进行治疗。本发明还包括预后方法,包括测定生物样品中选自lyve1、reg1(例如,reg1a和/或reg1b)和tff1构成的组的一种或多种蛋白质的表达水平或浓度,可选地,将表达水平与对照/参照进行比较,和测定患者的预后。
在本发明的具体实施方式中,用于本发明的生物标志物能够被单独使用(即只使用lyve1、reg1(例如,reg1a和/或reg1b)和tff1中的一个),它们能够被成对地使用(例如,lyve1和reg1(例如,reg1a和/或reg1b),lyve1和tff1,或者reg1(例如,reg1a和/或reg1b)和tff1),三个生物标志物可以被一起使用(lyve1和tff1的每一个与reg1a或reg1b之一),或者,四个全部可以被使用(lyve1、tff1、reg1a和regib)。第五个生物标志物,ca19.9也可以被使用。在本发明的具体实施方式中,可以通过对基因表达进行定量(例如,对生物样品中的mrna定量)或通过对蛋白质表达进行定量(例如,对生物样品中的蛋白质浓度定量)来测定lyve1、reg1(例如,reg1a和/或reg1b)和/或tff1的表达水平。
附图说明
参看若干附图,如下:
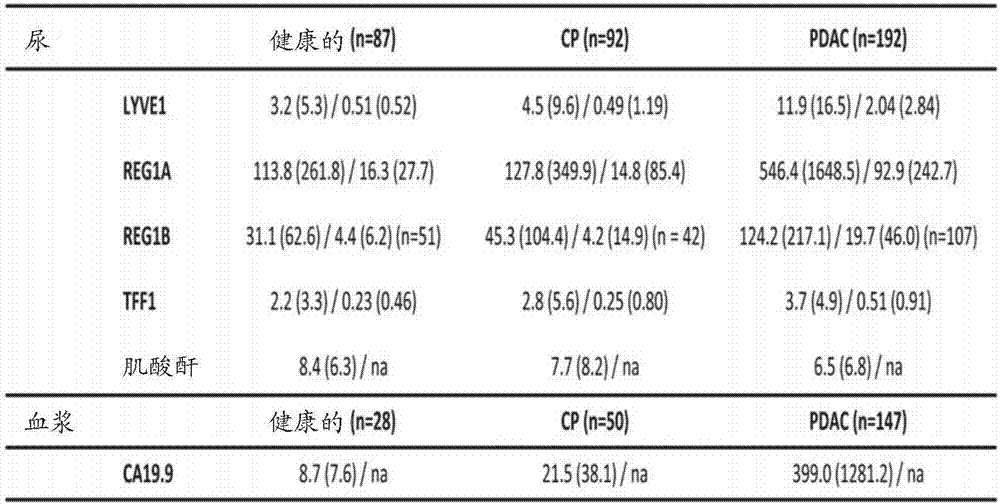
图1:候选蛋白质生物标志物的尿浓度。a,采用elisa分析的健康的、慢性胰腺炎(cp)和胰腺导管腺癌(pdac)患者的尿中lyve1、reg1a、reg1b和tff1蛋白质浓度(肌酸酐-正常化的)的散点图。上面的线:克鲁斯卡尔-沃利斯/邓恩后测试,***:p<0.001;b,显示了生物标志物的原始的/肌酸酐-正常化的数据的统计概括、中值和四分位差(iqr),尿肌酸酐的中值和iqr(mmol/l),以及样品组的ca19.9。
图2-尿生物标志物在区分胰腺癌患者和健康对照方面的诊断性能。a,训练集(数据的70%)中各个肌酸酐-正常化的尿生物标志物的pdac(n=143)相对于健康受试者(n=59)的roc曲线;b,训练集和独立验证集(数据的30%:pdacn=49,健康受试者n=28)中生物标志物的pdac相对于健康受试者的roc曲线;c,概括表。auc:曲线下面的面积,sn:灵敏性,sp:特异性,具有相应的95%置信区间(ci)。训练数据集确定的最佳分割点推导出验证集的sn和sp。cnorm:肌酸酐-正常化的,creat:肌酸酐。
图3-胰腺癌不同阶段中三种生物标志物的尿浓度。健康个体(n=87)和疾病发展不同阶段的胰腺癌患者(i-iian=16,i-iin=71,iii-ivn=77)的尿中尿lyve1、reg1a、tff1蛋白质浓度(肌酸酐-正常化的)的散点图。线表示中值和iqr值。上面的线:克鲁斯卡尔-沃利斯/邓恩后测试,*:p<0.05,**:p<0.01,***:p<0.001。
图4-尿生物标志物在区分早期胰腺癌患者和健康个体方面的诊断性能。a,训练集(数据的70%)中各个尿生物标志物的阶段i-iipdac(n=56)相对于健康受试者(n=61)的roc曲线;b,训练集和独立验证集(数据的30%;pdacn=15,健康受试者n=26)中生物标志物的阶段i-iipdac相对于健康受试者的roc曲线;c,概括表。auc:曲线下面的面积,sn:灵敏性,sp:特异性,具有相应的95%置信区间(ci)。训练数据集确定的最佳分割点推导出验证集的sn和sp。cnorm:肌酸酐-正常化的,creat:肌酸酐。
图5-尿生物标志物组和ca19.9在区分早期胰腺癌患者和健康个体方面的诊断性能。a,生物标志物组与相应血浆ca19.9单独和结合比较健康个体的尿(n=28)与pdac阶段i-ii(n=71)和i-iia(n=16)(b)时的roc曲线。c,概括表。auc:曲线下面的面积,sn:灵敏性,sp:具有95%置信区间(ci)的特异性。训练数据集确定的最佳分割点推导出验证集的sn和sp。
图5c的图例
λca19.9的最佳分割点是37u/ml
+相关的/成对的auc的德隆单侧检验,评估尿生物标志物组相比于血浆ca19.9单独用作二分生物标志物(0.973对0.880)是否产生显著较大的auc,p=0.005
$相关的/成对的auc的德隆单侧检验,评估加入血浆ca19.9用作二分生物标志物是否比单独使用尿生物标志物组(0.991对0.973)显著提高了auc,p=0.04
++相关的/成对的auc的德隆单侧检验,评估尿生物标志物组相比于血浆ca19.9单独用作二分生物标志物(0.971对0.839)是否产生显著较大的auc,p=0.006
$$相关的/成对的auc的德隆单侧检验,评估加入血浆ca19.9用作二分生物标志物是否比单独使用尿生物标志物组(0.969对0.971)显著提高了auc,p=0.7
图6-尿蛋白质组分析。a,研究的流程图;b,按照亚细胞定位鉴定的总蛋白质的分类;和c,采用通路分析软件测定的功能活性。h:健康的,cp:慢性胰腺炎,pdac:胰腺导管腺癌,gelc/ms/ms:sds-page-液相色谱-串联质谱。
图7-三种尿的生物标志物和血浆ca19.9(ca19.9p)的相互关系。a,关联图(深蓝色/最暗的:健康;蓝绿色/最亮的:慢性胰腺炎(cp);紫色/中间的:胰腺导管腺癌(pdac))。b,皮尔逊相关系数和相应的显著性(ns:不显著的,*:p<0.05,**:p<0.01,***:p<0.001)。
图8-尿生物标志物在区分胰腺癌所有阶段(a-c)及阶段i-ii(d-f)与慢性胰腺炎患者方面的诊断性能。a,训练集(数据的70%)中各尿生物标志物的pdac(n=143)对cp(n=62)患者的roc曲线。b,训练集和独立验证集(数据的30%,pdacn=49,cpn=30)中生物标志物组的pdac对cp患者的roc曲线。c,概括表。d,训练数据集(70%,pdacn=56,cp=66)中各尿生物标志物的roc曲线。e,训练数据集和验证数据集(pdacn=15,cpn=26)中生物标志物组的roc曲线。f,概括表。cnorm,肌酸酐-正常化的,creat,肌酸酐,auc:曲线下面的面积,sn:灵敏性,sp:具有95%置信区间(ci)的特异性。训练数据集确定的最佳分割点推导出验证集的sn和sp。
图9-血浆ca19.9和尿生物标志物组在区分早期胰腺癌和慢性胰腺炎患者方面的探索性比较。a,生物标志物组与相应血浆ca19.9单独和结合比较cp尿(n=50)和来自pdac阶段i-ii(n=71)与i-iia(n=16)(b)的尿的roc曲线。c,概括表。auc:曲线下面的面积,sn:灵敏性,sp:具有95%置信区间(ci)的特异性。训练数据集确定的最佳分割点推导出验证集的sn和sp。
图9c的图例
λca19.9的最佳分割点是37u/ml
+相关的/成对的auc的德隆单侧检验,评估尿生物标志物组相比于血浆ca19.9单独用作二分生物标志物(0.830对0.775)是否产生显著较大的auc,p=0.1
$相关的/成对的auc的德隆单侧检验,评估加入血浆ca19.9用作二分生物标志物是否比单独使用尿生物标志物组(0.885对0.830)显著提高了auc,p=0.01
++相关的/成对的auc的德隆单侧检验,评估尿生物标志物组相比于血浆ca19.9单独用作二分生物标志物(0.871对0.735)是否产生显著较大的auc,p=0.004
$$相关的/成对的auc的德隆单侧检验,评估加入血浆ca19.9用作二分生物标志物是否比单独使用尿生物标志物组(0.866对0.871)显著提高了auc,p=0.6
图10-不同肿瘤中尿生物标志物浓度。a,人口统计学资料。b,不同肝胆疾病和早期阶段的胰腺癌(i-iia,n=16)与i-ii(n=71)的尿lyve1、reg1a和血浆ca19.9的散点图。没有测量这些样品中的tff1蛋白质水平,原因是:在进行该分析时,源公司对原始elisa分析作了实质性修改。ipmn(n=33):胰腺导管内乳头状黏液肿瘤,amp(n=26):壶腹癌,net(n=18):神经内分泌肿瘤,chl(n=24):胆管癌,duca(n=16):十二指肠癌。线表示中值和iqr值。上面的线:克鲁斯卡尔-沃利斯/邓恩后测试,*:p<0.5,**:p<0.01,***:p<0.001;未显示,差异无统计学意义。
图11-胰腺癌组织中生物标志物组蛋白质的表达。a,reg1a的免疫组织化学分析:i)低分化的pdac中reg1a,ii)恶性腺体中管腔reg1a。b,tff1:i)癌症的外源表达,ii)恶性腺体中管腔tff1。c,分散的淋巴管中lyve1表达,i)在肌肉层,和ii)在恶性腺体周围基质。d,监控胰腺癌患者期间的生物标志物水平:对手术前和患者追踪期间采集的尿样品采用elisa测量lyve1、reg1a和tff1。每个点代表特定时间点(x-轴)的对数变换的elisa值。
发明详述
生物标志物组(biomarkerpanels)
本发明提供了用于诊断胰腺导管腺癌(pdac)的生物标志物组,所述组包括lyve1、reg1(reg1a和/或reg1b)和tff1。特别地,本发明提供了胰腺导管腺癌(pdac)的诊断、筛选或检测方法,包括检测生物样品中基因表达水平或蛋白质,所述蛋白质选自lyve1、reg1(reg1a和/或reg1b)和tff1或者其组合构成的组。在优选的具体实施方式中,lyvei、reg1和tff1中的至少两个被使用。在更优选的具体实施方式中,三个全部被使用。
lyve1也称作淋巴管内皮透明质酸受体,胞外连接结构域1(extracellularlinkdomaincontaining1,xlkd1)是i型整合膜糖蛋白(integralmembraneglycoprotein)。编码的蛋白质发挥受体的作用并结合至可溶且固定化的透明质酸。lyve的参考包括ncbi(genbank)参考序列转录本nm_006691.3(gl:15130120)、ncbi蛋白质idnp_006682.2(gl:40549451)、geneid:10894和hgnc(hugo(人类基因组织)基因命名委员会基因id):14687。该基因具有4个剪接变体;两个是编码蛋白质的(全长蛋白质具有322个氨基酸,且第二个具有218个氨基酸)。蛋白质的全序列如下:
marcfslvllltsiwttrllvqgslraeelsiqvscrimgitlvskkanqqlnfteakeacrllglslagkdqvetalkasfetcsygwvgdgfvvisrispnpkcgkngvgvliwkvpvsrqfaaycynssdtwtnscipeiittkdpifntqtatqttefivsdstysvaspystipaptttppapastsiprrkklicvtevfmetstmstetepfvenkaafkneaagfggvptallvlallffgaaaglgfcyvkryvkafpftnknqqkemietkvvkeekandsnpneeskktdknpeeskspskttvrcleaev
(seqidno:1)
reg1a指的是胰岛再生源蛋白1(regeneratingislet-derivedprotein1),其属于reg(再生)糖蛋白家族,该家族在胰腺腺泡细胞中表达并发挥自分泌生长因子和旁泌生长因子的作用。该reg基因家族是多基因家族,分为四个子类,即i、ii、iii和iv型;reg1a基因是i型子类成员。其它的家族成员:reg1b、regl、pap,该基因串联聚集在染色体2p12上并且通过基因复制可以来自于相同的祖先基因。reg1a编码由胰腺外分泌部所分泌的蛋白质。本文中reg1的参考包括两个普遍描述的基因,即reg1a和reg1b,它们的产物在蛋白质水平上的相同性超过80%并且难以区分。因此,本发明的方法可以量化reg1a和reg1b之一的表达或浓度。在本发明可选的具体实施方式中,可以分别对reg1a和reg1b的表达或浓度进行量化。在本发明另一具体实施方式中,可以使用reg1a和reg1b不必区分且因此它们被一同定量的量化方法。
reg1a的参考包括ncbi(genbank)参考序列转录本nm_002909.4(gl:189491780)、ncbi蛋白质idnp_002900.2(g1:29725633)、基因id:5967和hgnc:9951。该基因具有4个剪接变体(内含子保留),但是只有一个是编码蛋白质的(166个氨基酸)。
maqtssyfmlisclmflsqsqgqeaqtelpqariscpegtnayrsycyyfnedretwvdadlycqnmnsgnlvsvltqaegafvaslikesgtddfnvwiglhdpkknrrwhwssgslvsykswgigapssvnpgycvsltsstgfqkwkdvpcedkfsfvckfkn
(seqidno:2)
reg1b的参考包括ncbi(genbank)参考序列转录本nm_006507.3(gl:189491779)、ncbi蛋白质idnp_006498.1、基因id:5968和hgnc:9952ncbi。有该基因的5个剪接变体(内含子保留),但是只有两个编码166个氨基酸和149个氨基酸的蛋白质。
maqtnsffmlisslmflslsqgqesqtelpnpriscpegtnayrsycyyfnedpetwvdadlycqnmnsgnlvsvltqaegafvaslikesstddsnvwiglhdpkknrrwhwssgslvsykswdtgspssanagycasltscsgfkkwkdescekkfsfvckfkn
(seqidno:3)
应注意,本文中“reg1”的参考指的是reg1a和reg1b这两者,因为通常任何一个可被使用。然而,在一些具体实施方式中,可以使用reg1a和reg1b这两者。
tff1指的是三叶因子1。tff1属于胃肠分泌的肽的家族,其与粘蛋白相互作用并且在重建与修复粘膜损伤的过程中以升高的水平表达。它们保护上皮细胞免于凋亡并提高它们的运动性,而且在癌细胞中也发挥着类似的关键作用,因此它们参与各种癌症类型的发生和发展。tff1的参考包括ncbi(genbank)参考序列转录本nm_003225.2(gl:48928023)、ncbi蛋白质np_003216.1(gl:4507451)、基因id:7031和hgnc:11755。
matmenkvicalvlvsmlalgtlaeaqtetctvaprerqncgfpgvtpsqcankgccfddtvrgvpwcfypntidvppeeecef
(seqidno:4)
本发明的方法能够以定性的方式执行,这种方式测定样品中是否存在癌症标志物蛋白,但是,本发明的方法优选以定量的方式执行,这种方式还提供了对样品中存在的癌症标志物蛋白的量的测量。样品中存在的标志物蛋白的量可以使用上面描述的技术中的任一种来计算。在这种情况下,在进行分析之前,有必要通过测量使用检测反应获得的信号来绘制标准曲线,前述检测反应与用于分析含有已知浓度癌症标志物蛋白的一系列标准样品的检测反应是相同的。然后,根据标准曲线能够推测出接受筛选的样品中存在的癌症标志物的量。
通常,相比于来自健康患者的对照样品,测试样品中一种或多种生物标志物的增加表明存在慢性胰腺炎和/或pdac。每种生物标志物的阈值浓度(thresholdconcentration)因患者或人群的不同而不同。未经处理(“未经加工”或“粗”)尿样品的指示蛋白浓度显示如下:
例如,如果样品含有2至10ng/mllyve1、120至500ng/mlreg1a、40至100ng/mlreg1b和/或2.5至5ng/mltff1,那么会怀疑患有慢性胰腺炎。然而,这些范围是指示性的,本领域技术人员将理解,每种蛋白质的浓度需要在具体环境中被考虑,例如,取决于样品来源和可能对样品进行的预处理。在相关浓度阈值内的生物标志物越多,患者是健康的、患cp或患pdac的可能性就越大。
例如,如果未经处理的尿样品满足下述标准的至少一项(可选地,下述标准的至少2、3或4项),则怀疑患有慢性胰腺炎:
a)2至10ng/mllyve1
b)120至500ng/mlreg1a
c)40至100ng/mlreg1b和/或
d)2.5至5ng/mltff1
如果未经处理的尿样品满足下述标准的至少一项(可选地,下述标准的至少2、3或4项),则怀疑患有pdac:
a)大于10ng/mllyve1
b)大于500ng/mlreg1a
c)大于100ng/mlreg1b和/或
d)大于5ng/mltff1
当然,通过活检来检测pdac的存在和/或使用其它生物标志物(诸如ca19.9)能够进一步印证使用本发明的生物标志物组的诊断方法。
在本发明的一种具体实施方式中,方法包括检测尿样品中从lyve1、reg1和tff1或者其组合构成的组中选出的蛋白质的表达水平或浓度。在本发明的一些具体实施方式中,方法可包括对尿样品中的lyve1、reg1和tff1之一的表达水平或浓度进行定量。在本发明的其它具体实施方式中,方法可包括对lyve1、reg1和tff1的任两个(例如,lyve1和reg1(reg1a和/或reg1b)、lyve1和tff1或者reg1(reg1a和/或reg1b)和tff1)的表达水平或浓度进行定量。在本发明的一些具体实施方式中,方法可包括检测lyve1、reg1(reg1a和/或reg1b)和tff1的表达水平。在本发明的一些具体实施方式中,ca19.9也可被量化。
胰腺癌的类型
本发明在诊断pdac方面是有用的。pdac可以是早期阶段的pdac,例如,阶段i或阶段iipdac,或者,pdac可以是晚期阶段的pdac,例如,阶段iii或阶段ivpdac。然而,本发明在检测早期阶段的pdac方面,特别是阶段i至阶段iiapdac,是特别有用的。
在本发明的一种具体实施方式中,提供了一种诊断或检测阶段i或阶段iipdac的方法,包括检测尿样品中lyve1、reg1(reg1a和/或reg1b)和/或tff1的表达水平或浓度,和将每个检测的表达水平与一种或多种参照进行比较。该方法尤其可测定阶段i和/或阶段iipdac的存在并将这些与健康样品、患cp的患者和患ipmn的患者进行区分。
根据美国癌症联合委员会(ajcc)肿瘤淋巴结转移(tnm)分期系统对pdac分类。t得分描述主要的(原发性)肿瘤的尺寸以及它是否已经生长到胰腺外并进入邻近器官。n得分描述邻近的(区域)淋巴结受累情况。m得分表示癌症是否已经转移(扩散)至身体的其它器官。
tx、t0、tis:参见tnm系统
t1:肿瘤的最大尺寸<2cm,限于胰腺
t2:肿瘤的最大尺寸>2cm,限于胰腺
t3:延伸出胰腺,不涉及sma或腹腔干
t4:涉及sma或腹腔干
局部淋巴结(n)
nx:无法评估淋巴结
n0:没有淋巴结受累的证据
n1:存在区域淋巴结转移
转移(m)
mx:无法评估是否存在转移
m0:没有转移的证据
m1:存在远处转移
阶段ipdac是最早期的阶段,在该阶段,癌症局限在胰腺,淋巴结无癌症。在阶段ii,癌症是局部侵袭性的。这两个阶段的癌症仍是可切除的;目前,在阶段i/ii可诊断出的胰腺的癌症不足1/5(<20%)。本文中阶段iipdac的参考包括阶段iia和iib。在阶段iii,癌症扩散至胰腺外,并在大血管中,所以是不可切除的。阶段iv癌症已经转移至远端(并且不再是外科手术可治疗的)。本文中检测或诊断pdac的参考通常指的是检测或诊断每个阶段的pdac,尤其是阶段i或阶段iipdac。考虑到在该阶段癌症仍然是通过切除术可治疗的并且存活率被极大提高,因此这样的方法是特别有用的。
根据tnm得分,阶段分组是:
-阶段0:tisn0m0
-阶段ia:t1n0m0
-阶段ib:t2n0m0
-阶段iia:t3n0m0
-阶段iib:t1、t2或t3,和n1m0
-阶段iii:t4和m0(任何n)
-阶段iv:m1(任何t任何n)
生物样品
虽然尿样品是特别有用的,但是生物样品可以是尿样品、全血样品、血清样品或活组织标本(诸如胰腺组织样品)。方法可以包括获得或提供生物样品的步骤,或者可选地,样品可以采用离体法事先从患者获得。
将从患者获得的生物样品储存至需要时。合适的储存方法包括采集后两小时之内冷冻。-80℃保持能够用于长期储存。
在测定基因/蛋白质的表达水平之前可以先对样品进行加工。可以对样品进行富集(例如,提高待量化的生物标志物的浓度)、离心或稀释。在其它具体实施方式中,样品不经过任何预处理,不经加工直接使用。
在本发明的一些具体实施方式中,在检测和定量化(即测量)之前先对生物样品进行蛋白质生物标志物的富集。富集步骤可以是提高样品中蛋白质浓度的任何合适的预处理方法步骤。例如,富集步骤可以包括离心和/或过滤以便从样品中去除细胞或不需要的分析物。
本发明的方法可以在从患者获得的一个测试样品上进行。可选地,可以从患者得到多个测试样品,例如,2、3、4或5个样品。可以对每个样品进行单项测定以对生物标志物组成员之一进行量化,或者可选地,可以对样品测试所有待量化的生物标志物。
本发明的方法和用途
本发明提供了一组生物标志物,用于检测pdac,且特别是对早期阶段pdac与晚期阶段pdac、cp和胰腺炎进行鉴别诊断。
在本发明的一种具体实施方式中,方法包括如下步骤:
a)检测从患者获得的生物样品中令人感兴趣的生物标志物,尤其是蛋白质;和
b)对每个生物标志物的表达水平或浓度进行量化
生物标志物属于本发明的生物标志物组。因此,检测/量化包括对下述生物标志物中的一种或多种进行检测/量化:
1)lyve1
2)reg1(reg1a和/或reg1b)
3)tff1
4)ca19.9
在一种优选的具体实施方式中,本发明包括对从lyve1、reg1和tff1构成的组中选出的至少一种生物标志物与生物标志物ca19.9的组合进行分析。
基因或蛋白质的表达水平能够以许多方法来测定。表达水平可以通过如下方法测定:例如,通过测定样品(诸如尿样品)中蛋白质的浓度来量化生物标志物。可选地,可以测定样品(诸如组织样品)中mrna的量。一旦测定了表达水平或浓度,可以将该水平与之前测量的(在不同时间点从相同受试者获得的样品,或者,从不同受试者例如健康受试者获得的样品,即对照或参照样品)表达水平或浓度进行比较以便确定表达水平或蛋白质浓度在被分析的样品中是较高的还是较低的。
在本发明中,相比于健康患者,lyve1、reg1和/或tff1之一或全部的表达(和蛋白质浓度)的增加表示了pdac或cp。该生物标志物组在正确诊断早期阶段pdac方面是特别有用的。通过一起使用所有组成员也能够使假阴性和假阳性最小化。ca19.9也可以包括在生物标志物组中以便进一步减少假阳性或假阴性的发生率。
检测蛋白质表达水平的方法包括本领域已知的任何方法。例如,使用dna或mrna分析能够间接测量蛋白质水平。可选地,通过测量蛋白质合成的水平或测量蛋白质浓度能够直接测量蛋白质水平。
dna和mrna阵列(微阵列)包括一系列dna或rna寡核苷酸微点(microscopicspot),每个dna或rna寡核苷酸具有能够结合互补核酸分子的独特的核苷酸序列。以这种方式,寡核苷酸用作只有正确的靶序列在高度严格的条件下会与之杂交的探针。在本发明中,靶序列是编码dna序列或其独特片段,对应于表达待检测的蛋白质,或者,靶序列是转录的mrna序列或其独特片段,对应于表达待检测的蛋白质。
可以采用本领域已知的众多方法中的任意一种来直接测量蛋白质表达并鉴定给定样品中表达的蛋白质。例如,双向聚丙烯酰胺凝胶电泳(2d-page)已经成为分解复杂的蛋白质混合物和检测正常组织与患病组织在蛋白质表达模式上的不同的传统首选工具。在正常样品和肿瘤样品之间观察到的差异表达的蛋白质由2d-page分离并由蛋白质染色和差异模型分析(differentialpatternanalysis)来检测。可选地,双向差异凝胶电泳(2d-dige)能够被使用,其中在2d电泳之前不同的蛋白质样品用荧光染料进行标记。在进行电泳之后,用每种染料的激发波长一个接一个地对凝胶扫描。这种技术在检测蛋白质丰度差异方面是特别有用的,例如,在比较来自健康受试者的样品与来自患病受试者的样品时。
通常,进行电泳的蛋白质还会进一步由质谱法来表征。这样的质谱法包括基质辅助激光解吸/电离飞行时间(matrix-assistedlaserdesorption/ionisationtime-of-flight,maldi-tof)。
maldi-tof是一种允许进行生物分子(诸如蛋白质、肽和糖)分析的电离技术,前述生物分子在采用较常规的电离方法电离时往往是脆弱的并且易成为碎片。采用激光束(例如氮激光器)引发电离作用,使用基质保护生物分子免于因直接暴露于激光束而被破坏并有利于气化和电离。将样品在溶液中与基质分子混合,小量混合物沉积在表面并使其干燥。当溶剂蒸发时样品与基质共结晶(co-crystallise)。
蛋白质微阵列也能够用于直接检测蛋白质表达。这些类似于dna和mrna微阵列,因为它们包括固定于固体表面的捕捉分子(capturemolecule)。最常见地,捕捉分子是对待检测的蛋白质具有特异性的抗体,虽然在检测血清中的抗体时可以使用抗原。其它的捕捉分子包括蛋白质、适体(aptamer)、核酸、受体和酶,如果商购抗体不可用于待检测蛋白质,那么前述其它的捕捉分子是优选的。用于蛋白质阵列的捕捉分子可以是外部合成、纯化并附着于阵列。可选地,它们可以原位合成并直接附着于阵列。可以通过生物合成、无细胞dna表达或化学合成来合成捕捉分子。原位合成对于后两者是可能的。因此,提供了包括捕捉分子(诸如抗体)的蛋白质微阵列,所述捕捉分子对于固定在固体支持物上的待量化的每种生物标志物是具有特异性的。在本发明的一种具体实施方式中,微阵列包括对lyve1、reg1(reg1a和/或reg1b)和tff1蛋白质的每一种都有特异性的捕捉分子。
一旦在微阵列上被捕捉到,检测方法可以是本领域已知的任何方法。例如,可以采用荧光检测。它是安全的、灵敏的,并且能够具有高分辨率。其它检测方法包括其它的光学方法(例如,比色分析、化学发光法、无标签的表面等离子体共振分析、显微术、反射率,等等)、质谱分析法、电化学方法(例如,伏安法和安培法)和射频法(例如,多级共振谱)。
测定蛋白质浓度的其它方法包括质谱分析法和/或液相色谱法,诸如lc-ms、uplc或串联uplc-ms/ms系统。
一旦已经测定了表达水平或浓度水平,可以将该水平与之前测定的表达水平或浓度水平(在不同时间点从相同受试者获得的样品,或者,从不同受试者例如健康受试者获得的样品,即对照或参照样品)进行比较以便确定表达水平或浓度水平在被分析的样品中是较高的还是较低的。本发明的方法可进一步包括将所述检测或量化与对照或参照相互关联以确定是否存在pdac的步骤。所述相互关联步骤也可以检测特定类型pdac的存在,并且将这些患者与不存在pdac或胰腺癌的健康患者进行区分,或者将这些患者与患cp或胰腺导管内乳头状黏液肿瘤(ipmn)的患者进行区分。例如,该方法可检测早期阶段pdac,尤其是阶段i和/或阶段iipdac。所述相互关联步骤可包括将生物标志物组中的一个、两个、三个、四个或更多个的量与参照样品中对应生物标志物的量进行比较,参照样品例如是取自健康患者的生物样品。通常,该方法不包括测定参照样品中对应生物标志物的量的步骤,相反,此类值已被预先测定。然而,在一些具体实施方式中,本发明的方法可包括对用作对照的健康患者实施该方法的步骤。可选地,该方法可使用在之前时间点从相同患者样品获得的参照数据。以这种方式,任何处理的效果可被评估,患者的预后可被确定。
也可使用内部对照,例如,对不属于该生物标志物组的一种或多种不同生物标志物进行定量。这可以提供关于样品中生物标志物的相对量的有用信息,使结果对不同人群的任何差异进行调整或者对样品采集、加工或储存的方法所引入的变化进行调整。
对本领域技术人员而言明显的是,对分析物浓度或表达的任何测量都需要被标准化以便将所使用的测试样品的类型和/或进行分析之前对测试样品已经进行的处理考虑在内。数据标准化也有助于识别生物学相关结果。不变的生物标志物可被用来确定合适的样品处理。也可在不同的样品之间进行差异表达计算以确定统计显著性。
通常,本发明的方法可包括如下步骤:
a)提供生物样品,诸如尿样品;
b)任选地处理样品,以浓缩样品用于mirna分析;和
c)对生物标志物进行量化。
该方法可以进一步包括如下步骤:
d)将步骤d)蛋白质表达水平与对照或参照样品进行比较。
在本发明的一些具体实施方式中,量化步骤可包括如下步骤:
a)使样品接触特异性结合至感兴趣的生物标志物的结合伴侣(bindingpartner)
b)对生物标志物-结合伴侣的量进行量化以测定原样品中存在的生物标志物的量。
因此,本发明提供了一种反应混合物,包括感兴趣的蛋白质生物标志物,或者含有感兴趣的蛋白质生物标志物的生物样品(诸如尿样品),其中,感兴趣的蛋白质生物标志物结合至各自的结合伴侣,结合伴侣对蛋白质生物标志物具有特异性。结合伴侣可以是,例如,特异性结合至感兴趣的蛋白质生物标志物的抗体。在一种具体实施方式中,反应混合物包括结合至各自的选择性结合分子诸如抗体的lyve1、reg1和tff1蛋白质。选择性结合分子是外源性的。
在本发明的一些具体实施方式中,该方法包括将测量的生物标志物与pdac特别是阶段i或阶段iipdac相互关联。因此,本发明提供了一种用于限定患者胰腺疾病或确定是否存在胰腺疾病的方法,该方法包括测量生物样品(诸如尿样品)中一种或多种相关生物标志物的丰度(abundance)并将测量的生物标志物与疾病阶段相关联。疾病阶段可能是慢性胰腺炎、阶段ipdac或晚期阶段的pdac。可选地,也可能确定患者是健康的,即不存在胰腺疾病。
正如上面注意到的,本发明的方法能够使用对待检测的一种或多种蛋白质具有特异性的外源性结合分子或试剂来实施。“外源性的”(exogenous)是指如下事实:结合分子或试剂已被加入至进行分析的样品中。结合分子或试剂是具有如下性质的那些分子:它们对待检测的一种或多种蛋白质具有亲和力,这样,它们能够形成使用本领域已知的任何方法都能检测的结合分子/试剂-蛋白质复合物。本发明的结合分子可以是抗体、抗体片段、蛋白质或者适体或分子印迹聚合物结构(molecularlyimprintedpolymericstructure)。本发明的方法可包括使生物样品与合适的一种或多种结合分子接触。所述结合分子可形成本发明试剂盒的部分,特别地,它们可形成本发明生物传感器的部分。
抗体可包括单克隆抗体和多克隆抗体,并且能够采用本领域已知的任何方法来生产。用于生产结合至特定蛋白质的单克隆抗体和多克隆抗体的技术如今在本领域已得到良好发展。标准的免疫学教科书,例如“roittetal.,immunology,secondedition(1989),churchilllivingstone,london”,对这些技术进行了讨论。当将抗原注入动物时,通过在合适的动物宿主(例如,小鼠、大鼠、豚鼠、兔、绵羊、鸡、山羊或猴)中刺激多克隆抗体的产生能够增加多克隆抗体。如果必要,佐剂可与抗原一同施用。然后,通过抗体结合至抗原或如下进一步描述可纯化抗体。单克隆抗体可由杂交瘤来生产。这些能够通过融合骨髓瘤细胞和b-淋巴细胞来形成,这些细胞产生所需的抗体以便形成永生细胞系。这是著名的科勒&米尔斯坦技术(kohler&milsteintechnique)(kohler&milstein(1975)nature,256:52-55)。抗体可以是人的或人源化的,或者可以来自其它物种。
在制备合适的抗体之后,采用几种常用技术(例如,如“harlow&laneeds.,antibodies:alaboratorymanual(1988)coldspringharborlaboratorypress”中所描述的)之一来对其进行分离或纯化。通常,合适的技术包括肽或蛋白质亲和柱,高效液相色谱(hplc)或反相hplc(rp-hplc),蛋白质a或蛋白质g柱纯化,或者这些技术的组合。重组和嵌合抗体可按照标准方法来制备,并使用包括elisa、abc、斑点印迹分析(dot-blotassay)在内的常用方法来分析其特异性。
本发明包括能够结合至抗原的抗体衍生物。因此,本发明包括抗体片段和合成结构。“dougalletal.(1994)trendsbiotechnol,12:372-379”给出了抗体片段和合成结构的实例。
抗体片段或衍生物,诸如fab、f(ab')2或fv,可被使用,还可使用单链抗体(scab),如“hustonetal.(993)intrevimmunol,10:195-217”所描述,域抗体(dabs),例如单域抗体或抗体样单域抗原-结合受体。除抗体片段和免疫球蛋白样分子之外,也可以设计模拟肽(peptidomimetics)或非肽模拟物(non-peptidemimetics)以模拟抗体的结合活性。可对fv片段进行修饰以产生称作单链fv(scfv)分子的合成构建体(syntheticconstruct)。这包括将vh和vl区域共价结合的肽连接子,vh和vl区域有助于分子的稳定性。因此,本发明还延伸至单链抗体或scabs。
其它的合成构建体包括cdr肽。这些是包括抗原结合决定基(antigenbindingdeterminant)的合成多肽。这些分子在构象上通常是限制的有机环,所述有机环模拟cdr环的结构并包括抗原-交互式侧链。合成构建体还包括嵌合分子。因此,例如,人源化的(或猿源化的)抗体或其衍生物在本发明的范围内。人源化抗体的一个实例是具有除啮齿动物高变区之外的人框架区的抗体。合成构建体还包括了包含共价连接部分的分子,所述共价连接部分向分子提供了除抗原结合性质之外的一些其它有用的性质。例如,所述部分可以是标记(label)(例如可检测标记,诸如荧光标记或反射性标记)或者药学上的活性剂。
在本发明的结合分子是抗体或抗体片段的那些具体实施方式中,本发明的方法可以使用本领域已知的任何免疫学技术来执行。例如,可以使用elisa、放射免疫分析法或类似的技术。通常,将合适的自身抗体固定在固体表面,并使待检测样品与自身抗体接触。如果自身抗体识别的癌症标志物蛋白质存在于样品中,则形成抗体-标志物复合物。然后,可以使用特异性识别标志物蛋白质表位的标记的第二抗体来指导或定量测量该复合物。第二抗体可以使用生化标志物诸如辣根过氧化物酶(hrp)或碱性磷酸酶(ap)来标记,复合物的检测可以通过添加产生比色产物、化学发光产物或荧光产物的酶的底物来实现。可选地,通过加入可检测标记所标记的标志物蛋白质例如合适的酶可以测定复合物的存在。在这种情况下,测量的酶活性的量与形成的复合物的量成反比,需要阴性对照作为确定样品中抗原存在的参照。检测复合物的另一种方法可使用已由放射性同位素标记的抗体或抗原,随后测量放射性。用于抗原的放射性标记的实例包括3h、4c和125i。
适体是结合特异性靶分子的寡核苷酸或肽分子。寡核苷酸适体包括dna适体和rna适体。通过随机序列寡核苷酸或肽的库(pool)的体外选择过程可以创造适体。适体能够与核酸酶任选地结合以便在它们的靶分子存在的情况下进行自我切割。可以采用本领域已知的任何方法来制备适体。例如,可鉴别适体的方法是利用指数富集(selex)的配体(ligand)的系统进化。这涉及通过如下方法重复降低分子文库的复杂性:基于选择性结合至靶分子进行划分,随后再扩增。在将未结合的成员与结合的成员进行划分之前,先用靶蛋白质孵育潜在的适体文库。结合的成员被回收并扩增(例如,采用聚合酶链式反应)以便产生复杂性降低的文库(富集的库)。富集的库用来引发第二个循环的selex。周而复始地监控后续的富集库向靶蛋白质的结合。一旦判断出结合分子的比例已经增至足够水平,对富集库进行克隆。然后,分别分析结合分子。“fitzwater&polisky(1996)methodsenzymol,267:275-301”评论了selex。
因此,在本发明的一种具体实施方式中,提供了一种诊断pdac或cp的方法,包括:使来自患者的生物样品(诸如尿样品)与对待量化生物标志物蛋白质具有特异性的试剂或结合分子进行接触,测量蛋白质-试剂或蛋白质-结合分子复合物的丰度,并将蛋白质-试剂或蛋白质-结合分子复合物的丰度与生物样品中相关蛋白质的浓度相互关联。例如,在本发明的一种具体实施方式中,该方法包括如下步骤:
a)使生物样品(诸如尿样品)与对lyve1、reg1(reg1a和/或reg1b)和tff1的一种或多种具有特异性的试剂或结合分子进行接触;
b)对蛋白质-试剂或lyve1、reg1(reg1a和/或reg1b)和tff1的一种或多种的蛋白质-结合分子复合物的丰度进行量化;和
c)将蛋白质-试剂或蛋白质-结合分子复合物的丰度与生物样品中蛋白质lyve1、reg1(reg1a和/或reg1b)和tff1的一种或多种的浓度相互关联。
该方法进一步包括如下步骤:d)将步骤c)中蛋白质的浓度与参照进行比较以确定是否存在pdac或cp。然后,可以对患者进行相应治疗。在本发明的一些具体实施方式中,该方法包括使生物样品与对lyve1、reg1(reg1a和/或reg1b)和tff1的一种、两种或三种具有特异性的试剂或结合分子进行接触,并且在一些具体实施方式中,结合分子对该生物标志物组中的所有生物标志物具有特异性。在其它具体实施方式中,通过使生物样品还与对ca19.9具有特异性的试剂或结合分子进行接触,可将ca19.9包括在内。合适的试剂或结合分子可包括抗体或抗体片段、酶、核酸、细胞器、细胞、生物组织、印迹分子或小分子。此类方法可以使用本发明的试剂盒或生物传感器来实施。
本发明还提供了诊断胰腺导管腺癌的方法,包括检测生物样品尤其是尿样品中从lyve1、reg1(reg1a和/或reg1b)和tff1或者其组合构成的组中选出的蛋白质的表达水平或浓度。在本发明的一种具体实施方式中,该方法可包括检测生物样品尤其是尿样品中从lyve1、reg1(reg1a和/或reg1b)和tff1构成的组中选出的两种蛋白质的表达水平。在本发明的一些具体实施方式中,该方法可包括检测生物样品尤其是尿样品中lyve1、tff1以及reg1a和reg1b之一或它们两者的表达水平。因为本发明的生物标志物组还能够检测慢性胰腺炎,所以本发明也提供了诊断cp的类似方法。
与来自健康对照受试者的样品中对应基因或蛋白质的表达水平或蛋白质浓度相比,检测到基因表达或蛋白质浓度得到提高,可确定存在胰腺导管腺癌。此外,表达水平或浓度水平能够用于区分pdac和cp。这可通过如下方法实现:将测试样品中发现的表达水平或浓度水平与存在cp的患者中(或参照)可见的水平进行比较。此外,生物标志物能够用于区分pdac和胰腺导管内乳头状黏液肿瘤(ipmn)。这可通过如下方法实现:将测试样品中发现的表达水平或浓度水平与存在ipmn的患者中(或参照)可见的水平进行比较。
在本发明另一具体实施方式中,提供了从lyve1、reg1(reg1a和/或reg1b)和tff1或者其组合构成的组中选出的蛋白质在诊断胰腺导管腺癌(pdac)或cp中的用途。在本发明的一种具体实施方式中,提供了lyve1、reg1和tff1中的两者的组合在诊断pdac或cp中的用途(例如,lyve1和reg1(reg1a和/或reg1b)、lyve1和tff1或者reg1(reg1a和/或reg1b)和tff1)。在本发明另一具体实施方式中,提供了lyve1、reg1(reg1a和/或reg1b)和tff1中的三者的组合在诊断pdac或cp中的用途。还提供了lyve1、reg1a、reg1b和tff1这四者的组合在诊断pdac或cp中的用途。在本发明的一些具体实施方式中,这些生物标志物组还可以再与ca19.9结合。
在本发明的另一具体实施方式中,提供了治疗或预防患者pdac的方法,包括:将从患者获得的生物样品(尤其是尿样品)中选自lyve1、reg1(reg1a和/或reg1b)和tff1构成的组的一种或多种生物标志物量化,将数值与每种量化的生物标志物的参考进行比较,和,如果检测值大于参考(或者如果诊断或怀疑患pdac)则对pdac实施治疗。治疗pdac的方法可包括切除胰腺肿瘤和/或向患者实施化学疗法和/或放射疗法。通过测定基因表达水平(例如测定mrna浓度)或通过测定蛋白质浓度,可以量化生物标志物。在一些具体实施方式中,lyve1、reg1(reg1a和/或reg1b)和tff1的每一种被量化。以此类方法也可量化ca19.9。
本发明的治疗pdac的方法对于治疗早期阶段pdac尤其有用。预防pdac的方法对于预防晚期阶段pdac尤其有用。在一些具体实施方式中,对已经认定生物样品中具有特定浓度的生物标志物蛋白质的患者实施治疗方法。所述浓度是指示pdac的浓度。因此,提供了治疗pdac或cp的方法,包括:对采用本发明的方法已经诊断患pdac或cp的患者进行切除任何胰腺肿瘤和/或施用化学疗法和/或放射疗法。
在本发明的另一具体实施方式中,提供了测定患者的治疗pdac或cp的适合性的方法,包括:检测尿样品中从lyve1、reg1(reg1a和/或reg1b)和tff1或者其组合构成的组中选出的蛋白质的表达水平,将表达水平与对照比较,和,如果诊断或怀疑患pdac或cp则确定是否对pdac或cp进行治疗。
在本发明的一些具体实施方式中,方法可进一步包括:如果诊断或怀疑患pdac或cp则治疗患者的pdac或cp。如果基于尿、血液或血清样品检测或怀疑pdac或cp,则可以通过检测胰腺组织的样品中生物标志物的存在和/或量来证实pdac或cp的存在。因此,本发明的方法进一步包括检测或测定胰腺组织样品中生物标志物的量的步骤。胰腺组织样品可以事先已经从患者获得,或者,该方法可包括获得或提供所述胰腺组织样品的步骤。胰腺组织样品的分析也可包括组织学分析。
如有可能,pdac(尤其是阶段i和阶段iipdac)的治疗涉及切除肿瘤。治疗可选地或另外地可涉及采用化学疗法和/或放射疗法的治疗。采用化学疗法的治疗可包括施用吉西他滨(gemcitabine)和/或福瑞诺克司(folfirinox)。福瑞诺克司是氟尿嘧啶(5-fu)、伊立替康、奥沙利铂和亚叶酸(甲酰四氢叶酸)的组合。涉及福瑞诺克司的治疗方案可包括施用奥沙利铂,随后施用亚叶酸,随后施用伊立替康(可选地,伊立替康可与亚叶酸同时施用),随后施用5-fu。
还提供了监控患者对治疗的响应的方法,包括测定生物样品中至少一种感兴趣的生物标志物的表达水平,所述生物样品获取自先前已经接受治疗pdac(例如化学疗法和/或放射疗法)的患者。在一些具体实施方式中,表达水平与从接受治疗之前患者获得的相同的一种或多种生物标志物的表达水平进行比较。然后,基于表达水平的比较,能够决定是继续治疗还是尝试替代的治疗。
因此,在一种具体实施方式中提供了一种方法,包括:
a)测定生物样品中至少一种感兴趣的生物标志物或其组合的表达水平,其中生物样品来自先前已经接受针对胰腺癌或pdac治疗的患者;
b)将步骤a)测定的一种或多种生物标志物与事先测定(即治疗胰腺癌或pdac之前测定的)的相同的一种或多种生物标志物的表达水平进行比较;和
c)保持、改变或取消对胰腺癌或pdac的治疗。
该方法可包括如下的在前步骤(priorstep):向患者施用治疗胰腺癌或pdac的疗法。在另一种具体实施方式中,该方法还可包括如下的预步骤(pre-step):对施用疗法之前从相同患者获得的生物样品中至少一种感兴趣的生物标志物或其组合的表达水平进行测定。在步骤c)中,如果测定了一种或多种生物标志物的表达水平的合适调整,那么可以保持用于胰腺癌或pdac的疗法。例如,如果在胰腺癌或pdac中发现的被上调的一种或多种生物标志物的表达存在降低,那么可保持治疗。如果表达水平已经充分改变,例如回到被认为是健康的水平或低风险水平,那么可以取消对胰腺癌或pdac的治疗。如果表达水平没有变化或已恶化(例如,在胰腺癌或pdac中发现的被上调的一种或多种生物标志物的表达存在增加),这可表示患者病情恶化,因此应尝试治疗胰腺癌或pdac的替代疗法。这样,在治疗胰腺癌或pdac(尤其是早期阶段pdac)中有用的候选药物可被筛选。
在本发明的另一种具体实施方式中,提供了识别用于治疗pdac的药物的方法,包括:
(a)对从患者获得的生物样品中选自lyve1、reg1和tff1构成的组的一种或多种蛋白质的表达或浓度进行量化;
(b)向患者施用候选药物;
(c)在施用候选药物之后的某个时间点,对从相同患者获得的生物样品中选自lyve1、reg1和tff1构成的组的一种或多种蛋白质的表达或浓度进行量化;和
(d)将步骤(a)测定的值与步骤(c)测定的值进行比较,其中,一种或多种蛋白质表达水平或浓度水平在两样品之间的减小认定为候选药物是pdac的可能的治疗方法。在一些具体实施方式中,该方法使用该生物标志物组的所有生物标志物蛋白质,即lyve1、reg1和tff1在步骤(a)和步骤(c)中必须都被量化。在一些具体实施方式中,生物样品是尿样品。在一些具体实施方式中,药物是化合物、抗体或抗体片段。
试剂盒和生物传感器
在本发明另一具体实施方式中,提供了用于检测胰腺导管腺癌的成套试剂盒,包括用于量化lyve1、reg1(reg1a和/或reg1b)或tff1或者其组合的表达或浓度的工具(means)。该工具可以是任何合适的检测工具。
例如,该工具可以是生物传感器。在一些具体实施方式中,该工具可以包括涂有膜的试纸(dipstick),前述膜结合至对第一区段(section)上待检测蛋白质具有特异性亲和力的未标记结合分子(诸如抗体或抗体片段)。该膜还具有由非反应性蛋白质阻隔的区段以便阻止任何分子结合至膜的那部分。该膜还可具有如下区段:样品中待检测的蛋白质结合至该区段。通过使试纸的不同区段用于检测本发明的不同蛋白质将试纸配置为在单一分析中检测不止一种蛋白质,这样,待检测的每种其它蛋白质具有能够特异性结合该其它蛋白质(其结合在试纸的一区段上)的相应抗体,并且任选地,该待检测的其它蛋白质结合在试纸的另一区段。试剂盒还可包括容器,该容器用于容纳一种或多种样品和/或用于从生物样品提取生物标志物的溶剂。试剂盒还可包括使用说明。
在本发明的一些具体实施方式中,提供了用于诊断胰腺导管腺癌或cp的成套试剂盒,包括用于检测lyve1、reg1和tff1中至少两者的表达或浓度的工具。在本发明的其它具体实施方式中,提供了用于诊断胰腺导管腺癌或cp的成套试剂盒,包括用于检测lyve1、reg1和tff1这三者的表达或浓度的工具。检测生物标志物的工具可以是特异性结合至待量化的生物标志物或与待量化的生物标志物发生特异性反应的试剂。
本发明的成套试剂盒可以是生物传感器。生物传感器包含生物传感元件(element)并提供关于生物样品的信息,例如,分析物的存在(与否)或分析物的浓度。特别地,它们将生物识别组件(component)(生物接受器)与生化检测器结合,用于检测和/或量化分析物(诸如蛋白质)。
生物接受器特异性地与感兴趣的分析物相互作用或者结合至感兴趣的分析物,并且生物接受器可以是,例如,抗体或抗体片段、酶、核酸、细胞器、细胞、生物组织、印迹分子或小分子。生物接受器可以固定于支持物,例如,金属、玻璃或聚合物支持物、或者三维晶格支持物诸如水凝胶支持物。
生物传感器通常根据存在的生物换能器(biotransducer)的类型来分类。例如,生物传感器可以是电化学的(诸如电位的)、电子的、压电的、重量的、热电的生物传感器或者离子通道开关生物传感器。换能器将感兴趣的分析物与生物接受器之间的相互作用转变为量化信号,这样,存在的分析物的量能够被精确测量。光学生物传感器可依赖于由生物接受器与感兴趣的分析物之间相互作用引起的表面等离子体共振。因此,spr可用来量化测试样品中分析物的量。其它类型的生物传感器包括倏逝波生物传感器、纳米生物传感器和生物的生物传感器(例如,酶的、核酸(诸如dna)的、抗体的、后生的、细胞器的、细胞的、组织的或微生物的生物传感器)。
试纸是生物传感器的另一实例。本发明的试纸可包括膜。试纸可进一步包括:第一区段,该区段结合了未标记的抗体,该抗体对表达有待检测的蛋白质具有特异亲和力;第二区段,由非反应性蛋白质阻断;和第三区段,表达有待检测的蛋白质结合至该区段。
本领域已知的试纸技术能够用于快速且有效地实施本发明的方法。试纸技术包括如下。将标记的抗体溶解于样品的测试液体中,其中前述的标记的抗体例如是由甲瓒(formazan)来标记,该标记的抗体对待检测的蛋白质(抗原)具有特异性的亲和力。将其上安装有硝酸纤维素膜的试纸浸入反应混合物中。膜具有一个区段,对前述抗原具有特异性亲和力的非标记抗体结合在该区段上。第二区段无抗体并且被非反应性蛋白质阻断以阻止标记的抗体结合至膜。试纸的第三区段用于结合抗原。反应发生在测试液体中的游离抗原与结合至膜的非标记抗体之间以及游离抗原和加至样品的标记抗体之间。这在膜的第一区段上产生了非标记结合抗体/抗原/标记抗体的三明治结构。反应还发生在标记的抗体与在第三区段结合的抗原之间。膜的第二区段没有反应发生。
使反应进行一段固定的时间或直至目测反应完成。由于甲瓒是高度着色染料,发生反应的甲瓒-标记的抗体将颜色给予第三区段,如果抗原存在于测试液体中,那么发生反应的甲瓒-标记的抗体也会将颜色给予第一区段。因为第二区段上没有反应发生,所以第二区段不会有颜色。因此,第二区段充当阴性对照。在整个膜都着色的情况下,包括由于吸收了未发生反应的甲瓒颗粒和小部分未发生反应的甲瓒-标记的抗体而使第二区段着色的情况,膜的第一区段和第二区段之间颜色的不同表明存在抗原。第三区段通过显示实际上发生了适当的反应而充当阳性对照。
试纸浸在混合物中的时间长度是在存在抗原的情况下使膜的第一和第二区段之间形成颜色强度差别的时间长度。对于大多数抗体-抗原反应,颜色形成基本上在30-60分钟完成。如果需要,试纸颜色形成可通过如下方法来监控:简单移动试纸,目测膜的第一区段的颜色强度,然后,如果需要,再将试纸重新浸入。当不再看到颜色强度进一步改变时,可以认为反应完成。
试纸可以采用本领域已知的任何常规方法来制备。例如,将硝酸纤维素膜安装在试纸的下端。将含有非标记的第一抗体的溶液涂覆在膜的一个区段以使第一抗体结合至膜。含有阻滞剂(例如1%血清白蛋白)的溶液涂覆于膜的另一区段以阻止初级蛋白随后结合至膜。
试纸可通过如下方法被配备成用于同时检测不至一种蛋白质:通过包括其它区段,对待检测的一种或多种其它蛋白质具有特异性亲和力的非标记抗体结合至该区段,任选地,通过包括待检测蛋白质与之结合的一个区段。在这种情况下,对待检测蛋白质具有特异性亲和力的标记抗体可被加至样品以便它们结合至试纸的其它区段,因此能够检测到它们在样品中的存在。抗体可用相同染料或不同染料来标记。除甲瓒之外其它合适的染料包括酸性染料(例如蒽醌或三苯甲烷),偶氮染料(例如甲基橙或分散橙1),荧光染料(例如荧光素或若丹明),或者本领域已知的其它合适染料诸如考马斯亮蓝、氨基黑、甲苯胺蓝、固绿、印度墨汁、硝酸银和乳酸银。此外,明显的是,预标记的初级蛋白反应物不限于抗体,还可包括对样品中待检测的第二蛋白质具有特异性亲和力的任何蛋白质或其它分子。
本发明还提供了蛋白质微阵列(也称作蛋白质芯片),包括对待量化的每种生物标志物具有特异性的捕捉分子(诸如抗体),其中捕捉分子固定在固体支持物上。固体支持物可以是载片(slide)、膜、有孔小珠(bead)或微孔板。载片可以是玻璃载片。膜可以是硝酸纤维素膜。阵列可以是定量多重elisa阵列。微阵列在本发明的方法中是有用的。
特别地,本发明提供了结合分子的组合,其中每个结合分子特异性地结合不同的靶分析物和分析物的组合,结合分子特异性结合至lyve1、reg1或tff1或者它们的组合,和任选地ca19.9。
结合分子可存在于固体基底上,诸如阵列。结合分子可全部存在于同一固体基底上。可选地,结合分子可存在于不同基底上。在本发明的一些具体实施方式中,结合分子存在于溶液中。
这些试剂盒还可包括其它组分,诸如缓冲溶液。其它组分可包括用于检测结合蛋白的探针或标记分子,进行标记的必要试剂(即酶、缓冲液等);结合缓冲液;去除所有未结合的或非特异性结合的mirna的清洗溶液。结合分子结合至靶分析物可在标准条件或实验测定条件下发生。本领域技术人员根据待测量的生物标志物将理解需要何种严格条件。严格条件可包括足以减少非特异性结合的足够高的温度。
使用的蛋白质阵列可使用荧光标记以测定待分析生物标志物的存在和/或浓度,尽管也可使用其它标记(亲和力标签、光化学标签或放射性同位素标签)。也可使用无标记检测,诸如表面等离子体共振(srr)、碳纳米管碳纳米线传感器和微机电(mems)悬臂。近红外荧光检测对于定量检测是特别有用的,特别是使用硝酸纤维素涂覆的玻璃载片。
使用抗体阵列的定量蛋白质分析可包括信号放大、多色检测和竞争替代技术。其它技术包括用于分析蛋白质芯片的扫描电子显微镜(sempc),其涉及通过利用反向散射电子检测来计数与玻璃载片上排列的配体或蛋白质特异性相互作用的靶涂覆的金颗粒。因此,本发明的方法可包括计数生物标志物蛋白质与它们各自的特异性结合分子之间的相互作用以实现对检测样品的定量分析。定量蛋白质检测和分析在例如“barry&solovier,"quantitativeproteinprofilingusingantibodyarrays",proteomics,2004,4(12):3717-3726”中被进一步讨论。
在本发明的一种具体实施方式中,提供了诊断早期阶段胰腺导管腺癌(pdac)的方法,包括:测定尿样品中lyve1、reg1和tff1的每一种的浓度和将如此测定的值与参照进行比较。如果每种蛋白质的浓度大于参照值,那么可能存在早期阶段pdac,且对患者进行相应治疗。
本发明第二部分和后续部分的特征可如本发明第一部分一样进行修正。
参照下面的实施例对本发明作进一步描述,下面的实施例仅是说明目的的,不应被认为是对本发明的限制。
实施例
临床标本
从英国伦敦皇家医院(rlh)获得健康的、cp和pdac尿标本用于发现阶段(n=18),从rlh和伦敦大学学院(稍后共同称为“lon”),利物浦大学(“liv”)外科学系,和西班牙马德里cnio(“spa”)获得健康的、cp和pdac尿标本(共计371份尿)用于验证目的。患其它良性和恶性肝胆疾病的患者的尿样品(n=117)获取自liv。所有样品的收集都得到所涉及的中心的伦理批准,并获得所有捐赠尿样品的个人的同意。所有中心的标本采用相同标准操作方法收集:收集清洁的中段尿,收集2小时内冷冻并储存在-80℃直至使用。重要的是,所有样品来自没有肾脏疾病史的患者;还进行试纸测试分析(bayermultistixsg08935414)以排除可能的高胆红素血症、蛋白尿、细菌污染和血尿症。在外科手术或化学治疗之前收集样品。测量ca19.9的匹配的血浆样品获取自rlh和liv。
尿蛋白质组的凝胶c-ms/ms分析
采用每组6份尿样品(三男三女)(h、cp和pdac;共计18份样品):h男/女,年龄是45、50、60/44、45、54岁;cp男/女,年龄是46、48、51/47、69、74岁;pdac男/女,年龄是44、74、84/71、73、77岁;男性pdac阶段全部是iib/女性两人是ib、一人是iia。如前所述对所有尿样品脱盐并浓缩(weeksmeetal."analysisoftheurineproteomeinpatientswithpancreaticductaladenocarcinoma",proteomicsclinicalapplications2008;2:1047-57)。一式两份,在4-12%微型凝胶(英杰公司(invitrogen))上对各组20μg的每个预处理库的三个样品进行分离;分别分析男性和女性的尿。用胶体考马斯对凝胶染色,用网格将每条样品泳道切割成尺寸相同的40份切片。用胰蛋白酶自动消化凝胶切片,使用连接到ltq轨道离子阱xl串联质谱仪(ltqorbitrapxltandemmassspectrometer)(赛默飞世尔(thermofisher))的纳升级超高效液相色谱(nanoacquity)(沃特斯(waters))通过纳lc/ms/ms(nanolc/ms/ms)分析生成的肽。使用马斯科(mascot)针对人类ipi蛋白质数据库搜索产物离子数据,随后用scaffold软件(蛋白质组学软件)解析数据用于将其校准为非冗余蛋白质列表。使用反向数据库搜索来评估错误发现率,每个样品靶蛋白质fdr<0.5%。使用光谱计数方法获得pdac、cp和健康样品之间相对蛋白质丰度的半定量评估(liuhetal.,"amodelforrandomsamplingandestimationofrelativeproteinabundanceinshotgunproteomics",analyticalchemistry,2004;76:4193-201)。
尿生物标志物和ca19.9测量
采用布拉德福德分析(bradfordassay)(考马斯蛋白质分析试剂,皮尔斯(coomassieproteinassayreagent,pierce))测定尿中总蛋白质浓度。根据制造商说明对人lyve-1(cat#seb049hu,优尔生命科学有限公司(uscnlifescienceinc.))和人tff1(cat#elh-lyve1-001,瑞博奥有限公司(raybiotech,inc.))进行定量测定;人reg1a水平最初在发明人实验室评估,后来由biovendor分析测试服务(biovendor-laboratornimedicinaa.s)进行评估。使用纯化的标准品针对每一待评估蛋白质制备校正曲线。根据制造商说明利用四个参数逻辑回归完成曲线拟合。每一elisa分析的检测极限和变异系数(cv)如下:lyve-1-8.19pg/ml、批内(intra-assay)cv-9%、批间(inter-assay)cv-12%、tff1-0.037ng/ml、批内cv-9%、批间cv-12%.reg1a-0.094ng/ml、批内cv-9%、批间cv20%;reg1b-3.13pg/ml、批内cv-3.9%、批间cv-2.7%。在rlh的临床生化实验室(伦敦,英国)使用罗氏cobas8000系统(罗氏诊断公司,曼海姆,德国(rochediagnostics,mannheim,germany))利用苦味酸法(jaffemethod)测量尿肌酸酐。在rlh的临床生化实验室使用罗氏modulare170仪器按照常规方案测量血浆和尿中ca19.9的水平。
组织微阵列和免疫组织化学(ihc)
之前已描述了用于评价生物标志物表达的组织微阵列和评分方法的细节(ene-obongaetal.,"activatedpancreaticstellatecellssequestercd8+tcellstoreducetheirinfiltrationofthejuxtatumoralcompartmentofpancreaticductaladenocarcinoma",gastroenterology,2013;145:1121-32)。按照标准方案(scc1,1小时培养)使用本纳塔(ventana)发现系统利用抗-reg1a(abeam公司,兔多克隆,ab47099,1:100稀释)、抗-tff1(abeam公司,兔多克隆,ab50806,1:100稀释)和抗-lyve1(acris公司,兔多克隆,dp3500ps,1:100稀释)抗体进行ihc。
统计分析
为了由ms数据鉴别可能的尿生物标志物,使用arraytrack软件(http;edkb.fda.go/webstart/arraytrack)和t-检验对标准化的数据(基于光谱计数/样品之和)进行统计分析。根据p值和任意两样品组之间倍数变化来进一步过滤数据。
随后,使用elisa分析研究选择的蛋白质(lyve1、reg1a和tff1)的浓度,并且,使用非参数克鲁斯卡尔-沃利斯(kruskal-wallis)检验随后使用grafpadprism软件通过邓恩后测试(dunn'sposttest)分析获得的结果。使用皮尔逊相关系数(pearson'scorrelationcoefficient)评估三种生物标志物之间的相关性。
使用roc分析和留出法(hold-outapproach)对每种生物标志物以及该组的区别pdac患者(所有阶段或早期阶段i-ii)和对照样品(健康和cp)的能力进行研究。对于每一比较,随机选择患者和对照数据集中70%的受试者包含到训练数据集。然后应用逻辑回归。在回归分析之前,对所有蛋白质浓度数据进行自然对数转换和中心平均值。在单个生物标志物分析中,使用肌酸酐-正常化数据修正尿稀释因子;对于该组的分析,模型包括这三种生物标志物(在肌酸酐正常化(normalisation)之前),并且根据肌酸酐和年龄调整模型(因为pdac患者的中值年龄高于健康和cp个体,表1),即5-参数模型。将单独的模型应用于训练数据集以进行如下比较:pdac所有阶段相对于健康个体,pdac阶段i-ii相对于健康个体,pdac所有阶段相对于cp,和pdac阶段i-ii相对于cp。针对上述每一回归模型制作roc曲线;获得曲线下面的面积(auc)和区别不同组的“最佳”分割点处的灵敏性(sn)和特异性(sp)。根据下面的公式,最佳分割点对应于这样的点:该点最接近具有最佳sn和sp的roc平面(坐标0,1)中图左上部
min((1-sensitivities)2+(1-specificities)2)
如r'proc'程序包的'ci.threshold'算法所计算(robinxetal.,"proc:anopen-sourcepackageforrands+toanalyseandcompareroccurves",bmcbioinformatics,2011;12:77)。这种方法在评估生物标志物的最佳分割点方面已经显示了良好的性能。
其余受试者(30%)构成独立的数据集,用于模型验证。对于初步分析(所有pdac相对于健康个体),使用单侧检验,49个pdac和28个健康样品给出超过90%的概率检测到1.0的标准偏差(即,至少一个标准差的pdac和健康样品之间的不同)。
采用如下方法进行验证:根据基于训练数据集开发的逻辑回归模型对验证数据集中的每一样品进行分类,并且将该分类与实际诊断进行比较,从而得到新的roc曲线。使用对训练集计算的最佳分割点来得到验证数据集的sn和sp。基于德隆渐进精确法(delong'asymptoticallyexactmethod)得到auc的置信区间(ci,95%)以评价auc的不确定性(delongeretal.,"comparingtheareasundertwoormorecorrelatedreceiveroperatingcharacteristiccurves:anonparametricapproach",biometrics,1988;44:837-45);sn和sp,95%ci利用百分位数法(2,000引导程序重复)采用非参数分层重采样来获得,百分位数法描述于carpenterj&bithellj.,"bootstrapconfidenceintervals:when,which,what?apracticalguideformedicalstatisticians",statmed,2000;19:1141-64。使用针对相关的/成对的auc的德隆单侧检验来比较auc。
对于探索性分析,基于逻辑回归模型使用所有可获得的样品将pdac阶段i-iia相对于健康的样品或cp进行比较获得roc曲线。
使用epi,prochitp://cran.r-project.org/package=epi和rocr(singtetal.,"rocr:visualizingclassifierperformanceinr.",bioinformatics,2005;21:3940-1)软件包的算法在r2.13.0版(统计计算的r基础,http://www.r-project.org/foundation)中执行roc曲线分析。
尿蛋白质组
采用gelc/ms/ms对来自pdac、cp和健康(h)个体(每组6人,三男三女)的18个尿样本进行深入的蛋白质组学分析(图6a)。该分析鉴定了大约1,500(男性尿中1,198种,女性尿中1,061种)种非冗余蛋白质(non-redundantprotein)。这些蛋白质来源于所有的细胞区室(cellularcompartment),并且使用ipa(通路分析软件,http://www.ingenuity.com/)将这些蛋白质映射(map)到很多细胞功能和疾病,证实了就蛋白质的来源和功能作用而言尿提供了丰富来源的多样性蛋白质。
分别对来自男性受试者和女性受试者的尿样品进行ms分析。注意到了相当大的性别-特异性差异:在从健康尿样品中鉴定的997种蛋白质中,398种(40%)是男性的尿所特有的,118种(12%)是女性的尿所特有的,481种(48%)是男女共有的。
在三个实验组(pdac、cp、h)之间存在差异表达的大约200中蛋白质中,有三种蛋白质在男性和女性中都普遍不被控制,即lyve1、reg1a和tff1,选择这三种蛋白质基于如下来进行进一步评估:统计学(p-值、倍数变化),查询胰腺表达数据库(ped)(http://www.pancreasexpression.org/)和关于可能的候选物的先前知识的其它文献,和可利用的商品化的elisa分析。虽然蛋白质组数据中reg1b看似是稍微较好的候选物,但是当时只商购到reg1aelisa分析。然而,当reg1belisa可获得时,对尿样品子集进行了测试并获得了相似结果(参见后面)。免疫印迹检测(westernblotexamination)证实了这三种选择的生物标志物在尿样本中作为全尺寸蛋白质而存在:lyve135kda,reg1a19kda,以及tff19kda(数据未示出)。
生物标志物组用于检测pdac
随后,使用elisa分析在371个尿样品上评估选择的生物标志物,这些尿样品采集自三个中心:英国的伦敦和利物浦,以及西班牙的马德里。参与本研究的患者和健康参与者的人口统计学特征和临床特征显示于表1(下页中)。
表1-健康群组和患者群组的人口统计学特征和临床特征
pdac阶段i-iv相对于健康个体
当与健康样品(n=87)比较时,elisa分析显示了pdac患者(n=192)尿中每一候选生物标志物具有显著较高的尿浓度(全部p<0.0001,图1)。注意到,reg1b和reg1aelisa分析产生了相似结果(图1)。
在pdac中,lyve1、reg1a和tff1彼此正相关,而在健康样品中,只有lyve1与reg1a相关(图7)。使用受试者工作特征(roc)曲线分析来确定lyve1、reg1a和tff1的诊断性能(图2)。首先在训练数据集(样品的70%,分别是n=143和n=59)中评估了它们各自区分pdac阶段i-iv与健康尿样品的性能。单个(肌酸酐-正常化的)尿生物标志物能够区分两组,lyve1、reg1和tff1的auc值分别是0.851(95%ci0.801-0.902)、0.823(95%ci0.766-0.879)、0.686(95%ci0.606-0.765),sn分别是76.9%(95%ci69.3-83.2)、62.2%(95%ci53.8-69.9)、72.7%(95%ci65.0-79.7),sp分别是88.1%(95%ci79.6-96.6)、94.9%(95%ci88.1-100.0)和59.3%(95%ci47.5-71.2)(图2a、2c)。然后,将三种生物标志物结合为组,根据肌酸酐和年龄予以调整(图2b)。图2b和2c显示了训练数据集和验证数据集(样品的30%,pdacn=49,健康个体n=28)中作为roc分析基础的逻辑回归模型的结果。对于auc分别是0.891(95%ci0.847-0.935)和0.921(95%ci0.863-0.978)的训练数据集和验证数据集,该生物标志物组实现了sn>75%且sp>85%,因此显示了比任何单个生物标志物更好的性能。
pdac早期阶段相对于健康个体
接下来,评估了生物标志物在区分早期阶段癌症与健康个体方面的性能。获得了pdac患者中的148名(77%)的肿瘤分期信息。与健康人群(n=87)相比,每种生物标志物的浓度在较晚阶段(阶段iii-iv,n=77,全部p<0.001)、在阶段i-ii(n=71,全部p<0.001)及在阶段i-iia(局部侵袭性疾病,无淋巴结转移,n=16,p<0.05)有显著增加(图3)。lyve1和tff1的浓度在阶段i癌症也较高(分别是p<0.001与p<0.05;数据未显示)。因为只有有限数量的阶段i尿样品可获得(n=7),所以评估了尿标志物对结合的pdac阶段i-ii数据的诊断准确性。首先在新的训练数据集(样品的70%;分别地,pdac阶段i-iin=56且健康个体n=61)评估各个标志物及该标志物组在区分pdac阶段i-ii与健康尿方面的性能。使用该训练数据集建立新的5-参数模型,并用其余数据(样品的30%;pdac阶段i-iin=15,健康个体n=26)对该模型进行验证(图4a、4b)。该标志物组在训练数据集和验证数据集实现了auc分别是0.900(95%ci0.843-0.957)和0.926(95%ci0.843-1.000)(图4c)。因此,尿生物标志物组能够高度精确的区分早期pdac与健康样品。
作为探索性分析,选择来自个体的尿样品(与之匹配的血浆样品是可获得的),所以可获得ca19.9值。由血浆ca19.9(作为分类变量,在临床确定的阈值37u/ml处分隔)、生物标志物组以及生物标志物组与ca19.9的组合导出roc曲线。对于pdac阶段i-ii(n=71)对健康(n=28)样品的比较,ca19.9的auc是0.880(95%ci0.947-0.999),生物标志物组的auc是0.973(95%ci0.947-0.999),这显著大于单独的血浆ca19.9(p=0.005)。将血浆ca19.9加入到生物标志物组将auc显著提高至0.991(95%ci0.979-1.000,p=0.04,图5a/c)。当pdac阶段i-iia(n=16)与健康样品比较时,ca19.9的auc是0.839(95%ci0.719-0.959),生物标志物组的auc是0.971(95%ci0.929-1.000)(p=0.006)。将血浆ca19.9加入到生物标志物组并没有带来任何改善(auc=0.969,95%ci0.924-1.000,p=0.7,图5b/c)。
生物标志物组在区分pdac与cp方面
评估了生物标志物组在区分pdac与cp方面的能力。
pdac阶段i-iv对cp
三种生物标志物在pdac(n=192)样品的尿浓度都高于cp样品(n=92),全部p<0.001,(图1),对于pdac,cp数据中生物标志物浓度彼此正相关(图7)。在训练数据集(pdacn=143,cpn=62)中,lyve1和reg1能够以77-78%的sn和66-69%的sp来区分两组(auc值分别是0.775(95%ci0.704-0.846)和0.722(95%ci0.643-0.801),图8),而tff1的sp仅达到类似sn的50%。在训练数据集和验证数据集进行评价时,将三种生物标志物结合为一组仅对单独的lyve1和reg1的性能有轻微改善,其中训练数据集auc=0.815,95%ci0.752-0.878,验证数据集pdacn=49,cpn=30,auc=0.839,95%ci0.751-0.928。
pdac早期阶段对cp
相比于cp(n=87),生物标志物尿浓度在阶段i-iipdac(n=71)显著提高,每种生物标志物p<0.001(数据未示出)。生物标志物组在训练数据集(pdac阶段i-iin=56,cpn=66)和验证数据集(pdac阶段i-iin=15,cpn=26)都实现高sn(>85%),但是sp相对低(66.7%和50%),与从单个生物标志物观察到的sp类似,auc分别是0.831(95%ci0.762-0.901)和0.846(95%ci0.730-0.963,图8d-f)。
如以前,将生物标志物组与血浆ca19.9相结合进行探究。对于pdac阶段i-ii(n=71)对cp(n=50)样品的比较,roc曲线显示ca19.9的auc是0.775(95%ci0.699-0.852),生物标志物组的auc是0.830(95%ci0.759-0.902)(p=0.1),生物标志物组与ca19.9的组合的auc是0.885(95%ci0.825-0.945)(优于单独的生物标志物组,p=0.01)(图9a/c)。在将pdac阶段i-iia(n=16)与cp进行比较时,roc曲线显示ca19.9的auc是0.735(95%ci0.609-0.861),生物标志物组的auc是0.871(95%ci0.770-0.972)(优于血浆ca19.9,p=0.004),组合的auc是0.866(95%ci0.749-0.984)(p=0.6)(图9b/c)。因此,生物标志物组在区分阶段i-iia与cp方面优于ca19.9。
其它肝胆疾病的尿中生物标志物的表达
最后,对从患若干其它良性或恶性肝胆疾病的患者采集的尿样本中生物标志物的表达进行了探究,并将其与早期阶段pdac患者中的表达进行比较(图10)。pdac阶段i-ii样品中lyve1的尿水平高于ipmn、amp和胰腺net样本;相比于ipmn,仅reg1a水平在早期阶段pdac显著较高。相比于胰腺net和duca样品,血浆ca19.9水平在pdac阶段i-ii显著较高。这有可能表明lyve1和reg1a在将其它良性或恶性肝胆疾病与早期阶段pdac进行区分方面的潜在能力。
三种生物标志物的组织来源
在证实了生物标志物组在区分早期癌症患者与健康个体方面的良好性能之后,接下来是尝试确定生物标志物在胰腺组织的表达。使用内部构建的pdac组织微阵列进行免疫组织化学(ihc)。在组织学正常的邻近腺泡细胞中发现了reg1a的强表达,但是在44/60肿瘤(73%)中也发现了染色(图11a)。正常胰腺中缺少tff1,但是tff1在43/60(72%)的pdac中表达(图11b)。虽然在任何癌细胞中都没有发现lyve1表达,但是在八个pdac组织中发现缺少淋巴管(图11c)。接下来,对来自七名pdac患者的尿中的三种生物标志物水平都进行测量,其中样品是在手术之前和之后从这些患者采集的(图11d)。在所有患者中,lyve1和reg1a的水平在手术之后下降,对于tff1,在七名患者中的六名中也有类似发现(除了患者1,第一份手术后尿样品是在手术后4个月采集),有可能是因为手术后肿块实质上被切除的原因。
最后,如若干报道已指出的,ca19.9也存在于尿中并能够用于癌症诊断,并且在一些病例中甚至优于血液ca19.9,测量了尿样品中ca19.9水平并将其与匹配的血浆ca19.9进行比较。在该实例中,没有证明尿ca19.9在将pdac与cp及健康尿区分方面是有用的(数据未示出)。
pdac是一种最难以检测的癌症;因此,大多数患者在疾病晚期才表现出症状。因此,不到20%的pdac患者接受根治性手术,而其他的患者只能被提供姑息疗法。在本文中,描述了三-生物标志物组,能够高度精确的将早期阶段pdac患者与健康受试者进行区分。研发了基于尿样本的诊断检测,因为这种体液相比于血液具有若干优点:它不那么复杂,为分析提供了“惰性”且稳定的基质,并能够重复地且无创性地充分取样。到目前为止,在尿中已经检测到超过2,300种蛋白质,这些蛋白质中至少1/3是全身性来源的。作为血液的超滤液,可预计至少一些生物标志物会在尿中比在血液中以更高浓度被发现。
当组合时,reg1a和tff1、lyve1形成强有效的尿组,该组能够以超过90%的精确性检测阶段i-iipdac患者。探索性分析表明,当与ca19.9结合时,精确性会提高。此外,可证明该组在将阶段i-iia与健康个体区分方面是有用的。
因为是完全非侵袭性的且便宜的,当与及时的手术治疗结合时,这种尿筛选测试能够给患胰腺癌风险高的患者带来极大改善的结果。
- 还没有人留言评论。精彩留言会获得点赞!