一种山豆根中黄酮类化合物的提取检测方法与流程
本发明公开了一种将分子筛基质固相萃取技术(MSPD)和反向微乳毛细管电动色谱(MEEKC)在线富集技术联用来提取分离山豆根药材中黄酮类化合物的分析检测方法,具体地说,它涉及由分子筛SBA-15作为吸附剂,结合基质固相萃取技术的离线富集和反向微乳场放大进样(FASI-MEEKC)的在线富集,旨在建立一种针对槐属植物中富含的具有异戊二烯基侧链的小极性游离型黄酮类化合物的分离分析方法。
(二)
背景技术:
山豆根为豆科蔓生性矮小灌木植物越南槐(Sophora tonkinensis Gagnep.)的干燥根及根茎,主产于广西、贵州。始载于《开宝本草》。药性苦寒,有毒。归肺、胃经。功效清热解毒,消肿利咽。近代临床常用于治疗咽喉肿痛、湿热黄疸以及心律失常等病症。研究表明,山豆根富含生物碱、皂苷、黄酮类及多糖等化合物,其中生物碱和黄酮为其主要化学成分。迄今为止,针对山豆根的研究大多集中于生物碱,忽略了山豆根中黄酮类化合物的研究和开发,目前对山豆根中黄酮类成分研究的文献报道很少,仅有的二十几篇相关文献主要针对山豆根中总黄酮的提取和鉴别、化学成分及药理毒性研究等。因此对山豆根中黄酮类化合物的研究非常有必要。
一方面,山豆根中的黄酮大部分是游离型,且具有异戊二烯基侧链,极性小,用HPLC分离耗时长,分离效果差。毛细管电泳技术具有多种分离模式,其中的微乳毛细管电动色谱(MEEKC)不仅分离范围广,可以同时分离水溶性、脂溶性、带电或不带电的物质,而且进样体积小(nL)、分析时间快、流动相用量少(mL);另一方面,山豆根中黄酮类化合物化学组分结构比较复杂,种类多样且每种黄酮含量不高,用常用的HPLC分离方法难以实现完全分离和定量测定,而FASI-MEEKC能同时实现样品的在线分离和富集,提高其分析灵敏度。并且目前尚无MEEKC法在山豆根中黄酮类化合物中的应用研究,因此本发明具有一定创新性。
针对山豆根的样品前处理方法,目前主要集中在超声提取、回流提取等传统方法上,虽然简单易行,但提取时间长,提取效率低,大量有机溶剂的使用,不仅对实验操作人员身体有害,而且对环境污染严重。基质固相分散萃取技术(MSPD)是建立在固相萃取基础上的一种新型样品处理技术,为近年来国内外研究的一个热门领域,已经广泛地应用于水果、蔬菜、果汁等植物样本的农药残留检测领域。目前文献报道的基质固相分散萃取技术多采用弗罗里硅土、硅藻土、C18反向硅胶、氧化铝等作为吸附剂,其药材量和吸附剂的量以及洗脱剂的用量较大,尤其洗脱剂用量在10mL以上,对环境会造成污染。分子筛作为新型基质固相分散萃取吸附剂,由于它孔径均匀、高比表面积、大孔体积、高吸附能力、强热稳定性等优点,使其在中药活性成分的提取检测方面有很好的应用前景。本发明以山豆根中黄酮类化合物为示范,将分子筛SBA-15引入山豆根中6种黄酮类化合物的提取中,可简化提取步骤,提高提取率,且可避免有机溶剂的残留。
综上,本发明建立了基于SBA-15的基质固相分散萃取技术结合FASI-MEEKC在线富集技术测定山豆根中黄酮类化合物的含量,以期为山豆根药材的含量测定和质量控制提供一种更加绿色、简便、快速、高效的新方法。
(三)
技术实现要素:
本发明创造性地将基质固相分散萃取技术和反向微乳毛细管电动色谱技术结合,采用离线富集和在线富集技术的联用实现山豆根中黄酮类化合物的二次富集,有利于其定量检测,且本发明在一个微量体系中实施,所用药材以及实验药品试剂均在微克级别,有害化学试剂使用量少,安全,经济,环保。
本发明所述的山豆根中黄酮类化合物为:lupinifolin(1)、山豆根色满二氢黄酮A(tonkinochromane A,2)、山豆根色满二氢黄酮B(tonkinochromane B,3)、山豆根色满二氢黄酮C(tonkinochromane C,4)、山豆根色满二氢黄酮D(tonkinochromane D,5)、山豆根色满二氢黄酮E(tonkinochromane E,6)(如表1所示),依次编号为黄酮1、2、3、4、5、6共六种黄酮类化合物。本发明旨在定量检测黄酮1和4,在检测方法的建立过程中,选择黄酮1~6的标准品作为混标进行分离条件的优化,并且选择黄酮1、3、4、5四种标准品进行富集条件的优化,以探索得出一种在样品分析时能够与其他干扰成分实现分离,同时能够有效富集的定量检测方法。
为实现上述目的,本发明采用如下技术方案:
一种山豆根中黄酮类化合物的提取检测方法,待检测的黄酮类化合物为lupinifolin(黄酮1)和山豆根色满二氢黄酮C(tonkinochromane C,黄酮4),所述的方法包括如下步骤:
(a)制备黄酮类化合物提取液
将山豆根药材粉末和吸附剂混合并研磨均匀,得到固体混合物;将所得固体混合物装填入固相萃取柱中,并用洗脱剂进行洗脱,收集洗脱液,离心取上层清液,得到黄酮类化合物提取液;
所述山豆根药材粉末和吸附剂的质量比为1:0.5~3,优选1:1~3,最优选1:1;
所述的吸附剂为:C18、Al2O3、硅胶、硅藻土、弗罗里硅土、ZSM-5、TS-1、SAPO-11、MCM-48或SBA-15,特别优选SBA-15;
所述研磨的时间为90~210s,优选120~180s,最优选180s;
所述将固体混合物装填入固相萃取柱中可采用本领域常规的操作方法,例如:取固相萃取柱,在其底部加入筛板,然后将所述固体混合物加入固相萃取柱中,填实后顶部再加入筛板,即完成装填;
所述的洗脱剂为:甲醇、乙醇、乙腈、丙酮、甲醇/乙腈体积比1:1的混合溶剂或甲醇/乙醇体积比1:1的混合溶剂,特别优选甲醇;
所述洗脱剂的体积用量为固相萃取柱体积的0.15~0.8倍,优选0.35~0.65倍,最优选0.65倍;
所述离心的条件为:离心速率13000rpm,离心时间5min;
(b)检测样品溶液
取步骤(a)中制备的黄酮类化合物提取液,挥干后先用甲醇溶解配制成50~100mg/mL浓度的溶液,再用0.25mM硼砂缓冲液稀释1~5倍,然后经0.22μm微孔滤膜过滤,取滤液即为待测样品溶液;采用反向微乳毛细管电动色谱法对所得待测样品溶液进行检测,获得待测样品溶液的电泳谱图;
所述微乳毛细管电动色谱法的分离条件为:色谱柱为56cm×50μm未涂层石英毛细管,运行电压-15~-30v(优选-20kv);检测温度20~35℃(优选25℃);常规电压进样条件:-20kv,5s;检测波长280nm;微乳液组成:表面活性剂0.8%~3.0%(w/v,g/mL)、辅助表面活性剂2.2%~10%(w/v,g/mL)、油相0.3%~0.9%(w/v,g/mL)、有机改性剂10%~20%(w/v,g/mL)、手性拆分剂0~20mM、余量为缓冲液pH=1~3的10~30mM NaH2PO4水溶液;
所述微乳液的组成中,所述的表面活性剂为十二烷基硫酸钠(SDS),所述的辅助表面活性剂为正丁醇,所述的油相为乙酸乙酯,所述的有机改性剂为乙腈,所述的手性拆分剂为羟丙基-β-环糊精、β-环糊精、甲基-β-环糊精或磺丁基-β-环糊精钠(特别优选磺丁基-β-环糊精钠);
最优选的微乳液组成为:SDS 1%(w/v,g/mL)、正丁醇6.6%(w/v,g/mL)、乙酸乙酯0.5%(w/v,g/mL)、乙腈15%(w/v,g/mL)、磺丁基-β-环糊精钠10mM、余量为缓冲液pH=2的20mM NaH2PO4水溶液;
所述微乳液的制备方法为:将组成微乳液的各成分混合置于具塞容量瓶中,在600w的条件下超声30min即形成微乳液,使用前经0.22μm微孔滤膜过滤;
所述反向微乳毛细管电动色谱法的富集条件为:样品基质pH=7.5~9.5的0.1~10mmol/L硼砂缓冲液,水塞组成体积分数10%乙腈水溶液,进水时间5~40s,进样时间20~40s,进样电压-10~-25kv,运行电压-20kv,检测温度25℃;
最优选的富集条件为:样品基质pH=8.5的0.25mmol/L硼砂缓冲液,水塞组成体积分数10%乙腈水溶液,进水时间20s,进样时间30s,进样电压-20kv,运行电压-20kv,检测温度25℃;
(c)绘制标准曲线
精密称取黄酮1和黄酮4标准品,配制一系列不同浓度的混合标准品溶液,采用反向微乳毛细管电动色谱法并按照步骤(b)中的分离条件和富集条件分别对各混合标准品溶液进行检测,得到混合标准品溶液的电泳谱图,分别以谱图中黄酮1和黄酮4的峰面积为纵坐标(y),以混合标准品溶液中黄酮1和黄酮4的质量浓度(μg/mL)为横坐标(x)作图,获得黄酮1和黄酮4的标准曲线和标准曲线方程;
具体的,所述混合标准品溶液的配制方法为:精密称取质量比为1:1~3的黄酮1和黄酮4标准品,先用甲醇溶解制备黄酮1浓度在0.5~1200μg/mL范围内的溶液,再用0.25mM硼砂缓冲液稀释1.2~1200倍;
(d)获取样品检测结果
将步骤(b)所得待测样品溶液的电泳谱图中黄酮1和黄酮4的峰面积值代入步骤(c)所得标准曲线方程中,计算得出待测样品溶液中黄酮1和黄酮4的质量浓度,进而换算得到山豆根中黄酮1和黄酮4的含量。
本发明相对现有技术,具有如下优点:
(1)本发明方法将基质固相分散萃取技术用于中药药材提取,例如采用分子筛SBA-15这一独特的吸附材料,相对于常规的基质固相分散萃取吸附剂更具有创新性,相对于传统提取方法提取效率更高;
(2)提取过程使用的有机溶剂用量少(例如仅为0.65mL甲醇),所消耗时间仅在2min左右,使整个萃取流程效率高,成本低,无污染;
(3)MEEKC作为一种新型的毛细管分离模式,具有分辨率高、样品用量少(nL)、操作自动化、有机溶剂用量少(mL)、环境友好等优点;FASI-MEEKC在线富集技术能同时实现目标分析物的分离和富集,相比液相色谱法更适用于复杂基质的微量甚至痕量中药成分分析,方法简便、快速、灵敏度高、重现性好且符合绿色化学。
(四)附图说明
图1:本发明基质固相分散萃取方法的工艺流程图;
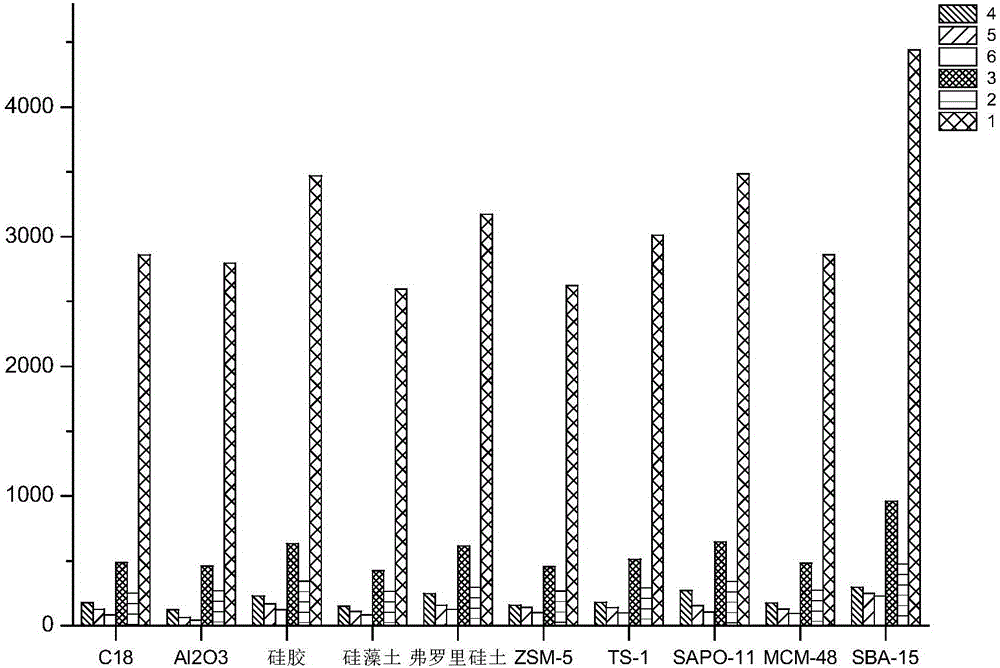
图2:考察不同种类吸附剂的固相萃取效果柱状图,图中纵坐标为峰面积。4、5、6、3、2、1均分别代表山豆根中不同的黄酮类成分(下同);
图3:9组不同的样品分子筛比例、研磨时间以及甲醇体积在正交试验条件下的基质固相分散萃取效果柱状图,图中纵坐标为峰面积,A、B、C、D、E、F、G、H、I代表不同提取条件,具体见表2;
图4:考察不同提取方法固相分散萃取效果柱状图,图中纵坐标为峰面积;
图5:山豆根混合对照品的液相色谱图;
图6:山豆根提取液的液相色谱图;
图7:考察不同种类环糊精(β-环糊精、甲基-β-环糊精、羟丙基-β-环糊精、磺丁基-β-环糊精钠)的微乳毛细管电动色谱分离效果叠加图。图中,A、B、C、D分别代表不同的环糊精的混标电泳图,分别为:A:羟丙基-β-环糊精;B:β-环糊精;C:甲基-β-环糊精;D:磺丁基-β-环糊精钠。1、2、3、4、5、6分别代表山豆根中不同的黄酮类化合物;
图8:考察不同浓度有机改性剂乙腈的微乳毛细管电动色谱分离效果折线图。图中横坐标为乙腈浓度,单位%(w/v,g/mL),纵坐标为保留时间,单位min;
图9:不同进样时间对四种黄酮类化合物在线富集效果折线图。图中1、3、4、5分别代表不同黄酮类化合物,图中横坐标为分析时间,单位s,纵坐标为峰高,单位mAu;
图10:常规电压进样条件下混标电泳谱图;
图11:反向微乳场放大进样条件下混标电泳谱图;
图12:山豆根提取液在FASI-MEEKC富集条件下的电泳谱图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
表1列出了本发明所述的山豆根中六种黄酮类化合物的编号、名称及其结构。
表1山豆根中六种黄酮类化合物的编号、名称及结构
本发明实施例所用山豆根根据中国药典2015年版制备。
本发明实施例所用固相萃取小柱为1mL柱管,材质为PP,购自上海安谱实验科技股份有限公司。
本发明实施例所用小柱筛板规格为1mL,材质为PE,购自上海安谱实验科技股份有限公司。
本发明实施例所优选的分子筛SBA-15,技术指标SiO2/Al2O3≥500mol,BET比表面积m2/g≥800,相对结晶度≥90%,Na2O≤0.1%,灼减≤5%,孔径6-10nm,优选购自南京吉仓纳米科技有限公司。
其他分子筛ZSM-5、TS-1、SAPO-11、MCM-48均购自南京吉仓纳米科技有限公司。
本发明实施例所用硅藻土SiO2·nH2O、中性Al2O3、硅胶mSiO2·nH2O,购自上海安谱实验科技股份有限公司。
本发明实施例所用C18,购自上海正亚化工有限公司。
本发明实施例所用弗罗里硅土,购自上海麦克林生化科技有限公司。
本发明实施例所用β-环糊精、甲基-β-环糊精、羟丙基-β-环糊精、磺丁基-β-环糊精钠,购自淄博千汇生物科技有限公司。
实施例1:样品前处理
1、高效液相色谱条件:Agilent Technologies 1290Infinity。色谱柱:EclipsePlus C18RRHD,1.8μm,2.1×50mm,检测波长:280nm,柱温:40℃,进样量:0.8uL,流速:0.4mL·min-1,流动相:A:乙腈,B:0.1%甲酸水。梯度洗脱:0~30min,10%~40%A;30~40min,40%~50%A;40~50min,50%~56%A;50~60min,56%~76%A;60~70min,76%~95%A;70~75min,95%~95%。
2、提取条件的优化:分别考察不同吸附剂C18、Al2O3、硅胶、硅藻土、弗罗里硅土、ZSM-5、TS-1、SAPO-11、MCM-48、SBA-15,不同山豆根药材粉末和分子筛比例2:1、3:2、1:1、1:2、1:3,不同研磨时间90s、120s、150s、180s、210s,不同洗脱剂甲醇、乙醇、乙腈、丙酮、50%甲醇-50%乙腈、50%甲醇-50%乙醇以及不同体积洗脱剂甲醇0.15mL、0.20mL、0.35mL、0.50mL、0.65mL、0.80mL对山豆根中黄酮类化合物提取效率的影响。具体操作参照步骤1。
选择分子筛SBA-15作为吸附剂,甲醇作为洗脱剂。选择样品与吸附剂比例1:1、1:2、1:3,研磨时间120s、150s、180s,甲醇体积0.35mL、0.50mL、0.65mL建立正交试验。不同种类吸附剂的固相萃取效果柱状图见图2,正交试验的设计表见表2。
表2基质固相分散萃取用于提取山豆根中黄酮类物质的正交试验
将获得的9组黄酮类有效成分提取液分别取样用高效液相色谱仪(HPLC)采样分析。不同条件组合的基质固相分散萃取效果柱状图见图3所示,图中的数据为峰面积。
结合单因素实验考察结果,结果显示,最佳的基质固相分散萃取条件是:25mg山豆根药材粉末与25mg SBA-15混合研磨180s后,用0.65mL甲醇洗脱,13000rpm离心5min后取上层清液即为黄酮类有效成分提取液。
3、不同提取方法的比较:经过基质固相分散萃取技术的条件研究,本发明进一步比较了基质固相分散萃取法与传统提取技术例如超声提取、乙醇回流提取对山豆根药材中黄酮类化合物提取率的影响。不同提取方法的提取效果柱状图见图4所示,图中数据为峰面积。结果显示,与甲醇超声提取和乙醇回流提取相比,基质固相分散萃取技术不仅缩短了样品前处理时间,而且明显提高了山豆根中黄酮类化合物的提取效率。
实施例2:分离条件优化
1、毛细管电动色谱条件:Agilent Technologies 7100Capillary Electrophoresis,配紫外检测器;色谱柱:未涂层石英毛细管(56cm×50μm,i.d.,河北永年锐丰色谱器件有限公司)。反向微乳液毛细管电动色谱法运行电压为-15~-30kv(优选-20kv),检测温度为20~35℃(优选25℃),常规电压进样条件:-20kv,5s;检测波长280nm。微乳液组成为:SDS 0.8%~3.0%(w/v)、辅助表面活性剂6.6%(w/v)、油相0.5%(w/v)、有机添加剂15%(w/v)、手性拆分剂0~20mM、缓冲液为20mM pH 2NaH2PO4水溶液。更优选为:1%(w/v)SDS、6.6%(w/v)正丁醇、0.5%(w/v)乙酸乙酯、15%(w/v)乙腈、10mM磺丁基-β-环糊精钠、20mM NaH2PO4(pH 2)缓冲液,在600w的条件下超声30min后形成微乳液,用前均需过0.22μm微孔滤膜。
2、毛细管预处理:分别用1mol/L NaOH、0.1mol/L NaOH、超纯水、运行缓冲液冲洗10min。两次MEEKC样品分析运行期间,分别用0.1mol/L NaOH、超纯水、运行缓冲液冲洗5min,以获得良好的分离检测重现性。
3、微乳液制备:将组成微乳液各成分混合置于具塞容量瓶中,超声30min后得到透明、稳定的溶液即可。使用前均需过0.22μm微孔滤膜。
4、微乳液组成优化
(1)环糊精种类和浓度的选择
由于黄酮4和5是手性异构体,实验过程中发现无论如何改变微乳液其他组分的浓度都不能增大其分离度。因此尝试在微乳液中加入常用的手性拆分剂环糊精,以期望达到手性拆分的目的。分别在微乳液中加入了10mM不同种类环糊精:羟丙基-β-环糊精、β-环糊精、甲基-β-环糊精、磺丁基-β-环糊精钠,六种黄酮类化合物的微乳毛细管电动色谱分离效果叠加图如图7所示。结果显示,综合考虑分离度和分析时间,磺丁基-β-环糊精钠作为拆分剂加入微乳液中效果最好。接着考察了磺丁基-β-环糊精钠浓度5mM~20mM对分离的影响,综合考虑分离度和分析时间,选择10mM磺丁基-β-环糊精钠为最优浓度。
(2)表面活性剂SDS浓度的影响
将步骤3微乳液中SDS浓度分别改为0.8%、1%、1.2%、2.4%、2.8%、3.0%(w/v),其他条件和操作不变。结果发现,随着SDS浓度的增加,分离度逐渐减小且迁移时间也减小。综合考虑分离度和分析时间,选择1%SDS较为合适。
(3)NaH2PO4浓度和pH的影响
缓冲液浓度直接影响毛细管内壁的Zeta电势。缓冲液浓度较低时Zeta电势大,电渗流较高,迁移时间短,分离不完全;提高缓冲液浓度有利于降低Zeta电势,减小电渗流,改善分离。但缓冲液浓度过大,产生较多焦耳热,增加分析物扩散程度,导致峰展宽。本发明考察了10~30mM范围内变化(pH 2)时对分离的影响。随着缓冲液浓度增加,分离度得到改善,但分析时间延长,且焦耳热增加导致峰展宽,因此选取20mM NaH2PO4为优化值。缓冲液pH值影响毛细管内表面的特性,改变电渗流的大小,考察了缓冲液pH 1~3对分离的影响,综合考虑,选择迁移时间最短,基线最稳的pH 2为最优缓冲液pH值。
(4)油相乙酸乙酯及辅助表面活性剂正丁醇浓度的影响
将步骤3微乳液中乙酸乙酯浓度分别改为0.3%、0.5%、0.7%、0.9%(w/v),同样的,将步骤3微乳液中正丁醇浓度分别改为2.2%、4.8%、6.6%、8.4%、10%(w/v),其他条件和操作不变。结果发现,随着乙酸乙酯和正丁醇浓度的增加,迁移时间和分离度均增大,综合考虑选择0.5%乙酸乙酯、6.6%正丁醇为最优。
(5)有机改性剂种类及浓度的选择
在微乳液中加入有机改性剂有利于改善待分析物的分离效果,本发明考察了甲醇、乙腈以及异丙醇(10mM)作为改性剂对分离的影响。结果发现,甲醇作为改性剂迁移时间最短,但分离度不好,基线不稳。异丙醇作为改性剂迁移时间最长,且黄酮1和2峰型重叠。综合考虑分离度和分析时间,选择乙腈为最合适的有机改性剂。接着考察乙腈的浓度的影响,不同浓度乙腈的MEEKC法分离效果折线图如图8所示。结果显示,随着乙腈浓度的增加,分离度和迁移时间都增加,综合考虑选择15%乙腈为最优浓度。
实施例3:FASI-MEEKC在线富集条件优化
1、样品基质pH值及浓度的影响
采用电动进样时待分析物的解离度会显著影响FASI的富集效果,黄酮类化合物在中性或酸性条件下难解离,富集效果很差,因此选择碱性样品基质。本发明考察了pH 7.5~9.5的硼砂缓冲液作为样品基质,发现在pH 8.5时峰形良好,富集效果最好。
硼砂缓冲液的浓度影响样品基质的离子强度和电导率,考察了样品基质浓度从0.1~10mol/L pH 8.5时对富集效果的影响。结果表明样品在较低浓度的溶液中检测灵敏度明显提高。这是因为在固定的进样时间内,低浓度基质溶液在样品进口端形成的低电场,能推动更多的样品离子进入毛细管,从而提高富集灵敏度。当基质浓度低于0.25mol/L过低浓度的基质在进样端形成的电场过低,造成样品进样不完全,降低富集效率。因此,样品基质浓度选择为0.25mol/L。
2、水塞组成及进水时间的影响
FASI法常在样品进样前先注入一段低电导溶液形成低场强区带。本实验考察了纯水、不同浓度的乙腈水溶液作为水塞时对富集效果的影响。结果发现当水塞组成含有10%乙腈时,能提高富集倍数并有效改善峰形,使峰形比较尖锐。所以水塞组成选择10%乙腈水溶液。水塞长度对富集效果也有影响,本发明在固定50mbar进水压力条件下,考察水塞进入时间为5、10、20、30和40s时对富集效果的影响。实验表明,当进水时间为小于20s时,随着进水时间的延长,峰形良好且峰高明显增加。当大于20s时,出现明显的峰展宽现象,导致峰高降低。并且进水过多会增大电动进样端的电阻,导致进样量降低,同时引起电渗流变化,产生层流,影响进样稳定性。所以选择20s为最长进水时间。
3、进样电压和进样时间的影响
本发明考察了反向进样电压在-10~-25kv之间时对富集效果的影响。通过实验发现,当进样电压增加富集效果也随之增加,但是当进样电压达到-25kv时,黄酮1峰出现裂分,且分析基线开始变得不稳定。经综合比较后,选择-20kv为最佳进样电压。保持进样电压-20kv不变,考察了进样时间为20s、25s、30s、35s、40s对富集效果的影响。不同进样时间对四种黄酮类化合物富集的效果折线图如图9所示,结果显示,当进样时间为20、25、30、35和40s时,随着进样时间的延长,峰面积逐渐增大,富集倍数增大。但当进样时间超过30s时,由于进样量过大导致毛细管过载,出现峰展宽甚至平台峰。因此本发明采用30s作为最长进样时间。
实施例4:样品中黄酮1和4的含量测定
1、供试品溶液的制备
称取山豆根药材粉末25mg和分子筛吸附剂25mg混合加入研钵中研磨180s,得研磨后的固体混合物:取1mL规格的固相萃取柱,固相萃取柱的底部加入筛板,将研磨后的固体混合物加入固相萃取柱中,填料填实后顶部再加入筛板,取0.65mL的甲醇,注入固相萃取柱内,缓缓进行洗脱,收集洗脱液,洗脱结束后,将洗脱液放入离心仪中,13000rpm离心5min,上层清液即为黄酮类有效成分提取液,挥干,用300μL甲醇溶解,再用0.25mmol/L pH 8.5的硼砂缓冲液稀释3倍,然后经0.22μm滤膜过滤后在最佳毛细管电泳分离富集条件下进行分析。
2、线性关系、富集倍数和检测限
为了建立黄酮1和4在常规MEEKC法和FASI-MEEKC法的线性关系,精密称定1和4对照品,用甲醇溶解,分别制备得到浓度为1000μg/mL的对照品溶液。取上述混合对照品溶液用甲醇和0.25mM硼砂缓冲液稀释至不同浓度分别用于常规MEEKC法和FASI-MEEKC法的分析,在优化条件下分别进样,测定色谱峰面积。以峰面积(y)对样品质量浓度(x,μg/mL)计算线性方程及相关系数,线性范围、相关系数、富集倍数及检出限(S/N=3),结果见表3。结果显示2个被测定的黄酮类化合物在标准曲线的范围内均呈良好的线性(r2>0.9989),且FASI-MEEKC法的检出限远低于常规MEEKC法,检测限在2.0×10-2-7.7×10-2μg/mL范围内。
富集倍数计算公式为:SEheight=Hstack/H,SEarea=Astack/A,式中SEheight和SEheight分别为以峰高和峰面积为衡量指标的富集因子,Hstack和Astack分别是分析物在富集条件下的峰高和峰面积,H、A分别是分析物在常规进样时的峰高、峰面积。
3、重现性和稳定性试验
通过测定日内和日间精密度来评价方法的重现性。日内精密度是指在同一天内测定6份经过相同处理的山豆根样品;日间精密度是通过连续测定3天,每天测定6次实现的。稳定性是指在同一天不同时间(0,2,4,6,8,12h)内测定6次山豆根样品。重现性和稳定性试验要与标准工作曲线同时进行,以当日的标准工作曲线计算样品的浓度,并记录黄酮1和4的迁移时间和峰面积,计算相对标准偏差(RSD%)评价方法的重现性和稳定性,结果见表3。其日内相对标准偏差分别低于2.5%、5.3%,日间相对标准偏差分别低于4.7%、8.9%。稳定性相对标准偏差分别低于3.3%、4.8%。说明本实验建立的方法具有良好的重现性和稳定性。
表3待测物富集前后的线性关系、富集倍数和检测限以及富集后的重现性和稳定性考察
a)常规MEEKC(y1=a1x1+b1),FASI-MEEKC(y2=a1x2+b2),y1,2:峰面积(mAu·s),x1,2:浓度:(μg/mL).
b)S/N=3.
4、样品测定和回收率实验
将所建立的FASI-MEEKC方法进一步应用到山豆根样品的分析中,电泳图如图12所示。通过比较迁移时间和加标法对实际样品电泳图中的组分峰进行了确定,根据电泳谱图和标准曲线方程,计算得到样品中黄酮1和4的含量、回收率和RSD如表4所示。通过向已知含量的山豆根药材样品中加入已知量的标准品,进行样品制备并进行FASI-MEEKC分析。回收率考察3个不同浓度样品,即样品浓度的高、中、低水平,每个实验重复三次,计算平均回收率。结果见表4,方法的回收率在92.42%~102.42%之间,且RSD值小于5.7%,表明本实验建立的方法具有良好的准确性和重复性。
表4山豆根中待测黄酮类成分的回收率
- 还没有人留言评论。精彩留言会获得点赞!