一种基于聚集诱导发光增强机制提高双链DNA保护的银纳米簇发光性能的方法与流程
本发明属于纳米材料技术领域,具体涉及一种基于聚集诱导发光增强机制来提高双链dna保护的银纳米簇发光性能的方法。
背景技术:
金属纳米簇由于其尺寸小、发光波长可控、稳定性好及生物相容性好等特点,已被广泛地应用于生物成像及各种体外、体内生物分子的检测。但是与量子点相比,其荧光量子产率依然偏低,这严重限制了它的应用。近年来,人们发现金属纳米簇也存在聚集诱导荧光增强现象,这主要是由于聚集限制了配体的振动和转动,使得内耗能减少,从而使得荧光增强、同时还伴随着峰位的移动。因此,聚集诱导荧光增强是一种提高金属纳米簇荧光量子效率的一种简单、易行的方法。据报道,已经通过聚集诱导荧光增强的方法获得了量子效率为5~20%的金属纳米簇。因此,在提高量子效率方面,这种方法越来越多地受到人们的关注。
蛋白与dna的相互作用在生命的整个周期中有着至关重要的意义,在过去的40年中,它们已经被广泛地应用在各种实验技术中。其相互作用驱动力主要是通过dna与蛋白表面区域之间的电位互补来实现的。有文献报道,dna不仅不影响而且还对蛋白质的二级结构有稳定作用;它主要是通过双链dna上富含g-c链段中的磷酸基团与蛋白相互作用,而且这种作用力是非特异性的。
牛血清蛋白(bsa)是牛血清中的一种球状蛋白,具有典型的生物学性质和明确的结构信息,并且在细胞培养和酶活性测试等生物化学实验中也有着非常重要的作用,因此人们常将它作为模型蛋白广泛地应用到各类研究和测试中。胰蛋白酶是一种胰腺丝氨酸蛋白酶,它对底物的作用位点为带正电荷的精氨酸和赖氨酸,本发明中我们主要利用它对bsa水解作用来改变蛋白或小肽的表面电荷分布,进一步诱导金属纳米簇的聚集和发光增强。
技术实现要素:
本发明的目的是提供一种基于聚集诱导发光增强机制来提高双链dna保护的银纳米簇发光性能的方法。
按照文献(analyst,2017,142,800-807)的方法合成了双链dna保护的银纳米簇,但其发光较弱,在4℃条件下能稳定存在;
在1.0×10-6mol/l双链dna保护的银纳米簇的磷酸缓冲溶液(pbs,ph=7.4,浓度为20×10-3mol/l)中,滴加牛血清蛋白bsa母液,边滴加边搅拌使混合均匀,反应3~8min,然后测试荧光光谱,发现双链dna保护的银纳米簇的荧光强度得到增强,并且随着牛血清蛋白bsa浓度的增加,其发光位置逐渐从555nm蓝移至522nm;在双链dna保护的银纳米簇的磷酸缓冲溶液中,bsa的终浓度为10×10-6~140×10-6mol/l;
在1.0×10-6mol/l双链dna保护的银纳米簇磷酸缓冲溶液(ph=7.4,浓度为20×10-3mol/l)中,滴加牛血清蛋白bsa母液,边滴加边搅拌使混合均匀,反应3~8min后,再滴加胰蛋白酶母液,反应15~30min,然后测试荧光光谱,发现双链dna保护的银纳米簇的荧光强度得到增强,因此,该过程极大地提高了双链dna保护的银纳米簇的发光性能。在双链dna保护的银纳米簇的磷酸缓冲溶液中,bsa的终浓度为10×10-6~140×10-6mol/l,胰蛋白酶的终浓度为5~400ng/μl。
本发明中,我们用到的金属纳米簇为双链dna保护的银纳米簇,双链dna中含有g-c链段,我们利用g-c链段中磷酸基团能够与血清蛋白通过静电相互作用的机理,通过bsa使配体dna聚集来限制银纳米簇配体双链dna的振动转动,减少内耗,从而诱导荧光增强:进一步的我们加入胰蛋白酶,水解bsa,改变bsa表面的电荷分布,诱导进一步配体dna聚集,使得银纳米簇的荧光进一步增强,从而通过聚集诱导荧光增强的方式提高银纳米簇的发光性能。
附图说明
图1:双链dna保护的银纳米簇溶液(1.0×10-6mol/l)与不同浓度牛血清蛋白(bsa)相互作用的荧光发射光谱图,对应实施例2产物;
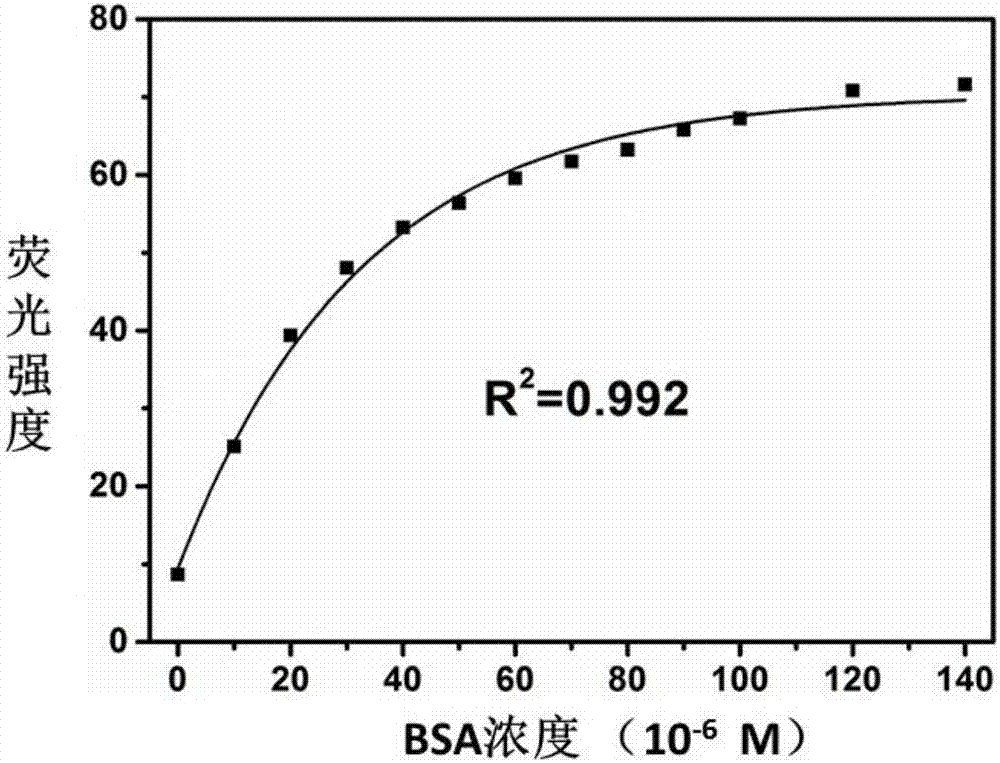
图2:双链dna保护的银纳米簇溶液(1.0×10-6mol/l)与不同浓度牛血清蛋白(bsa)相互作用的荧光发射峰强度与牛血清蛋白浓度的线性响应关系曲线图;横坐标为bsa浓度,纵坐标为银纳米簇在522nm处荧光发射峰强度,对应实施例2产物;
图3:双链dna保护的银纳米簇溶液(1.0×10-6mol/l)与bsa(10×10-6mol/l)结合之后,再与不同浓度胰蛋白酶混合5min的荧光发射光谱图,对应实施例3产物;
图4:双链dna保护的银纳米簇溶液(1.0×10-6mol/l)与bsa(10×10-6mol/l)结合之后,再与不同浓度胰蛋白酶相互混合5min后的荧光发射峰强度与胰蛋白酶浓度的线性响应关系曲线图;横坐标为胰蛋白酶浓度,纵坐标为其在545nm处荧光发射峰强度,对应实施例3产物;
图5a:双链dna保护的银纳米簇的透射电镜(tem)表征图片;
图5b:双链dna保护的银纳米簇与bsa作用后产物的透射电镜(tem)表征图片;
图5c:双链dna保护的银纳米簇与bsa作用再加入胰蛋白酶后产物的透射电镜(tem)表征图片;
图5d:图5c的放大图;
图5对应实施例4产物。
图6:双链dna保护的银纳米簇(1.0×10-6mol/l)与不同浓度bsa相互作用之后,再加入相同浓度胰蛋白酶(20ng/μl)之后的增强曲线。曲线a为1.0×10-6mol/l双链dna保护的银纳米簇与不同浓度的bsa(10、20、30、40、50、60、120×10-6mol/l)相互作用,得到的双链dna保护的银纳米簇荧光强度与bsa浓度关系曲线:曲线b为1.0×10-6mol/l双链dna保护的银纳米簇与不同浓度的bsa(10、20、30、40、50、60、120×10-6mol/l)相互作用,再加入相同浓度胰蛋白酶(20ng/μl),所得到的的双链dna保护的银纳米簇荧光强度与bsa浓度关系曲线。对应实施例5产物。
图7:双链dna保护的银纳米簇(1.0×10-6mol/l)与相同浓度bsa(30×10-6mol/l、40×10-6mol/l和50×10-6mol/l)相互作用之后,再加入不同浓度胰蛋白酶的增强曲线,对应实施例6产物。
具体实施方式
本发明中使用的所有dna样品都是在生工生物工程(上海)股份有限公司订购,并有液相色谱表征数据;硝酸银、磷酸氢二钠、磷酸二氢钠、硼氢化钠等化学试剂,都购自国药集团化学试剂有限公司;牛血清白蛋白(bsa),胰蛋白酶(tryp)等购自美国sigma公司。
分别称量牛血清白蛋白(bsa),胰蛋白酶(tryp)等原料后,通过加入磷酸缓冲溶液(pbs,ph=7.4,浓度为20×10-3mol/l)获得1.0×10-3mol/l的母液。
实施例1:
按照文献方法(analyst,2017,142,800-807)制备双链dna保护的银纳米簇:以含有互补链的模板链dna序列5′-tttaaataatatcccttaatcccc-3′(tttaaataatat为互补链段,cccttaatcccc为保护银纳米簇的模板链段)和含有富含g碱基的互补链dna序列5′-ggggtggggtggggtgggatattatttaaa-3′(atattatttaaa为互补链段,ggggtggggtggggtggg为富含g碱基链段)制备dna保护的银纳米簇,具体步骤如下:
方法:称取硝酸银(agno3)17.0mg,加入20ml蒸馏水配置成5mmol/l硝酸银母液备用(避光保存);称取358mg磷酸氢二钠(na2hpo4·12h2o)加入50ml水配置20mmol/l磷酸氢二钠溶液;再称取156mg磷酸二氢钠(na2hpo4·12h2o)加入50ml水配置20mmol/l磷酸二氢钠溶液;分别取40.5ml磷酸氢二钠溶液和9.5ml磷酸二氢钠溶液混合,配置ph=7.4、20mmol/l的磷酸缓冲溶液备用;称取硼氢化钠(nabh4)18.9mg,加入20ml蒸馏水配置25mmol/l的硼氢化钠溶液备用;取50od(1.65mg)的含有互补链的模板链dna,加入2.19ml蒸馏水配置100μmol/l含有互补链的模板链dna母液备用(4℃保存);取50od(1.65mg)的含有富含g碱基的互补链dna,加入1.60ml蒸馏水配置100μmol/l含有富含g碱基的互补链dna母液备用(4℃保存)。分别取320μl含有互补链的模板链dna母液和320μl含有富含g碱基的互补链dna母液充分混合,置于90℃水浴加热反应5min,室温下冷却1h即可获得双链dna溶液;向该体系中加入2514μl磷酸缓冲溶液(pbs,ph=7.4,浓度为20×10-3mol/l),38.4μl硝酸银母液(5mmol/l)充分混合均匀,再加入7.7μl新制硼氢化钠水溶液(25mmol/l),充分混合均匀,得淡黄色溶液,即双链dna保护的银纳米簇溶液,浓度是10μmol/l,4℃避光保存。
实施例2:
建立双链dna保护的银纳米簇与bsa之间的定量关系:将实施例1中制备的双链dna保护的银纳米簇溶液用磷酸缓冲溶液稀释至10倍体积,配成浓度为1.0×10-6mol/l的溶液;分别取1ml的该溶液,向其中分别加入bsa母液,使bsa终浓度分别为0~140×10-6mol/l(0,10,20,30,40,50,60,70,80,90,100,120,140×10-6mol/l),并在4min后利用荧光光谱仪(日本岛津,rf-5301pc)记录该银纳米簇溶液对不同浓度的bsa响应的荧光发射光谱(激发波长470nm)。如图1所示,随着bsa浓度的增加,其在555nm处的荧光发射峰被逐渐增强并蓝移至522nm,强度从555nm处的12增强到522nm处的70,增强大约6倍。同时,通过绘制该体系荧光发射峰强度(522nm位置处)与bsa浓度的关系曲线图(如图2所示)得两者响应曲线。
实施例3:
将实施例1中制备的双链dna保护的银纳米簇溶液用磷酸缓冲溶液稀释至10倍体积配成浓度为1.0×10-6mol/l的溶液,分别取11份1ml的该溶液,向其中加入bsa母液,使其终浓度分别为10×10-6mol/l;4min后,再向每一份中加入胰蛋白酶母液,使其终浓度分别为0~80ng/μl(0、5、10、15、20、25、30、40、50、60、70、80ng/μl),5min后利用荧光光谱仪记录双链dna保护的银纳米簇与bsa的混合溶液对不同浓度胰蛋白酶响应的荧光发射光谱(激发波长为470nm)。如图3所示,随着胰蛋白酶浓度的增加,其在522nm的荧光发射峰强度逐渐增强,强度从522nm处的35增强到545nm处的120,大概增强3.5倍,并红移至545nm。同时通过绘制荧光发射强度(545nm位置处)与胰蛋白酶浓度的关系曲线图(如图4所示),进一步通过线性拟合即可获得双链dna保护的银纳米簇和bsa形成的复合物对胰蛋白酶的关系曲线(如图4所示),从图中可看出它们具有极佳的线性依赖关系(如图4,r2=0.997)。因而,本发明制备的双链dna保护的银纳米簇与bsa结合形成的复合物能够用来定量检测胰蛋白酶。通过计算,检测灵敏度达到了2.8ng/μl。
实施例4:
将实施例1中制备的双链dna保护的银纳米簇溶液用磷酸缓冲溶液稀释至2倍体积配成浓度为5.0×10-6mol/l的溶液,各50μl取三份。用移液器从第一份中取10μl滴加到透射电镜专用的超薄微栅铜网上,静置2min后,用滤纸吸干;向第二份中加入2.5μlbsa母液,使得bsa终浓度为50μm,充分混合4min之后,用移液器取10μl,滴加到超薄微栅铜网上,静置2min后,用滤纸吸干;向第三份中加入2.5μlbsa母液,使其终浓度为50μm,充分混合4min之后,再加入胰蛋白酶母液,使胰蛋白酶终浓度为100ng/μl;充分混合20min之后,用移液器取10μl,滴加到超薄微栅铜网上,静置2min后,用滤纸吸干。如图5所示,单独的双链dna保护的银纳米簇是单分散的(a):与bsa作用之后,聚集形成片层结构(b):再加入胰蛋白酶将bsa水解之后能进一步诱导聚集增大,形成更大的球状结构(c,d)。
实施例5:
将实施例1制备的双链dna保护的银纳米簇溶液用磷酸缓冲溶液稀释10倍,配制成浓度为1.0×10-6mol/l的溶液,分别取8份1ml溶液。向其中分别加入bsa的母液,使其终浓度分别为0.0、1.0、2.0、3.0、4.0、5.0、6.0、12.0×10-5mol/l,4min后利用荧光光谱仪分别检测其荧光光谱;然后再分别加入胰蛋白酶母液,使其终浓度均为20ng/μl。20min后利用荧光光谱仪检测对应荧光光谱图,得到双链dna保护的银纳米簇与不同浓度的bsa在胰蛋白酶不存在与存在条件下的荧光光谱图。然后绘制其在发射波长545nm处的荧光强度与bsa浓度的关系曲线图,如图6所示,曲线a为1.0×10-6mol/l双链dna保护的银纳米簇与不同浓度的bsa(10、20、30、40、50、60、120×10-6mol/l)相互作用,得到的双链dna保护的银纳米簇荧光强度与bsa浓度关系曲线;曲线b为1.0×10-6mol/l双链dna保护的银纳米簇与不同浓度的bsa(10、20、30、40、50、60、120×10-6mol/l)相互作用,再加入相同浓度胰蛋白酶(20ng/μl),所得到的的双链dna保护的银纳米簇荧光强度与bsa浓度关系曲线。我们可以看出在相同浓度的胰蛋白酶存在的条件下,bsa浓度在3.0×10-5~5.0×10-5mol/l时,荧光强度增强到最大,而且稳定。所以我们得出结论,银纳米簇与bsa的最佳摩尔比为1:30~50。
实施例6:
将实施例1制备的双链dna保护的银纳米簇溶液稀释10倍,配制成浓度为1.0×10-6mol/l的溶液,分别取1ml,分为三组,每组9个样品。向每1ml该溶液中分别加入bsa的母液,使三组终浓度分别为3.0×10-5、4.0×10-5、5.0×10-5mol/l,且每组中bsa的浓度保持一致;4min后向其中加入不同体积胰蛋白酶母液,使得每组9个样品中胰蛋白酶的终浓度为0~400ng/μl(0、20、40、60、80、100、120、200、400ng/μl,)不等;20min后测试每个样品的荧光光谱。然后绘制在发射波长在545nm处荧光强度与胰蛋白酶浓度的关系曲线,如图7所示。我们可以看出,在bsa浓度分别为3.0×10-5、4.0×10-5、5.0×10-5mol/l时,双链dna保护的银纳米簇随着胰蛋白酶浓度的变化,荧光增强基本上保持一致,胰酶浓度提高到400ng/μl时,荧光强度增强倍数达到了30倍,极大地提高了双链dna保护的银纳米簇的发光性能。
还需要说明的是,本发明的具体实施例只是用来示例性说明,并不以任何方式限定本发明的保护范围,本领域的相关技术人员可以根据上述一些说明加以改进或变化,但所有这些改进和变化都应属于本发明权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于聚集诱导发光效应的花菁荧光探针及制备方法和应用与流程
- 具有聚集诱导发光性质和压致变色性质的荧光材料的制作方法与工艺
- 一种基于聚集诱导发光的铜离子检测探针及其制备方法和应用与流程
- 一种具有聚集诱导发光性能的侧链型液晶高分子及其制备方法与流程
- 一种聚集诱导发光检测Pb2+的纳米簇复合底物AuNPs@(SG)X的制备方法与流程
- 一种高诱导活性的修复材料、制备方法和应用与流程
- 一种利用聚集诱导发光性质实现对晶体生长与转化过程荧光可视化研究的方法与流程
- 一种具有聚集诱导发光效应的聚合物及其制备方法,石墨烯复合材料及其制备方法与流程
- 一种聚集诱导发光材料及其制备方法与流程
- 一种基于聚集诱导发光的氟离子检测探针及其制备方法和应用与制造工艺