全血中阿比特龙的定量检测方法与流程
本发明涉及一种动物(包括人)全血中阿比特龙的定量检测方法。
背景技术:
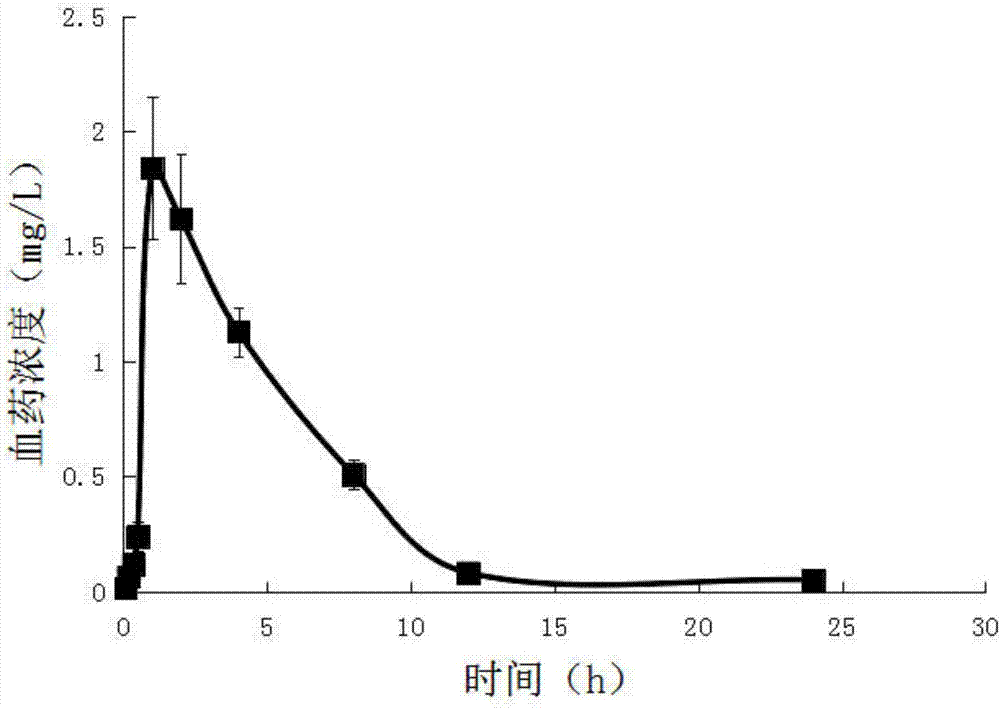
:前列腺癌是欧美男性常见的一种恶性肿瘤,每年新增诊断人数约为240000,是肿瘤男性死亡率第2的肿瘤,且转移性强。据统计,2012年大约28000人死于该病。虽然我国前列腺癌发病率远低于西方国家,但是随着生活方式的改变,前列腺癌特异抗原筛查的普及,我国前列腺癌的患病人数也呈直线型上升趋势,且其中大多数发展为晚期前列腺癌。其发展的主要机制为细胞内雄性激素受体受到雄性激素的持续刺激,目前对于前列腺癌的首选治疗方法为去势治疗,但研究显示初期显效后平均36个月后很大一部分患者发展为去势抵抗性前列腺癌,经过研究后发现患者在接受治疗后前列腺癌细胞内仍可继续合成少量雄性激素。随后的研究发现,第一代雄激素受体拮抗剂酮康唑可调控雄性激素轴,但是治疗效果短暂,并且酮康唑对于抑制雄性激素合成的耐受性很差。多项研究表明,在血清睾酮达到去势水平,前列腺癌细胞内的雄性激素受体信号轴依然能够保持活性,并对其增殖具有重要影响作用。临床研究证实,去势治疗后血清前列腺癌特异抗原的增加可被二线激素治疗药物所降低,且雄激素受体通路活性与睾酮循环水平无关。阿比特龙是一种抗雄激素药物,为雄激素代谢过程中的cyp17酶抑制剂,属于内分泌治疗范畴,该药物通过阻断雄激素生物合成的关键酶降低睾酮水平,除了睾丸、肾上腺来源的睾酮外,还可以降低前列腺肿瘤内部微环境中的雄激素合成。阿比特龙可以强烈抑制17α-羟化酶/c17,2-裂解酶(cyp17),从而显著抑制雄激素的生物合成,在小鼠的药物代谢动力学模型中阿比特龙对于cyp17的抑制活性远远超过酮康唑。i期临床试验结果表明,阿比特龙在去势环境下不仅可以很好地抑制睾酮水平,而且具有很好的耐受性,也没有表现出像酮康唑一样的毒性反应。开放、单中心和剂量递增的临床试验表明持续阿比特龙治疗可以使50%~57%的患者血清中前列腺癌特异抗原降低,且ii期临床推荐治疗剂量为1000mg/d,在此剂量下可同时抑制糖皮质激素和雄激素的合成。阿比特龙化学结构式如式1所示。目前,关于阿比特龙的定量检测与分析,尚未见国内相关文献报道。西南交通大学制药工程学院吴青松等开展了乙酸阿比特龙酯的合成及其质量检测研究,其采用lunac18色谱柱(250mm×4.6mm,5μm),流速1.0ml/min,检测波长220nm,柱温40℃,流动相a相为甲醇-乙腈(80%-20%)、流动相b相为水,梯度洗脱(洗脱程序见表1),定量分析了乙酸阿比特龙酯和作为杂质存在的阿比特龙的含量。检测结果显示,阿比特龙与其他杂质分离较好,峰形也非常对称,无前展或拖尾现象。但是该研究是在合成反应提取物中进行的检测,而且样品已经进行了前期净化处理,在反应样品中无蛋白、脂质成分等细胞内生物杂质干扰。表1.梯度洗脱程序国外期刊报道了印度kumar等采用rp-hplc方法定量分析了大鼠血浆中阿比特龙。该文献显示采用betasilc18色谱柱,利用乙酸乙酯萃取,室温环境下定量检测了大鼠血浆中阿比特龙含量。其回收率为70%以上,流动相为乙腈-水-0.01m磷酸二氢钾(ph3.0)=55-5-40(v/v/v)。根据文献可知,动物血浆中阿比特龙hplc检测能够定量分析生物样品中阿比特龙含量,结果定量准确、灵敏、重复性好,日内和日间变异系数较小,能够满足动物体内阿比特龙药物代谢动力学研究。然而该研究只是定量分析了动物血浆中阿比特龙含量,动物血浆为去除红细胞、白细胞、淋巴细胞等细胞成分的一类生物样品,细胞内大量的生物杂质已经被清除,从而使得血浆样品相比已经比较干净。因此,目前的研究只是定量检测了血浆或血清中阿比特龙含量,尚未得知血液中所含的各类血细胞(包括红细胞、白细胞等)中阿比特龙含量,也难以求出全血中阿比特龙含量。血细胞作为药物的一个重要储库和缓冲器,有时候需要全面评价药物在血细胞中的分布特征,从而在联合用药方面保证协同活性,降低联合用药的副作用。因此,获知全血中阿比特龙含量有其特定作用。技术实现要素:本发明要解决的技术问题是提供一种全血(包括血浆和血细胞)中阿比特龙含量的准确、定量检测方法。为了解决上述技术问题,本发明提供一种全血中阿比特龙的定量检测方法,以全血作为待测对象,依次进行以下步骤:1)、吸取全血裂解液0.4ml于带盖容器(带盖离心管)中,加入乙酸乙酯3ml,振荡器漩涡2±0.2min,8000±500r/min高速离心5±0.5min,分别得位于上层的乙酸乙酯层、位于下层的残渣;在残渣中加入2ml乙酸乙酯重复上述振荡器漩涡、高速离心(振荡器漩涡2±0.2min,8000±500r/min高速离心5±0.5min);即,残渣再重复萃取一次;合并两次离心所得的乙酸乙酯层;于45±1℃水浴中氮气流吹干,所得的干燥物用0.2ml的20%(体积%)乙腈水溶液复溶,漩涡混匀1±0.2min,18000±500r/min高速离心5±0.5min后,吸取上清液ⅰ;备注说明:此上清液ⅰ的体积为0.2ml;即,高速离心产生的沉淀微乎其微,可忽略不计;2)、称取碱性硅藻土(ph为8.5的硅藻土)4g放入玻璃层析柱(10×200mm规格)中,振动(于100hz振动泵)处理5±0.5min;3)、然后将步骤1)中的上清液ⅰ(0.2ml)全部加入步骤2)的玻璃层析柱中,先用5ml纯水洗脱,然后用20%甲醇(v/v)水溶液5ml洗脱;最后用5ml色谱甲醇洗脱,收集色谱甲醇所对应的全部洗脱液,于45±1℃水浴中氮气流吹干,干燥物用0.2ml的20%乙腈水溶液复溶,漩涡混匀1±0.2min,18000±500r/min高速离心5±0.5min后,吸取上清液ⅱ进行后续的高效液相色谱系统分析;备注说明:此上清液ⅱ的体积为0.2ml;即,高速离心产生的沉淀微乎其微,可忽略不计;下述步骤的进样量20μl,即,相当于取了1/10体积的上清液ⅱ进行后续步骤;4)、日本岛津shimadzu20at高效液相色谱系统,浙江大学智达n2000色谱工作站,色谱柱采用thermohypersilbdsc18色谱柱(3μm,250mm×4.6mm);流动相为乙腈-水-0.01m磷酸二氢钠(ph2.5)=60:5:35(v/v),流速1.0ml/min,柱温40℃,紫外检测波长254nm,进样量20μl;5)、以步骤4)所得的阿比特龙药物峰面积为y,代入公式y=27524x+1956.6(r2=0.9999)中,从而获得步骤3)所得的上清液ⅱ中的阿比特龙浓度x,该x的单位为μg/ml;然后经换算,得待测全血中的阿比特龙浓度。作为本发明的全血中阿比特龙的定量检测方法的改进:所述步骤1)中的全血裂解液的制备方法为:在全血中加入等体积的细胞裂解液均匀震荡(于100±10r/min震荡5±0.5分钟),得全血裂解液;所述细胞裂解液的配方为:氯化铵8.29g、碳酸氢钾1g和edta-2na37.2mg,溶于1000ml超纯水中。换算公式为x*20μl*10÷0.2ml=x;因此,待测全血中的阿比特龙浓度为x。为了验证本发明的方法的准确性和实用性,发明人进行了如下的试验:1、标准曲线制备准确称取阿比特龙标准品溶解于色谱甲醇中,作为储备液,利用流动相(即,本发明步骤4所述的流动相)将储备液分别稀释成200.0,50.0,10.0,5.0,1.0,0.5μg/ml系列标准液,取6支具塞离心管中准确加入0.36ml空白全血裂解液,再向上述每个离心管中各加入40μl上述标准液,混匀后即得含系列浓度阿比特龙标准品的全血裂解液,即:0.05,0.1,0.5,1.0,5.0,20.0μg/ml系列标准液。按照“上述
发明内容中的样品前处理方法和色谱条件”进样分析,以阿比特龙药物峰面积(y)为纵坐标,以质量浓度(x)为横坐标作标准曲线,求出标准曲线方程和相关系数(r),即:y=27524x+1956.6(r2=0.9999)。2、回收率和精密度制备含药物曲线范围内高、中、低浓度血浆样品0.05,0.5,5μg/ml作为质控样品(qc),按照上述条件进样分析,每个浓度样品重复5次,以样品中药物峰面积与相同浓度下标准样品峰面积之比,计算高、中、低3种浓度下回收率。制备含药物曲线范围内高、中、低浓度血浆样品0.05,0.5,5μg/ml作为质控样品(qc),按照上述条件进样分析,比较以上样品于日内5次进样和日间5次进样的峰面积变化幅度,计算日内和日间5次进样所得峰面积的变异系数(rsd),从而得出日内和日间精密度。表2.全血中阿比特龙的回收率和精密度3、大鼠口服阿比特龙后全血阿比特龙含量测定将50只spf级sd雄性大鼠随机分为10组,采用注射式灌胃针缓慢插入大鼠胃内,按100mg/kg灌入阿比特龙溶液,无回吐者保留试验。于给药后5、10、20、30min、1h、2h、4h、8h、12h和24h尾静脉取血0.2ml,放入肝素化离心管中,加入0.2ml细胞裂解液,震荡后,使血细胞全部裂解。准确吸取0.4ml全血裂解液按照上述前处理方法和色谱条件处理后进样分析,进样后将测得的阿比特龙峰面积代入上述标准曲线方程中,计算全血裂解液样品中阿比特龙浓度,根据采血时间,绘制血药浓度—时间曲线,见图1。本发明具有如下技术优势:首先,对样品前处理进行了大变化,采用碱性硅藻土作为填料,制备成固相萃取小柱,使萃取回收率得到显著提高;其次,色谱柱采用了柱效更为高效的bdsc18色谱柱,从而使得阿比特龙分离度更好,使得灵敏度得到显著提高;最后,本发明在流动相中加入了一定比例的乙腈,使流动相ph约为2.5,从而使得洗脱能力更强,全血中生物杂质洗脱更快、更全面,从而对阿比特龙色谱峰无干扰,对色谱柱损伤更小。附图说明下面结合附图对本发明的具体实施方式作进一步详细说明。图1是本发明的全血中阿比特龙血药浓度——时间曲线图;图2是对比例1的全血中阿比特龙血药浓度——时间曲线图;图3是对比例2的全血中阿比特龙血药浓度——时间曲线图;图4是对比例3-1的全血中阿比特龙血药浓度——时间曲线图;图5是对比例3-2的全血中阿比特龙血药浓度——时间曲线图;图6是对比例4的全血中阿比特龙血药浓度——时间曲线图。具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。实施例1、一种动物(人)全血中阿比特龙前处理方法以及定量检测手段,依次进行以下步骤:1)、将脱离动物体/人体的静脉全血0.2ml放入肝素化离心管中,加入0.2ml细胞裂解液,震荡后(100r/min的频率下震荡5分钟),使血细胞全部裂解;得全血裂解液。上述细胞裂解液的配方为:氯化铵8.29g、碳酸氢钾1g和edta-2na37.2mg,溶于1000ml超纯水中,搅拌溶解即可。准确吸取全血裂解液0.4ml于带盖离心管中,振荡混匀后,向其中准确加入乙酸乙酯3ml,振荡器漩涡(100r/min的频率)2min,8000r/min高速离心5min,分别得位于上层的乙酸乙酯层、位于下层的残渣。取出全部的上层乙酸乙酯;残渣再用2ml乙酸乙酯重复上述振荡器漩涡、高速离心(振荡器漩涡2min,8000r/min高速离心5min);即,残渣再重复萃取一次;合并两次萃取的乙酸乙酯(即,合并两次离心所得的乙酸乙酯层)于尖底玻璃离心管中,于45℃水浴中氮气流吹干,干燥物用0.2ml的20%(体积%)乙腈水溶液复溶,漩涡(100r/min的频率)混匀1min,18000r/min高速离心5min后,吸取上清液ⅰ;此上清液ⅰ的体积为0.2ml;即,高速离心产生的沉淀微乎其微,可忽略不计;2)、称取碱性硅藻土(ph为8.5的硅藻土)4g放入玻璃层析柱(10×200mm规格)中,振动(于100hz振动泵)处理5min;3)、然后将步骤1)中的0.2ml上清液i全部加入步骤2)的玻璃层析柱中,先用5ml纯水洗脱,然后用20%甲醇(v/v)溶液5ml洗脱;最后用5ml色谱甲醇洗脱,收集色谱甲醇所对应的全部洗脱液,于45℃水浴中氮气流吹干,干燥物用0.2ml的20%乙腈水溶液复溶,漩涡(100r/min的频率)混匀1min,18000r/min高速离心5min后,吸取上清液ⅱ20μl进高效液相色谱系统分析;上述洗脱时的流速均控制在5ml/min。4)、日本岛津shimadzu20at高效液相色谱系统,浙江大学智达n2000色谱工作站,色谱柱采用thermohypersilbdsc18色谱柱(3μm,250mm×4.6mm);流动相为乙腈-水-0.01m磷酸二氢钠(ph2.5)=60:5:35(v/v),流速1.0ml/min,柱温40℃,紫外检测波长254nm,进样量20μl。5)、以步骤4)所得的阿比特龙药物峰面积为y,代入公式y=27524x+1956.6(r2=0.9999)中,从而获得步骤3)所得的上清液ⅱ中的阿比特龙浓度x,该x的单位为μg/ml;该x即为待测全血中的阿比特龙浓度。对比例1、将实施例1步骤2)中的碱性硅藻土换成氧化铝填料,装入层析柱后不作振动处理,其余等同于实施例1的步骤1)~步骤4)。在0.05-20μg/ml浓度范围内标准曲线为:y=27465x–4627.8(r2=0.9947)。按照此对比例1-1进行“回收率和精密度”的实验,回收率和精密度结果如下表3所示:表3.全血中阿比特龙的回收率和精密度按照此对比例1进行“大鼠口服阿比特龙后全血阿比特龙含量测定”的实验,所得的血药浓度—时间曲线如图2所述。对比例2、将实施例1步骤3)中的“20%甲醇洗脱液”换成“50%甲醇洗脱液”,其余等同于实施例1。在0.05-20μg/ml浓度范围内标准曲线为:y=24196x+5548.8(r2=0.9985)按照此对比例2进行“回收率和精密度”的实验,回收率和精密度结果如下表4所示:表4.全血中阿比特龙的回收率和精密度按照此对比例2进行“大鼠口服阿比特龙后全血阿比特龙含量测定”的实验,所得的血药浓度—时间曲线如图3所述。对比例3-1、将实施例1步骤3)中的色谱柱由“bdsc18色谱柱(3μm,250mm×4.6mm)”改成“odsc18色谱柱(5μm,250mm×4.6mm)”;其余等同于实施例1。在0.05-20μg/ml浓度范围内标准曲线为:y=23457x+4693.5(r2=0.9973)按照此对比例3-1进行“回收率和精密度”的实验,回收率和精密度结果如下表5所示:表5.全血中阿比特龙的回收率和精密度按照此对比例3-1进行“大鼠口服阿比特龙后全血阿比特龙含量测定”的实验,所得的血药浓度—时间曲线如图4所述。对比例3-2、将实施例1步骤3)中的色谱柱由“bdsc18色谱柱(3μm,250mm×4.6mm)”改成“betasilc18色谱柱”;其余等同于实施例1。按照此对比例3-2进行“回收率和精密度”的实验,回收率和精密度结果如下表6所示:表6.全血中阿比特龙的回收率和精密度按照此对比例3-2进行“大鼠口服阿比特龙后全血阿比特龙含量测定”的实验,所得的血药浓度—时间曲线如图5所述。对比例4、将实施例1步骤3)中的流动相由“乙腈-水-0.01m磷酸二氢钠(ph2.5)=60:5:35(v/v)”改成“乙腈-水-0.01m磷酸二氢钠(ph3.5)=55:5:40(v/v)”;其余等同于实施例1。在0.05-20μg/ml浓度范围内标准曲线为:y=27537x–7944.7(r2=0.9918)。按照此对比例4进行“回收率和精密度”的实验,回收率和精密度结果如下表7所示:表7.全血中阿比特龙的回收率和精密度按照此对比例4进行“大鼠口服阿比特龙后全血阿比特龙含量测定”的,所得的血药浓度—时间曲线如图6所述。实验1、将以下3份待测品:全血a、全血b、全血c按照实施例1所述方法进行检测,得到阿比特龙药物峰面积(y),代入公式y=27524x+1956.6获得上清液中的阿比特龙浓度(x),再代入以下换算公式:x*20μl*10÷0.2ml,得待测全血中的阿比特龙浓度;所得结果如下表8;表8验证实验、按照hplc-ms方法对全血进行检测,所得的全血中阿比特龙浓度如下表9:表9全血中的阿比特龙浓度全血a0.022全血b0.33全血c2.78最后,还需要注意的是,以上列举的仅是本发明中阿比特龙的具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1