一种分析IC50剂量δ‑生育酚对RAW264.7和K562细胞的影响方法与流程
本发明涉及基于1hnmr代谢组学方法分析ic50剂量δ-生育酚对raw264.7和k562细胞的影响方法,属于细胞水平的代谢组学分析。
背景技术:
维生素e的生物活性:
维生素e是维持人体正常的新陈代谢和各项生理功能所必须的分子。并且,维生素e人体自身无法生成,需要通过食物从外界摄取。富含维生素e的食物包括杏仁、榛子、大豆以及鳄梨等。维生素e又名生育酚,根据甲基在色满环的位置以及数量,可分为以下八种α-toh、β-toh、γ-toh、δ-toh四种生育酚;α-tt、β-tt、γ-tt、δ-tt四种生育三烯酚。其中α-toh生物活性最大,γ-toh和δ-toh的活性分别仅占α-型的10%和1%;然而,抗氧化能力δ-toh最强,是α-toh抗氧化能力的100倍。维生素e具有多种生理功能,其中包括抗氧化,抗衰老,治疗冻伤,保护血管,保护细胞膜,甚至是信号转导和基因表达等。维生素e还能通过调控信号通路缓解肥胖症以及其代谢并发症,影响的通路包括wnt,jak-stat(thejanuskinase-signaltransducerandactivatoroftranscription),pi3k(thephosphatidylinositol3’-kinase)/akt/mtor(mammaliantargetofrapamycin)信号通路,而这些信号通路许多都与肿瘤活性相关。最近有研究人员发现γ-toh能够通过抑制有氧糖酵解抑制肿瘤发生。并且有报道称,维生素e的不同亚型在体内和体外具有不同的代谢途径。根据who(worldhealthorganization)数据表明正常成年人对维生素e(δ-tocopherol)的推荐摄入量(recommendednutrientintakes,rnis)为每天10mg,可耐受最高摄入量(tolerableupperintakelevel,ul)为1000mg。纳米银对小鼠肝原代细胞产生的毒性可以通过一定剂量的维生素e保护。在对小鼠不同癌变时期乳腺上皮细胞的毒性实验中发现,癌前病变时期,肿瘤时期和恶性肿瘤时期的乳腺上皮细胞δ-toh的ic50剂量分别为55μm,47μm和23μm。很早就有研究表明,维生素e能够修饰由于某些化疗药物引起的白细胞减少,从而对癌症的化疗治疗起到辅助作用。不同亚型的生育酚对巨噬细胞raw264.7的ic50浓度也不尽相同,结果显示δ-toh对小鼠巨噬细胞raw264.7的细胞活性影响大于α-toh的影响。过量的维生素e对细胞会造成怎样代谢组学方面的影响,很少有报道研究。
代谢组学的相关应用:
目前代谢组学已经在各个领域有广泛而成熟的应用,其中包括癌症治疗和中药成分研究等。这些都是基于代谢水平上分子定性以及定量的研究。伴随着代谢组学的发展,癌细胞与正常细胞的差异性也逐步确定。最近有研究表明,造血干细胞转移治疗癌症的方式可能导致骨髓增生异常综合症或急性髓细胞样白血病,这一过程包括丙氨酸和天冬氨酸代谢、二羧酸代谢、苯丙氨酸代谢、柠檬酸循环以及氨酰trna生物合成等代谢通路的调控。与此同时,对于raw264.7细胞系代谢组学方面的研究比k562细胞系相对要少。大部分对巨噬细胞代谢组学方向的研究侧重于δ-toh和γ-toh对其生物活性的影响。
因此,有必要研究δ-toh在小鼠巨噬细胞raw264.7和慢性髓性白血病胸腔积液淋巴细胞k562的ic50浓度时,对不同细胞差异性代谢产物以及代谢通路的影响,这有助于进一步了解δ-toh的亚毒性。
技术实现要素:
针对现有技术中的不足,本发明的第一个目的是提供一种ic50剂量δ-生育酚对raw264.7和k562细胞亚毒性的分析方法。
本发明采用的技术方案如下所述:
一种ic50剂量δ-生育酚对raw264.7或k562细胞亚毒性的分析方法,包括以下步骤:
(1)确定δ-生育酚对raw264.7或k562细胞的ic50剂量;
(2)细胞萃取液的制备:
δ-toh组细胞萃取液的制备:将raw264.7或k562细胞在相应的δ-生育酚ic50剂量下进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
空白组细胞萃取液的制备:将raw264.7或k562细胞进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
(3)核磁共振预处理:
将δ-toh组和空白组的水相旋转蒸干后采用含有(3-三甲基硅烷基)-2,2,3,3-四氘代丙酸钠(tsp)的d2o溶解,离心,冻干;将冻干之后的样品用d2o配制的磷酸盐缓冲液溶解,离心,得到上清液;
(4)1h核磁共振检测:将核磁共振预处理后的δ-toh组和空白组的上清液进行核磁共振检测,获得细胞核磁共振谱图,从而得到raw264.7或k562细胞样品中代谢物的信号值;
(5)差异性代谢物的筛选:将细胞核磁共振谱图的积分面积进行归一化处理,得到积分面积数据,使用偏最小二乘判别(pls-da)和正交-偏最小二乘判别(opls-da)分析数据,并采用排列实验和cv-anova进行验证筛选差异性变量,选取偏最小二乘判别(pls-da)中第一主成分的变量权重重要性排序值>0.1的代谢物作为差异性代谢物,并得到差异性代谢物的相对含量值,定量各个差异性代谢物的变化趋势;
(6)代谢通路分析:将确定的差异性代谢物导入京都基因与基因组百科全书数据库中,归属出相关的代谢通路;通过代谢组学数据分析软件metaboanalyst对差异性代谢物进行代谢通路富集分析,得到由差异性代谢物归属出的代谢影响分析通路以及代谢序列富集分析通路,代谢影响分析通路的通路影响值>0.1的代谢通路以及代谢序列富集分析通路的通路影响值<0.1的代谢通路均被识别为基于δ-生育酚组受到显著影响的通路;最后从所述受到显著影响的通路中筛选出具有代表性的代谢途径。
基于以上ic50剂量δ-生育酚对raw264.7或k562细胞亚毒性的分析,本发明的第二个目的是提供以下任一应用:
(1)促进甜菜碱代谢试剂在制备治疗由ic50剂量δ-生育酚引起的正常细胞亚毒性的试剂中的应用;
(2)降低无氧呼吸中丙酮酸代谢试剂在制备治疗由ic50剂量δ-生育酚引起的癌细胞亚毒性的试剂中的应用;或者为:乳酸拮抗剂/抑制剂在制备治疗由ic50剂量δ-生育酚引起的癌细胞亚毒性的试剂中的应用;
(3)δ-生育酚拮抗剂/抑制剂在制备促进哺乳动物体内甜菜碱代谢试剂中的应用;
(4)δ-生育酚拮抗剂/抑制剂在制备促进癌细胞的呼吸模式向有氧呼吸转化中的应用。
其中,促进甜菜碱代谢试剂为能够促进体内细胞中甜菜碱代谢的试剂,使得细胞体内的甜菜碱的含量增加。
降低无氧呼吸中丙酮酸代谢试剂为能够抑制无氧呼吸中丙酮酸代谢的试剂;乳酸拮抗剂/抑制剂为能够降低细胞中乳酸浓度/含量的试剂。δ-生育酚拮抗剂/抑制剂为能够降低细胞中ic50剂量或大于ic50剂量δ-生育酚浓度/含量的试剂;所述哺乳动物体内为小鼠巨噬细胞raw264.7或人白血病淋巴细胞k562;所述的正常细胞为小鼠巨噬细胞raw264.7,所述癌细胞为人白血病淋巴细胞k562。
本发明的第三个目的是提供一种ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物的筛选方法,包括以下步骤:
(1)确定δ-生育酚对raw264.7或k562细胞的ic50剂量;
(2)细胞萃取液的制备:
δ-toh组细胞萃取液的制备:将raw264.7或k562细胞在相应的δ-生育酚ic50剂量下进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
空白组细胞萃取液的制备:将raw264.7或k562细胞进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
(3)核磁共振预处理:
将δ-toh组和空白组的水相蒸发后采用含有(3-三甲基硅烷基)-2,2,3,3-四氘代丙酸钠(tsp)的d2o溶解,离心,冻干;将冻干之后的样品用d2o配制的磷酸盐缓冲液溶解,离心,得到上清液;
(4)1h核磁共振检测:将核磁共振预处理后的δ-toh组和空白组的上清液进行核磁共振检测,获得细胞核磁共振谱图,从而得到raw264.7或k562细胞样品中代谢物的信号值;
(5)差异性代谢物的筛选:
将细胞核磁共振谱图的积分面积进行归一化处理,得到积分面积数据,使用偏最小二乘判别(pls-da)和正交-偏最小二乘判别(opls-da)分析数据,并采用排列实验和cv-anova进行验证筛选差异性变量,选取偏最小二乘判别(pls-da)中第一主成分的变量权重重要性排序值>0.1的代谢物作为差异性代谢物。
本发明的第四个目的是提供一种ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物,包括:
raw264.7细胞的差异性代谢物为乙酸、赖氨酸、胆碱、精氨酸、丙氨酸、甲醇、半胱胺、甜菜碱和异丁酸;
k562细胞的差异性代谢物为亚牛磺酸、苏氨酸、甲醇、葡萄糖酸内酯、半胱胺、胍乙酸、乳酸、胆碱、甜菜碱、琥珀酸。
与现有技术相比,本发明的技术方案具有如下有益效果:
(1)本发明应用氢谱核磁共振技术结合代谢组学方法,研究了不同细胞差异性代谢物以及代谢通路的影响,提供了一种研究δ-生育酚对raw264.7或k562细胞的亚毒性的分析方法。
(2)对ic50剂量δ-生育酚作用于细胞后地差异性代谢产物进行非靶向分类,无需对某一或某些靶向物质进行一一定性定量测定。
(3)核磁谱图经mestrenova6.11和simca-p+12.0软件进行多元统计分析建立pca模型、pls-da模型和opls-da模型,发现δ-toh组和空白组代谢物能够明显区分,便可进行差异性代谢产物的归属和通路富集。
(4)ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物为两种细胞的代谢通路分析提供基础。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1是δ-toh对raw264.7和k562细胞活性的影响,注:***p<0.005vs空白组。
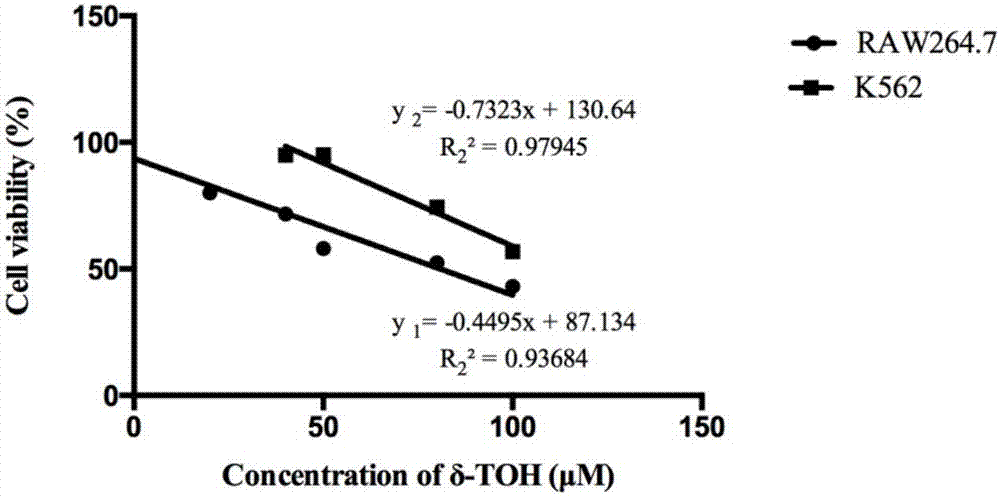
图2是根据(图1)得到两种细胞系的回归方程。
图3是助溶剂浓度的乙醇对细胞活性的影响。
图4是raw264.7细胞1h-nmr谱图。
图5是k562细胞1h-nmr谱图。
图6是raw264.7组的pca得分图。
图7是k562组的pca得分图。
图8是raw264.7组的pls-da得分图。
图9是k562组的pls-da得分图。
图10是raw264.7组的排列实验模型图。
图11是k562组的排列实验模型图。
图12是raw264.7组的opls-da得分图。
图13是k562组的opls-da得分图。
图14是raw264.7细胞中由差异性代谢产物归属出的代谢通路分析;其中,a是raw264.7细胞中由差异性代谢产物归属出的代谢通路;(1)氨酰trna的生物合成。(2)甘氨酸、丝氨酸和苏氨酸代谢。(3)赖氨酸生物合成。(4)生物素代谢。(5)牛磺酸和亚牛磺酸代谢。(6)甲烷代谢。(7)含硒氨基酸代谢。(8)赖氨酸降解。(9)丙酮酸代谢。(10)丙氨酸、天冬氨酸和谷氨酸代谢。(11)糖酵解和糖异生作用。(12)甘油磷脂代谢。(13)精氨酸和脯氨酸代谢。b是raw264.7细胞代谢产物组富集概述图,由上至下分别为:蛋白质的生物合成、甜菜碱代谢、尿素循环、蛋氨酸代谢、生物素代谢、丙氨酸代谢、牛磺酸和亚牛磺酸代谢、葡糖糖-丙氨酸循环、赖氨酸降解、含硒氨基酸代谢、磷脂生物合成、丙酮酸代谢、甘氨酸丝氨酸和苏氨酸代谢、精氨酸和脯氨酸代谢。
图15是k562细胞中由差异性代谢产物归属出的代谢通路分析;a是k562细胞中由差异性代谢产物归属出的代谢通路;(1)甘氨酸、丝氨酸和苏氨酸代谢。(2)牛磺酸和亚牛磺酸代谢。(3)缬氨酸、亮氨酸和异亮氨酸的生物合成。(4)糖酵解和糖异生作用。(5)磷酸戊糖途径。(6)丙酮酸代谢。(7)甲烷代谢。(8)丙酸代谢。(9)甘油磷脂代谢。(10)氨酰trna生物合成。(11)精氨酸和脯氨酸代谢。(12)卟啉与叶绿素代谢。b是k562细胞代谢产物组富集概述图;由上至下分别为:甘氨酸丝氨酸和苏氨酸代谢、牛磺酸和亚牛磺酸代谢、甜菜碱代谢、蛋氨酸代谢、磷酸戊糖途径、蛋白质生物合成、磷脂代谢、丙酮酸代谢、精氨酸和脯氨酸代谢、糖异生。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
本发明对术语的解释:
亚毒性:是指具有毒性或有小毒而未列入国务院《医疗用毒性药品管理法》规定的有毒中药品种,临床使用过量或应用不当会中毒或产生严重不良反应,应用或药房管理上需加以注意。
ic50(halfmaximalinhibitoryconcentration):是指被测量的拮抗剂的半抑制浓度
raw264.7:小鼠腹腔巨噬细胞细胞系,也是常用的炎症细胞模型之一。
k562是人慢性髓性白血病胸腔积液淋巴细胞。
topspin3.2是一种核磁分析软件。
simca-p软件为多元分析软件。
pca:主成分分析(principalcomponentsanalysis),是一种无监督的模式统计方法。通过正交变换将一组可能存在相关性的变量转换为一组线性不相关的变量,转换后的这组变量叫主成分。
pls-da:偏最小二乘判别(partialleastsquaresprojectiontolatentstructure-discriminantanalysis),是一种有监督的模式统计方法,利用偏最小二乘法对数据结构进行投影分析。
opls-da:正交-偏最小二乘判别分析(orthogonal-pls-da),将正交信号校正方法(orthogonalsignalcorrection,osc)与pls-da进行结合从而对pls-da进行修正的分析方法。
京都基因和基因组百科全书(kegg)是系统分析基因功能、联系基因组信息和功能信息的数据库。
metaboanalyst:是一种代谢组学数据分析网站,能够由差异性代谢产物归属出代谢通路。
正如背景技术中所介绍的,现有技术中缺少一种ic50剂量δ-生育酚对raw264.7和k562细胞的影响分析方法,针对以上技术问题,本发明的目标是采用半抑制浓度(ic50)δ-toh处理raw264.7细胞和k562细胞两种细胞系,利用核磁共振氢谱分析比较两种细胞系在代谢水平的变化。针对此,本发明的第一个方面,提出一种ic50剂量δ-生育酚对raw264.7或k562细胞亚毒性的分析方法,该方法包括以下步骤:
(1)确定δ-生育酚对raw264.7或k562细胞的ic50剂量;
采用mtt法确定δ-生育酚对raw264.7或k562细胞的ic50剂量,其中,raw264.7的ic50为80μm,k562的ic50为110μm。
(2)细胞萃取液的制备:
δ-toh组细胞萃取液的制备:将raw264.7或k562细胞在相应的δ-生育酚ic50剂量下进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,收集水相;
空白组细胞萃取液的制备:将raw264.7或k562细胞进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
在制备细胞萃取液的过程中,针对raw264.7或k562细胞这两种细胞的组织结构和成分,为了保证尽可能多的获取δ-toh组细胞和空白组细胞代谢物信息,提取试剂优先选用的是甲醇、氯仿和超纯水的混合溶剂,对细胞样品进行多次超声破碎提取,提取后即可进行核磁共振预处理,前处理步骤简单,易于操作。
为达到较好的提取代谢物的效果、更有利于提高后续差异性代谢物、代谢通路分析的准确性,本发明采用的提取剂为甲醇、氯仿和超纯水的混合溶液,体积比例为4:4:2.8~2.9,在本发明的优选的技术方案中,甲醇、氯仿和超纯水的体积比例为4:4:2.85。在本发明的优选的技术方案中,一共超声5次,超声一分钟停一分钟。
(3)核磁共振预处理:
将δ-toh组和空白组的水相蒸发后采用含有(3-三甲基硅烷基)-2,2,3,3-四氘代丙酸钠(tsp)的d2o溶解,离心,冻干;将冻干之后的样品用d2o配制的磷酸盐缓冲液溶解,离心,得到上清液;
核磁共振待测样品制备阶段,样品的预处理方法会对核磁共振检测结果和主成分分析的准确性产生影响,由于代谢组学需要高通量的试验数据,必须保证数据的稳定性和可比较性,本基于对核磁共振检测影响,本发明建立了针对raw264.7或k562细胞萃取液的预处理方法。故在本发明的优选的技术方案中,核磁共振预具体的处理方法是:将δ-toh组和空白组的水相蒸干后用900μl含有0.1%(w/w)tsp的d2o溶解,离心后取上清液冻干,将冻干的样品用d2o配制的磷酸盐缓冲液溶解至650μl,离心后取上清液至核磁管中,待测。
(4)核磁共振检测:将核磁共振预处理后的δ-toh组和空白组的上清液进行核磁共振检测,获得细胞核磁共振谱图,从而得到raw264.7或k562细胞样品代谢物的信号值,该信号值指的是不同化学位移处的核磁信号,每个信号峰既包含了代谢物的定性信息,也包含了定量信息,定性信息就是该代谢物的特征谱图和化学位移,定量信息就是该代谢物的核磁响应强度,如峰高、峰面积;
核磁共振样品检测阶段中,核磁共振的检测参数对核磁共振检测结果产生影响,代谢组学是一种需要高通量试验数据的技术,必须保证试验数据的稳定性,本发明筛选优化得到一套针对raw264.7或k562细胞萃取液的核磁共振检测条件。所有的核磁共振氢谱都采用配备了13c、1h双优化5mmcptci三共振反式超低温探头的iii600mhz超导超屏蔽傅立叶变换核磁共振波谱仪检测。其中质子共振频率为600.104mhz,脉冲序列为zg30,谱宽为12019.230hz,累加次数为256次,空采次数为2次,实验温度为298k,使用topspin3.2(brukerbiospin,germany)处理谱图。
(5)差异性代谢物的筛选:核磁共振谱图使用mestrenova6.11(mestrelabresearch,espain)处理,所有谱图添加指数窗函数(exponential:0.5),以提高信噪比。手动相位矫正,基线矫正后,用tsp定标,手动切除水峰,选取0.002ppm为间隔标准分段积分,这一间隔标准能够提高细胞萃取液谱峰的识别度,减小核磁共振谱峰重叠引起的误差,之后对谱图积分面积进行归一化。积分面积数据以excel文件保存,分组编号。之后,将数据导入simca-p+12.0软件(umetricsinc.,umea,sweden)中。使用偏最小二乘判别分析(pls-da)和正交偏最小二乘判别分析(opls-da)分析数据。为了确保pls-da和opls-da模型建立的可信性,运用排列实验和cv-anova进行验证筛选差异性变量。根据第一主成分的变量权重重要性排序值(vip)和载荷权重(loadingweights)确定差异性代谢产物。选取在偏最小二乘判别分析(pls-da)中vip值大于1的物质,判定为差异性代谢产物。载荷权重的正负代表相关差异性代谢产物在空白组与δ-toh组中的上下调关系。最后通过人类代谢组数据库(hmdb)以及生物核磁共振数据库(bmrb)进行定性分析,得到差异性代谢产物的种类名称。
(6)代谢通路分析:将确定的差异性代谢产物导入京都基因与基因组百科全书(kegg)数据库获得kegg号,然后metaboanalyst(metpa)中进行通路富集分析,得到由差异性代谢物归属出的代谢影响分析通路以及代谢序列富集分析通路,代谢影响分析通路的通路影响值>0.1的代谢通路以及代谢序列富集分析通路的通路影响值<0.1的代谢通路均被识别为基于δ-生育酚组受到显著影响的通路;最后从所述受到显著影响的通路中筛选出具有代表性的代谢途径。为得到具有代表性的代谢途径,将蛋白质生物合成、各种氨基酸或牛磺酸和亚牛磺酸的代谢排除,因为当细胞受到ic50剂量δ-toh作用时,上述的代谢途径均为常规的代谢途径,也就是说当细胞处于δ-toh的ic50浓度时,蛋白质生物合成、各种氨基酸或牛磺酸和亚牛磺酸的代谢属于细胞的基础代谢途径,因此,并不可以作为代表性的代谢途径。
这些代表性的代谢途径指示了δ-toh对raw264.7和k562细胞影响的具体生物学过程,如代谢的上下调及呼吸模式的转变。
结果发现δ-toh能够影响两种细胞系的蛋白质生物合成、甜菜碱代谢、尿素循环等多条代谢通路。经δ-toh处理后细胞代谢物水平发生变化,产生了相应的差异性代谢产物。
raw264.7细胞中甜菜碱显著降低,k562细胞中乳酸明显增加,导致呼吸模式向无氧呼吸转化。实验结果有助于进一步了解δ-toh的亚毒性。
基于上述ic50剂量δ-生育酚对raw264.7或k562细胞亚毒性的分析研究,本发明的第二个方面,提出下述任一应用:
(1)促进甜菜碱代谢试剂在制备治疗由ic50剂量δ-生育酚引起的正常细胞亚毒性的试剂中的应用;
(2)降低无氧呼吸中丙酮酸代谢试剂在制备治疗由ic50剂量δ-生育酚引起的癌细胞亚毒性的试剂中的应用;或者为:乳酸拮抗剂/抑制剂在制备治疗由ic50剂量δ-生育酚引起的癌细胞亚毒性的试剂中的应用;
(3)δ-生育酚拮抗剂/抑制剂在制备促进哺乳动物体内甜菜碱代谢试剂中的应用;
(4)δ-生育酚拮抗剂/抑制剂在制备促进白血病淋巴细胞的呼吸模式向有氧呼吸转化中的应用。
其中,促进甜菜碱代谢试剂为能够促进体内细胞中甜菜碱代谢的试剂,使得细胞体内的甜菜碱的含量增加。
降低无氧呼吸中丙酮酸代谢试剂为能够抑制无氧呼吸中丙酮酸代谢的试剂;乳酸拮抗剂/抑制剂为能够降低细胞中乳酸浓度/含量的试剂。
δ-生育酚拮抗剂/抑制剂为能够降低细胞中ic50剂量大于ic50剂量δ-生育酚浓度/含量的试剂;所述哺乳动物体内为小鼠巨噬细胞raw264.7或人白血病淋巴细胞k562。
上述应用的提出,为治疗由ic50剂量δ-生育酚引起的细胞亚毒性提供了一定的基础和参考。
本发明的第三个方面,提供一种ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物的筛选方法,其包括以下步骤:
(1)确定δ-生育酚对raw264.7或k562细胞的ic50剂量;
(2)细胞萃取液的制备:
δ-toh组细胞萃取液的制备:将raw264.7或k562细胞在相应的δ-生育酚ic50剂量下进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
空白组细胞萃取液的制备:将raw264.7或k562细胞进行培养,培养后加入冷甲醇使细胞代谢淬灭,然后采用甲醇氯仿水提取法进行超声破碎提取,离心收集水相;
(3)核磁共振预处理:
将δ-toh组和空白组的水相蒸发后采用含有(3-三甲基硅烷基)-2,2,3,3-四氘代丙酸钠(tsp)的d2o溶解,离心,冻干;将冻干之后的样品用d2o配制的磷酸盐缓冲液溶解,离心,得到上清液;
(4)1h核磁共振检测:将核磁共振预处理后的δ-toh组和空白组的上清液进行核磁共振检测,获得细胞核磁共振谱图,从而得到raw264.7或k562细胞样品中代谢物的信号值;
(5)差异性代谢物的筛选:将细胞核磁共振谱图的积分面积进行归一化处理,得到积分面积数据,将积分面积数据进行偏最小二乘法-判别分析,选取变量权重重要性排序>0.1的代谢物作为差异性代谢物。
每一步的具体技术方案可参照本发明的第一个方面。
本发明的第四个方面,提供一种ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物,包括:
raw264.7细胞的差异性代谢物为乙酸、赖氨酸、胆碱、精氨酸、丙氨酸、甲醇、半胱胺、甜菜碱和异丁酸;
k562细胞的差异性代谢物为亚牛磺酸、苏氨酸、甲醇、葡萄糖酸内酯、半胱胺、胍乙酸、乳酸、胆碱、甜菜碱、琥珀酸。
ic50剂量δ-生育酚对raw264.7或k562细胞的差异性代谢物为两种细胞的代谢通路分析提供基础。
本发明的主要技术创新
(1)应用代谢组学方法结合1hnmr技术分析ic50剂量δ-生育酚对raw264.7和k562细胞的影响,寻找差异性代谢产物。
不同于之前对δ-生育酚性质的研究局限于其对细胞水平的影响,本发明结合代谢组学多元分析统计方法,通过1hnmr技术建立模型,完成对δ-生育酚处理前后样品的分组,并归属相应的差异性代谢产物及通路。
(2)该检测方法,通过冷甲醇猝灭ic50剂量δ-生育酚处理的细胞,核磁前处理后进行1hnmr分析。核磁共振谱图使用mestrenova6.11(mestrelabresearch,espain)处理。之后,将数据导入simca-p+12.0软件(umetricsinc.,umea,sweden)中。使用主成分分析(pls-da)和正交偏最小二乘判别分析(opls-da)分析数据,寻找差异性代谢产物。通过人类代谢组数据库(hmdb)以及生物核磁共振数据库(bmrb)进行定量分析。将确定的差异性代谢产物导入京都基因与基因组百科全书(kegg)数据库以及metaboanalyst(metpa)中进行通路富集分析。
(3)细胞前处理方法操作简单,提取试剂优先选用的是甲醇、氯仿和超纯水的混合溶剂,对细胞样品进行多次超声破碎提取,提取后即可进行核磁共振预处理,前处理步骤简单,易于操作。
(4)核磁共振预处理方法操作简单,从主成分分析的分析结果可知,通过该核磁共振预处理方法,主成分分析模型拟合的较好,模型的预测准确性高,同组内差异性较小,不同组的样品分离更加明显。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1
1、基本方法原理
确定δ-生育酚对raw264.7和k562细胞的ic50剂量,应用核磁共振波谱仪(具体是avanceiii600mhz全数字化超导)检测样品,使用topspin3.2(brukerbiospin,germany)处理谱图。核磁共振谱图使用mestrenova6.11(mestrelabresearch,espain)处理。之后,将数据导入simca-p+12.0软件(umetricsinc.,umea,sweden)中。使用主成分分析(pls-da)和正交偏最小二乘判别分析(opls-da)分析数据,寻找差异性代谢产物。通过人类代谢组数据库(hmdb)以及生物核磁共振数据库(bmrb)进行定性分析,确定差异性代谢物的种类名称。将确定的差异性代谢产物导入京都基因与基因组百科全书(kegg)数据库以及metaboanalyst(metpa)中进行通路富集分析。
2、仪器与材料
仪器与设备:
波谱仪
材料与试剂:
3、细胞培养
巨噬细胞raw264.7细胞和k562细胞购于中科院上海细胞库。培养基使用dmem添加100u/ml青霉素、100μg/ml链霉素、10μg/ml谷氨酰胺以及10%胎牛血清。k562细胞使用rpmi1640培养基培养,添加因子与巨噬细胞培养基中添加的相同。细胞都在37℃恒温co2培养箱中培养,培养箱中通入含5%co2的湿润空气。δ-toh组添加的δ-toh用0.5%的乙醇溶解添加到培养基中。
4、细胞活性检测
使用mtt实验检测δ-toh对细胞活性的影响。细胞悬液调整浓度至每孔1×105个细胞铺板于96孔板中,37℃培养8h。之后移除培养基并添加含不同浓度δ-toh的培养基(20,40,50,80,100μm),37℃培养48h。每孔加入20μl的mtt后继续37℃培养4h。之后,移除孔中培养基,每孔添加150μl的二甲基亚砜(dmso),室温摇匀培养20分钟。由于k562是悬浮细胞,因此该细胞的96孔板移除培养基添加dmso之前需要1,000rmp离心10分钟。将细胞96孔板用酶标仪检测492nm处的吸光值。
5、细胞萃取液制备
根据mtt实验结果,δ-toh作用于raw264.7和k562的ic50分别为80μm和110μm。细胞在相应的δ-toh浓度下37℃培养48h后,弃去原培养液,用pbs清洗3次,加入4ml冷甲醇使细胞代谢猝灭,使用细胞刮直接将细胞刮离培养皿。以2.85:4:4的体积比例加入超纯水、甲醇和三氯甲烷。混合液涡旋震荡后,细胞悬液进行超声破碎细胞。采用超停各1min,共进行5次,超声时间共5min,超声全过程需在冰浴中进行。之后12,000rpm,4℃,离心30分钟,将水相和有机相分离,收集水相。有机相按比例补充超纯水和甲醇再次离心,重复3次后收集水相。上清液保存于-80℃。
6、核磁共振(nmr)预处理
上清液60℃旋转蒸发后用900μl含有0.1%tsp的d2o溶解。样品12,000rpm,4℃,离心15分钟后冻干。之后冻干的样品用d2o配制的磷酸盐缓冲液溶解至650μl,12,000rpm,4℃,离心15分钟,取上清液550μl至5mm核磁管中,待测。
7、核磁共振谱图分析
所有的核磁共振氢谱都采用配备了13c、1h双优化5mmcptci三共振反式超低温探头的iii600mhz超导超屏蔽傅立叶变换核磁共振波谱仪检测。其中质子共振频率为600.104mhz,脉冲序列为zg30,谱宽为12019.230hz,累加次数为256次,空采次数为2次,实验温度为298k,使用topspin3.2(brukerbiospin,germany)处理谱图。
8、成果展示
(1)δ-toh对细胞活性的影响
为了确定δ-toh对raw264.7和k562细胞活性的影响,本发明用含有不同浓度δ-toh的培养基处理细胞,细胞活性的影响如图1所示。mtt实验结果表明,δ-toh处理细胞48h后有明显抑制作用,并且确定了两种细胞不同的ic50。
根据生长曲线图2,得出raw264.7的ic50为80μm,k562的ic50为110μm。
同时,用溶解δ-toh浓度的乙醇处理细胞,发现对两种细胞系的细胞活性无明显影响,如图3所示。
以上实验结果表明巨噬细胞raw264.7和白血病细胞k562对δ-toh的耐受性和敏感性不同。
(2)核磁共振谱图分析
根据raw264.7和k562两种细胞水相萃取物的核磁共振氢谱谱图,能够确定相应的差异性代谢产物并进一步进行多元统计分析。两种细胞系各自δ-toh组和空白组的重叠谱图如图4和5所示。从谱图中可见,δ-toh组和空白组相比,两者的信号峰具有较大的差异,这预示着δ-toh组和空白组中的具有差异性代谢物,而且代谢物的种类非常多。
(3)多元统计分析
将核磁共振谱图使用mestrenova6.11(mestrelabresearch,espain)处理,所有谱图添加指数窗函数(exponential:0.5),以提高信噪比。手动相位矫正,基线矫正后,用tsp定标,手动切除水峰,选取0.002ppm为间隔标准分段积分,之后对谱图积分面积进行归一化。积分面积数据以excel文件保存,分组编号。之后,将数据导入simca-p+12.0软件(umetricsinc.,umea,sweden)中。使用主成分分析(pls-da)和正交偏最小二乘判别分析(opls-da)分析数据。为了确保pls-da和opls-da模型建立的可信性,运用排列实验和cv-anova进行验证筛选差异性变量。根据第一主成分的变量权重重要性排序值(vip)和载荷权重(loadingweights)确定差异性代谢产物。选取在偏最小二乘判别分析(pls-da)中vip值大于1的物质,判定为差异性代谢产物。载荷权重的正负代表相关差异性代谢产物在空白组与delta-toh组中的上下调关系。最后通过人类代谢组数据库(hmdb)以及生物核磁共振数据库(bmrb)进行定性分析,得到差异性代谢产物的种类名称,如表1和表2。
将vip值由大到小排列,取vip≥1的化学位移。其中vip值越大对差异性分组贡献越大。两种细胞系的化学位移确定的差异性代谢产物见表1和2。为了更好的比较差异性代谢产物的上下调程度,将差异性代谢产物的积分面积进行归一化处理。使用积分面积同时乘以1000的方式得到相对值(relativevalue),定量各个代谢产物具体的变化趋势进行比较。raw264.7和k562与各自空白组的比较结果见表3和4。
表1.raw264.7细胞中归属的差异性代谢产物以及对应的化学位移
表2.k562细胞中归属的差异性代谢产物以及对应的化学位移s-单峰;d-双峰;t-三峰
表3.raw264.7细胞中δ-toh组与空白组比较的差异性代谢产物的相对值和变化趋势dd-双双峰;q-四峰
表4.k562细胞中δ-toh组与空白组比较的差异性代谢产物的相对值和变化趋势
simca-p软件中进行多元统计分析的pca和pls-da分析结果表明,对于raw264.7和k562细胞,δ-toh组和空白组能够分开。两种细胞的得分图(图6和图7)和载荷图表明,两种细胞经过δ-toh处理后都有各自的差异性代谢产物。
首先,使用pca模型对数据进行降维处理,提取数据集中的大部分信息观察空白组和δ-toh组的自然分组状况。结果显示对于raw264.7细胞来说,δ-toh组和空白组能够从第一主成分和第二主成分上明显区分(pc1:88.38%;pc2:9.16%)。同样地,k562的δ-toh组和空白组也能在其第一主成分和第二主成分上有良好的区分(pc1:61.01%;pc2:20.45%)。pca作为无师监督的分析方法,只能反应数据的原始状况。但是,在实验的实际操作中存在许多因子影响结果的准确性,例如环境或某些系统性错误。为了获取更为准确的分组情况,尽可能排除这些外在影响因子,我们使用有师监督的分析方法pls-da和opls-da处理数据。
评价pls-da模型拟合的效果通常采用r2x,r2y和q2这三个指标。r2x和r2y能够表示模型中x和y矩阵的百分比,而q2意味着模型的预测能力。以上三个指标数值越接近于1,说明模型的可信度越高。raw264.7细胞系建立的pls-da模型拟合的较好(r2x=0.975,r2y=0.981,q2=0.972),如图8所示。
同样,k562细胞系建立的pls-da模型也拟合良好(r2x=0.813,r2y=0.964,q2=0.964),如图9所示。
通过排列实验可以验证模型的有效性,结果表明两条回归方程的斜率较大,任意r2和q2的值都小于最右侧的点,r2和q2的回归方程最右侧的值差距较小,这表明模型没有过拟合。观察两个细胞系排列实验结果图,如图10和11所示,说明raw264.7和k562所建立的pls-da模型都没有过拟合。
利用opls-da分析建立raw264.7细胞的模型,根据得分图(图12)能够发现空白组和δ-toh组能够最大程度的得到区分并且能够降低组内差异。
k562细胞建立opls-da模型,对其得分图(图13)观察发现也能够很好的区分。
结合相应的vip值能够得到差异性代谢产物,其中raw264.7有9种差异性代谢产物,k562有10种。同时,可以通过cv-anova(协自变量-方差分析)的p值能够验证opls-da模型的有效性,p值大于0.05证明模型验证有意义。两种细胞根据cv-anova得到的p值都小于0.05(raw264.7细胞系的p值为0.00164;k562细胞系的p值为0.02044),表明所建立的opls-da模型都具有意义。
(4)代谢通路分析
为了研究δ-toh作用于raw264.7和k562细胞相关生物标志物的代谢通路,本发明将筛选得到的差异性代谢物通过kegg数据库确定kegg号,然后再通过metaboanalyst(metpa)(网址:http://www.metaboanalyst.ca/)归属出这些差异性代谢物的代谢通路,从而探究差异性代谢物与代谢通路之间的相互作用关系。raw264.7细胞相关的9个差异性代谢产物归属出13条代谢通路,包括:(1)氨酰trna的生物合成;(2)甘氨酸、丝氨酸和苏氨酸代谢;(3)赖氨酸生物合成;(4)生物素代谢;(5)牛磺酸和亚牛磺酸代谢;(6)甲烷代谢;(7)含硒氨基酸代谢;(8)赖氨酸降解;(9)丙酮酸代谢;(10)丙氨酸、天冬氨酸和谷氨酸代谢;(11)糖酵解和糖异生作用;(12)甘油磷脂代谢;(13)精氨酸和脯氨酸代谢。而k562细胞相关的11个生物标记物归属出12条相关代谢通路,包括:(1)甘氨酸、丝氨酸和苏氨酸代谢;(2)牛磺酸和亚牛磺酸代谢;(3)缬氨酸、亮氨酸和异亮氨酸的生物合成;(4)糖酵解和糖异生作用;(5)磷酸戊糖途径;(6)丙酮酸代谢;(7)甲烷代谢;(8)丙酸代谢;(9)甘油磷脂代谢;(10)氨酰trna生物合成;(11)精氨酸和脯氨酸代谢;(12)卟啉与叶绿素代谢。
为了进一步确定这些代谢通路对δ-toh作用影响的大小,我们使用metpa进行分析。metpa能够根据代谢信息数据库(kegg)得到相应代谢物的kegg序列号(keggid),利用计算机自动对不同代谢物的生化变化进行分组,从而寻找出相关度最高的代谢通路和疾病。将上述物质(raw264.7的9种差异性代谢物和k562的10种差异性代谢物)导入metpa软件中,通过两种数据库归属代谢通路。一种是路径分析,即整合富集分析和路径拓扑分析,该模型能够对21种模式生物进行可视化分析。所得结果以通路影响特性作为横坐标,代表代谢通路富集重要性的-logp值为纵坐标,计算代谢通路重要性的拓扑分析进行作图。代谢途径影响的-logp值越大,不同分组之间的代谢相关性越高,图中的圆圈越大颜色越深位于右上角区域。两种细胞得到的路径分析图见图14a和15a。另一种是对人类和哺乳动物的代谢物组富集分析(msea),基于数据库中的大约6300组代谢物组进行的通路归属分析。本实验选取表征分析(overrepresentaionanalysis,ora)作为富集分析算法,该方法只需要将对应化合物的kegg序列号导入即可进行后续分析。该模型通过传统的特征选择方法或是聚类算法检测有意义的生物模式。
通路分析结果显示两种细胞系经δ-toh处理后有若干路径发生了都改变,如氨酰trna生物合成,甘氨酸、丝氨酸和苏氨酸代谢,牛磺酸和亚牛磺酸代谢,丙酮酸代谢,糖酵解和糖异生以及甘油磷脂代谢。然而,在两种细胞中也有一些不同的代谢途径发生了改变。在raw264.7细胞中,赖氨酸生物合成和降解,生物素代谢,含硒氨基酸代谢以及丙氨酸、天冬氨酸和谷氨酸这些通路发生了改变,但在k562细胞中都没有发生明显变化。
同样,缬氨酸、亮氨酸和异亮氨酸的生物合成,磷酸戊糖途径,丙酸代谢,精氨酸和脯氨酸代谢以及卟啉和叶绿素代谢都只在k562细胞中发生了明显变化。这些通路的功能确实可能表明线粒体功能障碍和自由基(ros)清除能力的下降。这些在两种细胞系中不同的代谢路径变化,可能意味着δ-toh作用于巨噬细胞和白血病细胞所产生的不同分子机制方面的影响。
通过代谢物组富集分析,我们能够发现生物标记物能够归属到确定的代谢通路。在raw264.7细胞中,蛋白质合成、氨基酸代谢、丙酮酸代谢、糖酵解和糖异生的异常引发了细胞的代谢障碍(图14b)。而对k562进行分析,发现相似的氨基酸代谢、蛋白质合成、丙酮酸代谢和糖酵解以及糖异生发生了异常(图15b)。
在分析经过δ-toh处理后细胞中的代表性的代谢途径时,综合分析两种图,首先分析路径分析图(如图14a和图15a),通路影响特性值大于0.1的通路被识别为受到显著影响的通路,其可信度高,可以用来分析,比如图15a,同时需要分析代谢物组富集分析图(如图14b和图15b),在图14b和图15b中,pvalue小于0.1时代表其为受到显著影响的代谢途径(注图中8e-04代表8×10-4)。为得到具有代表性的代谢途径,将蛋白质生物合成、各种氨基酸或牛磺酸和亚牛磺酸的代谢排除,因为当细胞受到ic50剂量δ-toh作用时,上述的代谢途径均为常规的代谢途径,也就是说当细胞面临被杀灭的威胁时,蛋白质生物合成、各种氨基酸或牛磺酸和亚牛磺酸的代谢属于细胞的一种常规的代谢途径,因此,并不可以作为代表性的代谢途径。
分析图14b,针对raw264.7细胞,甜菜碱代谢为其代表性的代谢途径,也就是说,δ-生育酚对raw264.7细胞的亚毒性的影响体现在甜菜碱代谢途径上。
分析图15a,针对k562细胞,丙酮酸代谢为其代表性的代谢途径(通路影响特性值大于0.1),也就是说,δ-生育酚对k562细胞的亚毒性的影响体现在丙酮酸代谢途径上。
综上,raw264.7细胞在δ-toh的ic50剂量的作用下,甜菜碱代谢降低,这与巨噬细胞生长受到抑制相符合。对于白血病细胞k562来说,经ic50剂量的δ-toh处理后,乳酸含量增加导致呼吸模式向无氧呼吸转化。在两种细胞中,半胱胺的含量都是减少的。乳酸的含量在k562细胞中增加,但在raw264.7细胞中没有明显变化。
raw264.7和k562经过δ-toh处理后,在蛋白质的生物合成、甜菜碱代谢、尿素循环以及呼吸方式上都有明显的变化。这可能说明了δ-toh会以不同的代谢途径对细胞生理功能产生影响。关于δ-toh对raw264.7和k562细胞的影响可以通过差异性代谢产物和富集到的通路来表述。这些代谢通路可以解释δ-toh作用于细胞后对其生理功能的影响。然而,由于δ-toh作用的细胞不同,代谢产物水平影响的通路也不尽相同。实验结果表明甜菜碱代谢在raw264.7细胞中降低(表3),而在k562细胞中升高(表4)。众所周知,甜菜碱是生物学中公认的甲基供体,它能够促进dna和rna合成。已经有研究表明,甜菜碱能够抑制raw264.7细胞对肿瘤坏死因子(tnf-α)、白介素-6(il-6)、诱导型一氧化氮合酶(inos)、环氧合酶-2(cox-2)等炎症因子的分泌。但也有研究表明,甜菜碱能够缓解大鼠的氧化应激以及炎症反应。因此,巨噬细胞在δ-toh作用的ic50浓度时,细胞dna和rna合成减少,但是炎症因子究竟变化如何还有待进一步研究。在慢性脑缺血大鼠模型中,甜菜碱可能通过抑制丙二醛(mda)和活性氧(ros),同时增加超氧化物歧化酶(sod)和谷胱甘肽(gsh),以此来降低氧化应激水平。由于胆碱是甜菜碱的前体,所以它在两种细胞中变化的趋势与甜菜碱相同。
在两种细胞变化的代谢通路中都存在牛磺酸和亚牛磺酸代谢。牛磺酸是一种具有多种生理活性的半必需氨基酸,它能够影响多数哺乳动物细胞的线粒体功能、细胞凋亡以及抗氧化防御。已有研究表明牛磺酸能够作为神经胶质瘤细胞凋亡的标志物,这意味着在k562细胞中亚牛磺酸的降低可能用于合成更多的牛磺酸,从而引发细胞在ic50凋亡的产生。有研究表明胱胺具有许多重要的代谢物,例如半胱胺、牛磺酸、亚牛磺酸等等。在两种细胞中,半胱胺的含量都是减少的,这可能意味着δ-toh在半胱胺代谢方面以相似的方式调控巨噬细胞和白血病细胞。
乳酸的含量在k562细胞中增加,但在raw264.7细胞中没有明显变化。这说明δ-toh可能通过促进丙酮酸代谢改变k562细胞供能方式,将有氧呼吸转化为无氧呼吸,降低了细胞供能效率。我们还能够发现,在raw264.7细胞中尿素循环减弱并且精氨酸增多,这意味着和尿素循环相关的三羧酸循环可能降低了细胞供能。相反,在k562细胞中作为尿素合成底物的琥珀酸则有下降趋势。实际上,琥珀酸的积累可能导致细胞开启无氧呼吸模式。然而,k562细胞无氧呼吸的加强意味着细胞更多的聚集在一起,导致低氧的肿瘤微环境产生,进而增强k562细胞侵袭和转移的能力。综上所述,当细胞经δ-toh处理后,两种细胞以不同的代谢途径改变了细胞呼吸水平,其中k562有氧呼吸转化为无氧呼吸,导致癌细胞转移能力增强。
综上,raw264.7细胞在δ-toh的ic50剂量的作用下,甜菜碱代谢降低,这与巨噬细胞生长受到抑制相符合;与此同时,在δ-toh的ic50剂量下甜菜碱对炎症因子的分泌以及氧化应激的作用还有待研究。对于白血病淋巴细胞k562来说,经ic50剂量的δ-toh处理后,乳酸含量增加导致呼吸模式向无氧呼吸转化。这种改变可能是由于k562细胞成团聚集在一起而导致,从而增强细胞侵袭转移的能力。这些代谢途径的差异可能证实了δ-toh对癌细胞和正常细胞影响的差异。
后续经过细胞实验验证,证实ic50剂量δ-生育酚对raw264.7细胞的亚毒性的影响体现在甜菜碱代谢途径上,ic50剂量δ-生育酚对k562细胞的亚毒性的影响体现在丙酮酸代谢途径上。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!