噻菌灵半抗原、偶联抗原、抗体及胶体金快速检测装置及其用途的制作方法
本发明属于食品安全检测领域。更具体地,本发明涉及一种噻菌灵半抗原、噻菌灵偶联抗原、噻菌灵抗体及包含该噻菌灵偶联抗原和该噻菌灵抗体的胶体金快速检测装置及其用途。
背景技术:
噻菌灵是一种苯咪唑类杀菌剂,是一种高效、广谱、通用的杀菌剂。噻菌灵用于防治由真菌引起的农作物、经济作物的各种病害,以及用于果蔬防腐保鲜。随着这类抗菌增效剂类药物的不合理使用、甚至滥用,以致于这类药物的残留会不可避免地发生。长期食用含有噻菌灵残留的食物,将有可能对人类健康产生危害。因此为了加强对食品中这类药物的监控,亟需建立噻菌灵残留物的检测方法。
目前,在国内外,噻菌灵残留物的检测方法主要有高效液相色谱法(HPLC)、液相-质谱联用(LC-MS)法和酶联免疫吸附(ELISA)法。在食品安全检测中,往往先用ELISA初筛后再对阳性样本用HPLC或LC-MS进行确证。上述方法中所用仪器设备操作复杂、成本高、对操作人员技术要求高,且不能立即显示结果,不适用于食品、商检、防疫、畜牧生产者对怀疑对象进行快速的在线检测和监控。
综上,本领域亟需一种准确、快速、方便的检测噻菌灵残留物的检测方法。
技术实现要素:
为了解决现有检测方法所存在的缺陷,本发明人经过反复地研究,提出了一种噻菌灵胶体金检测装置,该装置能够快速、准确地检测食品中残留的噻菌灵。
因此,在第一方面,本发明提供了一种噻菌灵半抗原,其具有式(I)所示结构:
在第二方面,本发明提供了一种噻菌灵偶联抗原,包含本发明第一方面的噻菌灵半抗原,以及与所述噻菌灵半抗原偶联在一起的载体。
在第三方面,本发明提供了一种噻菌灵抗体,所述噻菌灵抗体为特异性针对本发明第二方面的噻菌灵偶联抗原的抗体。
在第四方面,本发明提供了一种噻菌灵胶体金快速检测装置,包含试纸条和反应杯,所述试纸条包含样品垫和硝酸纤维素膜,所述硝酸纤维素膜包含检测线和质控线,所述检测线由噻菌灵偶联抗原制备获得;所述反应杯包含胶体金标记的噻菌灵抗体,所述噻菌灵抗体特异性地针对所述噻菌灵偶联抗原。
在第五方面,本发明提供了一种检测样品中噻菌灵的方法,所述方法包括使用本发明第四方面的噻菌灵胶体金快速检测装置进行检测。
本发明的有益效果:本发明应用层析式免疫胶体金原理,通过试纸条中检测线与质控线之间的比色来半定量检测样品中的噻菌灵残留量,在短时间内快速准确地检测出样品是否含有噻菌灵,以确定噻菌灵是否超标。该发明能够满足食品安全对噻菌灵残留量检测需求,适用于种植业或养殖业及政府检测机构。
本发明与现有技术相比,其效果不言而喻,即具有使用方便、经济快捷、制作容易、成本低廉的特点。
附图说明
图1示出本发明的噻菌灵胶体金快速检测装置的一个具体实施方式。
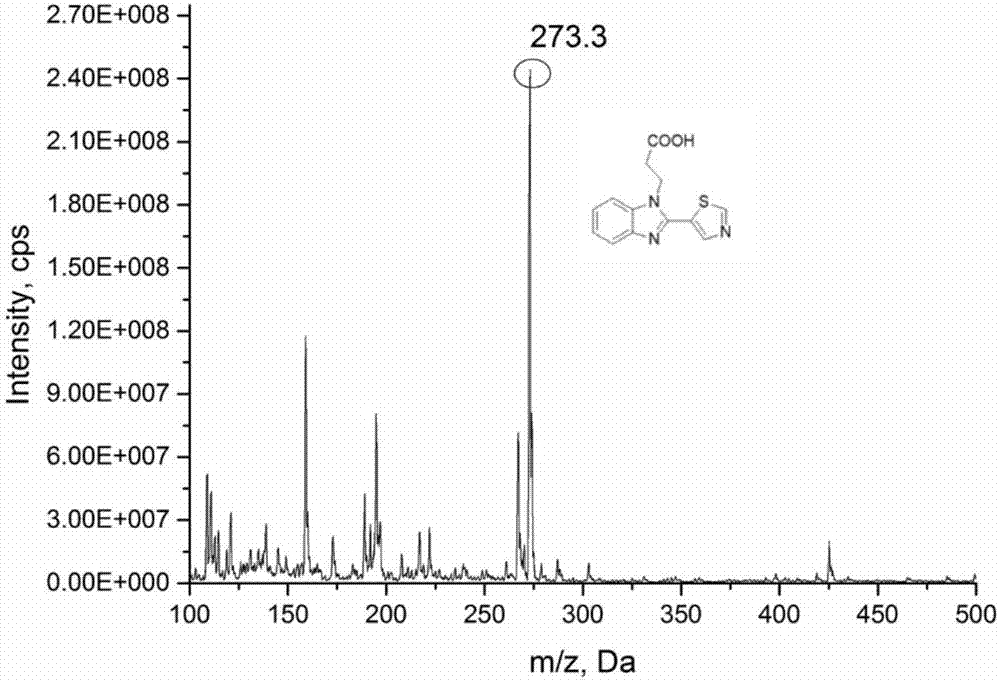
图2示出本发明的噻菌灵胶体金快速检测装置中所使用的一个示例性噻菌灵半抗原的质谱图。
具体实施方式
下面对本发明的噻菌灵胶体金快速检测装置、其制备方法及用途进行更为详细的描述。应注意,上文的发明内容部分以及下文的详细描述仅为具体阐释本发明之目的,无意于以任何方式对本发明进行限制。在不背离本发明的精神和主旨的情况下,本发明的范围由随附的权利要求书确定。
如上所述,本发明的目的是为了提供一种噻菌灵检测装置,其相对于现有技术或者设备,更为准确、快速、方便。
因此,在一方面,本发明提供了一种噻菌灵半抗原,其具有式(I)所示结构:
正如本领域技术人员理解的那样,所谓半抗原,是指这样的一类小分子物质:其单独存在时并不能诱导免疫应答,即不具备免疫原性;但当其与大分子蛋白质或非抗原性的多聚赖氨酸等载体交联或结合后可获得免疫原性,由此诱导免疫应答。这类小分子物质可与应答效应产物结合,具备抗原性即免疫反应性,但是不具免疫原性。
具体到噻菌灵半抗原,很容易理解的是,这是一类对特异性针对噻菌灵的抗体(即噻菌灵特异性抗体或噻菌灵抗体,单克隆抗体或者多克隆抗体均可)具有免疫反应性、但不具备免疫原性的小分子物质。换言之,在存在噻菌灵抗体的情况下,这类噻菌灵半抗原可以与之发生抗原-抗体结合反应;然而,在将该噻菌灵半抗原接种到动物体内进行免疫时,其并不能激发该动物产生相应的抗体。
噻菌灵自身作为半抗原,并不能产生良好的免疫反应性,因此在将其用作半抗原时需要对其进行修饰。但是需要注意的是,该修饰应尽可能地少,并且尽可能多地保留能与抗体结合的位点。
在本发明中,所述噻菌灵半抗原是通过使噻菌灵与丙溴酸反应获得的。
如上所述,噻菌灵半抗原分子仅具有免疫反应性,而不具有免疫原性。因此,为了赋予噻菌灵半抗原以免疫原性,还需要将该噻菌灵半抗原与合适的载体分子偶联、结合或者交联在一起,由此产生既具有免疫反应性又具有免疫原性的噻菌灵偶联抗原。半抗原与载体分子之间的偶联、结合或者交联方法是本领域已知的,例如本申请实施例部分所示例的方法。
因此,在第二方面,本发明提供了一种噻菌灵偶联抗原,包含本发明第一方面的噻菌灵半抗原、以及与所述噻菌灵半抗原偶联在一起的载体。
在本文中所提及的术语“载体”是任何能够与半抗原偶联、结合或者交联并由此产生既具有免疫原性又具有免疫反应性的物质,包括例如大分子蛋白质或者非抗原性的多聚赖氨酸等。作为示例,可以使用的载体包括,但不限于,大分子蛋白质,例如牛血清白蛋白(BSA)、人血清白蛋白(HSA)、血蓝蛋白(KLH)、卵蛋白(OVA)。
在第三方面,本发明提供了一种噻菌灵抗体,所述噻菌灵抗体为特异性针对本发明第二方面的噻菌灵偶联抗原的抗体。
所述噻菌灵抗体可以为单克隆抗体或多克隆抗体。另外,对于所述噻菌灵抗体,可以采用本领域常规方法来进行制备。例如,在所述噻菌灵抗体为多克隆抗体的情况下,可以通过采用所述噻菌灵偶联抗原免疫接种哺乳动物例如小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等、随后分离血清获得。在所述噻菌灵抗体为单克隆抗体的情况下,可以通过制造和培养杂交瘤细胞并收集培养基获得单克隆抗体,或者可以将由此制备获得的杂交瘤细胞通过腹腔注射接种到哺乳动物例如小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等的体内,在被接种动物的腹部明显膨大时收集腹水,由此获得单克隆抗体。
另外,正如本领域技术人员可以理解的那样,对于所述噻菌灵抗体的来源,并没有特别的限制,其可以来源于任何哺乳动物,包括例如鼠类如小鼠和大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等,但不限于此。在一个具体的实施方案中,所述噻菌灵抗体为来源于鼠类如小鼠和大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)的多克隆或者单克隆抗体。
在一个具体的实施方案中,所述噻菌灵抗体为特异性针对包含式(I)噻菌灵半抗原的噻菌灵偶联抗原的鼠源单克隆抗体。
在第四方面,本发明涉及一种噻菌灵胶体金快速检测装置,包含试纸条和反应杯,所述试纸条包含样品垫和硝酸纤维素膜,所述硝酸纤维素膜包含检测线和质控线,所述检测线由噻菌灵偶联抗原制备获得;所述反应杯包含胶体金标记的噻菌灵抗体,所述噻菌灵抗体特异性地针对所述噻菌灵偶联抗原。
如上所述,所述试纸条包含样品垫和硝酸纤维素膜,但是该试纸条还可以包含其它组件。例如,该试纸条还可以包含底板以及吸水纸。在这种情况下,样品垫、硝酸纤维素膜和吸水纸可以通过搭接粘贴依次铺设在该底板上。
如上所述,所述硝酸纤维素膜包含检测线和质控线。通常情况下,将检测线设置在靠近样品垫一侧。
所述检测线由噻菌灵偶联抗原在所述硝酸纤维素膜上进行线性点样制得。所述噻菌灵偶联抗原是通过将噻菌灵半抗原例如本发明第一方面的噻菌灵半抗原与载体分子偶联、交联或结合得到的。所述载体分子包括例如大分子蛋白质或者非抗原性的多聚赖氨酸等。作为示例,可以使用的载体包括,但不限于,大分子蛋白质,例如牛血清白蛋白(BSA)、人血清白蛋白(HSA)、血蓝蛋白(KLH)、卵蛋白(OVA)。
在一个优选的实施方案中,所述噻菌灵偶联抗原为本发明第二方面的噻菌灵偶联抗原。
本发明的噻菌灵胶体金快速检测装置包含质控线。设置质控线的目的是为了指示该装置在使用时检测体系是成立的,以确保所获得结果的可靠性和正确性。
所述质控线可以通过将抗原或者抗体在所述硝酸纤维素膜上进行线性点样获得。在一个实施方案中,所述质控线由针对本发明第三方面的噻菌灵抗体的第二抗体点样获得的。在胶体金标记的噻菌灵抗体通过虹吸移动至质控线时,其会与形成该质控线的该第二抗体发生结合反应,由此显现颜色。
如果质控线显色,则指示该检测系统成立,检测结果可用。相反,如果质控线不显色,则指示该检测系统不成立,检测结果不可用。
检测线和质控线应相互平行并相距合适距离,由此实现最佳检测。在一个实施方案中,检测线和质控线相距至少0.3厘米。
如上所述,所述反应杯包含胶体金标记的噻菌灵抗体,该噻菌灵抗体特异性地针对形成所述噻菌灵胶体金快速检测装置的检测线的噻菌灵偶联抗原。
所述噻菌灵抗体只要能够与所述噻菌灵偶联抗原发生抗原-抗体结合反应即可,而不管它是单克隆抗体还是多克隆抗体。然而,正如本领域技术人员可以理解的那样,从需要更高特异性的角度上考虑,所述噻菌灵抗体优选地为单克隆抗体。
对于所述噻菌灵抗体,可以采用本领域常规方法来进行制备。例如,在所述噻菌灵抗体为多克隆抗体的情况下,可以通过采用所述噻菌灵偶联抗原免疫接种哺乳动物例如小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等、随后分离血清获得。在所述噻菌灵抗体为单克隆抗体的情况下,可以通过制造和培养杂交瘤细胞并收集培养基获得单克隆抗体,或者可以将由此制备获得的杂交瘤细胞通过腹腔注射接种到哺乳动物例如小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等的体内,在被接种动物的腹部明显膨大时收集腹水,由此获得单克隆抗体。
另外,正如本领域技术人员可以理解的那样,对于所述噻菌灵抗体的来源,并没有特别的限制,其可以来源于任何哺乳动物,包括例如小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)等,但不限于此。在一个具体的实施方案中,所述噻菌灵抗体为来源于小鼠、大鼠、兔、山羊、绵羊、灵长类动物(不包括人类)的多克隆或者单克隆抗体。
在一个实施方案中,所述噻菌灵抗体为本发明第三方面的噻菌灵抗体。在一个具体实施方案中,所述噻菌灵抗体为特异性针对包含式(I)噻菌灵半抗原的噻菌灵偶联抗原的鼠源单克隆抗体。
在本发明的装置中涉及到胶体金标记的噻菌灵抗体,该抗体是通过将本发明的噻菌灵抗体与胶体金偶联制备获得的。噻菌灵抗体和胶体金之间的偶联方法可以采用本领域已知的相关偶联方法进行。
在一个具体的实施方案中,本发明提供了一种噻菌灵胶体金快速检测装置,包括试纸条和反应杯,所述试纸条包含底板以及在其上依次铺设的样品垫、硝酸纤维素膜和吸水纸,所述硝酸纤维素膜在所述样品垫至所述吸水纸方向上包括检测线和质控线,所述检测线由包含式(I)噻菌灵半抗原的噻菌灵偶联抗原制备获得;所述反应杯包含胶体金标记的噻菌灵抗体,所述噻菌灵抗体为特异性地针对所述包含式(I)噻菌灵半抗原的噻菌灵偶联抗原的鼠源单克隆抗体;并且所述质控线为针对所述噻菌灵抗体的兔抗鼠多克隆抗体。
本发明的噻菌灵胶体金检测装置可以通过下述制备方法进行制备:制备硝酸纤维素膜,采用本发明的噻菌灵偶联抗原在所述硝酸纤维素膜上进行线性点样制备检测线,并通过线性点样制备质控线;在底板上沿同一方向依次搭接粘贴样品垫、硝酸纤维素膜和吸水纸,由此组装成试纸条;将本发明的胶体金标记的噻菌灵抗体加入反应杯并冻干。该制备方法中使用到的各成分或者组件如上文针对本发明的噻菌灵胶体金检测装置所描述。
在第五方面,本发明涉及一种检测样品中噻菌灵的方法,所述方法包括使用本发明第四方面的噻菌灵胶体金快速检测装置进行检测。
所述样品可以为任何被怀疑含有噻菌灵的样品,其可以是动物源性食品,也可以是植物源性食品。例如,动物源性食品可以为羊肉、牛肉、鸡肉、猪肉、鸭肉、鱼肉、海鲜等,但不限于此。植物源性食品包括水果和蔬菜,水果例如苹果、香蕉、梨、葡萄、柑桔、荔枝、甘蔗、菠萝等,蔬菜例如萝卜、胡萝卜、芜菁、牛蒡、根芹菜、大头菜、大白菜、花椰菜、榨菜、雪里蕻、青菜、甘蓝、芥菜、莴苣、芹菜、菠菜、茼蒿、芫荽、苋菜、蕹菜、落葵、番茄、辣椒、茄子、青椒、柿子椒、南瓜、黄瓜、甜瓜、瓠瓜、冬瓜、丝瓜、苦瓜等。
在采用本发明的噻菌灵检测方法进行检测之前,可以根据样品的具体来源对其进行对应的预处理。例如,对于动物源性食品,可以先将组织搅碎,再对其中所包含的噻菌灵进行提取,并去除其中所包含的干扰性物质例如脂肪,随后再进行噻菌灵检测。对于植物源性食品,则无需进行脂肪去除操作。
在对样品进行相应预处理之后,将其加入至反应杯中并孵育几分钟,例如3-5分钟,随后插入试纸条,再孵育几分钟,例如3-5分钟。孵育完成之后,若观察到质控线显现出紫红色条带,则指示该检测系统成立、可用,此时进行如下判断:(1)若检测线同质控线一样显现出紫红色条带,并且检测线的颜色深度与质控线的颜色深度相当或者更深,则表明样品不含噻菌灵;(2)若检测线不显色,或者与质控线相比颜色更浅,则表明样品含有噻菌灵。
本发明的有益效果:本发明应用层析式免疫胶体金原理,通过试纸条中检测线与质控线之间的比色来半定量检测样品中的噻菌灵残留量,在短时间内快速准确地检测出样品是否含有噻菌灵,以确定噻菌灵是否超标。该发明能够满足食品安全对噻菌灵残留量检测需求,适用于屠宰企业及政府检测机构。
本发明与现有技术相比,其效果不言而喻,即具有使用方便、经济快捷、制作容易、成本低廉的特点。
下面结合附图以及实施例对本发明进行更为具体和详细的描述。
实施例
实施例1.噻菌灵半抗原的制备
噻菌灵半抗原的制备步骤具体如下:在100mL的三颈瓶中依次加入2.73g噻菌灵,1.67g丙溴酸,0.1g碳酸钠,并使其于50mL乙腈溶液中70℃反应过夜至完全。旋蒸结束后,通过乙酸乙酯萃取过柱,由此可以得到噻菌灵半抗原。
图2给出了由此得到的噻菌灵半抗原的质谱图,并且可以获知,该半抗原的分子式如下:
实施例2.噻菌灵偶联抗原的合成
利用实施例1制备的噻菌灵半抗原来制备偶联抗原,具体如下:取噻菌灵半抗原0.1mmol溶于2mL DMF中,搅拌加入27.5mg二环己基碳二亚胺(DCC)和14.4mg N-羟基琥珀酰亚胺(NHS)。4℃下磁力搅拌反应过夜,离心后保留上清夜,并将其标记为A液。称取牛血清白蛋白(BSA)、血蓝蛋白(KLH)140mg,将其分别溶于10mL浓度为0.1mol/L的PBS(pH8.0)中,再加入二甲基甲酰胺(DMF)1mL,搅拌溶解,由此制备获得B液。在磁力搅拌下,将A液逐渐滴入B液中,并于4℃反应12小时。离心后,取上清液,并于4℃用生理盐水透析3天,每天更换3次透析液,由此可以获得分别与牛血清白蛋白和血蓝蛋白偶联的噻菌灵偶联抗原。将所得噻菌灵偶联抗原以1mg/mL的浓度分装于0.5mL离心管中,并冻存于-20℃冰箱中。
实施例3.噻菌灵单克隆抗体的制备
利用实施例2制备的噻菌灵偶联抗原来制备噻菌灵单克隆抗体,具体如下:使用经鉴定的噻菌灵偶联抗原免疫4只6周龄昆明小鼠,加强免疫三次后,采血测效价。待血清效价不再上升,用两倍剂量的抗原不加佐剂免疫小鼠,三天后脱颈致死小鼠,在无菌条件下取脾脏制备脾细胞,与生长旺盛的小鼠骨髓瘤细胞按8:1的比例混合于50mL离心管,加入30mL无血清IPMI 1640培养基,1100r/min离心5分钟弃上清,将细胞团轻轻振松,置于37℃水浴中。把1mL50%PEG-4000缓缓加入细胞中,在1分钟内滴完,同时轻轻搅动底部沉淀,静置1分钟后,前30秒沿管壁缓慢匀速加入无血清培养基1mL,后30秒加入2mL,然后快速加入27mL终止融合过程,1100r/min离心5分钟,弃上清,用HAT选择性培养基重悬后加到已铺有饲养细胞的96孔细胞培养板中,并于37℃、体积分数5%的CO2条件下培养。7天后将培养基换成HT培养液,待孔内的杂交细胞数量达到300个以上时,用间接ELISA法筛选,选择强阳性、抑制效果好、细胞生长旺盛的孔进行有限稀释克隆化,经3次以上的克隆培养和检测,均呈阳性的孔内细胞即为分泌单克隆抗体的杂交瘤细胞,将杂交瘤细胞扩大培养以备单克隆抗体的制备。
采用体内诱生腹水法生产抗噻菌灵单克隆抗体,具体如下。选4只经产昆明小鼠,腹腔注射液体石蜡油0.5mL/只,7天后腹腔注射杂交瘤细胞3-5×106/只,10天后,待小鼠腹部明显膨大时收集腹水。用正辛酸-硫酸铵沉淀法来纯化腹水,经紫外测定抗噻菌灵单克隆抗体的含量。
实施例4.兔抗鼠抗体的制备
用实施例3制备的噻菌灵单克隆抗体免疫新西兰白兔,免疫剂量为50μg-100μg/次,背部皮下分多点注射;首免,用噻菌灵单克隆抗体与等量弗氏完全佐剂乳化;加强免疫,用噻菌灵单克隆抗体与等量弗氏不完全佐剂乳化,连续免疫4-5次,每次间隔4-8周,最后一次免疫后10-15天,以酶联免疫吸附法(ELISA)法测其定效价达到105以上时,采血并分离收集高免血清,以饱和硫酸铵盐析法提取IgG抗体,-20℃冻存备用。
实施例5.胶体金标记单克隆抗体的制备
5.1胶体金的制备
取1%氯金酸溶液1ml,加入99ml超纯水成终浓度0.01%的氯金酸溶液。将该溶液加热沸腾后,取1%柠檬酸三钠1.6ml一次性迅速加入煮沸的氯金酸溶液中,继续加热,直至溶液由淡黄色转为蓝黑色最终变为亮红色。颜色稳定后继续加热5min,室温冷却,补充失水至原体积。
5.2胶体金和单克隆抗体的偶联
调节在5.1中获得的胶体金溶液pH值至8.0,用恒速搅拌器均匀搅拌,同时逐滴加入实施例3制备的噻菌灵单克隆抗体,1小时后加入抗体量相当的聚乙二醇(PEG),充分反应30分钟后加入抗体量相当的牛血清蛋白(BSA)。加完后,继续搅拌30分钟。在9000rpm离心30分钟,获得均一性金标抗体沉淀物,再加对硝基苯酚丁酸酯(PNPB)重悬备用。
实施例6.噻菌灵胶体金检测装置的制备
步骤(一):制备硝酸纤维素膜,并在该硝酸纤维素膜上将实施例2制备的噻菌灵偶联抗原进行线性点样,由此形成检测线;并将实施例4制备的兔抗鼠IgG抗体进行线性点样,由此形成质控线。
步骤(二):在一块底板上沿同一方向依次搭接粘贴样品垫、硝酸纤维素膜及吸水纸,由此制备获得试纸条。
步骤(三):将实施例5制备的胶体金标记单克隆抗体加入至反应杯中,冻干,由此形成所需反应杯。
步骤(二)得到的试纸条和步骤(三)得到的反应杯组合在一起就形成了本发明的噻菌灵胶体金检测装置。
实施例7.样品中噻菌灵检测
取新鲜蔬菜或者水果样品绞碎,并将其用乙腈和丙酮提取,之后将提取物取样置于实施例6制备的反应杯中,室温孵育3分钟。随后将实施例6制备的试纸条插入反应杯中,再于室温孵育5分钟。取出试纸条,轻轻刮除湿海绵垫,进行结果判读:若检测线(T线)与质控线(C线)同时显示紫红色条带,并且检测线的颜色深度与质控线的颜色深度相当或者更深,则结果为阴性,表明样品中不含噻菌灵;若T线颜色比C线浅,或C线显色而T线不显色,则结果为阳性,表明样品中含有噻菌灵;若C线、T线均不显色,则检测装置已失效。
实施例8.噻菌灵胶体金检测装置的灵敏度
设置一系列的浓度梯度,噻菌灵浓度分别为1.25、2.5、5、10、20μg/ml,用胶体金试纸条进行测试,测试后使用仪器比较检测线与质控线颜色深浅。当噻菌灵浓度为5μg/ml时,检测线颜色深度为质控线的90%以下,因此其灵敏度为5μg/ml。
选取5μg/ml平行实验5次,统计检测限颜色深度与质控线颜色深度的比例,其CV值小于15%。
实施例9.噻菌灵胶体金检测装置的保质期实验
用三批常规生产的产品分别做保质期实验,放置于室内室温环境保持,间隔1个月取12个装置,用质控样本检测,分别做阴性,2.5ug/mL,5ug/mL和10ug/mL样品,重复三次,观察产品显色变化,考察保质期时间。阴性显色从13个月开始下降,实验结果表明在1年时间内产品品质无明显变化,因此确定保质期为1年。
上文已经通过一般性说明及具体实施方案对本发明做了详尽的描述,但在本发明基础上,可以对其做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!