一种肿瘤标志物群检测用微流控芯片的制作方法
本实用新型涉及微流控和肿瘤筛查技术领域,尤其是一种肿瘤标志物群检测用微流控芯片。
背景技术:
我国恶性肿瘤发病率日益上升,严重威胁人民健康。应对肿瘤威胁的最佳对策是“早发现、早治疗”。“早发现”是“早治疗”的前提,将极大提高治愈率,也可为患者和社会节省大量的医疗费用。肿瘤筛查是早期发现癌症和癌前病变的重要途径,推广普及肿瘤筛查,提高早期诊断率,是诊治恶性肿瘤的主要有效手段。
目前,肿瘤筛查一般使用低剂量CT扫描或血清肿瘤标志物检测,均需在具有一定规模的医疗机构中进行,由具备相应资质的专业技术人员在专业仪器上操作完成,无法在城镇和农村广泛开展。偏高的价格也难以惠及低收入阶层,制约了肿瘤筛查工作的推广。
技术实现要素:
本实用新型的目的在于提供一种检测快捷、低成本,无需借助专业仪器,实现自助式检测的肿瘤标志物群检测用微流控芯片。
为实现上述目的,本实用新型采用了以下技术方案:一种肿瘤标志物群检测用微流控芯片,包括基板以及位于其上方的盖板,所述盖板为透明材质,所述盖板上设采血微针阵列,所述采血微针阵列由多个采血微针组成,每根采血微针的内部有微管;所述盖板和基板二者胶合或热压键合形成溢流腔、进样腔、反应腔、毛细管流道和废液腔,所述进样腔和反应腔在垂直空间上连通,进样腔在上,反应腔在下;所述进样腔内设置吸水纸和滤纸;所述反应腔位于滤纸下方,所述反应腔内置微柱阵列,反应腔的底面和微柱阵列的表面涂有偶联了发色基团的标记抗体;所述毛细管流道通过延时阀与反应腔连通;所述毛细管流道的尾端区域的底部设置印有固相化的抗体试剂的多个检测条带和质量控制条带,每一个检测条带用于检测一种肿瘤标志物;所述毛细管流道外,与检测条带和质量控制条带一一对应的位置处印有标准检测色带和标准质量控制色带。
所述采血微针阵列由微电子机械系统的加工工艺制作,内置微管道,与进样腔连通。
所述吸水纸与采血微针内的微管的底部紧密相连;所述滤纸位于吸水纸的下方、反应腔的上方。
所述进样腔的顶部和溢流腔之间通过溢流槽连通。
所述延时阀为位于反应腔和毛细管流道之间的一段长约5毫米的毛细管,其底面具有疏水特性。
由上述技术方案可知,本实用新型的有益效果为:第一,实现了自助式检测:无需进医院,无需专业设备的辅助,受检者自行操作,自我检查;第二,采血量极低:仅需一滴指尖血,就可以同时检测多种肿瘤标志物指标;第三,高通量:同一毛细管流道,一次可以检测多种肿瘤标志物;第四,肿瘤标志物指标可视化读取,无需激发等光学设备器材;第五,高度集成、精密:只用一个流道,只用一种发色基团,就可同步检出多项肿瘤标志物,无需多色标记;第六,肿瘤标志物的定量检测:通过精巧的溢流槽和溢流腔设计,实现精确定量进样,又利用检测条带与标准检测色带的对比,实现多种肿瘤标志物的定量检测,并提高检测的稳定性和可靠性。第七,检测速度快:整个检测过程只需15分钟;第八,采用MEMS采血微针阵列,采血安全、无痛感;第九,利用毛细管浸润原理实现血清样品的自动进样和输送及流速控制,整个过程无需外界控制或提供能量,无需使用任何其他设备;第十,芯片由塑料制成,适合大批量生产,成本极低,适合一次性使用。
附图说明
图1为本实用新型中透明盖板的结构示意图;
图2为本实用新型中基板及其上安装的各个部件的结构示意图;
图3为本实用新型的剖视图;
图4为本实用新型中两个微针的放大结构示意图。
具体实施方式
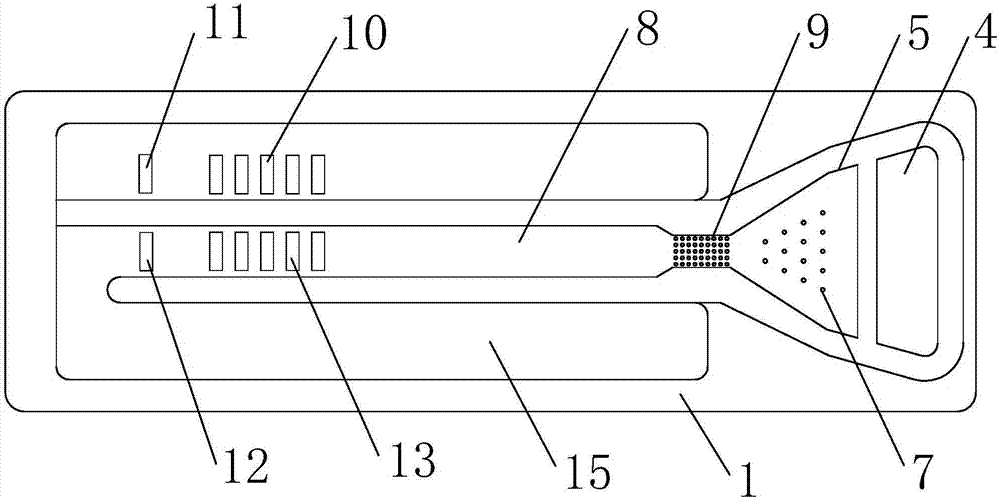
如图1、2、3所示,一种肿瘤标志物群检测用微流控芯片,包括基板1以及位于其上方的盖板2,所述盖板2为透明材质,所述盖板2上设采血微针阵列3,所述采血微针阵列3由多个采血微针组成,每根采血微针的内部有微管14;所述盖板2和基板1二者胶合或热压键合形成溢流腔4、进样腔16、反应腔5、毛细管流道8和废液腔15,所述进样腔16和反应腔5在垂直空间上连通,进样腔16在上,反应腔5在下;所述进样腔16内设置吸水纸6和滤纸18;所述毛细管流道8通过延时阀9与反应腔5连通;所述毛细管流道8的尾端区域的底部设置印有固相化的抗体试剂的多个检测条带13和质量控制条带12,每一个检测条带13用于检测一种肿瘤标志物;所述毛细管流道8外,与检测条带13和质量控制条带12一一对应的位置处印有标准检测色带10和标准质量控制色带11,用作读取检测反应和质量控制反应强度的对照参考。
如图1、2所示,所述基板1和盖板2利用胶水粘合,以防泄露。基板1和盖板2的材料均为生物兼容性的塑料,盖板2为透明材质。为适于大批量生产,基板1和透明盖板2均采用注塑或热压成型工艺生产。
如图4所示,所述采血微针阵列3由微电子机械系统的加工工艺制作,每根采血微针的高度为300微米,底部直径为250微米,尖端直径为100微米。被检测者手指按压采血微针阵列3,采血微针可穿破手指的角质层和表皮,血液即可通过微针内的微管14渗入微流控芯片。由于采血微针尺寸小,刺入皮肤时几乎不接触任何神经;拔出后,在皮肤上留下的针孔极小,皮肤可很快愈合,不会导致伤口感染,所以这种采血安全、无痛感。
如图2、3所示,所述吸水纸6与采血微针内的微管14的底部紧密相连,以吸收从微管14渗入的血样,并增强微管14对血样的吸力;所述滤纸18在吸水纸6的下方,反应腔5的上方,对全血起过滤作用,血清可透过,流入下面的反应腔5,血细胞则不能透过。吸水纸6较厚,具有较大孔隙,吸水性强,与采血微针阵列3内的微管14相连,增强了微管14对指尖血的吸力,提高采血效率。滤纸6在吸水纸18的下方,较薄,孔隙较小,对全血起过滤作用:血清可透过滤纸6的孔隙流入下面的反应腔5,血细胞则不能透过。
如图2、3所示,所述进样腔16的顶部和溢流腔4之间通过溢流槽17连通。所述进样腔16的一侧设置溢流槽17,连通溢流腔4,使得过量注入的血样可以溢入溢流腔4,保证进入进样腔的血样的体积精确定量。
如图2、3所示,所述反应腔5位于滤纸18下方,所述反应腔5内置微柱阵列7,反应腔5的底面和微柱阵列7的表面涂有偶联了发色基团的标记抗体。待测样品的血清透过滤纸6流入反应腔5后,标记抗体从反应腔5的底面和微柱阵列7的表面溶解下来,与血清中的待测蛋白(肿瘤标志物)起免疫反应,形成牢固的抗原-抗体结合,从而使偶联在标记抗体上的发色基团牢固地附着到被测蛋白(肿瘤标志物)上,即待测蛋白(肿瘤标志物)被发色基团标记,为后续检测提供必备的条件。
如图2、3所示,所述延时阀9为位于反应腔5和毛细管流道8之间的一段长为5毫米的毛细管。该段毛细管的底面为疏水性,导致液体浸润该管道底的过程缓慢,从而起到阻止血清流入毛细管流道8的“阀”作用,保证血清样品在反应腔5里停留足够长时间,以充分完成待测蛋白(肿瘤标志物)与标记抗体的免疫反应,确保待测蛋白被发色基团标记。经过特定的一段时间后,该段毛细管流道8的管底被血清完全浸润,表面覆盖了液体膜,就变成亲水的,失去阻碍血清样品的作用,相当于阀门打开,血清样品在毛细管力牵引下可顺利流过。
如图2、3所示,所述毛细管流道利用毛细管浸润原理实现血清样品沿管道的自动输送,毛细管力成为牵引血清样品沿微管道流动的动力。整个过程无需外界控制或提供能量。可通过设置毛细管流道8特定区域的亲、疏水特性,控制血清样品以合适的速度流过位于毛细管流道8尾端的若干检测条带13和质量控制条带12区域,使待测蛋白(肿瘤标志物)检测所需的特异性免疫反应充分完成,并保证未起特异性免疫反应的蛋白和附着其上的发色基团随血清流到废液腔15,不残留在检测条带13和质量控制条带12区域。
如图2所示,所述检测条带13和质量控制条带12位于毛细管流道8的尾端区域的底部,通过在毛细管流道8的底部分别印刷不同的抗体试剂制成。这些抗体试剂本身无色,固化后牢固地附着在毛细管流道8的底部,遇血清冲洗,也不会从管道底部脱落。血清样品流过检测条带13和质量控制条带12时,血清样品中特定的待测蛋白(肿瘤标志物)分别与这些固相化的抗体试剂起特异性免疫反应,形成不同的抗原-抗体结合体,从而分别被捕获在相应的检测条带上。由于待测蛋白(肿瘤标志物)已在反应腔5中通过标记抗体被发色基团染色,所以检测条带13显出发色基团的颜色。被捕获的待测蛋白(肿瘤标志物)越多,检测条带13的颜色就越深,因此,可以通过测量反应后检测条带13的灰度值,来判断待测血样中肿瘤标志物的浓度。每个检测条带13含有特定的检测抗体试剂,用于捕获一种肿瘤标志物。虽然不同的肿瘤标志物在反应腔5里被同一种发色基团标记,但由于毛细管流道8里各检测条带13是事先精确定位的,相互之间留有足够的间隔,并检测抗体牢固附着在流道底上,所以检测时各检测条带13互不混淆,显现的色带之间保持间隔,可以凭色带的位置识别检测的是哪一种肿瘤标志物,从而实现“一个流道,一种发色基团,同时检测多种肿瘤标志物”。
如图2、3所示,毛细管流道8外,与检测条带13和质量控制条带12一一对应的位置印有标准检测色带10和标准质量控制色带11,用作读取检测反应和质量控制反应强度的对照参考。质量控制条带12用于验证芯片是否有效:如果芯片有效,血清样品流过后,质量控制色带12出现的颜色应该与标准质量控制色带11的颜色接近,否则,则说明芯片失效。对检测条带13、质量控制条带12、标准检测色带10和标准质量控制色带11拍摄数字照片,再利用图像处理软件分别对质量控制条带12与标准质量控制色带11、检测条带13与标准检测色带10进行单位面积上的灰度值对比,可以判断芯片检测是否有效,并换算出各检测条带对应的肿瘤标志物的浓度。
本实用新型的工作流程如下:
1)指尖血进样:被检测者手指按压芯片盖板2上的采血微针阵列3,采血微针刺穿手指的角质层和表皮,血液即可通过采血微针内的微管14渗入芯片的进样腔16,被上层的滤纸18吸收。过量的血样通过溢流槽17流入溢流腔4,保证进入反应腔5的血样的精确定量。
2)血清分离:指尖血被吸入进样腔16内的上层滤纸后,在重力作用下,透过下层滤纸进入反应腔5。下层滤纸的孔隙小,血清可以透过,流入反应腔5,血细胞则不能透过,留在滤纸上。
3)待测蛋白(肿瘤标志物)标记:反应腔5的腔底和微柱阵列7表面涂有偶联了发色基团的标记抗体。由于反应腔5和毛细管流道8之间的延时阀9的作用,血清进入反应腔5后,在反应腔5里停留一段时间,将把标记抗体从反应腔5的腔底和微柱阵列7表面 “溶解’下来。血清中的待测蛋白(肿瘤标志物)与标记抗体起免疫反应,从而被发色基团标记。
4)待测蛋白捕获:延时阀9打开后,血清在毛细管力作用下,自动沿毛细管流道8流动,以合适的速度流过检测条带13和质量控制条带12区域。检测条带13的底部预先印有可与待测的肿瘤标志物(蛋白)起特异性反应的抗体探针,即捕获抗体。捕获抗体应与上述标记抗体无交叉反应,并且牢固地附着在检测反应区的底部。血清流过时,血清中的待测肿瘤标志物蛋白,将会与捕获抗体起特异性反应,形成抗原-抗体结合体,从而附着在检测反应区的底部。由于待测的肿瘤标志物(蛋白)已偶联发色基团,所以在检测反应区的底部出现显色条带。血清中的其他成分将沿毛细管通道流入废液腔15。质量控制条带12上印有固相化的质控抗体,也可与待测的肿瘤标志物(蛋白)起免疫反应,也捕获待测的肿瘤标志物(蛋白)。如果芯片反应有效,血清样品流过后,质量控制色带12将显色,否则,则说明芯片失效。
5)检测读取:对检测条带13、质量控制条带12、标准检测色带10和标准质量控制色带11拍照,然后利用图像处理软件对质量控制条带12与标准质量控制色带11、检测条带13与标准检测色带10进行单位面积的灰度值对比,判断芯片检测是否有效,并换算出各检测条带对应的肿瘤标志物的浓度。
综上所述,本实用新型实现了自助式检测:无需进医院,无需专业设备的辅助,受检者自行操作,自我检查;采血量极低:仅需一滴指尖血,就可以同时检测多种肿瘤标志物指标;高通量:同一毛细管流道,一次可以检测多种肿瘤标志物;肿瘤标志物在可见光范围读取,无需激发等光学设备器材。
- 还没有人留言评论。精彩留言会获得点赞!
- 普适型用于同时检测多种肿瘤标志物的微流控芯片装置的制造方法
- 男性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 女性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 一种检测口腔癌的标志物及其试剂盒的制造方法与工艺
- microRNA 标志物组及其在制备检测胃癌淋巴结转移试剂盒中的应用的制造方法与工艺
- 基于弹性蛋白酶荧光底物检测乳腺癌肿瘤标志物CA153的酶联免疫试剂盒制备方法与制造工艺
- 检测和评价力量训练效果的miRNA标志物或其组合及其应用的制造方法与工艺
- 一种最优超平面的构建方法、动态优化系统和构建装置与制造工艺
- 癌症标志物及癌症的判定方法与制造工艺
- 检测尿液中单羟酚类代谢物的试剂盒及其制备方法与制造工艺