一种用于检测次黄嘌呤和黄嘌呤的工作电极及其酶生物传感器体系的制作方法
本发明涉及一种用于检测次黄嘌呤和黄嘌呤的工作电极,及其制备方法,以及采用该工作电极的酶生物传感器体系,属于食品检测技术领域。
背景技术:
中国是一个海洋捕捞大国,每年都有数不胜数的鱼类被捕捞上来销往世界各地,在鱼类打捞上来后很容易发生死亡,而鱼类死亡后,会发生一系列复杂的化学反应,包括蛋白质分解、溶解和脂解等,甚至引起腐败变质。
鱼类死亡后会产生一些分解代谢物,例如次黄嘌呤及黄嘌呤(已知的三磷酸腺苷(atp)的主要分解代谢物),然而长期食用含有大量次黄嘌呤及黄嘌呤的食物,会导致次黄嘌呤及黄嘌呤在人身体内的累积,导致痛风、黄嘌呤尿、高尿酸血症和子痫前期等疾病,因此,检测鱼类体内次黄嘌呤及黄嘌呤的含量对于人们的身体健康有着至关重要的作用。
目前常规的检测方法,例如高效液相色谱、分光光度法、化学发光,毛细管电泳等都能高灵敏度和高选择性地检测次黄嘌呤和黄嘌呤;例如中国发明专利申请公开号cn106855508a公开了一种检测鱼中次黄嘌呤含量的方法,该方法是取鱼肉制样品液,用辣根过氧化物酶和黄嘌呤氧化酶偶联催化样品液后用紫外分光光度计进行检测获取次黄嘌呤的含量;然而这些检测方法的步骤非常繁琐,且需要相对昂贵的设备以及专业熟练的技术人员来进行操作,增加了检测的成本和时间。
因此,本领域希望能开发出一种检测更方便且能保证检测精准性的次黄嘌呤和黄嘌呤含量的装置。
技术实现要素:
为了解决上述技术问题,本发明一方面提供了一种用于检测次黄嘌呤和黄嘌呤的工作电极,其中,所述工作电极为其表面粘附了铜金属有机骨架材料的复合物的玻碳电极;
所述铜金属有机骨架材料的复合物为具有纳米纤维结构的铜金属有机骨架材料的表面孔隙中吸附了黄嘌呤氧化酶所形成的复合物;
所述具有纳米纤维结构的铜金属有机骨架材料,其比表面积的范围为30~80m2/g,其表面孔隙的孔径尺寸为1.7~50nm,其表面孔隙率为20~40%。
所述铜金属有机骨架材料的复合物通过海藻酸钠粘附于所述玻碳电极的表面。
优选的,所述具有纳米纤维结构的铜金属有机骨架材料是采用cu(no3)2·6h2o与天冬氨酸制备而成。
本发明另一方面提供了上述的用于检测次黄嘌呤和黄嘌呤的工作电极的制备方法,其中,
所述制备方法包括以下步骤:
步骤1),制备所述铜金属有机骨架材料的复合物:将浓度为20~40mg/ml的黄嘌呤氧化酶溶液与浓度为0.8~3mg/ml的所述铜金属有机骨架材料的溶液以1:1~1:3的体积比进行充分混合,使得所述黄嘌呤氧化酶被吸附于所述铜金属有机纳米纤维材料的表面孔隙中;
步骤2),将步骤1)制备获得的所述铜金属有机骨架材料的复合物与浓度为0.1~0.3%wt海藻酸钠溶液,以2:1~4:1的体积比进行充分混合,获得处理溶液;
步骤3),将步骤2)获得的处理溶液以3~6μl/cm2滴于所述玻碳电极的表面,获得所述工作电极;其中,所述玻碳电极的氧化还原峰电位差小于100mv。
优选的,在所述步骤1)中,将所述黄嘌呤氧化酶溶液与所述铜金属有机骨架材料的溶液在离心管中混合均匀后,再置于摇床中以100~300rpm/min的速度摇晃至少8h。
优选的,在所述步骤2)中,将所述铜金属有机骨架材料的复合物与所述海藻酸钠溶液混合后,置于涡轮振荡器上以300~500rpm/min的速度振荡3~5分钟以充分混合。
优选的,所述步骤3所用的玻碳电极在使用前经过了一个预处理的步骤,即将玻碳电极利用超声波清洗机清洗干净,再依次用0.5μm、0.3μm、0.05μm的氧化铝抛光粉打磨光亮,待氧化还原峰电位差小于100mv后,用去离子水清洗干净并用氮气吹干。
优选的,所述制备方法还包括步骤4),将步骤3)获得的工作电极贮存于4℃、ph值为6.5~7.5的磷酸缓冲液中至少8h以上,再使用。
本发明再一方面提供了一种用于检测次黄嘌呤和黄嘌呤的酶生物传感器体系,其中,所述酶生物传感器体系包括电化学工作站,以及连接于电化学工作站的参比电极、对比电极和工作电极,所述工作电极采用上述的用于检测次黄嘌呤和黄嘌呤的工作电极,或者采用上述的制备方法获得的用于检测次黄嘌呤和黄嘌呤的工作电极。
优选的,所述参比电极为饱和甘汞电极,所述对比电极为铂丝电极。
本发明的用于检测次黄嘌呤和黄嘌呤的工作电极,其制备方法简单,且该工作电极与参比电极、对比电极以及电化学工作站组合构成的酶生物传感器体系,可以用于检测次黄嘌呤和黄嘌呤,并且有着较高的精准性,不仅能够检测低浓度的底物(对于低浓度的底物,例如浓度范围为0.01μm~10μm的低浓度,检测相对标准偏差不超过8%),而且对于次黄嘌呤和黄嘌呤的浓度变化有着较高的灵敏性,且有较宽的检测范围(0.01μm-10μm),可以高效快速地获得次黄嘌呤和黄嘌呤的浓度检测结果,且具有很好的稳定性,可以重复使用,多次使用下仍能够保持对底物的灵敏检测。
附图说明
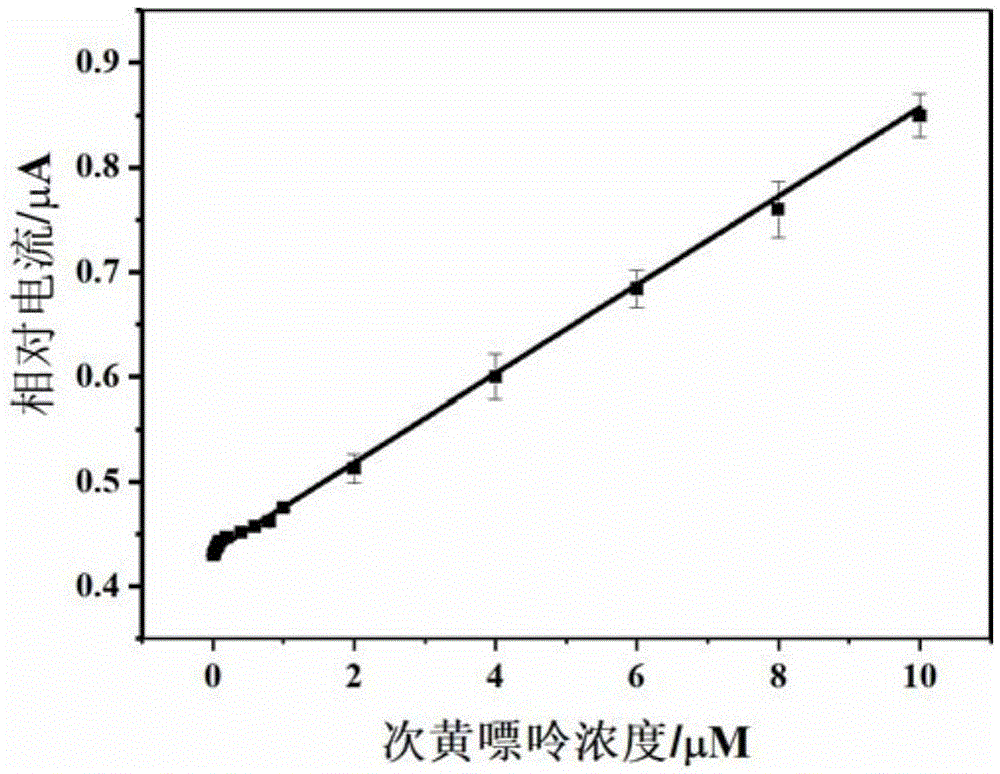
图1为本发明实施例2的酶生物传感器体系检测次黄嘌呤浓度的标准曲线;
图2为本发明实施例2的酶生物传感器体系检测黄嘌呤浓度的标准曲线;
图3为应用例1和应用例2中不同贮藏时间下鱿鱼和大黄鱼样品中次黄嘌呤的含量的变化图谱;
图4为应用例3和应用例4中不同贮藏时间下鱿鱼和大黄鱼样品中黄嘌呤的含量的变化图谱。
具体实施方式
以下通过实施例对本发明作进一步的说明,但本发明并不限于这些具体实施方式。
实施例1
制备用于检测次黄嘌呤和黄嘌呤的酶生物传感器的工作电极
该制备方法包括以下步骤;
步骤1),制备所述铜金属有机骨架材料的复合物;
首先,提供黄嘌呤氧化酶溶液和铜金属有机骨架材料的溶液;
本实施例所采用的黄嘌呤氧化酶,购买自sigma公司的产品型号为xu-4500的产品;取30g黄嘌呤氧化酶,加入到1l去离子水中制备得到浓度为30mg/ml的黄嘌呤氧化酶溶液;
关于铜金属有机骨架材料(以下简称cu-mof),可以直接购买市售产品,也可以自行配制,只要铜金属有机骨架材料满足以下参数即可:其比表面积的范围为30~80m2/g,其表面孔隙的孔径尺寸为1.7~50nm,其表面孔隙率为20%~40%。
本实施例所采用的cu-mof是采用cu(no3)2·6h2o与天冬氨酸制备而成,具体的制备方法如下:室温下,将cu(no3)2·6h2o溶液(4.5mmol,6ml)加入到含有naoh(6mmol)和天冬氨酸(3mmol)的30ml水溶液中,常温搅拌获得浅蓝色溶液;然后将获得的浅蓝色溶液离心一次,将离心产物用蒸馏水和80%乙醇溶液(两者体积比为1:1)的混合液冲洗6次,然后离心,获得沉淀物,再将获得的沉淀物在80℃真空烘干10h,获得本实施例的cu-mof。经鉴定,本实施例的cu-mof的比表面积:33.6579m2/g,表面孔隙的孔径尺寸范围约为15.3855~18.64364nm,孔隙率约为30%;另外,还测得本实施例的cu-mof的每根纳米纤维的直径范围约为100~200nm,长度范围约为0.1~0.4微米。
在本实施例中,取上述制备获得的cu-mof1.5g加入到1l去离子水中制备得到浓度为1.5mg/ml的cu-mof的溶液。
然后,将上述配制好的30mg/ml的黄嘌呤氧化酶溶液与1.5mg/ml的cu-mof的溶液以1:2的体积比进行充分混合,使得所述黄嘌呤氧化酶被吸附于cu-mof的表面孔隙中。
具体地,在本实施例中,取100μl、30mg/ml的黄嘌呤氧化酶溶液置于离心管中,再加入cu-mof溶液200μl,将离心管置于涡轮振荡器上振荡3min,使二者充分混合均匀,再将混匀后的离心管置于恒温摇床中以200rpm/min摇晃10h,使得黄嘌呤氧化酶充分地被吸附在cu-mof材料的表面孔隙里;从而制备获得铜金属有机骨架材料的复合物(cu-mof与黄嘌呤氧化酶的复合物)。
步骤2),将步骤1)制备获得的所述铜金属有机骨架材料的复合物(以下简称复合物)与海藻酸钠溶液进行充分混合,获得处理溶液。
具体在本实施例中,称取4g海藻酸钠,溶于50ml去离子水中,配制成0.2%的海藻酸钠溶液;将上述步骤1)获得的复合物(离心管)取出,向其中加入100μl、0.2%wt的海藻酸钠溶液,置于涡轮振荡器振荡3min,使得海藻酸钠与复合物之间充分结合,获得处理溶液。
步骤3),将步骤2)获得的处理溶液以5μl/cm2滴于玻碳电极的表面,获得所述工作电极;其中,玻碳电极的氧化还原峰电位差小于100mv。
具体在本实施例中,玻碳电极在使用前经过了一个预处理的步骤,即将玻碳电极利用超声波清洗机清洗干净,再依次用0.5μm、0.3μm、0.05μm的氧化铝抛光粉打磨光亮,待氧化还原峰电位差小于100mv后,用去离子水清洗干净并用氮气吹干。
具体在本实施例中,吸取步骤2)所获得的处理溶液以5μl/cm2滴于经预处理后的玻碳电极的表面,置于室温条件下自然风干,即得到实施例1的用于检测次黄嘌呤和黄嘌呤的酶生物传感器的工作电极。
在本实施例中,可以将步骤3)获得的目标电极贮存于4℃、ph值为7左右的磷酸缓冲液中至少8h以上,再使用。
实施例2
用于检测次黄嘌呤和黄嘌呤的酶生物传感器的体系
通常的酶生物传感器体系包括电化学工作站和连接于电化学工作站的参比电极、对比电极和工作电极。
电化学工作站作为整个反应体系信号变化的监测器。本实施例所采用的电化学工作站购买自上海辰华公司的chi760型号的产品。
实施例2的酶生物传感器体系的工作电极采用上述实施例1制备获得的工作电极。
在本实施例中,参比电极可以采用饱和甘汞电极(购买自艾达恒盛公司的产品),对比电极可以采用铂丝电极(购买自高仕睿联公司的产品)。
另外,关于参比电极和对比电极,本领域技术人员也可以采用其他合适的电极,例如参比电极还可以采用ag/agcl;对比电极还可以采用石墨棒电极。
本实施例的酶生物传感器的体系基于黄嘌呤氧化酶与次黄嘌呤及黄嘌呤发生氧化还原反应的原理,将得失电子转化为电信号传输到电化学工作站上,改变电化学工作站原有的电化学响应信号,从而实现对次黄嘌呤及黄嘌呤浓度的检测。
将参比电极、对比电极和实施例1制备获得的工作电极连接于电化学工作站完成整个酶生物传感器体系的构建之后,将三个电极插入到0.05m、ph=7.5的磷酸缓冲液溶液(以下简称pbs溶液)中,利用差分脉冲伏安法测试所得的相对响应电流值制作次黄嘌呤浓度的标准曲线;制作过程简述如下:取次黄嘌呤的化学标准品(购买自sigma公司)溶解于0.05m、ph=7.5的pbs溶液中,震荡1分钟,分别配制不同浓度的次黄嘌呤标准溶液(0.01μm、0.02μm、0.04μm、0.05μm、0.1μm、0.2μm,......);记录不同浓度的次黄嘌呤标准溶液的相对响应电流值,利用不同浓度的次黄嘌呤标准溶液的相对响应电流值,制作出次黄嘌呤浓度的标准曲线,参见图1。
按照上述同样的方法,记录不同浓度的黄嘌呤标准溶液的相对响应电流值,制作黄嘌呤浓度的标准曲线,参见图2。
验证实验1
验证实施例2的酶生物传感器体系在检测鱿鱼样品溶液中的次黄嘌呤浓度的精确性
鱿鱼样品溶液的制备过程如下:
将所购买的新鲜鱿鱼搅碎,分为2g每份;将每一份鱿鱼碎样品加入到10ml、0.05m、ph=7.5的pbs溶液中;搅拌5min后在4000rpm/min的条件下离心15min;取离心后的上清液过滤。
取100μl滤液,用0.05m、ph=7.5的pbs溶液稀释至10ml,获得鱿鱼样品溶液。
将实施例2的酶生物传感器体系的三个电极插入到一份鱿鱼样品溶液中,进行扫描,通过在e=-0.4v至e=+0.8v下通过差分脉冲伏安法测试,得到该鱿鱼样品溶液的电流响应曲线。测得该鱿鱼样品溶液的相对响应电流值,再对照上述图1的次黄嘌呤浓度的标准曲线,计算出该鱿鱼样品溶液中的次黄嘌呤浓度为0.2902μm。
然后,另外取三份滤液,每份100μl,分别向其中加入5μm、1μm和2μm的次黄嘌呤标准溶液(次黄嘌呤的化学标准品溶解于0.05m、ph=7.5的pbs溶液配制),再采用0.05m、ph=7.5的pbs溶液稀释100倍(定容至10ml),使得这三份样品溶液中,除去原鱿鱼样品溶液中的次黄嘌呤以外,所含的次黄嘌呤标准品的浓度依次为0.05μm、0.1μm和0.2μm(即添加的标准品浓度),采用上述同样的方法测定三份样品溶液的电流响应曲线,测得该鱿鱼样品溶液的相对响应电流值,再对照上述图1的次黄嘌呤浓度的标准曲线,获得三份样品溶液的次黄嘌呤浓度(依次为0.33948μm、0.39309μm、0.48312μm)。
将这三份样品溶液的次黄嘌呤浓度减去之前测得的鱿鱼样品溶液中的次黄嘌呤浓度,得到的结果分别为0.04928m、0.10289m和0.19292m;将这三个结果分别除以添加的标准品浓度0.05μm、0.1μm和0.2μm,得到的回收率分别为98.56%、102.89%和96.46%。
从而计算出,相对标准偏差(rsd,relativestandarddeviation)分别为4.01%、1.96%和4.14%。
验证实验2
验证实施例2的酶生物传感器体系在检测鱿鱼样品溶液中的黄嘌呤浓度的精确性
采用上述验证试验1同样的方式配制鱿鱼样品溶液,并采用同样的方式测得该鱿鱼样品溶液中的黄嘌呤浓度未检出。
采用上述验证实验1同样的方式,取三份滤液,添加黄嘌呤标准溶液(黄嘌呤的化学标准品溶解于0.05m、ph=7.5的pbs溶液配制),以获得添加的黄嘌呤标准品浓度依次为0.05μm、0.1μm和0.2μm的三份样品溶液。
按照上述验证实验1同样的方式,获得三份样品溶液的黄嘌呤浓度(依次为0.05029m、0.09335m和0.20887m)。
将这三份样品溶液的黄嘌呤浓度减去之前测得的鱿鱼样品溶液中的黄嘌呤浓度,得到的结果分别为0.05029m、0.09335m和0.20887m;将这三个结果分别除以添加的标准品浓度0.05μm、0.1μm和0.2μm,得到的回收率分别为100.57%、93.95%和104.44%。
从而计算出,相对标准偏差(rsd,relativestandarddeviation)分别为7.57%、3.82%和3.95%。
验证实验3
验证实施例2的酶生物传感器体系在检测大黄鱼样品溶液中的次黄嘌呤浓度的精确性
按照验证实验1的操作过程,检测并计算出相对标准偏差(rsd,relativestandarddeviation)分别为5.59%、3.07%和4.99%。
验证实验4
验证实施例2的酶生物传感器体系在检测大黄鱼样品溶液中的黄嘌呤浓度的精确性
按照验证实验2的操作过程,检测并计算出相对标准偏差(rsd,relativestandarddeviation)分别为3.18%、7.12%和3.45%。
应用例1
利用实施例2的酶生物传感器检测不同时间下鱿鱼样品中次黄嘌呤含量的变化
鱿鱼样品溶液的制备过程如下:
将所购买的新鲜鱿鱼搅碎,分为2g每份;首先取出一份样品(标记为0h),其余样品暂时在4℃条件下贮藏。
取标记为0h的样品,将其加入到10ml、0.05m、ph=7.5的pbs溶液中;搅拌5min后在4000rpm的条件下离心15min;取离心后的上清液过滤。取100μl滤液,用0.05m、ph=7.5的pbs溶液稀释至10ml,获得0h的鱿鱼样品溶液。
采用验证实验1同样的方式,测得0h的鱿鱼样品溶液的响应电流值,再对照上述图1的次黄嘌呤浓度的标准曲线,测得0h的鱿鱼样品溶液中的次黄嘌呤浓度为2.902μm。
再分别于1h、3h、5h、7h、9h、11h取出一份样品,按照同样的方式,测得1h、3h、5h、7h、9h、11h的鱿鱼样品溶液中的次黄嘌呤浓度分别为4.402、7.172、10.508、13.345、15.247、18.193μm。
应用例2
利用实施例2的酶生物传感器检测不同时间下大黄鱼样品中次黄嘌呤含量的变化
按照和应用例1同样的操作,测得0h、1h、3h、5h、7h、9h、11h的大黄鱼样品样品溶液中的次黄嘌呤浓度分别为0.532、0.672、0.875、1.023、1.256、1.405、1.615μm。
应用例3
利用实施例2的酶生物传感器检测不同时间下鱿鱼样品中黄嘌呤含量的变化
按照和应用例1同样的配制方法获得鱿鱼样品溶液。
采用验证实验1同样的方式,测得0h、1h、3h、5h、7h、9h、11h的鱿鱼样品溶液的响应电流值,再对照上述图2的黄嘌呤浓度的标准曲线,测得0h、1h、3h、5h、7h、9h、11h的鱿鱼样品溶液中的黄嘌呤浓度分别为0、0、0、0、0、0、0.502、0.902μm。
应用例4
利用实施例2的酶生物传感器检测不同时间下大黄鱼样品中黄嘌呤含量的变化
按照和应用例3同样的操作,测得0h、1h、3h、5h、7h、9h、11h的大黄鱼样品样品溶液中的黄嘌呤浓度分别为0、0、0、0.672、1.092、1.673、2.065μm
将上述应用例1和应用例2的实验结果,进行图谱绘制,获得了不同贮藏时间下鱿鱼和大黄鱼样品中次黄嘌呤的含量的变化,参见图3。
将上述应用例3和应用例4的实验结果,进行图谱绘制,获得了不同贮藏时间下鱿鱼和大黄鱼样品中黄嘌呤的含量的变化,参见图4。
从上述验证实验1-4和应用例1-4的结果可以看出,本发明所制造的生物传感器可以用于检测次黄嘌呤和黄嘌呤,并且有着较高的精准性,不仅能够检测低浓度的底物(对于低浓度的底物,例如浓度范围为0.01μm~10μm的低浓度,检测相对标准偏差不超过8%),而且对于次黄嘌呤和黄嘌呤的浓度变化有着较高的灵敏性,且有较宽的检测范围(0.01μm-10μm);另外,本发明所制造的生物传感器体系采用本发明的工作电极并配合电化学工作站,可以高效快速地获得次黄嘌呤和黄嘌呤的浓度检测结果,并且具有很好的稳定性,可以重复使用,多次使用下仍能够保持对底物的灵敏检测。
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!