一种可抛式核酸适配体传感器及其检测大田软海绵酸方法与流程
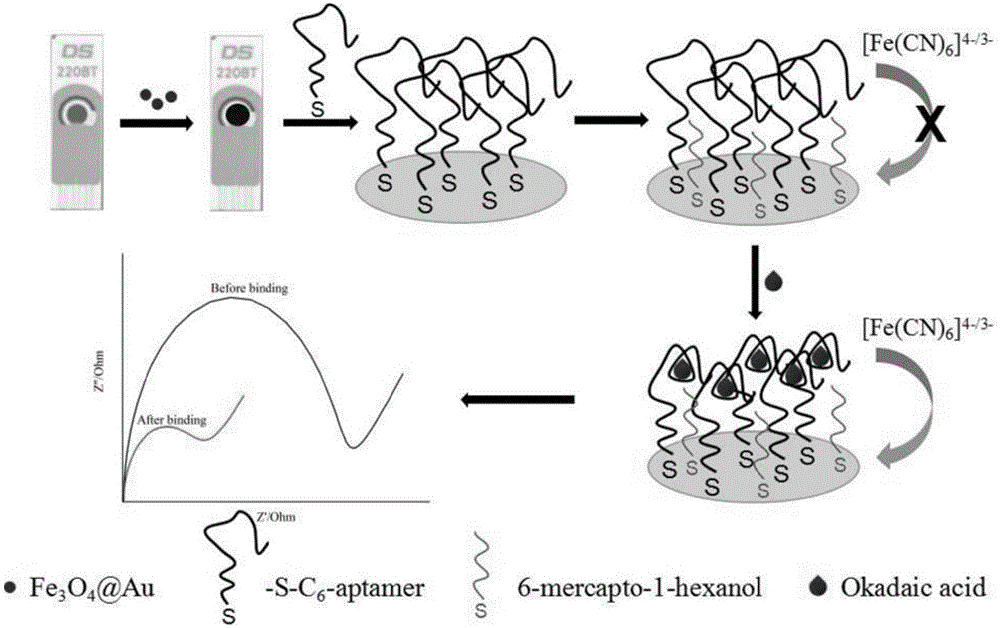
本发明涉及一种可抛式核酸适配体传感器及其检测大田软海绵酸方法,具体是以核酸适配体作为识别探针,利用核壳型纳米金磁微粒(fe3o4@au)与核酸适配体5’端修饰的巯基的吸附作用将识别探针固定于丝网印刷金电极(screen-printedgoldelectrode,spge)的工作电极表面,研制出一种可抛式核酸适配体传感器,实现了贝类中大田软海绵酸的快速、高灵敏检测。属于水产品安全检测技术领域。
背景技术:
大田软海绵酸(okadaicacid,oa)是腹泻性贝类毒素(diarrheticshellfishpoisoning,dsp)的主要致毒组分,由利马原甲藻及部分鳍藻等产毒微藻产生,经双壳贝类滤食性摄入后富集在消化腺内。oa可引发误食者恶心、呕吐、腹泻;对细胞质内蛋白磷酸酶的活性有着强烈的抑制作用,影响正常的细胞活动;甚至对人类细胞具有直接的毒害作用,干扰dna的修复过程,改变基因的表达,诱导肿瘤形成。为消除毒素对自身的毒害作用,贝类可通过复杂的生化反应将部分高毒性游离态的oa转化为形态各异的低毒性酯化态衍生物。此外,因oa具有脂溶性和热稳定性,在加工过程中很难通过常见的加工技术将其去除,甚至可能因贝类脱水及酯化态毒素向游离态的转化,从而导致毒素的毒性提高。为加强贝类安全的前端防控,国际食品法典委员会及欧盟规定双壳贝类可食性组织中dsp含量不得超过160μg/kg(以oa计),为进一步降低食用风险,欧盟食品安全局根据风险评估结果拟将其降低至45μg/kg。我国ny5073-2006《无公害食品水产品中有毒有害物质限量》规定其不得检出。由于伦理道德等原因,欧盟指令(ec)no.15/2011规定小鼠生物法作为官方标准方法仅限于2014年底前使用,以液相色谱-串联质谱法(lc-ms/ms)作为取代方法,并鼓励建立免疫分析等新型检测方法作为补充方法。
技术实现要素:
本发明解决的技术问题是提供一种可抛式核酸适配体传感器及其检测大田软海绵酸方法,以提供一种简便快捷、绿色环保的技术手段,克服现有检测方法仪器昂贵、有机试剂用量大、操作难度大,难以实现现场、快速检测等缺陷。本发明以核酸适配体为识别探针,利用核壳型纳米金磁微粒(fe3o4@au)与核酸适配体5’端修饰的巯基的吸附作用将识别探针固定于丝网印刷金电极(screen-printedgoldelectrode,spge)的工作电极表面,制备了一种可抛式核酸适配体传感器。以研制的传感器为检测手段,同时在贝类样品前处理过程中增加碱性水解步骤将oa的酯化态衍生物转化为游离态oa,实现了贝类体内oa总量的快速、高灵敏检测。
本发明是通过以下技术方案实现的:
一种可抛式核酸适配体传感器的制备方法,具体步骤如下:
(1)spge的预处理:丝网印刷金电极,以下简称spge,使用前置于0.5mol/lh2so4溶液中进行预处理,在0-1.25v电位范围内以0.1v/s速率采用循环伏安法(cyclicvoltammetry,cv)扫描5min,以提高传感界面的粗糙度而利于其功能化修饰;
(2)传感器的制备:将步骤(1)处理的spge用超纯水冲洗吹干后,在其工作电极背面对应处固定一圆形磁铁,在工作电极表面滴加10μl1mg/mlfe3o4@au混悬液,待fe3o4@au固定后,滴加10μl5μmol/l核酸适配体溶液,置于湿盒中反应过夜;用超纯水冲洗后,在工作电极表面滴加10μl1mmol/lmch溶液反应1h,以封闭多余的吸附位点即完成传感器的制备。
本发明还提供利用所述可抛式核酸适配体传感器进行检测贝类中大田软海绵酸的方法,具体步骤如下
(1)样品前处理:称取匀浆样品,用甲醇进行毒素提取,涡旋振荡2min,8000r/min离心5min,将上清液用甲醇定容;准确移取提取液,加入naoh溶液混匀后密封进行高温水解;待溶液冷却至室温继续加入hcl溶液中和后氮吹近干,再加入缓冲溶液复溶,涡旋混匀,待测;
(2)大田软海绵酸的测定:在传感器工作电极表面滴加oa标准溶液或样品溶液,反应结束后,用超纯水冲洗,然后在含终浓度5mmol/lk3[fe(cn)6]、5mmol/lk4[fe(cn)6]和0.1mol/lkcl的ph7.4、浓度10mmol/lpbs缓冲液中以频率范围0.1-10000hz,振幅0.01v,初始电位0.23v进行电化学阻抗谱eis测试,记录标准溶液或样品溶液反应前后的阻抗值以完成定量测定。
进一步,所述步骤(1)提取液与naoh溶液进行水解时的溶液体积比为1:1.25,水解条件为76℃下温育40min。
进一步,所述步骤(1)加入的naoh与加入的hcl物质的量相等。
进一步,步骤(2)在传感器工作电极表面滴加oa标准溶液或样品溶液,反应时间为45min。
本发明与现有技术相比的有益效果:
(1)和基于抗原-抗体反应原理的免疫传感器相比,核酸适配体的合成和使用更加简单价廉,大幅降低传感器的制备成本。
(2)通过引入核壳型纳米金磁微粒(fe3o4@au)改进传感器的组装过程,提高检测方法灵敏度的同时扩大了线性范围,检出限为0.1μg/l,比国标方法的检出限值降低一个数量级。应用于实际贝类样品检测时最低检出浓度为1μg/kg,定量范围为1-800μg/kg。
(3)一次性可抛spge的使用,省去了传统电极繁杂的抛光过程,同时避免了因基质成分或待测物在电极表面的吸附而造成的电极污染、钝化或干扰现象。
(4)样品前处理过程增加碱性水解步骤将oa的酯化态衍生物转化为游离态oa,实现了贝类体内oa总量的测定,有效避免贝类食用安全风险。
(5)测试方法操作简单,仅通过电化学工作站采用eis测试即可得到贝类中oa的定量结果,检测液不使用有机试剂,可作为一种新型、绿色的快速检测手段用于贝类样品中oa的日常监测,实现对贝类样品的快速筛查。
附图说明
图1为可抛式核酸适配体传感器制备过程及检测原理示意图。
图2为经过不同修饰步骤的丝网印刷金电极的电化学阻抗谱nyquist图(内插图为等效电路图)。
图3为核酸适配体浓度对传感器阻抗变化量的影响。
图4为oa反应时间对传感器阻抗变化量的影响。
图5为oa浓度-阻抗变化量一元线性曲线。
具体实施方式
下面通过实施例对本发明的技术方案做进一步解释,但本发明的保护范围不受实施例任何形式上的限制。
一种高灵敏检测贝类中大田软海绵酸的可抛式核酸适配体传感器及其检测方法,包括以下步骤:
(1)样品前处理:称取2g匀浆样品,用18ml甲醇进行毒素提取,涡旋振荡2min,8000r/min离心5min,将上清液于20ml容量瓶中用甲醇定容。准确移取1ml提取液,加入125μl2.5mol/lnaoh溶液混匀后密封,于76℃下温育40min。待溶液冷却至室温继续加入125μl2.5mol/lhcl溶液中和后氮吹近干,再加入1mlpbs缓冲溶液复溶,涡旋混匀,待测。
(2)spge的预处理:spge使用前置于0.5mol/lh2so4溶液中进行预处理,在0-1.25v电位范围内以0.1v/s速率采用循环伏安法(cyclicvoltammetry,cv)扫描5min,以提高传感界面的粗糙度而利于其功能化修饰。
(3)传感器的制备:将spge用超纯水冲洗吹干后,在其工作电极背面对应处固定一直径为4mm的圆形磁铁,在工作电极表面滴加10μl1mg/mlfe3o4@au混悬液,待fe3o4@au固定后,滴加10μl5μmol/l核酸适配体溶液,置于湿盒中反应过夜。用超纯水冲洗后,在工作电极表面滴加10μl1mmol/lmch溶液反应1h,以封闭多余的吸附位点即完成传感器的制备。
可抛式核酸适配体传感器的制备过程及检测原理如图1所示。检测过程中,当无oa存在时,核酸适配体的空间结构比较松散,阻碍电子在传感界面的传递,导致传感器阻抗值升高;当oa存在时,与核酸适配体结合后空间结构变得紧密,为电子的传递提供更多的空间,导致传感界面的电子传递增多,阻抗值下降。根据传感器反应前后阻抗值的变化量与oa浓度对数值之间的线性关系实现对毒素的定量检测。
采用eis对传感器的不同组装步骤进行电化学表征,图2为电化学阻抗谱的nyquist图,其半圆直径和电极表面的电子传递阻抗值正相关,内插图为拟合的阻抗谱的等效电路图,由溶液阻抗rs、电子传递阻抗ret、恒相位元件c和warburg阻抗w构成,等效电路图各元件参数如表1所示。
表1电化学阻抗谱等效电路图元件参数
根据图2和表1,电极未进行修饰时,电子在裸电极的表面传递不受阻碍,而fe3o4@au的引入能够促进电子传递,故其在电极表面的修饰并未引起ret值和半圆直径的明显增加。核酸适配体的结合增加了电极表面的传质阻力,导致半圆直径增加,ret值也显著上升;mch的封闭进一步阻碍电子的转移,半圆直径和ret值继续增大;当核酸适配体结合后,其空间结构比较松散,阻碍电子在传感界面的传递,导致传感器阻抗值继续升高;当oa与核酸适配体特异性结合后,半圆直径减小,ret值出现下降,说明二者特异性结合产生的复合物空间结构变得紧密,为电子传递提供更多位点。
传感界面核酸适配体的组装量影响目标物的结合量,进而影响方法的检测性能,本实验对核酸适配体浓度进行了优化。分别在已固定好fe3o4@au的传感界面滴加浓度为1、2、5和10μmol/l的核酸适配体溶液,反应过夜后进行eis测试。由图3看出,当溶液浓度为5μmol/l时,δret值达到最高,随后增幅放缓,说明电极表面的fe3o4@au无多余的结合位点,即对核酸适配体的结合基本达到饱和。因此采用5μmol/l的核酸适配体溶液作为传感器组装条件。
(4)大田软海绵酸的测定:在传感器工作电极表面滴加10μloa标准溶液或样品溶液,反应45min,经超纯水冲洗后在含5mmol/lk3[fe(cn)6]、5mmol/lk4[fe(cn)6]和0.1mol/lkcl的检测液中以频率范围0.1-10000hz,振幅0.01v,初始电位0.23v进行电化学阻抗谱(electrochemicalimpedancespectroscopy,eis)测试,记录标准溶液或样品溶液反应前后的阻抗值以完成定量测试。
oa与核酸适配体之间的结合反应与其孵育时间相关。实验考察了oa孵育时间在15、30、45和60min时对应的δret变化情况。由图4可见,δret随着孵育时间的延长而逐渐增大,当时间达到45min以后,变化量趋向平稳,表明45min即可使oa与核酸适配体的反应达到完全,即最佳孵育时间为45min。(5)根据步骤(4)所测阻抗差值与大田软海绵酸标准溶液浓度的对数呈线性关系,绘制工作曲线。
将按步骤(1)处理好的样品溶液按照步骤(4)的方法进行测试,根据其阻抗的变化值与步骤(5)得到的oa工作曲线,计算贝类样品中oa的含量。
图5为根据不同浓度oa标准溶液与传感器反应前后δre的关系拟合的标准曲线。δret与oa浓度在0.1-80μg/l范围内的对数值呈线性关系,一元线性回归方程为y=189.12lnx+752.59(r2=9976);而无fe3o4@au修饰的传感器,其线性范围仅为0.5-50μg/l。方法适用于oa的定量分析,检出限为0.1μg/l,应用于实际贝类样品检测时最低检出浓度为1μg/kg,定量范围为1-800μg/kg。(7)以oa测试结果为阴性的牡蛎、贻贝和扇贝作为空白基质,分别添加3个浓度的oa标准溶液,使毒素浓度分别为10、100和500μg/kg,进行加标回收率和精密度实验,每个浓度设置3组平行。加标回收率及精密度结果见表2。根据实验结果,oa的平均回收率为91.95%-118.56%,相对标准偏差小于12%,表明该方法具有较高的回收率和良好的精密度。
表2方法的加标回收率和精密度结果(n=3)
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法