一种检测铅离子的电化学传感器及其制备方法与流程
本发明涉及电化学传感器技术领域,特别涉及一种检测铅离子的电化学传感器及其制备方法。
背景技术:
作为一种众所周知和不可降解的环境污染物,铅离子能够通过食物链在人体内富集,同时对免疫系统,中枢神经系统,生殖系统造成危害,尤其是儿童。因此,构建一种有效的能够检测环境中痕量铅离子的分析方法是很迫切而且重要的。
目前,常用的铅离子检测方法包括原子吸收光谱法,原子发射光谱法,电感耦合等离子体质谱法,x-射线荧光光谱法等,这些方法往往存在仪器昂贵、分析周期长、样品预处理复杂、检测费用昂贵等问题,已经难以适应铅离子检测的方便、快捷、灵敏度等方面的要求。
因此,目前急需建立一种快速,灵敏且高特异性的检测方法来检测环境中的痕量铅离子。
技术实现要素:
为了解决以上现有技术中检测铅离子的方法特异性和灵敏度都比较低、成本高的问题,本发明提供了一种特异性和灵敏度高、成本低、检测速度快的基于dna酶引发cha扩增和纳米金连接检测铅离子的电化学传感器。同时本发明还提供了基于dna酶引发cha扩增和纳米金连接检测铅离子的电化学传感器的制备方法。
一种检测铅离子的电化学传感器,在电极上依次修饰有cp2层、hp1-hp2-hp3-cp1-aunp层、[ru(nh3)6]3+层;
所述的hp1-hp2-hp3-cp1-aunp层由均相溶液反应获得,原料包括sp-aunp、dp、hp1、hp2、hp3以及待测目标物;
所述的dp与sp-aunp能够形成dna酶,在铅离子存在的条件下,dna酶将修饰在纳米金上的sp链切割成cp1和tp,tp用于引发催化发夹组装反应形成hp1-hp2-hp3聚合体,cp1-aunp则与聚合体的末端部分杂交成hp1-hp2-hp3-cp1-aunp层;
所述的碱基序列为:
dp序列如seqno.1所示;
底物探针sp序列如seqno.2所示;
cp1序列如seqno.3所示;
tp序列如seqno.4所示;
hp1序列如seqno.5所示;
hp2序列如seqno.6所示;
hp3序列如seqno.7所示;
cp2序列如seqno.8所示;
所述的sp包括cp1及tp,以及两者中间通过rna碱基相连,其与tp的5’端的g碱基之间是铅离子切割位点。
所述的hp1-hp2-hp3-cp1-aunp层中hp1(摩尔)、hp2(摩尔)、hp3(摩尔)、cp1-aunp(摩尔,以cp1浓度算)的摩尔比为1:1:1:3。
上述电化学传感器的制备方法,包括以下步骤:
(1)对电极进行抛光预处理;
(2)将cp2层修饰到电极表面;
(3)将hp1-hp2-hp3-cp1-aunp层修饰到电极表面;
(4)将[ru(nh3)6]3+层修饰到电极表面;
(5)检测。
所述的步骤(2)的操作步骤为:将cp2滴加到经过预处理的电极表面,孵育,清洗。
所述的步骤(3)的操作步骤为:
s1将pbs缓冲液、hp1、hp2、hp3、sp-aunp、dp、待测目标物、灭菌水,混合震荡,孵育。
s2将孵育好的混合溶液滴加到修饰好cp2层的电极上,孵育,清洗。
所述的步骤(4)的操作步骤为:将[ru(nh3)6]3+滴加到第(3)步反应完成电极上,孵育,清洗。
所述步骤(1)中的电极为金电极。
所述的步骤(5)的检测工艺为:以ag/agcl为参比电极,以pt电极为对电极,电位设置为0到-0.5v,脉冲宽度0.05v,扫描速率为0.06s,采用差分脉冲伏安法读取电信号的变化,检测待测目标物。
上述电化学传感器在测环境中的痕量铅离子上的应用。
本发明一共用到了6条dna链,其序列分别是:
dna酶(dp):5’-ggagtagtgtccgagccggtcgaaatagttggt-3’
底物探针(sp):5’-aaaaaaaaaagcttgagattaacaaccaactatagcactactccctaacatctcaagc-3’(其中,下划线a为rna碱基;其左侧为cp1序列,右侧为tp序列)
hp1:5’-aggttagcttgagatgttagggagtagtgctaacctcacaacgcactactccctaacatcggttgttaatctca-3’
hp2:5’-gatgttagggagtagtgcgttgtgaggttaaacatctcaagctaacctcacaacgcactaggttgttaatctca-3’
hp3:5’-tagtgcgttgtgaggttagcttgagatgttgcactactccctaacatctcaagctaacctggttgttaatctca-3’
cp2:5’-sh-tttttagttggttgttaatctca-3’
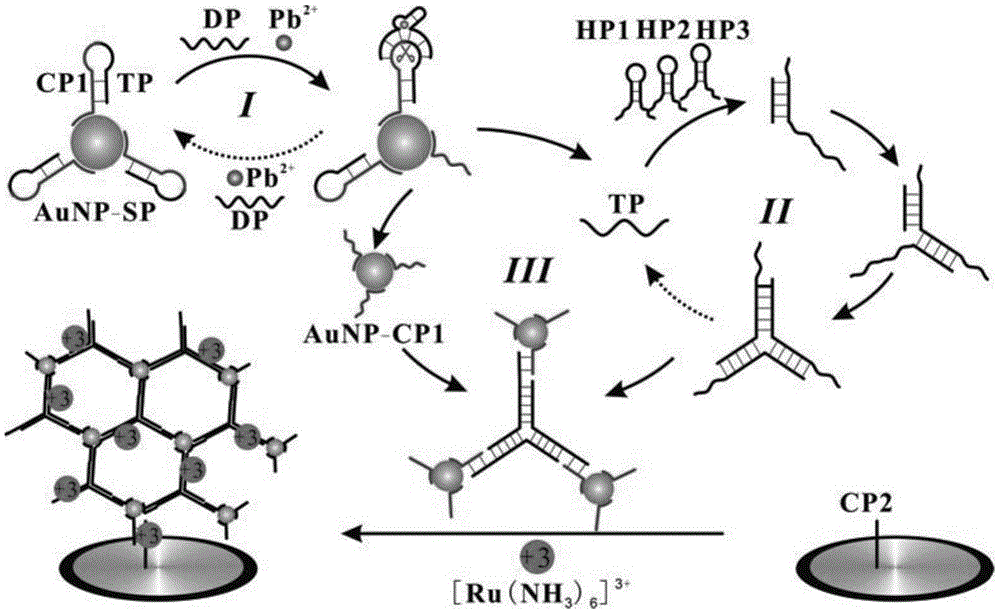
其中,sp包括捕获探针(cp1,rna碱基左侧序列)和引物探针(tp,rna碱基右侧序列)两部分,下划线a为rna碱基,其与g碱基之间是铅离子切割位点。sp通过polya与纳米金(aunp)表面连接。在铅离子存在情况下,dna酶探针(dp)能够与sp形成如图1的构象,且铅离子此时能够切割sp链,从而释放tp以及cp1-aunp。
tp能够诱导hp1,hp2和hp3产生催化发夹组装(cha,catalytichairpinassembly),暴露出三个发夹斜体部分,并各自与cp1-aunp杂交形成hp1-hp2-hp3-cp1-aunp聚合体。
cp2的5’端修饰有巯基(-sh),可以与金电极形成稳定的au-s键,从而固定在电极表面;cp2能够与cp1-aunp杂交,使hp1-hp2-hp3-cp1-aunp聚合体固定在电极表面。加入三氯六氨合钌[ru(nh3)6]3+,其能够在dna链上静电吸附,通过电化学扫描差分脉冲伏安法可以得到明显增强的电信号,我们就是通过检测该信号来达到定量检测目标物的目的。
均相中发生的反应主要有:在有目标物铅离子存在的情况下,纳米金上的sp发夹与dp链自发形成图1构象,此时铅离子能够剪切sp释放cp1和tp。同时,释放的dp以及铅离子能够继续同纳米金表面剩余的sp继续作用,这是第一步循环放大。产生的tp能够诱导hp1,hp2和hp3产生cha反应形成dna聚合分支结构,同时释放tp去继续诱导其他的cha反应(第二步信号放大),暴露出的三部分短链可以同第一步循环中产生的cp1-aunp杂交,使得dna聚合分支结构与纳米金形成聚合体,这是第三步扩增。此时,电极上已经修饰好的cp2能够与聚合体上的cp1结合,使聚合体固定在电极表面。加入[ru(nh3)6]3+后,其能够在dna链上静电吸附,从而得到明显增强的电信号。
附图说明
图1为该实验的原理图;
图2为实施例1hp1浓度优化检测结果图;
图3为实施例2cp2浓度优化检测结果图;
图4为实施例3sp-aunp浓度优化检测结果图;
图5为实施例4传感器检测铅离子的工作曲线。
本发明的有益效果:
1.特异性高
利用dna酶的特异性识别实现了对目标物铅离子的高特异性检测;
2.灵敏度高
利用铅离子的切割作用,实现了目标物的循环利用,起到了第一步信号增大的作用;利用cha反应,实现了信号的第二步循环放大;依靠纳米金的连接作用进行第三步信号扩增,实现了对目标物的高敏检测,提高了检测的灵敏度;检测原理的主要过程均是在电极上实现的,提高了反应速度,降低了操作的复杂程度,实现了目标物的快速,简单,灵敏的检测;该方法检测下限为0.05nm;
3.适合产业化
该传感器的反应条件温和,反应速度快;由于使用金电极,其电极简便、小型化、易携带、可多次使用;制备方法简单,性能稳定,电极的重复性好,适用于水环境中铅离子的检测和生物传感器产业化的实际应用;制作电极的工艺成本低,适用于产业化中价廉的要求。
具体实施方式
下面结合具体实施例对本发明进行进一步说明。
实施例1
一种本发明所述电化学生物传感器的制备方法:
a、金电极首先在0.3和0.05µm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;
b、将10μl1μm的cp2通过au-s键滴加到电极表面,在室温下孵育2h,清洗。
至此电极的修饰过程先告一段落,下面介绍一下均相溶液中发生的反应,均相反应中的主要步骤:
a、将1xpbs缓冲液,(0μm,0.5μm,1μm,1.5μm,2μm)hp1,1μmhp2,1μmhp3,3μmsp-aunp(1nm),1μmdp和待测目标物各2μl、灭菌水6μl加入离心管中,震荡30s,放入37℃的恒温箱中孵育2h;
b、将a步反应后的溶液(10μl)滴加到预先修饰好cp2的电极上。然后将电极继续放在37℃的恒温箱中2h;
c、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
d、将10μl50μm[ru(nh3)6]3+滴加到c步反应后的电极上,然后将电极继续放在37℃的恒温箱中10min。
e、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
以ag/agcl为参比电极,以pt电极为对电极,采用差分脉冲伏安法(dpv)进行信号的检测,dpv检测的底液是pbs(10mm,ph为7.4),电位设置为0到-0.5v,扫描速率为0.06s,脉冲宽度为0.05v。
结果见图2,从图中可以看出,检测到的电流信号随着hp1的浓度在0-1μm区间内增大而增大,当浓度超过1μm后,电流趋于稳定,所以hp1的最佳浓度为1μm。此外,由于hp1,hp2和hp3能够在tp作用下产生cha反应,因此,三者的浓度应该是1:1:1的关系。即:hp1,hp2和hp3的最佳浓度都是1μm。
实施例2
一种本发明所述电化学生物传感器的制备方法:
a、金电极首先在0.3和0.05µm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;
b、将10μl(0μm,0.5μm,1μm,1.5μm,2μm)的cp2滴加到电极表面,在室温下孵育2h。通过au-s键将cp2链固定到电极表面,清洗;
至此电极的修饰过程先告一段落,下面介绍一下均相溶液中发生的反应,均相反应中的主要步骤:
a、将1xpbs缓冲液,1μmhp1,1μmhp2,1μmhp3,3μmsp-aunp(1nm),1μmdp和待测目标物各2μl、灭菌水6μl加入离心管中,震荡30s,放入37℃恒温箱孵育2h;
b、将a步反应后的溶液(10μl)滴加到预先修饰好cp2的电极上。然后将电极继续放在37℃的恒温箱中2h;
c、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
d、将10μl50μm[ru(nh3)6]3+滴加到c步反应后的电极上,然后将电极继续放在37℃的恒温箱中10min。
e、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
以ag/agcl为参比电极,以pt电极为对电极,采用差分脉冲伏安法(dpv)进行信号的检测,dpv检测的底液是pbs(10mm,ph为7.4),电位设置为0到-0.5v,扫描速率为0.06s,脉冲宽度为0.05v。
结果见图3,从图中可以看出,检测到的电流信号随着cp2的浓度在0-1μm区间内增大而增大,当浓度超过1μm后,电流趋于稳定,所以cp2的最佳浓度为1μm。
实施例3
一种本发明所述电化学生物传感器的制备方法:
a、金电极首先在0.3和0.05µm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;
b、将10μl1μm的cp2滴加到电极表面,在室温下孵育2h。通过au-s键将cp2链固定到电极表面,清洗;
至此电极的修饰过程先告一段落,下面介绍一下均相溶液中发生的反应,均相反应中的主要步骤:
a、将1xpbs缓冲液,1μmhp1,1μmhp2,1μmhp3,(1.2μm,2.1μm,3μm,3.9μm,4.8μm)sp-aunp(0.4nm,0.7nm,1nm,1.3nm,1.6nm),1μmdp和待测目标物各2μl、灭菌水6μl加入离心管中,震荡30s,放入37℃的恒温箱中孵育2h;其中,aunp后的每个浓度都与sp每个浓度相对应。
b、将a步反应后的溶液(10μl)滴加到预先修饰好cp2的电极上。然后将电极继续放在37℃的恒温箱中2h;
c、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
d、将10μl50μm[ru(nh3)6]3+滴加到c步反应后的电极上,然后将电极继续放在37℃的恒温箱中10min。
e、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
以ag/agcl为参比电极,以pt电极为对电极,采用差分脉冲伏安法(dpv)进行信号的检测,dpv检测的底液是pbs(10mm,ph为7.4),电位设置为0到-0.5v,扫描速率为0.06s,脉冲宽度为0.05v。
结果见图4,从图中可以看出,检测到的电流信号随着sp-aunp的浓度在1.2-3μm区间内增大而增大,当浓度超过3μm后,电流趋于稳定,所以sp-aunp的最佳浓度为3μm。
实施例4
一种本发明所述电化学生物传感器的制备方法:
a、金电极首先在0.3和0.05µm的氧化铝浆中进行抛光处理,直到呈镜面,用pbs和二次水反复冲洗;
b、将10μl1μm的cp2滴加到电极表面,在室温下孵育2h。通过au-s键将cp2链固定到电极表面,清洗;
至此电极的修饰过程先告一段落,下面介绍一下均相溶液中发生的反应,均相反应中的主要步骤:
a、将1xpbs缓冲液,1μmhp1,1μmhp2,1μmhp3,3μmsp-aunp(1nm),1μmdp和(0nm,0.05nm,0.1nm,1nm,10nm,100nm,1μm,5μm,10μm)待测目标物各2μl、灭菌水6μl加入离心管中,震荡30s,放入37℃的恒温箱中孵育2h;
b、将a步反应后的溶液(10μl)滴加到预先修饰好cp2的电极上。然后将电极继续放在37℃的恒温箱中2h;
c、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
d、将10μl50μm[ru(nh3)6]3+滴加到c步反应后的电极上,然后将电极继续放在37℃的恒温箱中10min。
e、用磁力搅拌器在pbs溶液中清洗电极,每次10min,共清洗3次。
以ag/agcl为参比电极,以pt电极为对电极,采用差分脉冲伏安法(dpv)进行信号的检测,dpv检测的底液是pbs(10mm,ph为7.4),电位设置为0到-0.5v,扫描速率为0.06s,脉冲宽度为0.05v。
结果见图5。从图5中可以看出,检测到的电流信号随着目标物浓度在0.05nm-5μm区间内增大而增大,且铅离子浓度的对数与电流峰值大小呈正比关系,拟合曲线:i=2.3+0.5lg(c/nm)(相关系数是0.97684,其中c代表了铅离子的浓度),同时,我们在0.05nm的浓度基础上继续向更低的浓度检测,经检测当浓度低于0.05nm时,铅离子浓度的对数与电流峰值大小恰好不再符合拟合曲线规律,即图中的电流峰值最低值。因此,可得到该方法检测下限为0.05nm。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
序列表
<110>济南大学
<120>一种检测铅离子的电化学传感器及其制备方法
<160>8
<170>siposequencelisting1.0
<210>1
<211>33
<212>dna
<213>人工序列(artiartificialsequence)
<400>1
ggagtagtgtccgagccggtcgaaatagttggt33
<210>2
<211>58
<212>dna
<213>人工序列(artiartificialsequence)
<400>2
aaaaaaaaaagcttgagattaacaaccaactatagcactactccctaacatctcaagc58
<210>3
<211>33
<212>dna
<213>人工序列(artiartificialsequence)
<400>3
aaaaaaaaaagcttgagattaacaaccaactat33
<210>4
<211>24
<212>dna
<213>人工序列(artiartificialsequence)
<400>4
gcactactccctaacatctcaagc24
<210>5
<211>74
<212>dna
<213>人工序列(artiartificialsequence)
<400>5
aggttagcttgagatgttagggagtagtgctaacctcacaacgcactactccctaacatc60
ggttgttaatctca76
<210>6
<211>74
<212>dna
<213>人工序列(artiartificialsequence)
<400>6
gatgttagggagtagtgcgttgtgaggttaaacatctcaagctaacctcacaacgcacta60
ggttgttaatctca76
<210>7
<211>74
<212>dna
<213>人工序列(artiartificialsequence)
<400>7
tagtgcgttgtgaggttagcttgagatgttgcactactccctaacatctcaagctaacct60
ggttgttaatctca76
<210>8
<211>23
<212>dna
<213>人工序列(artiartificialsequence)
<400>8
tttttagttggttgttaatctca23
- 还没有人留言评论。精彩留言会获得点赞!