苯丙氨酸代谢变化在脑缺血/再灌注损伤程度评价中的应用的制作方法
本发明属于神经医学领域,涉及利用液相色谱-串联质谱法(lc-ms/ms方法)检测外周血等样本中苯丙氨酸含量变化,用于在药物试验中评价脑缺血/再灌注损伤程度的变化。
背景技术:
脑卒中在医学上是指由于血流不畅导致的脑部细胞死亡。脑卒中主要分为缺血性(由于血供不足造成)和出血性(由于出血造成)两类。颈内动脉和椎动脉的闭塞、狭窄等,均易引发缺血性脑卒中,导致脑功能的部分丧失,且男性多发。据统计,全球有大约4240万脑卒中病史的患者存活。在1990至2010年间,发达国家脑卒中患者的数量以每年大约10%的速度下降,而在发展中国家则是以每年约10%的速度递增。2016年脑卒中死亡患者达630万,占总体死亡人数的11%。大约一半的脑卒中患者生存期小于1年。我国每年约有150~200万新发脑卒中病例,其中约70%是缺血性脑卒中,已经成为我国仅次于恶性肿瘤和心血管疾病的第三大致死原因和首要致残病因。缺血性脑卒中的主要原因是血管阻塞或狭窄,导致局部的脑组织血供不足;而出血性脑卒中则是由于脑动脉瘤破裂等原因,导致血液直接进入脑组织或是脑膜间隙所致。国家卫计委2017年公布的《中国缺血性脑卒中急性期诊疗指导规范》指出,急性缺血性脑卒中的处理应强调早期诊断、早期治疗、早期康复和早期预防再发。溶栓治疗是目前最重要的恢复血流措施,重组组织型纤溶酶原激活剂(rtpa)和尿激酶是我国目前使用的主要溶栓药。然而,大量研究表明,快速的脑缺血后血流再灌注,易诱发缺血灶局部大量炎症细胞的激活和炎症因子的释放,促使神经细胞内反应活性氧(ros)水平增加和细胞凋亡,最终导致神经细胞发生缺血/再灌注(i/r)损伤。i/r损伤的机制异常复杂,涉及线粒体和ros损伤、谷氨酸等兴奋性氨基酸的毒性反应、细胞内ca2+的超载、炎症反应、细胞凋亡和自噬等多种机制。
代谢组学(metabonomics)是对某一个体、组织或细胞内含有的所有代谢产物进行定性和定量分析的一门新兴学科。目前,代谢组学已经与基因组学、转录组学、蛋白质组学等多种组学技术共同构成系统生物学的组学研究技术平台。近年来,随着质谱、核磁共振等检测技术平台的成熟,代谢组学逐渐渗透到各个领域,在脑缺血损伤过程中的应用也是日益深入。近年来,多家实验室相继报道在脑缺血损伤过程中伴随着细胞代谢状态的急剧改变,并且发现了显著变化的代谢标记物。这些内源性代谢物主要与能量代谢、氨基酸代谢和脂类代谢相关:(1)氨基酸类:包括兴奋性氨基酸(eaas)、支链氨基酸、牛磺酸、甘氨酸、谷氨酰胺、同型半胱氨酸、γ-氨基丁酸等;(2)能量代谢物:包括葡萄糖、乳酸、丙酮酸、酮体、α-酮戊二酸等;(3)其他:花生四烯酸及其代谢产物、5-ht、no、儿茶酚胺、甘油、肌醇等。其中,能量代谢物和兴奋性氨基酸是目前应用较多的内源性代谢物检测指标。
在评价病情严重程度时,除了使用评分量表,《中国急性缺血性脑卒中诊治指南2018》推荐,脑病变检查使用包括平扫ct(首选)、多模式ct、常规mri、多模式mri等。血管病变检查常用颈动脉超声、经颅多普勒(tcd)、磁共振脑血管造影(mra)、高分辨磁共振成像(hrmri)、ct血管造影(cta)和数字减影血管造影(dsa)等。然而,这些检查也存在着:需要注射碘造影剂、费用较高、检查时间稍长、患者本身的禁忌症等局限、操作技术水平的影响。aha/asa不推荐在静脉溶栓治疗前常规进行mri检查来排查颅内微出血,不推荐对发病6h内的缺血性脑卒中患者运用灌注检查来选择适于机械取栓的患者。除了以上评价措施,目前药物试验中对于脑损伤的评价一般采用的辅助措施往往需要从组织中取样。但显然,其不仅步骤复杂、耗时,而且对于人用药物临床试验而言是无法广泛采用的。
红花(carthamustinctorius)属于菊科类植物的管状花,性辛温,具有活血祛瘀的功效,目前其相关制剂广泛应用于临床治疗,发展前景十分可观。红花黄色素(sy)为含有羟基红花黄色素a(hydroxysaffloryellowa,hsya)的粗提物,hsya是红花药理功效中最有效的水溶性成分。已有大量的研究证实hsya对脑和心肌i/r损伤具有明确的保护作用,可以抑制细胞凋亡、降低ros水平、帮助修复受损神经元、促进细胞存活。此外,还具有抑制过氧化脂质和钙离子超载等功能,有助于保护细胞线粒体。有研究发现hsya可以明显的抑制nf-κb关键分子p65的细胞核转位和中性粒细胞的渗透,降低血浆血管紧张素ii的含量,并抑制血凝酶诱导的炎症反应等。与此同时,hsya还可以通过抑制神经细胞过多地摄入钙离子,并增加大鼠脑钠肽bnp水平,这可能与hsya降低脑水肿的功能有关。hsya还能显著抑制血小板的聚集作用,增加血管内皮细胞数量、黏附能力和细胞线粒体的活性,抑制血管血栓生成。hsya的神经保护作用及机理已基本明确。
技术实现要素:
本发明的目的在于提供苯丙氨酸代谢变化在脑缺血/再灌注损伤程度评价中的应用。
为达到上述目的,本发明采用了以下技术方案:
一种检测生物体及细胞中苯丙氨酸代谢的方法,包括以下步骤:
1)采用液质联用技术对生物体或生物体细胞培养物进行取样及样本(通过取样得到)检测,得到该生物体或生物体细胞培养物的样本中苯丙氨酸的含量;
2)经过步骤1)后,对同一生物体或同样的生物体给予药物处理或其他干预措施;或者,对同一生物体细胞培养物或同样的生物体细胞培养物给予药物处理或其他干预措施;
3)采用液质联用技术对给予干预措施后的生物体或生物体细胞培养物进行取样及样本检测,得到该生物体或生物体细胞培养物的样本中苯丙氨酸的含量;
4)将步骤1)及步骤3)得到的样本中苯丙氨酸的含量进行比较,根据比较结果得到干预措施下生物体或生物体细胞培养物在代谢过程中苯丙氨酸的变化情况,从而对干预措施对脑缺血/再灌注损伤程度的作用进行评价(若苯丙氨酸的含量降低,则表明脑缺血/再灌注损伤程度降低)。
优选的,所述液质联用技术选自液相色谱-串联质谱法。
优选的,所述样本选自脑组织、外周血或神经元细胞、pc12细胞等相关细胞。
优选的,所述样本在检测前通过提取代谢物、加入苯丙氨酸内标物并衍生化,然后分散于流动相中,制得液相色谱-串联质谱分析的上样检测样品。
优选的,所述提取具体包括以下步骤:将脑组织或细胞研磨后加入萃取剂,经研磨混均及离心后,取上清液;或者将外周血(血滤纸片)与萃取剂混合,经过静置,取上清液。
优选的,所述萃取剂选自乙酸乙酯和乙醇的混合液、无水甲醇、甲醇水溶液、二氯甲烷和甲醇的混合液中的一种或多种,对于脑组织或细胞,通过在研磨后依次使用上述四种萃取剂,最大程度提取样本内的苯丙氨酸等代谢物,结合液相色谱-串联质谱法准确、灵敏的特点,获得样本中苯丙氨酸的精确的含量分析结果。
优选的,所述干预措施选自药物处理。
优选的,所述药物选自红花黄色素或羟基红花黄色素a。
优选的,所述步骤1)中,生物体选自动物脑缺血/再灌注损伤模型,生物体细胞培养物选自细胞氧糖剥夺复氧损伤模型。
一种检测生物体及细胞中苯丙氨酸代谢的试剂盒,包括上述萃取剂及液相色谱-串联质谱分析用苯丙氨酸内标物。
上述检测生物体及细胞中苯丙氨酸代谢的方法在基于脑缺血/再灌注损伤程度的干预措施效果评价中的应用(例如,在药物的细胞试验、动物试验、或临床试验中)。
本发明的有益效果体现在:
本发明通过液质联用技术检测外周血或其他组织、细胞等样本中苯丙氨酸含量,方便快捷,不受检测对象生理状态影响,不需注射碘造影剂等外源性物质,通过组织或细胞中苯丙氨酸含量的变化情况对脑缺血/再灌注损伤程度的变化进行直观判断,对现有脑缺血/再灌注损伤程度的评价可以起到有效的补充和支持,为脑缺血/再灌注损伤临床治疗药物或其他干预措施的效果评价、新药开发中的药效评价提供新的参考。
进一步的,本发明对脑组织、外周血、神经元细胞和pc12细胞等不同生物样本的前处理简单有效,通过液相色谱-串联质谱联用,可以对苯丙氨酸含量进行快速、准确、可靠的检测,结合苯丙氨酸代谢变化分析,为评价脑缺血/再灌注损伤程度变化提供便利途径。
附图说明
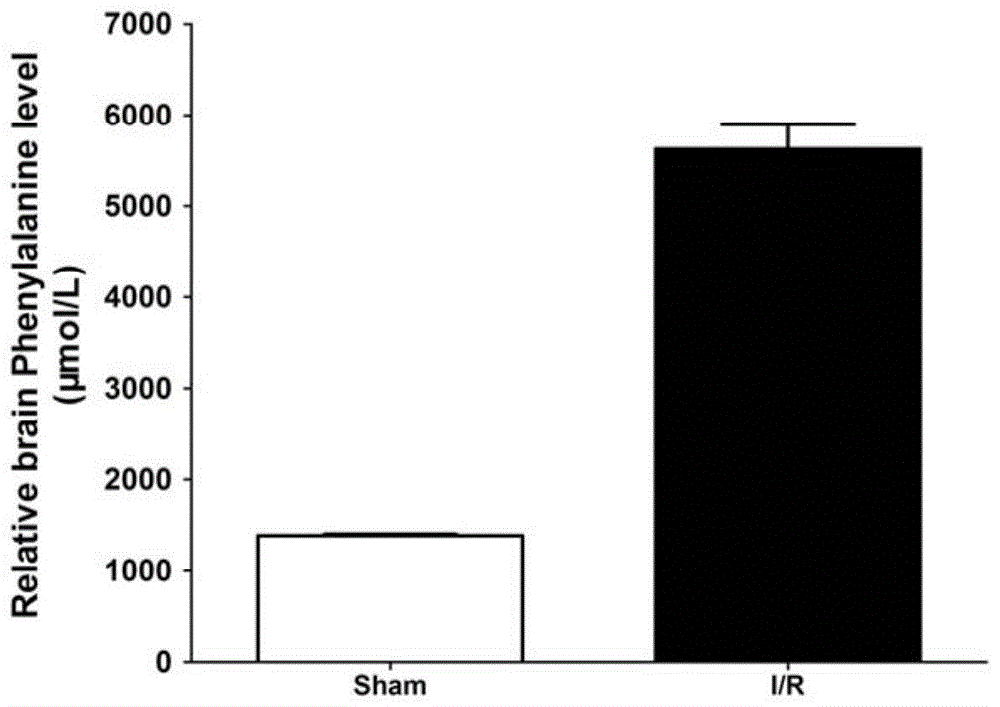
图1为control组(sham)与i/r损伤组(脑缺血再灌注组)小鼠脑组织中苯丙氨酸代谢变化统计图。
图2为control组(sham)与i/r损伤组(脑缺血再灌注组)小鼠外周血中苯丙氨酸代谢变化统计图。
图3为control组(未处理组)与ogd/r组(氧糖剥夺复氧组)小鼠神经元细胞中苯丙氨酸代谢变化统计图。
图4为control组(未处理组)与ogd/r组(氧糖剥夺复氧组)大鼠pc12细胞中苯丙氨酸代谢变化统计图。
图5为苯丙氨酸代谢通路示意图。
图6为rt-qpcr检测control组(sham)与i/r损伤组小鼠脑组织中苯丙氨酸代谢关键酶pah(苯丙氨酸羟化酶)、got1(天冬氨酸转氨酶)和tat(酪氨酸转氨酶)的表达差异统计图。
图7为rt-qpcr检测control组(未处理组)与ogd/r组小鼠神经元细胞苯丙氨酸代谢关键酶pah、got1和tat的表达差异统计图。
图8为rt-qpcr检测control组(未处理组)与ogd/r组大鼠pc12细胞苯丙氨酸代谢关键酶pah、got1和tat的表达差异统计图。
具体实施方式
下面结合附图和实施例对本发明做进一步的详细说明,所述实施例是对本发明的解释,而不是对本发明保护范围的限制。
(一)lc-ms/ms方法检测脑组织、外周血及细胞中代谢物含量
1.试剂和仪器
1.1主要试剂
氨基酸同位素内标(cambridgeisotopelabs);
乙酸乙酯、乙醇、无水甲醇、二氯甲烷、甲酸、甲醇(色谱)、正丁醇、乙腈(色谱)、乙酰氯(均购自上海国药集团化学试剂有限公司)。
1.2主要仪器
2.氨基酸同位素内标配制
共有12种氨基酸同位素内标,分别为15n,2-13c-甘氨酸(n1,c1-gly)、2h4-丙氨酸(d4-ala)、2h8-缬氨酸(d8-val)、2h3-亮氨酸(d3-leu)、2h3-蛋氨酸(d3-met)、2h5-苯丙氨酸(d5-phe)、13c6-酪氨酸(c6-tyr)、2h3-天冬氨酸(d3-asp)、2h3-谷氨酸(d3-glu)、2h2-鸟氨酸(d2-orn)、2h2-瓜氨酸(d2-cit)、2h4,13c-精氨酸(d4,cl-arg)。所有内标均用甲醇稀释为工作液,浓度除gly为12.5μmol/l外,其余均为2.5μmol/l。
3.样本采集
脑组织样本由c57bl/6小鼠解剖得到;外周血样本由c57bl/6小鼠鼠尾采血得到;pc12细胞购自中国科学院上海典型培养物保藏委员会细胞库。
4.lc-ms/ms工作条件
4.1液相色谱工作条件
流动相采用80%乙腈,四元泵流速设置变速:140μl/min,0.3min→30μl/min,1.2min→300μl/min,0.4min。自动进样器设置为每次取样20μl。
4.2质谱(ms/ms)工作条件
离子源温度(probetemperature):350℃;每次转变驻留时间(dwelltimepertransition):200ms;喷雾器(nebulizer,gas1):30psi;加热器(heatergas,gas2):40psi;气帘气(curtaingas):25psi;离子源电压(ionsprayvoltage):5500v。
质谱仪采用正离子扫描,氨基酸检测用2种不同的扫描方法,多反应检测用于甘氨酸(gly)、鸟氨酸(orn)、精氨酸(arg)和瓜氨酸(cit),其他氨基酸检测用中性丢失扫描方式。
5.苯丙氨酸含量检测步骤
5.1c57bl/6小鼠脑组织中苯丙氨酸含量的检测方法
a.组织研磨:取组织约50mg,加入200μl超纯水在研磨机中以40hz的频率研磨5min。
b.分步萃取:①400μl乙酸乙酯和乙醇的混合液(1:1,v/v),②200μl无水甲醇,③200μl无水甲醇和水的混合液(3:1,v/v),④200μl的二氯甲烷和甲醇的混合液(3:1,v/v);每加完一种溶液后在研磨机中研磨混匀2min,将研磨后的样本放入低温离心机中,4℃、12000rpm离心5min,然后吸取上清液,全程在冰上操作,剩余部分继续萃取。
c.氮吹:将样本的上清液混匀后,吸出1ml于ep管中,氮吹仪常温下吹干。
d.内标液准备:将储存在4℃冰箱中的同位素内标工作液在室温下震荡15min,取100μl加入所述ep管内,室温静置1h;65℃氮气吹干,约15min。
e.衍生:取50μl衍生剂(乙酰氯-盐酸正丁醇,9:1,v/v)加入所述ep管,置于65℃恒温箱内衍生20min;65℃内氮气吹干,约20min。
f.溶解:取150μl流动相溶液(乙腈-水混合液,8:2,v/v)加入所述ep管,室温放置10min,得到上样检测样品。
g.对上样检测检品利用液相色谱-串联质谱法进行分析,得到组织样本中苯丙氨酸的含量。
5.2c57bl/6小鼠外周血样本(血滤纸片)中苯丙氨酸含量的检测方法
a.干血滤纸片:滤纸片型号为903#,小鼠尾静脉血滴于滤纸片上,直径约10mm,室温下晾干,-20℃冰箱保存待测。
b.取样:用打孔器将干血滤纸片打成3mm圆形血片(相当于3.2μl血浆样品),置于96孔板中;
c.萃取:将储存在4℃冰箱中的同位素内标工作液在室温下震荡15min,取100μl加入放置血片的96孔板内,室温静置1h,取上清液置于新的96孔板;
d.氮吹:65℃氮气吹干,约15min;
e.衍生:加入50μl衍生剂(乙酰氯-盐酸正丁醇,9:1,v/v),置于65℃恒温箱内衍生20min;
f.氮吹:65℃氮气吹干,约20min;
g.溶解:加入150μl流动相溶液(乙腈-水混合液,8:2,v/v),室温放置10min,得到上样检测样品。
h.对上样检测检品利用液相色谱-串联质谱法进行分析,得到组织样本中苯丙氨酸的含量。
5.3小鼠原代培养神经元细胞和大鼠pc12细胞中苯丙氨酸含量的检测
方法(同5.1)。
6.数据处理
由spss15.0软件对数据进行分析计算,采用内标标准曲线法,根据代谢物与相应峰度比值代入标准曲线中进行计算,得出样品中苯丙氨酸的浓度。
(二)脑i/r损伤的代谢标记物
(1)对c57bl/6小鼠假手术组和i/r损伤组脑组织、外周血进行代谢组学分析,筛选代谢标记物。(2)对c57bl/6小鼠神经元细胞和大鼠pc12细胞control组、ogd/r组进行代谢组学分析,验证苯丙氨酸的变化趋势。(3)分别提取小鼠脑组织、神经元细胞和pc12细胞rna,进行反转录和pcr分析,明确在i/r损伤和ogd/r条件下,苯丙氨酸代谢关键酶的表达发生的改变,进一步对筛选得到的代谢标记物相关酶的表达进行实验室验证。具体步骤和结果如下。
1.筛选脑i/r损伤中含量显著变化的代谢物。
1.1实验设计
收集6对c57bl/6小鼠i/r损伤脑组织样本以及假手术组(control组)组织样本,-80℃冻存。组织样本送检,对样本进行代谢组学检测(包括上述lc-ms/ms方法)。
1.2数据的初步处理
总共有79个代谢物在脑组织中检测出来,通过数据处理初步筛选出6种氨基酸代谢物。
1.3配对t检验方法
使用spss18.0统计软件处理,通过t检验对代谢物进行分析,其中5种氨基酸代谢物含量显著增加,而1种氨基酸代谢物含量显著降低,其中苯丙氨酸变化趋势较为明显,结果如图1所示,即小鼠脑缺血/再灌注损伤后脑组织中苯丙氨酸含量增加。同时,参见图2,小鼠脑缺血/再灌注损伤后血浆中苯丙氨酸水平增加。因此,苯丙氨酸在i/r损伤组小鼠脑组织和外周血中含量均有升高。
2.验证实验
利用神经元细胞和pc12细胞进行ogd/r实验,体外模拟脑缺血/再灌注损伤,收集细胞样本后送检,对样本中代谢物含量变化进行代谢组学检测(参见上述lc-ms/ms方法),验证前期实验结果。如图3所示,小鼠原代培养神经元氧糖剥夺复氧后苯丙氨酸含量增加。如图4所示,大鼠pc12细胞氧糖剥夺复氧后苯丙氨酸含量增加。
3.苯丙氨酸含量升高关联代谢通路中调控关键酶基因表达的变化。
3.1苯丙氨酸代谢通路
从图5可知苯丙氨酸代谢通路中关键代谢酶为pah、got1、tat。
3.2pah、got1、tat引物设计
表1.小鼠细胞代谢关键酶pcr反应引物
注:引物设计完成时间为2017年5月,gapdh为内参
表2.大鼠细胞代谢关键酶pcr反应引物
注:引物设计完成时间为2017年9月,gapdh为内参
3.3rna提取及含量分析
a.取50mg小鼠脑组织放入匀浆器,加入1mltrizol试剂,置于冰上反复匀浆;
b.将组织或细胞的trizol裂解液转入1.5mlep管中,加入0.2ml氯仿,充分混匀,在室温下放置5min;
c.将样品置于4℃12000rpm离心10min;
d.取上层水相置于新的1.5mlep管中,加入0.5ml异丙醇混匀,室温静置10min,4℃12000rpm离心10min;
e.吸弃上清,肉眼可见rna沉淀;
f.加入1ml75%乙醇洗涤,4℃12000rpm离心5min,弃上清;重复一次;
g.自然干燥;根据rna量,用30~50μlrnase-freedepc水溶解rna沉淀;
h.利用nanodrop-2000核酸分析仪进行rna定量,并依据od260nm/280nm的比值分析rna纯度,其余样品冻存于-80℃。
3.4cdna反转录
根据cdna反转录试剂盒操作说明书进行,取1μgrna进行反转录。
3.5rt-qpcr
pcr反应条件:
(1)模板变性:95℃5min;
(2)产物扩增:95℃15s,56℃30s,72℃1min,40个循环;
(3)产物延伸:72℃10min。
利用各组小鼠脑组织的rna,进行反转录和pcr反应,对比分析氨基酸代谢的关键代谢酶mrna的含量差异,结果见图6,提示i/r损伤组脑组织中pah、got1表达下调,而tat表达上调。
各组细胞rna提取方法同上,进行反转录和pcr反应,对比分析氨基酸代谢的关键代谢酶mrna的含量差异,结果见图7、图8,与脑组织检测结果高度一致。
实验结果显示:i/r损伤组和ogd/r组的pah、got1表达下调,tat表达上调,苯丙氨酸含量增加。以此为依据,可以将外周血苯丙氨酸含量变化作为评价i/r损伤变化的新指标,为评价脑i/r损伤程度提供便利。
(三)红花黄色素或羟基红花黄色素a的神经保护作用药效学机制分析
(1)对c57bl/6小鼠假手术组、i/r损伤组以及5mg/kg、20mg/kgsy给药组脑组织及外周血进行代谢组学分析(参见上述lc-ms/ms方法),发现苯丙氨酸在i/r损伤组小鼠脑组织和外周血中含量均有升高,但sy干预组的苯丙氨酸含量明显下降。(2)对c57bl/6小鼠神经元细胞和pc12细胞control组、ogd/r组以及1μm、10μmhsya给药组进行代谢组学分析(参见上述lc-ms/ms方法),验证苯丙氨酸的变化趋势。结果发现苯丙氨酸的变化趋势与在体实验组一致。(3)分别提取脑组织、神经元细胞和pc12细胞rna,进行反转录和pcr分析,明确在i/r损伤和ogd/r条件下,苯丙氨酸代谢关键酶的表达发生改变,进一步对代谢标志物(苯丙氨酸)相关酶的表达进行实验室验证。实验结果显示:i/r损伤组和ogd/r组的pah、got1表达下调,tat表达上调,苯丙氨酸含量增加。而在药物(sy或hsya)干预下,pah、got1、tat的表达均有所逆转,苯丙氨酸含量下降。由此证明sy及hsya可以通过干预苯丙氨酸代谢关键酶的表达,从而降低苯丙氨酸含量,发挥神经保护作用。
总之,本发明首先对c57bl/6小鼠脑组织和外周血进行代谢组学检测,均发现i/r损伤状态下苯丙氨酸显著升高。通过小鼠神经元细胞和大鼠pc12细胞的代谢组学检测,进一步证实了ogd/r损伤会引起苯丙氨酸显著升高。因此推测苯丙氨酸代谢通路与i/r损伤密切相关。进一步对苯丙氨酸代谢通路的关键代谢酶进行表达分析,结合明确具有神经保护作用的红花活性成分干预,结果说明苯丙氨酸代谢的通路受阻导致组织和细胞中的苯丙氨酸含量升高,提示苯丙氨酸变化是评价i/r损伤变化的一个重要参考。
<110>中国人民解放军第四军医大学
<120>苯丙氨酸代谢变化在脑缺血/再灌注损伤程度评价中的应用
<160>16
<210>1
<211>20
<212>dna
<213>人工合成
<400>1
ttgtcctggagaacggagtc20
<210>2
<211>23
<212>dna
<213>人工合成
<400>2
ctggattcaatgtgtgtcaggtt23
<210>3
<211>19
<212>dna
<213>人工合成
<400>3
gcgcctccatcagtctttg19
<210>4
<211>21
<212>dna
<213>人工合成
<400>4
attcatctgtgcggtacgctc21
<210>5
<211>21
<212>dna
<213>人工合成
<400>5
tgctggatgttcgcgtcaata21
<210>6
<211>21
<212>dna
<213>人工合成
<400>6
cggcttcaccttcatgttgtc21
<210>7
<211>21
<212>dna
<213>人工合成
<400>7
cttcaccaccatggaggaggc21
<210>8
<211>21
<212>dna
<213>人工合成
<400>8
ggcatggactgtggtcatgag21
<210>9
<211>23
<212>dna
<213>人工合成
<400>9
accctctaggggtaaatctttca23
<210>10
<211>20
<212>dna
<213>人工合成
<400>10
gaagccccaatgacacaagc20
<210>11
<211>20
<212>dna
<213>人工合成
<400>11
tctgcacgttgcttgagtct20
<210>12
<211>20
<212>dna
<213>人工合成
<400>12
gccgagagacagagacgatg20
<210>13
<211>20
<212>dna
<213>人工合成
<400>13
aatgcggacctctgctatgg20
<210>14
<211>20
<212>dna
<213>人工合成
<400>14
gacaagccatctcctgtgct20
<210>15
<211>22
<212>dna
<213>人工合成
<400>15
gtgaagctcatttcctggtatg22
<210>16
<211>20
<212>dna
<213>人工合成
<400>16
aactgacggcctctctcttg20
- 还没有人留言评论。精彩留言会获得点赞!
- N-α-L-天冬氨酞-L-苯丙1-氨酸甲酯的冷却结晶方法
- N-α-L-天冬氨酞-L-苯丙1-氨酸甲酯生产工艺中的缩合方法
- N-α-L-天冬氨酞-L-苯丙1-氨酸甲酯中去除杂质的方法
- 用于抗菌耐腐蚀底层涂料的水性苯丙乳液和抗菌耐腐蚀底层涂料的制作方法
- 使用源自Idiomarina loihiensis的苯丙氨酸解氨酶从肉桂酸衍生物生产光学活性苯丙 ...的制作方法
- 一种选择性分离苯丙氨酸生物转化液中肉桂酸及循环利用转化液的方法
- 一种手性N-Boc联苯丙氨醇的制备方法
- 一种乌鳢的抗病免疫增强剂环-(苯丙氨酸-丝氨酸)的制作方法
- 一种苯丙氨酸与柠檬酸复合硅掺杂荧光纳米点的制备方法
- 一种l-苯丙氨酸不对称转换制备d-苯丙氨酸的方法