基于核酸适配体检测沙门氏菌的生物传感器及其检测方法与流程
本发明涉及生物传感器技术领域,特别涉及基于核酸适配体检测沙门氏菌的生物传感器,还涉及其制备方法。
背景技术:
沙门氏菌是一种常见的食源性致病菌,是革兰氏阴性、细胞内寄生的一种肠道菌。该菌广泛存在于自然界中,不但能引起家畜家禽及其他动物发生急性、慢性或隐性感染,而且还能通过污染食物导致人的食物中毒,对人类造成很大威胁。据统计在世界各国的种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。沙门氏菌每年会导致约四万美国人病倒,约600人死亡。在我国沙门氏菌是食物中毒中最常见的致病菌,占食物中毒的第一位。沙门氏菌病的临床症状主要包括头痛、腹痛、发热等,死亡率在1%,对人危害很大。
目前报道的检测沙门氏菌的方法包括传统的培养方法、酶联免疫法、pcr技术等。传统的沙门氏菌检测方法检测周期长达一周,工序繁琐,设备昂贵等,这远远不能满足要求。因此,食品工业急需一种快速、准确、简便、微量的分析方法,以对食品中的沙门氏菌进行检测。近几年,dna生物传感检测技术凭借其高灵敏性和特异性得到广泛的关注。其中,荧光技术的基础理论研究日益成熟,它在生物学、医学等领域中所扮演的角色越来越重要。相对于其他几种光学检测手段,荧光技术具有显著的优势,灵敏度高、特异性强、价格低廉、无需样品预处理等。
技术实现要素:
为了解决以上现有技术中检测沙门氏菌的方法特异性和灵敏度都比较低、成本高、检测周期长的问题,本发明提供了一种特异性和灵敏度高、成本低、检测速度快的基于荧光信号传导的检测沙门氏菌的生物传感器。
本发明的另一目的是提供一种上述生物传感器在检测沙门氏菌中的应用与方法。
为实现上述目的,本发明采用如下技术方案。
一种检测沙门氏菌的生物传感器,包括适配体apt、模板t、发卡探针h1、发卡探针h2、phi29、沙门氏菌、nt.alwl内切酶和缓冲液;
所述的序列为:
apt序列如seqidno:1所示;
模板t序列如seqidno:2所示;
发卡探针h1序列如seqidno:3所示;
发卡探针h2序列如seqidno:4所示。
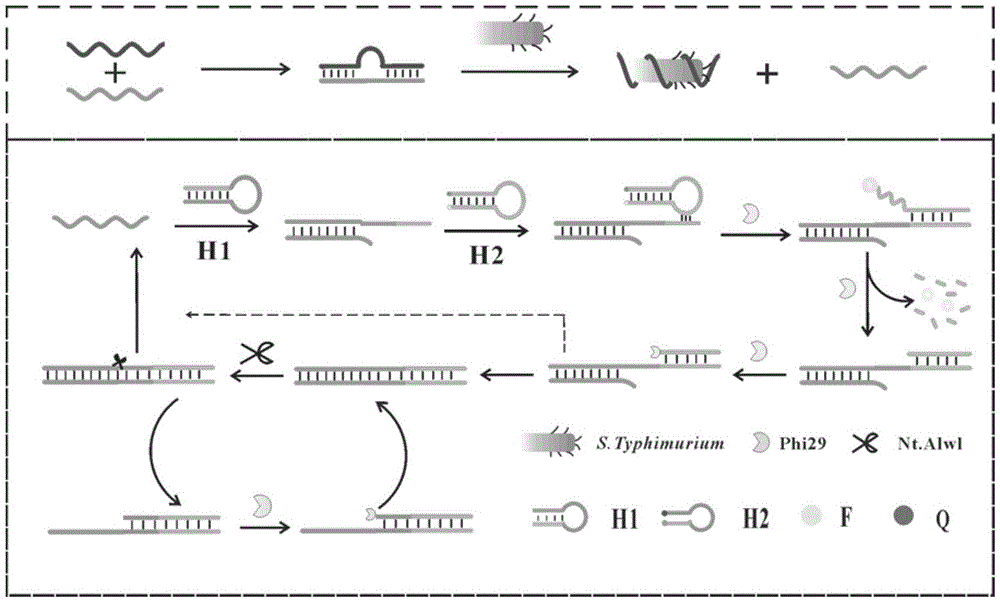
其中发卡探针h1黑色斜体部分是t的互补序列,加粗字体是nt.alwl内切酶的识别序列,下划线是发卡探针h2的互补序列。将apt和t杂交为探针,当目标物存在时,目标物和apt特异性结合,从而释放t,释放的t打开发夹h1,打开的发夹h1在phi29聚合酶的作用下打开h2,产生荧光,打开的h2在phi29聚合酶的作用下水解3’翘起部分同时进行dna的复制,从而实现了t链的循环,同时形成的双链dna在nt.alwl内切酶的作用下产生大量t’序列,产生的t’序列又可进一步打开h1,进行下一个循环,通过上述无限次循环实现指数放大,产生大量的trigger从而实现信号放大。从而通过测量荧光强度来定量检测沙门氏菌。
本发明中沙门氏菌的检测是在均相溶液中实现的,通过酶辅助的等温放大方式来实现信号的放大,从而实现沙门氏菌的高灵敏检测,并获得较低的检测下限。在均相反应中,反应条件为37℃,反应时间是90min。
所述的检测沙门氏菌的方法,包括以下步骤:
(1)拱形探针的构建;
(2)均相反应:将沙门氏菌与拱形探针加入到均相中,同时加入h1、h2、phi29聚合酶、dntps、nt.alwl内切酶,混和均匀后孵育;
(3)荧光仪检测荧光强度。
所述的步骤(1)拱形探针的构建步骤如下:
将灭菌水、10×pbs、apt链和t链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
所述的步骤(2)均相反应操作步骤如下:
将拱形探针、h1、h2、phi29聚合酶、dntps、nt.alwl内切酶、缓冲液、沙门氏菌悬液加入离心管中,震荡30s,于37℃下水浴90min。
优选地,所述的步骤(2)均相反应操作步骤如下:
将拱形探针(3μl,10μm),h1(3μl,10μm),h2(3μl,10μm),phi29聚合酶(0.5u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌悬液(5.0×105cfu/ml)加入离心管中,震荡30s,于37℃下水浴90min。
所述的步骤(3)荧光仪设置激发波长为486nm。
所述的生物传感器用于检测食品和水中的沙门氏菌。
该发明的检测方式是荧光法检测,在phi29聚合酶的作用下利用dna链的碱基互补配对将h2打开,使得荧光和猝灭基团远离,使得荧光强度的显著增强。通过检测溶液的荧光强度进行目标物的检测。
本发明基于核酸适配体与目标物的特异性识别,将apt与t形成的桥型结构打开,利用phi29聚合酶的链延伸功能打开h2产生荧光,以及3’翘起部分特异性消化实现目标物的循环放大,在nt.alwl内切酶的协助下,产生大量能打开h1的trigger链,而trigger进一步循环实现荧光信号的放大,从而构建了适体生物传感器。该传感器反应只需要一步,因此具有检测速度快,操作简便,价格低廉,检测限低,特异性高等优点,可以弥补沙门氏菌现有检测方法的缺陷与不足,实现对其快速,准确的定量检测。
本发明的有益效果:
1、检测限低
利用了核酸适配体的特异型识别,利用适配体与沙门氏菌的结合实现了对目标物的高特异性检测;利用phi29聚合酶的功能,实现了t的循环利用,放大了检测信号,提高了检测的灵敏度,实现对目标物沙门氏菌的超灵敏性检测;利用phi29聚合酶与nt.alwl内切酶的共同作用,实现了指数放大,产生大量的t’,有效地提高了传感器的灵敏度;检测线可达到0.541cfu·ml-1。
2、方法简单,性能稳定
该传感器的构建仅需一步,有效地避免了多步加入样品可能带来的污染,同时具有操作简便、反应速度快等优势;检测原理的主要过程均是在均相中实现的,提高了反应速度,降低了操作的复杂程度,实现了目标物的快速,简单,灵敏的检测;
3、检测食品和水中沙门氏菌
制作该生物传感器的工艺成本低,适用于产业化中价廉的要求。适用于食品安全及水体中沙门氏菌的检测和生物传感器产业化的实际应用。
附图说明
图1为该实验的原理图;
图2为实施例1h1浓度优化检测结果图;
图3为实施例2h2浓度优化检测结果图;
图4为实施例3nt.alwl内切酶浓度优化检测结果图;
图5为实施例4反应时间优化检测结果图。
具体实施方式
下面结合具体实施例对本发明进行进一步说明。
实施例1
所述的荧光生物传感器的制备方法,包括以下步骤:
拱形探针的合成操作步骤如下:
将14μl灭菌水,2μl10×pbs,2μl100μmapt链和2μl100μmt链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
均相溶液中反应过程的主要步骤如下:
a、将探针(3μl,10μm),h1(终浓度分别为0.4μm,0.6μm,0.8μm,1.0μm,1.2μm,1.4μm),h2(3μl,10μm),phi29聚合酶(0.5u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌菌悬液(5.0×105cfu/ml)加入离心管中,震荡30s,于37℃下水浴90min。
b、将a步反应后的溶液(30μl)稀释至100μl,用荧光仪在518nm处检测荧光峰值强度。
荧光仪激发波长设置为486nm,发射波长为518nm,检测范围490nm-600nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(buffer)是随聚合酶一起买来的,可直接使用。
结果见图2,从图中可以看出,检测到的荧光强度峰值随着h1的浓度增大而增大,当浓度超过1.0μm后,荧光强度趋于稳定。所以h1的最佳终浓度为1.0μm。
实施例2
所述的荧光生物传感器的制备方法,包括以下步骤:
拱形探针的合成操作步骤如下:
将14μl灭菌水,2μl10×pbs,2μl100μmapt链和2μl100μmt链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
均相溶液中反应过程的主要步骤如下:
a、将探针(3μl,10μm),h1(3μl,10μm),h2(终浓度分别为0.4μm,0.6μm,0.8μm,1.0μm,1.2μm,1.4μm),phi29聚合酶(0.5u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌菌悬液(5.0×105cfu/ml)加入离心管中,震荡30s,于37℃下水浴90min。
b、将a步反应后的溶液(30μl)稀释至100μl,用荧光仪在518nm处检测荧光峰值强度。
荧光仪激发波长设置为486nm,发射波长为518nm,检测范围490nm-600nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(buffer)是随聚合酶一起买来的,可直接使用。
结果见图3,从图中可以看出,检测到的荧光强度峰值随着h2的浓度增大而增大,当浓度超过1.0μm后,荧光强度趋于稳定。所以h2的最佳终浓度为1.0μm。
实施例3
所述的荧光生物传感器的制备方法,包括以下步骤:
拱形探针的合成操作步骤如下:
将14μl灭菌水,2μl10×pbs,2μl100μmapt链和2μl100μmt链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
均相溶液中反应过程的主要步骤如下:
a、将探针(3μl,10μm),h1(3μl,10μm),h2(3μl,10μm),phi29聚合酶(0.1u,0.2u,0.3u,0.4u,0.5u,0.6u,0.7u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌菌悬液(5.0×105cfu/ml)加入离心管中,震荡30s,于37℃下水浴90min。
b、将a步反应后的溶液(30μl)稀释至100μl,用荧光仪在518nm处检测荧光峰值强度。
荧光仪激发波长设置为486nm,发射波长为518nm,检测范围490nm-600nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(buffer)是随聚合酶一起买来的,可直接使用。
结果见图4,从图中可以看出,检测到的荧光强度峰值随着phi29聚合酶的浓度增大而减小,当浓度超过0.5u后,荧光强度趋于稳定。所以phi29聚合酶的最佳终浓度为0.5u。
实施例4
所述的荧光生物传感器的制备方法,包括以下步骤:
拱形探针的合成操作步骤如下:
将14μl灭菌水,2μl10×pbs,2μl100μmapt链和2μl100μmt链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
均相溶液中反应过程的主要步骤如下:
a、将探针(3μl,10μm),h1(3μl,10μm),h2(3μl,10μm),phi29聚合酶(0.5u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌菌悬液(5.0×105cfu/ml)加入离心管中,震荡30s,于37℃下水浴30min,45min,60min,75min,90min,105min,120min。
b、将a步反应后的溶液(30μl)稀释至100μl,用荧光仪在518nm处检测荧光峰值强度。
荧光仪激发波长设置为486nm,发射波长为518nm,检测范围490nm-600nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(buffer)是随聚合酶一起买来的,可直接使用。
结果见图5,从图中可以看出,检测到的荧光强度峰值随着反应时间的延长而增大,当反应时间超过90min后,荧光强度趋于稳定。所以最佳的均相反应时间为90min。
实施例5
实施例5
所述的荧光生物传感器的制备方法,包括以下步骤:
拱形探针的合成操作步骤如下:
将14μl灭菌水,2μl10×pbs,2μl100μmapt链和2μl100μmt链加入到预先准备好的灭菌的ep管中,震荡30s,在95℃下孵育5min,缓慢冷却至室温杂交为探针,储存于-20℃备用。
均相溶液中反应过程的主要步骤如下:
a、将探针(3μl,10μm),h1(3μl,10μm),h2(3μl,10μm),phi29聚合酶(0.5u),dntps(3μl),nt.alwl内切酶(0.5u)、缓冲液(3μl)和3μl沙门氏菌菌悬液(5.0×105,1.0×105,5.0×104,1.0×104,5.0×103,1.0×103,5.0×102,1.0×102,50,10cfu/ml)加入离心管中,震荡30s,于37℃下水浴90min。
b、将a步反应后的溶液(30μl)稀释至100μl,用荧光仪在518nm处检测荧光峰值强度。
荧光仪激发波长设置为486nm,发射波长为518nm,检测范围490nm-600nm,读取荧光信号变化,检测目标物。
上述过程中用到的溶液的制备方法:
1、超纯水均需进行高温灭菌处理。具体方法是,将超纯水分别放置在锥形瓶中,然后用锡箔纸和报纸进行封口。在高压灭菌锅中在120℃的温度下灭菌20min。
2、10×的缓冲液(buffer)是随聚合酶一起买来的,可直接使用。
结果见表1,可以看到,当沙门氏菌浓度从0到5.0×105cfu/ml时,分别测得的荧光强度峰值如表中所示。计算回归方程为f=-142.742+190.040×lg(cs.typhimurium/cfuml-1),相关系数为0.996,由此计算该方案的检测线为0.541cfu·ml-1。
表1
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
序列表
<110>济南大学
<120>基于核酸适配体检测沙门氏菌的生物传感器及其检测方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>40
<212>dna
<213>人工序列(artiartificialsequence)
<400>1
agtaatgcccggtagttattcaaagatgagtaggaaaaga40
<210>2
<211>27
<212>dna
<213>人工序列(artiartificialsequence)
<400>2
tcttttcctagaaatccgggcattact27
<210>3
<211>33
<212>dna
<213>人工序列(artiartificialsequence)
<400>3
agtaatgcccggcttagatccctgtccattact33
<210>4
<211>44
<212>dna
<213>人工序列(artiartificialsequence)
<400>4
ggagaagtttatttcttagtttctagtaatggacgttcttctcc44
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法