一种表面经过修饰的磁珠及其制备方法以及定量检测相关抗原的应用与流程
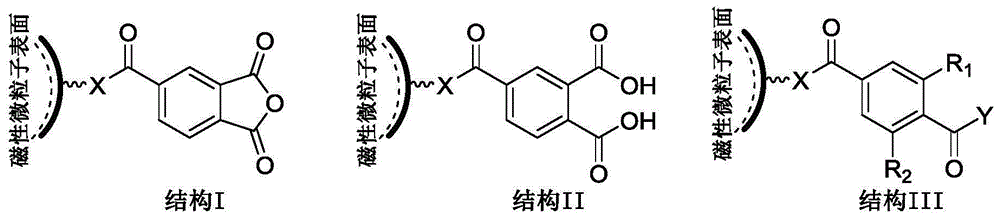
本发明属于免疫分析
技术领域:
,具体涉及一种磁珠表面固载抗体的方法及其定量检测相关抗原的应用。
背景技术:
:化学发光免疫分析(Chemiluminescenceimmunoassay,CLIA)是化学发光与免疫分析相结合的方法。它具有灵敏度高、特异性好、操作简便等优点,近年来在食品安全、临床诊断、药物分析中得到了广泛应用。免疫分析所涉及的免疫反应主要是抗原与抗体间的识别。抗原-抗体免疫复合物的分离往往比较繁琐,在CLIA中,引入磁性微纳米粒子作为免疫反应和分离的固相载体,是目前的策略之一。目前,常见磁珠的表面化学基团主要包括:磺酸酯基、氨基、醛基、羧基等。根据表面基团的不同,磁珠可采用不同的偶联剂进行抗体包被。如在专利CN106226513A中,采用1-乙基-3(3-二甲氨丙基)碳二亚胺/N-羟基琥珀酰亚胺作为偶联剂,对羧基磁珠进行抗体包被。抗体由Fc端和Fab端构成,与抗原反应的表位位于Fab端。通常的磁珠与抗体的包被过程中,磁珠表面的活性基团对抗体Fc端选择性差,磁珠表面基团与Fab端偶联,将导致偶联抗体的利用率低,因此,如何提高偶联抗体的利用率成为了待解决的问题。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供一种磁珠表面固载抗体的方法及其定量检测相关抗原的应用,本发明提供的方法首先对磁珠表面基团修饰,修饰后的磁珠表面基团可与抗体Fc端选择性偶联,使更多的抗体Fab端裸露,提高磁珠表面包被抗体的利用率。本发明提供了一种表面经过修饰的磁珠,所述磁珠表面连接有修饰基团,所述修饰基团选自芳香羧酸基团、芳香酸酐基团或芳香酰卤基团。优选的,所述修饰基团具有式I~式III所示结构:其中,Y选自羟基、氯、溴、碘;R1和R2独立的选自氢、C1~C8的直链或支链烷基、R3O-或R3选自氢、C1~C8的直链或支链烷基,n为1~6。优选的,所述磁珠选自胺基磁珠、羟基磁珠或巯基磁珠。本发明还提供了一种上述表面经过修饰的磁珠的制备方法,包括以下步骤:将磁珠与修饰化合物混合,在有机溶剂和有机碱存在条件下进行反应,得到经过表面修饰的磁珠;所述修饰化合物具有式IV~式VI所示结构:其中,Q选自羟基、氯、溴、碘,Y选自羟基、氯、溴、碘;R1和R2独立的选自氢、C1~C8的直链或支链烷基、R3O-或R3选自氢、C1~C8的直链或支链烷基,n为1~6。优选的,所述修饰化合物选自1,2,4-偏苯三酸酐、1,2,4-偏苯三酸酐酰氯、1,2,4-偏苯三酸酐酰溴、对苯二甲酸、对苯二甲酰氯、对苯二甲酰溴、2-甲基对苯二甲酸、2-甲基对苯二甲酰氯、2-甲基对苯二甲酰溴、2,6-二甲基对苯二甲酸、2,6-二甲基对苯二甲酰氯、2-羟基对苯二甲酸、2-甲氧基对苯二甲酸或2-甲氧基对苯二甲酰氯。优选的,所述有机溶剂选自二氯甲烷、氯仿、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲酰基环己胺、二甲基亚砜或四氢呋喃;所述有机碱选自三乙胺、二异丙基乙胺、三丙胺、三异丙基胺、三丁胺、吡啶、N-甲基吗啉、N-甲基哌啶或N,N’-二甲基哌嗪;所述磁珠表面与修饰化合物进行反应的表面官能团与修饰化合物的摩尔比为1∶20~1∶800;所述反应的温度为25±5℃,所述反应的时间为8~24小时。优选的,进行反应时,还包括缩合助剂,所述缩合助剂选自二环己基碳二酰亚胺、二异丙基碳二酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1,1’-羰基二咪唑、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯、O-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲四氟硼酸盐、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯、4-二甲胺基吡啶、羟基苯并三唑或1-羟基-7-氮杂苯并三氮唑;所述缩合助剂以缩合助剂的溶液的形式加入反应体系中,在所述缩合助剂的溶液中,所述缩合助剂的浓度为10~200mg/mL,溶剂为N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲酰基环己胺、二甲基亚砜或四氢呋喃,所述缩合助剂的溶液的用量为每毫克表面经过修饰的磁珠50~1000μL的缩合助剂的溶液。本发明还提供了一种偶联抗体的磁珠在化学发光免疫分析中作为固相捕获或分离抗原中的应用,所述偶联抗体的磁珠为上述磁珠经过活化后与蛋白或抗体偶联得到。优选的,所述蛋白或抗体的浓度为0.2~5mg/mL,所述偶联过程所用的溶液为pH5.0、100mM的MES缓冲液,反应温度为25℃,反应时间为8~36小时。优选的,所述活化为采用缩合试剂进行活化,所述缩合试剂选自二环己基碳二酰亚胺、二异丙基碳二酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1,1’-羰基二咪唑、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯、O-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲四氟硼酸盐、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯、4-二甲胺基吡啶、羟基苯并三唑或1-羟基-7-氮杂苯并三氮唑。与现有技术相比,本发明提供了一种表面经过修饰的磁珠,所述磁珠表面连接有修饰基团,所述修饰基团选自芳香羧酸基团、芳香酸酐基团或芳香酰卤基团。本发明首先对磁珠表面基团修饰,在磁珠表面引入芳香基团等疏水端基,修饰后的磁珠表面基团可与抗体Fc端选择性偶联,使更多的抗体Fab端裸露,可以提高抗体Fc端与磁珠表面官能团的偶联比例,进一步提高磁珠表面包被抗体的利用率。在一定程度上解决免疫检测试剂制备中,磁珠与抗体偶联时对抗体Fc端选择性差,包被抗体利用率下降,抗原与抗体特异性结合比例低的问题。本发明具有制备成本低,操作简单,稳定性好,特异性结合比例高等优点。附图说明图1为三种不同结构的表面经过修饰的磁珠的结构示意图;图2为磁珠表面基团修饰的流程示意图;图3为酸酐磁珠的制备工艺流程示意图;图4为标准曲线图。具体实施方式本发明提供了一种表面经过修饰的磁珠,所述磁珠表面连接有修饰基团,所述修饰基团选自芳香羧酸基团、芳香酸酐基团或芳香酰卤基团。所述修饰基团具有式I~式III所示结构:其中,Y选自羟基、氯、溴、碘;R1和R2独立的选自氢、C1~C8的直链或支链烷基、R3O-或R3选自氢、C1~C8的直链或支链烷基,n为1~6。在免疫分析中,磁珠是指具有磁性(含磁性材料)、表面有活性反应基团如胺基、羧基、羟基、巯基等,用于固载抗体或抗原以实现分离的粒子,商品化的磁珠尺寸从0.1微米到5微米不等,也称为磁性微粒子。本发明所述磁珠,等同于磁性微粒子。在本发明中,所述磁珠选自胺基磁珠、羟基磁珠或巯基磁珠。所述修饰基团与磁珠表面的反应性官能团,例如氨基、羟基或巯基进行连接。具体的结构示意图如图1所示,图1为三种不同结构的表面经过修饰的磁珠的结构示意图。本发明还提供了一种上述表面经过修饰的磁珠的制备方法,包括以下步骤:将磁珠与修饰化合物混合,在有机溶剂和有机碱存在条件下进行反应,得到经过表面修饰的磁珠。其中,所述磁珠如上文所述,选自胺基磁珠、羟基磁珠或巯基磁珠。在进行反应之前,需要对磁珠进行洗涤和干燥处理。所述洗涤处理是指用有机溶剂清洗磁珠2~3次,洗涤过程中通过磁分离将溶剂与磁珠分离,洗涤处理使用有机溶剂选自二氯甲烷、无水乙醇、丙酮或乙酸乙酯,优选为无水乙醇;所述干燥处理是指将磁珠放置到恒温干燥箱中,恒温干燥箱的温度为30~100℃,优选为40~60℃,干燥时间2~24小时,优选为8~12小时。将有机溶剂和有机碱进行混合,得到混合溶液;其中,所述有机溶剂选自二氯甲烷、氯仿、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲酰基环己胺、二甲基亚砜或四氢呋喃,优选为N,N-二甲基甲酰胺、二甲基亚砜;所述有机碱选自三乙胺、二异丙基乙胺、三丙胺、三异丙基胺、三丁胺、吡啶、N-甲基吗啉、N-甲基哌啶或N,N’-二甲基哌嗪,优选为三乙胺。然后向混合溶液中加入经过洗涤和干燥处理的磁珠,得到磁珠悬浮液;接着,将所述磁珠悬浮液与修饰化合物混合,进行反应,得到表面经过修饰的磁珠。所述修饰化合物具有式IV~式VI所示结构:其中,Q选自羟基、氯、溴、碘,Y选自羟基、氯、溴、碘;R1和R2独立的选自氢、C1~C8的直链或支链烷基、R3O-或R3选自氢、C1~C8的直链或支链烷基,n为1~6。优选的,所述修饰化合物选自1,2,4-偏苯三酸酐、1,2,4-偏苯三酸酐酰氯、1,2,4-偏苯三酸酐酰溴、对苯二甲酸、对苯二甲酰氯、对苯二甲酰溴、2-甲基对苯二甲酸、2-甲基对苯二甲酰氯、2-甲基对苯二甲酰溴、2,6-二甲基对苯二甲酸、2,6-二甲基对苯二甲酰氯、2-羟基对苯二甲酸、2-甲氧基对苯二甲酸或2-甲氧基对苯二甲酰氯。进行一步优选的,所述修饰化合物选自偏苯三酸酐酰氯、对苯二甲酰氯、取代的对苯二甲酰氯、间苯二甲酰氯、取代的间苯二甲酰氯等芳香酰氯衍生物。在本发明的一些具体实施方式中,所述修饰化合物选自偏苯三酸酐酰氯、苯二甲酰氯、2,6-二甲基对苯二甲酰氯。磁珠表面的反应性官能团与修饰化合物的摩尔比例为1:20~1:800,优选为1:100~1:600。所述修饰化合物占所述有机溶剂的质量百分比为1%~20%,优选为5%~10%。所述有机碱与所述修饰化合物的摩尔比例为0.3:1~3:1,优选为1:1~1.5:1。所述反应时间为8~24小时,优选为12~18小时,所述反应的温度为室温条件,在本发明中,定义所述室温条件为25±5℃。在本发明中,为了利于反应的进行,在进行反应时,还包括缩合助剂。具体的,在将所述磁珠悬浮液与修饰化合物混合时,还加入缩合助剂,进行反应。所述缩合助剂选自二环己基碳二酰亚胺、二异丙基碳二酰亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1,1’-羰基二咪唑、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯、O-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲四氟硼酸盐、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯、4-二甲胺基吡啶、羟基苯并三唑或1-羟基-7-氮杂苯并三氮唑。所述缩合助剂以缩合助剂的溶液的形式加入反应体系中,在所述缩合助剂的溶液中,所述缩合助剂的浓度为10~200mg/mL,溶剂为N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N-甲酰基环己胺、二甲基亚砜或四氢呋喃,所述缩合助剂的溶液的用量为每毫克表面经过修饰的磁珠50~1000μL的缩合助剂的溶液。反应结束后,还包括后处理过程,用上述有机溶剂清洗6~8次,清洗过程中及清洗后用磁分离移除有机溶剂,最后放置在恒温干燥箱中干燥2~24小时,干燥温度30~100℃,优选地,恒温干燥箱中干燥8~14小时,干燥温度50~80℃;在本发明的一些具体实施方式中,所述处理过程还可以为:用上述有机溶剂清洗6~8次,清洗过程中及清洗后用磁分离移除溶剂,然后将磁珠置于纯净水中,震荡3~24小时,优选为6~12小时,磁分离去除纯净水,用纯净水清洗2~3次,置于缓冲液中备用。所述缓冲溶液选自PB缓冲液、PBS缓冲液或MES缓冲液。本发明通过将磁珠表面基团修饰成含有芳香羧酸类化合物的活性基团,利用芳香基团和抗体Fc端的相似的亲疏水性,实现磁珠表面基团与抗体Fc端的选择性连接。磁珠表面基团修饰方法如下图2所示,图2为磁珠表面基团修饰的流程示意图。本发明还提供了一种偶联抗体的磁珠在化学发光免疫分析中作为固相捕获或分离抗原中的应用,所述偶联抗体的磁珠为上述表面经过修饰的磁珠经过活化后与蛋白或抗体偶联得到。其中,所述活化的具体方法为:采用缩合试剂的溶液处理所述表面经过修饰的磁珠。所述缩合试剂选自二环己基碳二酰亚胺(DCC)、二异丙基碳二酰亚胺(DIC)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDCI)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、1,1’-羰基二咪唑(CDI)、O-苯并三氮唑-N,N,N',N'-四甲基脲四氟硼酸酯(TBTU)、O-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲四氟硼酸盐(TATU)、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBOP)、2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)、4-二甲胺基吡啶(DMAP)、羟基苯并三唑(HOBt)或1-羟基-7-氮杂苯并三氮唑(HOAt)。所述缩合试剂的溶液中缩合试剂的浓度为10~200mg/mL,优选为30~80mg/mL,溶剂为纯净水或缓冲液,所述缓冲溶剂选自PB缓冲液、PBS缓冲液或MES缓冲液。在进行活化时,所述缩合试剂的溶液的用量为每毫克表面经过修饰的磁珠50~1000μL的缩合试剂的溶液,优选为每毫克表面经过修饰的磁珠100~300μL缩合试剂的溶液。所述活化温度为0~90℃,优选为20~45℃,活化反应时间为5~120分钟,优选为15~40分钟。活化磁珠后,需要对磁珠进行洗涤,洗涤处理为:用纯净水清洗1~3次,然后用pH5.0、100mM的MES缓冲液清洗1~3次。然后,将活化后的磁珠与蛋白或抗体在缓冲溶液中进行偶联,得到偶联抗体的磁珠。所用抗体浓度为0.2~5mg/mL,优选为0.5~1mg/mL,偶联过程所用的溶液为pH5.0、100mM的MES缓冲液,反应温度为25℃,反应时间为8~36小时,优选为12~24小时。在本发明的一些具体实施方式中,以氨基磁珠和偏苯三酸酐酰氯为例,实现磁珠表面基团的修饰及其检测相关抗原的应用。步骤一、磁珠表面修饰氨基磁珠表面基团修饰按以下步骤进行:将氨基磁珠加入到离心管中,洗涤干燥处理后,向离心管中加入1,2,4-偏苯三酸酐酰氯、溶剂和有机碱,室温下震荡混匀反应16h,后处理得到酸酐磁珠。具体过程参见图3,图3为酸酐磁珠的制备工艺流程示意图。上述反应中,所用的氨基磁珠为市售氨基磁珠。氨基磁珠表面基团修饰之前,先对磁珠进行洗涤和干燥处理。洗涤处理为:用有机溶剂清洗磁珠2~3次,通过磁分离架分离磁珠。洗涤处理使用的有机溶剂为:二氯甲烷(DCM)、无水乙醇或丙酮,优选为无水乙醇。干燥处理为:将磁珠放置到恒温干燥箱中,恒温干燥箱温度为40~50℃。上述反应中,反应过程中所用的有机溶剂包括DCM、四氢呋喃(THF)、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMAc),优选为DMF或DMAc。反应过程中加入有机碱为三乙胺、二异丙基乙胺、三丙胺、三异丙基胺、三丁胺、吡啶、N-甲基吗啉、N-甲基哌啶、N,N’-二甲基哌嗪中一种。上述反应中,所加的1,2,4-偏苯三酸酐酰氯的摩尔量以磁珠表面氨基基团的量计算,n1,2,4-偏苯三酸酐酰氯:n磁珠表面氨基基团=20~800,优选为100~600。反应过程中,1,2,4-偏苯三酸酐酰氯与有机溶剂的质量比为1%~20%,优选为5%~10%。上述反应中,反应时间为8~24h,优选为12~18h。优选地,反应温度为室温。上述反应中,后处理为:将氨基磁珠放入磁分离架中,先用DCM清洗2次,然后用DMF或DMAc清洗2次,再用DCM或DMAc清洗2次,移除残留的DMF或DMAc,最后放置在恒温干燥箱中干燥。步骤二、抗体包被将步骤一得到修饰了酸酐的磁珠在偶联包被抗体之前,先将新型磁珠进行活化处理。所述的活化处理为:向含有酸酐磁珠的离心管中加入纯净水,震荡混匀3-6h,通过磁分离移除纯净水。向酸酐磁珠中加入0.01M氢氧化钠溶液,清洗2-3次。再向酸酐磁珠中加入纯净水,清洗2-3次。最后向酸酐磁珠中加入浓度为15~120mg/mL的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)的水溶液,室温混匀15min。EDCI用作偶联剂。上述活化处理中,EDCI水溶液浓度优选为25~70mg/mL。在活化处理后用纯净水和浓度为0.05mol/L的MES缓冲液(pH5-6)各清洗一次。所述酸酐磁珠偶联包被抗体的方法为:向清洗后的磁珠缓冲液体系中加入抗体,室温下偶联8~36h,优选为12~24h,反应体系置于磁分离架,用pH7.4的TBST缓冲液清洗3~4次,将偶联包被抗体的酸酐磁珠放入保存液中待用。其中,磁珠缓冲液为0.02~0.1mol/L、pH5~6的MES缓冲液,优选为0.05M、pH5.0的MES缓冲液。所述抗体浓度为0.1-5mg/mL,优选为0.5-2mg/mL。所述保存液为含有1%BSA、pH5.6的TBST缓冲液。步骤三、免疫分析定量曲线测定将由上述步骤制备的偶联抗体的酸酐磁珠缓冲液与相关抗原缓冲液、FITC标记的抗体缓冲液混合,室温、避光条件下反应30~60min。反应结束后,反应液在磁分离架下用缓冲液清洗3~5次,重新加入纯净水,漩涡混匀后检测荧光信号强度。上述测定方法中,偶联包被抗体的酸酐磁珠缓冲液为pH5.6的TBST溶液,抗原缓冲液为pH7.4的TBST溶液,FITC标记的抗体缓冲液为pH5.6的TBST溶液。上述测定方法中,偶联包被抗体的酸酐磁珠溶液的浓度为0.2~3.0mg/mL,优选为0.5~1.0mg/mL。抗原溶液的浓度为0.5~1.0mg/mL。FITC标记的抗体溶液的浓度为200~2000ng/mL。上述测定方法中,相对于50μL、1mg/mL的偶联包被抗体的酸酐磁珠溶液,相关抗原的样本用量为30μL、1mg/mL,FITC标记的抗体溶液用量为100μL、2000ng/mL。芳香酸酐磁珠或芳香酰氯磁珠与二抗结合测定包被抗体的区域选择性:芳香酸酐磁珠或芳香酰氯磁珠偶联小鼠单克隆抗体,以FITC标记的抗鼠二抗对磁珠表面包被的单克隆抗体定量,以FITC标记的(H+L)二抗定量结果作为包被抗体总量的近似,以FITC标记的Fc端特异性二抗定量结果作为包被抗体中,Fc端向外的抗体量的定量(即以Fab端与磁珠表面基团偶联的量),Fc二抗与(H+L)二抗定量结果的比例与包被抗体以Fc端在磁珠表面结合的量成反比,该值越小越好。检测过程如下:用pH7.4的PB缓冲液清洗偶联抗体的酸酐磁珠1次,向偶联了抗体的酸酐磁珠中加入FITC标记的二抗溶液,室温、避光条件下反应30min。然后用pH7.4的TBST溶液清洗3-4次,再用pH7.4的PB缓冲液清洗1次。重新加入PB缓冲液,漩涡混匀后检测荧光信号强度。上述测定方法中,偶联包被抗体的酸酐磁珠溶液的浓度为1~2mg/mL,FITC标记的(H+L)二抗溶液的浓度为15μg/mL,相对于5μL偶联抗体的酸酐磁珠悬浮液,FITC标记的二抗样本用量为100μL。使用同样的方法,测定偶联抗体的芳香酸酐磁珠与Fc端特异性二抗结合量。使用同样的方法,分别测定偶联抗体的芳香酰氯磁珠与(H+L)二抗和Fc端特异性二抗结合量。本发明利用芳香酰氯衍生物修饰磁珠表面基团,相比于生物素或链霉亲和素包被的免疫磁珠具有很好的稳定性。本发明利用芳香羧酸与抗体Fc端亲疏水性相互作用,提高了磁珠与抗体偶联时对抗体Fc端的选择性,解决了传统化学偶联方法中磁珠与抗体偶联时对抗体Fc端选择性差,包被抗体利用率下降,抗原与抗体特异性结合比例低的问题。本发明涉及的表面修饰方法操作简便、重复性好,修饰基团廉价易得,具有很高的经济性。本发明利用芳香羧酸修饰常用磁珠表面,使芳香羧酸作为磁珠与抗体偶联的桥梁,在偶联反应中实现对抗体Fc端更高的选择性。为了进一步理解本发明,下面结合实施例对本发明提供的表面经过修饰的磁珠及其制备方法以及定量检测相关抗原的应用进行说明,本发明的保护范围不受以下实施例的限制。实施例1:芳香酸酐磁珠的合成。取1mg(200nmol氨基)氨基磁珠滴入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入偏苯三酸酐酰氯20mg(95μmol)、N,N-二甲基甲酰胺400μL及三乙胺13μL(94μmol),在25℃下反应16h。反应结束后,先用二氯甲烷清洗2次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得芳香酸酐磁珠。实施例2:芳香酰氯磁珠的合成。取1mg(200nmol氨基)氨基磁珠滴入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入对苯二甲酰氯20mg(99μmol)、二甲基亚砜400μL及三乙胺13μL(94μmol),在25℃下反应16h。反应结束后,先用二氯甲烷清洗2次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得芳香酰氯磁珠。实施例3:二甲基酰氯磁珠的合成。取1mg(200nmol氨基)氨基磁珠滴入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入2,6-二甲基对苯二甲酰氯20mg(87μmol)、二甲基亚砜400μL及三乙胺16μL(115μmol),在25℃下反应16h。反应结束后,先用二氯甲烷清洗2次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得二甲基酰氯磁珠。实施例4:芳香酸酐磁珠偶联包被抗体。向1mg实施例1制备的芳香酸酐磁珠中加入去离子水200μL,在25℃下水解6h。反应结束后,在磁分离架下,先用NaOH溶液(0.01M)清洗3次,再用去离子水清洗3次,向芳香酸酐磁珠中加入EDCI溶液(200μL、50mg/mL),室温下反应15min。反应结束后,在磁分离架下,先用去离子水清洗1次,再用MES缓冲液(50mM)清洗1次,然后向芳香酸酐磁珠中加入AFP抗体10μL(5mg/mL)、MES缓冲液90μL,室温下反应24h,用TBST溶液(pH7.4、1%BSA)清洗、重新悬浮,得到偶联包被抗体的芳香酸酐磁珠。实施例5按照实施例4的方法,对实施例2制备的芳香酰氯磁珠进行偶联包被抗体,仅将芳香酸酐磁珠替换为芳香酰氯磁珠,其他条件不变。实施例6:芳香酸酐磁珠偶联包被抗体的包被率测定在磁分离架下,先用TBST溶液(pH7.4、1%BSA)清洗实施例4制备的偶联包被抗体的芳香酸酐磁珠4次,再用PB缓冲液(pH7.4)清洗3次。取0.5mg磁珠与400μL反应试剂(BCA蛋白定量试剂盒)混合,在37℃下反应30min,取上层清液检测。芳香酸酐磁珠偶联包被抗体的包被率为30~40mg/g。实施例7:(1)芳香酸酐磁珠与抗体(H+L)端结合比例测定。用PB缓冲液(pH7.4)清洗实施例4制备的偶联包被抗体的芳香酸酐磁珠1次,向10μg偶联包被抗体的芳香酸酐磁珠中加入FITC标记的(H+L)端识别二抗溶液100μL(15μg/mL),25℃、避光条件下特异性反应30min。然后用TBST溶液(pH7.4)清洗4次,再用PB缓冲液(pH7.4)清洗1次。重新加入PB缓冲液400μL,漩涡混匀后,取200μL样品检测荧光信号强度。(2)芳香酸酐磁珠与抗体Fc端结合比例测定。用PB缓冲液(pH7.4)清洗实施例4制备的偶联包被抗体的芳香酸酐磁珠1次,向10μg偶联包被抗体的芳香酸酐磁珠中加入FITC标记的Fc端识别二抗溶液100μL(15μg/mL),25℃、避光条件下特异性反应30min。然后用TBST溶液(pH7.4)清洗4次,再用PB缓冲液(pH7.4)清洗1次。重新加入PB缓冲液400μL,漩涡混匀后,取200μL样品检测荧光信号强度。芳香酸酐磁珠与抗体(H+L)、Fc端结合比例检测结果如表1所示。表1:针对芳香酸酐磁珠单位磁珠上检出(H+L)端抗体量μg/mg18.56单位磁珠上检出Fc端抗体量μg/mg3.12由表1可得抗体Fc端与磁珠连接的比例为83%。表2:针对商品化羧基磁珠由表2可得抗体Fc端与磁珠连接的比例为29%。实施例8:抗原含量测定。取实施例4制备的AFP抗体包被的芳香酸酐磁珠40μg与AFP抗原溶液30μL(1mg/mL)混合,25℃下反应60min,用Abbott洗液清洗4次。然后加入SA标记的AFP抗体溶液100μL(1000ng/mL),25℃、避光条件下反应30min,用Abbott洗液清洗4次,加入200μL去离子水,漩涡混匀后检测荧光信号强度,结果如表3所示。标准曲线见图4,图4为标准曲线图。表3结果显示利用此偶联包被抗体的芳香酸酐磁珠检测AFP抗原的CV值基本在10%以内,线性相关性达到0.9982,重复试验结果一致。实施例9用pH7.4的PB缓冲液清洗实施例4制备的偶联抗体的芳香酸酐磁珠1次,向偶联了抗体的芳香酸酐磁珠中加入FITC标记的二抗溶液,室温、避光条件下反应30min。然后用pH7.4的TBST溶液清洗3~4次,再用pH7.4的PB缓冲液清洗1次。重新加入PB缓冲液,漩涡混匀后检测荧光信号强度。上述测定方法中,偶联包被抗体的芳香酸酐磁珠溶液的浓度为1~2mg/mL,FITC标记的(H+L)二抗溶液的浓度为15μg/mL,相对于5μL偶联抗体的芳香酸酐磁珠悬浮液,FITC标记的二抗样本用量为100μL。使用同样的方法,测定偶联抗体的芳香酸酐磁珠与Fc端特异性二抗结合量。使用同样的方法,分别测定实施例5制备的偶联抗体的芳香酰氯磁珠与(H+L)二抗和Fc端特异性二抗结合量。结果见表4对比例:脂肪羧酸磁珠与抗体(H+L)端和Fc端结合比例测定取1mg(200nmol氨基)氨基磁珠滴入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入己二酸酐13mg(101μmol)、四氢呋喃400μL及三乙胺16μL(115μmol),在25℃下反应24h。反应结束后,先用二氯甲烷清洗2次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得脂肪羧酸磁珠。按照实施例4的方法,对脂肪羧酸磁珠进行偶联包被抗体,仅将芳香酸酐磁珠替换为脂肪羧酸磁珠,其他条件不变。按照实施例7的方法,对偶联包被抗体的脂肪羧酸磁珠进行抗体(H+L)端和Fc端的结合比例测定。仅将偶联包被抗体的芳香酸酐磁珠替换为偶联包被抗体的脂肪羧酸磁珠,其他条件不变。结果见表4。表4磁珠与(H+L)二抗和Fc端特异性二抗结合量由上述结果具有定性比较的意义,说明以芳香酸酐修饰磁珠表面,再偶联抗体,Fc端检出量更低,表明抗体在通过芳香酸酐或芳香酰氯偶联到磁珠表面时具有更高的Fc端选择性。实施例10:芳香酸酐磁珠的合成。取1mg(200nmol氨基)氨基磁珠加入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺10mg(64μmol),偏苯三酸酐20mg(104μmol),N,N-二甲基甲酰胺400μL,在25℃下反应24h。反应结束后,先用NaOH溶液(0.01M)清洗1次,再用去离子水清洗1次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得芳香酸酐磁珠。所得芳香酸酐磁珠按实施例4的方法偶联包被抗体,其包被率为16-30μg/mg。实施例11:芳香羧酸磁珠的合成。取1mg(200nmol氨基)氨基磁珠加入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺10mg(64μmol),对苯二甲酸20mg(120μmol),N,N-二甲基甲酰胺400μL,在25℃下反应24h。反应结束后,先用NaOH溶液(0.01M)清洗1次,再用去离子水清洗1次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得芳香羧酸磁珠。所得芳香羧酸磁珠按实施例4的方法偶联包被抗体的包被率为15~35μg/mg。实施例12:二甲基芳香羧酸磁珠的合成。取1mg(200nmol氨基)氨基磁珠加入离心管中,在磁场中,用无水乙醇清洗3次,然后放入40℃恒温干燥箱中干燥2h。向干燥后的磁珠中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺10mg(64μmol),2,6-二甲基对苯二甲酸20mg(103μmol),N,N-二甲基甲酰胺400μL,在25℃下反应24h。反应结束后,先用NaOH溶液(0.01M)清洗1次,再用去离子水清洗1次,然后用N,N-二甲基甲酰胺清洗2次,最后再用二氯甲烷清洗2次,放入40℃恒温干燥箱中干燥2h,获得二甲基芳香羧酸磁珠。所得二甲基芳香羧酸磁珠按实施例4的方法偶联包被抗体的包被率为10~20μg/mg。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1