一种基于磁珠载体双抗夹心ELISA的考古现场快速检测痕量丝素蛋白的方法与流程
本发明涉及蛋白质检测技术领域,尤其涉及一种基于磁珠载体双抗夹心elisa的考古现场快速检测痕量丝素蛋白的方法。
背景技术:
丝绸作为中华文明的重要发明之一,承载着极其丰富的文化、技术和社会内涵,(,)为考古学、历史学、技术史的研究提供了珍贵的资料。已出土的丝绸残片表明丝绸的起源应不晚于5500年前。然而,从发现蚕丝纤维到将其织造成精美的丝绸必然需要长时间的发展。因此,我们的祖先开始使用蚕丝纤维的时间很可能远早于5500年前。
丝绸的原料是纤维丝素蛋白,长时间的埋藏过程中纤维丝素蛋白本身很难完整的保存下来,这给探寻丝绸的起源与发展带来了极大的障碍。如何在丝绸宏观形态消失的情况下探寻更早的证据成为了研究早期丝绸的关键问题。相对于完整的丝织物,无形的纤维丝素蛋白残留物更有可能保存下来,也有可能成为探寻早期蚕丝遗存的新证据。
在长达数百年甚至数千年的时间长河中,考古材料中剩余的丝绸含量微乎其微,因此在样品进行检测之前对考古材料中痕量丝素蛋白进行富集,以提高检测的准确性,同时又要考虑操作上的简便以及耗时少的问题。
目前检测痕量丝素蛋白的方法有多种,其中elisa检测方法是利用抗原抗体的特异性结合进行检测,也是丝素蛋白生物检测的最新技术,但elisa检测方法需要检测目标物丝素蛋白能够有一定的浓度和固相载体作为支撑,而在考古发掘样品中的丝蛋白经过长期的岁月和环境的侵蚀,泥土中残余的丝素蛋白含量微乎其微,而且可能被分解成不同的片段,常用的溶液提取法很难得到足够的丝素蛋白。
公开号为cn108387435a的中国专利文献公开了一种痕量丝素蛋白富集方法,包括以下步骤:(1)不同丝素蛋白单克隆抗体的混合;(2)偶联反应;(3)免疫磁珠的获得;(4)鉴定,确定偶联状态;(5)偶联后免疫磁珠的丝素蛋白单克隆抗体固定化;(6)丝素蛋白单克隆抗体免疫磁珠与丝素蛋白的结合;(7)丝素蛋白的洗脱;(8)elisa检测;(9)加标回收。该方法通过免疫磁珠可进行痕量丝素蛋白富集,但富集后需进行洗脱然后用elisa检测,过程较为复杂且时间较长。
技术实现要素:
为了解决上述技术问题,本发明提供了一种基于磁珠载体双抗夹心elisa的考古现场快速检测痕量丝素蛋白的方法。通过将磁珠与双抗夹心elisa结合,本发明能检测痕量丝素蛋白,且操作便捷,耗时较短。
本发明的具体技术方案为:
一种基于磁珠载体双抗夹心elisa的考古现场快速检测痕量丝素蛋白的方法,包括以下步骤:(1)将羧基聚合物磁珠悬浮在缓冲液中,加入经抗体稀释液稀释的鼠单克隆抗体iga,进行鼠单克隆抗体iga与磁珠的偶联;偶联完成后,进行磁性分离洗涤,弃上清,获得免疫磁珠;
(2)加入待测样品,孵育,磁性分离洗涤,弃上清,获得丝素蛋白结合磁珠;
(3)加入经抗体稀释液稀释的抗丝素蛋白的一抗,孵育,磁性分离洗涤,弃上清,获得丝素蛋白双抗夹心磁珠;
(4)加入经抗体稀释液稀释的抗一抗的酶标二抗,孵育,磁性分离洗涤,弃上清,获得二抗结合磁珠;
(5)加入显色液进行显色;
(6)显色结束后,磁性分离出上清液,向上清液中加入终止液,进行光密度值测试,结合标准曲线,即可获得待测样品中的丝素蛋白浓度。
本发明将磁珠与双抗夹心elisa结合,利用免疫磁珠富集待测样品中的丝素蛋白,而后直接通过elisa检测待测样品中的丝素蛋白浓度,实现了痕量丝素蛋白的检测,并且不需要经过现有技术中的洗脱步骤,因而操作简单,便于考古现场的快速检测。
本发明人团队通过大量实验,筛选出鼠单克隆抗体iga作为包被抗体,它与丝素蛋白具有较好的结合能力,将其制备成免疫磁珠,能富集更多的丝素蛋白,使本发明的方法能检测到更小含量的丝素蛋白。
作为优选,步骤(3)中,所述一抗为兔多克隆抗体。
作为优选,步骤(4)中,所述酶标二抗为羊抗兔-hrp。
作为优选,步骤(1)中,鼠单克隆抗体iga与抗体稀释液的体积比为1:8~10;
进一步地,步骤(1)中,鼠单克隆抗体iga与抗体稀释液的体积比为1:9。
作为优选,步骤(3)中,一抗与抗体稀释液的体积比为1:1000~1500;
进一步地,步骤(3)中,一抗与抗体稀释液的体积比为1:1500。
作为优选,步骤(4)中,二抗与抗体稀释液的体积比为1:4000~6000;
进一步地,步骤(4)中,二抗与抗体稀释液的体积比为1:4000。
作为优选,步骤(1)中,所述缓冲液为95~105mmmes;
进一步地,步骤(1)中,所述缓冲液为100mmmes。
作为优选,步骤(1)、(3)和(4)中,所述抗体稀释液为95~105mmmes;
进一步地,步骤(1)、(3)和(4)中,所述抗体稀释液为100mmmes。
作为优选,步骤(1)中,偶联温度为4~5℃,时间为8~12h,或偶联温度为35~40℃或室温,时间为1.5~2.5h;
进一步地,步骤(1)中,偶联温度为4℃,时间为10h。
作为优选,步骤(2)中,孵育温度为35~40℃,时间为1~2h;
进一步地,步骤(2)中,孵育温度为37℃,时间为1h。
作为优选,步骤(3)中,孵育温度为35~40℃,时间为0.5~1h;
进一步地,步骤(3)中,孵育温度为37℃,时间为0.5h。
作为优选,步骤(4)中,孵育温度为35~40℃,时间为0.5~1h;
进一步地,步骤(4)中,孵育温度为37℃,时间为0.5h。
作为优选,步骤(1)中,鼠单克隆抗体iga与羧基聚合物磁珠的质量比为45~90μg:1mg;进一步地,步骤(1)中,鼠单克隆抗体iga与羧基聚合物磁珠的质量比为67.5μg:1mg。
作为优选,步骤(2)中,免疫磁珠的用量为25~100μg;
进一步地,步骤(2)中,免疫磁珠的用量为50μg。
作为优选,步骤(1)中,鼠单克隆抗体iga与抗体稀释液的体积比为1:300;步骤(3)中,一抗与抗体稀释液的体积比为1:1500;步骤(4)中,二抗与抗体稀释液的体积比为1:4000;步骤(1)中,偶联温度为4℃,时间为10h;步骤(2)中,孵育温度为37℃,时间为1h;步骤(3)和步骤(4)中,孵育温度为37℃,时间为0.5h;步骤(1)中,鼠单克隆抗体iga与羧基聚合物磁珠的质量比为67.5μg:1mg;步骤(2)中,免疫磁珠的用量为50μg。
作为优选,通过以下方法获得步骤(7)中所述标准曲线:将步骤(2)中的待测样品换成浓度为10-2、10-1、100、101、102、103、104、105、106ng/ml的丝素蛋白溶液,重复步骤(1)~(6);然后以丝素蛋白浓度为x轴,以光密度值为y轴,进行线性拟合获得标准曲线。
作为优选,当丝素蛋白浓度为0~1000ng/ml时,步骤(7)中,所述标准曲线的线性方程为y=0.0022x+0.2248,其中,x为丝素蛋白浓度,单位为ng/ml,y为450nm处的光密度值,单位为nm。
作为优选,步骤(1)中,所述羧基聚合物磁珠的制备方法如下:
(a)制备精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物:在惰性气体氛围中,向精胺和三(2-氨基乙基)胺的混合溶液中滴加丙烯酸甲酯的甲醇溶液中,在20~25℃下进行加成反应,反应时间为2~3h;减压旋蒸除去甲醇后,将剩余液体在155~160℃、80~100pa下反应3~4h,制得精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物;
(b)制备羟基接枝改性的三元聚合物:将步骤(a)制得的精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物与缩水甘油乙酸酯分散到酒精中,在105~110℃下进行开环反应,反应时间为2~3h;反应完毕后,加入乙醚使反应产物沉淀;将沉淀溶解于水中,加入氢氧化钠,在75~80℃下进行水解反应,反应时间为1~2h;反应完毕后,加入乙醚使反应产物沉淀,沉淀经干燥后,制得羟基接枝改性的三元聚合物;
(c)制备羟基聚合物磁珠:将二甘醇分为两部分;在一部分二甘醇中加入氢氧化钠,加热至氢氧化钠完全溶解;冷却后,加入fecl3、步骤(b)制得的羟基接枝改性的三元聚合物、另一部分二甘醇,获得混合溶液;将混合溶液置于惰性气体氛围中,在225~230℃下反应20~24h;反应完毕后,磁性分离、用酒精洗涤、干燥后,获得羟基聚合物磁珠;
(d)制备羧基聚合物磁珠:将步骤(c)获得的羟基聚合物磁珠分散到n,n-二甲基甲酰胺中,加入琥珀酸苷和三乙胺,混合均匀后,在60~70℃下反应4~5h;反应完毕后,磁性分离、用乙醇洗涤、干燥后,获得羧基聚合物磁珠。
步骤(a)中,精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物的制备分为两个阶段,反应机制如下:在第一阶段,主反应是精胺中的一个或两个端氨基、三(2-氨基乙基)胺中的一个或多个端氨基分别与丙烯酸甲酯中的碳碳双键发生加成反应;在第二阶段,加成反应产物和三种反应物中的酯基与氨基之间发生反应生成酰胺键,形成精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物。
通过步骤(a)制得的精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物分子链中含有大量亚氨基和端氨基,步骤(b)中,缩水甘油乙酸酯中的环氧基与这些亚氨基和端氨基发生开环反应,使缩水甘油乙酸酯接枝到共聚物分子链上,同时,每个环氧基的开环反应生成一个羟基;而后接枝到共聚物分子上的缩水甘油乙酸酯中的酯基发生水解反应,每个酯基生成一个端羟基,通过这种方式,获得了带有大量羟基的三元共聚物。
步骤(c)中,fe2o3瞬时成核并生长,羟基接枝改性的三元聚合物包覆在fe2o3外。步骤(d)中,通过琥珀酸苷与羟基之间的反应,将三元聚合物上接枝的羟基转变成羧基,从而获得羧基聚合物磁珠,其上的羧基能与抗体发生偶联。
本发明制得的精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物分子链中含有大量亚氨基和端氨基,以这些亚氨基和端氨基为接枝位点,能接枝上大量羟基,将羟基转变成羧基后,能获得带有大量羧基的磁珠;同时,精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物具有较高的支化度,接枝上羟基的过程中,又产生了更多的支链,这使得羧基能更均匀地分布在磁珠表面,而不是集中在部分区域。这种磁珠能偶联更多的鼠单克隆抗体iga,因而能使获得的免疫磁珠对丝素蛋白有更好的富集效果,使本发明能检测到更小含量的丝素蛋白。
作为优选,步骤(a)中,所述丙烯酸甲酯、精胺、三(2-氨基乙基)胺的质量比为3.5~4:2.3~2.8:1。
精胺能为三元聚合物提供亚氨基,使其分子链内部具有更多的羟基接枝位点;三(2-氨基乙基)胺具有较多的氨基,能使三元聚合物具有更高的分子量和支化度,并使其分子链末端具有更多的羟基接枝位点。将精胺与三(2-氨基乙基)胺结合,并控制两者比例在合适范围内,能增加羧基聚合物磁珠上的羧基密度,并使羧基在磁珠上的分布更均匀。
氨基与碳碳双键的加成反应活性大于亚氨基,故丙烯酸甲酯首先与精胺和三(2-氨基乙基)胺中的氨基反应,再与精胺中的亚氨基反应。为了使三元聚合物中带有更多的亚氨基,需将丙烯酸甲酯的用量控制在合适范围内,以减少其与精胺中亚氨基的反应。
作为优选,步骤(b)中,所述精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物与缩水甘油乙酸酯的质量比为1:1.5~2。
作为优选,步骤(c)中,所述羟基接枝改性的三元聚合物与fecl3的质量比为1:1.2~1.8。
作为优选,步骤(c)中,所述氢氧化钠与fecl3的质量比为1:10~12。
作为优选,步骤(d)中,所述羟基聚合物磁珠与琥珀酸苷的质量比为1:4~5。
与现有技术相比,本发明具有以下优点:
(1)通过将磁珠与双抗夹心elisa结合,实现了痕量丝素蛋白的检测,且操作便捷,耗时较短;
(2)利用鼠单克隆抗体iga制备免疫磁珠,能更有效地富集丝素蛋白,使本发明能检测到更小含量的丝素蛋白;
(3)本发明中的制得的羧基聚合物磁珠上的羧基密度较大,且分布均匀,能更好地偶联鼠单克隆抗体iga,从而富集更多的丝素蛋白,故能提高丝素蛋白检测的灵敏度,使本发明能检测到更小含量的丝素蛋白。
附图说明
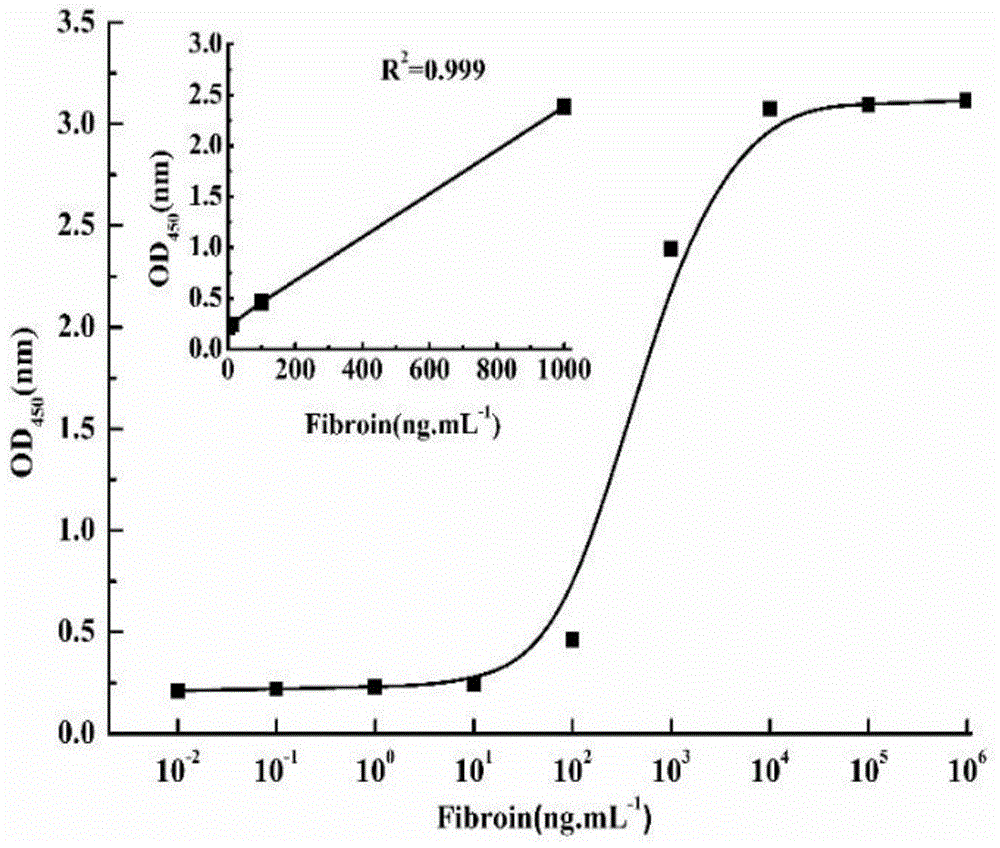
图1为免疫磁珠双抗夹心elisa检测丝素蛋白的标准曲线;
图2为不同包被抗体对丝素蛋白结合的影响;图中,浅色柱为空白组,深色柱为实验组;
图3为鼠单克隆抗体1a2-6-5的稀释比对丝素蛋白结合的影响;图中,浅色柱为空白组,深色柱为实验组;
图4为鼠单克隆抗体1a2-6-5的包被条件对双抗夹心elisa的影响;
图5为双抗夹心elisa检测痕量丝素蛋白的标准曲线;
图6为牛血清白蛋白(bsa)不同浓度的标准曲线;
图7为鼠单克隆抗体1a2-6-5添加量对磁珠偶联的影响;
图8为丝素蛋白吸附时间对免疫磁珠吸附丝素蛋白的影响;
图9为免疫磁珠用量对吸附丝素蛋白的影响;
图10为兔多克隆抗体(一抗)稀释比对检测丝素蛋白的影响;
图11为羊抗兔-hrp(二抗)稀释比对检测丝素蛋白的影响;
图12为免疫磁珠双抗夹心elisa检测痕量丝素蛋白的实验结果。
具体实施方式
下面结合实施例对本发明作进一步的描述。以下实施例2~4中,使用的羧基聚合物磁珠均为市售羧基聚合物磁珠(羧基琼脂糖磁珠mag25k/carboxyl,英芮诚生化科技,粒径25μm,浓度10%(v/v))。
实施例1:双抗体夹心法的建立
1鼠单克隆抗体亚型鉴定
表1hamk0111项目腹水亚型检测
结论:五个单抗轻链均为κ链,重链分别为:1a2-6-5iga,1a3-5-7igg1,1a5-5-2igg1,1a4-1-6igg2b,1a6-5-5igg1。
2包被抗体的筛选将五种单抗和一种多抗作为包被抗体通过间接elisa进行筛选,结果如图2所示。将六种抗体稀释到同一浓度后,同比稀释1:400,二抗稀释比为1:5000备用,在丝素蛋白包被量相同的情况下,当鼠单克隆抗体作为一抗时,检测抗体为hrp酶标记的羊抗鼠,当兔多克隆抗体作为一抗时,检测抗体为hrp酶标记的羊抗兔,除一抗种类不同,其他条件不变情况下,鼠单克隆抗体1a2-6-5表现出较高的免疫特性,根据表1,将这种单克隆抗体经鉴定为iga单抗,即后续包被抗体选择此型号抗体。
3包被抗体使用量的优化将鼠单克隆抗体1a2-6-5用抗体稀释液稀释至不同比例包被于96孔板,丝素蛋白稀释到浓度为1000ng/ml,空白组用pbs代替,并设置三个平行组。结果如图3所示,随着此单抗稀释比例的增大,空白孔od值即背景值逐渐降低,而od值在1:300处最大,说明此时抗体量适中,与丝素蛋白结合较好,所以包被抗体稀释比选择1:300。
4包被条件的优化抗体包被效果影响最大的是孵育条件,也就是孵育温度与时间,其他条件保持不变,将鼠单克隆抗体1a2-6-5按1:300稀释,并加入到微孔进行包被,包被条件分别为4℃过夜包被、37℃包被2h、37℃包被4h、37℃过夜包被,然后将丝素蛋白稀释至125ng/ml、250ng/ml、500ng/ml、1000ng/ml,空白孔用pbs代替。结果如图4所示,四种包被条件都能检测到丝素蛋白浓度变化,但不同的包被条件对抗体的包被影响有所不同,包被效果依次为4℃过夜包被较好,37℃包被2h次之,37℃包被4h和37℃过夜包被效果较差,可能原因是在37℃条件下,随着时间的增长,单抗活性会逐渐降低,不能和丝素蛋白有效结合,导致最后检测结果较低,所以抗体包被条件选择为4℃过夜包被。
5双抗夹心elisa检测丝素蛋白标准品利用上述优化结果确定双抗夹心elisa的具体流程为:包被抗体选择鼠单克隆抗体1a2-6-5,稀释比选择1:300,包被条件为4℃过夜,在间接elisa步骤上添加双抗夹心elisa,利用此方法检测痕量丝素蛋白。结果如图5所示,丝素蛋白浓度在0~1000ng/ml时,线性方程为y=0.0003x+0.1492,r2=0.9931,丝素蛋白的浓度与吸光度之间有良好的线性关系,制作的标准曲线线性较好,检出限为40ng/ml左右。因此,开发并优化的双抗夹心elisa可以用于检测丝素蛋白。
实施例2:免疫磁珠包被方法的建立
1抗体添加量的优化
利用bca检测蛋白质试剂盒检测牛血清白蛋白(bsa)不同浓度的标准曲线,结果如图6所示,当bsa纯品浓度为0~0.8mg/ml之间时,bsa的浓度与检测试剂盒中a液和b液反应后的od值之间线性关系较好,r2=0.9992,说明此试剂盒可以用来检测蛋白质,在一定范围内可以利用此标准曲线来计算蛋白质浓度,对未知浓度蛋白质可以较好反映其真实浓度,可以用来检测磁珠偶联前后抗体量的变化,以此结果来计算出偶联率。
取100μl羧基聚合物磁珠(10mg/ml)即1mg磁珠,偶联抗体选择1a2-6-5抗体,浓度为9mg/ml,分别加入5μl、7.5μl、10μl、12.5μl、15μl、17.5μl抗体,即对应抗体质量为45μg、67.5μg、90μg、112.5μg、135μg、157.5μg,添加量设置3个平行组,将抗体偶联前后溶液用bca检测,将吸光度值代入标准曲线计算浓度,最终计算偶联率,偶联率(%)=(偶联前浓度-偶联后浓度)/偶联前浓度。结果如图7和表2所示,测得偶联率分别为98%、97%、67%、45%、25%、17%,为了提高检测效率,尽量使得磁珠偶联抗体量达到饱和,所以抗体添加量选取67.5μg/mg。
表21mg磁珠偶联抗体前后抗体浓度变化及偶联率
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
2丝素蛋白吸附时间的优化
分别取免疫磁珠100μg每份,加入200μl1000ng/ml的丝素蛋白溶液,37℃水浴0、0.5、1、1.5、2h,随后加入一抗、二抗、显色液、终止液,在450nm处检测od值。结果如图8和表3所示,随着吸附时间的增长,od值逐渐增大,当吸附时间为1h时,od值接近最大,继续增加吸附时间,od无明显增大,差异显著(p<0.005),说明吸附时间达到1h时,免疫磁珠表面结合的丝素蛋白量已经接近饱和,继续增加吸附时间也不会增加吸附的丝素蛋白量,所以免疫磁珠吸附丝素蛋白的时间选择1h为最佳吸附时间。
表3不同吸附时间对免疫磁珠吸附丝素蛋白的影响
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
3免疫磁珠用量的优化
分别取免疫磁珠25、50、100、150、200μg,并设置3个平行组,向其中加入200μl1000ng/ml的丝素蛋白溶液,37℃水浴1h,随后加入一抗、二抗、显色液、终止液,在450nm处检测od值。结果如图9和表4所示,随着磁珠用量的增多,od值逐渐增大,在50μg处od值最大,但随着磁珠用量的继续增多,od值反而逐渐减小,一方面可能是因为磁珠量比较多,而丝素蛋白的量只有200ng,所以有大量的磁珠表面没有结合丝素蛋白,这也导致在加入一抗二抗后,抗体不能有效的与丝素蛋白进行特异性结合,所以磁珠用量在超过50μg后,od值没有增加反而有所下降;另一方面可能是由于磁珠量的增多,导致磁珠存在大量的表面积没有结合丝素蛋白和一抗,而加入羊抗兔-hrp有限,所以显色液与磁珠表面结合的hrp酶不能充分反应,这样也可能会出现磁珠的量过多,导致od值下降的现象,所以免疫磁珠用量选择50ug进行后续优化实验。
表4免疫磁珠用量对吸附丝素蛋白的影响
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
4兔多克隆抗体(一抗)稀释比的优化
取50μg免疫磁珠每份,向其中加入200μl1000ng/ml的丝素蛋白溶液,37℃水浴1h,加入200μl不同稀释比的一抗,随后加入二抗、显色液、终止液,在450nm处检测od值。结果如图10和表5所示,随着一抗(兔多抗)稀释比的降低,实验组和空白组od值都随之降低,由图可知当稀释比为1:1000和1:1500时,实验组的od值较高,对应的空白组od值也较低,计算s/n比可知,1:1000的s/n比为5.72,1:1500的s/n比为6.1,最后我们选择s/n比最高的一组,也就是一抗兔多抗的稀释比为1:1500。
表5一抗稀释比对检测磁珠吸附丝素蛋白的影响
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
5羊抗兔-hrp(二抗)稀释比的优化
取50μg免疫磁珠每份,向其中加入200μl1000ng/ml的丝素蛋白溶液,37℃水浴1h,加入200μl稀释比为1:1500的一抗,随后加入200μl不同稀释比的二抗,反应结束后加入显色液、终止液,在450nm处检测od值。结果如图11和表6所示,随着二抗(羊抗兔-hrp)稀释比的降低,实验组和空白组od值都随之降低,当稀释比为1:4000和1:6000时,实验组的od值较高,对应的空白组od值也较低,计算s/n可知,1:4000的s/n比为21.1,1:6000的s/n比为17.79,我们选择s/n比最高的一组,也就是羊抗兔-hrp的稀释比为1:4000。
表6二抗稀释比对检测磁珠吸附丝素蛋白的影响
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
实施例3:建立免疫磁珠双抗夹心elisa检测丝素蛋白标准曲线取50μg免疫磁珠每份,向其中加入200μl浓度范围为0.01~106ng/ml的丝素蛋白溶液,37℃水浴1h,加入200μl1:1500的兔多抗,37℃水浴30min,随后加入200μl1:4000的羊抗兔-hrp,37℃水浴30min,反应结束后于避光处,向反应孔中分别加入50μl显色液a和b,37℃水浴5min,显色结束后,磁性分离吸出上清液,上清液的颜色深浅如图12所示;将上清液加到酶标板中,每孔加入50μl终止液,立即在450nm处检测od值,结果如表7所示。当丝素蛋白从低浓度增加到高浓度时,od值逐渐增加,当浓度达到10μg/ml时,od值达到顶峰,当浓度提高到10μg/ml以上时,od值稳定在几乎相同的水平。根据临界值cut-off定义为阴性对照的吸光度值(平均值)加上其标准偏差的3倍,当样品的od450nm高于cut-off临界值时为阳性反应,当低于cut-off临界值时为阴性反应。获得的丝素蛋白标准曲线如图1所示,以丝素蛋白浓度的x轴,od值为y轴,当丝素蛋白浓度在0~1000ng/ml时,线性方程为y=0.0022x+0.2248,r2=0.9998,免疫磁珠检测丝素蛋白的检出限为20ng/ml左右,差异性显著(p<0.05),本方法的重现性良好(rsd<5%)。
由图12中显色结束获得的上清液的颜色变化可知,当丝素蛋白浓度较低时,显色反应颜色为接近透明的淡黄色,当丝素蛋白浓度逐渐增大时,颜色也逐渐加深,由淡黄色变为浅黄色,进而变为深黄色,当丝素蛋白继续增大时,颜色由深黄色变为深褐色,并生成深褐色沉淀(3-氨基-9-乙基卡巴唑),这是由于最终得到的免疫复合物中的hrp酶可以催化底物3,3',5,5'-四甲基联苯胺(tmb)的反应,得到蓝色产物,在蓝色产物中加入h2so4时,会得到黄色终产物。
表7磁珠检测丝素蛋白结果
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
实施例4:验证标准曲线
通过以下步骤检测三份待测样品(丝素蛋白含量分别为5ng/ml、50ng/ml、200ng/ml和500ng/ml)中的丝素蛋白含量:
(1)将浓度为9mg/ml的鼠单克隆抗体iga与100mmmes按1:9的体积比混合,获得浓度为0.9mg/ml的鼠单克隆抗体iga稀释液;将1mg羧基聚合物磁珠悬浮在40μl100mmmes中,加入75μl鼠单克隆抗体iga稀释液,进行鼠单克隆抗体iga与磁珠的偶联,偶联温度为4℃,时间为10h;偶联完成后,进行磁性分离,用0.1%pbst洗涤,弃上清,获得免疫磁珠;
(2)向50μg免疫磁珠中加入待测样品,在37℃下孵育1h,磁性分离,用0.1%pbst洗涤,弃上清,获得丝素蛋白结合磁珠;
(3)将兔多克隆抗体与100mmmes按1:1500的体积比混合,获得兔多克隆抗体稀释液;向丝素蛋白结合磁珠中加入兔多克隆抗体稀释液,在37℃下孵育0.5h,磁性分离,用0.1%pbst洗涤,弃上清,获得丝素蛋白双抗夹心磁珠;
(4)将羊抗兔-hrp与100mmmes按1:4000的体积比混合,获得羊抗兔-hrp稀释液;向丝素蛋白双抗夹心磁珠中加入羊抗兔-hrp稀释液,在37℃下孵育0.5h,磁性分离,用0.1%pbst洗涤,弃上清,获得二抗结合磁珠;
(5)加入显色液a和b,37℃水浴30min进行显色;
(6)显色结束后,磁性分离出上清液,将上清液加到酶标板中,每孔加入50μl终止液,立即在450nm处检测光密度值,结合实施例3中获得的标准曲线,即可获得待测样品中的丝素蛋白浓度。
三份待测样品的光密度值分别为0.235nm、0.335nm、0.671nm和1.335nm,根据实施例3中获得的标准曲线,三份待测样品的丝素蛋白浓度分别为4.64ng/ml、50.09ng/ml、202.82ng/ml、504.64ng/ml,接近于实际浓度,表明本发明的方法可用于痕量丝素蛋白的检测。
实施例5:市售羧基聚合物磁珠(羧基琼脂糖磁珠mag25k/carboxyl,英芮诚生化科技,粒径25μm,浓度10%(v/v))与本发明制备的羧基聚合物磁珠的效果对比
1制备羧基聚合物磁珠
按以下步骤制备羧基聚合物磁珠:
(a)制备精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物:将1.4g丙烯酸甲酯与5ml甲醇混合,制得丙烯酸甲酯的甲醇溶液;在氮气氛围中,向1g精胺和0.4g三(2-氨基乙基)胺的混合溶液中滴加丙烯酸甲酯的甲醇溶液中,在25℃下进行加成反应,反应时间为2.5h;减压旋蒸除去甲醇后,将剩余液体在155℃、90pa下反应3.5h,制得精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物;
(b)制备羟基接枝改性的三元聚合物:将2g步骤(a)制得的精胺-丙烯酸甲酯-三(2-氨基乙基)胺共聚物与3.5g缩水甘油乙酸酯分散到10ml50%酒精中,在105℃下进行开环反应,反应时间为2.5h;反应完毕后,加入乙醚使反应产物沉淀;将沉淀溶解于30ml水中,加入0.2g氢氧化钠,在80℃下进行水解反应,反应时间为1.5h;反应完毕后,加入乙醚使反应产物沉淀,沉淀经干燥后,制得羟基接枝改性的三元聚合物;
(c)制备羟基聚合物磁珠:在15ml二甘醇中加入0.13g氢氧化钠,加热至氢氧化钠完全溶解;冷却后,加入1.5gfecl3、1g步骤(b)制得的羟基接枝改性的三元聚合物、25ml二甘醇,获得混合溶液;将混合溶液置于氩气氛围中,在230℃下反应22h;反应完毕后,磁性分离、用70%酒精洗涤、干燥后,获得羟基聚合物磁珠;
(d)制备羧基聚合物磁珠:将1g步骤(c)获得的羟基聚合物磁珠分散到10mln,n-二甲基甲酰胺中,加入4.5g琥珀酸苷和2g三乙胺,混合均匀后,在65℃下反应4.5h;反应完毕后,磁性分离、用乙醇洗涤、干燥后,获得粒径为1±0.07μm的羧基聚合物磁珠。
2偶联鼠单克隆抗体iga的效果对比
取100μl10mg/ml的市售羧基聚合物磁珠和本发明制得的羧基聚合物磁珠;偶联抗体选择浓度为9mg/ml的鼠单克隆抗体iga,分别加入5μl、7.5μl、10μl抗体,即对应抗体质量为45μg、67.5μg、90μg,添加量设置3个平行组。将抗体偶联前后溶液用bca检测,将吸光度值代入标准曲线计算浓度,最终计算偶联率,偶联率(%)=(偶联前浓度-偶联后浓度)/偶联前浓度。结果如表8所示,相较于市售羧基聚合物磁珠而言,本发明的磁珠与鼠单克隆抗体iga的偶联率较大,添加的抗体量增加时,这种差异更加明显;在抗体量大于67.5μg时,仍具有较高的偶联率,故采用本发明制备的羧基聚合物磁珠时,通过增大鼠单克隆抗体iga的添加量,能有效提高磁珠偶联的抗体量,鼠单克隆抗体iga的添加量优选为90μg/1mg磁珠。
表81mg磁珠偶联抗体前后抗体浓度变化及偶联率
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
3检测丝素蛋白的效果对比
将市售羧基聚合物磁珠和本发明制备的羧基聚合物磁珠分别制备成免疫磁珠,鼠单克隆抗体iga的添加量分别为67.5μg/1mg磁珠和90μg/1mg磁珠。取50μg免疫磁珠每份,向其中分别加入200μl浓度为10-2ng/ml、10-1ng/ml、1ng/ml、10ng/ml的丝素蛋白溶液,37℃水浴1h,加入200μl1:1500的兔多抗,37℃水浴30min,随后加入200μl1:4000的羊抗兔-hrp,37℃水浴30min,反应结束后于避光处,向反应孔中分别加入50μl显色液a和b,37℃水浴5min,显色结束后,磁性分离吸出显色液,加到酶标板中,每孔加入50μl终止液,立即在450nm处检测od值。结果如表9所示,在丝素蛋白浓度相同的情况下,相较于市售羧基聚合物磁珠而言,利用本发明制备的羧基聚合物磁珠检测到的od值较大,这表明这种磁珠能提高丝素蛋白检测的灵敏度,从而提高痕量丝素蛋白检测的准确性,实现更小含量的丝素蛋白检测。
表9磁珠检测丝素蛋白结果
注:od1、od2、od3分别为三个平行组实验的od值(450nm)。
本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!