一种确定含能材料化合工艺温度修正系数的方法与流程
本发明属于含能材料化合工艺的安全评估技术领域,特别涉及一种确定含能材料化合工艺温度修正系数的方法。
背景技术:
含能材料在热、静电、机械等刺激作用下具有易发生燃烧、爆炸的特性,开展含能材料化合工艺过程燃烧、爆炸危险性评估是安全生产设计与管控的一项重要内容。含能材料化合工艺过程的物料是热的不良导体,对热刺激极为敏感,受热会发生自催化分解放热反应,极易产生热累积引发热爆炸,是大量安全事故的诱发因素,因此工艺过程燃烧爆炸危险性评估首先需要对工艺过程中的温度修正系数进行定量确定。本发明针对含能材料,定量确定化合工艺过程中的温度修正系数。
为了对燃烧爆炸危险性有定性的了解和定量的估算,国内根据兵器火炸药、弹药企业特点并借鉴国外的评估经验,制定出了《火炸药及其制品企业重大危险源定量评估方法》(简称bza-1法)。bza-1法提出的危险源评估数学模型及物理意义如下:
h=h内+h外(1)
式中:h为爆炸危险源系统的现实危险度,h内为系统内现实危险度,h外为系统外现实危险度。
其中,h内的计算方法如下:
h内=v+kb(2)
式中:v为物质危险系数,即火炸药固有的静态危险度,k为系统内可控危险行为受控程度系数,b为系统内可控危险度。
系统内可控危险度b由下式计算:
b=wb·d·p(3)
式中:wb为火炸药及其装置的物料能量危险系数,其计算公式入下。
wb=v·γ(4)
式中,γ为工艺危险系数,其计算公式如下:
γ=γ1+γ2+γ3+γ4+γ5(5)
式中:γ1为温度修正系数,随温度升高呈正相关,γ2为化学介质修正系数,γ3为压药修正系数,γ4为其他机械作用修正系数(如切削、钻孔、锯割、磨擦等),γ5为静电修正系数。
目前工艺过程中温度修正系数γ1取值条件如下(见表1)
表1工艺过程危险系数γ取值条件
由表1可以看出,温度修正系数γ1的确定方法为半定量法,虽有相应的评价参数取值,但实际可操作性差,无法逐一准确量化取值,并且取值条件概念内涵不明确,缺乏量化判据,难以与实际工艺条件有效结合对工艺过程物料危险程度进行评价。
由于含能材料化合工艺过程的物料为含能物料,在热作用下会发生分解放热反应导致燃烧爆炸事故,因此物料在工艺过程中经受工艺温度刺激后能否保持安定是工艺危险性的重要指标之一,因此,准确评价热稳定性是实现本质工艺安全的重要途径,为整个工艺生产线定量评估危险性、制定预警及防控措施提供科学依据,所以急需提供一种含能材料化合工艺过程的温度修正系数的确定方法。
技术实现要素:
针对现有温度修正系数γ1的取值确定方法存在的缺陷和不足,本发明提供了一种能够对温度修正系数γ1进行定量取值的确定方法,为了实现上述任务,本发明采取如下的技术方案:
步骤一:绝热加速量热试验获取含能材料化合工艺过程最大累积度时刻物料的热分解反应动力学参量表观活化能ea和指前因子a。
利用绝热加速量热仪(arc)测试含能材料化合过程最大累积度时刻物料在绝热条件下的热分解特性,获得热分解参数起始分解温度ton、终止分解温度tmax、放热量q,利用绝热分解反应动力学模型拟合得到物料发生热分解反应的动力学参数表观活化能ea和指前因子a。
其中,α为转化率,%;a为指前因子,s-1;ea为表观活化能,j/mol;r为气体常数,8.314j/(mol·k)。
转化率α及dα/dt的求解如式(ⅱ)~(ⅴ)所示:
其中:α为转化率,%;ton为起始分解温度,k;δtad为经热惯量修正后的绝热温升,k;tmax为终止分解温度,k;q为放热量,j/g;
通过式(ⅰ)~(ⅴ)获得α和
步骤二:不同危险等级绝热条件下最大反应速率到达时间tmrad所需要的合成反应最高温度tmtsr。
tmrad的计算公式如下式(ⅵ)所示:
式中,e为活化能,j/mol;a为指前因子,s-1;tmtsr为合成反应的最高温度,k;r为气体常数,8.314j/(mol·k);cs为物料的比热容,j/(g·k);q为放热量,j/g。
在苏黎世危险性分析法zurichhazardanalysis(zha)法六等级准则的基础上,选取不同危险等级的6个绝热条件下最大反应速率到达时间tmrad,6个tmrad分别为100h、50h、24h、12h、8h、1h,由式(11)分别获得6个tmrad所所需要的合成反应最高温度tmtsr,分别为td100、td50、td24、td12、td8、td1。
步骤三:反应量热试验确定含能材料化合工艺合成反应所能达到的最高温度ts-mtsr。
利用微热量热仪或反应量热仪测试含能材料化合工艺的放热过程,获得合成反应的反应热和比热容,确定合成反应的绝热温升δtad,rx,结合工艺温度求得实际合成反应所能达到的最高温度ts-mtsr,如公式(ⅶ)~(ⅷ)所示:
ts-mtsr=ts-p+xac·δtad,rx(ⅶ)
其中,ts-p为实际合成反应的工艺温度,k;xac为最大累积度δtad,rx,%;δtad,rx为合成反应的绝热温升,k;q’为合成反应的反应热,j/g;cs为物料的比热容,j/(g·k)。
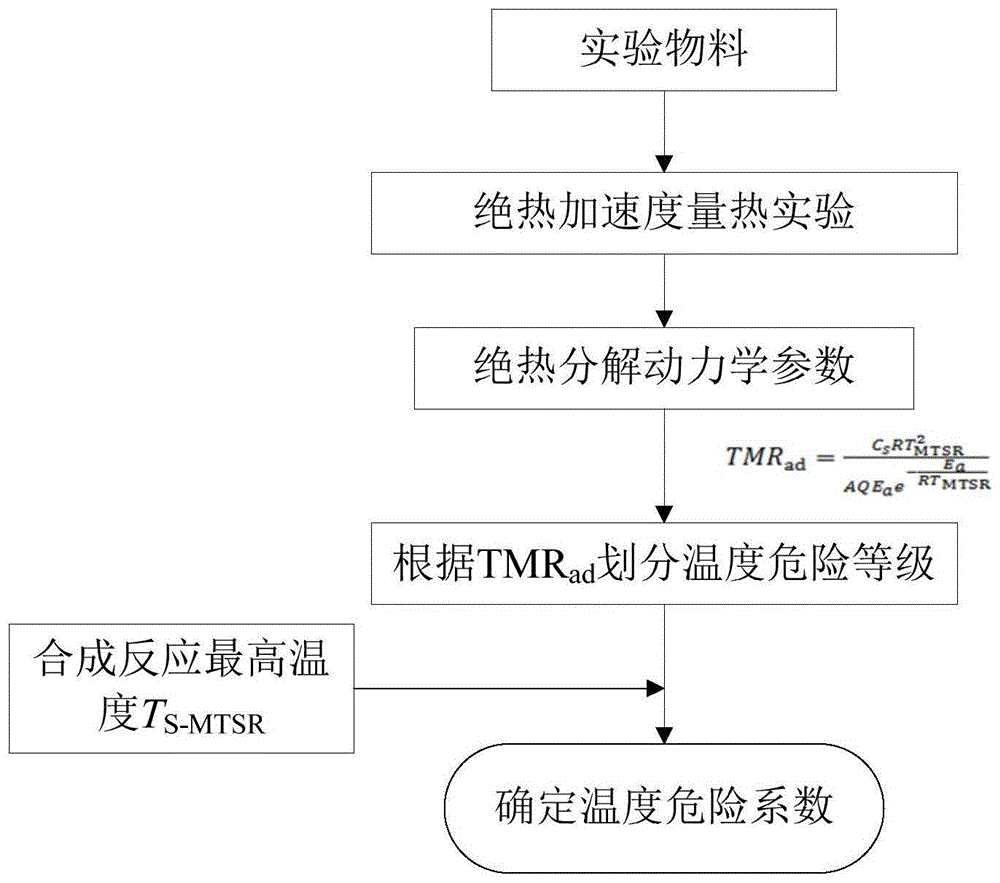
步骤四:以不同危险等级绝热条件下最大反应速率到达时间tmrad划分合成反应最高温度tmtsr的危险等级,对比衡量实际合成反应所能达到的最高温度ts-mtsr,定量获得化合工艺的温度修正系数γ1。
由于tmrad=100h需要的合成反应最高温度tmtsr为td100,因此,对于tmrad≥100h,当实际合成反应最高温度ts-mtsr≤td100时,温度修正系数γ1=1;
由于tmrad=50h需要的合成反应最高温度tmtsr为td50,因此,对于50h≤tmrad<100h,当实际合成反应最高温度td100﹤ts-mtsr≤td50时,温度修正系数γ1=2;
由于tmrad=24h需要的合成反应最高温度tmtsr为td24,因此,对于24h≤tmrad<50h,当实际合成反应最高温度td50﹤ts-mtsr≤td24时,温度修正系数γ1=3;
由于tmrad=12h需要的合成反应最高温度tmtsr为td12,因此,对于12h≤tmrad<24h,当实际合成反应最高温度td24≤ts-mtsr﹤td12时,温度修正系数γ1=4;
由于tmrad=8h需要的合成反应最高温度tmtsr为td8,因此,对于8h≤tmrad<12h,当实际合成反应最高温度td12﹤ts-mtsr≤td8时,温度修正系数γ1=5;
由于tmrad=1h需要的合成反应最高温度tmtsr为td1,因此,对于1h≤tmrad<8h,当实际合成反应最高温度td8﹤ts-mtsr≤td1时,温度修正系数γ1=6~9;
由于tmrad=1h需要的合成反应最高温度tmtsr为td1,因此,对于tmrad<1h,当实际合成反应最高温度ts-mtsr>td1时,温度修正系数γ1=1。温度修正系数γ1的确定如表2所示:
表2温度修正系数取值
步骤五:温度修正系数γ1为6~9,即td8≤ts-mtsr<td1时,以不同的比操作时间系数δ为依据,定量确定温度修正系数γ1。
γ1取值为6~9时,利用tmrad与实际工艺过程中的操作时间ts进一步确定,比操作时间系数δ的计算公式如式(ⅸ)所示:
式中:tmrad为绝热条件下最大反应速率到达时间(合成反应所能达到的最高温度ts-mtsr下),h;ts为此物料在工艺过程中的操作时间,h。比操作时间系数的物理意义为工艺操作时间ts的安全裕度,当γ1为6~9时,以1.5倍、2倍、4倍安全裕度即比操作时间系数δ=1,δ=2.5,δ=4为依据,划分温度修正系数,γ1在6~9时的确定方案如表3所示。
表3温度修正系数γ1在6~9时的取值方案
本发明的一种确定含能材料化合工艺温度修正系数的方法,与现有技术相比具有以下几方面有益技术效果:
(1)本发明温度修正系数γ1的确定以不同危险等级的工艺温度为衡量标尺,该工艺温度基于含能材料化合工艺过程物料本质热分解特性,由热分解动力学参数获得,结合工艺条件体现了不同工艺生产线物料属性,具有普适性,适用于不同火炸药物料热稳定性评价;
(2)本发明的温度修正系数γ1在6~9范围内的确定以不同危险等级绝热条件最大反应速率到达时间所需要的工艺及比操作时间系数为标尺,其中比操作时间系数标尺基于工艺操作时间的安全裕度确定,对比实际工艺温度、操作时间进行评定,因此温度修正系数的确定全面可靠,操作性强;
(3)定量确定温度修正系数γ1,为整个工艺生产线定量评估危险性、制定预警及防控措施提供科学依据;
(4)本发明采取绝热条件下最大反应速率到达时间tmrad对应的温度作为依据确定温度修正系数γ1的取值范围,绝热条件下物料发生分解反应所产生的热量没有散失,是最严苛的条件,因而绝热条件下得到的温度是最保守的温度,确定的温度修正系数结果保守,安全使用可靠性高。
附图说明
图1为温度修正系数γ1的取值方案流程图。
图2为本发明的实施例buaena化合工艺过程中物料在绝热条件下的热分解曲线。
图3为本发明的实施例buaena化合工艺合成反应的反应量热曲线。
具体实施方式:
本发明的绝热量热法确定火炸药化合工艺温度修正系数的确定方法,以丁基叠氮乙基硝胺(buaena)的化合工艺为研究对象,确定该化合工艺合成反应的温度修正系数。buaena是以bunena(丁基硝氧乙基硝胺)为原料,以dmso为溶剂,在70℃温度下与nan3化合反应制备而成。本发明以合成反应中最大累积度时刻的物料(bunena+nan3+dmso)为研究对象,利用绝热加速量热试验测试最大累积度时刻的物料在绝热条件下的热分解参数,根据绝热分解反应动力学模型获得表观活化能ea和指前因子a;进而获取不同危险等级绝热条件下最大反应速率到达时间tmrad所需要的合成反应最高温度tmtsr,并以不同危险等级绝热条件下最大反应速率到达时间tmrad所对应的合成反应最高温度tmtsr和比操作时间δ为标尺,对比衡量实际合成反应所能达到的最高温度ts-mtsr和实际工艺操作时间ts,定量确定含能材料化合工艺的温度修正系数γ1。温度修正系数的确定流程图如图1所示,具体按下列步骤进行:
步骤一:绝热加速量热试验测试并计算获得buaena化合工艺过程最大累积度时刻物料的热分解反应动力学参量表观活化能ea和指前因子a。
利用绝热加速量热仪测试(bunena+nan3+dmso)的反应液物料在绝热条件下的热分解,采用h-w-s(加热-搜索-等待)测试程序,起始温度50℃,升温台阶5℃,初始放热检测灵敏度为0.02℃/min。物料在绝热条件下的热分解曲线如图2所示。
通过试验获得获得热分解参数起始分解温度ton、终止分解温度tmax、放热量q,利用绝热分解反应动力学模型(式(1)~(5))拟合得到物料发生热分解反应的动力学参数表观活化能ea和指前因子a。
其中,α为转化率,%;a为指前因子,s-1;ea为表观活化能,j/mol;r为气体常数,8.314j/(mol·k)。
转化率α及dα/dt的求解如式(7)~(10)所示:
其中:α为转化率,%;ton为起始分解温度,k;δtad为经热惯量修正后的绝热温升,k;tmax为终止分解温度,k;q为放热量,j/g;
通过式(ⅰ)~(ⅴ)获得α和
步骤二:不同危险等级绝热条件下最大反应速率到达时间tmrad所需要的合成反应最高温度tmtsr。
tmrad公式如式(ⅵ)所示:
式中,ea为表观活化能,j/mol;a为指前因子,s-1;tmtsr为合成反应的最高温度,k;r为气体常数,8.314j/(mol·k);cs为物料的比热容,j/(g·k);q为放热量,j/g。
将活化能ea=135.08kj/mol,指前因子a=e24.57s-1,气体常数r=8.314j/(mol·g),物料的比热容cs=2j/(g·k),物料的绝热分解放热量q=604.45j/g代入公式(6),计算获得6个可能性等级下tmrad分别为100h、50h、24h、12h、8h、1h所需要的合成反应最高温度tmtsr,分别为td100、td50、td24、td12、td8、td1。
tmrad=100h需要的合成反应最高温度tmtsr为td100=125.10℃;
tmrad=50h需要的合成反应最高温度tmtsr为td50=132.35℃;
tmrad=24h需要的合成反应最高温度tmtsr为td24=140.33℃;
tmrad=12h需要的合成反应最高温度tmtsr为td12=148.2℃;
tmrad=8h需要的合成反应最高温度tmtsr为td8=152.9℃;
tmrad=1h需要的合成反应最高温度tmtsr为td1=179.0℃。
步骤三:反应量热试验确定含能材料化合工艺合成反应所能达到的最高温度ts-mtsr。
利用微热量热仪或反应量热仪测试含能材料化合工艺的放热过程,获得合成反应的反应热和比热容,确定合成反应的绝热温升δtad,rx,结合工艺温度求得实际合成反应所能达到的最高温度ts-mtsr,如公式(ⅶ)~(ⅷ)所示:
ts-mtsr=ts-p+xac·δtad,rx(ⅶ)
其中,ts-p为实际合成反应的工艺温度,k;xac为最大累积度δtad,rx,%;δtad,rx为合成反应的绝热温升,k;q’为合成反应的反应热,j/g;cs为物料的比热容,j/(g·k)。
buaena合成工艺的放热过程如图3所示。经过微热量热试验测得buaena合成过程中的反应热为62.11j/g,由式(ⅷ)可得反应的绝热温升为δtad,rx=31.01℃,buaena的合成反应属于间歇反应,对于间歇反应,在反应刚开始时的反应潜热最大,即累积度最大为100%。所以buaena合成反应实际所能达到的最高温度ts-mtsr=101.01℃。
步骤四:以不同危险等级绝热条件下最大反应速率到达时间tmrad划分合成反应最高温度tmtsr的危险等级,对比衡量实际合成反应所能达到的最高温度ts-mtsr,定量获得化合工艺的温度修正系数γ1。
由于tmrad=100h需要的合成反应最高温度tmtsr为td100=125.10℃,因此,对于tmrad≥100h,当实际合成反应最高温度ts-mtsr<125.10℃时,温度修正系数γ1=1;
由于tmrad=50h需要的合成反应最高温度tmtsr为td50=132.4℃,因此,对于50h≤tmrad<100h,当实际合成反应最高温度125.10℃≤ts-mtsr<132.35℃时,温度修正系数γ1=2;
由于tmrad=24h需要的合成反应最高温度tmtsr为td24=140.3℃,因此,对于24h≤tmrad<50h,当实际合成反应最高温度132.35℃≤ts-mtsr<140.33℃时,温度修正系数γ1=3;
由于tmrad=12h需要的合成反应最高温度tmtsr为td12=148.2℃,因此,对于12h≤tmrad<24h,当实际合成反应最高温度140.33℃≤ts-mtsr<148.16℃时,温度修正系数γ1=4;
由于tmrad=8h需要的合成反应最高温度tmtsr为td8=152.9℃,因此,对于8h≤tmrad<12h,当实际合成反应最高温度148.16℃≤ts-mtsr<152.89℃时,温度修正系数γ1=5;
由于tmrad=1h需要的合成反应最高温度tmtsr为td1=179.0℃,因此,对于1h≤ts-mtsr<8h,当实际合成反应最高温度152.89℃≤ts-mtsr﹤179.00℃时,温度修正系数γ1=6~9;
由于tmrad=1h需要的合成反应最高温度tmtsr为td1=179.0℃,因此,对于tmrad<1h,当实际合成反应最高温度ts-mtsr≥178.95℃时,温度修正系数γ1=10。
步骤五:温度修正系数γ1为6~9,即td8≤ts-mtsr<td1时,以不同的比操作时间系数δ为依据,定量确定温度修正系数γ1。
γ1取值为6~9时,利用tmrad与物料实际工艺过程中的操作时间ts进一步确定,由公式(ⅸ)计算出比操作时间δ:
式中:式中:tmrad为绝热条件下最大反应速率到达时间(合成反应所能达到的最高温度ts-mtsr下),h;ts为此物料在工艺过程中的操作时间,h。比操作时间系数的物理意义为工艺操作时间ts的安全裕度,以1倍、2.5倍、4倍安全裕度即比操作时间系数δ=1、δ=2.5、δ=4为标尺,划分温度修正系数,如表2所示:
表2温度修正系数γ1在6~9时的取值方案
根据上述结果,丁基叠氮乙基硝胺(buaena)化合工艺过程中物料的温度修正系数表3所示:
表3buaena化合工艺温度修正系数的取值
buaena合成工艺目标反应所能达到的最高温度ts-mtsr=101.01℃,所以根据温度修正系数的取值划分,物料在此温度下的温度修正系数γ1=1。
- 还没有人留言评论。精彩留言会获得点赞!