测定人血浆中依巴斯汀及代谢物卡瑞斯汀浓度的方法与流程
本发明涉及医药检测
技术领域:
,具体涉及一种测定人血浆中依巴斯汀及代谢物卡瑞斯汀浓度的方法。
背景技术:
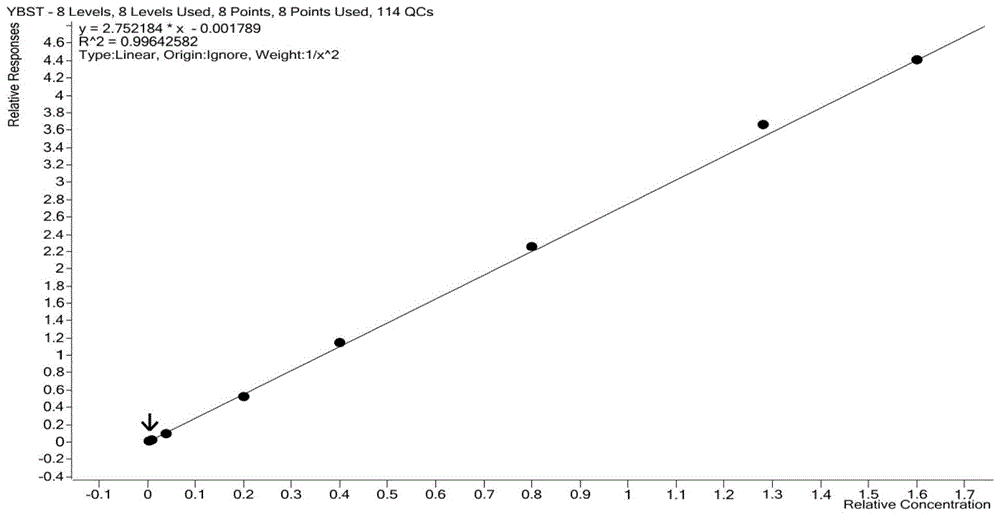
:依巴斯汀是由西班牙艾美罗公司首先开发成功的抗变态反应药物,具有长效、强效和高选择性等特点。该药对组胺h1受体特异性高,抗5-羟色胺(5-ht)作用非常弱,不易通过血-脑脊液屏障,因而嗜睡、镇静等不良反应少,具有抑制某些变态反应递质释放等抗变态反应作用。自1990年在西班牙上市以来,该药陆续在欧洲、亚洲、美洲、拉丁美洲等50多个国家和地区上市。2014年11月21日获批进口我国,商品名:规格:10mg。临床上适用于伴有或不伴有过敏性结膜炎的过敏性鼻炎(季节性和常年性)、慢性特发性荨麻疹的对症治疗。随着研究的深入,依巴斯汀又被发现了新的临床用途,在日本已经广泛用于斑秃的辅助治疗,另有肠易激综合征、银屑病等免疫相关疾病的临床研究报道,最近国外研究还揭示了依巴斯汀具有抗新生血管生成的作用,有望进一步应用于哮喘和气道炎症的治疗。依巴斯汀分子式为:c32h39no2;分子量:469.67;化学名称:1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮。结构式如下:由于依巴斯汀在体内很快代谢,浓度很低,并且个体内变异大,而卡瑞斯汀在体内浓度较高,峰浓度在约为依巴斯汀的50倍,是主要活性代谢产物。故考虑用代谢产物卡瑞斯汀作为等效性评价指标,原型药物依巴斯汀作为参考。现有的依巴斯汀有关物质高效液相分析方法有:欧洲药典(ep8.0),采用乙腈-磷酸-氢氧化钠溶液(ph5.0)等梯度洗脱,分析时间周期长达3个小时,主峰约110分钟出峰,且拖尾严重,测定很不方便,不利于实际推广应用;国家药品标准方法,采用甲醇-醋酸铵缓冲液(ph3.9)为流动相,检测波长为254nm,但该波长下个别杂质无吸收,且杂质无法达到有效分离,不能准确检测杂质;中国专利cn102095808所描述的方法采用三乙胺的磷酸盐缓冲溶液(ph6.5~10.8)为流动相,存在峰型钝且拖尾、杂质无法有效分离、优选的250nm波长下杂质不能完全被检测。申请号为cn201410378467.x的中国专利公开一种用高效液相色谱法测定依巴斯汀有关物质的方法,所述方法包括以下步骤:a.配制供试样品溶液:将待测样品用溶剂配制成供试样品溶液;b.检测:以十八烷基硅烷键合硅胶作为色谱柱填料,以磷酸盐缓冲溶液和有机溶剂的混合液作为流动相a、以所述有机溶剂作为流动相b,采用梯度洗脱法,检测所述供试样品溶液,检测波长为200-220nm。目前以高效液相色谱法为主,检测下限不能满足较小给药量时生物体内的含量测定。通常,依巴斯汀及其代谢物卡瑞斯汀在人血浆中同时存在,能够用一种方法同时检测具有重要意义。技术实现要素:本发明的目的在于提供一种测定人血浆中依巴斯汀及代谢物卡瑞斯汀浓度的方法,克服现有技术中的检测方法无法实现同时检测血浆中依巴斯汀和卡瑞斯汀的难题,以及克服二者实现同时检测但无法检测血浆中较低浓度水平的精准定量检测的缺陷;本发明的方法只需要极少的进样量就可以实现同时对血浆中依巴斯汀和卡瑞斯汀的分析检测,样本预处理过程简化,避免基质效应,色谱峰形极佳,实现了对血浆中药物快速、灵敏、特异性分析,为体内药代动力学的检测提供了简便的分析方法,实现在血浆中较低浓度水平的精准定量。为了解决上述技术问题,本发明采用如下技术方案:一方面,本发明提供一种测定人血浆中依巴斯汀及代谢物卡瑞斯汀浓度的方法,包括如下步骤:1)标准系列工作溶液的配制:称取依巴斯汀和卡瑞斯汀分别于容量瓶中,经甲醇溶解配制成标准对照品储备液;将标准对照品储备液用80%甲醇水溶液稀释,分别配制成标准系列的依巴斯汀工作溶液和卡瑞斯汀工作溶液;2)标准曲线血浆样本的制备:分别取标准系列的依巴斯汀工作溶液和卡瑞斯汀工作溶液,分别稀释到空白血浆中,配制成浓度为0.025~8ng/ml的依巴斯汀标准曲线血浆样品和浓度为2.5~800ng/ml的卡瑞斯汀标准曲线血浆样品;3)标准曲线回归方程的绘制:取标准曲线血浆样品,加入混合内标工作溶液,涡旋,加入乙腈沉淀剂沉淀后,涡旋、离心后,进样lc-ms/ms系统,得到色谱图;根据得到的色谱图中依巴斯汀色谱峰面积与内标峰面积的比值计算依巴斯汀在血浆中的浓度,制定依巴斯汀标准曲线回归方程;根据得到的色谱图中卡瑞斯汀色谱峰面积与内标峰面积的比值计算卡瑞斯汀在血浆中的浓度,制定卡瑞斯汀标准曲线回归方程。进一步地,所述标准对照品储备液的浓度为1mg·ml-1。进一步地,所述标准系列的依巴斯汀工作溶液的浓度范围为0.5~160ng/ml;优选浓度为160、128、80、40、20、4、1、0.5ng/ml;所述标准系列的卡瑞斯汀工作溶液的浓度范围为50~16000ng/ml;优选浓度为16000、12800、8000、4000、2000、400、100、50ng/ml。进一步地,所述依巴斯汀标准曲线血浆样品的浓度范围为0.025~8ng/ml,优选为0.025、0.05、0.2、1、2、4、6.4、8ng/ml;所述卡瑞斯汀标准曲线血浆样品的浓度范围为2.5~800ng/ml,优选为2.5、5、20、100、200、400、640、800ng/ml。进一步地,所述标准曲线回归方程的获取过程如下:取标准曲线血浆样品各50μl,加入混合内标工作溶液20μl,涡旋30s,分别加入300μl乙腈沉淀剂沉淀后,涡旋5min,离心2490g,4℃,10min;7μl进样lc-ms/ms系统,得到色谱图;根据得到的色谱图中依巴斯汀色谱峰面积与内标峰面积的比值计算依巴斯汀在血浆中的浓度,制定依巴斯汀标准曲线回归方程;根据得到的色谱图中卡瑞斯汀色谱峰面积与内标峰面积的比值计算卡瑞斯汀在血浆中的浓度,制定卡瑞斯汀标准曲线回归方程。进一步地,所述混合内标工作溶液的配制过程如下:称取富马酸依巴斯汀-d5和卡瑞斯汀-d5分别于容量瓶中,经甲醇溶解分别配制成1mg·ml-1的依巴斯汀-d5内标对照品储备溶液和卡瑞斯汀-d5内标对照品储备溶液;将依巴斯汀-d5内标对照品储备溶液用80%甲醇水溶液稀释,得浓度为10μg·ml-1的ybst-d5内标工作液;取ybst-d5内标工作液50μl置于100ml棕色容量瓶中,加入30μl卡瑞斯汀-d5内标对照品储备液,用80%甲醇水定容至刻度线,摇匀,即得浓度为ybst-d5/krst-d5=5/300ng·ml-1的混合内标工作液。进一步地,其中所述lc-ms/ms系统的条件如下:色谱条件色谱柱:phenomenex,gemini3umnx-c18110a,50*3mm;保护柱:ace5c18analyticlgrdcart(x5);流动相a∶0.1%甲酸水溶液,流动相b∶乙腈;流速:0.5ml·min-1;进样量:7μl;柱温:35℃;洗针液:50%甲醇水溶液;洗针液冲洗:10s;进样量:7μl;柱温:35℃;停止时间:6.00min。流动相比例设置如下:timeabflowmaxpressure10.00min70%30%0.500ml/min1300bar20.30min70%30%0.500ml/min1300bar33.00min12.6%87.4%0.500ml/min1300bar43.10min2%98%1.000ml/min1300bar54.50min2%98%1.000ml/min1300bar64.51min70%30%0.500ml/min1300bar76.00min70%30%0.500ml/min1300bar质谱条件采用esi源,离子化方式:电喷雾离子化正离子;监测方式:mrm;极性:正离子;碎裂电压:135v,碰撞能:30v;依巴斯汀(ybst):母离子m/z为470.4,子离子的m/z为167;依巴斯汀-d5(ybst-d5):母离子m/z为475.4,子离子的m/z为172.1;卡瑞斯汀(krst):母离子m/z为500.4,子离子的m/z为167.1;卡瑞斯汀-d5(krst-d5):母离子m/z为505.4,子离子的m/z为172.1;质谱切换阀设置如下:序号开始时间(min)电磁容量(deltaemv)采集(store)切换阀(divvalve)10600no切废液21.0600yes切质谱33.5600no切废液离子源参数设置如下:毛细管反吹干燥气温度(gastemp):350℃;毛细管反吹干燥气流量(gasflow):10l/min;雾化器压力(nebulizer):45psi;鞘流气温度(sheathgasheater):350℃;鞘流气流量(sheathgasflow):11ml/min,毛细管电压(capillary):4000v。进一步地,所述lc-ms/ms系统检测后,依巴斯汀和卡瑞斯汀分别在2.47min、2.02min左右出峰,峰形良好,且人血浆中无杂质峰干扰上述化合物的测定,表明该方法具有较强的专属性。进一步地,所述标准曲线的回归方程如下:测得的依巴斯汀在人血浆中的标准曲线回归方程为:y=2.752184x-0.001789,r2为0.99642582;依巴斯汀的线性范围为0.025ng/ml~8ng/ml,依巴斯汀的血药浓度的最低定量下限为0.025ng/ml;测得的卡瑞斯汀在人血浆中的标准曲线回归方程为:y=8.089103x-0.011261,r2为0.99750263;卡瑞斯汀的线性范围为2.5ng/ml~800ng/ml,卡瑞斯汀的血药浓度的最低定量下限为2.5ng/ml。进一步地,运用本发明所述的方法进行样品的检测,具体过程如下:向待测血浆样品中加入混合内标工作溶液,涡旋,加入乙腈沉淀剂沉淀后,涡旋、离心后,进样lc-ms/ms系统,得到色谱图;将待测血浆样品中目标药物的峰面积与内标峰面积比值代入获得的标准曲线回归方程,计算测定的药物的相应浓度。进一步地,所述样品的检测过程如下:向50μl待测血浆样品中加入20μl混合内标工作溶液,加入300μl乙腈沉淀剂沉淀后,涡旋5min,离心2490g,4℃,10min;7μl进样lc-ms/ms系统,得到色谱图;将待测血浆样品中目标药物的峰面积与内标峰面积比值代入获得的标准曲线回归方程,计算测定的药物的相应浓度。定性方法:待测药物与药物标准品的保留时间一致,结合质谱参数中的定性和定量离子对确定为目标药物。定量方法:以分析物峰面积与内标峰面积比对标准曲线中分析物的理论浓度进行线性最小二乘法回归计算,以所得回归方程计算样品中分析物的实测浓度。本发明采用液相色谱-质谱联用法进行检测,既结合了液相色谱仪有效分离不同化合物的分离能力,又结合质谱仪很强的组分鉴别能力,能够有效分离和鉴别血浆中依巴斯汀和卡瑞斯汀,并进行定量检测。本发明方法可获得高回收率且有效降低杂质峰的干扰,避免传统方法由于溶剂效应带来的影响,避免传统方法的繁琐和条件不受控的情况。本发明采用氘代依巴斯汀和氘代卡瑞斯汀作为内标物,可使测定的血浆中的依巴斯汀和卡瑞斯汀浓度的重现性好、准确度高;本发明方法具有系统适用性,对不同来源空白血浆无选择性,能够专一性测定依巴斯汀和卡瑞斯汀,分离度好。本发明方法用量小,每次血浆样品测试仅需7μl,可准确测定出化合物。与现有技术相比,本发明具有如下的有益效果:本发明提供了一种预处理方法简便的测定人血浆中的依巴斯汀及代谢物卡瑞斯汀浓度的方法,采用蛋白沉淀法,适用于常规测定;同时,在本实验所采用的色谱条件下,依巴斯汀保留时间为2.47min左右,代谢物卡瑞斯汀保留时间在2.02min左右,峰形良好,无杂峰干扰测定,基线平稳;本方法具有较高的特异性,能准确测定血浆中的依巴斯汀及代谢物卡瑞斯汀的浓度,灵敏度较高,依巴斯汀的血浆最低定量限为0.025ng/ml;代谢物卡瑞斯汀的血浆最低定量限为2.5ng/ml,本发明方法快速、准确、灵敏度高、操作简便,为依巴斯汀及代谢物卡瑞斯汀的血药浓度测定提供依据。本方法依巴斯汀的血浆标准曲线线性范围为0.025~8ng/ml,代谢物卡瑞斯汀的血浆标准曲线线性范围为2.5~800ng/ml,批内和批间精密度rsd均小于±10%。本发明方法重现性好,准确度高,不受基质、高血脂基质和溶血基质的干扰,不同人群的血浆对本发明方法无干扰现象。本发明方法能够满足人体药代动力学要求,可应用与临床药代动力学研究。附图说明图1lc-ms/ms法测得的人血浆中依巴斯汀的标准曲线图;图2lc-ms/ms法测得的人血浆中卡瑞斯汀的标准曲线图;图3lc-ms/ms法测得的人血浆中依巴斯汀和依巴斯汀-d5的液质图;图4lc-ms/ms法测得的人血浆中卡瑞斯汀和卡瑞斯汀-d5的液质图。图5依巴斯汀正离子多反应检测扫描质谱图;图6依巴斯汀-d5正离子多反应检测扫描质谱图;图7卡瑞斯汀正离子多反应检测扫描质谱图;图8卡瑞斯汀-d5正离子多反应检测扫描质谱图;具体实施方式下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。1.主要仪器agilentg6470型三重四极杆液质联用仪,配有液相色谱仪(含自动进样器)、电喷雾电离离子源(esi)及agilentmasshunterworkstationsoftware数据处理系(agilent,美国);mettlertoledoab135-s型十万分之一天平(mettler,瑞士)。2.色谱条件色谱柱:phenomenex,gemini3umnx-c18110a,50*3mm;保护柱:ace5c18analyticlgrdcart(x5);流动相a∶0.1%甲酸水溶液,流动相b∶乙腈;流速:0.5ml·min-1;进样量:7μl;柱温:35℃;洗针液:50%甲醇水溶液;洗针液冲洗:10s;进样量:7μl;柱温:35℃;停止时间:6.00min。流动相比例设置如下:timeabflowmaxpressure10.00min70%30%0.500ml/min1300bar20.30min70%30%0.500ml/min1300bar33.00min12.6%87.4%0.500ml/min1300bar43.10min2%98%1.000ml/min1300bar54.50min2%98%1.000ml/min1300bar64.51min70%30%0.500ml/min1300bar76.00min70%30%0.500ml/min1300bar3.质谱条件采用esi源,离子化方式:电喷雾离子化正离子模式(esi);扫描方式:多反应监测(mrm);质谱切换阀设置如下:离子源参数设置如下:parametervalue(+)gastemp(℃)350gasflow(l/min)10nebulizer(psl)45sheathgasheater350sheathgasflow11capillary(v)4000vcharging5004.抗凝剂:肝素钠5.内标:依巴斯汀-d5;卡瑞斯汀-d56.数据处理色谱保留时间及色谱峰面积由agilentmasshunterworkstationsoftware采集处理与定量分析,采用agilentecm网络系统。以分析物峰面积与内标峰面积比对标准曲线中分析物的理论浓度进行线性最小二乘法回归计算,以所得回归方程计算样品中分析物的实测浓度。样品中分析物的实测浓度由仪器采用以下回归方程计算:y=ax+b其中,y=分析物/内标峰面积比;a=标准曲线之斜率;x=药物浓度/内标浓度;b=标准曲线之截距;(权重因子为1/x2)所有计算和统计分析所使用小数点位数与软件输出保持一致。所有与浓度相关的数据保留小数点后3位,色谱峰保留时间保留小数点后3位,百分数保留1位小数,色谱峰面积保留整数,峰面积比保留小数点后6位。数据的rsd值、偏差、均值等采用microsoftofficeexcel2010进行计算。7.样品进行检测前的预处理方法:取全血,加入抗凝剂肝素钠,通过蛋白沉淀法进行处处理后制得空白血浆,冷藏用于进行样品稀释或配制,使用前解冻。50μl标准曲线血浆样品使用前加入混合内标工作溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样。50μlsst使用前加入混合内标工作溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样。50μl质控血浆样品使用前加入混合内标工作溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样。50μl空白血浆使用前加入80%甲醇水溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样,记作:doubleblank或carryover样品。或者50μl空白血浆使用前加入混合内标工作溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样,记作:blank样品。50μl超纯水使用前加入80%甲醇水溶液20μl,涡旋30s,加入300μl乙腈,涡旋5min,离心,2490g,4℃,10min,待进样,记作:reagentandmaterialsblank样品。备注:doubleblank为双空白样品、carryover为残留考察用双空白样品、blank为只加内标的单空白样品、reagentandmaterialsblank为试剂耗材验收空白样品。实施例11.溶液配制流动相a(0.1%甲酸水溶液):取1l超纯水于适当溶剂瓶中,加入1ml甲酸,混匀。流动相b(乙腈):量取1l的乙腈(merck)转移至适当的溶剂瓶中。稀释溶液(80%甲醇水溶液):取320ml甲醇于适当溶剂瓶中,加入80ml超纯水,混匀。洗针溶液配制(50%甲醇水):取1l甲醇于适当溶剂瓶中,加入1l超纯水,混匀。2.标准溶液配制:标准对照品储备液的配制精密称取依巴斯汀对照品、卡瑞斯汀对照品各10.00mg分别于10ml容量瓶中,用10ml移液管吸取10ml甲醇配置成浓度为1mg·ml-1的依巴斯汀标准对照品储备溶液、卡瑞斯汀标准对照品储备溶液,置于-20℃条件下保存。标准系列工作溶液的配制:取标准对照品储备液适量,用80%甲醇水溶液稀释,得到依巴斯汀工作溶液为:160、128、80、40、20、4、1、0.5ng/ml;卡瑞斯汀工作溶液为:16000、12800、8000、4000、2000、400、100、50ng/ml标准曲线血浆样品的配制取标准系列工作溶液各10μl,稀释到空白血浆中使得总体积为0.2ml,配制的标准曲线血浆样品中依巴斯汀浓度值为:0.025、0.05、0.2、1、2、4、6.4、8ng/ml;卡瑞斯汀浓度值为2.5、5、20、100、200、400、640、800ng/ml。sst样品:分别取标准系列工作溶液10μl,稀释到空白血浆中使得总体积为0.2ml,配制的sst样品中依巴斯汀浓度值为:0.025ng/ml;卡瑞斯汀浓度值为2.5ng/ml。3.内标标准溶液配制内标储备溶液配制在规格为1.01mg的富马酸依巴斯汀-d5对照品(含量96.8%,并去除富马酸的量)中加入0.786ml甲醇,摇匀。即得含依巴斯汀-d5(ybst-d5)浓度为1mg·ml-1的内标对照品储备溶液,置于-20℃条件下保存。在规格为1.01mg的卡瑞斯汀-d5对照品(含量93.4%)中加入0.943ml甲醇,摇匀。即得含卡瑞斯汀-d5(krst-d5)浓度为1mg·ml-1的内标对照品储备溶液,置于-20℃条件下保存。混合内标工作溶液配制(isspike,ybst-d5/krst-d5=3/500ng·ml-1)吸取10μl依巴斯汀-d5内标对照品储备液(ybst-d5isstock,1mg·ml-1)加80%甲醇水990μl,得浓度为10ug·ml-1的ybst-d5spike。取ybst-d5spike溶液50μl置于100ml棕色容量瓶中,加入30μl卡瑞斯汀-d5内标对照品储备液(krst-d5isstock,1mg·ml-1),用80%甲醇水定容至刻度线,摇匀,即得浓度为ybst-d5/krst-d5=5/300ng·ml-1的混合内标工作液(isspike)。4.质控标准溶液配制质控对照品储备液的配制:分别称取依巴斯汀对照品、卡瑞斯汀对照品10.00mg,用10ml移液管吸取10ml甲醇加入10ml容量瓶中,含待测物(依巴斯汀或卡瑞斯汀)浓度为1mg·ml-1的质控对照品储备溶液,置于-20℃条件下保存。质控工作溶液的配制:分别取质控对照品储备液,稀释到80%甲醇水溶液中,配制成的依巴斯汀质控工作液的浓度为120、48、1.5、0.5、600ng/ml;卡瑞斯汀质控工作液的溶液为:12000、4800、150、50、60000ng/ml质控血浆样品的配制:分别取质控工作溶液,稀释到空白血浆中,配制成的依巴斯汀质控血浆样品液的浓度为6、2.4、0.075、0.025、30ng/ml;卡瑞斯汀质控血浆样品液的溶液为:600、240、7.5、2.5、3000ng/ml;分别对应hoqqc、moqqc、loqqc、lloq、aql。5.方法学验证5.1线性范围和定量下限取标准系列工作溶液各10μl,稀释到空白血浆中使得总体积为0.2ml,配制的标准曲线血浆样品中依巴斯汀浓度值为:0.025、0.05、0.2、1、2、4、6.4、8ng/ml;卡瑞斯汀浓度值为2.5、5、20、100、200、400、640、800ng/ml。取标准曲线血浆样品、、空白血浆doubleblank样品、blank样品;7μl进样到色谱系统分析。结论:所得标准曲线样品的线性曲线图如1-2所示,其中lc-ms/ms法测得的依巴斯汀在人血浆中的标准曲线方程为:y=2.752184x-0.001789,r2为0.99642582;平均测定8次,r2的sd为0.002,cv为14.7;斜率的sd为0.427,cv为0.2;依巴斯汀的线性范围为0.025ng/ml~8ng/ml,依巴斯汀的血药浓度的最低定量下限为0.025ng/ml,在线性范围内线性关系良好。lc-ms/ms法测得的卡瑞斯汀在人血浆中的标准曲线方程为:y=8.089103x-0.011261,r2为0.99750263;平均测定8次,r2的sd为0.444,cv为5.3;斜率的sd为0.001,cv为0.1;卡瑞斯汀的线性范围为2.5ng/ml~800ng/ml,卡瑞斯汀的血药浓度的最低定量下限为2.5ng/ml,在线性范围内线性关系良好。5.2精密度与准确度取四个不同浓度的质控血浆样品,依巴斯汀质控血浆样品液的浓度为6、2.4、0.075、0.025ng/ml;卡瑞斯汀质控血浆样品液的溶液为:600、240、7.5、2.5ng/ml;分别对应为hoqqc、moqqc、loqqc、lloq浓度,并将其进行检测。作为批内及批间准确度和精密度的考察。每一个浓度平行制备6份,至少测试三次。采用平均值来评估批间准确度和精密度。结果如下表:表1:lc-ms/ms法测定血浆中依巴斯汀批内、批间的精密度和准确度表2:lc-ms/ms法测定血浆中卡瑞斯汀批内、批间的精密度和准确度结果表明:依巴斯汀和卡瑞斯汀的血浆样品批内、批间精密度、准确度偏差均小于15%。低、中、高浓度水平标准血浆样品测得值应为标示值的85.0%~115.0%范围内,批内与批间精密度(rsd)小于15.0%。说明本发明方法对血浆中的卡瑞斯汀和依巴斯汀的检测具有良好的精密度和准确度。5.3系统适用性:取经预处理过的依巴斯汀质控血浆样品,浓度为0.025ng/ml;卡瑞斯汀质控血浆样品,溶液为2.5ng/ml;7μl进样检测,重复分析5次;取经预处理过的空白血浆blank样品;7μl进样检测,重复分析5次;分别记录待测物与内标的色谱峰面积值及保留时间,并计算待测物与内标的色谱峰面积比值及色谱峰保留时间的变异系数。具体结果如下表3-4所示:表3:依巴斯汀的系统适用性表4:卡瑞斯汀的系统适用性结论:待测物信噪比(s/n不小于5),5次重复分析所得待测物与内标色谱峰面积比值的变异系数应小于5%;5次重复分析所得待测物与内标色谱峰保留时间的变异系数应小于0.5%。待测物ybst保留时间变异系数0.0-0.3%、内标保留时间变异系数0.0-0.2%、面积比的变异系数0.5-8.0%;待测物krst保留时间变异系数0.0-0.2%、内标保留时间变异系数0.0-0.2%、面积比的变异系数0.2-4.2%。说明本发明方法对血浆中药物的检测方法适用测定依巴斯汀和卡瑞斯汀。5.4选择性选择性是指色谱方法测定分析物时,区分生物基质中干扰的能力。方法验证之前,需要至少筛选6个不同批次的空白基质用于方法验证。取6个中国人群不同来源的空白血浆50μl,经预处理为carryover样品后,7μl进样到色谱系统分析。取50μl6份来自不同来源的空白血浆,配制成的依巴斯汀质控血浆样品液的浓度为0.025ng/ml,经预处理后,7μl进样到色谱系统分析;取50μl6份来自不同来源的空白血浆,配制成卡瑞斯汀质控血浆样品液的溶液为2.5ng/ml,经预处理后,7μl进样到色谱系统分析;取50μl6份来自不同来源的空白血浆,经预处理为blank样品后,7μl进样到色谱系统分析;分别记录各份空白样品及定量下限浓度水平的标准血浆样品的结果如下表。表5:六个不同来源空白健康人体血浆对分析物、内标的选择性考察对比表(依巴斯汀)表6六个不同来源空白健康人体血浆对分析物、内标的选择性考察对比表(卡瑞斯汀)结论:至少6份不同来源空白基质样品中的分析物保留时间处色谱峰峰面积低于相对应的不同来源空白基质lloq浓度待测物峰面积的20.0%,且内标保留时间处内标峰面积低于相对应的不同来源空白基质lloq浓度内标峰面积的5.0%。6份不同来源空白基质配制的lloq浓度测得值在理论值的80.0%~120.0%范围内。本发明方法针对不同来源空白基质样品中的分析物的干扰范围为0~6.7%,内标干扰响应值为0。可见,不同人体的空白血浆对依巴斯汀和卡瑞斯汀的检测结果没有造成干扰,该方法可以用于检测不同人体血浆中依巴斯汀和卡瑞斯汀,不同人群的血浆对本发明检测方法无影响。5.5回收率5.5.1分析物的提取回收率分析物回收样品分别取浓度为6、2.4、0.075ng/ml依巴斯汀质控血浆样品液,平行制备6份;分别取溶液为:600、240、7.5ng/ml卡瑞斯汀质控血浆样品液,平行制备6份;均不加入混合内标工作溶液,沉淀后,取合适体积的上清溶液,加入与上清相同体积的5ng/ml内标溶液,涡流混合后测定。回收率参比样品:提取过程与分析物回收样品操作相同,但是混合内标工作溶液在沉淀后加入,再取上清涡流后进行测定。5.5.2内标物的提取回收率内标的提取回收率样品由空白血浆样品平行制备6份,加入混合内标工作溶液,沉淀后,取合适体积的上清溶液,加入与moqqc质控样品浓度相当的标准品溶液。内标的回收率参比样品:提取过程与内标的提取回收率样品的提取操作相同,但是moqqc质控样品和内标溶液均在沉淀后加入。结论:1)本发明方法的待测物依巴斯汀在高、中、低三个浓度范围内的提取回收率分别为106.3%、100.5%、100.0%,对应的变异系数cv值为6.5%、0.7%、7.1%;总回收率为102.3%,总体回收率变异cv值为6.0%。2)本发明方法的待测物卡瑞斯汀在高、中、低三个浓度范围内的提取回收率分别为106.8%、97.9%、104.0%,对应的变异系数cv值为6.3%、1.3%、6.5%;总回收率为102.9%,总体回收率变异cv值为6.3%。3)本发明方法的内标物依巴斯汀的提取回收率为99.8%,回收率cv值为2.4%。4)本发明方法的内标物卡瑞斯汀的提取回收率为97.8%回收率cv值为6.7%。5.6基质效应1)基质效应系指生物基质中存在的组分对分析物的离子化所产生的抑制或增强作用。分别取6个不同批次的空白人血浆,每个批次配制一份,经前处理后分别加入与处理后的低浓度和高浓度质控样品浓度相当的标准品溶液及内标溶液进行分析。无基质存在的与低浓度和高浓度质控样品浓度相当的纯溶液,平行6份,进行分析。2)溶血基质的配制:取100μl空白全血,将其超声破坏血细胞,取其20μl加入980μl正常空白血浆,混匀,即为2%经超声破坏的溶血血浆,视为严重溶血。使用模拟的溶血血浆制备待测物两个浓度水平(loqqc、hoqqc)样品各6份,并将其处理后,进样到色谱系统分析。3)使用高血脂血浆样品制备待测物低、高浓度水平(loqqc、hoqqc)样品各6份,并将其处理后,进样到色谱系统分析。结论:经内标归一化的基质因子的变异系数cv%:ybst为1.7~2.8%,krst为1.1~1.3%;溶血基质效应的平均准确度偏差范围:ybst为-1.8~1.7%,krst为-3.7~-2.8%;高血脂基质效应的平均准确度偏差范围:ybst为-6.1~5.6%,krst为-3.7~-2.8%;说明本发明方法没有明显的基质效应,也没有明显的溶血和高血脂基质效应。5.7稳定性将待测物低、高(loqqc、hoqqc)两个浓度的人血浆质控样品,在如下条件下进行稳定性考察:1)-70℃反复冻融5次稳定。2)室温放置7h稳定。3)-20℃条件下42d稳定。4)全血稳定性:分别考察加入含低、高(loqqc、hoqqc)两个浓度水平分析物在全血中冰水浴下放置(0h)、(0.5~2h)峰面积之比的变化,在放置相应考察时间点后,将全血样品离心分离血浆,加入内标按照相应血浆样品处理操作方法处理,每个浓度水平平行6份。通过稳定性考察后的样品与现配制的样品同时检测,每个浓度对比结果如下:表7室温放置7h稳定-短期稳定性结果:表8-20℃条件下42d稳定-长期稳定性结果:表9-70℃反复冻融5次稳定性结果:表10全血稳定性结果:本发明的方法检测的血浆中各药物的浓度在上述考察条件下得出的cv值小于5%,提示在上述考察条件下本发明方法对全血和血浆中依巴斯汀和卡瑞斯汀的检测具有较强的稳定性。5.8人血浆样品检测于96孔板中精密加入50ul的依巴斯汀浓度为0.025ng/ml的血浆样品,加入20ul的isspike,加入300ul乙腈于96孔板中,涡旋混合5min,于4℃以2490rpm离心10min,7ul进样到色谱系统进行lc-ms/ms分析,结果如图3所示。于96孔板中精密加入50ul的卡瑞斯汀浓度为2.5ng/ml的血浆样品,加入20ul的isspike,加入300ul乙腈于96孔板中,涡旋混合5min,于4℃以2490rpm离心10min,7ul进样到色谱系统进行lc-ms/ms分析,结果如图4所示。结论:经方法学验证,本发明方法具有灵敏度高,适用性强,精密度和准确度良好、稳定性好的优点,药物的提取回收率在可接受范围内,未见明显基质效应,本发明方法还具有快速、通量高的优点。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1