一种心血管疾病标志物的免疫定量检测装置、检测方法及用途与流程
本发明涉及免疫定量检测技术领域,尤其涉及一种心血管疾病标志物的免疫定量检测装置、免疫定量检测方法和免疫定量放大检测方法及用途。
背景技术:
免疫学检测技术是应用免疫学原理设计的测定抗原、抗体、免疫细胞及化学成分等的实验手段,广泛用于来源于人体和动物体可进行疾病诊断和健康检测的样品以及用于环境、药物分析、食品和工业分析的样品。常用的免疫学检测技术有免疫浊度技术、固相酶免疫测定技术、化学发光检测技术、免疫荧光标记技术、流式细胞术、胶体金技术等。
其中,免疫浊度技术,也称免疫浊度法,是指可溶性抗原、抗体在液相中特异结合待测物,产生一定大小的复合物,形成光的折射或吸收,测定这种折射或吸收后的透射光或散射光作为计算单位,用于定量检测。但是,这种方法检测的灵敏度低,不适合用于微量检测。
固相酶免疫测定技术基于抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体保持其免疫学活性,抗原或抗体的酶结合物既保留其免疫学活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应,具有灵敏度高、线性响应范围宽和易于实现自动化等显著优点。但固相酶免疫测定技术检测反应时间长限制了其使用。
免疫化学发光检测技术是一种高灵敏的微量及痕量分析技术,具有操作方便、灵敏度高、线性响应范围宽和易于实现自动化等显著优点,广泛地应用于环境、临床、药物分析、食品和工业分析中,也是基于抗原或抗体的固相分离手段及抗原或抗体的发光试剂标记技术。但是免疫化学发光检测技术检测反应时间长,对检测设备的要求高也影响其使用。
另外,免疫荧光标记技术、流式细胞术、胶体金技术也是常用的检测技术被广泛使用,但均有其相应的不足。
高灵敏度、快速、小型化、全定量、自动化是目前临床免疫检测技术产品的发展趋势,但现有的免疫检测技术都无法同时实现上述功能。因此,开发一种能够实现既具有高灵敏度、全定量、自动化特点,同时又具有检测快速、设备可做到小型便携特点的新的检测技术,不仅使用方便、减少浪费,同时也可显著提高工作效率,在检测和分析、分离的诸多领域具有重要的实用意义。
技术实现要素:
本发明要解决的技术问题是如何提高心血管疾病标志物的免疫检测灵敏度、检测速度、定量检测精度以及如何实现免疫检测装置的自动化和小型化的问题,本发明提供了一种具有灵敏度高、全定量、检测速度快的心血管疾病标志物的免疫定量检测装置,特别是以过滤器作为反应载体的免疫定量检测装置。
为实现上述目的,本发明采用的技术方案是一种心血管疾病标志物的免疫定量检测装置,所述装置包括:流动相盛放装置、过滤器、检测相盛放装置、检测器;其中,
所述流动相盛放装置通过管道与过滤器相连接;
所述过滤器包括入口、过滤芯和出口;
所述检测相盛放装置通过管道与检测器相连接;
所述过滤芯的材质为能够用一种心血管疾病标志物特异性结合物进行偶联的物质。
进一步的,所述心血管疾病标志物特异性结合物为酶、抑制剂、配体、受体、蛋白质中的一种。更进一步的,所述蛋白质选自抗原和/或抗体。
进一步的,所述过滤器的体积小于1ml,优选2微升至1毫升,更优选3微升至0.3毫升,最优选5微升至0.1毫升。
进一步的,所述过滤芯的过滤结构为长大于宽的形状,其中长宽比值为2-100,优选2-50,更优选2-30,可以是圆柱状、圆锥状、方形、长方形及其组合形状等;或者所述过滤芯的过滤结构为宽大于长的形状,其中宽长比值为1.1-10,优选1.1-5,更优选1.1-3,可以是圆柱状、圆锥状、方形、长方形及其组合形状等。
所述过滤芯采用水不溶性固相材料制成;进一步的,所述水不溶性固相材料是颗粒状固相物质或筛孔状固相物质;优选的,所述的颗粒状固相物质或筛孔状固相物质为多种能够与心血管疾病标志物特异性结合物如抗原或抗体偶联结合并且对心血管疾病标志物特异性结合物如抗原或抗体的免疫学结合特性不产生明显改变的固态物质;更优选的,所述水不溶性固相材料选自凝胶颗粒、乳胶颗粒、磁微粒中的一种或多种;最优选的,所述凝胶颗粒选自葡聚糖凝胶颗粒、琼脂糖凝胶颗粒、溴化氰活化琼脂糖凝胶颗粒、nhs活化琼脂糖凝胶颗粒中的一种或多种。
所述检测器为能够定量检测并记录颜色或光量变化的机械结构;优选的,所述检测器选自化学发光检测器、分光光度检测器、荧光检测器、酶联免疫检测器的一种或多种。
进一步的,所述心血管疾病标志物选自肌钙蛋白i、肌钙蛋白t、肌红蛋白、肌酸激酶同工酶(ck-mb)、心源性脂肪酸结合蛋白、脑钠肽、同型半胱氨酸、c反应蛋白、d-二聚体、糖化血红蛋白、载脂蛋白a1、载脂蛋白b中的一种或多种;优选的,所述心血管疾病标志物选自肌钙蛋白i、肌红蛋白、肌酸激酶同工酶中的一种。
本发明还提供一种心血管疾病标志物的免疫定量检测方法,所述检测方法步骤包括:
(1)用心血管疾病标志物特异性结合物标记过滤芯,制成标记过滤芯i;
(2)用所述标记过滤芯i特异性捕获心血管疾病标志物,制成过滤芯-心血管疾病标志物结合物i;
(3)用所述过滤芯-心血管疾病标志物结合物i特异性捕获检测相中的检测物质,制成过滤芯-心血管疾病标志物-检测物质复合物,其中,所述检测物质为心血管疾病标志物特异性结合物与指示剂的指示结合物;
(4)检测并计算所述心血管疾病标志物的含量。
进一步的,在进行步骤(4)之前,采用清洗液对所述过滤芯-心血管疾病标志物-检测物质复合物进行洗脱,以去除未被捕获而残留在所述过滤芯中的检测相残留物。
进一步的,心血管疾病标志物的免疫定量检测方法包括以下具体步骤:
(1)用心血管疾病标志物特异性结合物标记过滤芯,制成标记过滤芯i;
(2)用标记过滤芯i制备所述过滤器的过滤结构;
(3)使所述心血管疾病标记物经过所述过滤器过滤,用所述标记过滤芯i特异性捕获心血管疾病标志物,制成过滤芯-心血管疾病标志物结合物i;
(4)用清洗液对所述过滤芯-心血管疾病标志物结合物i进行洗脱,以去除未被捕获而残留在过滤芯中的心血管疾病标志物残留物;
(5)使含有检测物质的检测相经过所述过滤器过滤,用所述过滤芯-心血管疾病标志物结合物i特异性捕获检测相中的检测物质,制成过滤芯-心血管疾病标志物-检测物质复合物,其中,所述检测物质为心血管疾病标志物特异性结合物与指示剂的指示结合物;
(6)采用清洗液对所述过滤芯-心血管疾病标志物-检测物质复合物进行洗脱,以去除未被捕获而残留在所述过滤芯中的检测相残留物;
(7)检测并计算所述心血管疾病标志物的含量。
所述检测并计算所述心血管疾病标志物的含量的步骤选自以下任一一种方法:1)直接对所述过滤芯-心血管疾病标志物-检测物质复合物进行检测,以获取所述过滤芯特异性捕获的指示剂的量i,根据所述指示剂的量i计算所述心血管疾病标志物的含量;和/或,2)直接对经步骤(6)用清洗液洗脱并收集含有检测物质的洗脱液进行检测,以获取未被捕获而残留在所述过滤芯中的指示剂的量ii,根据所述指示剂的量ii计算所述心血管疾病标志物的含量;和/或,3)直接对经步骤(5)特异性捕获后流出的检测相进行检测,以获取未被结合而流出的指示剂的量iii,根据所述指示剂的量iii计算所述心血管疾病标志物的含量。
本发明还提供一种心血管疾病标志物的免疫定量放大检测方法,所述免疫定量放大检测方法包括以下步骤:
(1)用心血管疾病标志物特异性结合物标记过滤芯,制成标记过滤芯ii;
(2)用所述标记过滤芯ii特异性捕获心血管疾病标志物,制成过滤芯-心血管疾病标志物结合物ii;
(3)用所述过滤芯-心血管疾病标志物结合物ii特异性捕获一级检测相中的亲和素偶联物,制成过滤芯-心血管疾病标志物-亲和素偶联物的复合物;
(4)用所述过滤芯-心血管疾病标志物-亲和素偶联物的复合物特异性捕获二级检测相中的生物素检测物,制成过滤芯-心血管疾病标志物-亲和素偶联物-生物素检测物的复合物,其中,所述生物素检测物为生物素与指示剂的结合物;
(5)检测并计算所述心血管疾病标志物的含量。
进一步的,在进行步骤(5)之前,采用清洗液对所述过滤芯-心血管疾病标志物-亲和素偶联物-生物素检测物复合物进行洗脱,以去除未被捕获而残留在所述过滤芯中的二级检测相残留物。
所述亲和素为具有亲和素结合特性的物质;优选的,所述亲和素选自卵白亲合素、链亲合素、卵黄亲合素及类亲合素中的一种或多种。
进一步的,所述免疫定量放大检测方法包括以下具体步骤:
(1)用心血管疾病标志物特异性结合物标记过滤芯,制成标记过滤芯ii;
(2)用标记过滤芯ii制备所述过滤器的过滤结构;
(3)使心血管疾病标志物经过所述过滤器,用所述标记过滤芯ii特异性捕获心血管疾病标志物,制成过滤芯-心血管疾病标志物结合物ii;
(4)用清洗液对所述过滤芯-心血管疾病标志物结合物ii进行洗脱,以去除未被捕获而残留在过滤芯中的心血管疾病标志物残留物;
(5)使含有亲和素偶联物的一级检测相经过所述过滤器过滤,用所述过滤芯-心血管疾病标志物结合物ii特异性捕获一级检测相中的亲和素偶联物,制成过滤芯-心血管疾病标志物-亲和素偶联物复合物;
(6)用清洗液对所述过滤芯-心血管疾病标志物-亲和素偶联物复合物进行洗脱,以去除未被捕获而残留在过滤芯中的一级检测相残留物;
(7)使含有生物素检测物的二级检测相经过所述过滤器过滤,用所述过滤芯-心血管疾病标志物-亲和素偶联物的复合物特异性捕获二级检测相中的生物素检测物,制成过滤芯-心血管疾病标志物-亲和素偶联物-生物素检测物复合物,其中,所述生物素检测物为生物素与指示剂的结合物;
(8)用清洗液对所述过滤芯-心血管疾病标志物-亲和素偶联物-生物素检测物复合物进行洗脱,以去除未被捕获而残留在过滤芯中的二级检测相残留物;
(9)检测并计算所述心血管疾病标志物的含量。
进一步的,所述检测并计算所述心血管疾病标志物的含量的步骤选自以下任一一种方法:1)直接对所述过滤芯-心血管疾病标志物-亲和素偶联物-生物素检测物进行检测,以获取所述过滤芯特异性捕获的指示剂的量iv,根据所述指示剂的量iv计算所述心血管疾病标志物的含量;和/或,2)直接对经清洗液洗脱并收集含有生物素检测物的洗脱液进行检测,以获取未被捕获而残留在所述过滤芯中的指示剂的量v,根据所述指示剂的量v计算所述心血管疾病标志物的含量;和/或,3)直接对经步骤(3)特异性捕获后流出的二级检测相进行检测,以获取未被结合而流出的指示剂的量vi,根据所述指示剂的量vi计算所述心血管疾病标志物的含量。
进一步的,所述指示剂为能够直接或间接产生颜色或光量变化的物质;
优选的,指示剂为酶类物质、可直接或间接发光的物质、可产生荧光的物质、自身带有颜色的物质;
更优选的,上述酶类物质选自辣根过氧化酶(hrp)、碱性磷酸酶(ap)、葡萄糖氧化酶,β-半乳糖苷酶、溶菌酶和苹果酸脱氢酶中的一种或多种;上述可直接或间接发光的物质选自鲁米诺及其衍生物、光泽精、洛粉碱、过氧化草酸酯类、吖啶酯类中的一种或多种;上述可产生荧光的物质选自异硫氰酸荧光素(fitc)或罗达明(rb200)中的一种或多种;上述自身带有颜色的物质选自胶体金类物质。
本发明还提供一种免疫定量检测装置、免疫定量检测方法或免疫定量放大检测方法用于免疫定量检测含有心血管疾病标志物的样品的用途。
其中,所述含有心血管疾病标志物的样品为来源于人体和动物体可进行疾病诊断和健康检测的样品,或者含有心血管疾病标志物的样品是用于环境、药物分析、食品和工业分析的样品。所述的免疫定量检测装置、免疫定量检测方法或免疫定量检测放大方法在多种检测技术产品开发中的应用,包括来源于人体的样本检测为临床检测的主要内容,用于各种疾病的诊断、辅助诊断、预测、病情监测等;来源于动物体的样本检测也为临床检测的主要内容,用于动物相关的各种疾病的诊断、辅助诊断、预测、病情监测以及食品安全检测等。
采用上述技术方案,本发明至少具有下列优点:
本发明设计了一种以过滤器为反应载体的心血管疾病标志物的免疫定量检测装置,与现有检测技术相比,采用本发明的免疫定量检测装置,全程操作时间仅需要13分钟,但是现有化学发光检测技术基本达到平衡则需要30分钟,本发明过滤的反应时间较现行的检测结合反应时间明显缩短,提高了检测速度。因此,在检测结果基本相同的情况下,本发明完成检测的时间明显短于现有检测技术,提高了心血管疾病标志物免疫定量检测个性化的可控程度,大大提高了其检测效率。
另外,当检测时间在10分钟以上时,检测倍数基本不变,这表明本发明检测样品如甲胎蛋白水平具体良好的重复性,能够满足检测准确性的要求。
本发明在室温下就可以完成全部反应,免除了现行检测设备中需要设置的温控反应结构,采用3立方毫米的过滤器就可以实现免疫检测,整个检测装置体积小,简化了仪器设计,可实现小型化、便携的目的。
因此,本发明心血管疾病标志物的免疫定量检测装置和检测方法对改善现有心血管疾病标志物的免疫检测技术具有重要的意义和良好的应用前景。
附图说明
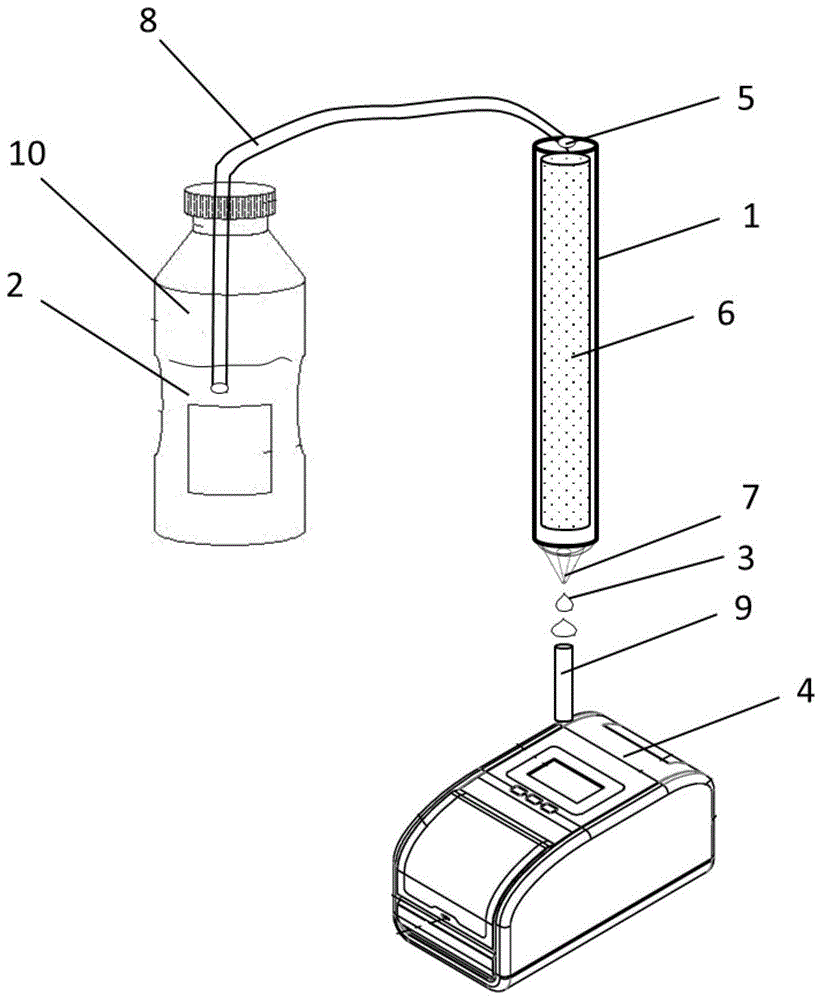
图1为本发明心血管疾病标志物的免疫定量检测装置示意图。
具体实施方式
为更进一步阐述本发明为达成预定目的所采取的技术手段及功效,以下结合附图1及较佳实施例,对本发明进行详细说明。
如图1所示,一种心血管疾病标志物的免疫定量检测装置,包括:流动相盛放装置2、过滤器1、检测相盛放装置3、检测器4;其中,所述流动相盛放装置2通过管道8与所述过滤器1相连接;所述过滤器1包括入口5、过滤芯6和出口7;所述检测相盛放装置3通过管道9与所述检测器4相连接。
进一步的,上述过滤器1为检测反应的反应器,检测反应的主要反应过程在过滤器1上进行,由入口5、过滤芯6和出口7组成,其中过滤层内的过滤芯是由能够与心血管疾病标志物形成特异性结合的用抗原或抗体偶联的标记的水不溶性固相材料组成。固相材料可以是堆积的固相颗粒状物质,形成了颗粒与颗粒之间的腔隙性过滤孔径,也可以是筛孔状的固相物质。
进一步的,上述流动相盛放装置2为一装有样本的容器结构,装载包括来源于人体和动物体可进行疾病诊断和健康检测的样品以及用于环境、药物分析、食品和工业分析的样品。
进一步的,上述检测相盛放装置3为一装有检测溶液的容器结构,装载有能够与心血管疾病标志物特异性结合并能够直接或间接产生颜色或光量变化的检测物质的溶液。
进一步的,上述检测器4为一颜色或光量检测分析装置。
实施例1:本发明过滤器的制备
实验材料:市售微型过滤器、nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人纤维蛋白原多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺。
实验方法:取市售微型过滤器,取出滤芯;取5mg抗人纤维蛋白原多克隆抗体加0.2m碳酸氢钠溶液,ph8.3,2ml溶解;取1ml的nhs活化琼脂糖凝胶颗粒,用1mm盐酸20ml,分三次抽滤清洗;将抗人纤维蛋白原多克隆抗体溶液与处理后的nhs活化琼脂糖凝胶颗粒混合,4℃,震荡反应4小时;清洗反应后的nhs活化琼脂糖凝胶颗粒,然后加入10mm乙醇胺,0.2m碳酸钠溶液,ph8.0,室温震荡4小时封闭未偶联的基团,洗干净,用制备后的nhs活化琼脂糖凝胶颗粒制作过滤芯,装入市售微型过滤器内,封闭,备用。
实施例2:本发明与现行化学发光检测技术的检测性能的比较
实验材料:抗人纤维蛋白原多克隆抗体过滤器、辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体、磁微粒、鲁米诺、对碘苯酚、过氧化脲、化学发光检测仪、人纤维蛋白原溶液。
实验方法:取已知浓度的人纤维蛋白原溶液,用pbs溶液稀释配置1ug/ml人纤维蛋白原溶液。实验方法将采用本发明与现行化学发光检测技术观测不同结合反应时间对发光量的影响。观察结合反应时间点1、2、4、10、20、30、45、60分钟。
现行化学发光检测技术组,每管加入抗人纤维蛋白原多克隆抗体标记的磁微粒100ul,再分别加入人纤维蛋白原溶液各100ul,,结合反应在37℃震摇温育,用磁块吸附分离磁微粒,弃上清,加入200ul的pbs清洗三次,,用磁块吸附分离磁微粒,弃上清,加入辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体200ul,结合反应在37℃震摇以对应的反应时间进行温育,用磁块吸附分离磁微粒,弃上清,加入200ul的pbs清洗三次,用磁块吸附分离磁微粒,弃上清,转移磁微粒至发光杯,置化学发光检测仪,加入100ul鲁米诺、对碘苯酚和过氧化脲等配置的发光底物工作液,反应进行2分钟时,记录发光量6秒钟。
本发明组,取实施例1制作的抗人纤维蛋白原多克隆抗体过滤器,用碱性pbs稀释100ul人纤维蛋白原溶液至1ml,过滤,用碱性pbs缓冲液1ml过滤洗三次,再用碱性pbs稀释100ul辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体至1ml,过滤,用碱性pbs缓冲液1ml过滤洗三次,再用ph4.5的tris-盐酸缓冲液1ml过滤,收集滤出液,取100ul至发光杯,置化学发光检测仪,加入100ul鲁米诺、对碘苯酚和过氧化脲等配置的发光底物工作液,反应进行2分钟时,记录发光量6秒钟,乘以10作为与上述现行化学发光检测技术组可比较的总计数结果。
实验结果:现行化学发光检测技术在1、2、4、10、20、30、45、60分钟时的发光量(mv)分别为3222、5672、7968、9810、14281、20339、19827、20513,结合反应30分钟基本达到平衡,结合反应为30分钟时的全过程操作时间为89分钟。本发明的检测结果为21320,全过程操作时间仅为13分钟。
实施例3:本发明与现行化学发光检测技术检测结果的比较
实验材料:抗人纤维蛋白原多克隆抗体过滤器、辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体、磁微粒、鲁米诺、对碘苯酚、过氧化脲、化学发光检测仪、人纤维蛋白原溶液、健康人血浆。
实验方法:取已知浓度的人纤维蛋白原标准溶液,用pbs溶液稀释配置10、30、70、100、300、700ng/ml人纤维蛋白原溶液;另取健康人血浆,用pbs进行10000倍稀释;实验方法采用本发明与现行化学发光检测技术检测人纤维蛋白原溶液并绘制标准曲线,然后测定健康人纤维蛋白原,并用标准曲线计算纤维蛋白原浓度;取42个试管,分为本发明组和现行化学发光检测技术组;每个样品做3个平行管。
现行化学发光检测技术组,每管加入抗人纤维蛋白原多克隆抗体标记的磁微粒100ul,再分别加入人纤维蛋白原溶液或健康人血浆各100ul,,结合反应在37℃震摇温育30分钟,用磁块吸附分离磁微粒,弃上清,加入200ul的pbs清洗三次,用磁块吸附分离磁微粒,弃上清;加入辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体200ul,结合反应在37℃震摇温育30分钟,用磁块吸附分离磁微粒,弃上清,加入200ul的pbs清洗三次,用磁块吸附分离磁微粒,弃上清;转移磁微粒至发光杯,置化学发光检测仪,加入100ul鲁米诺、对碘苯酚和过氧化脲等配置的发光底物工作液,反应进行2分钟时,记录发光量6秒钟;绘制标准曲线,计算血浆纤维蛋白原含量。
本发明组,取实施例1制作的抗人纤维蛋白原多克隆抗体过滤器,用碱性pbs稀释100ul人纤维蛋白原溶液或健康人血浆各至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用碱性pbs稀释100ul辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用ph4.5的tris-盐酸缓冲液1ml过滤;收集滤出液,取100ul至发光杯,置化学发光检测仪,加入100ul鲁米诺、对碘苯酚和过氧化脲等配置的发光底物工作液,反应进行2分钟时,记录发光量6秒钟;绘制标准曲线,计算血浆纤维蛋白原含量。
实验结果:现行化学发光检测技术测定结果2.51g/l,本发明测定结果2.58g/l,两种实验方法所得结果基本一致,但本发明的完成实验时间明显短于现行技术,对比实验结果显示,现行化学发光检测技术的全过程操作时间为89分钟,本发明的全过程操作时间仅为13分钟。
实施例4:本发明过滤芯体积对检测结果的影响
实验材料:市售微型过滤器、nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人纤维蛋白原多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人纤维蛋白原。
实验方法:采用实施例1方法制备体积为1、2、3、5、10、50、100、300、500、700、1000立方毫米的抗人纤维蛋白原多克隆抗体过滤器;用pbs溶液稀释配置1ug/ml人纤维蛋白原溶液;用碱性pbs稀释100ul人纤维蛋白原溶液至1ml,过滤,用碱性pbs缓冲液1ml过滤洗三次,再用碱性pbs稀释100ul辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用ph4.5的tris-盐酸缓冲液1ml过滤;收集滤出液,取100ul至发光杯,置化学发光检测仪,加入100ul鲁米诺、对碘苯酚和过氧化脲等配置的发光底物工作液,反应进行2分钟时,记录发光量6秒钟。
实验结果:所记录的体积为1、2、3、5、10、50、100、300、500、700、1000立方毫米过滤器的发光量(mv)分别为843、1597、1871、1925、1967、1983、2042、1956、1995、2035、2068,体积为3立方毫米时基本达到平衡。由此可见,本发明采用3立方毫米的过滤器就可以实现免疫检测,因此整个检测装置体积小,便于携带。
实施例5:本发明与现行酶联免疫检测技术检测结果的比较
实验材料:抗人纤维蛋白原多克隆抗体(genagatesinc.)、抗人纤维蛋白原多克隆抗体过滤器、辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体、邻苯二胺、酶联免疫检测仪、人纤维蛋白原溶液、健康人血浆。
实验方法:取已知浓度的人纤维蛋白原标准溶液,用pbs溶液稀释配置30、70、100、300、700、1000ng/ml人纤维蛋白原溶液;另取健康人血浆,用pbs进行10000倍稀释;实验将采用本发明与现行酶联免疫检测技术检测人纤维蛋白原溶液并绘制标准曲线,然后测定健康人纤维蛋白原,并用标准曲线计算纤维蛋白原浓度;取42个试管,分为本发明组和现行酶联免疫检测技术组;每个样品做3个平行管。
现行酶联免疫检测技术组,采用96孔酶联板,每管加入抗人纤维蛋白原多克隆抗体100ul,4℃过夜包被,清洗三次,再分别加入人纤维蛋白原溶液或健康人血浆各100u,结合反应在37℃温育120分钟,清洗三次,加入辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体100ul,结合反应在37℃温育60分钟,清洗三次,弃上清,加入100ul显色液(0.1m柠檬酸2.43ml,0.2m磷酸氢二钠2.57ml,邻苯二胺5mg,过氧化氢5ul),避光5分钟,加入2m硫酸终止反应;置酶联免疫检测仪上读取吸光值,绘制标准曲线,计算血浆纤维蛋白原含量。
本发明组,取实施例1制作的抗人纤维蛋白原多克隆抗体过滤器,用碱性pbs稀释100ul人纤维蛋白原溶液或健康人血浆各至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用碱性pbs稀释100ul辣根过氧化物酶标记抗人纤维蛋白原单克隆抗体至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用ph4.5的tris-盐酸缓冲液1ml过滤;收集滤出液,各取100ul至96孔酶联板,加入100ul显色液,避光5分钟,加入2m硫酸终止反应;置酶联免疫检测仪上读取吸光值,绘制标准曲线,计算血浆纤维蛋白原含量。
实验结果:现行技术测定结果2.56g/l,本发明技术测定结果2.50g/l,两种实验方法所得结果基本一致,但本发明的完成实验时间明显短于现行技术,对比实验结果显示,现行酶联免疫检测技术的全过程操作需要16小时,本发明的全过程操作时间仅为16分钟。
实施例6:本发明技术以胶体金为指示剂的检测技术检测结果的比较
实验材料:抗人纤维蛋白原多克隆抗体过滤器、胶体金标记抗人纤维蛋白原单克隆抗体、分光光度计、人纤维蛋白原溶液。
实验方法:取已知浓度的人纤维蛋白原标准溶液,用pbs溶液稀释配置100、300、700、1000、3000ng/ml人纤维蛋白原溶液;另取健康人血浆,用pbs进行5000倍稀释。实验将采用本发明技术检测100ng、300ng、700ng、1000ng、3000ng人纤维蛋白原溶液并绘制标准曲线,然后测定健康人纤维蛋白原,并用标准曲线计算纤维蛋白原浓度。取18个试管,每个样品做3个平行管。
取实施例1制作的抗人纤维蛋白原多克隆抗体过滤器,用碱性pbs稀释100ul人纤维蛋白原溶液或健康人血浆各至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用碱性pbs稀释100ul胶体金标记抗人纤维蛋白原单克隆抗体至1ml,过滤;用碱性pbs缓冲液1ml过滤洗三次,再用ph4.5的tris-盐酸缓冲液1ml过滤;收集滤出液,混匀,取800ul置分光光度计读取520nm波长的吸光值,绘制标准曲线,计算血浆纤维蛋白原含量。
实验结果:本发明技术测定结果2.81g/l,与其它方法检测的结果基本一致,但本发明的完成实验时间明显短于现行技术,现行胶体金检测技术的全过程操作需要12小时,本发明的全过程操作时间仅为13分钟。
实施例7:本发明采用hrp化学发光技术测定肌红蛋白水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌红蛋白单克隆抗体(genagatesinc.)、抗人肌红蛋白多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌红蛋白(genagatesinc.)、hrp-羊抗小鼠igg(平睿生物)、pico发光试剂(thermoscientific)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌红蛋白多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置500ng/ml人肌红蛋白溶液。用碱性pbs稀释100ul人肌红蛋白溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌红蛋白单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释辣根过氧化物酶标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入pico发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表1显示了肌红蛋白水平的实验结果,实验中人肌红蛋白抗原浓度500ng/ml,3次平行实验最大检测倍数均在40倍左右,以上结果表明本发明检测样品肌红蛋白水平具体良好的重复性。
表1肌红蛋白水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例8:本发明采用hrp化学发光技术测定肌钙蛋白i水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌钙蛋白i单克隆抗体(genagatesinc.)、抗人肌钙蛋白i多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌钙蛋白i(genagatesinc.)、hrp-羊抗小鼠igg(平睿生物)、pico发光试剂(thermoscientific)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌钙蛋白i多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置100ng/ml人肌钙蛋白i溶液。用碱性pbs稀释100ul人肌钙蛋白i溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌钙蛋白i单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释辣根过氧化物酶标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入pico发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表2显示了肌钙蛋白i水平的实验结果,实验中人肌钙蛋白i抗原浓度100ng/ml,3次平行实验最大检测倍数均在35倍左右,以上结果表明本发明检测样品肌钙蛋白i水平具体良好的重复性。
表2肌钙蛋白i水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例9:本发明采用hrp化学发光技术测定ck-mb水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人ck-mb单克隆抗体(genagatesinc.)、抗人ck-mb多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人ck-mb(genagatesinc.)、hrp-羊抗小鼠igg(平睿生物)、pico发光试剂(thermoscientific)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人ck-mb多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置200ng/ml人ck-mb溶液。用碱性pbs稀释100ul人ck-mb溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人ck-mb单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释辣根过氧化物酶标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入pico发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表3显示了ck-mb水平的实验结果,实验中人ck-mb抗原浓度200ng/ml,3次平行实验最大检测倍数均在25倍左右,以上结果表明本发明检测样品ck-mb水平具体良好的重复性。
表3ck-mb水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例10:本发明采用ap化学发光技术测定肌红蛋白水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌红蛋白单克隆抗体(genagatesinc.)、抗人肌红蛋白多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌红蛋白(genagatesinc.)、ap-羊抗小鼠igg(平睿生物)、apls发光试剂(郑州英诺生物)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌红蛋白多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置500ng/ml人肌红蛋白溶液。用碱性pbs稀释100ul人肌红蛋白溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌红蛋白单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释ap标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表4显示了肌红蛋白水平的实验结果,实验中人肌红蛋白抗原浓度500ng/ml,3次平行实验最大检测倍数均在5倍左右,以上结果表明本发明检测样品肌红蛋白水平具体良好的重复性,但最大检测倍数偏低,影响检测准确性。
表4肌红蛋白水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例11:本发明采用ap化学发光技术测定肌钙蛋白i水平的实验研究实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌钙蛋白i单克隆抗体(genagatesinc.)、抗人肌钙蛋白i多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌钙蛋白i(genagatesinc.)、ap-羊抗小鼠igg(平睿生物)、apls发光试剂(郑州英诺生物)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌钙蛋白i多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置100ng/ml人肌钙蛋白i溶液。用碱性pbs稀释100ul人肌钙蛋白i溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌钙蛋白i单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释ap标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表5显示了肌钙蛋白i水平的实验结果,实验中人肌钙蛋白i抗原浓度100ng/ml,3次平行实验最大检测倍数均在4倍左右,以上结果表明本发明检测样品肌钙蛋白i水平具体良好的重复性,但最大检测倍数偏低,影响检测准确性。
表5肌钙蛋白i水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例12:本发明采用生物素-亲和素放大技术测定肌红蛋白水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌红蛋白单克隆抗体(genagatesinc.)、抗人肌红蛋白多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌红蛋白(genagatesinc.)、亲和素-ap(华蓝生物)、生物素标记羊抗鼠多克隆抗体(北京博奥森)、apls发光试剂(郑州英诺生物)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌红蛋白多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置500ng/ml人肌红蛋白溶液。用碱性pbs稀释100ul人肌红蛋白溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌红蛋白单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释生物素标记羊抗鼠多克隆抗体,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释ap标记亲和素至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表6显示了采用亲和素-生物素放大技术测定肌红蛋白水平的实验结果,实验中人肌红蛋白抗原浓度500ng/ml,3次平行实验最大检测倍数均在5倍左右,以上结果表明本发明检测样品肌红蛋白水平具体良好的重复性,但最大检测倍数偏低,影响检测准确性。
表6采用亲和素-生物素放大技术测定肌红蛋白水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例13:本发明采用生物素-亲和素放大技术测定肌钙蛋白i水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌钙蛋白i单克隆抗体(genagatesinc.)、抗人肌钙蛋白i多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌钙蛋白i(genagatesinc.)、亲和素-ap(华蓝生物)、生物素标记羊抗鼠多克隆抗体(北京博奥森)、apls发光试剂(郑州英诺生物)。
实验方法:采用实施例1方法制备体积为50立方毫米的抗人肌钙蛋白i多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置100ng/ml人肌钙蛋白i溶液。用碱性pbs稀释100ul人肌钙蛋白i溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌钙蛋白i单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释生物素标记羊抗鼠多克隆抗体,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释ap标记亲和素至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表7显示了采用亲和素-生物素放大技术测定肌钙蛋白i水平的实验结果,实验中人肌钙蛋白i抗原浓度100ng/ml,3次平行实验最大检测倍数均在6倍左右,以上结果表明本发明检测样品肌钙蛋白i水平具体良好的重复性,但最大检测倍数偏低,影响检测准确性。
表7采用亲和素-生物素放大技术测定肌钙蛋白i水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例14:本发明采用亲和素-生物素放大技术测定肌红蛋白水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌红蛋白单克隆抗体(genagatesinc.)、抗人肌红蛋白多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌红蛋白(genagatesinc.)、亲和素(sigma)、edc(thermoscientific)、nhs(thermoscientific)、mes(上海生工)、羊抗鼠多克隆抗体(genagatesinc.)、生物素标记ap(上海宝曼生物)、apls发光试剂(郑州英诺生物)。
实验方法:
1、亲和素标记羊抗鼠多克隆抗体:取10mg/ml的亲和素100ul,加入羊抗鼠igg50ug,补加mes溶液至150ul,冰浴10min。取0.1mg/ml的edc溶液12ul,加入mes至600ul,混匀后缓慢加入至上述离心管。取0.1mg/ml的nhs溶液18ul,加入mes至900ul,混匀后缓慢加入至上述离心管。冰浴10min后,在震荡器上震荡3小时。取下离心管,加入600ul1mtris使之终浓度为20mm。在震荡器上震荡1小时。pbs缓冲液4℃过夜透析,-20℃冻存,备用。
2、检测实验:采用实施例1方法制备体积为50立方毫米的抗人肌红蛋白多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置500ng/ml人肌红蛋白溶液。用碱性pbs稀释100ul人肌红蛋白溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌红蛋白单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释100ul亲和素标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释生物素标记ap至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表8显示了采用亲和素-生物素放大技术测定肌红蛋白水平的实验结果,实验中人肌红蛋白抗原浓度500ng/ml,3次平行实验最大检测倍数均在50倍左右,以上结果表明本发明检测样品肌红蛋白水平具体良好的重复性,可满足准确性检测要求。
表8采用亲和素-生物素放大技术测定肌红蛋白水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例15:本发明采用亲和素-生物素放大技术测定肌钙蛋白i水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人肌钙蛋白i单克隆抗体(genagatesinc.)、抗人肌钙蛋白i多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人肌钙蛋白i(genagatesinc.)、亲和素(sigma)、edc(thermoscientific)、nhs(thermoscientific)、mes(上海生工)、羊抗鼠多克隆抗体(genagatesinc.)、生物素标记ap(上海宝曼生物)、apls发光试剂(郑州英诺生物)。
实验方法:
1、亲和素标记羊抗鼠多克隆抗体:取10mg/ml的亲和素100ul,加入羊抗鼠igg50ug,补加mes溶液至150ul,冰浴10min。取0.1mg/ml的edc溶液12ul,加入mes至600ul,混匀后缓慢加入至上述离心管。取0.1mg/ml的nhs溶液18ul,加入mes至900ul,混匀后缓慢加入至上述离心管。冰浴10min后,在震荡器上震荡3小时。取下离心管,加入600ul1mtris使之终浓度为20mm。在震荡器上震荡1小时。pbs缓冲液4℃过夜透析,-20℃冻存,备用。
2、检测实验:采用实施例1方法制备体积为50立方毫米的抗人肌钙蛋白i多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置100ng/ml人肌钙蛋白i溶液。用碱性pbs稀释100ul人肌钙蛋白i溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人肌钙蛋白i单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释100ul亲和素标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释生物素标记ap至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表9显示了采用亲和素-生物素放大技术测定肌钙蛋白i水平的实验结果,实验中人肌钙蛋白i抗原浓度100ng/ml,3次平行实验最大检测倍数均在40倍左右,以上结果表明本发明检测样品肌钙蛋白i水平具体良好的重复性,可满足准确性检测要求。
表9采用亲和素-生物素放大技术测定肌钙蛋白i水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
实施例16:本发明采用亲和素-生物素放大技术测定n-端脑利钠肽前体水平的实验研究
实验材料:nhs活化琼脂糖凝胶颗粒(acrobiosystems)、抗人n-端脑利钠肽前体单克隆抗体(genagatesinc.)、抗人n-端脑利钠肽前体多克隆抗体(genagatesinc.)、碳酸氢钠、盐酸、乙醇胺、人n-端脑利钠肽前体(genagatesinc.)、亲和素(sigma)、edc(thermoscientific)、nhs(thermoscientific)、mes(上海生工)、羊抗鼠多克隆抗体(genagatesinc.)、生物素标记ap(上海宝曼生物)、apls发光试剂(郑州英诺生物)。
实验方法:
1、亲和素标记羊抗鼠多克隆抗体:取10mg/ml的亲和素100ul,加入羊抗鼠igg50ug,补加mes溶液至150ul,冰浴10min。取0.1mg/ml的edc溶液12ul,加入mes至600ul,混匀后缓慢加入至上述离心管。取0.1mg/ml的nhs溶液18ul,加入mes至900ul,混匀后缓慢加入至上述离心管。冰浴10min后,在震荡器上震荡3小时。取下离心管,加入600ul1mtris使之终浓度为20mm。在震荡器上震荡1小时。pbs缓冲液4℃过夜透析,-20℃冻存,备用。
2、检测实验:采用实施例1方法制备体积为50立方毫米的抗人n-端脑利钠肽前体多克隆抗体微型柱状过滤器,选用3组进行重复测定。用pbs溶液稀释配置10ng/ml人n-端脑利钠肽前体溶液。用碱性pbs稀释100ul人n-端脑利钠肽前体溶液至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,再用碱性pbs稀释100ul抗人n-端脑利钠肽前体单克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释100ul亲和素标记羊抗鼠多克隆抗体至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,用碱性pbs稀释生物素标记ap至300ul,过滤,用碱性pbs缓冲液1ml过滤清洗,收集滤芯,加入apls发光试剂200ul,用化学发光仪检测发光值,并记录。
实验结果:表10显示了采用亲和素-生物素放大技术测定n-端脑利钠肽前体水平的实验结果,实验中人n-端脑利钠肽前体抗原浓度10ng/ml,3次平行实验最大检测倍数均在25倍左右,以上结果表明本发明检测样品n-端脑利钠肽前体水平具体良好的重复性,可满足准确性检测要求。
表10采用亲和素-生物素放大技术测定n-端脑利钠肽前体水平的实验结果
备注:阳性和阴性的检测指标是发光值,发光值是发光光值的计数。
通过具体实施方式的说明,应当可对本发明为达成预定目的所采取的技术手段及功效得以更加深入且具体的了解,然而所附图示仅是提供参考与说明之用,并非用来对本发明加以限制。
- 还没有人留言评论。精彩留言会获得点赞!