非小细胞肺癌对培美曲塞耐药性的研究方法与流程
本发明涉及非小细胞肺癌
技术领域:
,尤其涉及非小细胞肺癌对培美曲塞耐药性的研究方法。
背景技术:
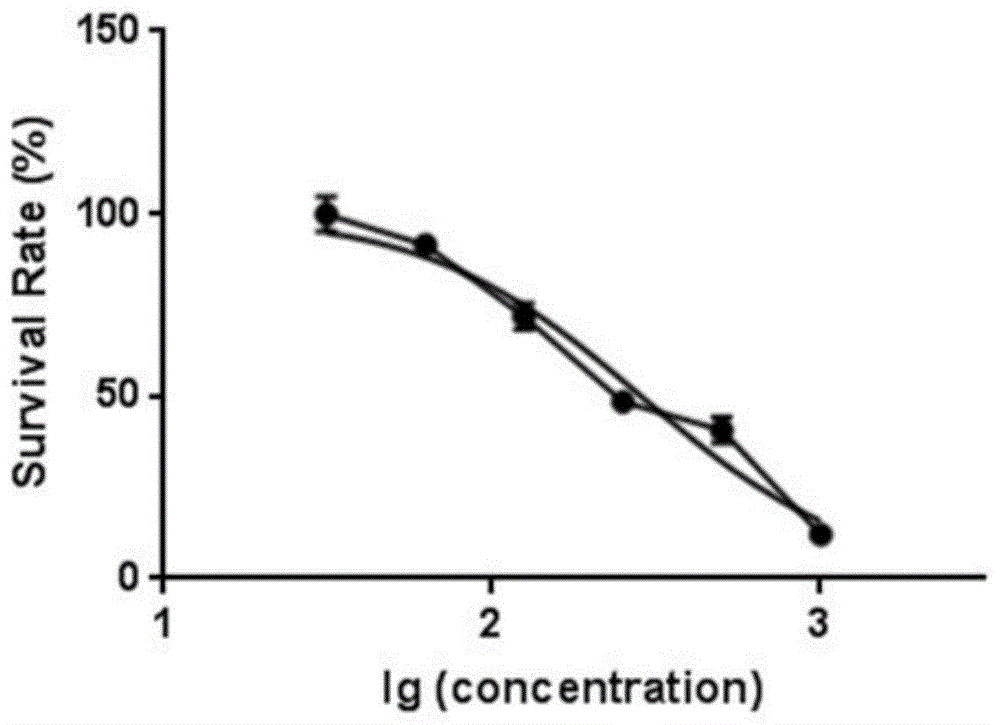
:肺癌是一种常见的恶性肿瘤,也是导致癌症相关死亡的主要原因。非小细胞肺癌(nsclc)占所有新诊断肺癌的约85%,包括腺癌,鳞状细胞癌,大细胞癌。nsclc患者在早期多不表现典型的临床症状,大多患者在确诊时已发展为中晚期肺癌,这也极大程度的增加了患者的临床治疗难度。近年来,随着研究的不断深入,nsclc早期诊断及治疗技术也有所改善,但患者的5年生存率仍不容乐观,癌症复发和高转移率也是导致nsclc治疗失败的主要原因。化疗是针对nsclc的常用的一线或二线治疗方法,其中培美曲塞(mta)药物化疗是近年来应用较为广泛的化疗药物,主要通过破坏细胞内叶酸依赖性的正常代谢过程,抑制细胞复制,从而抑制肿瘤的生长。尽管该治疗方法在一定程度上改善了患者的治疗效果,但随着治疗时间的推移,越来越多的患者对其产生耐药性,从而导致治疗失败。因此,了解nsclc潜在的耐药机制并研究新的分子治疗技术以提高nsclc癌对mta化疗药物的敏感性是当前研究的重点。技术实现要素:针对上述存在的问题,本发明旨在提供一种通过研究非小细胞肺癌培美曲塞a549/pem耐药细胞株中的差异表达蛋白来研究非小细胞肺癌对培美曲塞耐药性的方法。为了实现上述目的,本发明所采用的技术方案如下:非小细胞肺癌对培美曲塞耐药性的研究方法,其特征在于:通过对非小细胞肺癌培美曲塞a549/pem耐药细胞株中的差异表达蛋白的研究来实现非小细胞肺癌对培美曲塞耐药性的研究。进一步的,非小细胞肺癌培美曲塞a549/pem耐药细胞株中的差异表达蛋白的研究具体包括以下步骤,s1:非小细胞肺癌培美曲塞a549/pem耐药细胞株的构建及鉴定;s2:利用itraq技术分析a549/pem耐药细胞株中的差异表达蛋白;s3:从步骤s2分析得到的差异表达蛋白中筛选出若干个兴趣蛋白进行prm验证;s4:对步骤s3中经过验证的兴趣蛋白进行分析,进一步的筛选出两个目标差异蛋白进行药物敏感性研究。进一步的,步骤s1的具体操作包括,s11、细胞培养:将非小细胞肺癌的亲本细胞株a549培养在含10%胎牛血清,100u/ml青霉素和100μg/ml链霉素的rpmi-1640培养基中,置于37℃,5%co2的恒温培养箱中孵育;s12、nsclc亲本细胞株a549的ic50值测定:s13:采用高浓度反复间歇诱导法,构建pem耐药nsclc细胞株a549/pem;s14:a549/pem耐药细胞株耐药指数的测定。进一步的,步骤s12的具体操作包括,s121:取生长状态良好的a549对数生长期细胞,每孔按4×103个接种至96孔板中,每组设置3个复孔,置于37℃,5%co2的细胞培养箱中培养;s122:待细胞贴壁后,在nsclc亲本细胞株a549中分别加入1000ng/ml、500ng/ml、250ng/ml、125ng/ml、62.5ng/ml、31.25ng/ml的pem;s123:继续培养48h后,弃培养基,每孔加入新鲜配制的含10μl的毒性检测液cck8;将培养板在培养箱孵育1-4小时;s124:用酶标仪测波长为450nm的吸光度,计算亲本株的半数抑制浓度ic50。进一步的,步骤s13的具体操作包括,s131:选取终浓度为1/3亲本株半数抑制浓度ic50的培美曲塞,冲击对数生长期a549亲本株;s132:药物作用24小时后,弃去含药培养液,换不含药的新鲜培养液;s133:待细胞长至70%-80%时,重复原剂量冲击,如此反复冲击8代,最终成活的细胞株即为a549/pem耐药细胞株。进一步的,步骤s14具体操作包括,s141:取生长状态良好的a549/pem耐药细胞株,每孔按4×103个接种至96孔板中,每组设置3个复孔,置于37℃,5%co2的细胞培养箱中培养;s142:待细胞贴壁后,分别用浓度为4000ng/ml、2000ng/ml、1000ng/ml、500ng/ml、250ng/ml、125ng/ml的pem对a549/pem耐药细胞株进行处理;s143:继续培养48h后,弃培养基,每孔加入新鲜配制的含10μl的毒性检测液cck8;将培养板在培养箱孵育1-4小时;s144:用酶标仪测波长为450nm的吸光度,计算a549/pem耐药细胞株的半数抑制浓度ic50;s145:利用公式ri=a549/pem耐药细胞株的半数抑制浓度ic50/亲本株的半数抑制浓度ic50计算a549/pem的耐药指数。进一步的,步骤s2的具体操作包括,s21:提取亲本细胞株a549和a549/pem耐药细胞株样品中的总蛋白;s22:将来自每个样品的等量的蛋白质用胰蛋白酶进行消化,对酶解后的肽段进行脱盐;s23:对亲本细胞株a549和a549/pem耐药细胞株样品中不同的蛋白进行标记和分组;s24:液相色谱-质谱联用分析亲本细胞株a549和a549/pem细胞样品中的蛋白;s25:对步骤s24中液相色谱-质谱分析所得的数据经过系列优化处理,然后与数据库进行相似性比较打分从而进行蛋白鉴定。进一步的,步骤s3的具体操作包括,s31:从步骤s2鉴定出来的差异蛋白中筛选出16个兴趣蛋白;s32:提取亲本细胞株a549和a549/pem耐药细胞株样品中的总蛋白;s33:将来自每个样品的等量的蛋白质用胰蛋白酶进行消化,对酶解后的肽段进行脱盐;s34:液相色谱-质谱联用分析亲本细胞株a549和a549/pem细胞样品中的兴趣蛋白;s35:利用lc-ms/ms检测得到兴趣蛋白的定量信息;s36:对步骤s34中得到的兴趣蛋白的定量信息进行分析。进一步的,提取亲本细胞株a549和a549/pem耐药细胞株样品中的总蛋白的具体操作包括,s231:向亲本细胞株a549和a549/pem耐药细胞株样品中加入蛋白裂解液,混匀后冰上孵育5min,加入终浓度为l0mm的dtt,冰浴超声15min;s232:取步骤s231中的混合物,在13000g,4℃条件下离心20min,取上清液转入新的离心管中;s233:向离心管中加入4倍体积的冷丙酮,在-20℃静置过夜;s234:离心收集蛋白沉淀,空气中晾干,加入8murea/100mmteab溶液重新溶解蛋白,加入dtt至终浓度10mm,56℃水浴30min进行还原反应;s235:加入iam至终浓度55mm,暗处室温放置30min进行烷基化反应,bradford法测定蛋白浓度。进一步的,将蛋白质用胰蛋白酶进行消化,对酶解后的肽段进行脱盐的具体操作包括,s236:取100μg的蛋白质,用100mmteab将蛋白溶液稀释5倍;s237:按胰酶:蛋白质为1:50的量加入胰蛋白酶,37℃酶解过夜;s238:酶解后的肽段用c18柱脱盐,真空冷冻干燥脱盐后的肽段。本发明的有益效果是:1、本发明通过构建非小细胞肺癌培美曲塞a549/pem耐药细胞株,采用itraq和prm分析技术分析敏感型a549细胞及a549/pem耐药细胞中差异表达的蛋白,这些差异蛋白可能影响非小细胞肺癌对培美曲塞的耐药性;并从中筛选出与耐药性相关的兴趣蛋白进行prm蛋白组学技术加以验证。通过差异表达蛋白的研究,为后续影响a549/pem细胞耐药性的基因筛选提供基础,为pem耐药nsclc患者的临床治疗提供理论依据;通过本发明中非小细胞肺癌培美曲塞耐药性的研究,有望探索非小细胞肺癌可行的基因治疗方法,促进社会科技的发展。2、本发明中从itraq和prm分析结果的差异表达蛋白中筛选了igf2bp2和folr1两个蛋白开展相关功能研究,结果显示,干扰igf2bp2和folr1后可增强a549/pem耐药细胞对pem的敏感性,因此,本发明有望为非小细胞肺癌培美曲塞耐药患者的临床治疗提供可靠的生物靶点,即igf2bp2和folr1。附图说明图1为本发明中在nsclc亲本细胞株a549中加入不同浓度的pem后,a549的存活情况;图2为本发明中不同浓度pem处理a549/pem耐药细胞株后,a549/pem耐药细胞株的存活情况;图3为本发明中a549/pem耐药细胞株蛋白质组itraq分析时bradford法测定不同a549/pem耐药细胞株样品中总蛋白的sds-page电泳图;图4为本发明中a549/pem耐药细胞株prm蛋白定量分析时bradford法测定不同a549/pem耐药细胞株样品中总蛋白的sds-page电泳图;图5为本发明中利用优化后的prm质谱采集方法对每个样品进行数据采集后得到的prm谱图;图6为本发明中比较组a549/pem耐药细胞株和a549的prm定量与itraq定量的差异结果比较柱状图;图7为本发明中qrt-pcr检测si-nc、si-igf2bp2#1,si-igf2bp2#2,si-igf2bp2#3转染组细胞中igf2bp2mrna表达,以及si-nc、si-folr1#1,si-folr1#2,si-folr1#3转染组细胞中folr1mrna表达结果;图8为本发明中将si-nc、si-igf2bp2及si-folr1细胞中加入不同浓度的培美曲塞后,细胞的ic50值。具体实施方式为了使本领域的普通技术人员能更好的理解本发明的技术方案,下面结合附图和实施例对本发明的技术方案做进一步的描述。非小细胞肺癌对培美曲塞耐药性的研究方法,通过对非小细胞肺癌培美曲塞a549/pem耐药细胞株中的差异表达蛋白的研究来实现非小细胞肺癌对培美曲塞耐药性的研究。具体的,非小细胞肺癌培美曲塞a549/pem耐药细胞株中的差异表达蛋白的研究具体包括以下步骤,s1:非小细胞肺癌培美曲塞a549/pem耐药细胞株的构建及鉴定;具体的,细胞培养:将非小细胞肺癌的亲本细胞株a549培养在含10%胎牛血清,100u/ml青霉素和100μg/ml链霉素的rpmi-1640培养基中,置于37℃,5%co2的恒温培养箱中孵育;s12、nsclc亲本细胞株a549的ic50值测定:取生长状态良好的a549对数生长期细胞,每孔按4×103个接种至96孔板中,每组设置3个复孔,置于37℃,5%co2的细胞培养箱中培养;待细胞贴壁后,在nsclc亲本细胞株a549中分别加入1000ng/ml、500ng/ml、250ng/ml、125ng/ml、62.5ng/ml、31.25ng/ml的pem;继续培养48h后,弃培养基,每孔加入新鲜配制的含10μl的毒性检测液cck8;将培养板在培养箱孵育1-4小时;用酶标仪测波长为450nm的吸光度,计算亲本株的半数抑制浓度ic50。在nsclc亲本细胞株a549中加入不同浓度的pem后,a549的存活情况如图1所示,根据附图1的数据可以得出,在nsclc亲本细胞株a549中加入不同浓度的pem后,a549生存率为50%对应的药物浓度情况如表1所示,从表1中可以看出,a549生存率为50%对应的药物浓度为285ng/ml,也即亲本株的半数抑制浓度ic50值为285ng/ml。表1亲本株的半数抑制浓度ic50值log(inhibitor)vs.normalizedresponse-variableslopebest-fitvalueslogic502.455hillsiope-1.327ic50285s13:采用高浓度反复间歇诱导法,构建pem耐药nsclc细胞株a549/pem;具体的,选取终浓度为1/3亲本株半数抑制浓度ic50(1/3*285=95ng/ml)的培美曲塞,冲击对数生长期a549亲本株;药物作用24小时后,弃去含药培养液,换不含药的新鲜培养液;待细胞长至70%-80%时,重复原剂量冲击,如此反复冲击8代,最终成活的细胞株即为a549/pem耐药细胞株。s14:a549/pem耐药指数的测定。具体的,取生长状态良好的a549/pem耐药细胞株,每孔按4×103个接种至96孔板中,每组设置3个复孔,置于37℃,5%co2的细胞培养箱中培养;待细胞贴壁后,分别用浓度为4000ng/ml、2000ng/ml、1000ng/ml、500ng/ml、250ng/ml、125ng/ml的pem对a549/pem耐药细胞株进行处理;继续培养48h后,弃培养基,每孔加入新鲜配制的含10μl的毒性检测液cck8;将培养板在培养箱孵育1-4小时;用酶标仪测波长为450nm的吸光度,计算a549/pem耐药细胞株的半数抑制浓度ic50;利用公式ri=a549/pem耐药细胞株的半数抑制浓度ic50/亲本株的半数抑制浓度ic50计算a549/pem的耐药指数。具体的,使用不同浓度pem对a549/pem耐药细胞株进行处理后,a549/pem耐药细胞株的存活情况如附图2所示,从图2中可以得出在不同浓度pem处理a549/pem耐药细胞株后,a549/pem耐药细胞株生存率为50%对应的药物浓度情况如表2所示,从表2中可以看出,a549/pem耐药细胞株生存率为50%对应的药物浓度为5182ng/ml,也即a549/pem耐药细胞株的半数抑制浓度ic50值为5182ng/ml。表2a549/pem耐药细胞株的半数抑制浓度ic50值结合表1和表2可以得出,a549/pem耐药细胞株在药物浓度为5182ng/ml时才能将细胞生长抑制一半,但a549细胞在药物浓度为285ng/ml即可将细胞生长抑制一半,两株细胞ic50值放在一起比较,说a549/pem耐药细胞株构建成功。利用公式ri=a549/pem耐药细胞株的半数抑制浓度ic50/亲本株的半数抑制浓度ic50计算a549/pem耐药细胞株的耐药指=5182/285=18.2。进一步的,步骤s2:利用itraq技术分析a549/pem耐药细胞株中的差异表达蛋白;具体的,s21:取亲本细胞株a549和步骤s1中构建成功的a549/pem耐药细胞株,提取亲本细胞株a549和a549/pem耐药细胞株样品中的总蛋白;具体的,采用2组6个样品,干冰运输,-80℃冰箱保存。样品的详细标识如下表3所示。表3样本名称对应表向每个细胞样品中加入蛋白裂解液(7murea/2mthiourea/4%sds/40mmtris-hcl,ph8.5/1mmpmsf/2mmedta),混匀后冰上孵育5min,加入终浓度为l0mm的dtt,冰浴超声15min;取上述混合物,在13000g,4℃条件下离心20min,取上清液转入新的离心管中;向离心管中加入4倍体积的冷丙酮,在-20℃静置过夜;离心收集蛋白沉淀,空气中晾干;加入8murea/100mmteab溶液重新溶解蛋白,加入dtt至终浓度10mm,56℃水浴30min进行还原反应;加入iam至终浓度55mm,暗处室温放置30min进行烷基化反应,bradford法测定蛋白浓度,结果如表4所示,不同样品的蛋白sds-page电泳图如附图3所示。表4bradford法测定不同蛋白样品的结果s22:将来自每个样品的等量的蛋白质用于胰蛋白酶消化;取100μg的蛋白质用于胰蛋白酶消化,用100mmteab将蛋白溶液稀释5倍后,按胰酶:蛋白为1:50的质量比例加入胰蛋白酶,37℃酶解过夜。酶解后的肽段用c18柱脱盐,真空冷冻干燥脱盐后的肽段。s23:利用itraq对不同的蛋白进行标记和分组;用0.5mteab溶解多肽,根据itraq-8标试剂盒(sciex)说明书进行标记,样本标记后混合,然后将混合后的肽段运用ultimate3000hplc系统(thermodinoex,usa)对肽段样品进行分级分离。色谱柱使用的是durashellc18柱(5μm,4.6×250mm)。利用碱性条件下逐渐升高的acn浓度实现肽段的分离,流速为1ml/min,每分钟收集一管。共收集42个次级馏分并合并成12个组分,合并后的组分在strata-x柱上脱盐并真空干燥。s24:液相色谱-质谱联用分析a549/pem细胞样品中的蛋白;质谱数据采集使用的是tripletof5600+液质联用系统(sciex)。将多肽样品溶解于2%乙腈/0.1%甲酸中,并使用与eksigentnanolc系统(sciex,usa)偶联的tripletof5600plus质谱仪进行分析。将多肽溶液加到c18捕获柱(5μm,100μm×20mm)上,并以90min时间梯度,300nl/min的流速在c18分析柱(3μm,75μm×150mm)上进行梯度洗脱。两个流动相是缓冲液a(2%乙腈/0.1%甲酸/98%h2o)和缓冲液b(98%乙腈/0.1%甲酸/2%h2o)。对于ida(信息依赖性采集),以250ms的离子累积时间进行一级质谱图的扫描,并以50ms的离子累积时间采集30个前体离子的二级质谱图。在350-1500m/z的范围内采集ms1光谱,并且在100-1500m/z的范围内采集ms2光谱;将前体离子动态排除时间设置为15s。s25:对步骤s24中液相色谱-质谱分析所得的数据经过系列优化处理,然后与数据库进行相似性比较打分从而进行蛋白鉴定。采用基于质谱方法的蛋白质组鉴定基本流程,即对ms/ms质谱数据经过系列优化处理后与数据库进行相似性比较打分从而进行蛋白鉴定,该方法具有鉴定准确度高,通量大,无需人工序列解析等优点。本发明中使用与absciex5600plus配套的搜索引擎——proteinpilottmv4.5。proteinpilot在搜索时由于考虑了全部可能的修饰种类,同时增加了自动容错匹配功能,在保证鉴定结果可信度的前提下,能够比同类软件检索到更多的结果。对于proteinpilot的鉴定结果,本发明做了进一步过滤,对于鉴定到的蛋白,认为unusedscore≥1.3(即可信度水平在95%以上),每个蛋白至少包含一个unique肽段的蛋白为可信蛋白,不符合该条件的蛋白不包括在本报告中;对于鉴定的肽段和蛋白质定量,我们以conf≥95过滤,即可信度在95%以上认为可信肽段用于蛋白质定量,不符合该条件的肽段不包含在本报告中。进一步的,步骤s3:从步骤s2分析得到的差异表达蛋白中筛选出若干个兴趣蛋白进行prm验证;具体的,s31:从步骤s2鉴定出来的差异蛋白中筛选出16个兴趣蛋白,分别为sp|p07203|gpx1_human,sp|p08183|mdr1_human,sp|p08195|4f2_human,sp|p12236|adt3_human,sp|p12956|xrcc6_human,sp|p15144|ampn_human,sp|p15328|folr1_human,sp|p31327|cpsm_human,sp|p32320|cdd_human,sp|p46459|nsf_human,sp|p49585|pcy1a_human,sp|q9bra2|txd17_human,sp|q9nph2|ino1_human,sp|q9nqc3|rtn4_human,sp|q9y3b8|orn_human,sp|q9y6m1|if2b2_human;s32:提取亲本细胞株a549和a549/pem耐药细胞株样品中的总蛋白;采用2组6个样品,干冰运输,-80℃冰箱保存。样品的详细标识如下表5所示。表5样本名称对应表每个样品取适量进行蛋白提取;向样品中加入蛋白裂解液(7murea/2mthiourea/4%sds/40mmtris-hcl,ph8.5/1mmpmsf/2mmedta),混匀后冰上孵育5min,加入终浓度为l0mm的dtt,冰浴超声15min,然后去上述混合液在13000g,4℃条件下离心20min,取上清液转入新的离心管中;向离心管中加入4倍体积的冷丙酮,在-20℃静置过夜。离心收集蛋白沉淀,空气中晾干。加入8murea/100mmteab(ph8.0)溶液重新溶解蛋白,加入dtt至终浓度10mm,56℃水浴30min进行还原反应。随后,加入iam至终浓度55mm,暗处室温放置30min进行烷基化反应。bradford法测定蛋白浓度,结果如表6所示,不同样品的蛋白sds-page电泳图如附图4所示。表6bradford法测定不同蛋白样品的结果s33:将来自每个样品的等量的蛋白质用胰蛋白酶进行消化,对酶解后的肽段进行脱盐;将来自每个样品的等量的蛋白质用于胰蛋白酶消化。取100μg的蛋白质用于胰蛋白酶消化。用100mmteab将蛋白溶液稀释5倍后,按胰酶:蛋白为1:50的质量比例加入胰蛋白酶,37℃酶解过夜。酶解后的肽段用c18柱脱盐,真空冷冻干燥脱盐后的肽段。s34:液相色谱-质谱联用分析亲本细胞株a549和a549/pem细胞样品中的兴趣蛋白;利用lc-ms/ms检测得到蛋白的定量信息;质谱数据采集使用的是tripletof5600+液质联用系统(sciex)。多肽样品溶解于2%乙腈/0.1%甲酸中,首先到c18捕获柱(5μm,100μm×20mm)上,以300nl/min的流速从c18分析柱(3μm,75μm×150mm)上进行梯度洗脱。两个流动相分别是水相buffera(2%乙腈/0.1%甲酸/98%h2o)和有机相bufferb(98%乙腈/0.1%甲酸/2%h2o)。ida(信息依赖性采集)检测时,以250ms的离子累积时间进行一级质谱图的扫描,并以100ms的离子累积时间采集30个前体离子的二级质谱图。在350-1500m/z的范围内进行ms1采集,并且在100-1500m/z的范围内进行ms2采集。前体离子动态排除时间设置为15s。对于prm(平行反应监控)的数据采集,将筛选优化后的蛋白肽段列表加入inclusionlist中,质谱将列表中大小的肽段一一选出打碎,采集二级离子谱图。取前面得到酶解后的所有肽段样品,首先各取一部分混合后进行质谱dda检测,proteinpilot数据库检索后,导入skyline软件建立谱图库(spectralibrary),并从中筛选目标蛋白的肽段进行方法建立。设计prm检测方法,将目标肽段m/z加入到inclusionlist中建立质谱采集方法。然后使用该prm方法对混合样品进行prm数据采集,以对prm采集方法进行调整和优化,形成最终用于样品数据采集的prm方法。每个样品用loadingbuffer(0.1%甲酸/3%乙腈)进行溶解,离心后取上清液进行点样。使用上述优化的prm质谱采集方法对每个样品进行数据采集,得到6个prm谱图文件,如附图5所示,附图5中的峰面积大小(所有子离子峰面积求和)直接代表肽段在对应样品中的含量。对这些prm谱图文件进行提取和分析,即可得到蛋白的定量信息。s36:对步骤s34中得到的兴趣蛋白的定量信息进行分析;lc-ms/ms得到质谱数据后,使用proteinpilot软件进行数据库检索,所用的蛋白数据库为uniprot网站下载的uniprot-taxonomy_homo_sapiens数据库。使用与absciex5600plus配套的搜索引擎——proteinpilottmv4.5。proteinpilot在搜索时由于考虑了全部可能的修饰种类,同时增加了自动容错匹配功能,在保证鉴定结果可信度的前提下,能够比同类软件检索到更多的结果。对于proteinpilot的鉴定结果,我们做了进一步过滤,对于鉴定到的蛋白,认为unusedscore≥1.3(即可信度水平在95%以上),每个蛋白至少包含一个unique肽段的蛋白为可信蛋白,不符合该条件的蛋白不包括在本报告中;对于鉴定的肽段和蛋白质定量,我们以conf≥95过滤,即可信度在95%以上认为可信肽段用于蛋白质定量,不符合该条件的肽段不包含在本报告中,具体的搜索参数如下表7所示。表7proteinpilot搜索参数具体的,经过itraq及prm两种技术验证的16种差异表达蛋白的而具体数值如下表8和9所示。表8itraq差异蛋白表达表9prm差异蛋白表达对经过itraq及prm两种技术验证的16种差异蛋白进行比较,比较组a549/pem耐药细胞株和a549的prm定量与itraq定量的差异结果比较柱状图如附图6所示,从附图6中可以看出,prm与itraq技术分析出的差异蛋白差基本一致,这些经两种技术验证的差异蛋白可能参与非小细胞肺癌对培美曲塞的耐药性。进一步的,s4:对步骤s3中经过验证的兴趣蛋白进行分析,进一步的筛选出两个目标差异蛋白进行药物敏感性研究。具体的,本发明中还从itraq和prm分析结果中筛选2个差异蛋白(igf2bp2,folr1)进行相关功能研究,分析igf2bp2和folr1对a549/pem耐药细胞药物敏感性的影响,具体操作包括:(1)构建igf2bp2和folr1小干扰rna(si-igf2bp2和folr1)及阴性对照rna(si-nc);每个基因设计三个干扰片段,分别为si-igf2bp2#1,si-igf2bp2#2,si-igf2bp2#3,si-folr1#1,si-folr1#2,si-folr1#3,干扰rna构建由武汉百齐生物技术有限公司设计合成。(2)a549/pem细胞转染;a、收集细胞,将细胞接种到6孔细胞培养板内,放在37℃的细胞培养箱中培养,观察细胞密度为70%左右时,用于细胞转染;b、在细胞转染操作前的2h,把6孔板内的细胞培养液更换成不含血清的细胞培养液;c、取10μl的lipofectamine2000转染试剂和200μl的无血清细胞培养液混合均匀,室温条件下反应5min,配制成lipofectamine2000工作溶液;d、将si-nc、si-igf2bp2#1,si-igf2bp2#2,si-igf2bp2#3,si-folr1#1,si-folr1#2,si-folr1#3分别与200μl的无血清细胞培养液混合均匀,室温条件下反应5min,配制成质粒稀释溶液;e、把lipofectamine2000工作溶液和上述干扰rna稀释溶液充分混合以后,在室温中孵育20min,配制成脂质体-质粒复合物;f、将脂质体-质粒复合物添加到6孔板内,继续培养6h以后,将不含血清的细胞培养液更换为含有血清的细胞培养液继续培养。g、次日,观察细胞生长状态,细胞培养24h以后换液,用于后续实验。(3)实时荧光定量pcr(qrt-pcr)检测igf2bp2及folr1基因干扰效率;qrt-pcr检测si-nc、si-igf2bp2#1,si-igf2bp2#2,si-igf2bp2#3转染组细胞中igf2bp2mrna表达,以及si-nc、si-folr1#1,si-folr1#2,si-folr1#3转染组细胞中folr1mrna表达,结果如附图7所示。从附图7中可以看出,si-igf2bp2#3及si-folr1#3转染后,相应基因表达水平降低最明显,说明其干扰效率较好,在后续研究中,利用si-igf2bp2#3及si-folr1#3转染细胞开展非小细胞肺癌敏感性研究。(4)cck-8测定si-igf2bp2#3或si-folr1#3转染的a549/pemic50值,均以si-nc转染组作为阴性对照;将细胞接种到96孔板内,每个孔内2000个细胞,放在培养箱中培养,分别加入250,500,1000,2000,4000,8000ng/ml的培美曲塞培养,之后测定各组细胞ic50值,结果如附图8所示。从附图8中可以看出,与si-nc组相比,si-igf2bp2及si-folr1转染组ic50值均明显降低,说明igf2bp2及folr1干扰均可增强a549/pem对培美曲塞药物的敏感性,使a549/pem细胞变得不耐药,进一步证实igf2bp2及folr1具有潜在的临床应用价值。以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种治疗非小细胞肺癌的中药胶囊的制作方法
- 基于p53抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于ca125抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于survivin抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于psma抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于psa抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于scc抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于sp17抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于mage-3抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于lmp-1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图