一种可视化定量标记细胞中聚集型功能蛋白的方法
本发明涉及生物探针和蛋白检测技术领域,具体涉及一种可视化定量标记细胞中聚集型功能蛋白的方法。
背景技术:
整联蛋白广泛分布于细胞表面,由α和β两种亚基组成跨膜异二聚体,是一类跨膜受体糖蛋白,其配体主要为细胞外基质(ecm)蛋白,如玻璃体结合蛋白、层粘连蛋白等。整联蛋白大都有较长的胞外结构域、跨膜区和较短的胞质结构域,其不同结构域具有不同的功能。对胞外结构域而言,它可通过识别细胞外基质蛋白的特定序列即精氨酸-甘氨酸-天冬氨酸(rgd序列)与细胞外基质连接,介导细胞与细胞外基质、细胞与细胞之间的粘附信号;而胞质结构域与细胞骨架结合,形成细胞外基质-整联蛋白-细胞骨架跨膜复合体,参与细胞内外信号的双向传导,调节细胞的存活、增殖及肿瘤的侵袭转移等,通过研究整联蛋白的结构功能及表达调控,能够进一步了解细胞粘附作用的发生及其相关信号的调控。
研究表明整联蛋白通过调控其下游信号分子及途径,包括fak(focaladhesionkinase,局部粘着斑激酶)、src、ilk(integrin-linkedkinase,整联蛋白连接激酶)、pi3k/akt、mapk,调控肿瘤细胞的促存活信号。fak是一种非受体酪氨酸激酶,作为整联蛋白信号通路下游活化位点分子之一,介导细胞的粘附、迁移、增殖等。fak内含多个酪氨酸位点,整联蛋白与细胞外基质结合,在与基质形成的粘附位点上,通过β亚基招募fak,fak在y397位点磷酸化,与下游src激酶形成复合物,激活src激酶,其他fak位点磷酸化,激活pi3k-akt和mapk-erk信号通路,抑制细胞凋亡。
2015年,jonnaalanko等人发现整联蛋白介导促细胞生长信号不只局限于细胞与细胞外基质的粘附位点,还出现在内涵体上。细胞与细胞外基质连接时,整联蛋白可在粘附位点招募下游信号分子fak,传导整联蛋白介导的信号,细胞失去粘附,整联蛋白内吞进入内涵体,通过内涵体传导整联蛋白介导的细胞生长信号,这就表明除了质膜粘附点,内涵体可作为整联蛋白介导的fak促细胞生长信号平台,延长依赖细胞外基质的存活信号,维持肿瘤细胞的存活。已有研究证实整联蛋白内吞作用可促进内涵体上fak磷酸化,内涵体上磷酸化的fak信号,可以抑制肿瘤细胞凋亡,支持肿瘤细胞的非锚定性生长,促进肿瘤转移。因此,通过检测内化进入内涵体的活化整联蛋白束标记建立在内涵体上的p-fak信号平台,能够检测细胞脱粘附后的存活能力。
荧光成像作为直观、原位的检测技术,可用于检测分子的表达和分布。目前,对于整联蛋白的研究多集中于通过抗体孵育表达进行成像分析,传统的有机荧光分子浓度高,在聚集状态下会发生聚集诱导淬灭(acq)效应,使用过程中需要合理控制荧光分子的工作浓度,大大限制了其适用范围。
聚集诱导发光(aie)分子作为一种特殊的荧光分子,其内含有的活跃基团进行相对运动(例如振动和转动),使得处于激发态的分子通过相对运动的形式将光能转化为热能等形式消耗,以光形式输出能量的比例较低;aie分子聚集,限制了分子的相对运动,大幅度提高了能量以光能形式输出的比例,从而表现出荧光增强的现象,甚至发生由由暗到明的突跃,实现对诱导源可视化的定性分析和定量检测,因此,聚集诱导发光(aie)分子为生物大分子生理功能的可视化提供了可能,有利于高品质的成像及高灵敏度的在线传感监测。
技术实现要素:
本发明针对目前蛋白检测过程中利用抗体识别蛋白位点通过荧光放大提供蛋白信号,抗体多为连接fitc、tritc等传统有机荧光分子,长时间曝光极易发生荧光猝灭并在蛋白聚集区产生荧光分子聚集猝灭效应的问题,提出了一种可视化定量标记细胞中聚集型功能蛋白的方法,利用聚集诱导发光探针aie-crgd对整联蛋白进行染色,解决了抗体识别存在的聚集淬灭效应,有利于聚集活化蛋白的特异性检测。
本发明具体采用如下技术方案:
一种可视化定量标记细胞中聚集型功能蛋白的方法,采用聚集诱导发光探针aie-crgd,具体包括以下步骤:
步骤1,聚集诱导发光探针aie-crgd的构建和表征
将1,2-二(4-羧基苯)-1,2-苯乙烯和crgd按照相同摩尔比混合,再加入催化剂edc-nhs进行催化,反应得到聚集诱导发光探针aie-crgd,配制由二甲基亚砜和水组成的测试体系,在该测试体系中测定聚集诱导发光探针aie-crgd的紫外吸收光谱和荧光光谱,确定聚集诱导发光探针aie-crgd的吸收峰和荧光发射峰;
步骤2,确定聚集诱导发光探针aie-crgd的浓度
改变聚集诱导发光探针aie-crgd的浓度,利用细胞计数试剂cck-8检测不同聚集诱导发光探针aie-crgd浓度条件下的细胞活性,确定聚集诱导发光探针aie-crgd用于活细胞成像的适用浓度;
步骤3,检测聚集诱导发光探针aie-crgd的靶向蛋白
分别将牛血清白蛋白bsa、胰蛋白酶trypsin、谷氨酰胺glutamine、半胱氨酸cysteine、胱氨酸cystine、基质金属蛋白酶mmp9和整联蛋白αvβ3稀释至100μg/ml,将聚集诱导发光探针aie-crgd的浓度稀释至适用浓度范围内,再分别将各蛋白溶液与聚集诱导发光探针aie-crgd按照1:1的体积比加入至300μl磷酸缓冲盐溶液中混合,针对各蛋白溶液,测定聚集诱导发光探针aie-crgd在吸收峰处的紫外吸收程度,确定整联蛋白αvβ3为聚集诱导发光探针aie-crgd的靶向蛋白,能够利用聚集诱导发光探针aie-crgd对细胞中的整联蛋白进行染色;
步骤4,基于poly-hema铺板法建立悬浮存活细胞模型,诱导悬浮存活细胞模型内细胞在脱离粘附的环境下生长,模拟细胞的抗凋亡状态;
步骤5,在悬浮存活细胞模型中,利用聚集诱导发光探针aie-crgd标记细胞的整联蛋白并进行成像,当整联蛋白内化进入内涵体后,确定整联细胞在脱离粘附细胞内的分布情况,检测磷酸化粘着斑激酶p-fak与活化整联蛋白在内涵体上的共定位,确定细胞的抗凋亡能力。
优选地,所述聚集诱导发光探针aie-crgd内含有聚集发光分子和靶向整联蛋白的多肽。
优选地,所述步骤1中,测试体系中二甲基亚砜和水的比例为1:100。
优选地,所述步骤2中,分别将聚集诱导发光探针aie-crgd的浓度调整为1μg/ml、10μg/ml、50μg/ml和100μg/ml。
优选地,所述步骤5中,基于matlab软件编制定量多参数图像分析平台,通过将图像分割,确定悬浮存活细胞模型内各内涵体的形态和位置。
优选地,所述步骤5中,磷酸化粘着斑激酶p-fak随整联蛋白的增加而增加,聚集诱导发光探针aie-crgd的荧光强度显示了整联蛋白的活化情况,用于检测整联蛋白介导的内涵体p-fak信号平台。
优选地,所述步骤5中,聚集诱导发光探针aie-crgd与磷酸化粘着斑激酶p-fak之间荧光强度的关系为n(p-fak)=186.06+0.16n(aie-crgd),其中,n(p-fak)表示磷酸化粘着斑激酶p-fak的荧光强度,n(aie-crgd)表示聚集诱导发光探针aie-crgd的荧光强度。
本发明具有如下有益效果:
本发明采用聚集诱导发光探针aie-crgd对整联蛋白进行染色,相对于抗体染色方法,具有更好的生物相容性,可以直接在活细胞中进行染色和评价,无需固定细胞进行染色处理,操作简单,仅需进行一次孵育,大幅度缩短了检测时间,同时,本发明采用聚集诱导发光探针aie-crgd诱导细胞内的整联蛋白发出荧光,避免了聚集淬灭效应的发生,可以直接根据探针荧光强度的变化对蛋白聚集情况进行分析,准确评价蛋白分子含量,实现了对细胞的成像以及对细胞中整联蛋白分布情况的确定,有利于研究细胞的抗凋亡情况。
附图说明
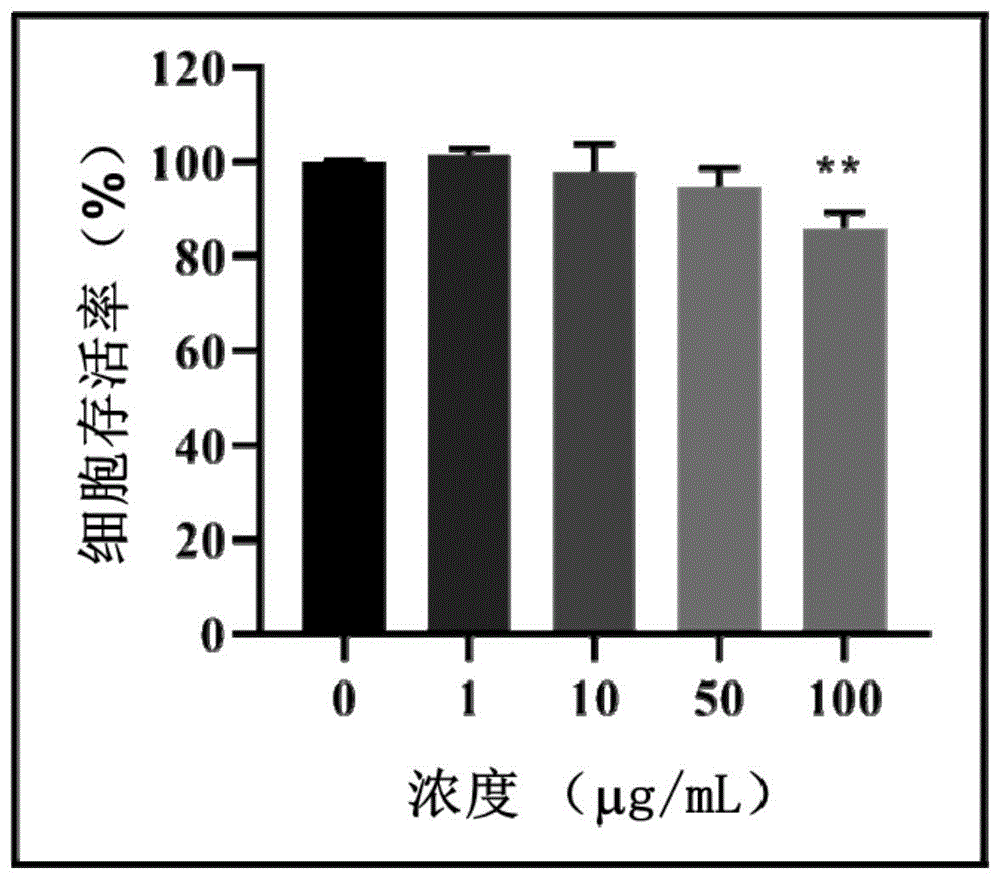
图1为聚集诱导发光探针aie-crgd的生物相容性检测结果。
图2为聚集诱导发光探针aie-crgd与各蛋白溶液混合后的吸收度。
图3为聚集诱导发光探针aie-crgd与各蛋白溶液混合后的荧光强度。
具体实施方式
下面结合附图和具体实施例对本发明的具体实施方式做进一步说明:
实施例1:聚集诱导发光探针aie-crgd的构建和表征
聚集诱导发光探针aie-crgd内含有聚集发光分子和靶向整联蛋白的多肽,将1,2-二(4-羧基苯)-1,2-苯乙烯和crgd按照相同摩尔比混合,再加入催化剂edc-nhs进行催化,过夜反应得到聚集诱导发光探针aie-crgd;
将二甲基亚砜dmso和水按照1:100的比例配制成测试体系,在测试体系中测定不同浓度聚集诱导发光探针aie-crgd的紫外吸收光谱和荧光光谱,紫外吸收光谱显示不同浓度的聚集诱导发光探针aie-crgd均在230nm处出现吸收峰,荧光光谱显示不同浓度的聚集诱导发光探针aie-crgd均在425nm处出现荧光发射峰,即确定聚集诱导发光探针aie-crgd的吸收峰为230nm、荧光发射峰为425nm。
实施例2:聚集诱导发光探针aie-crgd的浓度
以乳腺肿瘤细胞mcf-7为例,确定聚集诱导发光探针aie-crgd的浓度;分别将聚集诱导发光探针aie-crgd的浓度设置为1μg/ml、10μg/ml、50μg/ml和100μg/ml,再将mcf-7细胞分别置于各浓度的聚集诱导发光探针aie-crgd溶液中,利用细胞计数试剂cck-8检测不同浓度聚集诱导发光探针aie-crgd溶液中mcf-7细胞的活性,通过分析聚集诱导发光探针aie-crgd浓度对细胞活性的影响,发现当聚集诱导发光探针aie-crgd浓度为1μg/ml、10μg/ml和50μg/ml时,细胞活性并未发生明显变化,而当聚集诱导发光探针aie-crgd浓度为100μg/ml时,细胞活性降低,如图1所示,因此,确定聚集诱导发光探针aie-crgd的适用浓度应当不超过100μg/ml,当聚集诱导发光探针aie-crgd的浓度不超过100μg/ml时,聚集诱导发光探针aie-crgd可用于活细胞成像。
实施例3:检测聚集诱导发光探针aie-crgd的靶向蛋白
分别将牛血清白蛋白bsa、胰蛋白酶trypsin、谷氨酰胺glutamine、半胱氨酸cysteine、胱氨酸cystine、基质金属蛋白酶mmp9和整联蛋白αvβ3稀释至100μg/ml,将聚集诱导发光探针aie-crgd的浓度稀释至100μg/ml,再分别将各蛋白溶液与聚集诱导发光探针aie-crgd溶液按照1:1的体积比加入至300μl磷酸缓冲盐溶液中混合,针对各蛋白溶液,测定230nm处聚集诱导发光探针aie-crgd的紫外吸收强度变化,分析聚集诱导发光探针aie-crgd对各蛋白的响应,如图2和图3所示,聚集诱导发光探针aie-crgd溶液在230nm处的吸光度为0.0027,而将聚集诱导发光探针aie-crgd加入至整联蛋白αvβ3溶液后,在230nm处的吸光度为0.31,吸光度明显增加,为聚集诱导发光探针aie-crgd溶液在230nm处的吸光度的115倍,并且聚集诱导发光探针aie-crgd与牛血清白蛋白bsa、胰蛋白酶trypsin、谷氨酰胺glutamine、半胱氨酸cysteine、胱氨酸cystine、基质金属蛋白酶mmp9混合后的吸光度均低于与整联蛋白αvβ3混合后的吸光度,同时,这些蛋白溶液均会增强聚集诱导发光探针aie-crgd的吸收强度,但都比整联蛋白αvβ3引起的吸收强度低,由此可得,聚集诱导发光探针aie-crgd对整联蛋白αvβ3的响应度显著高于牛血清白蛋白bsa、胰蛋白酶trypsin、谷氨酰胺glutamine、半胱氨酸cysteine、胱氨酸cystine、基质金属蛋白酶mmp9,聚集诱导发光探针aie-crgd与整联蛋白αvβ3的结合具有特异性,整联蛋白αvβ3为聚集诱导发光探针aie-crgd的靶向蛋白,能够利用聚集诱导发光探针aie-crgd对细胞中的整联蛋白进行染色。
实施例4:建立悬浮存活细胞模型
基于poly-hema铺板法,建立悬浮存活细胞模型,诱导悬浮存活细胞模型内细胞在脱离粘附的环境下生长,模拟细胞的抗凋亡状态,以低粘附板培养的细胞作为对照,通过对比发现,悬浮存活细胞模型内,细胞聚集成团生长,将悬浮存活细胞模型内的细胞转移至其他基质后,细胞能够重新生长增殖。同时,对比聚集诱导发光探针aie-crgd和整联蛋白αvβ3抗体两者对整联蛋白的结合能力,分别利用聚集诱导发光探针aie-crgd和整联蛋白αvβ3抗体对mcf-7细胞和mda-mb-231细胞进行标记,利用共聚焦荧光显微镜分别研究聚集诱导发光探针aie-crgd和整联蛋白αvβ3抗体与细胞中整联蛋白的荧光共定位,发现在mcf-7细胞和mda-mb-231细胞中,聚集诱导发光探针aie-crgd和整联蛋白αvβ3抗体的荧光点基本重合,mcf-7细胞中两者的共定位系数为0.954,mda-mb-231细胞中两者的共定位系数为为0.837,共定位系数代表了发光斑点的重叠程度,共定位系数越高,发光斑点的重叠程度越高,由此可得,聚集诱导发光探针aie-crgd能够与整联蛋白特异性结合,聚集诱导发光探针aie-crgd对整联蛋白的识别能力与整联蛋白αvβ3抗体相当,进一步对比两种标记的荧光强度,发现聚集诱导发光探针aie-crgd的荧光信号强于整联蛋白αvβ3抗体的荧光信号,推测可能聚集诱导发光探针aie-crgd与整联蛋白结合后,限制了分子内苯环的旋转,大幅度增强了荧光信号,因此,相比于整联蛋白αvβ3抗体,聚集诱导发光探针aie-crgd更适用于对聚集型整联蛋白的染色。
实施例5:确定细胞的凋亡能力
基于matlab软件编制定量多参数图像分析平台,用于显示悬浮存活细胞模型中的内涵体的成像结果,在悬浮存活细胞模型中,利用聚集诱导发光探针aie-crgd标记细胞的整联蛋白,再利用整联蛋白αvβ3抗体标记内涵体的标志蛋白rab5和标志蛋白rab7,成像后,分析聚集诱导发光探针aie-crgd与标志蛋白rab5、rab7的共定位,确定内化后整联蛋白在脱离粘附细胞内的分布情况,对比发现聚集诱导发光探针aie-crgd与标志蛋白rab5的共定位率高于其与标志蛋白rab7的共定位率,细胞处于脱离粘附状态时,整联蛋白内化进入早期内涵体内,并在早期内涵体上建立维持细胞存活的信号平台,悬浮状态的细胞得到内涵体信号平台的支持存活和生长。
磷酸化粘着斑激酶p-fak随整联蛋白的增加而增加,聚集诱导发光探针aie-crgd的荧光强度显示了整联蛋白的活化情况,用于检测整联蛋白介导的内涵体p-fak信号平台,检测磷酸化粘着斑激酶p-fak与活化整联蛋白在内涵体上的荧光共定位,确定细胞的抗凋亡能力。
以mda-mb-231细胞为例,在悬浮存活细胞模型中,利用聚集诱导发光探针aie-crgd标记脱离粘附细胞中的整联蛋白,再利用抗p-fak和抗rab5的荧光抗体分别标记p-fak和早期内涵体,测定聚集诱导发光探针aie-crgd标记的整联蛋白与p-fak、rab5的荧光共定位后,发现聚集诱导发光探针aie-crgd标记的整联蛋白与p-fak、rab5的共定位率高,在脱离粘度仍存活的细胞中,聚集诱导发光探针aie-crgd的强度与p-fak及rab5的表达具有一定的相关性。
实施例6:聚集诱导发光探针aie-crgd与p-fak在早期内涵体中共定位分析
在mda-mb-231细胞中聚集诱导发光探针aie-crgd、p-fak和rab5三者的共定位荧光斑点较少,而悬浮存活细胞模型中显示了大量的聚集诱导发光探针aie-crgd、p-fak和rab5共定位荧光斑点,通过对三者的共定位两两进行共定位率统计,即将聚集诱导发光探针aie-crgd与p-fak、聚集诱导发光探针aie-crgd与rab5、p-fak与rab5分别进行共定位率统计,发现在悬浮存活细胞模型中各共定位率均高于mda-mb-231细胞中的共定位率,由此可得,mda-mb-231细胞建立了早期内涵体信号生长平台,具有更强的存活能力,脱离粘附细胞的活化整联蛋白束被内化进入内涵体,招募并激活早期内涵体上的fak,建立可以维持细胞生长和生存的信号系统,再分别选取u87-mg、kb、hela、hepg2、du-145、caco-2、a549和143b等细胞进行实验,确定细胞脱离粘附后的存活能力,通过对比发现,尽管各细胞的共定位率不同,但均低于悬浮存活细胞模型中所建立内涵体信号平台的能力,因此,验证了聚集诱导发光探针aie-crgd可用于检测悬浮细胞中整联蛋白街道内涵体p-fak信号平台的建立,支持细胞的生长与存活。
实施例7
对比聚集诱导发光探针aie-crgd、p-fak和rab5三者的荧光信号分布、荧光强度以及荧光信号的斑点比例,分析聚集诱导发光探针aie-crgd与p-fak之间荧光信号强度的相关性,发现两种信号之间存在显著的正相关,通过对图像进行拟合,确定聚集诱导发光探针aie-crgd与p-fak之间的荧光信号强度关系为n(p-fak)=186.06+0.16n(aie-crgd),其中,n(p-fak)表示磷酸化粘着斑激酶p-fak的荧光强度,n(aie-crgd)表示聚集诱导发光探针aie-crgd的荧光强度,探针的信号强度显示了整联蛋白的成束活化,磷酸化粘着斑激酶p-fak随整联蛋白的增加而增加,表明了内涵体内建立有支持细胞存活与生长的信号平台;再利用基于matlab软件开发的定量多参数图像分析平台,通过将图像分割描述各内涵体的形态和位置,选取荧光共定位区域的像素群,分析荧光强度后,验证了聚集诱导发光探针aie-crgd可用于活化整联蛋白束介导的内涵体fak信号平台,根据聚集诱导发光探针aie-crgd荧光信号强度的变化,能够确定脱离粘附后细胞的存活能力。
当然,上述说明并非是对本发明的限制,本发明也并不仅限于上述举例,本技术领域的技术人员在本发明的实质范围内所做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!