一种香兰素分子的定量检测方法
0.35。
12.其中,所述方法1)中含有香兰素分子的待测溶液和托伦试剂的反应时间为15-60s。
13.其中,所述方法1)中3,3',5,5'-四甲基联苯胺溶液与托伦试剂的反应时间为30-120s。
14.其中,所述方法1)中所述已知不同浓度的香兰素溶液与吸光值之间的线性关系方程包含在350nm处和490nm处的香兰素溶液与吸光值之间的线性关系方程中的一种或两种。
15.其中,所述在350nm处香兰素溶液与吸光值之间的线性关系方程为a=0.0239c+0.183(r2=0.9996),a为350nm处吸光值,c为香兰素浓度。
16.其中,所述在490nm处香兰素溶液与吸光值之间的线性关系方程为a=-0.0178c+1.0559(r2=0.994),a为490nm处吸光值,c为香兰素浓度。
17.其中,所述方法2)中已知不同浓度的香兰素溶液与拉曼信号强度之间的线性关系方程为i=3171.5log c+35133(r2=0.992),其中i为1040cm-1
处的拉曼信号强度,c为香兰素浓度。
18.有益效果:与现有技术相比,本发明具有如下显著优点:1、对香兰素的灵敏检测;2、本发明检测方法操作方便,比色法检测香兰素准确度更高,可实现三分钟内快速检测,同时明显的颜色变化可用裸眼定性分析;3、sers法原位快速制备sers活性基底,检测香兰素线性范围广,检测限更低,达10-11
m;4、两种检测方法可以应对不同的样品检测。
附图说明
19.图1a为香兰素和托伦试剂反应产物的sem图像,图1b为tmb和托伦试剂反应产物的sem图像,图1c为香兰素和托伦试剂反应产物的tem图像,图1d为tmb和托伦试剂反应产物的tem图像,图1e为香兰素和托伦试剂反应产物的dls图像,图1f为tmb和托伦试剂反应产物的dls图像,图1g为香兰素和托伦试剂反应产物、tmb和托伦试剂反应产物的zeta电位图;
20.图2a为香兰素与tmb分别和托伦试剂反应的机理图;图2b为托伦试剂和tmb检测香兰素的机理图;
21.图3a为加入不同浓度香兰素的样品溶液图像,图3b为加入不同浓度香兰素的样品溶液的吸光度图谱;图3c为350nm处样品溶液与香兰素浓度之间的线性关系,图3d为490nm处样品溶液与香兰素浓度之间的线性关系;
22.图4a为不同反应物的吸光值变化,图4b为托伦试剂-香兰素-tmb体系的tem图;
23.图5a为不同摩尔比的tmb与托伦试剂溶液的吸光值变化图,图5b为不同反应时间下托伦试剂和香兰素溶液的吸光值变化图,图5c为不同反应时间下托伦试剂与tmb溶液的吸光值变化图;
24.图6为不同检测物与托伦试剂反应后的体系在350nm处的吸光度;
25.图7a为不同反应物的拉曼信号图,图7b为不同浓度香兰素和托伦试剂反应产物的拉曼散射光谱的变化图,图7c为1040cm-1
处的拉曼信号强度与香兰素浓度之间的线性关系;
26.图8a为不同检测物和托伦试剂反应产物的拉曼散射光谱,图8b为不同检测物和托伦试剂反应产物在1040cm-1
处的吸光度;
27.图9a为不同浓度的目标物香兰素在奶粉样品中的回收率;图9b为不同浓度的目标
物香兰素在咖啡样品中的回收率;图9c为香兰素在不同基质中和托伦试剂反应产物的拉曼散射光谱。
具体实施方式
28.下面结合附图对本发明的技术方案作进一步说明。
29.本实验中用到的试剂和仪器:
30.硝酸银、氢氧化钾购自国药化学试剂公司(中国上海),氨水、3,3',5,5'-四甲基联苯胺、二甲基亚砜、香兰素、乙基香兰素、甲基香兰素、异香兰素购自aladdin industrial corporation(中国上海),苯甲醛购自凌峰化学试剂有限公司(中国上海),苯乙醛购自麦克林生化科技有限公司(中国上海)。
31.navo nano sem450 nova场发射扫描电镜(美国)、talos f200x高分辨透射电镜(赛默飞)、nanobrook omni多角度粒度电位分析仪(brookhaven公司)、cary 60uv-vis紫外-可见分光光度计(安捷伦)、renishaw invia raman microscopy共聚焦显微拉曼光谱仪(雷尼绍)。
32.本发明所有的实施例中的托伦试剂是先后将10mm硝酸银溶液500μl,80mm氢氧化钾溶液65μl、1.3%氨水35μl和超纯水400μl混合得到的,且托伦试剂的浓度为5mm;3,3',5,5'-四甲基联苯胺(tmb)溶液在二甲基亚砜(dmso)中配制,且tmb的浓度为1mm;其余溶液均是在蒸馏水中溶解得到。
33.实施例1两种银纳米粒子(agnps)的合成与测定
34.取5mm的托伦试剂12μl于离心管中,加入100μm香兰素200μl,在室温下反应1分钟,然后用超纯水稀释至400μl,得到第一组无色的agnps溶液;另取5mm的托伦试剂12μl于离心管中,加入1mm tmb 18μl,室温反应2分钟,然后用超纯水稀释至400μl,得到第二组粉色的agnps溶液。最后分别对两组agnps溶液进行sem和tem图像测定,如图1a和1c所示,香兰素还原托伦试剂获得尺寸约为45nm的银纳米粒子(ag
45 nps),该ag
45 nps大致呈球形,尺寸较小,表面光滑;如图1b和1d所示,tmb还原托伦试剂获得尺寸约为100nm的银纳米粒子(ag
100 nps)。ag
100 nps呈不规则球形,尺寸较大,表面有褶皱。再对ag
45 nps溶液和ag
100 nps溶液分别进行动态光散射(dls)实验和zeta电位值测定,如图1e和1f,ag
45 nps的平均直径为45nm,ag
100 nps的平均直径为100nm;如图1g所示,ag
45 nps的zeta电位值为-48.4mv,ag
100 nps的zeta电位值为-22.1mv。以上结果表明香兰素和tmb分别还原托伦试剂生成两种不同形貌和尺寸的agnps,即香兰素还原托伦试剂生成ag
45 nps,裸眼可观察到溶液呈无色;tmb还原托伦试剂生成ag
100 nps,裸眼可观察到溶液呈粉色。
35.实施例2比色法检测香兰素
36.根据图2所示的步骤和机理,首先取5mm的托伦试剂12μl于离心管中,分别加入浓度为1μm、10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm的香兰素200μl,在室温下反应1分钟;接着,向混合物中加入1mm tmb溶液18μl,室温反应2分钟,最后用超纯水稀释至400μl,得到样品溶液。将样品溶液在200~800nm波长范围内进行吸光度测定,用紫外可见光谱仪测定溶液在350nm和490nm波长处的吸光度。如图2所示,香兰素还原托伦试剂得到ag
45 nps,且溶液呈无色,在350nm波长处有紫外吸收信号;tmb还原托伦试剂得到ag
100 nps,且溶液呈粉色,在490nm波长处有紫外吸收信号。因此,先在一定量的托伦试剂中加入
目标物香兰素,得到ag
45 nps,再向混合溶液中加入tmb还原剩余托伦试剂,得到ag
100 nps。随着目标物香兰素浓度的增加,得到的ag
45 nps越多,ag
100 nps越少。如图3a所示,随着目标物香兰素终浓度从0.5μm增加到50μm,裸眼可观察到样品溶液的颜色由粉红色变为无色;如图3b所示,随着香兰素浓度的增加,样品溶液在350nm处的吸光值逐渐增强,而在490nm处的吸光值逐渐减弱;如图3c所示,在350nm处的样品溶液吸光值与香兰素浓度之间的线性关系,其线性方程式是a=0.0239c+0.183(r2=0.9996),其中a为350nm处吸光值,c为香兰素浓度,范围为0.5μm~50μm,检出限为0.411μm;如图3d所示,在490nm处的样品溶液吸光值与香兰素浓度之间的线性关系,其线性方程式是a=-0.0178c+1.0559(r2=0.994),随着香兰素浓度的增加,且此时香兰素的浓度范围为0.5μm~50μm,检出限为0.482μm。
37.实施例3不同反应物混合条件下的吸光值强度验证
38.分别检测托伦试剂、tmb以及检测分子香兰素单独存在或者两者或者三者混合时的吸光值。基于实施例2,分别配制以下溶液,并且分别加入蒸馏水至总反应体积均为400μl:(a)取5mm托伦试剂12μl;(b)取100μm香兰素100μl;(c)取1mm tmb 18μl;(d)取100μm香兰素100μl,然后加入1mm tmb 18μl反应;(e)取5mm托伦试剂12μl,然后加入100μm香兰素100μl;(f)取5mm托伦试剂12μl,然后加入1mm tmb 18μl反应;(g)取5mm托伦试剂12μl,然后加入100μm香兰素100μl反应,接着加入1mm tmb 18μl反应;以上溶液基于实施例2进行紫外可见吸收光谱的测定。
39.如图4a所示,香兰素与托伦试剂的反应产物,在350nm波长处有紫外吸收信号;tmb与托伦试剂反应后,在490nm波长处有紫外吸收信号;托伦试剂先后与香兰素和tmb反应后,在350nm处吸光值不变,而在490nm处的吸光值减弱。如图4b所示,托伦试剂先后与香兰素和tmb反应后,体系中同时存在两种尺寸的agnps。通过以上检测结果可以看出,香兰素和tmb可以在同一体系中还原托伦试剂合成两种有不同最大吸收波长的agnps。在托伦试剂-香兰素-tmb体系中,由于香兰素首先消耗了部分托伦试剂合成ag
45 nps,导致能与tmb反应的托伦试剂的量减少,进而合成的ag
100 nps的量减少,故在490nm处的吸光值也减少。
40.实施例4比色法检测目标物分子最优反应条件的选择
41.为了使检测方法可行,需要保证在没有香兰素的条件下,tmb能与托伦试剂完全反应,因此需对tmb与托伦试剂的浓度比例进行优化,取5mm托伦试剂12μl,然后分别加入1mm tmb溶液12μl、15μl、18μl、21μl,室温反应2分钟,然后用超纯水稀释至400μl,分别测量体系在490nm处的吸光值,如图5a所示,当tmb与托伦试剂的摩尔比为0.30时,体系反应完全。进一步,对托伦试剂-香兰素反应的时间进行优化,取5mm托伦试剂12μl,然后加入40μm香兰素200μl,选择一系列反应时间为(15s,30s,45s,60s),然后用超纯水稀释至400μl,测量体系在350nm处的吸光值,如图5b所示,托伦试剂和香兰素反应在60s达到平衡。对托伦试剂与tmb反应的时间进行优化,取5mm托伦试剂12μl,然后分别加入1mm tmb溶液12μl、15μl、18μl、21μl,选择一系列反应时间为(30s,60s,90s,120s),然后用超纯水稀释至400μl,测量体系在490nm处的吸光值,如图5c所示,托伦试剂与tmb反应在120s达到平衡。所以,tmb与托伦试剂的摩尔比为0.30,托伦试剂和香兰素反应为60s,托伦试剂与tmb反应在120s时,体系反应完全。
42.实施例5比色法检测目标物分子的选择性
43.取5mm托伦试剂12μl,然后分别加入40μm的香兰素,40μm的乙基香兰素,40μm的甲
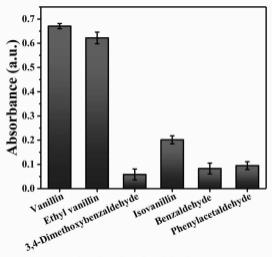
基香兰素,40μm的异香兰素,40μm的苯甲醛以及40μm的苯乙醛200μl,然后用超纯水稀释至400μl,在室温下反应1分钟,测量不同体系在350nm处的吸光值。如图6所示,与香兰素结构相似的醛类衍生物中,香兰素和乙基香兰素存在的体系在350nm处有很强的紫外吸收峰强度,而其他体系中在350nm处的紫外吸收峰值强度非常低。因为不同的醛还原托伦试剂所需的反应时间和温度不同,香兰素和乙基香兰素可以在室温下一分钟内快速还原托伦试剂得到大量的银纳米颗粒,而其他结构相似的醛类衍生物不能在相同的条件下合成较多的银纳米颗粒。所以,该定量检测方法能够特异性地检测香兰素。
44.实施例6表面增强拉曼散射(sers)光谱技术对目标物香兰素的检测
45.取1mm的托伦试剂200μl于离心管中,分别加入浓度为10-9
m、10-8
m、10-7
m、10-6
m、10-5
m、10-4
m、10-3
m的香兰素40μl,在室温下反应1分钟;最后用超纯水稀释至400μl。取20μl样品滴在硅片上,室温干燥后采用拉曼光谱仪测量拉曼信号,激发波长为785nm,激光功率为1%,曝光时间为10s。图7a显示了托伦试剂、香兰素和托伦试剂-香兰素体系的拉曼光谱,由图可以看出,托伦试剂和香兰素本身的拉曼信号很弱,而托伦试剂-香兰素体系拉曼信号很强,表明香兰素还原托伦试剂获得的银纳米颗粒ag
45 nps可以作为sers基底来增强体系的拉曼信号。图7b显示了随着香兰素浓度的增大,体系的拉曼信号强度也增大,因此选取拉曼信号强度最大的峰所在的1040cm-1
进行对香兰素的定量检测。图7c显示了1040cm-1
处的拉曼信号强度与香兰素浓度之间的线性关系,其线性方程式是i=3171.5log c+35133(r2=0.992),其中i为1040cm-1
处的拉曼信号强度,c为香兰素浓度,范围为10-10
m~10-4
m,检出限为2.58
×
10-11
m,随着香兰素浓度的增加,样品溶液的拉曼信号强度逐渐增强。该定量检测方法也会原位快速制备sers基底提供了新思路。
46.实施例7表面增强拉曼散射法检测目标物分子的选择性
47.基于实施例6中的步骤条件,将目标物分子香兰素(浓度10-3
m)分别换成浓度为10-3
m的乙基香兰素,10-3
m的甲基香兰素,10-3
m的异香兰素,10-3
m的苯甲醛以及10-3
m的苯乙醛,测量不同体系的拉曼散射光谱及在1040cm-1
处的拉曼信号强度。从图8a可以看出,与香兰素结构相似的醛类衍生物与托伦试剂反应后体系拉曼散射特征峰出峰位置与香兰素相似,但特征峰的信号强度不同。图8b显示了与香兰素结构相似的醛类衍生物和托伦试剂反应产物在1040cm-1
处的拉曼信号强度远低于香兰素。这是由于不同的醛还原托伦试剂所需的反应条件不同,而在同一条件下合成的银纳米颗粒量不同,这导致了sers增强效果的不同,且香兰素及其结构相似的醛类衍生物不同的分子结构会引起它们之间拉曼光谱的差异。所以,该定量检测方法能够特异性地检测香兰素。
48.实施例8奶粉和咖啡中香兰素的加标回收检测
49.为了将这种方法应用在实际样品中,从超市购买了速溶全脂奶粉和咖啡(配料中均含有香兰素,《0.5mg/l),将实际样品(10mg/ml)用水溶解振荡,取上清液进行使用,加标实验在线性范围内进行,实际样品以总体积的10%加入。
50.用比色法对香兰素进行加标回收的实验步骤如下:取5mm的托伦试剂12μl于离心管中,加入含有浓度分别为50μm,250μm,500μm香兰素的实际样品溶液40μl,在室温下反应1分钟;接着,向混合物中加入1mm tmb 18μl,室温反应2分钟,最后用超纯水稀释至400μl,得到终浓度为5μm,25μm,50μm的香兰素溶液。样品的吸光度测定在200~800nm波长范围内进行,用紫外可见光谱仪测定溶液在350nm和490nm波长处的吸光值,并计算含有不同香兰素
浓度(added)的样品的香兰素回收浓度(found)和回收率(recovery)。实验结果如表1、图9a和图9b所示,该检测方法在奶粉和咖啡样品中加标回收率在91.68%~105.76%之间,变异系数(cv)小于9.6%,表明制备的方法具有良好的性能,可用于检测奶粉和咖啡样品中的香兰素,且两条线性方程结合检测比单检测有更优异的回收率和cv值,进一步提高该定量检测方法的准确性和可靠性。
51.表1
[0052][0053]
用sers对香兰素进行加标回收实验步骤如下:取1mm的托伦试剂200μl于离心管中,加入含有浓度分别为10-9
mm,10-6
mm,10-3
mm香兰素的实际样品溶液40μl,在室温下反应1分钟,最后用超纯水稀释至400μl。取20μl样品滴与在硅片上,室温干燥后采用拉曼光谱仪测量拉曼信号。图9c显示了香兰素溶液和加入到奶粉和咖啡基质中香兰素溶液和托伦试剂反应产物的拉曼散射光谱,由图可以看出奶粉和咖啡基质不影响产物在1040cm-1
处出峰,表明奶粉和咖啡基质对该检测体系不干扰。
[0054]
表2
[0055][0056]
加标回收实验结果如表2所示,该检测方法在奶粉和咖啡样品中加标回收率在94.5%~110.9%之间,变异系数(cv)小于12.3%,表明制备的方法具有良好的性能,可用于检测奶粉和咖啡样品中的香兰素。
[0057]
对比例
[0058]
与王永平等人(氮掺杂碳点的合成及其在香兰素检测中的应用,2019)(序号1)、mohamed amin elaguech等人(基于纳米孔的适配酶传感器用于食品样品中香兰素的无标记灵敏测定,2022)(序号2)、江佳民等人(嵌入纳米硅的可调谐拉曼内标诱发的定量可回收sers检测,2022)(序号3)、张燕等人(双金属分子印迹纳米酶:双模检测平台,2022)(序号4和5)的研究结果进行比较。
[0059]
表3
[0060][0061]
如表3所示,以上五种现有的检测方法中,序号2的电化学方法的检测限最低,为500pm,远高于本发明方法(序号7)中的25.8pm,准确度远没有本发明方法好;本发明方法(序号6)的响应时间(3min)也比以上六种检测方法快速,且操作简单快捷;另外本发明还可以通过比色法(序号6)对待测样品中的香兰素进行定性分析,再通过sers(序号7)进行定量分析,上述方案均可实现对香兰素高效、快捷、准确的检测,且检测效果远高于现有技术的检测效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1