蛋白质‑蛋白质相互作用的超分辨成像的制作方法
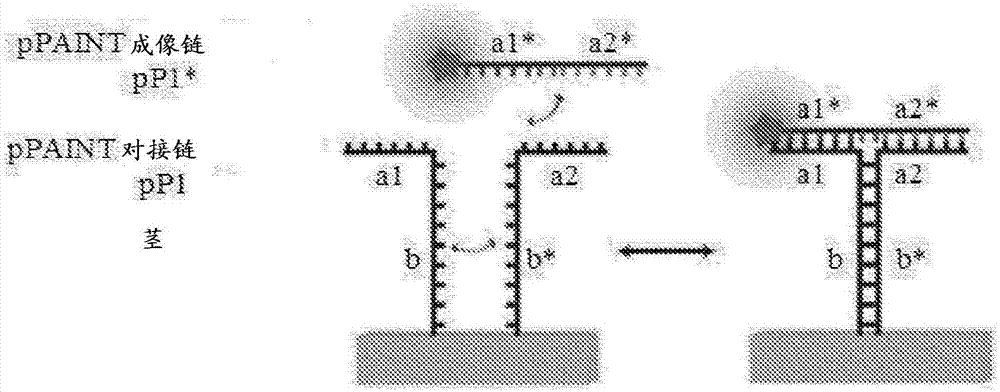
相关申请本申请根据35u.s.c.§119(e)要求2015年8月7日递交的美国临时申请号62/202,327的权益,其全部内容通过引用并入本文。联邦资助的研究本发明是在美国国立卫生研究院授予的u01-mh106011-01和5r01eb018659-02和美国国家科学基金会授予的ccf-1317291和美国国防部海军研究办公室授予的n00014-13-1-0593的政府支持下完成的。美国政府对本发明享有一定的权利。背景基因组测序数据已经产生了大量预测的蛋白质组。然而,建立用于生物医学研究的全面的相互作用组图需要精确和准确的方法来研究相互作用蛋白质的定位和共定位。许多目前可用的方法不能检测单细胞中的瞬时相互作用,而是只能检测细胞群体中相对稳定的蛋白质相互作用(例如使用免疫共沉淀)。概述本公开提供了用于相互作用部分(例如蛋白质和其他生物分子)的超分辨成像的组合物、试剂盒和方法。基于dna-paint(用于纳米级拓扑图中成像的脱氧核糖核酸-点积累(deoxyribonucleicacid-pointaccumulationforimaginginnanoscaletopography))技术的这些灵敏和特异性方法在本文中被称为“接近dna-paint”方法。在一些实施方案中,接近dna-paint用于检测/可视化两个不同分子(例如个体细胞中的细胞内蛋白质(或核酸))之间的相互作用。接近dna-paint使用一对寡核苷酸(例如,长度小于200个核苷酸或长度小于100个核苷酸的单链核酸),每个寡核苷酸包含形成“对接位点”的一半的结构域,只有当两个一半结合在一起形成一个完全对接位点时,标记的“成像链”才与之结合。每个寡核苷酸还包含稳定结构域。一对寡核苷酸的稳定结构域彼此互补,使得当一对寡核苷酸对通过与寡核苷酸连接的结合伴侣(例如蛋白质)之间的相互作用而靠近在一起时,寡核苷酸(通过稳定/茎结构域)彼此结合。如所描绘在图1a-1b的,只有当(互补的)一对寡核苷酸的两个寡核苷酸(各自含有对接位点的一半)彼此结合时(当两个感兴趣的结合伴侣彼此相互作用或彼此非常接近时)才形成完全对接位点。因此,只有当一对寡核苷酸的两个寡核苷酸彼此足够接近以使它们彼此结合时,成像链才会与对接位点结合。通过将每对寡核苷酸与一对靶特异性结合伴侣例如靶特异性抗体缀合,能够直接观察到亚衍射极限分辨率的这些靶的相互作用。因此,例如,如本文所提供的组合物和方法可用于可视化个体细胞中的内源性蛋白质之间的相互作用。也可以通过dna对接链的正交性来实现多重分析(multiplexing)。因此,本公开提供了系统、组合物和试剂盒,其包含(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补。在一些实施方案中,(a)和(b)的结合伴侣中的每一个是抗体或抗原结合抗体片段。抗体(和抗原结合抗体片段)可以是例如单克隆或多克隆。嵌合抗体(和抗原结合抗体片段)和人源化抗体(和抗原结合抗体片段)也包括在本文中。在一些实施方案中,(a)和(b)的结合伴侣中的每一个结合不同的蛋白质。例如,一对结合伴侣可以包括特异性结合蛋白a的一个抗体和特异性结合蛋白b的另一个抗体。因此,每个结合伴侣(例如抗体)结合不同的蛋白质(例如一个结合蛋白a,一个结合蛋白b)。在一些实施方案中,(a)和(b)的结合伴侣中的每一个结合相同蛋白质的不同结合位点(例如表位)。例如,一对结合伴侣可以包括特异性结合蛋白a的表位a的一个抗体,和特异性结合蛋白a的表位b的另一个抗体。因此,每个结合伴侣(例如抗体)结合相同蛋白质的不同的表位(例如,一个结合表位a,一个结合表位b)。在一些实施方案中,(a)和(b)的半对接结构域中的每一个长5-15个核苷酸。例如,(a)和(b)的半对接结构域中的每一个可以长5-10个核苷酸。在一些实施方案中,(a)和(b)的半对接结构域中的每一个长3-20,3-15,3-10,4-20,4-15,4-10,5-20,5-15或5-10个核苷酸。在一些实施例中,(a)和(b)的半对接结构域中的每一个长3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20个核苷酸。在一些实施方案中,(a)和(b)的半对接结构域中的每一个长5±2个核苷酸,6±2个核苷酸,7±2个核苷酸或8±2个核苷酸。在一些实施方案中,(a)和(b)的半对接结构域中的每一个长5-7个核苷酸。在一些实施方案中,(a)和(b)的半对接结构域中的每一个长6个核苷酸。在一些实施方案中,(a)和(b)的稳定结构域中的每一个长5-50个核苷酸。例如,(a)和(b)的稳定结构域中的每一个可长5-40,5-30,5-20,5-10,10-50,10-40,10-30或10-20个核苷酸。在一些实施方案中,(a)和(b)的稳定结构域中的每一个长5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20个核苷酸。在一些实施方案中,(a)和(b)的稳定结构域中的每一个长8±2个核苷酸,9±2个核苷酸,10±2个核苷酸,11±2个核苷酸或12±2个核苷酸。在一些实施方案中,(a)和(b)的稳定结构域中的每一个长9-11个核苷酸。在一些实施方案中,成像链长10-30个核苷酸。例如,成像链可以长10-15或10-20个核苷酸。在一些实施方案中,成像链长8,9,10,11,12,13,14,15,16,17,18,19或20个核苷酸。在一些实施方案中,成像链长8±2个核苷酸,9±2个核苷酸,10±2个核苷酸,11±2个核苷酸,12±2个核苷酸,13±2个核苷酸,14±2个核苷酸,15±2个核苷酸,或者16±2个核苷酸。在一些实施方案中,成像链长10-12个核苷酸或12-14个核苷酸。在一些实施方案中,成像链的5’结构域和3’结构域中的每一个长5-10个核苷酸。在一些实施方案中,成像链的5'结构域和3'结构域中的每一个长5,6,7,8,9或10个核苷酸。在一些实施方案中,成像链的5'结构域和3'结构域中的每一个长6个核苷酸。在一些实施方案中,成像链的5'结构域和3'结构域中的每一个长6±2个核苷酸。在一些实施方案中,接头结构域长1-5个核苷酸。例如,接头结构域可以长1,2,3,4,或5个核苷酸。在一些实施方案中,接头结构域包含胸腺嘧啶(t)核苷酸(t残基)或由其组成。在一些实施方案中,接头包含tt序列或由其组成。在一些实施方案中,接头结构域包含腺嘌呤(a)核苷酸(a残基)或由其组成。在一些实施方案中,接头包含aa序列或由其组成。在一些实施方案中,接头结构域包含胞嘧啶(c)核苷酸(c残基)或由其组成。在一些实施方案中,接头包含cc序列或由其组成。在一些实施方案中,接头结构域包含鸟嘌呤(g)核苷酸(g残基)或由其组成。在一些实施方案中,接头包含gg序列或由其组成。在一些实施方案中,成像链被可检测地标记(包含能够被检测的分子)。在一些实施方案中,成像链被荧光标记(包含荧光标记/分子,如荧光团)。在一些实施方案中,(a)和(b)的结合伴侣中的每一个通过链霉抗生物素蛋白-生物素结合对各自缀合至(a)和(b)的寡核苷酸。例如,结合伴侣可以链接至链霉抗生物素蛋白,并且寡核苷酸可以连接至生物素。或者,结合伴侣可以连接至生物素,并且寡核苷酸可以连接至链霉抗生物素蛋白。在一些实施方案中,组合物进一步包含复合物,所述复合物包含两个靶(例如彼此结合或以其他方式相互作用的蛋白质),其中(a)的结合伴侣结合或被结合至两个靶中的一个,并且(b)的结合伴侣结合或被结合至两个靶中的另一个。在一些实施方案中,两个靶中的每一个是蛋白质。在一些实施方案中,多个组合物中的不同组合物的成像链包含光谱上能够明确区分的标记(例如,一些在红色通道中发荧光,另一些在蓝色通道中发荧光等)。本文还提供了多个(例如10,100,1000,10000,等)组合物,其包含(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补,其中多个组合物内的不同组合物的成像链包含光谱上不能够明确区分的标记。本文还提供了多个组合物,其包含(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补,其中所述多个组合物中组合物中的至少一个具有能够明确区分于多个组合物中其它组合物的闪烁频率(例如kon/koff)。本文进一步提供了检测样品中两个靶的复合物的方法,该方法包括:使样品接触(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补,其中(a)的结合伴侣具有针对两个靶中的一个的特异性,(b)的结合伴侣具有针对两个靶中的另一个的特异性;并且检测样品中复合物的存在或不存在。在一些实施方案中,样品是细胞(例如细菌细胞,酵母细胞,昆虫细胞或哺乳动物细胞)或细胞裂解物。在一些实施方案中,两个靶中的每一个是蛋白质。在一些实施方案中,两个靶中的每一个获得自(例如分离自或纯化自)细胞或细胞裂解物。在一些实施方案中,该方法还包括检测样品中两个靶的多个复合物。在一些实施方案中,多个复合物是多个不同的复合物。在一些实施方案中,多个复合物内复合物的子集位于彼此的子衍射距离内。本发明还提供了检测样品中分子内相互作用的方法,该方法包括使包含靶分子的样品接触:(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)的结合伴侣具有针对靶分子上一个位置的特异性,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(b)的结合伴侣具有针对靶分子上另一个位置的特异性,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含可检测标记、5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补;并且检测样品中(c)的成像链的可检测标记的存在或不存在。在一些实施方案中,样品是细胞或细胞裂解物。在一些实施方案中,靶分子是蛋白质。在一些实施方案中,(a)和(b)的位置中的每一个是该蛋白质上的不同表位。因此,该方法可用于检测感兴趣蛋白质上两个不同结合位点(例如表位)的存在。本文还提供了系统、试剂盒和组合物,其包含(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成第一完全对接结构域,(c)第三结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(c)的稳定结构域彼此互补,并且其中(a)和(c)的半对接结构域线性组合形成第二完全对接结构域,(d)第一成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中第一成像链的5’结构域与(a)的半对接结构域互补,第一成像链的3’结构域与(b)的半对接结构域互补,和(e)第二成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中第二成像链的5’结构域与(a)的半对接结构域互补,第二成像链的3’结构域与(c)的半对接结构域互补。在一些实施方案中,本发明提供了系统、组合物和试剂盒,其包含(a)第一结合伴侣-寡核苷酸(例如抗体-dna)缀合物,其包含与包含长5-7个核苷酸的半对接结构域、长9-11个核苷酸的稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,(b)第二结合伴侣-寡核苷酸(例如抗体-dna)缀合物,其包含与包含长5-7个核苷酸的半对接结构域、长9-11个核苷酸的稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域对齐(例如线性)形成完全对接结构域,和(c)成像链,其包含长5-7个核苷酸的5’结构域、长5-7个核苷酸的3’结构域和位于5’结构域和3’结构域之间的长1-5个核苷酸的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补。附图简要说明图1a-1c显示接近paint的实例。图1a显示两个靶蛋白,各自标记有两个p-paintdna寡核苷酸中的一个。如果蛋白质发生相互作用,则相互作用将通过dna-paint可见。图1b显示ppaint寡核苷酸的详细原理图:用作对接位点的两个寡核苷酸具有短的互补结构域(茎),其将瞬时结合。该结构域被设计为具有比成像链的平均结合时间更长的平均结合时间。因此,当两个寡核苷酸足够接近以形成对接位点时,成像链将以比两个寡核苷酸没有足够接近以形成对接位点的概率更高的概率结合对接位点。在没有形成对接位点的情况下,观察不到dna-paint踪迹。用于本实例中所示的ppaint的成像链(探针)具有三个结构域:一个末端结构域“a1*”(其结合对接链序列之一的一个末端“a1”(例如5'末端))、中央结构域(其包含tt接头)和另一个末端结构域“a2*”(其结合另一个对接链序列的一个末端“2a”(例如3'末端))。如本文所用,术语接头和间隔区可互换使用。图1c显示了在其四角用ppaint寡核苷酸“标记”的dna折纸(origami)结构:当存在一对ppaint寡核苷酸时,使用cy3b标记的成像链获得dna-paint超分辨率荧光图像。当只有ppaint寡核苷酸中的一个存在时,没有获得可见的踪迹。图1d显示了含有ppaint探针延伸的dna折纸结构,证明用对照dna-paint对接位点(p16和p38)和ppaint对接位点(pp1)能够看到期望的几何形状。图1e显示了一对ppaint探针(i)、基序2(ii)和基序1(iii)采用的二级结构。每个基序设计为采用二级结构,其足够弱以保证当两个探针紧密接近时,它们采用(i)中描述的二级结构,但足够强以防止形成多价相互作用。例如,这最后一个特征是有用的,因为抗体通常用多于一个dna探针标记,因此多价相互作用能够导致形成ppaint对接位点(i),即使只有一个靶存在。图2.ppaint的第一阶段。(左图)使用中间为tttt、ttt和tt接头的三种类型的成像链评估在茎和对接位点中的一个之间的边缘有tt、t和没有间隔区的三种类型的对接位点。(中图)基于动力学分析选择相对于对接位点的性能最好的成像链。(右图)作为一个实例,该对用于确定长度范围为9-11bp的茎设计库中的最佳茎长度。图3.在茎和对接位点序列中的一个之间的边缘有tt间隔区(正方形)、t间隔区(三角形)和没有间隔区(圆形)的三种类型的对接位点和中间为tttt(中灰色)、ttt(浅灰色)和tt(深灰色)接头的三种类型的成像链的平均结合时间。在一些情况下,ppaint的设计对应于在茎的边缘缺少间隔区和成像链中的tt接头的设计。图4.在茎和对接位点序列中的一个之间的边缘有tt间隔区(正方形)、t间隔区(三角形)和没有间隔区(圆形)的三种类型的对接位点和中间为tttt(中灰色)、ttt(浅灰色)和tt(深灰色)接头的三种类型的成像链的kon。图5.评价的每个茎长的最佳设计的平均结合时间:s9v2(方形),s10v2(三角形),s11v1(圆形)。图6.评价的每个茎长的实例设计的kon:s9v2(正方形),s10v2(三角形),s11v1(圆形)。图7.ppaint的检测范围。(左图)在三个不同的距离用ppaint寡核苷酸“标记”dna折纸聚合物。(中图)随着距离的增加,我们期望看到更弱的信号。(右上图)通过此特性,可以确定p-paint的工作范围。(右下图)用两个对接点进行更大距离测试的初步结果。将两个ppaint寡核苷酸置于它们之间5nm(上图)和20nm(下图)的距离处。在每个图的左侧,六订书钉(hex-staple)表示(其中每个六边形表示编码用于3'末端延伸(深灰色)和5'末端(黑色)中修饰的订书钉颜色)描绘了其中两个半对接位点被放置在dna折纸结构中的位置。通过这种表征,可以得出结论,ppaint的工作范围至少为20nm。图8.基准测试原位ppaint(benchmarkingppaintinsitu)。详述本公开提供了对传统dna-paint方法的改良。本发明的方法不是对单个靶(例如单个蛋白质或单个核酸)进行成像,而是检测彼此相互作用的靶(例如两个靶)。只有当一对靶彼此足够紧密接近时,该方法才会产生信号,使得两个靶可以被认为是相互结合或相互复合。当靶没有足够靠近彼此时,则检测不到信号。因此,本公开提供dna-paint方法的预料不到的用途,以及涉及这种用途的组合物。dna-paint是超分辨率成像方法,其涉及标记的寡核苷酸随机、短寿命结合至彼此由小于衍射极限距离的距离分开的靶。该方法依赖于寡核苷酸在任何给定时间仅与靶子集的结合。靶子集可以是一个或多个(例如,2,3,4,5,6,7,8,9或10个),并且在一些情况下,可以没有靶被结合。当少于所有的靶被结合至可检测的寡核苷酸时,来自个体靶的信号更容易彼此区分开。这与所有靶都被结合至可检测标记的情况相反,在这种情况下,来自多个靶的信号是不可区分的。因此,彼此太靠近的靶可以通过检测其中每个信号在时间上交错的方式的信号在空间上被解析。在dna-paint方法中,通过使用特异性结合靶的结合伴侣来检测靶。结合伴侣进而与本文中称为“对接链”的寡核苷酸缀合。检测还需要使用与对接链互补的称为“成像链”(探针)的另一寡核苷酸。对接链提供成像链与其结合的对接位点。成像链被可检测地标记,包括例如被荧光标记。dna-paint需要对接链和成像链之间的相互作用是短寿命的。这通过多种方式实现,例如通过对接链和成像链的长度,通过对接链和成像链的核苷酸序列,通过成像链的浓度,通过每个靶的对接链的数量,通过其中发生结合相互作用的条件等。诸如双分子荧光互补(hu,chinenov,&kerppola,2002)的其他技术使得在细胞内定位这些相互作用,但需要融合蛋白的高表达水平。称为接近连接测定(pla)(etal.,2006)的不同的方法提供高灵敏度和特异性,但指示蛋白质之间相互作用的可视信号仍然局限于衍射极限,并且几个酶促步骤是必要的,以放大和检测这种信号。单分子定位(sml)技术使得能够在衍射极限以下进行可视化,揭示无数有价值的生物信息。这些实现中的许多使用荧光on和off状态来时间上解耦衍射极限区域内的蛋白质的定位。靶向(例如stimulatedemissiondepletionmicroscopy或sted)(hell,1994)和随机(photoactivatedlocalizationmicroscopy或palm和stochasticopticalreconstructionmicroscopy或storm)(rust,bates,&zhuang,2006)(betzig,etal.,2006)切换方法已经实现了前所未有的空间分辨率,但是它们需要昂贵的设备和/或专门的实验条件。相比之下,dna-paint利用短暂可检测标记的寡核苷酸(“成像”链)的可编程能力,瞬时与其互补的“对接”链结合,实现单分子定位所必需的随机on和off状态,由此促进超分辨率显微术(jungmannetal.nanolett.2010nov10;10(11):4756-61,作为参考引入本文)。dna-paint能够获得在dna纳米结构中空间分辨率小于10nm的高度多重的亚衍射图像。除此之外,通过将dna寡核苷酸与抗体偶联,dna-paint能够扩展到原位多重二维和三维超分辨率成像。将sml方法的解析能力与其他测定相结合的技术也是可用的。这些技术包括将双分子荧光互补(bifc)与palm组合用于蛋白质-蛋白质相互作用的超分辨成像(liu,etal.,2014),以及共振能量转移(fret)与通用paint(upaint)的组合(winckler,etal.,2013)。这些方法已经为使用亚衍射极限分辨率的相互作用蛋白的作用提供了有价值的见解。尽管如此,这些方法依赖于并因此受限于需要以非常高的水平表达融合蛋白。另外,这些方法仅限于分析膜中的靶蛋白。此外,使用这些可用的技术对于大量蛋白质对的多重分析是非常具有挑战性的。接近paint像dnapaint一样,接近dna-paint依赖于已知的核苷酸序列的动力学。通过调节寡核苷酸对的长度和序列,可以实现瞬时结合和解除结合,使得靶分子如复合物在衍射极限区域内定位。参见2014年7月30日提交的国际公开号wo2015/017586,其全部内容通过引用并入本文。提供了一种系统,在一些实施方案中,该系统包括一对核苷酸序列,只有当它们彼此非常接近时,它们才能充当对接位点。当该对不是非常接近时,成像链和每个单独序列之间的任何相互作用都没有足够稳定以至于被检测到(图1a-b)。图1a-c示出了在两个相互作用蛋白的情况下的接近paint(ppaint)方法。在图1a中,两个靶蛋白各自用一对p-paint寡核苷酸中的一个进行标记。如果蛋白质发生相互作用,则通过dna-paint可以看到相互作用。图1b显示了ppaint寡核苷酸设计。两个ppaint寡核苷酸组合形成对接位点。另外,它们具有短的互补结构域(本文称为稳定结构域或茎结构域),其可以将寡核苷酸彼此瞬时结合。该结构域具有比成像链结合到对接位点更长的平均结合时间。因此,当两个寡核苷酸彼此足够靠近时,成像链将以比倘若寡核苷酸没有足够靠近在一起时更高的概率结合对接位点。当寡核苷酸彼此没有足够靠近时,不会得到显著的dna-paint踪迹(例如荧光信号)。图1b示出了ppaint成像链的一个实施方案。所示的成像链具有三个结构域:第一结构域结合对接位点的5'-末端核苷酸序列(即,5'半对接位点);第二结构域结合对接位点的3'-末端核苷酸序列(即,3'半对接位点);和位于5'和3'结构域之间的(任选的)接头结构域。当存在时,接头可以是核酸或可以是非核酸。在一些实施方案中,接头包含1-5个核苷酸。核苷酸可以是a,t,c或g残基或其某种组合、变体或修饰形式。连接器可以由无碱基位点组成。重要的是,当存在时,接头序列不与任何半对接位点中的序列结合。相反,接头的作用是使5'和3'结构域彼此充分分开,以便它们可以结合它们在半对接位点上互补序列。在一些实施方案中,接头结构域可以仅由t残基例如t,tt,ttt,tttt或ttttt组成。在一些实施方案中,接头结构域可以仅由a残基例如a,aa,aaa,aaaa或aaaaa组成。在一些实施方案中,接头结构域可以仅由c残基例如c,cc,ccc,cccc或ccccc组成。在一些实施方案中,接头结构域可以仅由g残基例如g,gg,ggg,gggg或ggggg组成。因此,接头可以是例如由仅a(多聚a),t(多聚t),c(多聚c)或g(多聚g)组成的同聚物。为了进行体外分析,如图1c所示意显示的,在其四角用ppaint寡核苷酸对dna折纸结构(纳米结构)进行“标记”。当存在一对ppaint寡核苷酸时,使用cy3b标记的成像链获得dna-paint超分辨率荧光图像。当只有ppaint寡核苷酸中的一个存在时,没有获得可见的踪迹。与靶特异性结合伴侣缀合的ppaint寡核苷酸被设计成具有短的互补(茎或稳定)结构域,其将瞬时结合(彼此杂交)。茎结构域的平均结合时间比成像链-对接位点结合的平均结合时间要长。因此,茎结构域赋予对接位点复合物一定程度的稳定性,以增加成像链结合的可能性。成像链结合对接位点的5'-末端(由一个寡核苷酸赋予)和对接位点的3'-末端(由另一个寡核苷酸赋予)。图1b所示的成像链包含5'和3'结构域,每个结构域与半对接位点结合,中间具有接头结构域。该成像链可能会比以前使用的成像链更长。所增加的长度补偿了在中间具有小环的热力学损失(图1b)。本公开尤其提供了用于检测各种靶之间的相互作用的方法,诸如至少两个(例如2,3,4或5个)蛋白质之间的相互作用,或者蛋白质与其他部分之间的相互作用。本公开的方法可以用于研究细胞中或细胞裂解物中的相互作用。另外,它们可以用于研究体外靶之间的相互作用,例如作为筛选测定或平台的一部分。对接位点、半对接位点和半对接链在本文提供的方法中,“对接位点”包括两个“半对接位点”,由靶特异性结合伴侣贡献每个半位点。因此,当两个靶彼此复合时,与两个靶结合的结合伴侣将彼此紧密接近,缀合至结合伴侣的寡核苷酸也将如此。当寡核苷酸彼此紧密接近时,它们一起形成成像链可以杂交的完全对接位点。如果靶不复合,则结合伴侣不太可能位于彼此足够接近的位置,并且它们所结合的寡核苷酸将不会彼此发生相互作用,因此不会形成对接位点。该系统及其组分被设计成使得成像链在观察这种结合所需的时间内不会结合到任何一个半对接位点。因此,成像链结合需要两个半对接位点的组合。只有当成像链被结合时,才能获得来自焦平面的可检测信号。未结合的成像链通常在焦平面之外,因此不能被检测到,尽管它们可能会造成噪声。缀合至结合伴侣的寡核苷酸各自包含半对接位点结构域、稳定(或茎)结构域、任选的半对接位点结构域和稳定结构域之间的间隔区结构域,以及任选在缀合至结合伴侣的寡核苷酸的末端和稳定结构域之间的间隔区结构域。半对接位点结构域是与由缀合至另一结合伴侣的寡核苷酸赋予的另一半对接位点结构域组合以形成互补成像链所结合的完全对接位点的核苷酸序列。稳定结构域是与缀合至另一个结合伴侣的寡核苷酸中的另一个稳定结构域互补的核苷酸序列。当两个靶发生相互作用并且这些寡核苷酸处于足够紧密接近的位置时,它们通过它们的稳定结构域彼此杂交以形成双链茎结构域。这样的杂交有助于稳定由两个半对接位点结构域的组合形成的完全对接位点。寡核苷酸可以任选地包含1或2个间隔区结构域。间隔区结构域可以促进寡核苷酸彼此的杂交和/或成像链与对接位点的杂交。寡核苷酸通常是单链的,尽管它可以在缀合至另一个结合伴侣的另一个寡核苷酸结合之前包含双链区域。本公开考虑到两个寡核苷酸之间的经由其稳定结构域的杂交将比成像链与对接位点的结合更稳定。本公开进一步设想,两个复合物彼此的结合将比两个寡核苷酸之间的杂交更稳定。换句话说,各种相互作用的自由能如下:靶-靶相互作用>寡核苷酸-寡核苷酸杂交>成像链-对接位点。完全对接位点可长约8个核苷酸至约60个核苷酸,约8至约50个核苷酸,约8至约40个核苷酸,约8至约30个核苷酸,约8至约20个核苷酸,约8至约15个核苷酸,或约10至约14个核苷酸,包括8,9,10,11,12,13或14个核苷酸。在一些实施方案中,完全对接位点长8-14个核苷酸,或者9-13个核苷酸,或者10-12个核苷酸。成像链长度通常至少是完全对接位点的长度。半对接位点的长度范围从约4个核苷酸到约100个核苷酸。在一些实施方案中,对接链长约4至约20个核苷酸,约4至约10个核苷酸,包括4,5,6,7,8,9或10个核苷酸。在一些实施方案中,对接链长4至50,或4至100个核苷酸。例如,对接链可长4至10,4至15,4至20,4至25,4至30,4至35,4至40,4至45,4至50,4至55,4至60,4至65,4至70,或4至75个核苷酸。半对接位点可给完全对接位点贡献数量相等的核苷酸,或者它们可给完全对接位点贡献数量不等的核苷酸。例如,半对接位点可以各自贡献4,5,6,7或更多个核苷酸。在一些实施方案中,半对接位点各自贡献4或5个核苷酸。半对接位点贡献5个核苷酸,或6个核苷酸,或7个核苷酸。稳定结构域或茎结构域可以长约8至约20个核苷酸,或约8至约15个核苷酸,包括长8,9,10,11,12,13或14个核苷酸。寡核苷酸可以包含稳定结构域和半对接位点结构域之间的间隔区结构域。例如,这样的间隔区结构域可以长1-5个核苷酸。核苷酸可以是t残基,或者它们可以是无碱基残基。这样的间隔区结构域不应与成像链杂交。在一些实施方案中,在稳定结构域与半对接位点之间不存在间隔区结构域。寡核苷酸可以包含寡核苷酸的缀合末端和稳定结构域之间的间隔区结构域。该间隔区结构域可以长1-100个核苷酸或更长,包括例如长5-100个核苷酸。间隔区结构域可以至多5,10,20,30,40,50,60,70,80,90和100个核苷酸。在一些实施方案中,间隔区结构域长至多或约为40nm,包括约2.5nm,5nm,10nm,15nm,20nm,30nm,或更长。成像链“成像链”是与对接位点瞬时结合的单链核酸(例如dna)。成像链的长度可能与对接位点的长度大致相同。因此,没有接头结构域,成像链可以长约8个核苷酸至约50个核苷酸,约8至约40个核苷酸,约8至约30个核苷酸,约8至约20个核苷酸,约8至约15个核苷酸,或约10至约14个核苷酸,包括长8,9,10,11,12,13或14个核苷酸。在一些实施方案中,在不存在接头结构域或序列的情况下,成像链长8-14个核苷酸,或长9-13个核苷酸,或长10-12个核苷酸。在一些实施方案中,成像链长14个核苷酸,包含5'和3'结构域(各自长6个核苷酸)以及2个核苷酸的接头。在一些实施方案中,成像链长8-20个核苷酸,包含5'和3'结构域(各自长4-8个核苷酸)以及1-4个核苷酸的接头。成像链与完全对接位点互补并瞬时结合。如果两个核酸或核酸结构域彼此碱基配对或结合以通过watson-crick相互作用形成双链核酸分子,则两个核酸或核酸结构域彼此“互补”。如本文所用,“结合”是指由于例如生理条件下的静电、疏水、离子和/或氢键相互作用而导致的至少两个分子之间的缔合。如果成像链与对接位点的互补区域结合并且然后在短时间内从对接位置解离(解除结合),则认为成像链与对接位置“瞬时结合”。在一些实施方案中,这些相互作用可以在室温下进行。在一些实施方案中,成像链保持与对接链结合约0.1至约10,或约0.1至约5秒。例如,成像链可保持与对接链结合约0.1,约1,约5或约10秒。在接头结构域的存在下,成像链可比上述长度至少长1-5个核苷酸。本公开的成像链可以标记有可检测标记(例如,荧光标记,在这种情况下它们被认为是“荧光标记的”)。例如,在一些实施方案中,成像链可以包含至少一个(即,一个或多个)荧光团。根据本公开使用的荧光团的实例包括但不限于呫吨衍生物(例如荧光素,罗丹明,俄勒冈绿,伊红和德克萨斯红),花青衍生物(例如花青,吲哚羰花青,氧杂羰花青,硫代羰花青和部花青),萘衍生物(例如丹酰和普罗丹衍生物),香豆素衍生物,二唑衍生物(例如吡啶并唑,硝基苯并二唑和苯并二唑),芘衍生物(例如级联蓝),嗪衍生物(例如尼罗红,尼罗蓝,甲酚紫和嗪170),吖啶衍生物(例如二氨基吖啶,吖啶橙和吖啶黄),芳基次甲基衍生物(例如金胺,结晶紫和孔雀石绿),和四吡咯衍生物(例如卟吩,酞菁和胆红素)。根据本公开可以使用其他可检测标记,例如金纳米颗粒或其他可检测的颗粒或部分。在一些实施方案中,成像链以靶特异性方式被标记。这意味着特异性针对复合物a的成像链用光谱上能够明确区分的标记进行标记。如本文所用,“光谱上能够明确区分的”标记是指具有不同光谱信号或波长的标记(例如荧光团)。例如,用cy2荧光团标记的成像链发射波长约510nm的信号,而用cy5荧光团标记的成像链发射波长约670nm的信号。因此,cy2标记的成像链与cy5标记的成像链是光谱上能够明确区分的。相反,“光谱上不能明确区分的”标记是具有相同光谱信号或波长的标记-也就是说,标记的发射波长不能用于区分两个光谱上不能明确区分的荧光标记,因为波长相同或紧靠在一起。在一些实施方案中,成像链以非靶特异性方式被标记。成像链可能标记有相同的标记或光谱上不能明确区分的标记。本文提供的方法可以用于检测多个相互作用,并且以这种方式,这些方法可以被称为多重方法或测定。不同的相互作用可以在时间上相互区分,或者通过使用光谱上能够明确区分的信号,或者通过成像链对接位点相互作用的闪烁频率的差异来区分。不同的靶可以顺序而不是同时的不同的成像链进行时间上的区分。例如,使用对第一相互作用特异性的第一成像链来检测第一相互作用的存在,然后使用对第二相互作用特异性的第二成像链来检测第二相互作用的存在等。不同的成像链指具有检测不同对接位点的不同核苷酸序列的成像链。不同的靶可以使用标记有光谱上能够明确区分的标记的不同的成像链进行光谱上的区分。例如,使用具有cy2标记的第一成像链来检测第一相互作用,并且使用具有cy5标记的第二成像链来检测第二相互作用。这些光谱上能够明确区分成像链可以同时使用。不同的靶可以通过具有不同闪烁频率的成像链-对接位点组合来区分。如本文所述,可以调节成像链-对接点相互作用的闪烁频率,以便具有限定的和不同的on和/或off率。这样,一些成像链-对接位点对可能以更高的频率结合和解除结合,从而比其他对更频繁地“闪烁”。这样,成像链可以标记有光谱上不能明确区分的标记,包括相同的标记,但由于它们的闪烁频率不同,所以仍然同时使用。通过改变成像链长度和相应的对接位点,改变序列组成(例如,更富含at或更富含gc),使用包括例如改变杂交条件、改变每个靶对接位点的数量、增加成像链的浓度的其它方法改变解链温度等可以调节闪烁频率。结合伴侣该方法可以用于检测针对其存在或可以产生结合伴侣的几乎任何部分的相互作用,只要这种结合伴侣可以与寡核苷酸缀合。与寡核苷酸缀合的结合伴侣在此可以被称为结合伴侣-核酸(bp-na)缀合物或结合伴侣-寡核苷酸(bp-oligo)缀合物。如本文所用,bp-na或bp-oligo缀合物是指与单链核酸(例如dna)连接(例如通过n-羟基琥珀酰亚胺(nhs)接头)的分子。单链核酸包含半对接位点、稳定结构域和任选的间隔区结构域。结合伴侣可以是对感兴趣的靶如生物分子(例如蛋白质或核酸)具有亲和性(例如结合)的任何部分(例如,抗体或适体)。在一些实施方案中,结合伴侣是蛋白质。用于本公开缀合物的蛋白质的实例包括但不限于抗体(例如单克隆抗体),抗原结合抗体片段(例如fab片段),受体,肽和肽适体。可以根据本公开使用其他结合伴侣。例如,本文考虑通过静电(例如静电颗粒)、疏水或磁性(例如磁性颗粒)相互作用结合靶的结合伴侣。如本文所用,“抗体”包括全长抗体及其任何抗原结合片段(例如“抗原结合部分”)或单链。术语“抗体”包括但不限于包含通过二硫键相互连接的至少两条重链(h)和两条轻链(l)的糖蛋白或其抗原结合部分。抗体可以是多克隆或单克隆的;异种的、同种异体的或同基因的;或其修饰形式(例如人源化,嵌合)。如本文所用,抗体的“抗原结合部分”是指保留与抗原特异性结合的能力的抗体的一个或多个片段。抗体的抗原结合功能可以通过全长抗体的片段来进行。包含在术语抗体的“抗原结合部分”内的结合片段的实例包括(i)fab片段,由vh,vl,cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,在铰链区包含由二硫桥连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vh和vl结构域组成的fv片段,(v)由vh结构域组成的dab片段(wardetal.,nature341:544546,1989)和(vi)分离的互补决定区(cdr)或(vii)两个或更多个分离的cdr的组合,其可任选地通过合成接头连接。此外,尽管fv片段的两个结构域vh和vl由分开的基因编码,但是可以使用重组方法通过合成接头将它们连接起来,使得它们能够被制成单一蛋白质链,其中vh和vl区配对以形成单价分子(称为单链fv(scfv);参见例如birdetal.science242:423426,1988;和hustonetal.proc.natl.acad.sci.usa85:5879-5883,1988)。这样的单链抗体也包含在术语抗体的“抗原结合部分”中。使用本领域技术人员已知的常规技术获得这些抗体片段,并且以完整抗体的相同方式筛选片段的实用性。如本文所用,“受体”是指与配体(例如肽或小分子(例如,低分子量(<900道尔顿)的有机或无机化合物)结合的细胞衍生的分子(例如蛋白质)。如本文所用,“肽适体”是指具有插入恒定支架蛋白中的可变肽序列的分子(参见例如bainesic,etal.drugdiscov.today11:334–341,2006)。在一些实施方案中,bp-na缀合物的分子是核酸,例如核酸适体。如本文所用,“核酸适体”是指可以形成能够特异性结合蛋白质或其他细胞靶的二级和三级结构的小rna或dna分子(参见例如nix,etal.currmedchem.18(27):4206–4214,2011)。因此,在一些实施方案中,bp-na缀合物可以是适体-核酸缀合物。在重要的实施方案中,结合伴侣是与感兴趣的靶结合的抗体或抗原结合抗体片段。靶靶可以是感兴趣的任何分子或感兴趣的分子(例如生物分子)上的任何结合位点。靶的实例包括但不限于蛋白质和核酸(dna和/或rna,如mrna)。蛋白质的实例包括但不限于酶、参与细胞信号传导、配体结合和/或定位的蛋白质、以及结构蛋白质。在一些实施方案中,靶是蛋白质的表位。一对靶可以是一对相同类型的分子或一对不同类型的分子。例如,一对靶可以包括蛋白a和核酸a、蛋白a和蛋白b或核酸a和核酸b。方法本文还提供了检测样品中两个靶(至少一个)的复合物的方法,所述方法包括使样品接触段落29-44中任一的成像链和段落29-44中任一的结合伴侣-寡核苷酸缀合物,其中(a)的结合伴侣具有针对两个靶中的一个的特异性,(b)的结合伴侣具有针对两个靶中的另一个的特异性;并检测样品中复合物的存在或不存在。样品可以是生物样品,例如包括血液(例如血清和/或血浆)样品,脑脊液样品,尿液样品或其他生物样品的组织样品。在一些实施方案中,样品是细胞或细胞裂解物。例如,细胞可以是哺乳动物细胞,细菌细胞,酵母细胞或昆虫细胞。本文涵盖其他细胞和细胞的裂解物。在一些实施方案中,靶是生物分子,如蛋白质或核酸。感兴趣的蛋白质的实例包括但不限于酶,涉及细胞信号传导、配体结合和/或定位的蛋白质以及结构蛋白质。核酸的实例包括但不限于天然存在的或工程改造的(例如合成的或重组的)dna和rna(例如mrna)。在一些实施方案中,靶复合物位于彼此的子衍射距离内。也就是说,当使用光学成像系统(例如显微镜)时,相互作用靶的分辨率受到衍射限制(由于衍射,任何光学系统的分辨率具有基本的最大值)。进行方法的条件可由本领域普通技术人员在理解核酸杂交动力学的情况下确定。这样的条件可能会有所不同。例如,根据需要,可以在具有特定浓度的盐以及允许核酸杂交和“闪烁”动力学的任何其他必需的试剂的反应缓冲液或细胞裂解物中进行靶检测的方法(如上所讨论的)。试剂盒本文还提供了试剂盒。如本文所提供的,试剂盒可以包括例如结合伴侣-寡核苷酸缀合物对,作为单独组分(分别为结合伴侣和寡核苷酸)或作为缀合物(与寡核苷酸连接的结合伴侣)以及具有或不具有标记的成像链。如本文提供的,可以包含在组合物中的任何组分(例如,结合伴侣,核酸,接头等)也可以被包括在其中例如个体组分被包装(例如在分开存储容器中)并一起提供在更大的包装(例如盒子)中。本公开进一步提供由以下编号段落所涵盖的实施方案:1.试剂盒、系统或组合物,包含第一结合伴侣-寡核苷酸缀合物,其包含与第一寡核苷酸连接的第一结合伴侣,其中第一寡核苷酸包含第一半对接结构域、第一稳定结构域和任选的第一间隔区结构域,第二结合伴侣-寡核苷酸缀合物,其包含与第二寡核苷酸连接的第二结合伴侣,其中第二寡核苷酸包含第二半对接结构域、第二稳定结构域和任选的第二间隔区结构域,其中第一和第二稳定结构域彼此互补,并且其中第一和第二半对接结构域线性组合形成完全对接结构域,和成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与第一半对接结构域互补,3’结构域与第二半对接结构域互补。2.根据段落1所述的试剂盒、系统或组合物,其中第一和第二结合伴侣是抗体或抗原结合抗体片段。3.根据段落1或2所述的试剂盒、系统或组合物,其中第一和第二结合伴侣结合第一和第二蛋白质,其中第一和第二蛋白质彼此不同。4.根据段落1-3中任一项所述的试剂盒、系统或组合物,其中第一和第二半对接结构域长5-7个核苷酸。5.根据段落1-4中任一项所述的试剂盒、系统或组合物,其中第一和第二半对接结构域二者长6个核苷酸。6.根据段落1-5中任一项所述的试剂盒、系统或组合物,其中第一和第二稳定结构域长9-11个核苷酸。7.根据段落1-6中任一项所述的试剂盒、系统或组合物,其中成像链长10-12个核苷酸或长12-14个核苷酸。8.根据段落1-7中任一项所述的试剂盒、系统或组合物,其中5’和3’结构域长6个核苷酸。9.根据段落1-8中任一项所述的试剂盒、系统或组合物,其中接头结构域长1-5个核苷酸。10.根据段落1-9中任一项所述的试剂盒、系统或组合物,其中接头结构域包含t残基。11.根据段落1-10中任一项所述的试剂盒、系统或组合物,其中接头结构域包含tt序列。12.根据段落1-11中任一项所述的试剂盒、系统或组合物,其中成像链被可检测地标记。13.根据段落1-12中任一项所述的试剂盒、系统或组合物,其中成像链被荧光标记。14.根据段落1-13中任一项所述的试剂盒、系统或组合物,其中结合伴侣通过链霉抗生物素蛋白和生物素缀合至寡核苷酸。15.根据段落1-14中任一项所述的试剂盒、系统或组合物,进一步包含复合物,所述复合物包含第一和第二靶,其中第一结合伴侣结合或被结合至第一靶,第二结合伴侣结合或被结合至第二靶。16.根据段落15所述的试剂盒、系统或组合物,其中第一和第二靶是蛋白质。17.多个根据段落1-16中任一项所述的试剂盒、系统或组合物,其中不同系统的成像链标记有光谱上能够明确区分的标记。18.多个根据段落1-16中任一项所述的试剂盒、系统或组合物,其中不同系统的成像链标记有光谱上不能明确区分的标记。19.多个根据段落1-16中任一项所述的试剂盒、系统或组合物,其中系统中的至少一个具有能够明确区分于多个试剂盒、系统或组合物中其他系统的闪烁频率。20.检测样品中第一和第二靶的复合物的方法,该方法包括:使样品接触(a)根据段落1-16中任一项所述的第一和第二结合伴侣-寡核苷酸缀合物,其中第一结合伴侣具有针对第一靶的特异性,第二结合伴侣具有针对第二靶的特异性,和(b)根据段落1-16中任一项所述的成像链;并且检测样品中第一和第二靶的复合物的存在。21.根据段落20所述的方法,其中样品是细胞或细胞裂解物。22.根据段落20或21所述的方法,其中第一和/或第二靶是蛋白质。23.根据段落20-22中任一项所述的方法,其中靶获得自细胞或细胞裂解物。24.根据段落20-23中任一项所述的方法,其中该方法检测多个复合物。25.根据段落24所述的方法,其中多个复合物是多个相同复合物。26.根据段落24所述的方法,其中多个复合物是多个不同复合物。27.根据段落24-26中任一项所述的方法,其中其多个复合物内复合物的子集位于彼此的子衍射距离内。28.试剂盒、系统或组合物,包含第一结合伴侣-寡核苷酸缀合物,其包含与第一寡核苷酸连接的第一结合伴侣,其中第一寡核苷酸包含第一半对接结构域、第一稳定结构域和任选的第一间隔区结构域,第二结合伴侣-寡核苷酸缀合物,其包含与第二寡核苷酸连接的第二结合伴侣,其中第二寡核苷酸包含第二半对接结构域、第二稳定结构域和任选的第二间隔区结构域,其中第一和第二稳定结构域彼此互补,并且其中第一和第二半对接结构域线性组合形成第一完全对接结构域,第三结合伴侣-寡核苷酸缀合物,其包含与第三寡核苷酸连接的第三结合伴侣,其中第三寡核苷酸包含第三半对接结构域、第三稳定结构域和任选的第三间隔区结构域,其中第一和第三稳定结构域彼此互补,并且其中第一和第三半对接结构域线性组合形成第二完全对接结构域,第一成像链,其包含第一5’结构域、第一3’结构域和位于第一5’结构域和第一3’结构域之间的第一接头结构域,其中第一5’结构域与第一半对接结构域互补,第一3’结构域与第二半对接结构域互补,和第二成像链,其包含第二5’结构域、第二3’结构域和位于第二5’结构域和第二3’结构域之间的第二接头结构域,其中第二5’结构域与第一半对接结构域互补,第二3’结构域与第三半对接结构域互补。29.组合物,其包含:(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣;(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣;其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域;和(c)成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补。30.根据段落29所述的组合物,其中(a)和(b)的结合伴侣中的每一个是抗体或抗原结合抗体片段。31.根据段落29或30所述的组合物,其中(a)和(b)的结合伴侣中的每一个结合不同的蛋白质。32.根据段落29-31中任一项所述的组合物,其中(a)和(b)的半对接结构域中的每一个长5-15个核苷酸。33.根据段落32所述的组合物,其中(a)和(b)的半对接结构域中的每一个长5-10个核苷酸。34.根据段落29-33中任一项所述的组合物,其中(a)和(b)的稳定结构域中的每一个长5-50个核苷酸。35.根据段落34所述的组合物,其中成像链长10-30个核苷酸。36.根据段落29-35中任一项所述的组合物,其中成像链的5’结构域和3’结构域中的每一个长5-10个核苷酸。37.根据段落29-36中任一项所述的组合物,其中接头结构域长1-5个核苷酸。38.根据段落29-37中任一项所述的组合物,其中接头结构域包含胸腺嘧啶(t)核苷酸。39.根据段落29-38中任一项所述的组合物,其中接头结构域包含tt序列。40.根据段落29-39中任一项所述的组合物,其中成像链被可检测地标记。41.根据段落29-39中任一项所述的组合物,其中成像链被荧光标记。42.根据段落29-41中任一项所述的组合物,其中(a)和(b)的结合伴侣中的每一个通过链霉抗生物素蛋白-生物素结合对各自缀合至(a)和(b)的寡核苷酸。43.根据段落29-42中任一项所述的组合物,其还包含复合物,所述复合物包含两个靶,其中(a)的结合伴侣结合或被结合至两个靶中的一个,(b)的结合伴侣结合或被结合至两个靶中的另一个。44.根据段落43所述的组合物,其中两个靶中的每一个是蛋白质。45.多个根据段落29-44中任一项所述的组合物,其中多个组合物内的不同组合物的成像链包含光谱上能够明确区分的标记。46.多个根据段落29-44中任一项所述的组合物,其中多个组合物内的不同组合物的成像链包含光谱上不能明确区分的标记。47.多个根据段落29-44中任一项所述的组合物,其中多个组合物中组合物中的至少一个具有能够明确区分于多个组合物中其它组合物的闪烁频率。48.检测样品中两个靶的复合物的方法,该方法包括:使样品接触段落29-44中任一的成像链和段落29-44中任一的结合伴侣-寡核苷酸缀合物,其中(a)的结合伴侣具有针对两个靶中的一个的特异性,(b)的结合伴侣具有针对两个靶中的另一个的特异性;并且检测样品中复合物的存在或不存在。49.根据段落48所述的方法,其中样品是细胞或细胞裂解物。50.根据段落48或49所述的方法,其中两个靶中的每一个是蛋白质。51.根据段落50所述的方法,其中两个靶中的每一个获得自细胞或细胞裂解物。52.根据段落48-51中任一项所述的方法,还包括检测样品中两个靶的多个复合物。53.根据段落48-52中任一项所述的方法,其中多个复合物是多个不同复合物。54.根据段落48-53中任一项所述的方法,其中多个复合物内复合物的子集位于彼此的子衍射距离内。55.检测样品中分子内相互作用的方法,该方法包括:使包含靶分子的样品接触:(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(a)的结合伴侣具有针对靶分子上一个位置的特异性,(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣,其中(b)的结合伴侣具有针对靶分子上另一个位置的特异性,其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成完全对接结构域,和(c)成像链,其包含可检测标记、5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中5’结构域与(a)的半对接结构域互补,3’结构域与(b)的半对接结构域互补;并且检测样品中(c)的成像链的可检测标记的存在或不存在。56.根据段落55所述的方法,其中样品是细胞或细胞裂解物。57.根据段落55或56所述的方法,其中靶分子是蛋白质。58.根据段落57所述的方法,其中(a)和(b)的位置中的每一个是该蛋白质上的不同表位。59.组合物,其包含(a)第一结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣;(b)第二结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣;其中(a)和(b)的稳定结构域彼此互补,并且其中(a)和(b)的半对接结构域线性组合形成第一完全对接结构域;(c)第三结合伴侣-寡核苷酸缀合物,其包含与包含半对接结构域、稳定结构域和任选的间隔区结构域的寡核苷酸连接的结合伴侣;其中(a)和(c)的稳定结构域彼此互补,并且其中(a)和(c)的半对接结构域线性组合形成第二完全对接结构域;(d)第一成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中第一成像链的5’结构域与(a)的半对接结构域互补,第一成像链的3’结构域与(b)的半对接结构域互补;和(e)第二成像链,其包含5’结构域、3’结构域和位于5’结构域和3’结构域之间的接头结构域,其中第二成像链的5’结构域与(a)的半对接结构域互补,第二成像链的3’结构域与(c)的半对接结构域互补。实施例实施例1在本实施例中,分析了接头的长度和设计。将由2、3或4个胸腺嘧啶(t)残基组成的接头彼此进行比较。除此之外,在半对接位点结构域和茎(或稳定)结构域之间的ppaint寡核苷酸中的一个中引入1或2个t残基的短间隔区。图2a显示了这些不同的成像链和寡核苷酸。使用中间为tttt、ttt和tt接头的三种类型的成像链(以橙色显示)评估在茎结构域和一个半对接结构域之间有tt、t和没有间隔区的三种类型的对接位点(以绿色显示)。分析这些组合的特征动力学参数。如图2b所示,基于动力学分析选择相对于对接位点的性能最好的成像链。如图2c所示,该对用于确定长度范围为9-11bp的茎设计库中的最佳茎长度。在另一个实验中,在成像链结合之前将ppaint寡核苷酸保持在一起的茎结构域的长度最初通过尝试9、10和11bp茎结构域来确定(表1列出了每个长度的实例序列),其中两条链位于在每个实验中彼此之间的距离为0.35nm。从这些结果中,如图3和4所示,我们得出结论:在5'和3'结构域之间具有tt接头的成像链和没有间隔区的对接位点表现最好,具有最长的平均结合时间和最大的kon。从这些结果中,如图5和6所示,我们得出结论:最好的茎结构域长11和10bp。这两个长度都应该呈现一个可以瞬时结合但是足够长的时间以使得成像链能够结合至对接位点的茎结构域。表1.在优化过程中测试的茎结构域的序列茎的名称序列s9v25’-gatgacatc-3’(seqidno:1)s10v25’-taataaggat-3’(seqidno:2)s11v15’-ctaactaatta-3’(seqidno:3)在选择成像链和两个半对接位点的序列之后,这些在dna折纸结构中再次以彼此之间距离5和20nm进行测试。如图7所示,在该实施例中得到了dna-paint信号,由此证明ppaint的工作范围至少为20nm。实施例2本实施例描述了基准测试原位ppaint实验。选择α和β微管蛋白作为两个靶。阳性对照(上面三个图)包括使用针对α和β微管蛋白的一抗和针对其每个一抗靶的二抗,每个标记有ppaint基序中的一个(图8)。当用pp1、p16和p38成像时,微管是可见的。阴性对照包括仅添加一抗之一和两种二抗。对于第一个阴性对照,仅添加抗α微管蛋白(中间三个图),因此当仅使用p16时,微管是可见的。对于第二个阴性对照,仅加入抗β微管蛋白,当仅使用p38时,观察到微管。利用图1a-1e中描述的实施方案,ppaint能够用于通过使用例如仅需要pbs洗掉过量的寡核苷酸标记的抗体的传统免疫标记技术来检测蛋白质相互作用。探针之间的距离范围:至多10nmpp1.motif1.10nm:atacaacgaactattcgttagtttgttt(seqidno:4)pp1.motif2.10nm:tatttagtgttcgaatagttcgatctag(seqidno:5)探针之间的距离范围:至多15nmpp1.motif1.15nm:atacaacgaactattcgttagtttgttttttt(seqidno:6)pp1.motif2.15nm:tttttatttagtgttcgaatagttcgatctag(seqidno:7)参考文献betzig,e.,patterson,g.,sougrat,r.,lindwasser,o.,olenych,s.,bonifacino,j.,etal.(2006).imagingintracellularfluorescentproteinsatnanometerresolution.science,313,1642-5.hell,s.&.(1994).breakingthediffractionresolutionlimitbystimulatedemission:stimulated-emission-depletionfluorescencemicroscopy.optlett,19,780-2.hu,c.,chinenov,y.,&kerppola,t.(2002).visualizationofinteractionsamongbzipandrelfamilyproteinsinlivingcellsusingbimolecularfluorescencecomplementation.molecularcell,9,789-798.jungmann,r.,steinhauer,c.,scheible,m.,kuzyk,a.,&tinnefeld,p.&.(2010).single-moleculekineticsandsuper-resolutionmicroscopybyfluorescenceimagingoftransientbindingondnaorigami.nanoletters,10,4756-4761.liu,z.,xing,d.,su,q.p.,zhu,y.,zhang,j.,kong,x.,etal.(2014).super-resolutionimagingandtrackingofprotein–proteininteractionsinsub-diffractioncellularspace.naturecommunications,5.rust,m.j.,bates,m.,&zhuang,x.(2006).sub-diffraction-limitimagingbystochasticopticalreconstructionmicroscopy(storm).naturemethods,3,793-5.o.,gullberg,m.,jarvius,m.,k.,leuchowius,k.,jarvius,j.,etal.(2006).directobservationofindividualendogenousproteincomplexesinsitubyproximityligation.naturemethods,3,995-1000.winckler,p.,lartigue,l.,giannone,g.,degiorgi,f.,ichas,f.,sibarita,j.-b.,etal.(2013).identificationandsuper-resolutionimagingofligand-activatedreceptordimersinlivecells.scientificreports,3.本文所公开的所有参考文献、专利和专利申请通过引用并入其引用的每个主题,在一些情况下可涵盖整个文件。在说明书和权利要求书中使用的不定冠词“a”和“an”,除非有相反的明确说明,应理解为表示“至少一个”。还应该理解的是,除非有相反的明确说明,否则在本文所要求的包括多于一个步骤或行为的任何方法中,该方法的步骤或行为的顺序不一定限于所叙述的该方法的步骤或者行为。在权利要求书以及以上说明书中,所有过渡性短语诸如“包含”,“包含”,“带有”,“具有”,“含有”,“涉及”,“拥有”,“由...组成(composedof)”等应被理解为是开放式的,即意味着包括但不限于。如美国专利局专利审查程序手册第2111.03节所述,只有过渡性短语“由...组成(consistingof)”和“基本上由...组成”应分别是封闭式或半封闭式过渡短语。序列表<110>哈佛学院院长及董事<120>蛋白质-蛋白质相互作用的超分辨成像<130>h0498.70557wo00<140>尚未分配<141>同时提交<150>us62/202,327<151>2015-08-07<160>7<170>patentinversion3.5<210>1<211>9<212>dna<213>人工序列<220><223>合成多核苷酸<400>1gatgacatc9<210>2<211>10<212>dna<213>人工序列<220><223>合成多核苷酸<400>2taataaggat10<210>3<211>11<212>dna<213>人工序列<220><223>合成多核苷酸<400>3ctaactaatta11<210>4<211>28<212>dna<213>人工序列<220><223>合成多核苷酸<400>4atacaacgaactattcgttagtttgttt28<210>5<211>28<212>dna<213>人工序列<220><223>合成多核苷酸<400>5tatttagtgttcgaatagttcgatctag28<210>6<211>32<212>dna<213>人工序列<220><223>合成多核苷酸<400>6atacaacgaactattcgttagtttgttttttt32<210>7<211>32<212>dna<213>人工序列<220><223>合成多核苷酸<400>7tttttatttagtgttcgaatagttcgatctag32当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1