表面共价有机框架材料修饰的磁性纳米材料及制备、应用的制作方法
本发明涉及功能化磁性纳米材料技术领域,特别涉及一种表面共价有机框架材料修饰的磁性纳米材料及制备、应用。
背景技术:
人热休克蛋白90α(heatshockprotein90α,hsp90α)是遗传上高度保守的热休克蛋白家族成员之一。作为一种atp依赖的分子伴侣,hsp90α可以调节多种底物蛋白活性进而参与到复杂的生命活动中。除了在细胞内行使分子伴侣作用,最近研究表明,hsp90α还可被肿瘤细胞分泌到细胞外。并且,在多种癌症患者血浆中已检测到hsp90α,其表达水平与肿瘤恶性程度呈一定相关性。目前,hsp90α蛋白的定量检测方法主要涉及酶联免疫吸附法(enzymelinkedimmunosorbentassay,elisa)。然而,该方法存在费时费力、试剂昂贵、定量重复性差等问题。近年来,质谱成为生物标志物定量分析的有力工具。然而由于hsp90α在血液中含量极低(ng/ml),因此在质谱检测前,对hsp90α蛋白进行有效的富集分离是质谱定量分析的关键。
最近,基于磁性纳米颗粒的免疫亲和材料由于具有易操作、易修饰、对目标物分离的高特异性和高灵敏度特点,受到越来越多人的关注。通常,抗体通过物理吸附或共价修饰无序地固定在材料表面。物理吸附法中,抗体通过静电引力、范德华力、亲水相互作用力等非共价力结合,导致该方法固载的抗体易脱落、实验重复性差等。因此,通过共价键固定抗体成为常用方法。然而在该方法中,抗体通过赖氨酸无规律地固定在磁性载体表面,其表面活性位点可能被掩盖,直接影响抗原抗体结合效率。人们将目光投向可有序固载抗体的基质材料,如二维或三维的dna四面体结构材料,其特殊结构为抗体有序固载提供空间限制,然而该类材料的应用受到材料连接臂可变性的限制。共价有机框架材料(covalentorganicframeworks,cofs)是一类由有机单元通过共价键有序构筑的新型多孔结晶材料。cofs材料具有有序排列的活性反应位点,较大比表面积,良好的化学和结构稳定性等优点。然而,由于构成cofs材料的元素主要为碳、氮、氧、硼等质量较轻元素,在溶液中分离需要引入离心步骤,这样既费时又不方便。
技术实现要素:
本发明的目的是提供一种表面共价有机框架材料修饰的磁性纳米材料、制备方法及应用,该材料合成方法简单、快速;首次建立了肿瘤标志物hsp90α的高效富集分离方法;可实现复杂人血浆基质中低浓度(1ug/ml)hsp90α的富集检测。
本发明的技术方案如下:
一种表面共价有机框架材料修饰的磁性纳米材料,包括氨基基团修饰的磁性纳米颗粒、以沉淀聚合方式生长在所述氨基基团修饰的磁性纳米颗粒表面的共价有机框架材料层、通过所述共价有机框架材料层表面活性基团固定的连接臂、通过所述共价有机框架材料层表面活性基团固定的hsp90α多克隆抗体和用于封闭多余活性反应位点的封端试剂。
进一步的,所述表面共价有机框架材料修饰的磁性纳米材料的结构式如下:
其中,
进一步的,将氨基基团修饰在磁性纳米材料表面所采用的试剂为1,6-己二胺
将共价有机框架材料层生长在氨基基团修饰的磁性纳米颗粒表面所采用的有机配体为1,3,5-三甲酰基间苯三酚(tp)和联苯胺(bd);
所述连接臂为辛二酸双(n-羟基琥珀酰亚胺酯);
所述封端试剂为氨基三甘醇单甲醚。
进一步的,所述磁性纳米颗粒为fe3o4磁性纳米颗粒,如γ-fe3o4磁性纳米颗粒;所述磁性纳米颗粒的粒径为20~200nm,如30~100nm;所述共价有机框架材料层的厚度可为100~300nm,如150~200nm。
本发明还提供了一种表面共价有机框架材料修饰的磁性纳米材料的制备方法,包括如下步骤:
(1)在磁性纳米颗粒表面修饰氨基,得到产物ⅰ;
(2)在所述产物ⅰ表面沉淀聚合共价有机框架材料,得到表面有氨基基团和醛基基团的产物ⅱ;
(3)在所述产物ⅱ表面通过共价键固定连接臂,得到产物ⅲ;
(4)在所述产物ⅲ表面通过活性基团与hsp90α多克隆抗体反应,得到产物ⅳ;所述活性基团包括琥珀酰亚胺基团和醛基基团;
(5)通过封端试剂封闭所述产物ⅳ表面未反应的活性位点,即可得到所述表面共价有机框架材料修饰的磁性纳米材料,即产物v。
进一步的,步骤(1)中,所述磁性纳米颗粒可为氨基修饰的γ-fe3o4磁性纳米颗粒。所述氨基修饰的γ-fe3o4磁性纳米颗粒可按照溶剂热法制得,如在乙二醇溶液中加入六水三氯化铁、无水乙酸钠和1,6-己二胺,得混合溶液;对所述混合溶液依次进行超声、加热处理,冷却后干燥可得到所述氨基修饰的γ-fe3o4磁性纳米颗粒,即可得到产物ⅰ。
在乙二醇溶液中,六水三氯化铁的质量和乙二醇的体积比可为(0.4~2.8)g:(15~80)ml,具体可为1g:30ml;
所述六水三氯化铁与所述无水乙酸钠的质量比可为(0.4~2.8):(0.5~6),具体可为1:4;
所述超声的温度可为25℃,时间可为5~40分钟,具体可为30分钟;
所述加热的温度可为200℃,时间可为6~10小时,具体可为8小时。
步骤(2)中,可采用溶剂热法在所述氨基修饰的磁性纳米材料表面修饰共价有机框架材料。优选的,可通过如下步骤实施:所述产物ⅰ和所述有机配体1,3,5-三甲酰基间苯三酚(tp)和联苯胺(bd)分散在乙醇溶液中进行超声、加热处理。所述产物ⅰ的质量与所述有机配体tp、bd的质量比可为(30~100)mg:(40~80)mg:(50~120)mg,优选可为35mg:(40~80)mg:(50~120)mg、(30~100)mg:63mg:(50~120)mg、(30~100)mg:(40~80)mg:83mg或35mg:63mg:83mg。
所述超声的温度为20-40℃,如具体可为25℃,时间可为5~40分钟;
所述加热的温度为160-200℃,如具体可为180℃,时间可为30~80小时;
步骤(3)中,所述产物ⅱ表面带有醛基基团和氨基基团,将连接臂与所述产物ⅱ反应,获得表面带有醛基基团和琥珀酰亚胺基团的磁性纳米材料,即可得到产物ⅲ;
在乙腈溶液中,所述产物ⅱ的质量与连接臂的质量比为(0.5~3)mg:(0.1~5)mg,如可为5:1;所述连接臂可为辛二酸双(n-羟基琥珀酰亚胺酯);
步骤(4)中,所述产物ⅲ在pbs缓冲液中与hsp90α多克隆抗体反应,即可得到产物ⅳ;
所述产物ⅲ的质量与hsp90α多克隆抗体的质量比为(0.5~3)mg:(0.1~2)mg,如具体可为5:1;
步骤(5)中,所述产物ⅳ在pbs缓冲液中与封端试剂反应,即可得到产物v;
所述产物ⅳ的质量与封端试剂的质量比为(0.5~3)mg:(10~200)ug;如具体可为12:1;
所述封端试剂为氨基三甘醇单甲醚。
本发明提供了一种上述的表面共价有机框架材料修饰的磁性纳米材料在hsp90α富集中的应用。
本发明还提供了一种上述的表面共价有机框架材料修饰的磁性纳米材料对hsp90α进行富集的方法,利用所述表面共价有机框架材料修饰的磁性纳米材料的免疫亲和吸附hsp90α,用外加磁场分离吸附有hsp90α的所述表面共价有机框架材料修饰的磁性纳米材料,即可实现对所述hsp90α的富集。
进一步的,所述共价有机框架材料修饰的磁性纳米材料与hsp90α的质量比为(10~50):1;如具体可为25:1。
所述hsp90α可以以蛋白质溶液形式存在;所述蛋白质溶液的浓度为100fmol/ml~1umol/ml;如具体可为100fmol/ml~1umol/ml、100pmol/ml、10nmol/ml或1umol/ml;
所述表面共价有机框架材料修饰的磁性纳米材料的质量与hsp90α蛋白溶液的体积比为50ug:(0.1~5)μl,如具体可为25ug:2μl。
所述免疫亲和吸附的步骤如下:将hsp90α和所述表面共价有机框架材料修饰的磁性纳米材料置于pbs缓冲溶液进行震荡孵育;
所述表面共价有机框架材料修饰的磁性纳米材料的质量与pbs缓冲溶液的体积比为50ug:(50~300)μl;如具体可为50ug:200μl。
震荡孵育的频率为10~100rpm,如具体可为15rpm;温度为25~40℃,如具体可为37℃;时间为30~90分钟,如具体可为60分钟;
进一步的,外加磁场分离之后,还包括用洗涤液清洗吸附有hsp90α的表面共价有机框架材料修饰的磁性纳米材料的步骤及对其溶液酶切的步骤;所述洗涤液可依次为tbst缓冲液、碳酸氢铵溶液(如具体可为50mm);所述酶为胰蛋白酶。
本发明还提供了一种hsp90α的质谱分析方法,利用前述方法对hsp90α进行富集,以及对富集得到的hsp90α酶切后进行maldi-tofms分析。
本发明的有益效果为:
(1)通过沉淀聚合方法,在磁性纳米颗粒表面修饰共价有机框架材料;材料合成方法简单、快速。
(2)hsp90α多克隆抗体可通过所述材料表面有序排列的活性基团规律固载在材料表面,避免了抗体因无序排列导致的活性位点掩盖的问题。
(3)通过所述磁性纳米材料与hsp90α的免疫亲和作用,实现hsp90α高特异性、高选择性富集;在复杂人血浆基质中,可实现低浓度(1ug/ml)hsp90α的富集检测。首次建立肿瘤标志物hsp90α的高效富集分离方法。
附图说明
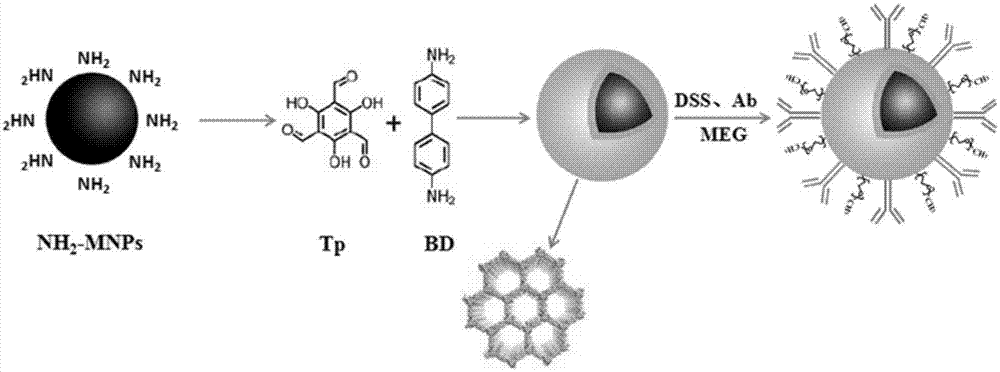
图1所示为表面共价有机框架材料修饰的磁性纳米材料的合成路线示意图。
图2为实施例1中合成过程中产物ⅰ和产物ⅱ的透射电镜照片和扫描电镜照片,其中,图2(a)为氨基修饰的fe3o4纳米颗粒的扫描电镜图,图2(b)为氨基修饰的fe3o4纳米颗粒的透射电镜图;图2(c)为fe3o4@cofs的扫描电镜图,图2(d)为fe3o4@cofs的透射电镜图。
图3为表面共价有机框架材料修饰的磁性纳米材料高效富集hsp90α的流程图。
图4为实例1中表面共价有机框架材料修饰的磁性纳米材料富集前后的hsp90α酶切肽段的maldi-tof质谱图,其中,图4(a)为表面共价有机框架材料修饰的磁性纳米材料富集前的hsp90α酶切肽段的maldi-tof质谱图;图4(b)为表面共价有机框架材料修饰的磁性纳米材料富集后的hsp90α肽段的maldi-tof质谱图。
图5为实施例2中表面共价有机框架材料修饰的磁性纳米材料富集不同质量(100ng,10ng,1ng,0.1ng,0.01ng)hsp90α后的maldi-tof质谱图,其中,图5(a)为表面共价有机框架材料修饰的磁性纳米材料富集100nghsp90α后,酶切肽段的maldi-tof质谱图;图5(b)为表面共价有机框架材料修饰的磁性纳米材料富集10nghsp90α后,酶切肽段的maldi-tof质谱图;图5(c)为表面共价有机框架材料修饰的磁性纳米材料富集1nghsp90α后,酶切肽段的maldi-tof质谱图;图5(d)为表面共价有机框架材料修饰的磁性纳米材料富集0.1nghsp90α后,酶切肽段的maldi-tof质谱图;图5(e)为表面共价有机框架材料修饰的磁性纳米材料富集0.01nghsp90α后,酶切肽段的maldi-tof质谱图。
图6为实施例3中表面共价有机框架材料修饰的磁性纳米材料富集hsp90α和bsa(1:1000)混合物后的酶切肽段的maldi-tof质谱图,其中,图6(a)为表面共价有机框架材料修饰的磁性纳米材料富集hsp90α和bsa混合物前,酶切肽段的maldi-tof质谱图;图6(b)为表面共价有机框架材料修饰的磁性纳米材料富集hsp90α和bsa混合物后,酶切肽段的maldi-tof质谱图。
具体实施方式
下文将结合具体附图详细描述本发明具体实施例。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效果。在下述实施例的附图中,各附图所出现的相同标号代表相同的特征或者部件,可应用于不同实施例中。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用的氨基修饰的磁性纳米颗粒(fe3o4-nh2)通过如下步骤制备得到:称取1.0g六水合三氯化铁,3,6g1,6-己二胺和4g无水乙酸钠,溶解分散于30ml乙二醇溶液中,超声10min,室温下机械搅拌30min,获得均匀透明溶液。将溶液转移至高压反应釜,加热至200℃,反应6h。将所得氨基修饰的磁性颗粒依次用无水乙醇和水清洗3次,50℃干燥过夜。所得氨基修饰的fe3o4磁性纳米颗粒的扫描电镜图和透射电镜图如图2所示,粒径约为30~60nm。
富集了热休克蛋白90α的免疫亲和材料上的酶切过程如下:取富集了hsp90α的免疫亲和材料50ug,分散于50mm碳酸氢铵溶液中,加入终浓度为10mm二硫苏糖醇,100℃变性10min。加入终浓度为20mm碘代乙酰胺,避光烷基化反应30min后,按照50:1(蛋白质/酶)的质量比加入trypsin,37℃下酶切16h。酶切结束后,收集肽段进行质谱鉴定。
热休克蛋白90α和牛血清白蛋白混合物的配制过程如下:称取0.5mghsp90α和0.5mgbsa,分别用0.5ml和0.1mlpbs缓冲液溶解,得到hsp90α溶液(1ug/ul)和bsa溶液(5ug/ul)。按照1:1000(hsp90α:bsa)的摩尔比取两种溶液混合,获得hsp90α和bsa蛋白混合液。
实施例1制备表面共价有机框架材料修饰的磁性纳米材料并对hsp90α进行富集和检测
一、制备表面共价有机框架材料修饰的磁性纳米材料
按照图1所示合成路线示意图制备表面共价有机框架材料修饰的磁性纳米材料,具体步骤如下:
步骤1:制备表面共价有机框架材料修饰的磁性纳米材料(fe3o4@tpbd)
分别称取63mg1,3,5-三甲酰基间苯三酚和83mg联苯胺,置于添加了3mlfe3o4-nh2颗粒的乙醇溶液中,室温超声处理30min,转入高压反应釜,加热至180℃,反应48h。取出反应釜冷却后,将所得材料依次用无水乙醇和水清洗3次,50℃干燥过夜。所得产物(fe3o4@tpbd)的扫描电镜图和透射电镜图如图2所示。
步骤2:制备固定连接臂的磁性cofs材料(fe3o4@tpbd-dss)
取步骤1所得产物置于乙腈溶液中,按照fe3o4@tpbd与连接臂的质量比5:1加入dss,室温反应5h。所得产物用pbs缓冲液清洗3次。
步骤3:制备固定hsp90α多克隆抗体的磁性cofs材料(fe3o4@tpbd-dss-ab)
取步骤2所得产物于pbs溶液中,按照fe3o4@tpbd-dss与hsp90α多克隆抗体的质量比5:1加入抗体,4℃反应过夜。所得产物用pbs缓冲液清洗3次。
步骤4:制备meg封闭的磁性cofs材料(fe3o4@tpbd-dss-ab-meg)
取步骤3所得产物于pbs溶液中,按照fe3o4@tpbd-dss-ab与封闭剂的质量比12:1加入meg,室温反应5h。所得产物用pbs缓冲液清洗3次。
上述制备得到的表面聚合离子液体的磁性纳米材料的结构式如下:
其中,
二、采用上述表面共价有机框架材料修饰的磁性纳米材料对hsp90α进行富集和检测
(1)表面共价有机框架材料修饰的磁性纳米材料对hsp90α富集
按照图3所示流程图对糖肽进行富集和检测,具体步骤如下:
步骤1:取表面共价有机框架材料修饰的磁性纳米材料1ml,然后吸取50μl上述悬浊液,通过外加磁场分离磁性纳米颗粒,并用pbs缓冲液清洗3次。
步骤2:将上述所得磁性纳米材料(50ug)置于200ulpbs缓冲液中,加入2ughsp90α,37℃反应1h。然后在外加磁场作用下,分离富集了hsp90α的磁性纳米颗粒,并依次用200μltbst缓冲液、50mm碳酸氢铵溶液洗涤3次,将所得磁性纳米颗粒分散于50mm碳酸氢铵溶液中进行胰蛋白酶酶解。通过外加磁场分离磁性纳米颗粒,取1μl酶切后的肽段溶液加于maldi靶盘上,待其充分挥发后,滴加1μlchca基质(α-氰基-4-羟基肉桂酸,含0.1%三氟乙酸,溶于60%乙腈中),样品结晶挥发后,进行maldi-tofms分析。
通过对比富集前hsp90α酶解液与富集后hsp90α酶解液的质谱鉴定结果,表明该材料对hsp90α有特异性富集效果。富集前,在hsp90α酶解液的maldi质谱图上,鉴定到的肽段均来自热休克蛋白90α蛋白。经过材料富集后hsp90α酶解液的maldi质谱图中,可以鉴定出来自23条hsp90α肽段,此外质谱图上还存在hsp90α多克隆抗体酶切后肽段峰。此结果表明所制备的磁性纳米颗粒对于hsp90α有着良好的富集作用(图4)。
实施例2表面共价有机框架材料修饰的磁性纳米材料对hsp90α富集灵敏度检测
取表面共价有机框架材料修饰的磁性纳米材料1ml,然后吸取20μl上述表面共价有机框架材料修饰的磁性纳米材料的悬浊液,通过外加磁场分离磁性纳米颗粒,并用pbs缓冲液清洗3次。
将上述所得磁性纳米材料(20ug)置于50ulpbs缓冲液中,加入不同质量(100ng,10ng,1ng,0.1ng,0.01ng)hsp90α,37℃反应1h。然后在外加磁场作用下,分离富集了hsp90α的磁性纳米颗粒,并依次用50μltbst缓冲液、50mm碳酸氢铵溶液洗涤3次,将所得磁性纳米颗粒分散于50mm碳酸氢铵溶液中进行胰蛋白酶酶解。通过外加磁场分离磁性纳米颗粒,取1μl酶切后的肽段溶液加于maldi靶盘上,待其充分挥发后,滴加1μlchca基质(α-氰基-4-羟基肉桂酸,含0.1%三氟乙酸,溶于60%乙腈中),结晶挥发后,进行maldi-tofms分析。
通过对系列低丰度hsp90α进行富集,结果表明发展的磁性纳米材料对hsp90α有高灵敏度富集效果。经过材料富集后,100nghsp90α酶解液的maldi质谱图中可以鉴定到4条hsp90α肽段,当hsp90α含量进一步降低至0.01ng时,仍可以鉴定到2条hsp90α肽段。该结果表明所制备的磁性纳米颗粒可用于hsp90α的高灵敏度富集(图5)。
实施例3表面共价有机框架材料修饰的磁性纳米材料对hsp90α富集特异性检测
取表面共价有机框架材料修饰的磁性纳米材料1ml,然后吸取50μl上述表面共价有机框架材料修饰的磁性纳米材料的悬浊液,通过外加磁场分离磁性纳米颗粒,并用pbs缓冲液清洗3次。
将上述所得磁性纳米材料(50ug)置于200ulpbs缓冲液中,加入hsp90α和bsa混合物(摩尔比1:1000),37℃反应1h。然后在外加磁场作用下,分离富集了hsp90α的磁性纳米颗粒,并依次用200μltbst缓冲液、50mm碳酸氢铵溶液洗涤3次,将所得磁性纳米颗粒分散于50mm碳酸氢铵溶液中进行胰蛋白酶酶解。通过外加磁场分离磁性纳米颗粒,取1μl酶切后的肽段溶液加于maldi靶盘上,待其充分挥发后,滴加1μlchca基质(α-氰基-4-羟基肉桂酸,含0.1%三氟乙酸,溶于60%乙腈中),结晶挥发后,进行maldi-tofms分析。
通过对复杂样品中hsp90α进行富集,结果表明发展的磁性纳米材料对hsp90α有高特异性富集效果。材料富集前,hsp90α和bsa混合物的酶解液的maldi质谱图中检测不到hsp90α肽段,所有质谱峰均对应bsa酶切肽段。经材料富集后,可以成功鉴定到15条hsp90α肽段,同时bsa肽段的峰强度明显下降。以上结果说明所制备的的磁性纳米颗粒可用于hsp90α高特异性富集(图6)。
本文虽然已经给出了本发明的几个实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本文的实施例进行改变。上述实施例只是示例性的,不应以本文的实施例作为本发明权利范围的限定。
- 还没有人留言评论。精彩留言会获得点赞!