一种耐镉芦苇幼苗的人工种子的制备方法与流程
本发明涉及无性繁殖领域,具体为一种耐镉芦苇幼苗的人工种子的制备。
背景技术:
芦苇是广泛分布于世界各地、形态上高度分化的草甸与湿地植被建群种,具有重要的生态学和经济学价值。芦苇在自然环境中以根状茎繁殖为主,难以进行种子繁殖。长期大量的分株繁殖常常会导致种性的退化,从而影响植物的生活力。同时由于人类活动对生态环境的严重干扰,部分湿地重金属污染程度不容乐观。长期处于重金属污染环境中,植物的根茎存活和繁殖往往受到抑制,而导致种群衰退。所以,避免从芦苇原生地采取芦苇而保护原生地生态环境的同时,又如何轻便、快速培育具有重金属耐受性的幼苗,成为恢复芦苇种群研究的瓶颈。
植物可通过有性的和无性的两个生命发育周期来繁殖,对于很难以种子进行有性繁殖的植物种,由微胶囊包埋植物繁殖体制备而成的人工种子,可替代天然种子进行无性繁殖。常规的人工种子研制一直都是建立在植物单独存在的理念之上,即通过离体组织培养产生体细胞胚或不定芽等作为包埋繁殖体,而以植物和微生物共生体为培育材料的研究很少。植物离体组织培养一般建立和维持在无菌条件下,以降低微生物污染物对体外培养的植物材料做有害竞争。而有着生态独特性的植物内生细菌,不仅能和宿主植物协同进化,并能产生具有生物活性的代谢产物而提高植物对生物胁迫或非生物胁迫的抵抗能力。因而引入特定功能的内生细菌来增强人工种子活力和品质,将具有改良植物表型的潜力;因此本发明在离体培养条件下,制备一种耐镉芦苇幼苗的人工种子。
技术实现要素:
本发明的目的在于提供一种耐镉芦苇幼苗的人工种子的制备方法,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:步骤如下:
步骤一:采集成熟芦苇小穗,去内外稃,以表面无损的芦苇种子为外植体;
步骤二:将步骤一中所述的外植体消毒后,置于诱导培养基上诱导出粘性愈伤组织;
步骤三:剥取步骤二中所述的粘性愈伤组织,将所述粘性愈伤组织转置于新鲜的诱导培养基上,进一步诱导出胚性愈伤组织;
步骤四:将步骤三所述的胚性愈伤组织通过增殖培养,获取胚性培养物;
步骤五:将步骤四所述的胚性培养物转至无植物生长调节剂的再生培养基上生成完整植株;
步骤六:将步骤五中生成的完整植株进行培养,得到芦苇再生苗;
步骤七:将步骤六所述的芦苇再生苗转至无菌组培瓶中进行培养,向所述无菌组培瓶中加入无菌OECD模拟废水;采集活性污泥,将所述活性污泥离心、清洗后加入所述组培瓶中,用组培膜覆盖瓶口,将所述组培瓶于人工气候箱中孵育;
步骤八:取经步骤七处理的芦苇再生苗的根组织,将所述根组织的表面进行消毒后研磨成浆,再将所述根组织的浆标准稀释涂布于MS平板上,将所述MS平板放置在恒温培养箱中培养,待菌落长出;
步骤九:从步骤八所述的MS平板上挑选草螺菌单菌落,接种至NB液体培养基中培养;然后离心处理所述NB液体培养基以收集菌体,清洗收集的所述菌体,使用MS液体培养基重新悬浮所述菌体制成细菌重悬液,调节所述细菌重悬液中草螺菌的OD600nm值为0.01-1;取至少一个芦苇胚性培养物浸入所述细菌重悬液中孵育,将所述芦苇胚性培养物转至无菌滤纸上除去表面菌体后,再将所述芦苇胚性培养物置于MS平板上进行培养;
步骤十:配制人工胚乳;向所述人工胚乳溶液中加入海藻酸钠,配制成溶胶悬液作为种皮基质,同时使用去离子水配制CaCl2溶液作为络合剂,将所述溶胶悬液和CaCl2溶液分别调节pH值后灭菌处理;
步骤十一:将步骤九所述的芦苇胚性培养物加入步骤十所述的种皮基质中,均匀混合后,再用无菌巴氏吸管每次吸入一个所述芦苇胚性培养物,滴入步骤十所述的CaCl2溶液中,取出后将所述芦苇胚性培养物清洗晾干,即形成人工种子;
步骤十二:将步骤十一所述的人工种子放在MS培养基上进行萌发培养。
优选的,所述诱导培养基的制备方法为:向每升MS液体培养基中加入1mg的二氯苯氧乙酸、1mg的萘乙酸、0.5mg的6-苄基腺嘌呤、30g的蔗糖以及0.5mgL-谷氨酰胺;所述增殖培养基的配制方法为向每升MS液体培养基中加入2.5mg的二氯苯氧乙酸、30g的蔗糖以及16g的琼脂;所述再生培养基的配置方法为:向每升MS液体培养基中加入2.5mg的二氯苯氧乙酸、30g的蔗糖以及16g的琼脂。
优选的,步骤二所述的消毒为用质量浓度为5%的次氯酸钠进行表面消毒,步骤二所述的粘性愈伤组织为在胚芽鞘末端的白色、半透明、有光泽组织;步骤三所述的胚性愈伤组织为表面具有细小瘤状物和绿点的组织;步骤四所述的胚性愈伤组织通过质量浓度为2.5mgL-1的2,4-D进行增殖培养。
优选的,步骤六所述的完整植株的高度为5cm~10cm,培养方式为转至1/2MS液体培养基中进行水培,或以蛭石为栽培基质进行。
优选的,步骤七所述的无菌组培瓶的高为20cm、直径为5cm,所述OECD模拟废水的配方为向0.5L去离子水中加入160mg的蛋白胨、110mg的肉膏、30mg的尿素、28mg的K2HPO4、7mg的NaCl、4mg的CaCl2·2H2O和2mg的MgSO4·7H2O,配制成混合液,再用去离子水将所述混合液定容至1L,再用规格为0.22μm的滤膜过滤灭菌,即制成OECD模拟废水;所述加入无菌组培瓶中的OECD模拟废水的体积为150ml;所述活性污泥从污水处理厂采集,所述离心条件为于12000rpm下离心5min,所述清洗为用pH值为7.4的磷酸盐缓冲液清洗3次,所述组培瓶中溶液的终浓度为2.5g VSS L-1,所述组培膜的大小为16cm×16cm,所述人工气候箱中的条件为温度24℃,光照时间16h d-1,光照强度60μmol.m-2.s-1,所述孵育时间为14d。
优选的,步骤八所取的根组织的重量为1g,所述研磨在无菌研钵中进行,所述恒温培养箱中的温度为30℃,培养时间为2d~3d。
优选的,步骤九所述的培养条件为30℃下150rpm振荡培养24h;离心条件为12000rpm下离心5min;所述清洗为用磷酸缓冲液清洗3次,调节所述细菌重悬液中草螺菌的OD600nm值为0.01;所述芦苇胚性培养物数目为10个,所述细菌重悬液的体积为20mL,所述孵育的时间为30min。
优选的,步骤十所述人工胚乳以MS培养基为基本培养基,所述基本培养基中含有质量浓度为3%的蔗糖作为碳源;所述海藻酸钠的质量浓度为3%,所述CaCl2溶液的浓度为100mM,所述溶胶悬液和CaCl2溶液调节后的pH值均为5.8,所述灭菌为121℃下高温高压灭菌20min。
优选的,步骤十一中所述的芦苇胚性培养物表面有绿点,所述巴氏吸管的直径为7mm,滴入所述的CaCl2溶液中的时间为30min,用无菌水将所述芦苇胚性培养物清洗5遍后在无菌滤纸上晾干。
优选的,步骤十二所述的每个MS培养基内放置20粒人工种子,培养条件为24℃,光照时间为16hd-1,光照强度60μmol.m-2.s-1,重复培养3次。
与现有技术相比,本发明的有益效果是:本发明在离体培养条件下,调节芦苇胚性培养物对内生草螺菌的亲和能力,再以胚性培养物与草螺菌共生体为繁殖材料,经水凝胶包埋制备成芦苇人工种子,进而通过人工种子垂直传递草螺菌而诱导产生耐镉的芦苇幼苗,适合大规模推广。
附图说明
图1为本发明芦苇愈伤组织诱导与芦苇幼苗再生;
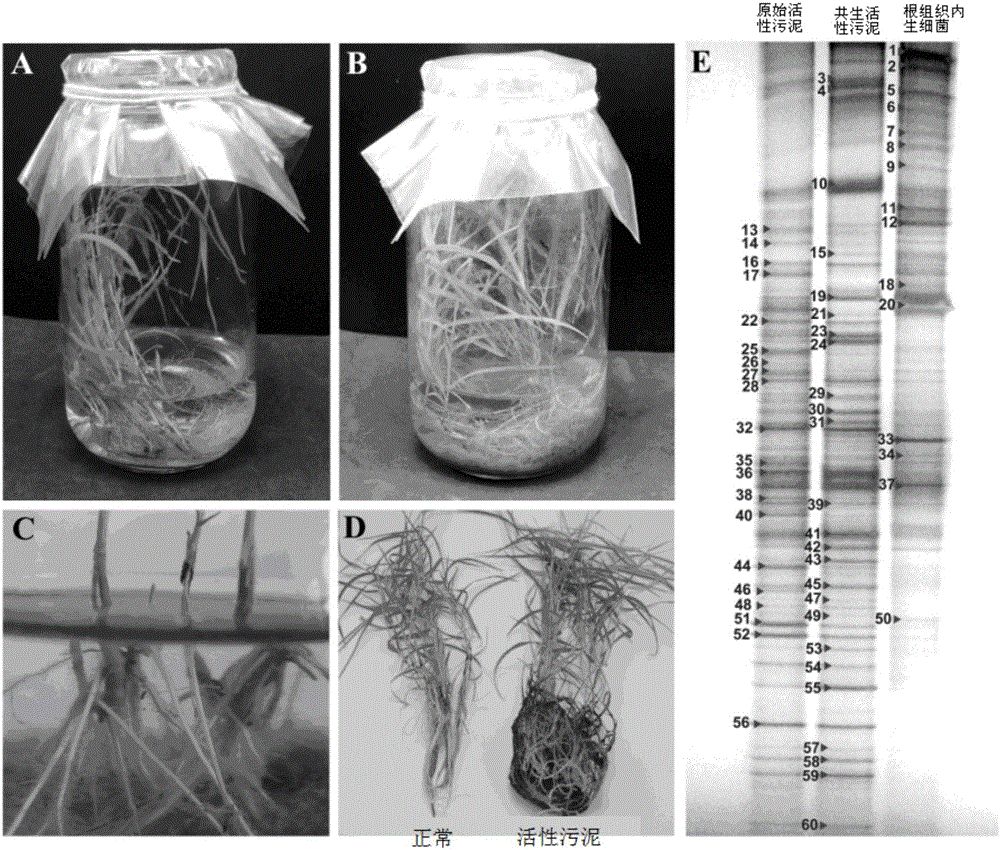
图2为本发明内生细菌根定殖;
图3为草螺菌功能鉴定;
图4为草螺菌与芦苇胚性培养物共培养;
图5为芦苇种子胚轴腐烂图;
图6为芦苇人工种子耐镉性能检测对比图。
其中,图1中A为芦苇小穗;B为芦苇种子;C为粘性愈伤组织;D、E为胚性愈伤组织;F、G、H为芦苇苗再生;I为水培法培育的芦苇再生幼苗;
图2中A为无活性污泥孵育的芦苇再生苗;B为活性污泥孵育的芦苇再生苗;C为活性污泥诱导再生苗侧根生成;D为活性污泥孵育的芦苇再生苗与正常芦苇再生幼苗的对比;E为芦苇再生苗的根组织内生细菌变性梯度凝胶电泳指纹图谱;
图3中A为草螺菌产吲哚乙酸功能鉴定,B为草螺菌产铁载体功能鉴定;
图4中A为草螺菌草OD600nm值为0.01的孵育液孵育的芦苇胚性培养物与正常芦苇胚性培养物对比图;B为经草螺菌草OD600nm值为0.01的孵育液孵育的芦苇再生幼苗。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
参见图1-6,本发明提供一种技术方案步骤如下:
步骤一:采集成熟芦苇小穗,去内外稃,以表面无损的芦苇种子为外植体;
步骤二:将步骤一中的外植体用质量浓度为5%的次氯酸钠进行表面消毒后,将外植体置于诱导培养基上,在外植体胚芽鞘末端诱导出白色、半透明、有光泽的粘性愈伤组织,诱导培养基的制备方法为:向每升MS液体培养基中加入浓度为1mg的二氯苯氧乙酸、1mg的萘乙酸、0.5mg的6-苄基腺嘌呤、30g的蔗糖以及0.5mg L-谷氨酰胺;
步骤三:剥取步骤二中所述的粘性愈伤组织,将所述粘性愈伤组织转置于新鲜的诱导培养基上,进一步诱导出表面具有细小瘤状物和绿点的胚性愈伤组织;
步骤四:将步骤三所述的胚性愈伤组织通过质量浓度为2.5mgL-1的2,4-D进行增殖培养,获取胚性培养物,增殖培养基的配制方法为向每升MS液体培养基中加入2.5mg的二氯苯氧乙酸、30g的蔗糖以及16g的琼脂;
步骤五:将步骤四所述的胚性培养物转至无植物生长调节剂的再生培养基上生成完整植株,再生培养基的配置方法为:向每升MS液体培养基中加入2.5mg的二氯苯氧乙酸、30g的蔗糖以及16g的琼脂;
步骤六:将步骤五中生成的高度为7cm的完整植株转至1/2MS液体培养基中进行水培,得到芦苇再生苗,芦苇再生苗存活率达到95%;
步骤七:将步骤六的芦苇再生苗转至高为20cm、直径为5cm的无菌组培瓶中进行培养,向无菌组培瓶中加入150ml的无菌OECD模拟废水,OECD模拟废水的配方为向0.5L去离子水中加入160mg的蛋白胨、110mg的肉膏、30mg的尿素、28mg的K2HPO4、7mg的NaCl、4mg的CaCl2·2H2O和2mg的MgSO4·7H2O,配制成混合液,再用去离子水将所述混合液定容至1L,再用规格为0.22μm的滤膜过滤灭菌,即制成OECD模拟废水;从合肥市望塘污水处理厂采集活性污泥,鉴于活性污泥法实质上是天然水体自净化作用的强化,本发明利用活性污泥孵育芦苇再生苗的手段定殖内生细菌,以从芦苇根组织发掘有效内生菌资源,将活性污泥于12000rpm下离心5min、用pH值为7.4的磷酸盐缓冲液清洗活性污泥3次,将活性污泥加入组培瓶中至组培瓶中溶液的终浓度为2.5g VSS L-1,用大小为16cm×16cm组培膜覆盖瓶口,将组培瓶于人工气候箱中孵育14d,与同等培养条件下的无活性污泥孵育的再生苗对比,活性污泥孵育的再生苗能正常生长,且活性污泥可诱导再生苗侧根生成,其根生长速度明显快于无活性污泥孵育的再生苗;
步骤八:取1g经步骤七处理的芦苇再生苗的根组织,将根组织的表面进行消毒后在无菌研钵中研磨成浆,再将所述根组织的浆标准稀释涂布于MS平板上,将所述MS平板放置在30℃恒温培养箱中培养2d~3d,待菌落长出,;对刚从合肥市望塘污水处理厂采集的原始活性污泥和孵育过芦苇再生苗的共生活性污泥采用总DNA提取试剂盒提取总DNA,对根组织内生细菌采用CTAB法提取总DNA;通过引物341F-GC-clamp(5'-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCCCTACGGGAGGCAGCAG-3')和518R(5'-ATTACCGCGGCTGCTGG-3')扩增微生物16S rRNA基因的V3高变区;使用DCodeTM通用突变检测系统,经电压80V、电泳时间14h、温度60℃、电泳缓冲液1×TAE、上样量10μL进行变性梯度凝胶电泳,再用银染法染色;对变性梯度凝胶电泳图谱上的60个优势条带进行切胶重扩增,克隆测序;在基因库中选取相关的特征序列,与测序结果一起用Clustal W软件,按照最大同源性的原则进行多重序列比对,检测的结果表明再生苗根组织中有着丰富的内生菌资源;使用细菌DNA试剂盒提取菌落中细菌的基因组DNA,扩增细菌16S rRNA基因全长序列,引物采用27F(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492R(5’-TACGGYTACCTTGTTACGACTT-3’),将纯化的扩增产物连接于pEASY-T3克隆载体上,送至上海生工生物工程股份有限公司测序,在基因库中选取相关的特征序列,与测序结果一起用Clustal W软件,按照最大同源性的原则进行多重序列比对,通过MEGA 5.0软件包,以邻位连接法进行系统进化树的估算,经引导程序检验生成系统发育树,且经基因库服务器进行同源性比较,该菌落与草螺菌GSF30同源性达99.33%,因而鉴定该菌株为草螺菌,其基因库序列登录号为KP713806;根据格里克曼与德绍方法(Glickmann,E.,Dessaux,Y.A.,植物病原细菌产生的吲哚化合物的索尔科斯基试剂检讨,应用与环境微生物学,1995,61:793-796.)定量检测草螺菌的吲哚乙酸产量为60.93±1μg mL-1,根据亚历山大与朱伯尔方法(Alexander,D.B.,Zuberer,D.A.用铬天青S试剂对根际细菌产铁载体的评价,土壤生物学与肥力,1991,12:39-45.)定性检测其产铁载体功能,耐镉试验检测其最小抑菌浓度为400μM;
步骤九:从步骤八所述的MS平板上挑选草螺菌单菌落,接种至NB液体培养基中培养;然后将NB液体培养基在12000rpm条件下离心5min以收集菌体,用磷酸缓冲液清洗3次所收集的菌体,使用MS液体培养基重新悬浮菌体制成细菌重悬液,调节草螺菌的OD600nm值为0.01;取10个芦苇胚性培养物浸入20mL细菌重悬液中孵育30min,将芦苇胚性培养物转至于无菌滤纸上,除去表面菌体,再将芦苇胚性培养物置于MS平板上进行培养,经草螺菌OD600nm值为0.01菌液孵育过的胚性培养物,60%能进一步分化而形成完整幼苗,且扫描电子显微镜可观察到草螺菌存活于胚性培养物内,表明草螺菌成功定殖于再生苗根组织,计数为每克根组织中含4.0×105CFU的草螺菌;
步骤十:以MS培养基为基本培养基,基本培养基中含有质量浓度为3%的蔗糖作为碳源,配制人工胚乳,由于芦苇胚性培养物可在无植物生长调节剂的培养基上再生出植株,因而人工胚乳中无需加入任何植物生长调节剂;向所述胚乳溶液中加入质量浓度为3%的海藻酸钠,配制成溶胶悬液作为种皮基质,同时使用去离子水配制100mM CaCl2溶液作为络合剂,将溶胶悬液和CaCl2溶液分别调节pH值为5.8后,在121℃下高温高压灭菌20min;
步骤十一:将步骤九中的表面有绿点芦苇胚性培养物加入步骤十中的种皮基质中,均匀混合;再用直径为7mm无菌巴氏吸管每次吸入一个所述芦苇胚性培养物,滴入步骤十中的CaCl2溶液中30min,取出后将芦苇胚性培养物5遍后在无菌滤纸上晾干,即形成人工种子;
步骤十二:将步骤十一所述的人工种子放在MS培养基上进行萌发培养,每个MS培养基内放置20粒人工种子,培养条件为24℃,光照时间为16hd-1,光照强度60μmol.m-2.s-1,重复培养3次,统计种子萌发率为90%。4℃下存储3个月,萌发率不变。且草螺菌根定殖仍为每克根组织4.0×105CFU,这表明种皮基质与络合剂对共培养物不产生影响。
对高于300μM的镉浓度,芦苇种子会出现明显的胚轴腐烂现象。以此为基础,将正常芦苇种子(RZS)、水凝胶包埋的包埋芦苇种子(RZSM)、芦苇人工种子(SS),以及经草螺菌孵育过的芦苇种子(ZSH)、包埋芦苇种子(ZSMH)、人工种子(SSH)6类种子,置于含300μM的1/2MS平板中进行耐镉性能检测。每板5粒种子,重复10次。50天后观察发现:正常芦苇种子(RZS)不能正常萌发;水凝胶包埋的芦苇种子(RZSM)、芦苇人工种子(SS))都能萌发,但根伸长受到抑制;经草螺菌孵育过的芦苇种子(ZSH)、包埋种子(ZSMH)、人工种子(SSH)的萌发不受影响,且根都能正常伸长。其中人工种子(SSH)具有最发达的根系统,并能繁殖成大量幼苗。这些结果表明,人工种皮虽然可以起到阻挡金属吸收而保护种胚的功效,但这种强化作用对芦苇幼苗生长很有限。草螺菌的引入,明显缓解了镉胁迫对芦苇幼苗生长的影响,且能诱导出大量耐镉幼苗。在不影响芦苇遗传潜力的情况下,以含有草螺菌的人工种子为繁殖手段,可提高种子活力和幼苗品质,而为人工湿地建设提供优质种苗,适合大规模推广。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!