一种蛋鸡小肠肠炎模型的构建方法
本发明属于动物营养学和毒理学技术领域,具体地说,涉及一种蛋鸡小肠肠炎模型的构建方法。
背景技术:
动物的小肠是营养物质消化吸收的重要部位,同时也是机体最大的免疫器官。大量研究表明,鸡的肠道疾病问题,会影响营养物质的消化和吸收,造成生产性能和饲料转化效率的下降,严重会导致鸡的死亡,严重制约家禽产业发展。鸡肠炎是现代化家禽集约化养殖生产中最为突出的肠道疾病之一,给家禽产业带来了巨大的经济损失。已有的数据表明,生产上由于肠炎问题给家禽产业造成的经济损失从2000年的20亿美元上升到2015年的60亿美元。另外,尽管药物性饲料添加剂(主要为抗生素)对肠炎有较为显著的治疗效果,但由于抗生素耐药性和其本身的安全性等问题,随着饲用抗生素在我国的全面禁止(2020年7月),动物肠道健康问题,更为突出,亟待寻求更安全,更有效的方式防止肠炎的发生。生产上造成肠炎的因素有许多,其中以产气荚膜梭菌(clostridiumperfringens)和球虫造成的肠炎较为常见。此外,霉菌毒素,饲粮动物蛋白浓度过高,环境冷热及高密度应激等因素也易诱导肠炎的发生。分析已有的文献表明,大部分肠炎模型均为肉鸡上的研究,尚未见蛋鸡小肠肠炎模型建立的标准方法,构建难度大,且其导致蛋鸡繁殖性能的影响尚不清楚。
因此,鉴于上述原因,为了进一步探究由于应激因素导致的肠炎以及消化道功能损伤从而降低产蛋性能的具体机制,有必要建立一种蛋鸡小肠肠炎模型。
技术实现要素:
有鉴于此,本发明针对缺乏蛋鸡小肠肠炎模型的问题,提供了一种蛋鸡小肠肠炎模型构建的方法,能够探究营养和饲料因素以及应激等因素引起蛋鸡生产性能下降的具体机制。
为了解决上述技术问题,本发明公开了一种蛋鸡小肠肠炎模型的构建方法,包括以下步骤:
步骤1、选用50只产蛋高峰期罗曼粉蛋鸡,采用单因素试验设计,设处理,每个处理10个重复,每个重复1只鸡,分别为对照组和4个攻毒处理组;
步骤2、4个攻毒处理组为:球虫疫苗+不同梯度的a型产气荚膜梭菌处理组,将球虫疫苗溶解于生理盐水中,配成球虫疫苗溶液,将a型产气荚膜梭菌菌液溶解于生理盐水中,配成a型产气荚膜梭菌菌液,分别于试验开始后每天早上9:00先灌服球虫疫苗溶液,半小时以后再灌服a型产气荚膜梭菌菌液;最后一次灌服后48h进行采样;
步骤3、试验期为7天,饲粮为玉米-豆粕型基础饲粮,根据nrc(1994)和中国鸡饲养标准配制,饲喂方式为定量饲喂;饲养管理按常规饲养管理进行,每周进行严格消毒,室温保持在20~22℃,注意通风换气;试验开始预饲2周,前通过观察记录蛋鸡产蛋率,保持初始产蛋率无统计学差异以后,开始正式试验;
步骤4、将各个处理组的饲料按照每天110g~120g、或者按其对应周自由采食量的90%,分两次:上午5点30和下午3点30,饲养过程中蛋鸡自由饮水。
可选地,所述产蛋高峰期罗曼粉蛋鸡为28周龄罗曼粉蛋鸡;对照组灌胃10ml生理盐水。
可选地,球虫疫苗+不同梯度的a型产气荚膜梭菌处理组为:球虫疫苗+1mla型产气荚膜梭菌处理组;球虫疫苗+2mla型产气荚膜梭菌处理组;球虫疫苗+3mla型产气荚膜梭菌处理组;球虫疫苗+4mla型产气荚膜梭菌处理组;球虫疫苗的具体的制备方法如下:将10克球虫疫苗溶解于10ml生理盐水中;不同梯度的a型产气荚膜梭菌菌液的具体的制备方法如下:分别将称量好的1ml、2ml、3ml和4mla型产气荚膜梭菌菌液溶解于生理盐水中,最终配成10mla型产气荚膜梭菌菌液。
可选地,所述的攻毒处理组为球虫疫苗+3mla型产气荚膜梭菌处理组。
可选地,所述的球虫疫苗为200倍弱毒性球虫四价疫苗,含有球虫孢子数为220000个,包括质量比为5:3:2:1的柔嫩艾美耳球虫ptmz株、毒害艾美耳球虫pnhz株、巨型艾美耳球虫pmhy株、堆型艾美耳球虫pahy株,每羽份中含有卵囊1100个±10%个。
可选地,所述的产气荚膜梭菌菌液中含有a型产气荚膜梭菌(cvcc2050,购自中国国家兽医微生物菌种保藏管理中心)的浓度为4×109cfu/ml。
可选地,所述的饲粮按照质量份包括玉米55.15份,小麦麸5.00份,大豆油3.00份,cp43%豆粕25.25份,粒状石粉4.50份,粉状石粉4.50份,磷酸氢钙1.30份,氯化钠0.30份,70%l-赖氨酸硫酸盐0.13份,99%dl-蛋氨酸0.20份,l-苏氨酸0.09份,60%氯化胆碱cc0.10份,多维0.03份,矿添0.45份。
可选地,所述步骤4中的鸡舍温度在22℃,相对湿度低于75%。
本发明还公开了一种用于蛋鸡小肠肠炎模型的饲粮,按照质量份包括玉米55.15份,小麦麸5.00份,大豆油3.00份,cp43%豆粕25.25份,粒状石粉4.50份,粉状石粉4.50份,磷酸氢钙1.30份,氯化钠0.30份,质量分数为70%l-赖氨酸硫酸盐0.13份,质量分数为99%dl-蛋氨酸0.20份,l-苏氨酸0.09份,质量分数为60%氯化胆碱cc0.10份,多维0.03份,矿添0.45份。
与现有技术相比,本发明可以获得包括以下技术效果:
本发明的模型可以诱导蛋鸡小肠肠炎,破坏肠道物理和化学屏障功能,导致肠道炎症,降低蛋鸡产蛋率、采食量和饲料转化效率。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有技术效果。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
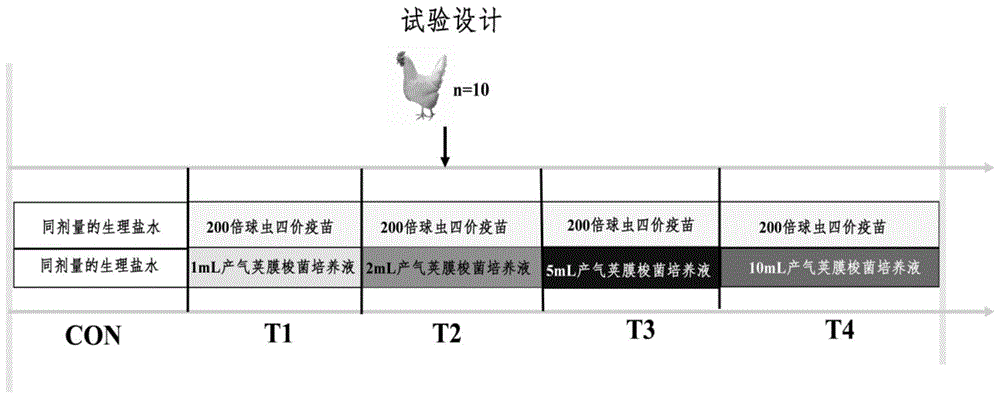
图1是本发明试验设计图;
图2是本发明模型对肠道病变情况的影响;
图3是本发明模型对肠道物理屏障相关基因的影响(p<0.05);
图4是本发明模型对肠道化学屏障相关基因的影响(p<0.05);
图5是本发明模型对肠道促炎因子相关基因的影响(p<0.05)。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1
一种蛋鸡小肠肠炎模型的构建方法,包括以下步骤:
步骤1、选用50只产蛋高峰期(28周龄)罗曼粉蛋鸡,采用单因素试验设计,设处理,每个处理10个重复,每个重复1只鸡,分别为灌胃10ml生理盐水(对照组,con)和4个10ml攻毒处理组(图1)。
其中,攻毒处理组的具体操作方法为,球虫疫苗(200倍弱毒性球虫四价疫苗,含有球虫孢子数为220000个)+不同梯度的a型产气荚膜梭菌处理组,不同梯度的a型产气荚膜梭菌的灌服剂量分别为:1ml(t1)、2ml(t2)、3ml菌液(t3)和4ml菌液(t4)。试验期为7天,分别于试验开始后每天早上9:00先灌服200倍球虫疫苗(10克溶解于10ml生理盐水中),半小时以后再灌服产气荚膜梭菌菌液(分别将称量好的1ml、2ml、3ml和4mla型产气荚膜梭菌菌液溶解于生理盐水中,最终配成10ml溶液)。
其中,球虫疫苗为鸡球虫四价活疫苗,包括质量比为5:3:2:1的柔嫩艾美耳球虫ptmz株、毒害艾美耳球虫pnhz株、巨型艾美耳球虫pmhy株、堆型艾美耳球虫pahy株,每羽份中含有卵囊1100个±10%个。
产气荚膜梭菌菌液中含有a型产气荚膜梭菌(cvcc2050,购自中国国家兽医微生物菌种保藏管理中心)的浓度为4×109cfu/ml。
步骤2、最后一次灌服后48h进行采样。试验期为7天,饲粮为玉米-豆粕型基础饲粮,根据nrc(1994)和中国鸡饲养标准配制,具体数据见表1,饲喂方式为定量饲喂。试验在四川农业大学教学实验基地进行。饲养管理按常规饲养管理进行,每周进行严格消毒,室温保持在20~22℃左右,注意通风换气。试验开始预饲2周,前通过观察记录蛋鸡产蛋率,保持初始产蛋率无统计学差异以后,开始正式试验。
步骤3、将各个处理组的饲料按照每天110g~120g、或者按其对应周自由采食量的90%,分两次:上午5点30和下午3点30,饲养过程中蛋鸡自由饮水,同时控制鸡舍温度在22℃,相对湿度低于75%。
表1饲料配方
注:1矿物元素和多维预混料按中国鸡饲养标准进行配置。
下面结合具体的实验数据来说明本发明的技术效果:
一、实验方法:
1、肠道健康及相关指标的测定:在试验结束时(最后一次攻毒24h后),每个处理随机选择10只蛋鸡屠宰,采集其十二指肠、空肠、回肠做肠道病理切片分析。
2、肠道形态:剪取十二指肠、空肠和回肠肠段中部取3cm左右肠段放入固定液(4%多聚甲醛),测定绒毛高度,隐窝深度和绒隐比值。
3、肠道评分:对肠道(空肠和回肠)病理变化进行评分(采用5分制,包括0-4分,分数越高炎性越重,参考johnsonetal.,1970)。
表2肠道评分标准
4、肠道屏障功能:刮取空肠粘膜,测定上皮细胞跨膜连接蛋白(claudin2)、紧密连接蛋白(zo-1、zo-2)、闭锁蛋白(occludin)、黏蛋白(mucin-1,mucin-2)的荧光定量pcr分析。
5、肠道炎性因子表达:测定空肠粘膜促炎(il-1β,il-6,il-8,tnf-α)因子水平的荧光定量pcr分析。
二、实验结果:
1、该模型对蛋鸡生产性能的影响
如表3所示,相对于对照组,蛋鸡t2,t3,t4组降低蛋鸡产蛋率,平均蛋重,采食量、料蛋比和破壳蛋率(p<0.05)。
表3该发明预混料对产蛋性能的影响
注:同列a、b、c、d字母不同表示差异显著(p<0.05)。
2、该模型对蛋鸡肠道病变评分的影响
如表4和图2所示,相对于对照组,t2、t3和t4处理组蛋鸡肠道病变评分显著高于对照组,其中处理t3和t4的评分最高,其肠壁变薄,出现病变出血点(p<0.05)。
表4该模型对肠道病变评分的影响
注:同列a、b、c、d字母不同表示差异显著(p<0.05)。
3、该模型对蛋鸡肠道形态的影响
如表5所示,相对于对照组,t2、t3和t4处理降低了蛋鸡十二指肠和空肠的绒毛高度和绒隐比,增加了隐窝深度(p<0.05),其中t3和t4处理组之间的十二指肠和空肠绒毛高度、隐窝深度和绒隐比无显著差异,但均低于其他处理组(p<0.05)。
表5、该模型对肠道形态的影响
注:同列a、b、c、d字母不同表示差异显著(p<0.05)。
4、该模型对蛋鸡肠道物理和化学屏障相关基因表达
如图3和图4所示,与对照组相比,t2、t3和t4处理组降低了肠道物理屏障相关基因(zo-1,zo-2和occludin)的mrna的表达(p<0.05),同时t3和t4处理组下调了化学屏障(mucin-1)相关基因的表达(p<0.05)。
5、该模型对蛋鸡肠道促炎性因子相关基因表达
如图5所示,与对照组相比,t3和t4处理组上调了促炎因子il-1β,il-6和tnf-α基因的mrna表达(p<0.05)。
综上所述:结果说明该模型(处理t3和处理t4)均可以诱导蛋鸡小肠肠炎,破坏肠道物理和化学屏障功能,导致肠道炎症,降低蛋鸡产蛋率、采食量和饲料转化效率。综合推荐可以采用t3的方法来构建蛋鸡小肠肠炎模型。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!