一种利用微生物降低鱼类过敏原活性的方法与流程
本发明属于食品生物技术领域,具体涉及一种利用微生物降低鱼类过敏原活性的方法。
背景技术:
食物过敏目前已成为严重的食品安全问题,世界变态反应组织(WAO)调查显示,食物过敏已影响着世界上1-3%的成年人及6-8%的儿童。临床上的过敏反应主要由八大类食物引起:牛奶、蛋类、花生、大豆、坚果类、小麦及甲壳类和鱼类。其中鱼类和鱼制品作为一种必需氨基酸、不饱和脂肪酸和脂溶性维生素的重要食物来源,全球需求量持续增加,随之而来的鱼类过敏发病率也呈现递增趋势,过敏症状也更加复杂化、多样化。为了消费者的健康,降低鱼类当中的过敏原极为重要。
食物中的过敏原大多数属于蛋白质,有研究已表明,鱼类当中的过敏原主要为小清蛋白,相对分子量为10-14kD,它是一种水溶性的钙离子结合蛋白,等电点偏酸性。国外学者首次发现于鳕鱼体内,随后陆续在鲤、鲢、鲑、鲈体内证实其为主要过敏原,并且不同种鱼之间的小清蛋白可以发生交叉反应。现有研究已证明,90%以上的鱼类过敏患者症状是由于小清蛋白引起,因此寻找有效的降低或消除小清蛋白的有效方法具有重要意义。目前国内外众多的研究表明,加工能够对小清蛋白产生一定程度的影响,从而降低其免疫活性,主要包括物理法(热处理、辐照、高压)、化学法(美拉德反应、酶法)和生物法(基因工程),这些方法对鱼类过敏原均有不同程度的消减作用,但是不同的加工方式对鱼类过敏原产生的影响不同,比如不同的物理法、化学法处理后会导致加工后的鱼制品营养成分、活性物质、风味物质流失,产品的质构和感官质量下降;基因工程操作不够简单,在对过敏原基因进行改造的同时,有引入新过敏原基因的风险。
微生物发酵法作为生物法当中的一种,虽然范围局限于发酵食品,但发酵后食品中的蛋白质被分解为多肽和氨基酸,不仅利于吸收,一定程度上还能增加发酵食品的风味,最重要的是发酵过程中微生物的生长活动可以将一些具有抗原特性的蛋白质分解或使之变性,起到降低过敏原致敏性的作用。现今微生物发酵法降低食物致敏性的作用已在大豆、牛奶和蛋清中得到证实,并且已研制出相关的低致敏性发酵豆制品及乳制品,但在鱼类制品中,微生物发酵法是否能降低其过敏原活性还有待研究。
技术实现要素:
为了弥补现有的利用微生物降低鱼类过敏原方法的缺失,本发明提供了一种利用微生物发酵降低鱼类过敏原活性的方法。其是通过以下技术方案实现的:一种利用微生物降低鱼类过敏原活性的方法,包括如下步骤:
①发酵剂的制备:将木糖葡萄球菌活化、培养后,离心并用无菌生理盐水重悬得到的菌悬液;
②发酵鱼糜的制备:将鱼肉、发酵剂及辅料混匀后,灌肠发酵;
③定期取样检测发酵鱼糜的过敏原活性。
优选的,所述步骤①制得的菌悬液含菌量在1×108 CFUml-1 -2×108 CFUml-1。
优选的,所述步骤②中灌肠后发酵的条件为:将鱼肠置于30℃培养箱中发酵60h。
优选的,步骤③取样时间分别为发酵的0、12、24、36、48、60h。
优选的,所述步骤②中各原料的配比为:91.2%鱼肉,2%葡萄糖,2%食盐,0.3%复合磷酸盐,4.5%淀粉;将上述原料混合均匀后,以5mL/100g的接种量接种发酵剂。
优选的,所述发酵剂的制备方法如下:
⑴菌株活化:将木糖葡萄球菌菌株接种至MRS固体培养基,置于30℃恒温培养箱培养48h;取长势良好的菌落再次划线,接种至固体培养基培养,以此重复3次;
⑵菌株液体培养:将上述活化三次后长势良好的菌落用接种环挑取一环,接种至MRS液体培养基中,在30℃振荡培养箱中120r/min培养24h;
⑶菌株扩大培养:将上述液体培养后的菌液按1%接种量接种至MRS液体培养基中,30℃振荡培养箱中120r/min培养24h;
⑷发酵剂制备:将上述扩大培养后的菌悬液于4℃、4000r/min下离心15min,去掉上清液,菌体沉淀用无菌生理盐水洗涤三次后重悬于与步骤⑶中的MRS液体培养基等体积的无菌生理盐水中。
优选的,所述鱼肉为鲈鱼去除头部、去除鱼鳞、去除内脏后,所采集的背部或腹部肌肉。
优选的,所述检测发酵鱼鱼糜的过敏原活性的方法为:提取鱼肉肌浆蛋白;利用提取的鱼肉肌浆蛋白对鱼肉蛋白组分分析,鱼肉致敏蛋白免疫印迹分析以及鱼肉致敏蛋白间接酶联免疫吸附分析。
本发明相对于现有技术所具有的优点为:本发明方法使得发酵后的鱼糜过敏原活性有所降低,说明发酵剂可降低鱼类过敏原的活性,以此本发明首次提供了一种降低鱼类过敏原的新方法,将有助于开发低过敏或无致敏的鱼糜食品,保障过敏患者的健康,并满足特定过敏人群的需要。
此外,2016年,卫生部将木糖葡萄球菌列为可食用菌种名单,表明其食用安全性得到证实,同时,该菌已列入国际乳业联盟(IDF)发布的“具有在食品中安全使用记录史的微生物清单”,并且国外多个国家如丹麦、加拿大都已批准使用。因此,可将木糖葡萄球菌制成发酵剂应用于鱼制品发酵,寻找一种可有效降低鱼类过敏的新方法。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
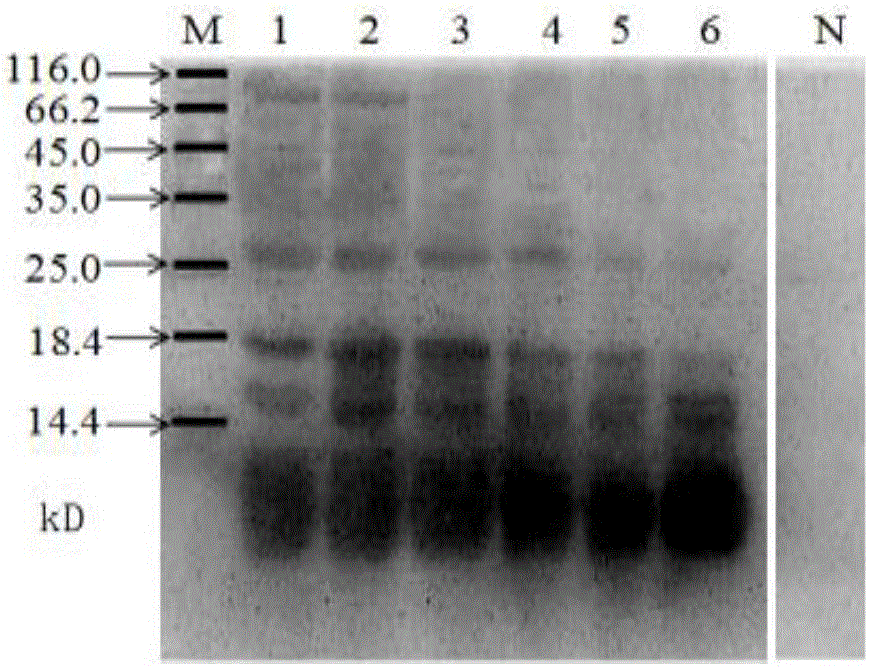
图1为本发明发酵鱼糜肌浆蛋白SDS-PAGE电泳图谱。
图2为本发明发酵后鱼糜肌浆蛋白IgG结合能力的免疫印迹分析图谱。
图3为本发明发酵后鱼糜肌浆蛋白IgE结合能力的免疫印迹分析图谱。
图4为本发明发酵后鱼糜肌浆蛋白IgG结合能力的间接ELISA结果分析。
图5为本发明发酵后鱼糜肌浆蛋白IgE结合能力的间接ELISA结果分析。
具体实施方式
实施例中试剂如无特殊说明,均为分析纯。本发明的木糖葡萄球菌购买于中国工业微生物菌种保藏管理中心(CICC)。
本实施例提出一种利用木糖葡萄球菌降低鱼类过敏原的方法,其包括如下步骤:
一、发酵剂的制备:将木糖葡萄球菌活化、培养后,离心并用无菌生理盐水重悬得到的菌悬液;
二、发酵鱼糜的制备:将鱼肉、上述发酵剂及辅料混匀后,灌肠发酵;
三、定期取样检测发酵鱼糜的过敏原活性。
下面将结合具体实施例对上述步骤作进一步说明。
一、发酵剂的制备
1. 菌株活化:将木糖葡萄球菌菌株接种至MRS固体培养基,置于30℃恒温培养箱培养48h;
2. 取长势良好的菌落再次划线,接种至固体培养基培养,以此重复3次;
3. 菌株液体培养:将上述活化三次后长势良好的菌落用接种环挑取一环,接种至MRS液体培养基中,在30℃振荡培养箱中120r/min培养24h;
4. 菌株扩大培养:将上述液体培养后的菌液按1%接种量接种至MRS液体培养基中,30℃振荡培养箱中120r/min培养24h;
5. 发酵剂制备:将上述扩大培养后的菌悬液于4℃、4000r/min下离心15min,去掉上清液,菌体沉淀用无菌生理盐水洗涤三次后重悬于与步骤4中的培养基等体积的无菌生理盐水中制得菌悬液,其菌悬液的含菌量在1×108 CFU ml-1 -2×108 CFU ml-1。
二、发酵鱼糜的制备
1. 原料准备:新鲜鱼肉、食盐、复合磷酸盐、葡萄糖、土豆淀粉,肠衣;其中肠衣为食品级。
2. 鱼糜发酵:其中本实施例选用的材料为鲈鱼,当然也可以选用其他品种的鱼,将鱼体去除头部,去除鱼鳞,去除内脏后,清水洗净,取鱼体背部和腹部肌肉切丁,将上述原料按照91.2%鱼肉,2%葡萄糖,2%食盐,0.3%复合磷酸盐,4.5%土豆淀粉混合均匀后,按5mL/100g的接种量接种发酵剂(即:5ml发酵剂接种于100g鱼糜中)灌肠,使得每克鱼肉中含有1×105 CFU以上的木糖葡萄球菌,鱼肉发酵初始pH为6.7,灌肠后,置于30℃培养箱中发酵60h,每隔12h取样一次,实验结果测得鱼肉中菌落数不断上升,鱼糜pH不断下降,发酵60h结束后,鱼糜中菌落数维持在1×109CFU/g左右,最终pH为4.8。
三、检测发酵鱼糜过敏原活性
1. 鱼肉肌浆蛋白的提取:将每隔12h取样后的鱼糜称取50g,加入150mL提取液(Tris 0.1mol/L,Glycine 0.5mol/L,DTT 1 mmol/L,pH 8.7),匀浆后置于4℃震荡过夜提取,提取结束后在4℃下以4000 r/min 离心30min后取上清液,将沉淀继续用原方法提取6h,将两次上清液合并,所提取的上清液即为鱼肉肌浆蛋白。对发酵0、12、24、36、48、60h后提取的鱼糜过敏原进行检测。
四、结果分析:
1.鱼肉蛋白组分分析:采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析发酵后鱼肉肌浆蛋白组分变化,参照文献(陆宗超. 大菱鲆过敏原小清蛋白的制备及氧化对其IgE 结合能力的影响[D]. 青岛: 中国海洋大学, 2013)的方法,分析发酵不同时间鲈鱼过敏原蛋白组分变化。分离胶浓度15%,浓缩胶浓度5%,每个蛋白样品稀释至浓度为1mg/ml,上样量10ul。电泳结束后考马斯亮蓝R-250染色2h,然后脱色液脱色过夜,脱色完毕后观察结果,SDS-PAGE结果如图1。
图1中1-6表示分别发酵0、12、24、36、48、60h后提取的鱼糜过敏原蛋白,M为蛋白标准分子量。
未发酵的鲈鱼肌浆蛋白在10kD左右处有两条分子量相近的蛋白条带,为小清蛋白的两个不同亚型,这与国外关于鱼类小清蛋白的报道相一致;
随着发酵时间增长,150kD、96kD、48kD、42kD、28kD、26kD、20kD蛋白条带逐渐减弱甚至消失,表明蛋白质在发酵过程中发生了降解;
70kD、35kD处在发酵12h后出现新的条带,并且蛋白条带随发酵时间增长而加深;从整个发酵过程来看,小清蛋白无明显变化;
高分子量蛋白质的降低却没有导致相应的其他低分子量的蛋白质增加,原因可能是随着发酵时间的增长,pH不断降低,导致一些大分子量的蛋白质变性,通过共价键和非二硫键形成了不溶的蛋白质聚合物。
2、鱼肉致敏蛋白免疫印迹分析:步骤参考文献(宋永娜. 丙二醛氧化修饰对虾类原肌球蛋白过敏性质的影响[D].中国海洋大学,2015)进行并略改动。将不同发酵时间的鲈鱼蛋白经过SDS-PAGE电泳后,用半干式碳板转印仪,将蛋白条带转印至PVDF膜上,转印条件为恒流100 mA转印45 min。电转移结束后丽春红S染色,检验条带转移成功后,标记标准蛋白分子量。将膜完全覆盖在封闭液(5%脱脂奶粉)中,室温下封闭2 h。倒掉封闭液,用PBST(含0.1% Tween-20的PBS缓冲液)轻洗3次,每次5 min。兔抗鲈鱼小清蛋白多克隆抗体(1:2000)或人血清(1:5)作为一抗,室温下过夜。HRP标记的羊抗兔IgG(1:500)或HRP标记的羊抗人IgE(1:500)作为二抗,37℃孵育1 h。孵育结束后用PBST轻洗。将膜放于凝胶成像仪中,ECL蛋白印迹底物等量混合,滴加在膜上显色,结果如图2、3所示。
图2、图3中,1-6表示分别发酵0、12、24、36、48、60h后提取的鱼糜过敏原蛋白,M为蛋白标准分子量,N为阴性对照。在图2、3的免疫反应中,除了小清蛋白之外,均有其他的蛋白组分能够与相应抗体发生免疫反应。
图2中,未发酵的鱼肉蛋白(即发酵0h)中,出现的阳性反应条带,分别为12kD的小清蛋白反应条带,96kD、26kD、17kD及16kD分子量的蛋白反应条带,发酵过程中,发酵12h后96kD处条带消失,36h后26kD处条带逐渐消失,而小清蛋白和16、17kD处蛋白条带并无显著变化,但小清蛋白较其它两种蛋白质免疫反应更加强烈。
图3中,未发酵的鱼肉蛋白反应强烈的阳性条带有96kD、48kD、26kD、17kD、16kD及10-12kD,但从12h开始,出现了35-40kD之间新的阳性条带。96、26kD处两条阳性条带的免疫反应随着发酵时间增长,免疫活性逐渐消失,这与图2的IgG反应具有相似之处,由电泳图可知此两处的蛋白在发酵过程中被逐渐降解。同样的,小清蛋白条带也无明显变化。48kD、26kD等处能发生免疫反应的蛋白条带很可能为小清蛋白的低聚物,或是其他的能引起免疫反应的尚不确定的蛋白质。
3、鱼肉致敏蛋白间接酶联免疫吸附(ELISA)分析:参照文献(宋永娜. 丙二醛氧化修饰对虾类原肌球蛋白过敏性质的影响[D].中国海洋大学,2015)用碳酸盐缓冲溶液(CBS,pH 9.6)将发酵不同时间的蛋白液稀释至20 μg/mL,每孔100 μL样品包被,4℃过夜。将包被过夜的蛋白液用洗涤液PBST洗涤3次,每次5min。洗涤结束后封闭液(1%脱脂奶粉)封闭2h。封闭结束后以上述同样洗涤方式洗涤,然后将兔抗鲈鱼小清蛋白多克隆抗体(1:5000)或过敏患者血清(1:200)作为一抗孵育1.5h,洗涤后加入HRP标记的羊抗兔IgG(1:500)或HRP 标记的羊抗人 IgE(1:2000)作为二抗,反应结束后洗涤,并加入底物溶液显色,37℃培养箱放置20min后终止反应,于450nm处测定吸光值,结果如图4、5所示。
图4为鱼肉过敏原蛋白IgG免疫活性变化,图5为鱼肉过敏原蛋白IgE免疫活性变化。
图4中,发酵后,鱼肉过敏原蛋白IgG免疫活性持续下降,发酵60h时,鱼肉过敏原免疫活性降低程度最大,此时下降了26.9%,表明木糖葡萄球菌发酵鱼肉后,细菌的生长最终导致了鱼肉过敏原蛋白IgG免疫活性的持续降低。
图5中,发酵后鱼肉过敏原蛋白IgE免疫活性也呈现下降趋势,但从发酵开始至36h时,鱼肉蛋白IgE结合能力变化不显著(P>0.05),在发酵48h之后显著降低,60h时降低了22.3%,因此,本发明的方法可以降低鱼肉蛋白过敏原活性。
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!