奥贝胆酸药物组合物及其制备方法与流程
本发明属于药物制剂领域,具体而言,本发明涉及一种奥贝胆酸药物组合物及其制备方法。
技术背景
奥贝胆酸(Obeticholic Acid)又名6-乙基鹅去氧胆酸,是人初级胆汁酸中鹅脱氧胆酸(CDCA)的一种新型衍生物,为法尼酯衍生物X受体(FXR)的天然配体。奥贝胆酸属法尼醇X受体激动剂,通过活化法尼醇X受体,间接抑制细胞色素7A1(CYP7A1)的基因表达。由于CYP7A1是胆酸生物合成的限速酶,因此奥贝胆酸可以抑制胆酸合成,用于治疗原发性胆汁性肝硬化和非酒精性脂肪性肝病。
奥贝胆酸由美国Intercept制药公司研发成功,是二十年来首个研发用于治疗胆汁淤积性肝病的药物。用于那些对旧标准治疗药物熊去氧胆酸没有充分应答或不能耐受的患者。
奥贝胆酸的化学结构式如下:
奥贝胆酸为一多晶型化合物,目前公开的技术文献(专利WO2013192097)记载了Intercept制药公司发明的奥贝胆酸的A、C、D、G、F晶型以及不定型。
由于奥贝胆酸是一种难溶性的药物,其原料药的粒径大小对药物的溶出及吸收具有重要的影响,因此考察奥贝胆酸用于制剂的粒径具有很重要的意义。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一或提供一种有用的商业选择。为此,本发明的一个目的在于提出一种奥贝胆酸药物组合物及其制备方法。该奥贝胆酸药物组合物克服了原料药难溶的特性,并且该组成的奥贝胆酸药物组合物具有较高的 生物利用度和稳定性,可以用于治疗原发性胆汁性肝硬化、非酒精性脂肪肝、胆汁酸腹泻、门静脉血压过高、酒精性肝炎、原发性硬化性胆管炎等。
在本发明的一个方面,本发明提供了一种奥贝胆酸药物组合物,该药物组合物中含有奥贝胆酸、填充剂、崩解剂、粘合剂、润滑剂。
根据本发明实施例的奥贝胆酸药物组合物克服了原料药难溶的特性,提高了奥贝胆酸的溶解性和溶出速度,从而提高了药物吸收的速度和程度,进而提高奥贝胆酸药物组合物的生物利用度和稳定性,并且该药物组合物可以用于治疗原发性胆汁性肝硬化、非酒精性脂肪肝、胆汁酸腹泻、门静脉血压过高、酒精性肝炎、原发性硬化性胆管炎等,并且该药物组合物组分简单,产品稳定,杂质少。
根据本发明的实施例,奥贝胆酸可以为经微粉化后的奥贝胆酸微粒,根据本发明的具体实施例,奥贝胆酸微粒的平均粒径并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体示例,奥贝胆酸微粒的平均粒径可以为3.0~250μm。发明人通过对奥贝胆酸进行微粉化处理,收集到了不同平均粒径范围的样品,并通过湿法制粒和粉末直接压片工艺制备出不同的奥贝胆酸片进行试验最终发现,当奥贝胆酸微粒的平均粒径为3.0~250μm时可以保证得到一个生物利用度高且稳定的制剂。
根据本发明的一个实施例,奥贝胆酸微粒的平均粒径优选为3.0~150μm。由此,可以进一步保证生所得制剂具有较高的生物利用度和稳定性。根据本发明的具体实施例,奥贝胆酸微粒的平均粒径更优选为3.0~10μm。发明人发现,采用该粒径范围的奥贝胆酸微粒,所得制剂的生物利用度和稳定性最佳。
根据本发明的实施例,奥贝胆酸原料的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,可以采用晶型或无定型原料,具体的,奥贝胆酸晶型可以采用C、G、F晶型中的至少一种。由此,可以保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,优选为无定型原料。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。
根据本发明的实施例,填充剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,填充剂可以为选自微晶纤维素、乳糖、预胶化淀粉、淀粉和甘露醇中的至少一种。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,填充剂可以为选自微晶纤维素和乳糖中的至少一种。
根据本发明的实施例,崩解剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,崩解剂可以为选自羧甲淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素和交联聚维酮中的至少一种。由此,可以促进该药物快 速溶解,从而积极发挥药效。根据本发明的具体示例,崩解剂可以为羧甲淀粉钠。
根据本发明的实施例,粘合剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,粘合剂可以为选自羟丙甲基纤维素、羟丙基纤维素、聚维酮和淀粉浆中的至少一种。由此,可以显著提高该药物组合物的稳定性。根据本发明的具体示例,粘合剂可以为羟丙甲基纤维素。
根据本发明的实施例,润滑剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,润滑剂可以为选自滑石粉、十二烷基硫酸钠、二氧化硅、硬脂酸镁、硬脂酸钙和聚乙二醇4000中的至少一种。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,润滑剂可以为硬脂酸镁。
根据本发明的实施例,奥贝胆酸药物组合物为固体口服制剂,优选为片剂或胶囊,最优选为片剂。由此,可以保证所得药物组合物具有较高的生物利用度和稳定性。
根据本发明的实施例,奥贝胆酸药物组合物的规格可以为1~50mg,优选为5~25mg。
在本发明的另一方面,本发明提供制备上述奥贝胆酸药物组合物的方法,包括:(a)将奥贝胆酸微粉化,以便获得平均粒径为3.0~250μm的奥贝胆酸微粒;(b)制备粘合剂溶液;(c)将奥贝胆酸与填充剂、崩解剂混合均匀,得到含有主药和赋形剂的粉末;(d)将步骤(b)制得的所述粘合剂溶液加入到所述含有主药和赋形剂的粉末中,并进行制粒、干燥;(e)将步骤(d)得到的干燥药物颗粒过筛整粒,然后加入润滑剂,并进行压片,以便获得奥贝胆酸药物组合物;(e)过筛整粒,加入润滑剂,测定颗粒中奥贝胆酸的含量,压片,得奥贝胆酸药物组合物成品。由此,采用该方法可以有效制备得到上述具有较高的生物利用度和稳定性的奥贝胆酸药物组合物,并且发明人通过对奥贝胆酸进行微粉化处理,收集到了不同平均粒径范围的样品,并通过湿法制粒和粉末直接压片工艺制备出不同的奥贝胆酸片进行试验最终发现,当奥贝胆酸微粒的平均粒径为3.0~250μm时可以保证得到一个生物利用度高且稳定的制剂,同时该制备方法工艺简单,适合于工业化大生产。需要说明的是,上述针对奥贝胆酸药物组合物所描述的特征和优点同样适用于该制备奥贝胆酸药物组合物的方法,此处不再赘述。
根据本发明的一个实施例,奥贝胆酸微粒的平均粒径优选为3.0~150μm。由此,可以进一步保证生所得制剂具有较高的生物利用度和稳定性。根据本发明的具体实施例,奥贝胆酸微粒的平均粒径更优选为3.0~10μm。发明人发现,采用该粒径范围的奥贝胆酸微粒,所得制剂的生物利用度和稳定性最佳。
根据本发明的实施例,奥贝胆酸原料的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,可以采用晶型或无定型原料,具体 的,奥贝胆酸晶型可以采用C、G、F晶型中的至少一种。由此,可以保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,优选为无定型原料。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。
根据本发明的实施例,填充剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,填充剂可以为选自微晶纤维素、乳糖、预胶化淀粉、淀粉和甘露醇中的至少一种。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,填充剂可以为选自微晶纤维素和乳糖中的至少一种。
根据本发明的实施例,崩解剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,崩解剂可以为选自羧甲淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素和交联聚维酮中的至少一种。由此,可以促进该药物快速溶解,从而积极发挥药效。根据本发明的具体示例,崩解剂可以为羧甲淀粉钠。
根据本发明的实施例,粘合剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,粘合剂可以为选自羟丙甲基纤维素、羟丙基纤维素、聚维酮和淀粉浆中的至少一种。由此,可以显著提高该药物组合物的稳定性。根据本发明的具体示例,粘合剂可以为羟丙甲基纤维素。
根据本发明的实施例,润滑剂的具体类型并不受特别限制,本领域技术人员可以根据实际需要进行选择,根据本发明的具体实施例,润滑剂可以为选自滑石粉、十二烷基硫酸钠、二氧化硅、硬脂酸镁、硬脂酸钙和聚乙二醇4000中的至少一种。由此,可以进一步保证所得药物组合物具有较高的生物利用度和稳定性。根据本发明的具体示例,润滑剂可以为硬脂酸镁。
根据本发明的实施例,步骤(d)中干燥至干燥失重不大于3wt%。由此便于进行压片。
在本发明的第三方面,本发明提供制备上述奥贝胆酸药物组合物的方法。根据本发明的实施例,该方法包括:(1)将奥贝胆酸原料药处理到平均粒径为3.0~250μm奥贝胆酸微粒;(2)将所述奥贝胆酸微粒与填充剂、崩解剂和润滑剂混合均匀后直接压片,以便得到奥贝胆酸药物组合物。由此,采用该方法可以有效制备得到上述具有较高的生物利用度和稳定性的奥贝胆酸药物组合物,并且发明人通过对奥贝胆酸进行微粉化处理,收集到了不同平均粒径范围的样品,并通过湿法制粒和粉末直接压片工艺制备出不同的奥贝胆酸片进行试验最终发现,当奥贝胆酸微粒的平均粒径为3.0~250μm时可以保证得到一个生物利用度高且稳定的制剂,同时该制备方法工艺简单,适合于工业化大生产。需要说明的是,上述针对奥贝胆酸药物组合物所描述的特征和优点同样适用于该制备奥贝胆酸药物组合物的方法,此处不再赘述。
根据本发明的实施例,在将奥贝胆酸微粒与填充剂、崩解剂和润滑剂混合之前可以根据需要分别对填充剂、崩解剂和润滑剂进行过筛处理。由此,可以提高各组分的分散程度,从而保证所得药物组合物具有较高的生物利用度和稳定性。
本发明的奥贝胆酸药物组合物与现有技术相比,具有如下优点:
(1)本发明制剂组分简单,产品稳定,杂质少,活性成分含量高;
(2)本发明提高了奥贝胆酸的溶解性和溶出速度,提高了药物吸收的速度和程度,提高了药物的生物利用度;
(3)本发明通过考察奥贝胆酸原料药的粒径大小对药物的溶出及吸收的影响,明确制剂工艺的关键参数,为提高产品制剂水平垫定基础;
(4)本发明首次采用微粉化技术制备奥贝胆酸片,并开展了奥贝胆酸片的处方、工艺研究,其为国内外均未上市的产品。
本发明附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
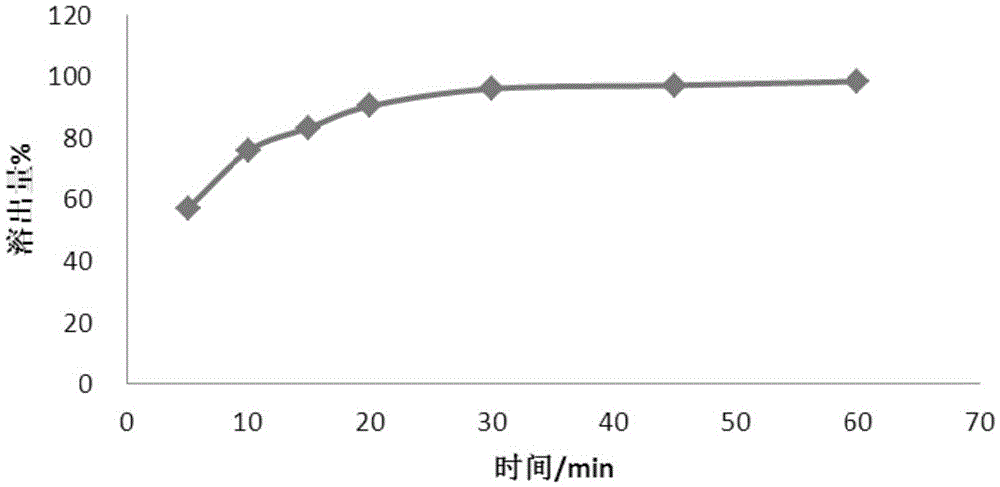
附图1:实施例1的奥贝胆酸片体外溶出曲线图;
附图2:实施例2的奥贝胆酸片体外溶出曲线图;
附图3:实施例3的奥贝胆酸片体外溶出曲线图;
附图4:实施例4的奥贝胆酸片体外溶出曲线图;
附图5:实施例5的奥贝胆酸片体外溶出曲线图;
附图6:实施例6的奥贝胆酸片体外溶出曲线图。
附图7:实施例7的奥贝胆酸片体外溶出曲线图;
附图8:实施例8的奥贝胆酸片体外溶出曲线图;
附图9:实施例9的奥贝胆酸片体外溶出曲线图;
附图10:实施例10的奥贝胆酸片体外溶出曲线图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
奥贝胆酸,白色粉末,由中美华世通生物医药科技(武汉)有限公司提供。
微粉化采用气流粉碎机,购自宜兴市精新粉体机械设备有限公司。
实施例1
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在3.0~5μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例2
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在10~150μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例3
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在150~250μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例4
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在6.2~10μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例5
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在3.0~10μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例6
处方:
制备工艺:
1.将奥贝胆酸原料药处理到平均粒径在3.0~10μm之间,备用;
2.分别将微晶纤维素、乳糖、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将羟丙纤维素用水配制成浓度为3%(W/V)的溶液备用;
4.将奥贝胆酸、微晶纤维素、乳糖和羧甲淀粉钠混合均匀,加入粘合剂制软材,制粒,在50℃~60℃干燥,整粒,加入硬脂酸镁混匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例7
处方:
制备工艺
1.将奥贝胆酸原料药处理到平均粒径在10~150μm之间,备用;
2.分别将微晶纤维素、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将奥贝胆酸、微晶纤维素、羧甲淀粉钠和硬脂酸镁混合均匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例8
处方:
制备工艺
1.将奥贝胆酸原料药处理到平均粒径在10~150μm之间,备用;
2.分别将微晶纤维素、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将奥贝胆酸、微晶纤维素、羧甲淀粉钠和硬脂酸镁混合均匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例9
处方:
制备工艺
1.将奥贝胆酸原料药处理到平均粒径在10~150μm之间,备用;
2.分别将微晶纤维素、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将奥贝胆酸、微晶纤维素、羧甲淀粉钠和硬脂酸镁混合均匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例10
处方:
制备工艺
1.将奥贝胆酸原料药处理到平均粒径在10~150μm之间,备用;
2.分别将微晶纤维素、羧甲淀粉钠和硬脂酸镁分别过80目筛备用;
3.将奥贝胆酸、微晶纤维素、羧甲淀粉钠和硬脂酸镁混合均匀,压片,即得符合本发明描述的一种奥贝胆酸片剂。
实施例的体外溶出试验:
奥贝胆酸片体外溶出的测定:
本发明体外溶出的测定方法采用中国药典2010年版二部附录XC第二法,以pH为6.8磷酸盐缓冲溶液900ml为溶出介质,转速为每分钟50转,温度为37℃。
在5、10、15、20、30、45、60分钟取样,取出的溶出液用0.45μm滤膜滤过,用HPLC法测定奥贝胆酸的溶出含量,并计算每个时间点的溶出量。
实施例1的体外溶出试验结果,见表1:
表1奥贝胆酸片体外溶出试验结果
实施例2的体外溶出试验结果,见表2:
表2奥贝胆酸片体外溶出试验结果
实施例3的体外溶出试验结果,见表3:
表3奥贝胆酸片体外溶出试验结果
实施例4的体外溶出试验结果,见表4:
表4奥贝胆酸片体外溶出试验结果
实施例5的体外溶出试验结果,见表5:
表5奥贝胆酸片体外溶出试验结果
实施例6的体外溶出试验结果,见表6:
表6奥贝胆酸片体外溶出试验结果
实施例7的体外溶出试验结果,见表7:
表7奥贝胆酸片体外溶出试验结果
实施例8的体外溶出试验结果,见表8:
表8奥贝胆酸片体外溶出试验结果
实施例9的体外溶出试验结果,见表9:
表9奥贝胆酸片体外溶出试验结果
实施例10的体外溶出试验结果,见表10:
表10奥贝胆酸片体外溶出试验结果
实施例1-10的体外溶出试验结果曲线图分别如图1-10所示。
结论:由实施例1至实施例5(图1-5)的体外溶出结果表明:不同平均粒径的奥贝胆酸原料,采用相同的工艺,制得的片剂,在相同的溶出条件下,随粒径的减小其 溶出度逐渐增大,但当平均粒径小于10μm后,粒径将不再影响体外溶出度。在3.0~10μm的粒径范围内,产品溶出曲线最优。
实施例5至实施例10(图5-10)的体外溶出结果表明:不同晶型的奥贝胆酸原料在选定的平均粒径3.0~150μm内,采用相同(或不同)的工艺,即通过湿法制粒压片与粉末直接压片两种方法制得的片剂,其体外的溶出是相同的。
在本发明的描述中,需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!