氨基噻唑类MyD88特异性抑制剂TJM2010-5的应用的制作方法
本发明涉及一种氨基噻唑类药物,具体地指一种氨基噻唑类MyD88特异性抑制剂TJM2010-5的应用,特别是制备免疫抑制剂和免疫调节剂方面的应用。
背景技术:
一直以来,医学证明对机体免疫系统的抑制性调控是治疗多种疾病的关键,如治疗器官移植后排斥反应、自身免疫性疾病、炎症性疾病及肿瘤、缺血再灌注损伤等。
虽然免疫学很早就知道机体免疫系统分为天然免疫和获得性免疫两部分,后者一直以来被当作免疫的主要研究对象和干预标靶,因为其表现有特异性极强的识别功能和高效的反应效果。传统免疫反应被认为是由获得性免疫系统的第一和第二刺激信号激活NF-κB,激活的NF-κB进入细胞核,启动转录,细胞合成和分泌各种炎性细胞因子,引发随后的一系列免疫反应。目前的抗排斥药物都是作用在获得性免疫系统上的。天然免疫一直被忽略,被认为是机体的天然保护屏障,主要是抗击病毒细菌感染、外来生物入侵等,但最近几年大量的研究发现天然免疫系统在移植免疫、自身免疫性疾病和缺血损伤等方面发挥着极其重要的作用。天然免疫系统中又以Toll样受体(Tool-Like Receptor,TLR)发挥最主要的作用而最受关注,目前发现TLR有至少14个亚型,主要分布在APC等免疫细胞上,这些亚型除TLR3以外,都要通过髓样分化蛋白(myeloid-differentiation protein 88,MyD88)分子传递信号。大量的研究显示各种内源性和外源性的危险因子,刺激天然免疫系统的各个TLR,刺激信号经关键分子MyD88传导,激活IRAKs、TRIF、TRAM/TRIF、IRF7等信号通路中的激酶,IRAK最后也激活NF-κB,其后的免疫反应过程与前述的一样,而其它的通路通过调控炎性因子如IFN-α和IFN-β及其基因的表达来激活炎性反应。因此,MyD88就是天然免疫的关键分子节点,阻断了MyD88就阻断了天然免疫系统的主要反应,进而产生非常广泛而且强烈的免疫抑制效果。这种抑制效果的广泛性和强度,比传统的只作用于NF-κB的获得性免疫系统的药物的效果要强大得多。
技术实现要素:
本发明的目的在于提供氨基噻唑类小分子化合物TJM2010-5作为MyD88特异性抑制剂,并应用其对天然免疫中MyD88分子的抑制作用,治疗多种免疫相关性疾病。实现本发明的具体技术方案的基础在于,本发明首先提出将TJM2010-5作为抗移植排斥及移植物抗宿主反应(GVHD)、抗自身免疫疾病、抗缺血再灌注损伤、器官组织细胞保存、防治慢性迁延性炎症恶性循环及其恶性转化(癌变)、抗内毒素血症等应用,是利用其对天然免疫中MyD88分子的抑制作用。
本发明所述的MyD88蛋白由两个结构域组成:包括TIR(toll/IL-1recptor domain)域和DD域(death domain),TIR域是MyD88发生自身同源二聚化的物质基础,进而活化下游的IRAK1或IRAK4等激酶。经过对MYD88的TIR域的拓扑结构学分析后,合成MyD88特异性抑制剂TJM2010-5。它们能特异性的结合在MyD88的TIR域,干扰MyD88的TIR域的功能,阻止MyD88形成同源二聚体,使MyD88不能活化,从而阻断MyD88通路转导,进而不能激活其下游的IRAKs、TRIF、TRAM/TRIF、IRF7等激酶,其中的IRAK不能激活NF-κB,其它激酶也不能激活其它途径包括IFNs等炎性因子的激活等,从而阻断了炎性反应,因而在相关的炎症及免疫疾病治疗方面有重要治疗作用。
本发明所述的氨基噻唑类MyD88特异性抑制剂的分子结构如下:
TJM2010-5
3-(4-benzylpiperazin-1-yl)-N-(4-phenylthiazol-2-yl)propanamide
3-(4-苄基哌嗪-1-基)-N-(4-苯基噻唑-2-基)丙酰胺
MyD88特异性抑制剂TJM2010-5分子极小,结构稳定,可穿透细胞膜,并可同时在体内外应用。
本发明设计人在TLR/MyD88方面所作的一系列前期研究,验证了TLR在免疫中起着重要作用,并通过对MyD88基因敲除小鼠的研究证实阻断MyD88分子能够诱导和维持移植免疫耐受,而在后期的相关研究中,本发明设计人通过与药学专业团队合作,制造合成并反复筛选获得了MyD88特异性抑制剂:代号TJM2010-5,此小分子 化合物由于结构上的活化位点与MyD88分子的关键活化位点相匹配而能特异性结合,故能够竞争性结合而抑制MyD88相应的信号传导。因此,将MyD88特异性抑制剂TJM2010-5应用于抗移植排斥及移植物抗宿主反应(GVHD)、抗自身免疫疾病、抗缺血再灌注损伤、防治结肠、肝脏等脏器慢性炎症及其恶性转化(癌变)、抗内毒素血症等,开创了此类小分子物质的应用先河,为多种天然免疫相关性疾病找到了一种全新的药物治疗可能。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,作为NF-κB和其它多种炎性因子的抑制剂,在制备免疫调节类药物上的应用。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,在制备治疗减低移植后排斥反应以及移植免疫耐受诱导和维持方面药物上的应用,如防治移植后排斥反应、诱导移植免疫耐受、抗移植物抗宿主反应(GVHD)等。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,在制备治疗多种炎症、慢性炎症性疾病以及炎症介导的相关肿瘤药物上的应用。
本发明氨基噻唑类的特异性抑制剂TJM2010-5,在制备治疗多种自身免疫性疾病药物上的应用。例如I型糖尿病、多发性硬化症、红斑狼疮等。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,在制备治疗缺血再灌注损伤保护剂上的应用。例如预防和治疗心梗后缺血再灌注损伤、断肢再植后缺血再灌注损伤、移植物术后的缺血再灌注损伤以及器官保存液、组织保存液、细胞保存液的制作等。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,在制备内毒素血症和脓毒血症防治药物上的应用。
本发明氨基噻唑类MyD88的特异性抑制剂TJM2010-5,在制备治疗结肠炎和结肠癌药物上的应用。TJM2010-5作为免疫反应起始点抑制剂,在炎症反应的最起始点阻断炎症反应和炎症恶性循环,通过改变炎症病灶中炎性细胞、致瘤炎性细胞、巨噬细胞等种类及比例等,在治疗多种慢性难治性炎症性疾病以及防治其恶性转化(癌变、炎症介导性癌症)等上的应用。例如慢性结肠炎及其癌变(结肠癌)、慢性肝炎肝硬化及相关肝癌、慢性支气管炎及肺癌、慢性萎缩性胃炎胃溃疡及胃癌等。
本发明的有益效果:本发明将化合物TJM2010-5作为MyD88特异性抑制剂应用 在实验中,充分证实了该在用于移植后抗排斥和诱导免疫耐受、治疗各种炎症反应、防治缺血再灌注损伤等方面具有明显的效果。将是一种有效的免疫抑制剂、或移植耐受诱导剂、或移植耐受维持剂、抗炎药物和免疫调节剂。该类新型化合物能够有效抑制CD80、CD86表达,从而阻止DC细胞的成熟。DC细胞成熟已被证明为多种自身免疫性疾病如自身免疫性心肌病、实验自身免疫性葡萄炎、I型糖尿病、多发性硬化症、红斑狼疮等发病的关键步骤之一。故MyD88抑制剂TJM2010-5可用于此类疾病的治疗。MyD88途径阻断可以明显起到对缺血再灌注损伤的保护作用,故MyD88抑制剂TJM2010-5可用于防止如心梗后缺血再灌注损伤、断肢再植后缺血再灌注损伤、移植物术后的缺血再灌注损伤、器官保存液、细胞保存液等许多方面起到重要作用。体外实验结果表明MyD88抑制剂TJM2010-5通过抑制该通路能有效减少移植物内炎症因子水平,说明其与炎症因子的产生密切相关,故可能成为各类炎症治疗的有效手段,阻止慢性炎症恶性循环及其恶性转化,防治炎性癌变等等。
附图说明
图1a为TJM2010-5抗心脏排斥的生存曲线。
图1b为TJM2010-5抗皮肤移植物排斥的生存曲线。
图2a为TJM2010-5抗GVHD疗效图,其中,图2a-A示TJM2010-5治疗组与对照组的体重差异,图2a-B示TJM2010-5治疗组与对照组的GVHD分级,图2a-C示TJM2010-5治疗组和对照组的存活率。
图2b为TJM2010-5联合MR1治疗小鼠急性GVHD疗效图,其中,图2b-A为体重差异比较图,图2b-B为GVHD等级差异比较图,图2b-C为存活率差异比较图。
图2c为各组小鼠的大体表现和各个组织切片的GVHD差别图,其中,图2c-A为小鼠外观状态比较图,图2c-B为各组间皮肤组织切片对比图,图2c-C为各组间肝脏组织切片对比图,图2c-D为各组间小肠组织切片对比图,图2c-E为各组间脾脏组织切片对比图(其中1代表对照组、2为TJM2010-5单独治疗组、3为MR1单独治疗组、4为TJM2010-5和MR1联合治疗组)。
图3a为TJM2010-5剂量相关地减少T细胞活化图。
图3b为LPS、CPG、心肌组织匀浆溶媒刺激DC,TJM2010-5下调CD80的表达图。
图3c为TJM2010-5剂量相关性下调DC表面CD80表达图。
图3d为TJM2010剂量相关性下调巨噬细胞表面CD80表达图。
图4为TJM2010-5减低糖尿病发生率曲线图。
图5为TJM2010-5影响移植受体体内淋巴细胞亚群柱状图。
图6为TJM2010-5改善小鼠肾脏IRI生存率生存曲线图。
图7为TJM2010-5保护小鼠肾脏IRI肾功能(血肌酐、尿素氮)图。
图8为TJM2010-5减弱CpG刺激DC活化引发的T细胞增殖流式图。
图9a为TJM2010-5减少移植物内炎性因子IL-1β实时定量PCR分析图。
图9b为TJM2010-5减少移植物内炎性因子TNF-α实时定量PCR分析图。
图9c为TJM2010-5减少移植物内炎性因子IL-6实时定量PCR分析图。
图10a为TJM2010-5减少肺炎模型中炎性细胞渗出图(支气管肺泡中细胞总数)。
图10b为TJM2010-5减少肺炎模型中炎性细胞渗出图(支气管肺泡中性粒细胞数)。
图11a为TJM2010-5减少肺组织中髓过氧化酶活性的效果比较图。
图11b为TJM2010-5减少肺组织中白细胞介素-6浓度的效果比较图。
图12A为TJM2010-5抑制AOM/DSS诱导的结肠炎并防止其诱导的结肠癌实验中的小鼠体重比较图。
图12B为TJM2010-5抑制AOM/DSS诱导的结肠炎并防止其诱导的结肠癌实验中的小鼠存活率比较图。
图12C为TJM2010-5抑制AOM/DSS诱导的结肠炎并防止其诱导的结肠癌实验中的小鼠结肠解剖图。
图12D为TJM2010-5抑制AOM/DSS诱导的结肠炎并防止其诱导的结肠癌实验中的结肠癌发生率比较图。
图12E为TJM2010-5抑制AOM/DSS诱导的结肠炎并防止其诱导的结肠癌实验中的各组结肠病理切片比较图。
图12F为TJM2010-5抑制AOM/DSS诱导的结肠炎症打分的比较图。
图13A为TJM2010-5抑制了IRAK4激活的效果图。
图13B为TJM2010-5抑制NF-κBp65激活图。
图13C为TJM2010-5抑制各类炎症因子表达的效果图,其中,图13C1~5分别为TNF-α、IL-6、G-CSF、MIP-1β、TGF-β1的表达图。
图13D为TJM2010-5抑制IL-6和TGF-β1的mRNA表达图,其中,图13D1和13D2分别为IL-6、TGF-β1的mRNA表达图。
图14A为TJM2010-5抑制炎性细胞的组织切片比较图。
图14B为TJM2010-5抑制LPMCs中的F4/80+CD11b+肿瘤介导巨噬细胞效果比较图。
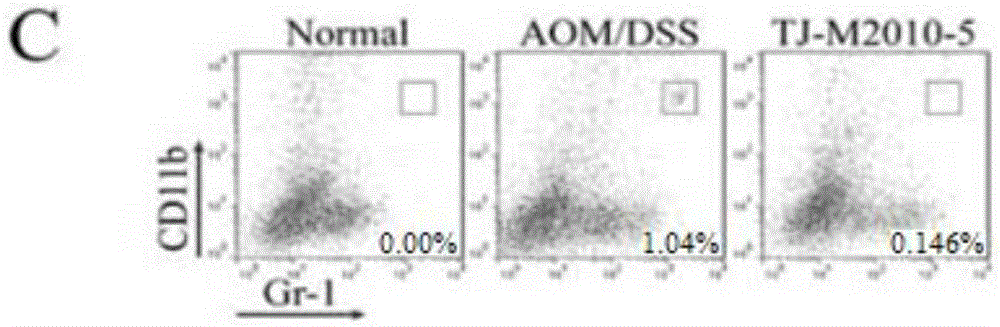
图14C为TJM2010-5抑制Gr-1highCD11bhigh MDSC髓样抑制细胞侵润的效果比较图。
图14D为TJM2010-5使IL-6的表达减少的效果图。
图15a为内毒素致死实验生存曲线。
图15b为脓毒血症致死实验生存曲线。
具体实施方式
以下结合附图和具体实施例对本发明作进一步的详细描述。
应用实例1:TJM2010-5用于移植后抗排斥反应和诱导移植免疫耐受。
1)TJM2010-5用于小鼠心脏移植模型
实验共分为四组,分别为:对照组(不做任何处理,做心脏移植)、CMC组(溶媒对照组)、TJM2010-5用药组(效果检测组)和环孢素A(CsA)对照组。具体处理方法如下:
对照组:取Balb/c小鼠心脏移植到C57bl/6小鼠腹腔,术后不做特殊处理;
CMC对照组:取Balb/c小鼠心脏移植到C57bl/6小鼠腹腔,术后心脏移植前第0天到第6天给予腹腔注射不含TJM2010-5的羧甲基纤维素钠(0.5%CMC)溶液,200μl。
TJM2010-5用药组:取Balb/c小鼠心脏移植到C57bl/6小鼠腹腔,术后心脏移植前第0天到第6天给予腹腔注射溶于CMC的TJM2010-5,150mg/kg。
CsA用药组:取Balb/c小鼠心脏移植到C57bl/6小鼠腹腔,术后心脏移植前第0天到第6天给予腹腔注射CsA 15mg/kg/day。
所得到实验结果如生存曲线图(见附图1a)所示,附图1a中Balb/c和C57bl/6为两种小鼠品系,分组:Balb/c心脏移植给C57bl/6为普通对照组,CMC溶媒对照组,C57bl/6到C57bl/6为同系对照图,TJ-M2010实验组,CsA对照组。结果显示对照组和文献报道排斥时间基本一致,为8天左右;CMC溶媒对照组无差异;TJM2010-5用 药组80%以上心脏移植物长期存活达100天,较对照组有明显延长。
2)TJM2010-5联合共刺激分子抑制剂-抗CD154单抗(MR1)用于小鼠皮肤移植模型
实验分为5组:异基因皮肤移植对照组(文献报导排斥时间为8~10天)、单用TJM2010-5组、单用MR1组和联合用药组(TJM2010-5+MR1)。
具体处理方式如下:
异基因皮肤移植CMC对照组:取Balb/c小鼠皮肤移植到C57bl/6小鼠背部,术后第0~3,5,7,9,11,13,15天腹腔注射0.5%CMC200μl/天;同基因皮肤移植组:取C57bl/6小鼠皮肤移植到C57bl/6小鼠背部,术后不做特殊处理。
单用TJM2010-5组:取Balb/c小鼠皮肤移植到C57bl/6小鼠背部,术后第0~3,5,7,9,11,13,15天分别腹腔注射溶于0.5%CMC的TJM2010-5,150mg/kg/d;
单用MR1组:取Balb/c小鼠皮肤移植到C57bl/6小鼠背部,术后第0,1,3,7,14天给予腹腔注射MR1,200μg/天;
联合用药组:取Balb/c小鼠皮肤移植到C57bl/6小鼠背部,术后术后第0~3,5,7,9,11,13,15天分别腹腔注射溶于0.5%CMC的TJM2010-5,150mg/kg/d,同时第0-3,5,7,9,11,13,15天给予腹腔注射MR1,200μg/天。
所得到实验结果如生存曲线图(见附图1b)所示,附图1b中异基因皮肤移植对照组(文献报导排斥时间为8~10天)、单用TJM2010-5组、单用MR1组和联合用药组(TJ-M2010-5+MR1)异基因皮肤移植对照组移植物排斥时间为10天左右,和文献报导时间一致,无统计学差异,而联合用药组(TJM2010-5+MR1)皮肤移植物长期存活达150天(文献认为>100天为移植物耐受)可见TJM2010-5和MR1单用对耐受诱导无明显效果,但联合应用效果显著,能使及其难以诱导耐受的皮肤移植物长期存活。
以上实验结果直接和间接说明,MyD88抑制剂在用于移植后抗排斥和诱导免疫耐受具有明显的效果。将是一种特殊的免疫抑制剂、或移植耐受诱导剂(短期用药即可使极难移植成功的皮肤移植物长期存活)、或移植耐受维持剂(如可对抗病菌感染所诱发的排斥)。其独特的作用是目前的免疫抑制剂不可比拟和替代的。
应用实例2:MyD88抑制剂TJM2010-5用于治疗GVHD。
1)TJM2010-5治疗GVHD效果实验
实验步骤
GVHD模型的制作:给予雌性BALB/c(H-2d)小鼠清髓性全身放射线照射(TBI,710cGy)(HI-ENERGY PRIMV S-M X-射线源),然后2小时内输注1.0x1010C57BL/6(B6,H-2b)小鼠的骨髓细胞,一部分还同时输注B6脾脏细胞1.0x1010。
分组:GVHD小鼠分成4组,第1组.对照组8只不做其它处理;第2组.TJM2010-5治疗组照射同天开始给予TJM2010-5每日50mg/kg灌胃治疗;第3组.MR1组8只,在第0、1、2、3、7、14天给予MR1每次10mg/kg治疗;第4组.TJM2010-5+MR1治疗组8只同时按上述方法给予TJM2010-5和MR1治疗。
结果:
1.TJM2010-5显著改善存活率和减轻GVHD等级(见图2a):附图2a显示TJM2010-5治疗GVHD疗效:其中,图2a-A示TJM2010-5治疗组体重明显高于对照组。图2a-B示TJM2010-5治疗组GVHD分级明显低于对照组。图2a-C示TJM2010-5治疗组存活率显著高于对照组。(P<0.05、P<0.05and P<0.01)
2.TJM2010-5联合MR1治疗完全逆转小鼠急性GVHD(见图2b)。附图2b显示TJM2010-5联合MR1治疗小鼠急性GVHD疗效:联合治疗效果在体重(图2b-A)、GVHD等级(图2b-B)、存活率(图2b-C)三方面与各对照组的差异(P﹥0.05:MR1vs Combination.*P<0.05and#P<0.01)。
联合治疗效果在体重、GVHD等级、存活率三方面均较TJM2010-5单独治疗效果更好,但MR1单独治疗无效(P﹥0.05:MR1vs Combination.*P<0.05and#P<0.01)。
各组小鼠的大体表现和各个组织切片显示出各个组的明显区别:图2c-B为各组间皮肤组织切片对比图,图2c-C为各组间肝脏组织切片对比图,图2c-D为各组间小肠组织切片对比图,图2c-E为各组间脾脏组织切片对比图(其中1代表对照组、2为TJM2010-5单独治疗组、3为MR1单独治疗组、4为TJM2010-5和MR1联合治疗组)?。GVHD小鼠瘦小、毛发稀疏脱落、腹泻严重、病死率高,而TJM2010-5治疗组相反,接近正常鼠。组织切片显示各个组织有典型严重的GVHD病变,而对照组则不明显或正常。
结论:TJM2010-5能明显抑制GVHD,与MR1联合应用疗效更好,可完全逆转GVHD。
2)TJM2010-5和TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4治疗GVHD的效果比较实验。
上述TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4药物的结构在中国专利申请201110049579.7中已公开,此处不做说明。
实验步骤同TJM2010-5治疗GVHD效果实验,将每组小鼠(8只)单独使用一种TJM2010+MR1联合药物,照射后同天开始给予TJM2010每日50mg/kg灌胃治疗,经过60天后,TJM2010-5和TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4对应组别的小鼠存活率分别为100%、28%、16%、37%、6%;结果显示TJM201-5表现出独特的抗移植物抗宿主反应(GVHD)。应用TJM2010-5治疗,可以明显改善GVHD各种症状,逆转70%GVHD。TJM2010-5如果和MR1联合应用,可以逆转100%的GVHD。而其它的氨基噻唑类化合物无此疗效,或疗效较弱。
应用实例3:MyD88抑制剂用于治疗自身免疫性疾病。
体外实验——细胞流式仪结果:证明MyD88抑制剂可阻止DC成熟,用于治疗自身免疫性疾病。
步骤:
1.应用了TJM2010-5的BALB/c小鼠来源骨髓细胞,破红,2×106/ML密度RPMI1640培养基(加GM-CSF10ng/ml,IL-410ng/ml)
2.48小时去悬浮细胞,第六天收悬浮及半贴壁细胞
3.DCs加50mM TJM2010-5培养1小时,加入坏死心肌上清液,LPS(200ng/ml),Poly I:C(20mg/ml),CpG(10mg/ml)培养12小时
4.加流式抗体FITC标记抗CD80,CD86,上机检测
TJM2010-5抑制了RAW264.7细胞对TLR刺激物(LPS、CpG)引起的共刺激分子CD80的上调,说明TJM2010-5能够有效的阻断TLR信号通路,进而抑制了细胞的免疫反应。
附图3(c)、(d)实验过程如下:
Raw264.7:48孔板细胞数为9×105/孔,每孔1ml培养基体系,首先加入不同浓度梯度TJM2010-5预孵育2h,然后加入CPG,终浓度40ug/ml,37℃CO2培养箱孵育过夜(12h)。加流式抗体FITC标记抗CD80,CD86,上机检测;
DC:48孔板,细胞数为1×106/孔,每孔1ml培养基体系,首先加入不同浓度梯度TJM2010-5预孵育2h,然后加入LPS,终浓度1ug/ml,37℃CO2培养箱孵育过夜(12h)。
加流式抗体FITC标记抗CD80,CD86,上机检测以上二图中可见TJM2010-5对DC和巨噬细胞表面CD80表达起一浓度相关性抑制。结果见附图3,图3a中,TJM2010剂量相关地减少T细胞活化;附图3b中,LPS、CPG、心肌组织匀浆溶媒刺激DC,TJM2010-5下调CD80的表达。附图3c为TJM2010-5剂量相关性下调DC表面CD80表达,附图3d为TJM2010剂量相关性下调巨噬细胞表面CD80表达。TJM2010-5抑制LPS、CpG引起的共刺激分子CD80/CD86的上调。
以上检测结果说明MyD88抑制剂可降低CD80表达,从而阻止DC细胞的成熟。
DC细胞成熟已被证明为多种自身免疫性疾病如自身免疫性心肌病、实验自身免疫性葡萄炎、I型糖尿病、多发性硬化症、红斑狼疮等发病的关键步骤之一。故MyD88抑制剂可用于此类疾病的治疗。
体内试验:应用MyD88-/-以及TJ-M2010对构建I型糖尿病模型的影响
实验步骤:
1.实验分组:MyD88KO NOD小鼠,MyD88KO/+NOD小鼠,NOD小鼠TJM2010-5用药组
2.用药组:抗原注射前1天,第0~3,5,7,9,11,13,15天分别腹腔注射溶于0.5%CMC的TJM2010-5,150mg/kg/d
3.各组均腹腔注射分支杆菌抗原并持续监测其浓度
4.清洁级饲养观察30周,取尾静脉血,测非空腹血糖,连续2次所测血糖≥22mmol/L为糖尿病建模标准
所得I型糖尿病发生率曲线见附图4:
结果显示:MyD88KO杂合子组随着时间延长I型糖尿病发生逐渐增加,而MyD88KO纯合子组无I型糖尿病发生,TJM2010-5组I型糖尿病发生率与MyD88KO 纯合子组相当,说明MyD88通路与I型糖尿病的发生有必然的联系,阻断其通路能减少糖尿病的发生,因此小分子MyD88抑制剂TJ-M2010可能成为I型糖尿病的有效防治方法。
应用实例4:MyD88抑制剂用于预防和治疗缺血再灌注损伤。
体外实验:对接受抗原(同基因,异基因)刺激的受体脾脏内淋巴细胞亚群分析及同时接受过TJM2010-5治疗的受者体内CD4+CD25+Foxp3+T细胞比例流式检测
实验步骤:TJM2010-5
1、取不同组别(同基因,异基因抗原刺激)受体脾脏,碾磨分离淋巴细胞
2、加流式抗体APC标记的IFN-γ和APC标记的IL-17,APC标记的CD25和PE标记的Foxp3
3、上流式细胞仪分析不同移植组别受体脾脏内淋巴细胞亚群和TJM2010-5治疗的移植受者体内CD4+CD25+Foxp3+T细胞比例
见附图5,结果显示TJM2010-5治疗的移植受者体内CD4+CD25+Foxp3+T细胞比例明显上调,而IFN-γ和IL-17明显低于CMC对照组。
通过应用MyD88抑制剂TJ-M2010后,对移植受体脾脏内淋巴细胞亚群分析和CD4+CD25+Foxp3+T细胞比例的检测发现TJM2010-5的应用通过上调CD4+CD25+Foxp3+T细胞而改变受体小鼠的移植耐受状态。而大量文献表明调节性T细胞可以通过其免疫抑制作用调节炎症的发展,炎症因子,促炎症因子的释放与缺血再灌注时细胞因子的交联,从而出现损伤,因此,TJM2010-5的应用通过抑制TLR信号,抑制NF-kB活化,减少炎症因子(IFN-γ和IL-17)的表达,从而减轻损伤。
体内实验部分:
MyD88途径阻断减轻肾脏缺血再灌注损伤实验:
实验步骤:
1.分组:普通C57bl/6组(Control),CMC溶媒组,MYD88KO组,TJ-M2010组各组8只做缺血再灌注处理:麻醉,血管夹阻断左侧肾脏,置温箱31℃,80min后开放并切除右侧肾脏,关腹。24小时取血用于BUN,Cr检测。
2.TJM2010-5组和CMC组,术前1天和手术当天分别腹腔注射溶于0.5%CMC的 TJ-M2010-5,150mg/kg/d;CMC组:0.5%CMC溶液,200μl。
3.观察小鼠生存时间,做生存曲线。血标本送病理科做BUN,Cr检测。
4.结果显示TJM2010-5显著提高小鼠肾脏IRI后生存率,而且对肾功能有很好的保护效果。
结果见附图6和附图7。由以上实验可见MyD88途径阻断可以明显起到对缺血再灌注损伤的保护作用,故MyD88抑制剂可用于防止如心梗后缺血再灌注损伤、断肢再植后缺血再灌注损伤、移植物术后的缺血再灌注损伤、器官保存液、细胞保存液等许多方面起到重要作用。
应用实例5:MyD88抑制剂用于治疗炎症性疾病。
体外实验:TJM2010-5减弱CpG刺激DC活化引发的T细胞增殖及移植物内炎性因子实时定量PCR分析
实验步骤:
1、取Bal b/c小鼠股骨,分离骨髓细胞,加入GMS-CSF和IL-4细胞因子,培养骨髓源性DC。
2、培养至第六天,吹打细胞,分离未成熟DC。离心,1640培养基重悬。
3、加入丝裂霉素(使终浓度达50μg/ml),37℃水浴,15min。1640洗一次,计数。
4、取C57bl/6小鼠脾脏,利用小鼠淋巴细胞分离液分离脾脏淋巴细胞,并计数。
5、取C57bl/6小鼠脾脏淋巴细胞标记CFSE。
6、Bal b/c来源的DC与C57bl/6小鼠淋巴细胞做混合淋巴细胞培养。并分组如下:
空白组:在混合培养的过程中不加CPG及TJM2010-5。
对照组:在混合培养的过程中加CPG而不加TJM2010-5。
实验组1:在混合培养的过程中同时加CPG及TJM2010-5,其中TJM2010-5的量为10μM。
实验组2:在混合培养的过程中同时加CPG及TJM2010-5,其中TJM2010-5的量为20μM。
实验组3:在混合培养的过程中同时加CPG及TJM2010-5,其中TJM2010-5的量为40μM。
1、培养至第三天,收集细胞,流式检测C57bl/6小鼠淋巴细胞增殖情况。
流式结果见附图8,结果显示:随着TJM2010-5量的增加,T细胞增殖(CD44为其表面标志)呈下降趋势,说明TJM2010-5可减弱CpG刺激DC活化引发的T细胞增殖。
实时定量PCR步骤:
1.从接受抗原(同基因,异基因)刺激的受体用TRIzol法抽提总RNA
2.逆转录为cDNA,两步法RT-PCR
3.做标准曲线对比得出IL-1β,TNF-α,IL-6相对水平
附图九为移植物内炎性因子(IL-1β,TNF-α,IL-6)实时定量PCR分析结果显示:心脏移植物内炎症因子水平TJM2010-5组明显比对照组低,有显著统计学差异体外实验结果表明MyD88抑制剂TJM2010-5通过抑制该通路能有效减少移植物内炎症因子水平(IL-1β,IL-6较CMC异基因移植组明显降低),说明其与炎症因子的产生密切相关,故可能成为各类炎症治疗的有效手段。
体内试验:
MyD88途径阻断降低小鼠气管炎症反应
方法与步骤:
1.动物分组:C57bl/6(B6)NaCl(200μl滴鼻)组,C57bl/6(B6)BLM组和TJM2010-5BLM组(第0~3,5,7,9,11,13,15天分别腹腔注射溶于0.5%CMC的TJM2010-5,150mg/kg/d)。
2.BLM(博来霉素)滴鼻制作肺炎模型:40μl氯胺酮甲苯噻嗪气道麻醉,鼻腔滴入法BLM硫酸盐(300μg or 15mg/kg)
3.支气管肺泡灌洗液(BAL)收集细胞及细胞因子:切开气管,插入塑料套管,37℃,0.3mlPBS灌洗,抽吸灌洗液(回抽达95%以上),重复10次。灌洗液分两部分:一部分用于细胞因子检测(600g离心10min收集上清存放-80℃用于检测)一部分用于细胞计数(连同下层0.4ml重悬)4℃计数
4.肺匀浆检测组织内细胞及因子:BAL后,取整肺,搅碎,离心取上清-80℃存 放用于MPO的检测
5.肺MPO活性检测:盐水经右心充分灌洗肺脏,肺匀浆,离心去上清,1mlPBS(含0.5%HTAB,5mM EDTA)重悬沉淀。离心,50μl上清加入试管(200μlPBS-HTAB-EDTA,2mlHBSS,100μl二盐酸邻联茴香胺(1.25mg/ml),100μl H2O20.05%),15min,37℃漩涡水箱,100μl NaN31%中止反应,460nm检测MPO吸光度值。
6.细胞计数:MG-1L染色4min,95%GS-500染色8min,涂片计数
7.因子检测:IL-6水平用ELISA检测
8.统计学分析:U检验分析统计学差异
附图9显示MYD88-/-小鼠在支气管炎发生过程中募集中性粒和淋巴细胞减少。
实验分组:B6NaCL组,B6BLM组和TJ-M2010BLM组(n=4)
附图10显示在TJM2010-5组支气管肺泡中性粒细胞募集明显减少。a图显示第1,7,11天的细胞总数,WT小鼠和TJM2010-5BLM组有统计学差异;b图显示WT小鼠支气管肺泡中性细胞24h达峰,持续7天,11天恢复,而TJM2010-5组明显募集减少。
附图11显示TJM2010-5BLM组减轻BLM诱导的肺炎症反应,表现为炎症细胞及炎症因子的减少。a图肺组织中MPO因子(第7天检测)的减少;b图分别显示24h肺组织中IL-6的减少。
从炎症细胞的募集到炎症因子的释放两个方面的实验可以看出TJM2010-5BLM组明显减轻BLM引起的肺炎症反应,从而证明TJM2010-5的抗炎效果。
以上实验说明MyD88途径阻断可降低炎症反应。因此MyD88抑制剂可用于治疗多种慢性炎症性疾病,如慢性炎症性肠病、哮喘等。
应用实例6:MyD88抑制剂TJM2010-5用于防治慢性炎症、炎症相关肿瘤及其机理
1)TJM2010-5防治结肠炎和结肠癌效果实验
实验步骤:
制作慢性结肠炎和结肠炎介导的结肠癌colitis-associated colorectal cancer (CAC)模型:40只Balb/c小鼠腹腔注射10mg/Kg azoxymethane(AOM)(Sigma-Aldrich Chemical),7天后开始三次循环喂食2.5%dextran sodium sulfate(DSS)(MP Biomedicals)的饮水,每次循环为1周DSS水和2周普通淡水,随后观察10周。发现经AOM/DSS处理小鼠全部发生结肠炎,便血,体重明显下降,存活率明显低于TJM2010-5治疗组,本组小鼠100%发生结肠癌。
TJM2010-5治疗组:20只Balb/c小鼠在行上述处理前2天开始TJM2010-550mg/kg灌胃,观察期为10周。
机理研究:在满2周和7周时每组4只实验鼠取血清、结肠、脾脏等标本检测IRAK4和炎性细胞因子、巨噬细胞和Gr-1highCD11bhigh MDSC的侵润、LPMCs(固有层单核细胞)F4/80+CD11b+巨噬细胞的比例等等。
实验结果:
1.TJM2010-5治疗组所有小鼠体重不下降,附图12A示TJM2010-5治疗组体重明显高于未治疗组。
2.TJM2010-5治疗组存活率明显高于对照组,见附图12B。
3.TJM2010-5治疗组未发现有明显结肠炎,附图12C示TJM2010-5治疗组,所有小鼠未发现结肠炎和结肠癌。而对照组全部发生严重的结肠炎和结肠癌。见附图12C、D、E、F。
结论:MyD88抑制剂TJM2010-5能够显著抑制AOM/DSS诱导的结肠炎,并能彻底防止结肠炎导致的结肠癌的发生。
4.TJM2010-5抑制了IRAK4的激活和细胞因子等的产生,见附图13。附图13A示TJM2010-5抑制了IRAK4的激活,使p-IRAK4减少,而对照组AOM/DSS的相应指标明显高于治疗组。附图13B示TJM2010-5抑制NF-κBp65的激活。附图13C示TJM2010-5治疗组的各种炎性细胞因子TNF-α,IL-6,G-CSF,MIP-1β及TGF-β1等产生量明显低于对照组。附图13D示TJM2010-5治疗组的IL-6and TGF-β1mRNA水平明显低于对照组。
5.TJM2010-5治疗使CAC结肠中的巨噬细胞和Gr-1highCD11bhigh MDSC(髓样抑制细胞)的侵润和IL-6的表达减少。LPMCs中的F4/80+CD11b+肿瘤介导巨噬细胞减少,见附图14。
2)TJM2010-5和TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4的防治结肠炎和结肠癌效果比较实验。
实验步骤同TJM2010-5防治结肠炎和结肠癌效果实验,将每组Balb/c小鼠20只,共6组,小鼠在行AOM/DSS处理前2天分别开始用TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4、TJM2010-550mg/kg灌胃,观察期为10周。TJM2010-5和TJM2010-1、TJM2010-2、TJM2010-3、TJM2010-4、TJM2010-5对应组别的小鼠发生结肠炎和结肠癌的分别0%、71.52%、42.28%、60.19%、81.34%天;2.TJM2010-5能100%预防和治愈慢性结肠炎以及预防慢性结肠炎所致结肠直肠癌。TJM2010-5灌胃治疗使上述表现消失,病检证实没有明显结肠直肠炎表现。其它的氨基噻唑类化合物无此疗效或疗效较弱。
应用实例7:MyD88抑制剂用于治疗内毒素血症以及脓毒血症
第一部分:观察MyD88抑制剂对内毒素血症小鼠死亡率的影响。小鼠随机分为2组:
溶剂对照组(Vehicle)和实验组(TJM2010-5防治组),各20只。其中TJM2010-5防治组给予TJM2010-5(0.5%CMC溶剂,25mg/ml)灌胃,剂量为250mg/kg(200μL每只);溶剂对照组给予0.5%CMC灌胃,200μL每只。每天一次,连续灌胃三天。第三天灌胃后1小时后予LPS腹腔注射,每十二小时观察存活情况,观察三天。观察得到的生存曲线情况如图15(a),如图所示,所用的两种MyD88抑制剂能有效延迟内毒素致死事件,降低内毒素的致死率。
第二部分:观察MyD88抑制剂对脓毒症小鼠死亡率的影响。小鼠随机分成:假手术组、模型组、MyD88抑制剂治疗组。除假手术组只做开腹后缝合以外,对脓毒症模型组和MyD88抑制剂治疗组小鼠施行盲肠结扎穿孔术(CLP),复制脓毒症小鼠模型。术后1h,分别予以0.5%CMC200μL或TJM2010-5灌胃250mg/kg(200μL),1次/12h,连续4次。术后每12h观察各组小鼠生存率一次,连续观察72h。所得观察生存率情况如图15(b)。
如图可见,MyD88抑制剂TJM2010-5对小鼠脓毒症死亡时间和最终死亡率有比较明显改善作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 氨基‑取代的异噻唑的制造方法与工艺
- 一种吡啶联噻唑类羧酸衍生物的合成方法与制造工艺
- 5-胡椒基-4-烷基-2-苄亚氨基噻唑及其制备方法与应用
- 5-苄基-4-烷基-2-芳氨基噻唑及其制备与应用的制作方法
- 4-叔丁基-5-(1-芳基-2-硝乙基)-2-酰氨基噻唑及其制备方法与应用的制作方法
- 4-叔丁基-5-(2-硝乙基)-2-氨基噻唑及其制备方法与应用的制作方法
- 2-芳基吗啉及其盐作为杀虫剂的应用的制作方法
- 5-[2-(苄亚氨基)噻唑-4-基]呋喃酚醚作为制备杀菌剂的应用的制作方法
- 具有杀虫活性的4-叔丁基-5-苄基-2-酰氨基噻唑及制备方法
- 具有杀虫活性的4-叔丁基-5-(1-芳基-2-硝乙基)-2-酰氨基噻唑及制备方法