热敏材料在制备热消融中保护脏器周围结构注射液的应用的制作方法
本发明涉及医药领域,具体的说,是涉及一种热敏材料在制备保护脏器热消融时周围结构注射液的应用,更具体的说,是涉及一种热敏材料在制备哺乳动物腹腔实体脏器邻近被膜肿瘤热消融过程中,保护脏器热消融时周围结构的注射液的应用。
背景技术:
“肿瘤热消融”定义为对某一肿瘤(或几个肿瘤)直接应用热能为基础的治疗,以消灭或彻底破坏肿瘤,包括射频消融,微波消融,激光消融,高强度超声聚焦治疗。其中临床应用最广泛的热消融技术为射频消融术。
射频消融术(radiofrequency ablation,RFA):借助超声或CT等影像手段引导,把电极针插入肿瘤内,通过电极针发射射频能量,使肿瘤局部组织发生离子震荡,摩擦生热,产生60℃以上高温、肿瘤组织蛋白变性,最终发生凝固性坏死而达到杀灭肿瘤的目的,是临床治疗肝癌的一种有效的微创手段。射频消融治疗的死亡率约0.3-4.5%,严重并发症的发生率约2.2-8.9%。这些结果证实RFA是治疗肝肿瘤相对低风险的方法。目前,射频消融已经广泛应用于治疗腹腔实体脏器的肿瘤,如肝脏、肾脏和脾脏。然而,对于经皮途径治疗脏器被膜下肿瘤,如邻近膈肌、胆囊、胃肠道的应用,热损伤的风险增加。另外,被膜下肿瘤治疗过程的一个局限性是来自邻近腹膜壁层灼烧感和疼痛感。因此,对脏器周围重要结构损伤及相关并发症的预防受到日益关注。
为了减少对肝周重要结构损伤及相关并发症的预防,既往研究报道经皮注射液体或气体制造人工腹水,分离肝与外周易热损伤的结构,使热消融更安全。常用的液体如生理盐水、5%葡萄糖溶液等,气体如二氧化碳(CO2)等。
由于这些常规注射液体流动性大,在目标区域存留时间短,并可以被很快地吸收,有时难以达到充分的隔离效果,依然导致热损伤肝周结构。因此,需要大量的液体(1-3L)或持续灌注,确保液体达到足够的保护厚度,这些常导致患者术后不适。而 用CO2作为人工腹水材料则影响肿瘤的超声显像。
应用球囊导管经皮穿刺置入到肝周,使球囊充气,体积增加,推开肝周的膈肌或肠管等结构。通过这种机械分离,使肝内热消融区域与肝周重要结构分开,防止损伤。治疗结束后,排出球囊气体,将导管撤出体内。
应用球囊导管经皮穿刺置入到肝周,由于导管管径较粗,穿刺操作增加了对人体的创伤,引起并发症增加。腹腔内粘连时,通过球囊充气的机械性分离容易撕裂肝周结构,造成出血或肠壁撕裂等。另外,这项技术对操作者的要求较高,需要把球囊置入准确位置,不能有偏移。最后,该项技术一般在CT引导下进行,有放射性辐射,对人体有一定损伤。
因此,亟需一种有效的热消融被膜下肿瘤时,减少脏器周围结构损伤的保护手段。
技术实现要素:
本发明的一个目的在于提供一种热敏材料在制备哺乳动物腹腔实性脏器邻近被膜肿瘤热消融过程中,保护脏器热消融时周围结构的注射液的应用;
本发明的另一个目的在于提供一种热消融中保护脏器周围结构的注射液。
为达上述目的,一方面,本发明提供了一种热敏材料在制备保护脏器热消融时周围结构的注射液的应用,其是在哺乳动物腹腔实性脏器邻近被膜肿瘤热消融过程中保护脏器周围结构,所述热敏材料在温度在0-25℃为能够自由流动的液体状态,而温度增加至34-37℃(体温)可以快速转变为无流动性的固相或半固相(可在原位停留)。
其中可以理解的是,本发明所述的无流动性是指失去像水一样的液体的流动性,在静止状态下不会像液体一样均匀分散开,而能大体保持一个具有一定形状的固体或半固体形态。
而所述的半固体形态可以理解为如胶状、冻状的,能够在一定范围内改变形状的,介于可以自由流动的液态和不会发生较大形状改变的固态之间的状态。
根据本发明一些具体实施方案,其中,所述热敏材料在0-4℃(冰盒温度)保持液体状态,或者在10-22℃(室温)保持液体状态。
其中可以理解的是,本发明所述的在0-25℃保持液体状态是指至少在0-25℃保持能够自由流动的液体状态,以使得所述热敏材料可以在这个温度范围内通过如注射器或导管的注入工具注入到腹腔内。
这里并不是排除0℃以下或25℃以上也可以保持液体状态,本发明的热敏材料只要在高于室温及接近人体温度时(如34-37℃)能够由液态转变为固态或半固态即可。
本发明的热敏材料随温度升高液体粘度增加,在34℃或以上(接近体温)时在10sec-3min内转化固体或半固态状态;
其中本发明热敏材料在40-50℃粘度最高,可在注射部位停留,无流动性。
可以理解的是,本发明所述的热敏材料应当是符合医用材料安全标准的,且对人体也是安全的,不会产生致命的毒害、感染甚至排异反应。
本发明的热敏材料可以生物降解,或者可以在热消融结束后再次人工取出,而根据本发明一些具体实施方案,其中,所述热敏材料在1个月内可以被哺乳动物身体吸收,体内无残留。
根据本发明一些具体实施方案,其中,所述热敏材料含有选自医用热敏聚合物和基质胶中的至少一种;
满足上述条件的材料为本领域技术人员所熟知,本领域技术人员可以根据本发明的记载并依据其自身掌握的现有技术知识在本领域常规材料中进行选择,而根据本发明一些具体实施方案,其中,所述药用热敏性聚合物为热敏性聚合物水凝胶。
本发明所述的热敏性聚合物水凝胶譬如可以是本领域常规使用的嵌段共聚物、无规共聚物、接枝共聚物或分支聚合物或共聚物;
其中可以进一步具体是聚氧化烯嵌段共聚物,如泊洛沙姆;更具体如泊洛沙姆P407、188、338、1107和1307及Pluronic牌的泊洛沙姆F127和108。
譬如本领域用作血管栓塞材料的嵌段共聚物、无规共聚物、接枝共聚物或分支聚合物或共聚物。
还譬如所述的热敏性聚合物水凝胶可以为聚N-丙烯酰胺类水凝胶。
所述聚N-丙烯酰胺类水凝胶可以选自本领域常规的具体种类,譬如聚N-正丙基丙烯酰胺-co-N-异丙基丙烯酰胺、N-异丙基丙烯酰胺、聚N-异丙基丙烯酰胺-co-丙烯酰胺和聚N-异丙基丙烯酰胺-co-丙烯酸。
其中可以理解的是,本发明的注射液材料主要成分选自泊洛沙姆、聚N-丙烯酰胺类水凝胶、寡聚酯类和壳聚糖类中的至少一种。
根据本发明一些具体实施方案,所述基质胶为Matrigel基底膜基质。
而根据本发明一些具体实施方案,其中,所述注射液还含有注射用水、生理盐水 和注射用葡萄糖水溶液中的一种;
根据本发明一些具体实施方案,所述注射用水、生理盐水或注射用葡萄糖水溶液的质量百分比含量为注射液总重量的30-90%。
根据本发明一些具体实施方案,所述注射液还含有附加材料。
所述的附加材料是为了进一步改善所述注射液材料的使用性能,本领域技术人员可以根据使用的需要,如改善其保存性能、使用性能而在现有技术中选择常规的材料进行添加,而根据本发明一些具体实施方案,其中,所述附加材料选自保湿剂、防腐剂、抗氧剂、乳化剂和增稠剂中的一种或多种的组合。
其中可以理解的是,所述附加材料的用量可以根据所选用的附加材料性能而确定,即确保加入附加材料后,所制备的注射液材料仍可以在接近人体温度时能够由液态转变为固态或半固态,且在较低温度(至少在0-4℃)能够保持自由流动的液体状态,而根据本发明一些具体实施方案,所述附加材料总重量占所述注射液材料总重量的0.5%-10%;
根据本发明另一些具体实施方案,所述附加材料总重量占所述注射液材料总重量的0.5%-5%;
根据本发明另一些具体实施方案,所述附加材料总重量占所述注射液材料总重量的0.5%-1%。
另外,为了增加抗肿瘤疗效和显像功能,注射液中还可附加造影剂和/或化疗药物。
其中造影剂和/或化疗药物的用量可以根据使用情况及所选用的造影剂和/或化疗药物的常规临床用量而决定,无需本领域技术人员进一步付出创造性劳动。
而根据本发明一些具体实施方案,所述造影剂和/或化疗药物用量为热敏注射液总重量的1%-20%。
根据本发明一些更具体的实施方案,其中,所述基质胶为Matrigel基底膜基质(美国BD公司)。
根据本发明另一些更具体的实施方案,其中,所述注射液由泊洛沙姆(P407)和注射用水组成。
其中更具体为泊洛沙姆质量百分比含量为注射液总重量的15-33%。
根据本发明另一些更具体的实施方案,其中,所述注射液由聚N-正丙基丙烯酰 胺-co-N-异丙基丙烯酰胺和/或注射用水组成。
注射液材料的物理相变特性:在0-4℃(冰盒温度)时流动性最大,呈液体状态,或者10-22℃时(室温)流动性最大,呈液体状态,高于室温的22-37℃,尤其是34-37℃(体温)时快速相变(10sec-3min)内,流动性明显降低成固体或半固体状态,40-50℃粘度最大。射频消融前冰盒存储运输热敏性注射液材料(0-4℃),使之保持液体状态,易于经皮进行腹腔注射。超声引导可实时显示液体分离带、腹腔脏器与周围结构(膈肌、胆囊、肠管)的分离情况。射频消融被膜下肿瘤时,在热消融区与脏器周围重要结构之间注射适量的热敏性注射液,在体温(37℃)的以及来自消融针的温度(50℃以上)作用下,热敏性注射液流动性降低,快速相变呈固体状态,形成隔离保护层,达到相对安全的保护厚度。
根据本发明一些具体实施方案,其中,所述腹腔实性脏器包括肝脏、肾脏,胰腺或脾脏。
根据本发明一些具体实施方案,其中,所述脏器周围结构包括膈肌、胆囊、胃肠、腹壁、大血管或输尿管。
根据本发明一些具体实施方案,其中,所述肿瘤热消融为通过局部组织高热产生热凝固坏死来消除肿瘤的治疗技术。
根据本发明一些具体实施方案,其中,所述肿瘤热消除技术包括射频消融,微波消融,激光消融和高强度超声聚焦消融。
根据本发明一些具体实施方案,其中,所述哺乳动物为人。
根据本发明一些具体实施方案,其中,所述注射液材料人体用量为20-200ml。
另一方面,本发明提供了一种热消融中保护脏器周围结构的注射液,其是在哺乳动物腹腔实性脏器邻近被膜肿瘤热消融过程中,保护脏器周围结构,所述注射液包括如下重量百分含量成分:热敏材料10%-70%;注射用水、生理盐水或注射用葡萄糖水溶液30%-90%;附加材料0%-10%;造影剂和/或化料药物0%-20%;所述热敏材料在温度0-25℃为能够自由流动的液体状态,而温度增加至34-37℃时由液相转变为无流动性的固相或半固相。
根据本发明一些优选实施方案,所述注射液包括如下重量百分含量成分:热敏材料10%-70%;注射用水、生理盐水或注射用葡萄糖水溶液30%-90%。
根据本发明一些优选实施方案,其中所述热敏材料是在0-4℃或10-22℃为能够 自由流动的液体状态。
根据本发明一些优选实施方案,所述热敏材料是在10sec-3min内转变为无流动性的固相或半固相。
根据本发明一些优选实施方案,所述腹腔实性脏器包括肝脏、肾脏,胰腺或脾脏。
根据本发明一些优选实施方案,所述脏器周围结构包括膈肌、胆囊、胃肠道、腹壁、大血管或输尿管。
根据本发明一些优选实施方案,所述哺乳动物为人。
根据本发明一些优选实施方案,所述注射液材料人体用量为20-200ml。
根据本发明一些优选实施方案,所述附加材料选自保湿剂、防腐剂、抗氧化剂、乳化剂和增稠剂中的一种或多种的组合。
根据本发明一些优选实施方案,所述热敏材料可生物降解,在1个月内被哺乳动物身体吸收。
根据本发明一些优选实施方案,所述热敏材料含有选自医用热敏聚合物和基质胶中的至少一种。
根据本发明一些优选实施方案,所述医用热敏性聚合物为热敏性聚合物水凝胶;
根据本发明一些优选实施方案,所述医用热敏性聚合物选自泊洛沙姆、聚N-丙烯酰胺类水凝胶、寡聚酯类和壳聚糖类中的至少一种。
根据本发明一些优选实施方案,所述基质胶为Matrigel基底膜基质。
根据本发明一些优选实施方案,所述肿瘤热消融为通过局部组织高热产生凝固性坏死来消除肿瘤的治疗技术。
根据本发明一些优选实施方案,所述肿瘤热消融包括射频消融,微波消融,激光消融和高强度聚焦超声消融。
综上所述,本发明提供了一种热敏材料在制备哺乳动物腹腔实性脏器邻近被膜肿瘤热消融过程中,保护脏器周围结构的注射液的应用。本发明的技术方案具有如下优点:
为了减少热消融对腹腔实性脏器周围重要结构(膈肌、胆囊、胃肠、腹壁、输尿管等)损伤及相关并发症的预防,利用热敏性注射液材料代替常规注射液体,进行腹腔注射,分离脏器与外周易热损伤的结构,可达到足够的保护厚度,使热消融更安全,克服了常规液体流动性大、在目标区域存留时间短、需要持续灌注等缺点。这种材料 在脏器被膜下肿瘤消融时,通过经皮腹腔注射到邻近热消融区的脏器周围,可以形成分隔带,有效减少或消除对邻近结构如膈肌、胃肠、腹壁或输尿管的热损伤。
附图说明
图1为实施例1热消融中使用热敏性注射液材料与生理盐水的隔离效果超声图像对比;
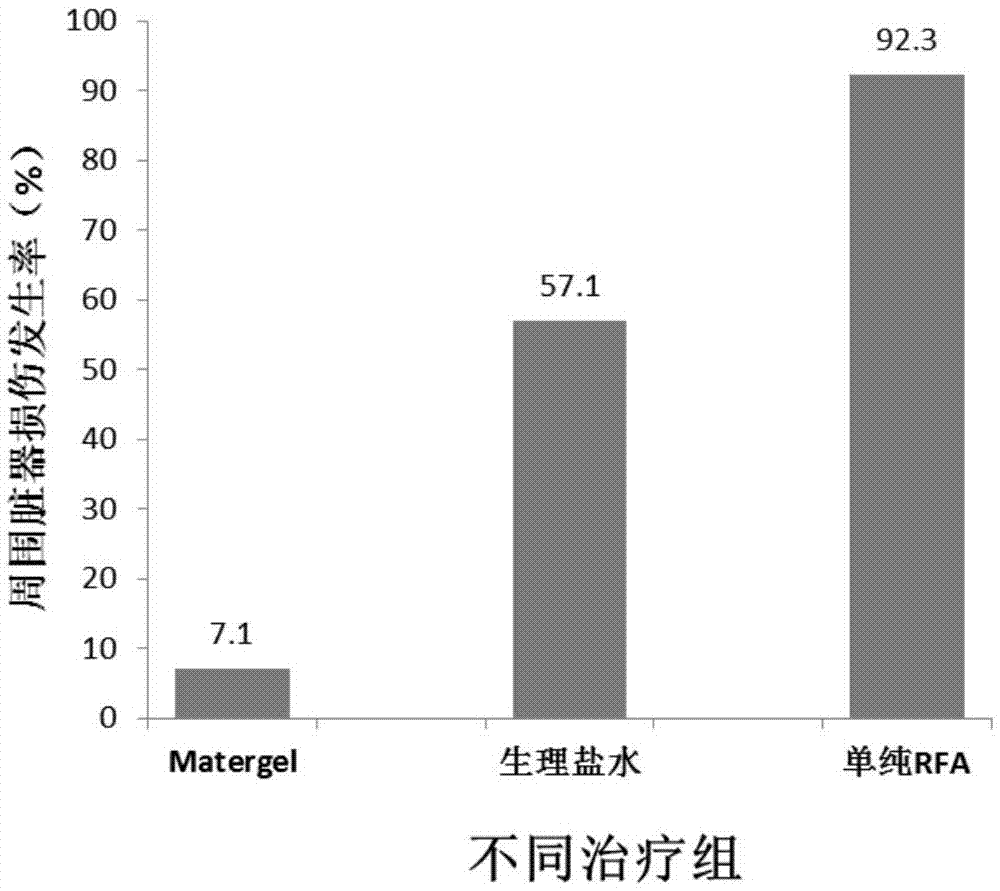
图2为实施例1的热消融中采用热敏性注射液材料、生理盐水,以及未采用任何保护措施三组,治疗后肝周围结构热损伤率对比;
图3为在肝脏与胃肠道之间经皮注射热敏性Matrigel基底膜基质,形成隔离带,保护胃肠结构;其中1为肿瘤、2为注射器、3为注射液、4为射频电极针、5为肠管、6为注射液固化形成的隔离带;
图4为大鼠动物实验显示肝周注射Matrigel基底膜基质的效果,可以形成半固体的凝胶,位于肝周,保护邻近的膈肌,腹壁及肠管。
具体实施方式
以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。
实施例1
热敏注射液采用Matrigel基底膜基质(美国BD公司),既往用于细胞培养试验。其主要成分由层粘连蛋白,Ⅳ型胶原,巢蛋白,硫酸肝素糖蛋白等组成,还包含对温度敏感的水凝胶。Matrigel在22-35℃温度环境下快速成胶,因此溶解时在0-4℃冰上过夜冻融(4℃以上会随着温度的上升部分成胶)。所有用品在使用前需置于冰浴,必须使用预冷的注射器或导管操作Matrigel。BD Matrigel基底膜基质在37℃条件下1min内可形成半固体的凝胶,聚合形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能,有利于体外细胞的培养和分化,以及对细胞形态、生化功能、迁移、侵染和基因表达的研究。高浓度的Matrigel适用于研究体内血管生成和肿瘤细胞迁移及肿瘤模型的建立等。我们将1支(10ml)BD公司生产的Matrigel基底膜基质置于0-4℃,24-48hrs,保持液体状态,使用时放置于冰盒。
应用Sprague Dawley大鼠实验,使用射频电极针4对邻近胃肠道5的肝脏肿瘤1射频消融,治疗前使用注射器2在肝消融区与胃肠5之间的间隙注射适量(10ml)的Matrigel基底膜基质3,形成5-10mm厚度的隔离带6(图3)。超声引导将射频电极针经皮插入肝脏,直到针尖处于Matrigel基底膜基质形成分隔带旁的肝被膜下区域。动物的体温(37℃左右)以及来自消融针的温度(50℃以上),使Matrigel基底膜基质的流动性降低,1min内呈固体状态,可在注射区形成分隔,有效减少射频消融对胃肠道的热损伤(图4)。消融仪器为CC-1-220型单极RFA仪(Valleylab公司,泰科医疗,美国),发生器频率480kHz,最大输出功率40W,17G Cool-tip射频电极针,长度15cm,尖端裸露0.7cm。治疗过程与既往射频消融参数一样(针尖温度保持70℃,消融区边缘温度50℃)。治疗时间为5min,治疗后观察30min,如果腹腔内无活动性出血,即可将大鼠送回原处恢复。无特殊处理,治疗后1个月内Matrigel基底膜基质吸收。生理盐水组的应用方法与Matrigel基底膜基质组完全相同。如图1所示,Matrigel组比生理盐水组分隔带厚度有明显差异,尤其是治疗5min时差异最大(p<0.001)。如图2所示,使用Matrigel基底膜基质、生理盐水和单纯RFA组(没有采取任何保护措施)的三组之间肝周围结构热损伤的发生率明显不同。单纯RFA组邻近消融区周围结构的损伤率为92.3%(12/13例),显著高于生理盐水组57.1%(8/14例,P=0.037),Matrigel组最低7.1%(1/14例,P<0.001)。
实施例2
热敏注射液采用对温度敏感的泊洛沙姆水溶液,其中15.4%为泊洛沙姆P407,这种聚合物水凝胶是由高分子组成的三维空间交联网络与水的混合体系,传统用于非离子型表面活性剂,近年来,在药物控制释放等领域获得广泛应用。这种水凝胶在14-20℃(室温)呈粘度低的液体状态,在34-37℃(接近体温)时相变成凝胶,40℃粘度最高。我们将Sigma公司生产的泊洛沙姆水溶液置于室温,保持液体状态。
应用Sprague Dawley大鼠实验,对邻近膈肌的肝脏肿瘤射频消融,治疗前在肝消融区与膈肌之间的间隙超声引导注射适量(10ml)的泊洛沙姆水溶液,形成5-10mm厚度的隔离带。超声引导将射频电极针经皮插入肝脏,直到针尖处于泊洛沙姆水溶液形成分隔带旁的肝被膜下区域。动物的体温(37℃左右)以及来自消融针的温度(50℃以上),使注射液的流动性降低,1min内呈固体状态,可在注射区形成分隔,有效减少射频消融对膈肌的热损伤。
实施例3
热敏注射液采用对温度敏感的温敏纳米聚水凝胶(N-异丙基丙烯酰胺-co-丙烯酰胺)(简称温敏纳米凝胶)(华中科技大学生命科学与技术学院药物研究所研制)。这是一种能对温度的微小变化产生结构上和性能上变化的智能纳米材料,目前用于血管介入栓塞领域。研究表明温敏纳米凝胶具有较低的溶胶粘度和较高的凝胶强度,并且具有快速的温度响应性及显著的触变性。在20℃左右常温下,温敏纳米凝胶呈液态,流动性较好,当温度升高到34-37℃,12secs内完全失去流动性,成凝胶态。
应用Sprague Dawley SD大鼠实验,对邻近腹壁的肝脏肿瘤射频消融,治疗前在肝消融区与腹壁之间的间隙超声引导注射适量(10ml)的温敏纳米聚水凝胶,形成5-10mm厚度的隔离带。超声引导将射频电极针经皮插入肝脏,直到针尖处于温敏纳米聚水凝胶形成分隔带旁的肝被膜下区域。动物的体温(37℃左右)以及来自消融针的温度(50℃以上),使注射液的流动性降低,1min内呈固体状态,可在注射区形成分隔,有效减少射频消融对膈肌的热损伤。
- 还没有人留言评论。精彩留言会获得点赞!