平滑肌细胞结构的制作方法
技术领域:
本发明涉及在有需要使用支架接种细胞的受试者中的管腔器官或组织构造的重建、扩大或替换,所述细胞从不是源自(重建、扩大或替换的受试者的)相应的器官或组织构造获得。
背景技术:
:最近的研究表明了,在人体内管腔的或管状的器官的重新再生的前景。在一项研究中,儿童患者的膀胱被扩大,通过植入管状的、生物可降解的支架,所述支架接种自体尿路上皮及膀胱平滑肌细胞。所述植入启动了具有层状组织架构的全层膀胱壁、以及伴随的泌尿系统功能的再生(Atala,A.,等(2006)Lancet367,1241-1246)。在另一项研究中,设计了功能性人体气管,使用脱细胞的、尸体气管支架,所述支架内接种自体骨髓细胞定向分化所产生的自体呼吸道上皮细胞和软骨细胞(Asnaghi,M.A.,等(2009)Biomaterials30,5260-5269;Macchiarini,P.,等(2008)Lancet372,2023-2030)。细胞接种支架的使用有可能解决在不同类型的管腔或管状器官设置中的缺损。一些异常现象可能导致膀胱发育异常,并且需要手术扩大。尿流改道术是当个体由于损伤或非功能性泌尿系统而不能排尿的时候,从身体排出尿液的路径和方式。总之,任何阻塞尿液流动,和增加在输尿管和/或肾脏中的压力的疾病,可能需要尿流改道术。改道的一些常见适应症包括需要囊切除术的膀胱癌症,影响肾功能、辐射损伤到膀胱的神经性膀胱功能障碍,在女性中发生的顽固性尿失禁,以及慢性盆腔疼痛综合征。总之,尿流改道存在两种主要的策略:尿道造口术和可控尿流改道。尽管小肠黏膜下层(SI)可以用于尿流改道,据报道,所述黏膜和黏膜下层的去除可能导致肠道段缩回(参见Atala,A.,J.Urol.156:338(1996))。因此,需要存在其他方法和设备,以为有需要的患者提供尿流改道系统。尿失禁是一个普遍的问题,它影响所有年龄和水平的人们的身体健康(包括在广大市民和在医疗机构中)。目前治疗急迫性尿失禁是注射神经毒素,如肉毒杆菌毒素,如据认为,肉毒杆菌毒素对膀胱过动发挥其作用,通过使在膀胱壁中的膀胱逼尿肌瘫痪,或可能影响在膀胱内的传入神经通路和减少在泌尿道上皮下层的神经感受器。大尺寸的肉毒杆菌毒素的分子可以限制其扩散能力,从而禁止它达到传入、传出神经纤维。然而,治疗可能需要许多的肉毒杆菌毒素注射(一般为20至50)进入膀胱肌壁内。目前仍需要替代方法来治疗尿失禁。肺脏可以被认为是高度分化的管状器官,可以改善以再生(通过利用源自于脂肪平滑肌细胞和可降解支架)。据报道,用源自脂肪的“基质细胞”接种的聚乙醇酸(PGA)片毡表明,在大鼠肺叶切除模型内的肺再生(Shigemura等,AmJRespirCritCareMedVol174.pp1199—1205,2006)。接种PGA片层的细胞被封在剩余的肺叶上。在移植的1周内,观察到肺泡和血管再生,同时伴随肺功能性的修复。在另一项研究中,胎儿大鼠肺细胞被接种到凝胶泡沫海绵支架上,并移植到成年大鼠肺中。具有明显血管网络的肺泡状结构,被观察到在降解支架内再生,在植入后4个月内(Andrade等,AmJPhysiolLungCellMolPhysiol292:510-518,2007)。所述体内研究的结果,该研究使用接种胎儿肺细胞的聚乳酸-共-乙醇酸/聚-L-乳酸(PLGA/PLLA)支架(Mondrinos等TissueEngineering12(4):717-728,2006;Mondrinos等AmJPhysiolLungMolPhysiolo239:L639-L650,2007)表明:选择的以靶向特定受体亚型的外源性纤维母细胞生长因子的适当组合,将促进适当的肺上皮细胞和间充质细胞的行为,以有利于组织再生。Mondrinos等(2006)也报道了这一现象:三维MATRIGELTM结构含有肺泡形成单元(AFU)(摘要,图3)。仍然需要附加的细胞群体,以合适地为肺脏提供再生医学为基础的治疗。在所述胃肠道内的缺损是需要存在替代的治疗方法的另外领域。使用脱细胞的、尸体气管段支架,设计功能性的人体器官,所述支架接种由自体骨髓细胞分化直接形成的自体呼吸上皮细胞和软骨细胞(Macchiarini,P.,等(2008)上文)。动物模型被用于设计成气管的组织,在所述组织中,包括来自于分化的MSC的软骨细胞、以及上皮细胞都是宿主生存所需要的(Go等(2010)JThoracCardiovascSurg139,437-443)。直接来源于自体气管外植体的软骨细胞可能对重新再生的气管适用(Komura,M.,等(2008)JPediatrSurg43,2141-2146;Komura,M.,等(2008)PediatrSurgInt24,1117-1121)。另外,所述小肠(SI)当前代表迫切临床需求,由于小肠移植不能满足儿科小肠综合症的当前治疗标准。自体类器官单元,由不完全解离的上皮细胞和间叶细胞集落组成,部分来源于消化的肠上皮(大概含有滞留的肠干细胞),并且用于接种PLLA支架管道,所述支架管道随后在所述猪的腹膜腔内成熟。在移植后7周,观察到所述重新得到的植入含有组织段,其概括了天然SI总的整体层状组织(Sala,F.G.,等(2009)JSurgRes156,205-21225)。重要地,相似地植入到所述腹膜内的无细胞支架,不产生胃肠组织段。尽管如此,嫁接这种组织工程的SI片段到在大型哺乳动物中的宿主SI的效果,仍然有待证明。而且,这种方法要求收获到10cm的自体SI至派生类器官,以用于移植。另外,这是不确定的:体外扩增是否能减少所需要的自体SI的量,能接种支架结构的类器官单元是否能从患病人体内部分离,或者会需要多少自体组织以形成临床相关移植。在另一项报道中,凝胶海绵支架(具有或者不具有源自胃的SMC)被嫁接到在狗的手术分离的回肠袢中的lxlcm缺损处。在SMC+移植位点的宏观分析证明了类天然新黏膜的再生。尽管如此,在SMC-移植位点的组织仍然溃烂。在所述SMC+移植位点观察到显著增强的血管化、上皮化合圆形肌肉组织化(Nakase,Y.,等(2006)TissueEng12,403-412)。接种到所述支架的SMC的数量的增加,导致更大区域的再生SI组织,尽管没有观察到伴随的所述平滑肌层厚度的增加(Nakase,Y.,等(2007)JSurgRes137,61-68)。所述管腔或管状器官再生方法,也可以适用于食管再生。在27例雌性大鼠中的腹部食管中的块状缺损用从胃无细胞模型形成的无细胞支架修补。在所述24例存活者中,即使在移植后18个月,也没有显示黏膜肌层再生的证据(Urita,Y.,等(2007)PediatrSurgInt23,21-26)。与之相反的,在犬模型的食管切除和更换中,PGA管道接种角质形成细胞和成纤维细胞的混合物,在植入后的3个星期内引发与天然食管相似的平滑肌层状组织的再生,同时无细胞PGA管道形成食管狭窄,并在2-3个星期内导致几乎完全的阻塞(Nakase,Y.,等(2008)JThoracCardiovascSurg136,850-859)。将无细胞SIS管状结构引入到仔猪的颈部食管的尝试,也没有成功,表明了伤痕和最小的再生反应(Doede,T.,等(2009)ArtifOrgans33,328-333)。源自胃的类器官单元,当其被接种到生物聚合物支架上,引发在胃组织工程中的所述胃部和黏膜肌层在猪的腹膜腔内部的再生(Sala,F.G.,等(2009)JSurgRes156,205-212)。使用犬模型,在7例动物的胃中创建环状缺损,并且,用源自自体的外周血或者骨髓血液浸泡的复合生物可降解支架(“新片层”)被缝合在所述缺损处。在植入后16周前,所述缺损位点已经形成胃,具有的证据:在黏膜下层以内上皮再形成、绒毛形成、血管化和纤维化。尽管如此,已经观察到平滑肌层的最小再生,其通过平滑肌α-肌动蛋白的表达显示,虽然不是调宁蛋白,与成熟平滑肌细胞的表型一致的标记物(Araki,M.,等(2009)ArtifOrgans33,818-826)。虽然严格来说不是一个管状器官,肛门括约肌是胃肠道的组成部分,并且是调节大肠通畅的关键。最近的努力,设计肛门括约肌,平衡用于催化膀胱再生利用的相同通用平台。为了这个目的,从人体内部肛门括约肌分离的平滑肌细胞被接种在围绕中心模具倾倒的纤维凝胶上。所述模具周围凝胶的细胞介导的收缩,导致形成3D圆柱管道的括约肌平滑肌肉组织。尽管体内吻合仍然有待被证明,这种生物工程的肛门括约肌表明了收缩性能和对定义的神经递质的反应与天然肛门括约肌功能一致。(Hashish,M.,等(2010)JPediatrSurg45,52-58;Somara,S.,等(2009)Gastroenterology137,53-61)。使用替代来源的平滑肌细胞可以促进工程括约肌向商业生产的转变。在血管组织工程中的主要问题是建设具有合适的、长期的生物机械性能,并与天然血管匹配的血管移植。由于与所述血管共同的循环负载,但是特别地,这些血管需要较高的工作压力,动脉替代品带来了特殊的挑战,。研究者们已经接近了这个问题,通过多种合成的和有机的材料,不同的构建方式(例如静电纺丝和铸造)和大量的复合设计。例如,已经尝试使用多种供体移植、天然成分和合成成分的组合,去建立血管移植(参见Zilla等,美国出版专利申请2005/0131520;Flugelman,美国出版专利申请2007/0190037;Shimizu,美国专利6,136,024;Matsuda等,美国专利5,718,723;和Rhee等,美国专利5,292,802)。已经报道,由聚脲氨脂(PEUU)(Courtney等(2006)Biomaterials.27:3631-3638)和PEUU/胶原(Guan等(2006)CellTransplant.Vol.15.Supp.1;S17-S27)组成的其它支架,具有类组织功能属性。Ludlow等,美国出版申请号20100131075(其整体通过引用的方式并入本文)涉及了在有需要的受试者中使用支架再生、重建、扩大或替换层状组织的管腔器官或组织构造,所述支架接种来源于所述受试者的自体细胞。仍然需要其它来源的细胞,例如非自体来源。已经被解释的原因:异体的干细胞能提供替代的膀胱再构建和膀胱癌的治疗(参见Yinan和Guomin(2008)MedicalHypothesis.70,294-297)。技术实现要素:本发明涉及通过使用支架在有需要的受试者中再生、重建、扩大或替换管腔或管状器官或组织构造,所述支架接种源自与(此处描述的所述受试者的再生、重建、扩大或替换的)所述器官或组织构造不同的来源的细胞,分离这种细胞,新器官/组织构造支架或模型接种此细胞(结构)的方法。所述管腔器官可能为层状组织。制作这种新器官组织构造结构的方法,并提供了通过使用所述结构治疗有需要的患者的方法。所述细胞可以从自体或非自体来源获得。如果使用非自体来源,那么可以进行所述治疗方法,而不需要免疫抑制治疗。在一方面中,本发明涉及可植入的细胞支架结构,用于治疗有需要的受试者。在一个实施方案中,所述结构组成为:a)支架,包括具有第一表面的模型,其中所述模型被形成以符合在所述受试者中的天然管腔器官或组织构造的至少一部分;以及b)第一细胞群体,所述第一细胞群体源自与所述受试者非自体、并且不是所述天然器官或组织构造的来源,所述第一细胞群体沉积在第一表面上或其中,所述支架和所述第一细胞群体形成可植入式结构。在另一实施方案中,所述支架被形成以允许所述来自所述受试者中天然血管或器官的流体通过。在另一实施方案中,所述结构组成为:a)支架,包括具有第一表面的模型,其中所述模型被形成以允许在有需要的受试者中来自天然容器的尿液的通过;和b)源自与所述受试者非自体并且不是所述天然器官或组织构造的第一细胞群体,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。在另一实施方案中,所述模型为管状模型。所述管状模型可能具有第一端。所述第一端可被配置为与被所述受试者的腹壁接触。所述第一端可被配置为与所述受试者腹壁的开口相吻合。所述第一端可被配置为外置于皮肤。在另一实施方案中,所述管状模型可进一步包括用于连接第一输尿管的第一侧开口。所述管状模型可进一步包括用于连接到第二输尿管的第二侧开口。所述管状模型进一步包括用于连接的第二输尿管的第二端。在一个实施方案中,所述结构允许尿液从所述第一输尿管通过,进入到植入后的管状模型内部。允许尿液从第二输尿管通过进入植入后的管状模型内部。所述结构可允许尿液通过,从植入后的受试者中排出。在另一实施方案中,管状支架的所述第一端在植入后的受试者外部形成造口。所述第一端可包括造口端延伸通过所述受试者的腹壁。所述造口端可与受试者的皮肤联系。在一个实施方案中,所述结构可在植入后的造口端形成上皮黏膜。在造口端,所述上皮黏膜可具有黏膜皮肤区。所述表皮黏膜可具有与黏膜皮肤区相邻的前庭区。所述表皮黏膜,其特征在于上皮首先出现在前庭区并由所述黏膜皮肤区向造口端区逐渐增加。所述上皮,其特征在于上皮细胞标记物的表达。所述表皮黏膜可等同于自然产生的黏膜皮肤区。在一个实施方案中,所述结构不包含任何其它的细胞群体。所述结构可以不包含尿道上皮细胞。所述结构可作为泌尿导管使用。在一方面中,本发明涉及可植入式细胞支架结构,其用于治疗在有需要的受试者中的呼吸系统疾病。在另外一个实施方案中,所述结构的组成为:(a)支架,所述支架包括具有第一表面的模型,其中所述模型被形成以符合受试者天然呼吸道器官或组织构造的至少部分;和(b)非源于呼吸组织的第一细胞群体,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。在另外一个实施例中,所述结构适于允许所述空气从在所述受试者中的天然容器或其内通过。在另一实施方案中,所述结构也可以具有源自呼吸组织的第二细胞群体,其中所述模型、所述第一细胞群体、和所述第二细胞群体形成可植入结构。所述细胞群体可从自体或非自体来源获得。在一方面中,本发明涉及治疗在有需要的受试者中的胃肠道(GI)疾病的可植入式细胞支架结构。在另外一个实施方案中,该结构的组成为:a)支架,包括具有第一表面的模型,其中所述模型被形成以符合受试者胃肠器官或组织的至少一部分;和b)不是源自胃肠来源的第一细胞群体,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。在另一实施方案中,所述结构可进一步包括来自GI组织的第二细胞群体,其中所述的模型、所述第一细胞群体、和所述第二细胞群体形成可植入结构。所述细胞群体可从自体或非自体的来源获得。在所有实施方案中,所述第一细胞群体为平滑肌细胞(SMC)群体。在一些实施方案中,所述第一细胞群体源自与所述受试者非自体的来源。所述非自体的来源可能为异体的来源。在一些实施方案中,所述第一细胞群体来源于与所述受试者异体的来源。在一些实施方案中,所述SMC群体来源于脂肪。在一些实施例中,所述SMC源自外周血。例如,本发明可具体涉及以下实施方案:1.可植入式细胞支架结构,用于治疗有需要的受试者,包括:a)支架,包括具有第一表面的模型,其中所述模型被形成以符合在所述受试者中至少部分的的天然管腔器官或组织构造;以及b)第一细胞群体,所述第一细胞群体源自与所述受试者非自体的、并且不是所述天然器官或组织构造的来源,所述第一细胞群体沉积在所述第一表面上或其中,所述支架和所述第一细胞群体形成可植入式结构。2.可植入式细胞支架结构,用于治疗有需要的受试者,包括:a)支架,包括具有第一表面的模型,其中所述模型被形成以允许在有需要的受试者中的来自天然容器的所述尿液的通过;以及b)第一细胞群体,所述第一细胞群体源自与所述受试者非自体的、并且不是所述天然器官或组织构造的来源,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。3.可植入式细胞支架结构,用于治疗在有需要的受试者中的呼吸障碍,包括:a)支架,包括具有第一表面的模型,其中所述模型被形成以符合在所述受试者中至少部分的天然呼吸器官或组织构造;b)第一细胞群体,所述第一细胞群体不是源自呼吸组织,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。4.可植入式细胞支架结构,用于治疗在有需要的受试者中的胃肠道失调,包括a)支架,包括具有第一表面的模型,其中所述模型被形成以符合在有需要的受试者中至少部分的天然胃肠道器官或组织构造;以及b)第一细胞群体,所述第一细胞群体不是源自胃肠道的来源,所述第一细胞群体沉积在所述第一表面上或其中,所述模型和所述第一细胞群体形成可植入式结构。5.根据实施方案1至4的任意一项所述的结构,其中所述第一细胞群体是平滑肌细胞(SMC)群体。6.根据实施方案1至4的任意一项所述的结构,其中所述第一细胞群体是来源于与所述受试者异体的来源。7.根据实施方案3或4所述的结构,其中所述第一细胞群体是来源于与所述受试者异体的来源。8.根据实施方案5所述的结构,其中所述SMC群体来源于脂肪。9.根据实施方案5所述的结构,其中所述SMC群体来源于外周血。10.根据实施方案1、2,以及5-9中的任意一项所述的结构,其中所述模型是管状模型。11.根据实施方案10所述的结构,其中所述管状模型包括第一端。12.根据实施方案11所述的结构,其中所述第一端被设置以接触所述受试者的腹壁。13.根据实施方案12所述的结构,其中所述第一端被设置以吻合在所述受试者的腹壁中的开口。14.根据实施方案12或13所述的结构,其中所述第一端被设置以外置于所述皮肤。15.根据实施方案10至13的任意一项所述的结构,其中所述管状模型进一步包括连接到第一输尿管的第一侧开口。16.根据实施方案15所述的结构,其中所述管状模型进一步包括连接到第二输尿管的第二侧开口。17.根据实施方案15所述的结构,其中所述管状模型进一步包括连接到第二输尿管的第二端。18.根据实施方案15所述的结构,所述结构允许尿液从所述第一输尿管通过,进入到植入后的管状模型内部。19.根据实施方案16至18任意一项所述的结构,所述结构允许尿液从所述第二输尿管通过,进入到植入后的所述管状模型的内部。20.根据实施方案18所述的结构,所述结构允许尿液通过,从植入后的所述受试者排出。21.根据实施方案19所述的结构,所述结构允许尿液通过,从植入后的所述受试者排出。22.根据实施方案14所述的结构,其中所述管状支架的所述第一端在植入后的受试者外部形成造口。23.根据实施方案22所述的结构,其中所述第一端包括造口端,所述造口端延伸通过所述受试者的腹壁。24.根据实施方案23所述的结构,其中所述造口端连接到所述受试者的皮肤。25.根据实施方案23或24所述的结构,所述结构在植入后的造口端形成上皮黏膜。26.根据实施方案25所述的结构,其中所述上皮黏膜包括在所述造口端的黏膜皮肤区。27.根据实施方案26所述的结构,其中所述上皮黏膜包括与所述黏膜皮肤区相邻的前庭区。28.根据实施方案27所述的结构,其中所述上皮黏膜特征在于,上皮首先出现在所述前庭区中并通过所述黏膜皮肤区向所述造口端逐渐增加。29.根据实施方案28所述的结构,其中所述上皮特征在于,上皮细胞标记物的表达。30.根据实施方案25所述的结构,其中所述上皮黏膜相当于自然发生的黏膜皮肤区。31.根据实施方案1-30任意一项所述的结构,其中所述结构不包含任何其它的细胞群体。32.根据实施方案1、2,以及5-30的任意一项所述的结构,其中所述结构不包含尿道上皮细胞。附图说明图1A-D示出了膀胱扩大支架的例子。图2A-D示出了膀胱替换支架的例子。图3A示出了尿流改道或导管支架的例子。图3B-C示出了尿流改道结构的例子,所述尿流改道结构具有不同类型的横截面区域、以及潜在的开口位置,所述开口可以被设置为连接到输尿管。图3C显示了多种尿流改道结构(A:开放的要求卵形;B:开放的要求卵形容器,C:封闭的卵形容器和三管)。图4A-D示意了尿流改道或者导管构建的不同应用。图5A-B示出了肌肉等价支架的例子。图6描绘了多种肌肉等价支架的图像,以补丁或条带的形式。图7描绘了不同的肌肉等价支架和代表性的移植方法。图7A描绘了支架平薄片的形成。图7B描绘了适合于腹腔镜的支架,它可以在植入的时候卷起、并馈通过腹腔镜管道、以及在所述腹腔中展开。图7C描绘了适合于腹腔镜的支架薄片以卷起的形态形成,以促进通过腹腔镜管道的插入,然后在所述腹腔中展开。图7D描绘了适合于腹腔镜的支架薄片以折叠的形态或者手风琴折叠式形成,促进通过管道的插入,然后它在所述腹腔中展开。图7E描绘了肌肉等价支架的移植的可能的手术方法。图7F描绘了在空虚的和充盈的膀胱中的植入位点。图7G描绘了具有手术切口的泌尿膀胱模型,示出了创建在切片表面的椭球。图8描绘了预折叠的手风琴式支架薄片,以促进通过腹腔镜端口的插入。图9A描绘了预切割成条带的支架,然后缝合在一起,以允许堆积和插入到所述腹腔镜端口中,并且在所述腹腔中固定到位。图9B描绘了一个18.7cm长、2.0cm宽的支架,其具有2个折叠。图9C描绘了一个13.3cm长、2.8cm宽的支架,其具有3个折叠。图9D描绘了一个9.7cm长、4.0cm宽的支架,其具有4个折叠。图9E描绘了一个支架,由2个薄片,每个薄片有2个折叠、9.7cm长、2.0cm宽.图10A-C描绘了GI组织支架。图11A-B示出了植入导管结构的形态的例子。图12描绘了植入的新泌尿导管支架的两种可选择的形态(A和B)。图13示出了永久尿流改道结构的植入元件的例子。图14描绘了所述尿流改道结构的其它应用。图15示出了测试动物在植入泌尿导管结构后的固定后组织(在长度上一分为二)。图16A-D示出了来自肺脏肺泡形成单元的Clara细胞分泌蛋白(A)和前表面活性蛋白C(prosurfactantProteinC)(B-D)的表达。图17描绘了来自肺脏肺泡形成单元的Clara细胞蛋白的表达。图18描绘了来自肺脏肺泡形成单元的KRT18、SCGB1A1、和SFTPA1的表达。图19示出了接合素43染色的大鼠肺脏AFU的聚焦图像。图20描绘了在明胶海绵和PLGA支架上的AFU,有或没有预接种Ad-SMC(顶部左侧平板-明胶海绵预接种Ad-SMC,然后接种分离的肺脏细胞;顶部右侧平板-明胶海绵没有接种Ad-SMC,然后接种分离的肺脏细胞;底部左侧平板-明胶海绵预接种Ad-SMC,然后接种分离的肺脏细胞;底部右侧平板-明胶海绵没有预接种Ad-SMC,然后接种分离的肺脏细胞;箭头描绘了明显的AFU在预接种Ad-SMC的支架上形成。图21示出了在顶部左侧平板中,明胶海绵(-)Ad-SMC,用抗Clara细胞蛋白的抗体染色;顶部右侧平板示出了明胶海绵(-)Ad-SMC时相图;底部左侧平板示出了明胶海绵(+)Ad-SMC用抗Clara细胞蛋白的抗体染色;以及底部右侧平板示出了明胶海绵(+)Ad-SMC时相图。图22在顶部左侧平板中示出了用抗表面活性蛋白C(SurfactantProteinC)的抗体染色的明胶海绵(-)Ad-SMC;顶部右侧平板示出了明胶海绵(-)Ad-SMC时相图;底部左侧平板示出了用抗表面活性蛋白C的抗体染色的明胶海绵(+)Ad-SMC;以及底部右侧平板示出了明胶海绵(+)Ad-SMC时相图(在底部平板的箭头描绘了明显的AFU形成)。图23在顶部左侧平板中描绘了用抗Clara细胞蛋白的抗体染色的PLGA支架(+)Ad-SMC;顶部右侧平板-PLGAscaffold(+)Ad-SMC时相图;以及底部左侧平板示出了荧光免疫和时相图的合并(在顶部平板的箭头描绘了明显的AFU形成)。图24示出了用抗表面活性蛋白C的抗体染色的明胶海绵支架(+)Ad-SMC;顶部右侧平板示出了明胶海绵支架(+)Ad-SMC时相图;底部左侧平板示出了荧光免疫和时相图的合并(在平板中的箭头描绘了在所述明胶海绵中的空腔)。图25A-C示出了平滑肌细胞在多种生物材料上的粘附/增殖。图26示出了沉积在多种生物材料上的平滑肌细胞的活着的/死亡的分析结果。图27A-B示出了接种源自脂肪平滑肌细胞(Ad-SMC),在培养基介质中孵育后的支架。图27C-E示出了上皮细胞从食管组织到支架的迁移程度,所述支架包括没有预接种Ad-SMC的支架(C)、以及预接种Ad-SMC的支架(D)。图27E示出了没有食管组织的支架。图28示出了源自食管的细胞培养物。图29A上皮细胞标记物在食管组织和培养的食管细胞中的基因表达。图29B示出了培养的食管细胞的细胞角蛋白8、18、9的免疫染色。图30示出了评估细胞迁移的实验设计。图31示出了食管细胞的迁移。图32示出了食管细胞的迁移。图33A示出了所述手术创建的食管缺损和后续的结构移植。图33B示出了植入结构在移植后1天的组织学。图34示出了在植入位点的新生血管化(血管生成)。图35示出了植入结构在移植后8天的组织学。图36示出了植入结构在移植后8天的组织学。图37A示出了食管结构在移植后10周的合并。图37B示出了第1切片(横向的)的更多细节。图37C示出了第2切片(横向的)的更多细节。图37D示出了第3节(横向的)的更多细节。图38示出了接种到编织网格的Ad-SMC。图39A-C示出了植入的小肠(SI)结构。图40A-C示出了在植入后8周(A)和16周(B-C)的SI补丁结构。图41示出了在植入后10周的SI管状结构。图42示出了在植入5个月的SI管状结构。图43示出了在支架上的源自大鼠脂肪的SMC的活着的/死亡的染色。图44示出了外周血细胞的细胞形态。图45示出了在外周血细胞上的内皮标记物的RT-PCR分析。图46示出了源自脂肪细胞的细胞形态。图47示出了在源自脂肪细胞的内皮标记物的RT-PCR分析。图48示出了在含有10%FBS的DMEM中培养的源自脂肪细胞的内皮细胞基因表达分析。具体实施方式本发明涉及细胞群体(所述细胞群体源自与本文所描述的所述受试者再生、重建、扩大或替换的器官或组织构造不同的来源),分离此细胞的方法,接种此细胞(结构)的新器官/组织构造支架或模型,以及制备所述相同的方法,以及使用这种新器官/组织构造结构治疗有需要的患者的方法。1.定义除非另有定义,本文所使用的技术和科学术语具有相同的含义,如通常可被本发明所属的本
技术领域:
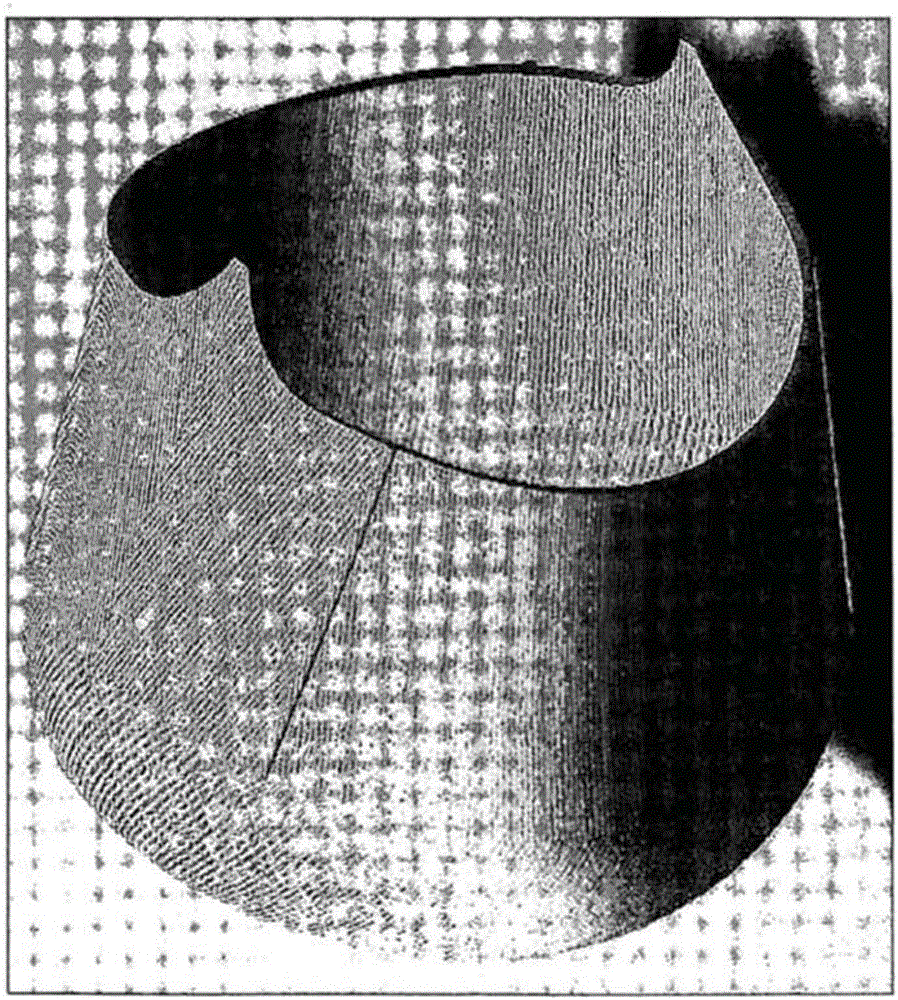
的普通技术人员所理解。组织工程原理,2007年,第3版。(RLanza,RLanger,&JVacanti编辑),为本领域的技术人员在目前应用中使用的术语提供了基本指南。本领域的技术人员将认识到许多的方法和材料类似或等同于本文所描述的,可用于本发明的所述实践中。事实上,本发明不限制所述的方法和材料。对于本发明的目的,所述术语定义如下。本文所述术语“平滑肌细胞”或“SMC”是指源自与天然器官或组织不同或相同的来源的收缩细胞,所述天然器官或组织属于所述受试者使用本文所述的结构和方法再生、重建、扩增或替换的。本发明所提供的所述平滑肌细胞,一旦接种并培养在如本文所述的支架或本文所描述的模型上,能够形成在中空器官(例如,膀胱、腹腔、胃肠道、等)壁中发现的所述非横纹肌,其特征在于有能力收缩和放松。那些本领域的普通技术人员可理解平滑肌细胞的其它属性。此处使用的本文所述术语“细胞群体”是指直接从合适的组织来源(通常是哺乳动物)分离的一些细胞。所述分离的细胞群体可随后在体外培养。那些在本领域的普通技术人员将理解分离培养细胞群体,以及在细胞群体中不同数量的细胞的各种方法,这可能是适合于在本发明中使用。所述细胞群体可源自自体或非自体。SMC群体可来自脂肪、血液或膀胱,其特征在于可与平滑肌细胞相联系表达标记物。所述SMC群体也可能为纯化的细胞群体。本文所使用的术语“源自脂肪的平滑肌细胞群体”或“Ad-SMC群体”是指源自脂肪的平滑肌细胞群体(SMC),其基本上没有脂肪细胞或非贴壁脂肪细胞。所述Ad-SMC群体,其特征在于可与平滑肌细胞相联系表达标记物。所述Ad-SMC群体也可以是纯化的细胞群体。所述Ad-SMC群体可源自自体的来源。所述Ad-SMC可源自SVF,含有血管组织。因此,所述Ad-SMC可源自所述脂肪衍生的血管床的毛细血管、小动脉和小静脉,或SMC可源自含有周细胞的血管周围微环境。所述术语“胃肠道细胞群体”或“GI细胞群体”是指是源自胃肠道组织的细胞群体,包括但不限于:食管、小肠、大肠、胃、结肠,或肛门括约肌组织。例如,所述GI细胞群体可能为源自食管组织的异种的细胞群体。所述术语“食管细胞群体”或者“食管细胞群体”是指源自于食管组织的细胞群体。它可以是异种的细胞群体,其包括上皮细胞、平滑肌细胞、以及其任意的组合。食管细胞群体可以源自食管活检或者源自整个食管组织。选择性地,所述食管群体可以源自体外培养的细胞群体,所述细胞群体从食管组织活检或者整个食管组织建立。所述食管细胞群体的特征在于,与上皮细胞、平滑肌细胞和其任意组合相关的标记物的表达。所述食管细胞群体可以是纯化的细胞群体。所述术语“呼吸细胞群体”是指细胞群体,它是源自呼吸组织(例如肺脏)的、异种的细胞群体。所述呼吸细胞群体可以包括细支气管细胞、上皮细胞、肺泡细胞和其任意的组合。呼吸细胞群体可以源自肺活检或者整个肺组织。作为选择,所述呼吸细胞群体可以源自在体外培养的细胞群体,所述细胞群体从肺活检或者整个肺组织建立。所述呼吸细胞群体的特征可以在于,与细支气管细胞、上皮细胞、肺泡细胞和其任意的组合相关的标记物的表达。所述呼吸细胞群体可以是纯化的细胞群体。所述术语“自体的”是指源自相同个体的或从相同的个体转化的。本文所描述的自体的细胞群体源自需要再生、重建、扩大或替换天然器官或组织构造的受试者。自体细胞群体源自这种受试者,其是本文所描述的结构的接受者。所述术语“非自体”是指源自供体或者从供体转化的,所述供体不是本文所描述的可植入结构的接收者。这种非自体来源包括同种异体的、同基因的(自体的或同基因的)、及其任意组合的来源。如本文所使用的,非自体细胞群体是源自与本文所描述的所述受试者非自体的来源的细胞群体。所述术语“标记物”或“生物标记物”通常是指DNA、RNA、蛋白、碳水化合物或者基于糖脂类的分子标记物,它们在培养的细胞群体中表达或存在,可以通过标准方法检测(或者本文公开的方法),并且与在所述培养的细胞群体(成为特定的细胞类型)中的一个或多个细胞一致。总之,所述术语细胞“标记物“或者”生物标记物“是指在本文所描述的细胞群体中表达的分子,所述分子通常通过天然细胞表达。所述标记物可以是由所述细胞或者在染色体上可识别的物理位点(如基因、限制性核酸酶切识别位点或者天然细胞表达的编码多肽的核酸(如mRNA)表达的多肽。所述标记物可以是基因的表达区域,称为“基因表达标记物”、或者不具有已知编码功能的一些DNA片段。所述术语“平滑肌细胞标记物”通常是指标记物,其在培养的细胞群体中的表达或存在可以通过标准方法(或本文公开的方法)检测,并且它和成为平滑肌细胞的培养细胞群体中的一个或多个细胞一致。总之,所述术语平滑肌细胞(SMC)“标记物”或者“生物标记物”是指通常由天然平滑肌细胞表达的分子。通过本发明考虑的这种标记物包括但不限于,一种或多种以下的:心肌素、α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、肌间线蛋白、肌成纤维细胞抗原、SM22、和其任意的组合。所述术语“呼吸细胞标记物”通常是指DNA、RNA、蛋白质、碳水化合物或者基于糖脂的分子标记物,他们在培养细胞群体中的表达或存在可以通过标准方法(或者本文公开的方法)检测,并且其与培养的细胞群体(将成为呼吸细胞)中的一个或多个细胞一致。总之,所述术语呼吸细胞“标记物”或者“生物标记物”是指通常由天然呼吸细胞表达的分子。所述标记物可以是由所述细胞或者在染色体上可识别的物理位点(如基因、限制性核酸酶切识别位点或者所述SMC表达的编码多肽的核酸)表达的多肽。所述标记物可以是基因的表达区域,称为“基因表达标记物”、或者不具有已知编码功能的一些DNA片段。由本发明考虑到的这种标记物包括但不限于,一种或多种以下的:Clara细胞分泌蛋白(CCSP);前表面活性蛋白C(ProsurfactantProteinC)(PPC);KRT18;分泌球蛋白、家族1A、成员1(子宫球蛋白或者SCGB1A1);表面活性蛋白A1(SFTPA1);及其任意的组合。所述术语“胃肠道细胞标记物”通常是指DNA、RNA、蛋白质、碳水化合物或者基于糖脂的分子标记物,他们在培养细胞群体中的表达或存在可以通过标准方法(或者本文公开的方法)检测,并且其与培养的细胞群体(将成为胃肠道细胞)中的一个或多个细胞一致。总之,所述术语胃肠道细胞“标记物”或者“生物标记物”是指通常由天然胃肠道细胞表达的分子。所述标记物可以是由所述细胞或者在染色体上可识别的物理位点(如基因、限制性核酸酶切识别位点或者所述胃肠道细胞表达的编码多肽的核酸)表达的多肽。所述标记物可以是基因的表达区域,称为“基因表达标记物”、或者不具有已知编码功能的一些DNA片段。这些现有技术中普通技术人员可以理解到合适的胃肠道细胞标记物。所述术语“食管道细胞标记物”通常是指DNA、RNA、蛋白质、碳水化合物或者基于糖脂的分子标记物,他们在培养细胞群体中的表达或存在可以通过标准方法(或者本文公开的方法)检测,并且其与培养的细胞群体(将成为食管细胞)中的一个或多个细胞一致。总之,所述术语食管细胞“标记物”或者“生物标记物”是指通常由天然食管细胞表达的分子。所述标记物可以是由所述细胞或者在染色体上可识别的物理位点(如基因、限制性核酸酶切识别位点或者所述食管细胞表达的编码多肽的核酸)表达的多肽。所述标记物可以是基因的表达区域,称为“基因表达标记物”、或者不具有已知编码功能的一些DNA片段。这些标记物可以是食管平滑肌细胞标记物,包括但不限于,一种或多种以下的:心肌素,α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、肌间线蛋白、肌成纤维细胞抗原、SM22、及其任意的组合。这种标记物可以是食管上皮细胞标记物,包括但不限于一种或多种以下物质:KRT8(角蛋白8),vWF(vonWillebrand因子),细胞角蛋白8、18、19,及其任意的组合。所述术语“源自脂肪的平滑肌细胞标记物”或者“Ad-SMC标记物”是指在本文所描述的细胞群体中,在基因和/或蛋白质水平表达的标记物。基于观察到的蛋白质表达,所述细胞群体可以具有特定的细胞表面标记物性能,其中标记物被指定为阳性或阴性(对于在所述细胞表面上的蛋白表达)。对于阳性标记物,蛋白表达可以被观察到在约80%、约90%、约95%、约96%、约97%、约98%、约99%或者约100%。对于阴性标记物,蛋白表达可以被被观察到在约20%、约15%、约10%、约5%、约4%、约3%、约2%、约1%或者约0%。所述术语“差异表达基因”、“差异基因表达”和他们交换使用的同义词,是指这种基因:他们在第一细胞或细胞群体中的表达被激活到较高或较低的水平(相对于它们在第二细胞或细胞群体中的表达)。所述术语也包括这种基因:它们在培养中的第一或第二细胞的传代过程中、随时间推移的不同阶段的表达被激活到较高或较低的水平所述术语。也可以理解:差异表达基因可以是在核酸水平或蛋白质水平的被激活的或者被抑制的,或者可能会经历可变剪接而导致不同的表型产物。这种差异的表现可能是:mRNA水平、表面表达、分泌或者其它多肽分割的变化。差异基因表达可以包括比较在两种或多种基因之间或者他们的产物之间的表达,或者比较在两种或多种基因或者他们的产物之间的表达比率,或者甚至比较相同基因两个不同的加工产物(其在所述第一细胞和所述第二细胞之间具有变化)。差异表达包括定量的以及定性的差异,在时间上或细胞表达模式上,在基因或者它的表达产物之间,例如所述第一细胞和所述第二细胞之间。为了本发明的目的,“差异基因表达”被认为存在,当存在至少约1倍,至少约1.5倍,至少约2倍,至少约2.5倍,至少约3倍,至少约3.5fold,至少约4倍,至少约4.5倍,至少约5倍,至少约5.5倍,至少约6倍,至少约7倍,至少约8倍,至少约9倍,至少约10倍,至少约10.5倍,至少约11倍,至少约11.5倍,至少约12倍,至少约12.5倍,至少约13倍,至少约13.5倍,至少约14倍,至少约14.5倍,或者至少约15倍的差异,在给定基因在所述第一细胞和所述第二细胞之间的表达,或在培养细胞的传代过程中的不同阶段。所述标记物的表达差异可以是在源自脂肪的细胞(所述第一细胞)中相对于在间质干细胞或MSC(所述第二细胞)中的表达。所述术语“抑制”、“下调”、“下表达(under-express)”被可交换使用,并且意思是:基因的表达、RNA分子或者编码一种或多种蛋白质或蛋白质亚单位的等价RNA分子的水平、或者一种或多种蛋白质或蛋白质亚单位的活性,相对于一种或多种对照(例如,一种或多种阳性和/或隐性对照)被降低。所述下表达可以是在源自脂肪的细胞中(相对于在MSC中的表达)。使用的所述术语“上调”或者“过表达(over-express)”意思是基因的表达,或者RNA分子的水平或者编码一种或多种蛋白质或蛋白质亚单元的等价RNA分子的水平、或者一种或多种蛋白质或蛋白质亚单元的活性,相对于一种或多种对照(例如一种或多种阳性的和/或阴性的对照)被提高。所述过表达可以是在源自脂肪的细胞中(相对于在MSC中的表达)。所述术语“收缩功能”是指平滑肌细胞收缩功能,涉及滑动肌动蛋白和肌球蛋白丝的相互作用,它是由肌球蛋白的钙激活的磷酸化所引发,从而完成依赖细胞内钙水平的收缩。所述术语“协调有节奏的收缩功能”或者"CRCF"是指细胞或者细胞群体的收缩功能,其特征在于周期性的收缩和放松模式。这种协调有节奏的收缩可以在本文所描述呼吸组织结构中观察到,例如在本文所描述的培养条件下的维持所述结构以后。所述术语“接触依赖性抑制”是指当两个或多个细胞彼此接触时,细胞生长停止。与在转化的细胞培养物中的集落形成相似,可以观察到细胞生长没有被接触抑制的细胞在彼此的顶部上堆积,不能在这种细胞培养物中观察到“接触依赖性抑制”的属性。骨髓间充质干细胞不具有这个属性。与此相反,具有接触-依赖性抑制性的细胞将在培养时不会被观察到在彼此的顶部上堆积。所述术语“外周血”通常是指在整个身体循环的血液。所述术语“脂肪组织”或者脂肪,通常意思是松散结缔组织,其主要由脂肪细胞组成。脂肪组织可以从在身体中的多个位点获得,所述位点包括但不限于,皮肤下方(皮下脂肪)和周围的内脏器官(内脏脂肪)。所述术语“管腔器官”或“组织构造”通常是指器官或其部分,其特征具有外的、外部的侧面和内部的、管腔的侧面。所述器官或组织构造可以是层状地组织地。例如,所述泌尿膀胱的壁包括大量层状组织的层。它具有移行上皮黏膜组成的内衬、称为黏膜下层的第二层(支持具有弹性纤维的结缔组织组成的黏膜)、以及称为由平滑肌组成的肌层的第三层。在另一个实施例中,天然血液血管具有多层的或层状的结构。动脉具有三层:最内层称为内膜(intima),包括排列在管腔表面的血管内皮细胞;中间层称为中膜(media),包括多层平滑肌细胞的薄片;以及最外层,称为外膜(adventia),其含有松散结缔组织、较小的血管和神经。所述内膜和中膜通过基底膜分离。在现有技术中的本领域技术人员将能理解不同的管腔器官和组织构造。所述术语“结构”是指至少一个细胞群体,其沉积在支架或模型的第一表面上或其中,所述支架或模型由合成的或者天然发生的生物材料组成。所述细胞群体可以是支架或模型在体内或在体外结合。所述术语“管腔器官结构”或者“管腔器官组织构造结构”是指至少一个细胞群体,其沉积在支架或者模型的表面上,所述支架或者模型由一种或多种合成的或天然发生的生物材料组成。在一个实施方案中,所述支架或者模型被形成以符合受试者天然管腔器官或组织构造的至少部分。所述受试者可以是需要重建、再生、扩大或替换天然管腔器官或组织构造的。所述细胞群体可以是平滑肌细胞群体(例如源自脂肪SMC群体或者源自外周血的SMC群体)。所述细胞群体可以在体内或者在体外与支架或者模型结合。所述术语“呼吸组织结构”是指由支架和一种或多种细胞群体(例如源自脂肪的SMC群体和/或呼吸细胞群体)组成的结构。所述结构可以是在至少一种细胞群体的沉积后进行培养,并且在沉积第二细胞群体后进一步培养。所述第二细胞群体可以接触所述支架和/或所述沉积的第一细胞群体。所述术语“样品”和或“患者样本”或“生物样本”通常意思是从个体、人体液体、人体组织、细胞系、组织培养物或其它来源获得的生物样品。所述术语包括人体液体,如血液(如外周血或静脉血)、尿液和或其它生物来源的液体(例如脂肪组织)样品;以及固体组织活检,例如活检样本(例如脂肪组织活检),或组织培养物或来源其的细胞,以及它们的后代。所述定义也包括样品,其在它们从来源获得后以任意的方式被操作,例如通过试剂处理、溶液化或者某种成分的富集(例如蛋白质或者聚核苷酸)。所述定义也包括临床样品,也包括在培养基、细胞悬浮液、细胞裂解液、血清、血浆、生物液体和组织样品中的细胞。所述样品的来源可以是固体组织,例如来自新鲜的、冻结的和/或贮存的器官或组织样品或活检或抽吸物,血液或任意血液成分;人体液体,例如脑脊髓液、羊水、腹膜液、或间质液;来自所述受试者发育中任何时间的细胞。所述生物样品可以含有不是天然存在的复合物,具有或在组织中存在:如防腐剂,抗凝血剂,缓冲液,固色剂,营养物,抗生素,或类似的化合物。所述样品可被用于诊断或监测分析。用于从哺乳动物获取样本的方法在本领域中公知的。如果所述术语“样品”单独使用,它仍然意味着“样品”是“生物样品”或“患者样品”,即,所述术语可以互换使用。样品也可能是测试样品。所述术语“测试样品”是指来自在植入本文所描述的结构后的受试者的样品。所述测试样品可以来源于多种在所述哺乳动物受试者中的来源,包括但不限于血液、血清、尿液、精液、骨髓、黏膜、组织等。所述术语“对照”或者“对照样品”是指阴性对照,其中预期的阴性结果有助于联系在所述测试样品中的阳性结果。可选择地,所述对照可以是阳性对照,其中预期的阳性结果有助于与在所述测试样品中的阴性结果联系。适合本发明的对照包括,但不限于,已知具有正常水平的细胞因子的样品,从已知没有被植入本文所述结构的哺乳动物受试者获得的样品,以及从已知正常的哺乳动物受试者获得的样品。对照也可以是从在植入本文所描述的结构之前的受试者获得的样品。另外,所述对照可以是含有正常细胞的样品,其与在所述测试样品中含有的细胞具有相同的来源。本领域技术人员可以理解其它适合于本发明的对照。所述术语“受试者”的意思是任意单个的人体受试者,包括符合治疗条件的患者,其正在经历或具有一种或多种体症、症状或其它缺陷器官功能或故障的迹象,包括缺陷、损坏或者非功能性器官。这种受试者包括,但不限于,最新诊断或预先诊断的受试者,并且现在正经历重发或复发,或不管何种原因正处于缺陷器官功能或故障的危险期。所述受试者可以已经预先治疗缺陷器官功能或故障相关的疾病,或者没有被治疗。所述术语“患者”是指任意单个的动物,更优选的,需要治疗的哺乳动物(包括非人类动物,例如狗、马、兔、动物园动物、牛、猪、羊和非人类灵长类)。最优选的,所述患者是人类。所述术语“尿流改道”或者“导管”是指最终器官或组织构造,所述最终器官或组织构造由所述受试者在一段时间内与植入的尿流改道结构、吻合的输尿管和任选的附加的内腔相互作用而产生。所述内腔是与连接房室的前部,其允许尿液通过所述腹壁,并且可以由腹膜包裹的最前部的管道样的部分制备,将所述结构的尾端(定位在所述腹腔内部)与所述皮肤连接。所述术语“尾端的”和“颅端的”是关于尿生产和流体的描述性术语。所述术语“尾端的”是指所述尿流改道结构在植入后接近所述造口的一端,同时,所述术语“颅端的”是指所述尿流改道结构在植入后接近所述肾脏和输尿管的一端。所述尾端的可以指植入结果的所述“造口端的”或者“流出的”一端。所述术语的“碎屑(detritis)”是指在植入尿流改道结构后发生的愈合和再生过程中形成的碎片。碎屑可以由脱落的组织细胞、炎性渗出物和支架生物降解物组成。如果所述导管被这些碎片阻塞(不当流出),那么所述淤塞的碎片在所述导管的管腔形成碎屑或半固体团块。所述术语“清创术”是指手术的或者非手术的去除外源物质、或者来自导管撕裂的、衰弱的、污染的或者死亡的组织,以防止感染、防止阻塞和促进所述愈合过程。所述清创术可以包括碎屑的去除。所述术语“造口”是指手术创建的开口,用于尿液从尿流改道结构的排泄外流端通过流到人体的外部。所述尿液通常在体外的蓄水库收集。所述术语“造口端口”或者“造口纽扣”是指意思是,例如用于维持所述造口开口完整的装置。在一个实施方案中,所述造口端口促进尿液从尿流改道结构的排泄外流端通过流出到所述受试者身体的外部。在另一个实施方案中,所述造口端口的管腔可以用来连接与支架(支架系带)连接的缝合股,所述缝合股设置在一个或两个输尿管中,如此以避免支架迁移,并允许稍后去除支架。本文使用的所述术语“扩大”或“放大”是指增加存在的层状组织的管腔器官或组织构造的尺寸。例如,在本发明一方面中,所述存在的层状组织的管腔器官或组织构造可以放大,以百分之10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、或29。在本发明的另一方面中,所述存在的层状组织的管腔器官或组织构造可以放大,以增加所述存在的层状组织的管腔器官或组织构造的容积。本文所是使用的所述术语“容积”是指能够容纳在限定的区域内的液体的数量。“再生预后”或者“再生的预后”通常是指预期或者预测植入本文所描述的结构后可能的过程或结果。如本文所使用的,再生预后包括预期或预测功能性器官或组织构造在植入本文所描述结构后的发育或完善。如本文所使用的,“预后再生”意思是提供植入新器官或者组织构造后可能的过程或结果的预期或预测。“再生组织”指的是新的器官或组织构造的组织,其在植入本文所描述的结构后发育。2.细胞群体本发明提供的平滑肌细胞的群体,用于重建、再生、扩大或替换一个或多个以下:层状组织管腔器官或组织构造,其中所述平滑肌细胞不是源自器官或组织构造,所述器官或组织构造属于所述受试者再生、重建、扩增或替换的;呼吸组织,其中所述平滑肌细胞不是源自呼吸组织;胃肠道组织,其中所述平滑肌细胞不是源自GI组织;血管,其中所述平滑肌细胞不是源自天然血管。所述SMC群体其特征在于收缩功能以及对一个或多个平滑肌细胞标记物为阳性。如本文所讨论的,组织工程原理已被成功地应用于提供可植入的细胞接种模型,用于层状组织管腔器官和组织构造的重建、扩大或替代,如膀胱或膀胱元件,通常由尿路上皮和平滑肌层组成。(Becker等Eur.Urol.51,1217-1228(2007);Frimberger等Regen.Med.1,425-435(2006);Roth等Curr.Urol.Rep.10,119-125(2009);Wood等Curr.Opin.Urol.18,564-569)。平滑肌细胞可源自所述患者自身组织或合适供体的所述组织。不过,也有依赖于来自主要器官位点的细胞培养系统的发育与维持相关的挑战,例如在癌变膀胱组织的治疗过程中,用于发育新器官和健康工程组织的所述基本单元。显然,来自患者的癌细胞不适合于增殖可植入的新膀胱支架或模型。此外,来自供体的细胞供应及获取活检的难易程度可以为限制因素。本发明提供的细胞群体源自与所述器官或组织构造不同的来源,所述器官或组织构造为所述重建、扩大或替换的所述受试者的。在一个实施方案中,所述来源为非自体来源。所述非自体来源可能为同种异体的、同源的(自体或同基因的)、或其任意组合。在另一实施方案中,所述来源为自体的来源。在另一方面中,所述细胞群体表达标记物与平滑肌细胞群体一致或其典型。在一方面中,所述来源为外周血。在一个实施方案中,所述外周血来源的平滑肌细胞群体来自合适的供体。所述供体样本可能为静脉血液。在一方面中,所述来源为脂肪组织。在一个实施方案中,所述脂肪组织来源的平滑肌细胞群体来自合适的供体样品。所述供体样品可能为腹部去脂术或脂肪吸收过程中除去的脂肪组织。在又一其它实施方案中,所述分离的本发明的细胞群体,培养后,可以发育各种平滑肌细胞,其特征包括但不限于,丘陵和山谷形态,表达一个或多个平滑肌肉细胞标记物,收缩功能,形成纤维,和细胞因子的合成。在一方面中,所述培养的细胞群体的特征在于其丘陵和山谷形态。所述细胞具有丘陵和山谷的形态,可能具有各种特性,包括但不限于,细长的,扁平的和传代后的成纤维样的,加长的和平行布置的,“陀螺”的增长外观,及其任意组合。在一个实施方案中,在适当的培养基中培养后,所述细胞群体发育出了“丘陵和山谷形态”,其为典型培养的平滑肌细胞。另一方面,所述培养的细胞群体其特征在于,存在一个或多个平滑肌细胞标记物。在一个实施方案中,在适当的介质中培养所述细胞群体后,开发检测平滑肌细胞的标记物,包括但不限于一个或多个下列:心肌素、α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、结蛋白、肌成纤维细胞抗原、SM22,及其任意组合。在另一方面中,所述培养的细胞群体的特征在于存在一个或多个细胞表达一个或多个细胞表面标记物。在一个实施方案中,在适当的培养基中培养的所述细胞群体后,包含一个或多个对细胞表面标记物为阳性的细胞,包括但不限于,一个或多个下列的:CD73、CD90、CD105、CD166、CD31、CD54、CD56、CD117,及其任意组合。对细胞表面标记物为阳性的细胞群体,可能在基因表达水平和/或蛋白表达水平(见实施例3)上为阳性。例如,所述细胞群体可能证明CD73在所述基因水平上表达,但不在蛋白质水平上表达,而CD45可能证明在基因和蛋白水平上表达。在另一实施方案中,在适当的培养基中培养的所述细胞群体包含一个或多个细胞,其为:CD45+、CD31+、CD54+、CD56+、CD90+,和CD105+。在另一实施方案中,所述细胞群体具有细胞表面标记物配置,其为:CD31+、CD73-、CD90+、CD105+、CD117+,CD133-。所述细胞表面标记物配置还可以包括一个或多个CD45+、CD166+、CD54+,和/或CD56+。在另一方面,所述培养的细胞群体其特征在于存在一个或多个具有收缩功能的细胞。在一个实施方案中,在适当的培养基中培养的所述细胞群体发育收缩功能。在另一实施方案中,所述收缩功能是钙依赖的。在一个其它的实施方案中,通过钙离子螯合剂抑制收缩来证实其所述钙依赖性收缩功能。在另一实施方案中,所述钙离子螯合剂为EDTA。那些在本
技术领域:
的普通技术人员将会理解,在本领域中已知的其它螯合剂可能是合适的。在另一方面中,所述培养的细胞群体的特征在于丝的形成。在一个实施方案中,在丝形成后,在适当的培养基中培养所述细胞群体。在一方面中,该细胞群体的包括表达一个或多个细胞因子的至少一个细胞。在一个实施方案中,所述细胞因子选自MCP-1、制瘤素M、IL-8,和GRO。在一方面中,本发明的所述细胞群体在分离后具有有限的的培养增殖寿命。在其它实施方案中,该细胞群体具有的寿命约1代,约2代,约3代,约4代,约5代,约6代,约7代,约8代,约9代,约10代,约11代,约12代,13代,14代,约15代,约16代,约17代,或18代。在一个优选的实施方案中,该细胞群体具有不超过5代的培养寿命。所述脂肪来源的SMC在每代之间一般可以培养3-5天,而且血液来源的SMC在所述第一代之前,一般可以培养14天,然后附加代(更多详细信息,见实施例1)可以培养3-5天。在一方面中,本发明提供了再生细胞群体,当沉积在如本文所述的支架或模型上时含有至少一个再生细胞,并植入到需要的受试者中,为所述器官或组织构造提供了再生效果,所述器官或组织构造为本文所述重建、扩大、或替换的所述受试者的。再生细胞群体具有植入有需要的患者后激发或启动层状组织管腔器官或组织构造再生的能力。在一般情况下,所述器官或组织构造的再生,其特征在于通过所述细胞成分,组织组成和体系结构、功能和调节发育的恢复。另外,再生的细胞群体最大限度地减少趋向于发生在植入的细胞接种管腔器官或组织构造结构部位的不完整或疾病。在所述植入部位的组织破坏可表现自身为增加胶原蛋白沉积和/或形成瘢痕组织,可以通过使用再生细胞群体使其每一个被最小化。此外,某些细胞活动指示的再生过程。在使用本文所述的细胞群体和支架来再生膀胱或膀胱部分所述情况下,再生器官或组织构造由平滑肌实质的维管组织(辐射围绕众多微血管延伸朝向管腔表面)组成,以及基质元素具有发达的血管与黏膜表面对齐(见Jayo等(2008)RegenMed3,671-682)。再生膀胱或膀胱部分,其的特征还在于存在纺锤/间充质细胞和αSMA阳性肌前体细胞。在一个实施方案中,在新基质组织和多个新血管(动脉)周围观察到所述αSMA阳性纺锤细胞。所述再生细胞群体有能力刺激或引发不同器官或组织构造再生,包括但不限于,胃肠器官或组织构造,如食管、小肠、大肠、胃、结肠、或肛门括约肌;呼吸器官或组织构造,例如,肺,肺组织包括肺泡和细支气管组织;血管。在一个实施方案中,所述再生的细胞为脂肪来源的平滑肌细胞,其利于细胞成分、组织的组织和体系结构、和/或器官或组织构造的功能的恢复。在另一实施方案中,所述再生的细胞不是干细胞。在另一方面中,所述再生细胞群体提供了再生的作用,其特征在于所述适应性调节还原的层状组织管腔器官或组织构造的大小。在一个实施方案中,所述再生细胞群体的再生作用是建立对受试者具有特异性的适应性调节,所述受试者接收接种所述再生细胞群体的所述支架或模型。在一个实施方案中,所述适应性调节使用本文所述的结构替换或扩大受试者的膀胱,使得所述新膀胱生长和发育到与受试者身体大小成正比的尺寸。在一个实施方案中,所述细胞群体能够再生刺激MCP-1产生细胞群体,其中包含至少一个表达所述趋化因子的细胞产生MCP-1。所述细胞因子MCP-1为膀胱逼尿肌细胞的正常产物。在主动脉平滑肌细胞中,它在再生中起到了重要作用,及其招募单核细胞的能力是众所周知的。然而,它不止是趋化因子;它也是一种有效的血管平滑肌细胞增殖的有丝分裂原以及招募循环单核细胞到血管损伤区域。单核细胞通常转化为巨噬细胞,其可以作为细胞因子和生长因子的储藏。巨噬细胞和肌肉前体细胞二者目标为MCP-1信号。此细胞因子在体内有牵连的干细胞和祖细胞招募,可能有助于再生过程。在一个实施方案中,能够再生刺激的所述细胞群体为产生MCP-1的细胞群体,其中包含至少一个细胞表达趋化因子产物MCP-1。MCP-1再生刺激,其特征在于招募某些类型的细胞到所述植入部位。在一个实施方案中,MCP-1招募肌肉祖细胞到所述植入部位以在所述新膀胱内增殖。在另一实施方案中,MCP-1招募单核细胞到植入部位,进而产生各种细胞因子和/或趋化因子,以促进再生过程。在一个实施方案中,MCP-1诱导的大网膜细胞发育成肌肉细胞。在一方面中,本发明提供了使用特定的细胞因子,如MCP-1,作为替代标记物用于组织再生。这样的标记物在功能是否被改组的基础上可用于结合评估再生。在再生过程中的时间内监测替代标记物,也可以作为再生的预后指标。在另一实施方案中,所述细胞群体为纯化的细胞群体。如本文所述的纯化细胞群体,其特征在于基于一个或多个形态的表型,标记物的所述表达,和功能。所述表型包括但不限于,一个或多个丘陵和山谷形态,表达一个或多个平滑肌细胞标记物,细胞因子的表达,培养中有限的增殖寿命,收缩功能,以及诱导长丝形成的能力。所述表型可包括本文所述的其他功能或那些在本
技术领域:
的普通技术人员所知的。在另一实施方案中,所述纯化群体基本上为均匀的平滑肌细胞群体,如本文所述。纯化的群体,其基本上是均匀的,通常至少约90%是均匀的,如根据一个或多个形态,标记物的表达,和功能来判断的。在其它实施方案中,所述纯化的群体至少约95%是均匀的,至少约98%是均匀的,或至少约99.5%是均匀的。在另一实施方案中,所述平滑肌细胞群体直接源自人类脂肪组织,其特征在于差异表达以下的一个或多个:骨桥蛋白、Oct4B、生长分化因子5(GDF5)、肝细胞生长因子(HGF)、白血病抑制因子(LIF)、黑色素瘤细胞粘附分子(MCAM)、血管细胞粘附分子1(VCAM1)、PECAM、vWF、FLK-1、runt-相关转录因子2(RUX2)、骨形态发生蛋白6(BMP6)、CD44,和IL-IB,相对其在人骨髓源的间充质干细胞(MSC)的表达水平。在另外一个实施方案中,所述SMC群(a)低量表达一个或多个GDF5、HGF、LIF、MCAM、RUNX2、VCAM1、PECAM,vWF和Flk-1和/或(b)过量表达的一个或多个Oct4B、骨桥蛋白、BMP6、CD44,和IL-IB,相对于其在人骨髓来源的MSCs的表达水平。在另外一个实施方案中,所述SMC群(a)低量表达所有的GDF5、HGF、LIF、MCAM、RUNX2、VCAM1,PECAM和vWF,和Flk-1和/或(b)过量表达的所有的Oct4B、骨桥蛋白、BMP6,CD44和IL-IB,相对于其在人骨髓来源的间充质干细胞的表达水平。在另一实施方案中,所述平滑肌细胞群体直接源自于脂肪组织,所述平滑肌细胞群体包括一个或多个CD45+细胞和/或一个或多个CD117+细胞。在其它实施方案中,本发明提供了平滑肌细胞群体,直接源自人体脂肪组织,比人类骨髓来源的MSC具有较短的增殖寿命。在另一实施方案中,所述SMC群在培养中显示出接触依赖性抑制增殖。在另外一个实施方案中,所述SMC群直接源自脂肪组织,其特征在于下调至少一个平滑肌细胞(SMC)标记以响应血栓素A2模拟物。在其它实施方案中,所述SMC标记选自心肌素和肌球蛋白重链-平滑肌同种型(SMMHC)。在另一实施方案中,所述心肌素和SMMHC是下调的,以响应血栓素A2模拟物。在所有的实施方案中,所述SMC群源自自体来源或非自体来源。在另一实施方案中,本发明的所述细胞群体可施用于具有疾病的受试者而不使用支架,如移植。那些在本领域的普通技术人员将理解移植的合适方法。本发明提供平滑肌细胞群体从与所述管腔器官或组织构造不同的来源分离,所述管腔器官或组织构造为所述再生,重建,扩大或替换的受试者的。所述管腔器官或组织构造可能为膀胱或膀胱的部分,呼吸器官或组织构造,胃肠道器官或组织构造,血管器官或组织构造,例如,血管,或眼组织构造。因此,所述平滑肌细胞群体可能源自非膀胱、非呼吸、非胃肠道、非血管、或非眼来源。本发明还提供了GI组织细胞群体,如源自所述食管的食管细胞群体。所述食管来源可能为自体源。在一个实施方案中,该细胞群体为异源性细胞群体。在另一实施方案中,所述异源细胞群体包括上皮细胞和/或平滑肌细胞。在另一实施方案中,所述食管细胞群体的特征在于存在一个或多个生物标记物。在另一实施方案中,该细胞群体具有可检测的上皮细胞标记物,包括但不限于,一个或多个以下:KRT8(角蛋白8)、vWF(vonWillebrand因子)、细胞角蛋白8、18、19,及其任何组合。在一个实施方案中,该细胞群体具有可检测的平滑肌细胞标记物,包括但不限于,一个或多个以下:心肌素、α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、结蛋白、肌成纤维细胞抗原、SM22、及其任意组合。本发明还提供了呼吸组织细胞群体,如源自肺(例如,全肺或肺活检)的细胞群体。所述来源可能为自体或非自体来源。在一个实施方案中,该细胞群体为异源性的细胞群体。在另一实施方案中,所述异源细胞群体可包括细支气管细胞、上皮细胞、肺泡细胞、Clara细胞,或其任意组合。所述呼吸细胞群体的特征在于细支气管细胞、上皮细胞、肺泡细胞、及其任意组合相关标记的表达。所述标记物包括一个或多个以下物质:Clara细胞分泌蛋白(CCSP)、Prosurfactant蛋白C(proSPC)、表面活性蛋白C(SPC)、KRT18、Secretoglobulin、家族1A、成员1(胚泡激肽)(SCGB1A1),和表面活性蛋白A1(SFTPA1)。(见实施例6-9)CCSP为为细支气管上皮细胞标记物,以及proSPC为肺泡上皮细胞标记物。KRT18为肺特异性细胞角蛋白和上皮细胞标记物。SCGB1A1(分泌球蛋白,家族1A,成员1(子宫球蛋白))为Clara细胞标记物。SFTPA1为肺泡上皮细胞标记物。所述呼吸细胞群体也可以为纯化的细胞群体。本发明还提供了内皮细胞(EC)群体。此EC群体可用于血管的重建、扩大或替换。目前,直接从静脉或动脉获得细胞群体,以构建血管移植(Yang等AnnalsofPlasticSurgery:March2009-Volume62-Issue3-pp297-303)。内皮细胞可以从所述主动脉获得(CascadeBiologicis,C-006)。然而,获得合适的用于分离细胞群体的血管片段,从血管获得细胞的困难性,以及从每活检体获得的细胞的数目,为限制因素。这是有利的:从身体的其他部位获得细胞群体,其中细胞更丰富,更容易获得更大的数量。本发明提供的细胞群体源自非血管来源。所述来源可能为自体或非自体。所述细胞群体可能为平滑肌细胞(SMC)群体或内皮细胞(EC)群体。所述非血管来源可以为脂肪组织或外周血。所述SMC群体可以源自患者样本。所述患者样本可能为脂肪组织或静脉血。在一个实施方案中,所述非血管源可能为腹部去脂术或脂肪吸收过程中除去的脂肪组织。本发明考虑内皮细胞(EC)群体的使用来自非血管来源,其特征在于表达的基因为EC群体或与其一致。所述EC群体其特征可在于一个或多个所述下列CDH5/VECAD、vWF、PECAMl、FLT1/VEGFR、KDR/FLK1、TEK,及其任何组合中的差异表达。所述差异表达的基因可能为EC标记物。在另一实施方案中,在适当的培养基中培养的所述细胞群体开发的可检测的EC标记物,包括但不限于,一种或多种所述下列CDH5/VECAD、vWF、PECAMl、FLT1/VEGFR、KDR/FLK1、TEK,及其任何组合。在一方面中,所述培养的EC群体,其特征在于内皮形态。所述细胞表现出缩短的、圆形的或长方体形状。在实施例17中更详细地描述了EC群体。在另一方面,本发明涉及源自膀胱组织的平滑肌细胞群体,用于层状组织管腔器官或组织构造重建、再生、增强或替换,其中所述平滑肌细胞源自非自体来源。所述非自体来源可能为异基因的或同基因的。3.分离细胞群体的方法自体细胞群体直接源自需要治疗的受试者。非自体细胞群体可能源自合适的捐赠者。所述源组织一般与需要治疗的器官或组织构造不同。细胞群体可以源自患者自身组织或供体组织,例如,脂肪或外周血。所述细胞可被分离活检。此外,所述细胞可以在使用前冻结或扩大。为了准备构建细胞接种支架,从含有平滑肌细胞的合适的供体中获得的样品,被分解成合适的细胞悬液。已发行的美国专利号5,567,612(其全部内容通过引用的方式纳入本文)对分离和培养细胞的方法进行了讨论。分解所述细胞形成所述单细胞的阶段对于初始原代培养而言是没有必要的,因为一段时间后可得到单细胞悬浮液,例如,在体外培养一星期。可通过机械和酶破坏细胞外模型和将细胞维持一体的细胞间连接来进行组织分离。非自体细胞可以在体外培养,如果需要的话,可用于增加接种在支架上的细胞数。可在接种遗传物质之前进行细胞转染。可在聚合物接种之前对平滑肌细胞转染特定的基因。所述细胞聚合物结构可携带遗传信息(所述宿主或所述组织工程新器官长期存活所需要)。可以制备细胞培养物,带或不带细胞分级分离步骤。可以使用的细胞分级分离技术是那些在本
技术领域:
技术人员已知的。也可以根据细胞的大小、DNA含量、细胞表面抗原、和生存能力进行细胞分级分离。例如,可从脂肪组织中富集平滑肌细胞,同时减少内皮细胞和脂肪细胞来收集平滑肌细胞。虽然也可以使用细胞分级分离,其没有必要用于本发明的所述实践中。本文所述方法的另一种任选步骤为冷冻保存。低温保存可能是有用的,例如,减少多个侵入性外科手术的需要。取自受试者活体检查或样品的细胞可能被放大,而且所述放大细胞的一部分可以使用,而另一部分可低温法保藏。扩增并保存细胞的所述能力,可最大限度地减少外科手术所需的数量。低温保存效用的另一个例子为在组织库中。非自体细胞可以被存储,例如,在供体组织库中。由于新的器官或组织构造需要细胞,可以根据需要使用所述冷冻保存的细胞供应。可以初步确定合适的供体而且一个或多个活检可低温保藏。以后,如果受体的器官或组织构造在一些治疗方式下失败后,可解冻所述低温保存完好的非自体细胞并用于治疗。例如,如果经治疗后,肿瘤在受试者新的器官或组织构造中重新出现,低温保藏的细胞可用于重建所述器官或组织构造,而不需要源自供体的额外活检标本。根据以下常规协议,平滑肌细胞可从脂肪或外周血中分离。可以得到合适的重量(例如,以克为单位)和/或面积(例如,平方厘米)的脂肪活检标本。在所述计划植入新的器官或组织的构造结构之前,可以得到适当体积的(例如,ml)外周血。以下为协议的具有代表性的例子,其适合从脂肪的所述基质血管部分(SVF)(代表由多种类型细胞组成的异质细胞群体,包括内皮细胞和平滑肌细胞以及由国际细胞治疗协会(ISCT)标准(Domini等2006Cytotherapy8:4,315-317)定义的类MSC)分离平滑肌细胞。可通过活检并用PBS(例如,3次)洗涤,用解剖刀和剪刀切碎,转移到50mL锥形管中,并在胶原酶(例如,0.1至0.3%)(Worthington)溶液和1%BSA的DMEM-HG中37℃下温育60分钟,来获得脂肪组织合适的克重量(例如,7-25g)。可不断地震荡或定期摇动所述锥形管,以利于消化。可以在600g下进行10分钟离心分离,沉淀所述SVF,再悬浮于DMEM-HG+10%FBS中。然后,基质血管部分可用于接种零代。以下为协议的具有代表性的例子,其适合从外周血中分离平滑肌细胞。合适体积的外周血(如25ml)可1:1稀释在PBS中,并在50mL锥形管中,用25ml的Histopaque-1077(Sigma)分层。在离心分离(如,800g,30分钟)后,可收集所述单核部分,用PBS洗涤一次,并再悬浮于α-MEM/10%胎牛血清(Invitrogen)中,以接种零代。另一方面,本发明涉及从膀胱组织分离平滑肌细胞群体的方法,其用于重建、再生、扩大或替换层状组织管腔器官或组织构造,其中所述平滑肌细胞(SMC)源自非体源。所述非自体源可能为异基因或同基因的。那些在本领域的普通技术人员将理解从膀胱组织中分离SMC的协议。例如,示例性协议中见于:Bertram等,美国专利号7,918,897;Atala,美国专利号6,576,019;KimBS和AtalaA:Mesenchymalcellculture:smoothmuscle.In:MethodsofTissueEngineering.由AAtala和RPLanza.SanDiego编辑的:AcademicPress2002;pp287-292;以及LaiJY和AtalaA:Epithelialculture:urothelium.In:MethodsofTissueEngineering.由AAtala和RPLanza编辑的.SanDiego:AcademicPress2002;pp243-246,其中每一个的全部内容通过引用方式纳入本文。那些本领域的普通技术人员将会理解用于分离平滑肌细胞的额外的方法。在另一方面中,本发明提供了分离食管细胞群体的方法。以下为适合从所述食管组织中分离食管细胞的代表性的协议实施例。获得食管组织,并放置在DMEM+5μg/mL的庆大霉素(洗涤液(WashSolution))中并涡旋震荡5分钟。然后,将所述组织放入新鲜的洗涤液中。在将组织切碎至均匀大小之前,重复此过程1到5次。然后放置所述切碎的组织到含有消化溶液(DigestSolution)(具有300U/mL胶原蛋白酶TypeIV-Worthington/Dispase-Stem细胞在DMEM中;20mL/lg组织)的50mL离心管中。消化在37℃下进行30分钟。用20%FBS,在KSFM培养基中实现酶中和。然后混合所述消化的组织,并通过一个100uMSteriflip过滤器过滤,以确保没有大的组织片段转入。然后,所述材料在300g下离心5分钟以沉淀所述细胞。然后用KSFM洗涤所述细胞沉淀。然后计数所述细胞并铺板在生长培养基(KSFM+2%FBS或KGM(50:50的KSFM与附加物+DMEM10%FBS,含有Anti/Anti,1XITS)上(参见实施例12)。另一方面,本发明提供分离呼吸道细胞群体的方法。实施例6提供了适合从肺组织分离呼吸道细胞的代表性的协议实施例。那些在本
技术领域:
的普通技术人员将理解分离平滑肌、食管、呼吸道和胃肠细胞群体的附加方法。在一方面中,本发明提供了从SVF分离平滑肌细胞群体的方法,而不需要诱导分化成平滑肌细胞的条件。在一个实施方案中,所述方法包括:a)获得脂肪组织,b)消化所述脂肪组织,c)离心所述消化的脂肪组织,提供基质血管部分(SVF),d)培养所述SVF,而不需要诱导分化成平滑肌细胞的条件,和e)从源自SVF的脂肪组织中分离平滑肌细胞群体。在一个实施方案中,所述培养步骤包括洗涤所述SVF,重新悬浮细胞培养基中的所述SVF,并平板涂覆重新悬浮的SVF。在另一实施方案中,所述培养步骤包括提供细胞群体,其粘结到所述细胞培养支持物,如板或容器。在另一实施方案中,所述方法进一步包括扩大培养的细胞群体。在其它实施方案中,所述方法进一步包括分析所述平滑肌细胞群体的平滑肌细胞特性。在一个实施方案中,所述脂肪组织源自非自体来源。在一个实施方案中,所述培养条件不需要使用细胞培养成分诱导源自SVF脂肪组织的细胞群体分化成平滑肌细胞。Jack等,JBiomaterials30(2009)3529-3270报道,在含有肝素的诱导培养基上培养源自SVF的未分化的脂肪干细胞6个星期,以将干细胞分化成平滑肌细胞(见Rodriguez美国专利号7,531,355)。由Jack等报道的所述干细胞并不需要在此孵育期分裂。在另一实施方案中,所述培养条件不需要使用诱导介质,包括含有肝素的诱导介质。在另一个实施方案中,本发明的所述方法包括使用的培养条件不需要使用外源性生长因子将细胞群体分化成平滑肌细胞或用于培养和扩大细胞群体。与其它报道的方法相比,本发明方法的优点包括删除了将脂肪干细胞分化成平滑肌细胞的步骤,从而减少在获得脂肪活检和从中分离平滑肌细胞群体之间的时间间隔。此外,删除了其它诱导分化的细胞培养基成分,如外源性生长因子,对于成本方面是有利的。在另一方面,本发明提供了分离和培养平滑肌细胞群体的方法,其含有至少一个具有收缩功能的细胞,并且对一个或多个平滑肌细胞标记物为阳性。在一个实施方案中,所述方法包括以下步骤:从合适的供体中获得样品,其中所述样本不能从所述管腔内脏器官或组织构造中获得,所述管腔内脏器官或组织构造为在有需要其的受试者中重建、扩增或替换的所述目标。在另一实施方案中,所述方法包括从捐赠样本中获得平滑肌细胞的所述步骤。在另外一个实施方案中,所述管腔内脏器官或组织构造为膀胱或膀胱部分。在一个实施方案中,所述示例为非自体样品。在另一实施方案中,所述样品为外周血液样本。在又一实施方案中,所述样品为脂肪组织样品。所述脂肪组织可能为腹部去脂术过程中从受试者除去的组织。在另一实施方案中,所述获得步骤之后为分离步骤。在外周血样品的情况下,所述分离步骤包括将所述样品与密度梯度材料接触,离心所述样品来确定具有单核部分的密度梯度,从所述密度梯度中提取单核部分。所述分离步骤之后为培养步骤,在该步骤中对所述提取部分的细胞进行培养。在所述脂肪组织样品的实例中,所述纯化步骤包括用胶原酶消化样品,离心消化的样品,将离心样品混合以从原代脂肪细胞中分离基质细胞,离心分离所述混合样品获得基质血管部分,可以重新悬浮用于随后的培养。在一个方面中,本发明提供了未经使用诱导细胞培养基提供分离平滑肌细胞(SMC)群体的方法。在一个实施方案中,该方法包括以下步骤:a)获得脂肪组织活检,b)酶促消化所述脂肪组织,c)离心所述消化的脂肪组织,以提供一种包含异质性细胞群体的基质血管部分(SVF),d)洗涤和平板涂覆所述异质性细胞群体,e)未经使用平滑肌细胞分化诱导介质,培养所述细胞群体,f)从所述培养的细胞中分离出完全分化的SMC群体。在另一实施方案中,所述培养步骤e)包括选择贴壁于细胞培养支持物的细胞。在另一实施方案中,所述培养步骤e)不包括使用含有外源性生长因子的细胞培养基。在一个实施方案中,所述培养方法包括使用的细胞培养基含有最小必需培养基(例如,DMEM或-MEM)和胎牛血清(例如,10%FBS),由本领域那些普通技术人员已知的标准条件。在另一个实施方案中,所述平滑肌细胞群体不是来源自脂肪的干细胞群体。在一个其它实施方案中,平滑肌细胞群体不是间充质干细胞群体。在另一个方面中,本发明提供了分离和培养内皮细胞群体的方法。EC群体的特征在于,存在的细胞表现出缩短的内皮样形态、圆形的或长方体形状。所述EC群体含有的细胞对一个或多个内皮细胞标记物为阳性。在一个实施方案中,所述方法包括以下步骤:从有需要重建、扩增或替换血管的患者获得样品,其中样品从非血管源获得。在另一实施方案中,内皮细胞源自患者身上获得的样品。在一个实施方案中,所述样品对患者为自体或非自体。在另一实施方案中,所述样品为外周血样品。在又一实施方案中,所述样品为脂肪组织样本。所述脂肪组织可以是腹部去脂术过程中从受试者除去的组织。在另一实施方案中,所述获得步骤之后为分离步骤。在外周血样品的所述实例中,所述分离步骤包括将所述样品与密度梯度材料接触,离心样品来确定单个分离频带中产生的细胞的密度梯度,从密度梯度中提取和洗涤细胞的分离频带。所述分离步骤之后为培养步骤,在该步骤中对所述提取部分的细胞进行培养。在脂肪组织样本的实例中,所述纯化步骤包括用胶原酶消化所述样品,离心消化的样品,混合离心样品以从原代脂肪细胞中分离基质细胞,离心所述的混合样品以获得基质血管部分,其可以重新悬浮用于随后的培养。在一方面中,本发明提供了分离内皮细胞(EC)群体的方法。已成功地从外周血和脂肪源分离出内皮细胞(Daiju等,2005.Circulation111:926-931;Shepherd等,2006.TheFASEBJ.20:El124-El132;melero-MartinJM等,2007.Blood109(11):4761-4768;Kern等,1983.J.Clin.Invest.71:1822-1829;Planat-benardV等,2004.Circulation109:656-663)。在一个实施方案中,本发明提供了从非血管源分离EC的方法。所述血管源可以是外周血,而且实施例17提供了用于获得EC的示例性协议。所述非血管源可以是脂肪组织,在其实例中,所述方法可以包括一个或多个以下步骤:a)获得脂肪组织活检,b)酶消化所述脂肪组织,c)离心分离所述消化脂肪组织以提供基质血管部分(SVF),其包含异质性群体的细胞,d)洗涤和平板涂覆所述异质性细胞群体,e)在细胞培养基中以VEGF培养细胞群体,f)从所述培养的细胞中分离EC群体。在另外一个实施例中,所述培养步骤e)包括选择贴壁于细胞培养支持物的细胞。以下的实施例17提供了从脂肪组织中分离内皮细胞示例方法的附加信息。在一个实施方案中,所述培养方法包括:使用含有最小必需培养基(例如,DMEM、α-MEM、或EGM-2(CambrexBioScience))和胎牛血清(例如,10%FBS的细胞培养基),由本领域那些普通技术人员已知的标准条件。在另一实施方案中,所述内皮细胞群体不是脂肪来源的干细胞群体。在另外一实施方案中,内皮细胞群体不是间充质干细胞群体。实施例17描述了获得EC群体的示例性协议。4.支架如Atala美国6576019(其全部内容通过引用的方式纳入本文)中描述的,支架或聚合物模型可以由各种不同的材料组成。一般地,生物相容材料及尤其是可生物降解材料是本文所述的构建支架的优选材料。所述支架为可植入的、生物相容的、合成的或天然的聚合物模型,至少具有两个独立的表面。所述支架被形成以符合有需要或治疗的管腔器官或组织构造的至少部分。所述生物相容性材料为可生物降解的。生物相容性是指对生物学功能不具有毒或有害影响的材料。可生物降解是指材料可被患者身体吸收或降解。可生物降解材料的实例包括,例如,可吸收缝合线。用于形成支架的代表性材料包括天然的或合成聚合物,例如,胶原蛋白,聚(α-羟基酯),如聚(乳酸)、聚(乙醇酸)、聚原酸酯和聚酐及其共聚物,其被以可控制的速率水解降解和被再吸收。这些材料为可降解性,可管理性,大小和配置提供了最大程度的控制。优选的可生物降解的聚合物材料包括:聚乙醇酸和丙交酯乙交酯共聚酯/物纤维(polyglactin),开发的如可吸收的合成缝合材料。聚乙醇酸和丙交酯乙交酯共聚酯/物纤维可由生产商提供。其它支架材料包括纤维素醚、纤维素、纤维素酯、氟化聚乙烯、聚-4-甲基戊烯、聚丙烯腈、聚酰胺、聚酰胺酰亚胺、聚丙烯酸酯、聚苯并恶唑、聚碳酸酯、聚芳醚腈、聚酯、聚酯碳酸酯、聚醚、聚醚醚酮、聚醚酰亚胺、聚醚酮、聚醚砜、聚乙烯、聚氟烯烃、聚酰亚胺、聚烯烃、聚恶二唑、聚苯醚、聚苯硫醚、聚丙烯、聚苯乙烯、聚硫化物、聚砜、聚四氟乙烯、聚硫醚、聚三唑、聚氨酯、聚氯乙烯、聚偏二氟乙烯、再生纤维素、硅树脂、脲-甲醛,或共聚物或这些材料的物理共混物。所述材料可浸渍合适的抗微生物剂,并可被颜色添加剂着色以增加能见度以帮助手术过程。其它支架为可生物降解的材料,包括由EthiconCo.(EthiconCo.,Somerville,N.J.)制造的合成缝合材料,如MONOCRYLTM(乙交酯和ε-己内酯共聚物),VICRYLTM或Polyglactin910(涂覆有Polyglactin370和硬脂酸钙的丙交酯和乙交酯的共聚物),和PANACRYLTM(涂覆有己内酯和乙交酯共聚物的丙交酯和乙交酯共聚物)。(CraigP.H.,WilliamsJ.A.,DavisK.W.,等:ABiologicalComparisonofPolyglactin910andPolyglycolicAcidSyntheticAbsorbableSutures.Surg.141;1010,(1975))和聚乙醇酸。这些使用材料可由生产商提供。在又一实施方案中,可以使用天然脱细胞器官部件创建所述模型或支架。可通过从器官中除去全部细胞和组织内容物来对生物结构或器官部件进行脱细胞处理。脱细胞处理方法包括:一系列的连续提取。该提取过程的一个关键特性为恶劣提取,其可能扰乱或破坏生物结构的复杂基础结构,可避免。第一步涉及除去细胞碎片以及溶解细胞膜。其后为溶解核细胞质组分和核组分。优选地,所述生物结构,例如,器官的一部分,通过使用温和机械破碎方法去除包围器官的细胞膜和细胞碎片来脱细胞。所述柔和的机械破碎方法必须足以破坏细胞膜。然而,在所述脱细胞的过程中,应避免损坏或干扰所述生物结构的复杂基础结构。温和机械破碎方法包括刮擦所述器官部分的表面,搅动所述器官部分,或在合适量的流体中,例如,蒸馏水中搅拌器官。在一个优选的实施方案中,所述温和的机械破碎方法包括在合适体积的蒸馏水中搅拌所述器官部分,直到所述细胞膜被破坏,以及细胞碎片已经从所述器官移除。在所述细胞膜被移除后,所述生物结构的细胞核和细胞质组件都被删除。这可以在通过溶解所述细胞和核部件,而不扰乱所述基础结构的情况下进行。也可使用非离子型洗涤剂或表面活性剂溶解所述核成分。非离子型洗涤剂或表面活性剂的实例包括但不限于,所述Triton系列,可由RohmandHaasofPhiladelphia,Pa.,提供,其中包括的TritonX-100、TritonN-101、TritonX-114、TritonX-405、TritonX-705和TritonDF-16,可由许多供应商市售提供;所述Tween系列,如单月桂酸酯(Tween20)、单棕榈酸酯(Tween40)、单油酸酯(Tween80)和聚氧乙烯-23-月桂基醚(Brij.35)、聚氧乙烯醚W-1(Polyox),及类似物、胆酸钠、脱氧胆酸盐、CHAPS、皂草苷、n-正癸基-D-glucopuranoside、n-正庚基-D-吡喃葡萄糖苷、n-正辛基-D-吡喃葡糖苷和NonidetP-40。本领域技术人员将理解属于在上述分类的化合物的描述,和可从市售得到的供应商以及可能在“ChemicalClassification,EmulsifiersandDetergents”,McCutcheon's,EmulsifiersandDetergents,1986,NorthAmericanandInternationalEditions,McCutcheonDivision,MCPublishingCo.,GlenRock,N.J.,U.S.A.andJudithNeugebauer,AGuidetothePropertiesandUsesofDetergentsinBiologyandBiochemistry,Calbiochem.R.,HoechstCelaneseCorp.,1987.在一个优选的实施方案中,所述非离子型表面活性剂为所述Triton系列,优选TritonX-100。所述非离子型洗涤剂的所述浓度取决于被脱细胞的生物结构类型,可能会改变。例如,对于脆弱组织,例如,血管,所述洗涤剂的所述浓度应降低。非离子型洗涤剂优选的浓度范围可从约0.001至2.0%(w/v)。更优选地,约0.05至1.0%(w/v)。甚至更优选地,约0.1%(w/v)至0.8%(w/v)。这些范围内的优选的浓度为约0.001至0.2%(w/v),特别优选地,约0.05至0.1%(w/v)。所述细胞骨架成分,其中包括所述致密的细胞质细丝网络,胞间配合物和根尖的微孔结构,可使用碱性溶液,如氢氧化铵溶解。也可以使用由铵盐或其衍生物组成的其它碱性溶液,以溶解细胞骨架成分。其它合适的铵溶液实例包括硫酸铵、醋酸铵和氢氧化铵。在一个优选的实施方案中,使用氢氧化铵。所述碱性溶液的浓度,如氢氧化铵,取决于被脱细胞的生物结构类型,可能会被改变。例如,对于脆弱的组织,例如,血管,洗涤剂的浓度应降低。优选的浓度范围可从约0.001至2.0%(w/v)。更优选地,约0.005%至0.1%(w/v)。甚至更优选地,约0.01%(w/v)至0.08%(w/v)。所述脱细胞,干冻结构可在合适的温度下存储,直到需要使用。在使用之前,所述脱细胞结构可在合适的等渗缓冲剂或细胞培养基中平衡。合适的缓冲剂包括但不限于,磷酸缓冲盐水(PBS)、生理盐水、MOPS、HEPES、Hank's平衡盐溶液及类似物。合适的细胞培养基包括但并不限于,RPMI1640、Fisher's,Iscove's,McCoy's、Dulbecco's培养基中,及类似物。而且,可以使用的其它生物相容性材料包括不锈钢、钛、有机硅、金和硅橡胶。可以加强所述聚合物模型或支架。例如,在合成模型或支架的形成过程中可以添加加强材料或在植入前连接所述天然的或合成模型。用于形成所述加强的代表性材料包括天然或合成聚合物,例如,胶原蛋白,聚(α-羟基酯)如聚(乳酸)、聚(乙醇酸)、聚原酸酯和聚酐及其聚物,其在控制的速率下水解降解和被再吸收。这些材料对可降解性、易处理性、大小和配置提供了最大程度的的控制。所述可生物降解的聚合物,其特征在于,关于机械性能,如拉伸强度使用Instron测试仪,聚合物分子量使用凝胶渗透色谱法(GPC)、玻璃化、转变温度使用差示扫描量热法(DSC)以及键结构使用红外(IR)光谱学;关于毒理学,初步筛选测试包括Ames实验及体外致畸性试验和植入动物的免疫原性,炎症反应,释放和降解研究。可利用扫描电子显微镜、组织学和放射性同位素定量评估对体外细胞附着和可行性进行评估。所述生物降解性材料其特征在于,重视材料植入在患者体内后所必需的降解时间量。通过改变所述结构,例如,厚度和网目尺寸,所述可生物降解材料可在约2年,或2个月之间基本上生物降解,优选地在约18个月和4个月之间,最优选地约15个月和8个月之间,最优选地约12个月和10个月之间。在另外一个实施方案中,可构建所述支架在较短的时间框架内降解,包括但不限于,在约1个月内、约2个月内、约3个月内、约4个月内、约5个月内、约6个月内、在7个月内、约8个月内、约9个月内、约10个月内、约11个月内,或约12个月内。如果有必要,可以构建的所述生物降解性材料,在约3年,或约4年,或约5个或更长年内基本上不被降解。本文所述的涂层也可被用于调解所述降解速率。例如,有涂层(例如,聚-丙交酯-共-乙交酯的共聚物)的模型或支架,可能比未经涂层的模型或支架降解更慢。所述聚合物模型或支架可由如上所述的具有可控的孔隙结构制作。所述孔的大小可用于确定细胞分布。例如,所述聚合物模型或支架上的所述孔可以大到使细胞从一个表面迁移到所述相对的表面。另外,所述孔可以小到,使所述聚合物模型或支架(但不是细胞)双方之间无法实现流体连通。实现这一目标的合适孔隙尺寸可以为约0.04微米至10微米的直径,优选为约0.4微米至约4微米的直径。在一些实施方案中,聚合物模型或支架的表面可包括的孔足够大,允许附件和迁移的细胞群体进入所述孔隙。在聚合物模型或支架内部,所述孔径大小可以减小,以防止细胞从聚合物模型或支架的一侧迁移至相反侧。孔径减小的聚合物模型或支架的一个实施方案为,夹在两个大孔材料之间小孔材料层叠结构。聚碳酸酯膜是特别合适的,因为其可以在很好受控的孔径下制造,例如,约0.01微米、约0.05微米、约0.1微米、约0.2微米、约0.45微米、约0.6微米、约1.0微米、约2.0微米、约4.0微米。在所述亚微米级水平,聚合物模型或支架可能对细菌、病毒和其它微生物不可渗透。以下所述特点或标准,其中包括,考虑到在每个离散模型或其部分的所述设计中:(i)形状,(ii)强度,(iii)刚度和刚性,及(iv)缝合能力(所述模型的所述程度,或其中一部分,容易缝合或以其它方式连接到相邻的组织)。如本文所用的,由所述弹性模量定义的模型或支架的刚度,系数表示在每单位面积作用于支架变形的应力与由其导致的变形量之间的比率。(例如,HandbookofBiomaterialsevaluation,Scientific,Technical,andClinicalTestingofImplantMaterials,第二版,由AndreasF.vonRecum编辑,(1999);Ratner,等,BiomaterialsScience:AnIntroductiontoMaterialsinMedicine,Academic出版社(1996))。支架的所述刚性是指给定支架表现出的弹性(或缺乏其)的程度。这些标准的每一个是可变的,其可以改变(通过,除其他外,材料和制造过程的所述选择)以允许所述模型、或其部分放置至最好,并调整以解决其意图的医疗指示和生理功能。例如,所述材料包括所述模型或支架用于膀胱更换、重建和/或扩大,必须足够坚固,以支持缝线而不会撕裂,同时足够兼容,以便适应波动的尿量。理想情况下,所述模型或支架应成形,使在它生物降解后,最终重建的膀胱当空虚时是可以以和天然膀胱相似的方式折叠的,并且所述输尿管不被堵塞,同时泌尿导管已经被从新的器官或组织构造中删除(不留泄漏点)。生物工程膀胱结构可以作为单件生产,或每个部件可以单独地生产,或所述部分的组合可以作为特定的部件生产。可以生产具有特定功能的每个特定的模型或支架部分。否则,特定部分可能会容易制造地生产。特定部分可以由特定材料构建,并且可以被设计为提供特定的属性。特定部分的属性可以包括类似于天然组织(例如,输尿管)的0.5至1.5MPa.sup.2的抗拉强度,30至100%的极限伸长率,或拉伸强度的范围可以从0.5至28MPa.sup.2,最终伸长率范围可为10-200%,压缩强度可以是<12。所述聚合物模型或者支架可以具有三维(3-D)形状。所述3-D形状可以是管状的、半管状的、或半圆柱形状的。所述3-D形状可以是凹形状的。所述聚合物模型或者支架可以具有平面形状。所述平面形状的聚合物模型或者支架可以具有允许更多的弹性的预处理区域。在某些实施方案中,所述预处理区域被涂覆在产生折缝的区域中。在一个实施方案中,所述聚合物模型或者支架具有足够的延展性,以被卷起、被折叠或者其它的形状,以适合通过腹腔镜管道和/或端口植入。在这种实施方案中,所述聚合物模型或者支架具有足够的延展性,不被卷起、不折叠的或者相反的回到(通过腹腔镜管道和/或端口)插入后的形状。这些本领域技术人员可以理解其它的形状的支架,适合在本发明中使用。由纤维形成的网眼状结构是优选的,它可以是圆形的、扇形的、扁平的、星形的,单独的或与其他纤维缠绕的。分支纤维的使用是基于相同的原则,其性质已经被用来解决增加表面面积,使其与体积成比例增大的问题。所有的多细胞生物利用这种重复的分支结构。分支系统代表器官之间,以及个别器官的功能单元之间的通信网络。接种和植入具有细胞的此配置,允许植入大量的细胞,其中每个被暴露于宿主环境,以提供营养物质和废物的自由交换,同时新生血管形成得以实现。该聚合物模型或支架可以制成柔性或刚性的,这取决于所需的最终形式、结构和功能。在一个优选的实施方案中,所述聚合物模型或者支架由平均纤维直径15μm的聚乙醇酸形成,并且使用4-0polyglactin910缝合线配置成膀胱形状的模具。所述最终的构造用液化的共聚物涂覆,例如聚-DL-丙交酯-共-乙交酯50:50,80毫克每毫升二氯甲烷,以提供一定的好处,包括,但不限于,以延缓涂覆的模型或支架的降解,以获得足够的机械特性,并设定其形状。在一个实施方案中,提供所述支架包括涂层,使得其沉降或积聚在所述支架纤维之间的接合处。在进一步的实施方案中,本发明的所述支架用生物相容性和可生物降解性的形状可设置材料涂覆。在一个实施方案中,所述形状可设置的材料含有聚-丙交酯-共-乙交酯的共聚物。在另一实施方案中,所述形状可设置的材料是液化的。在其它实施方案中,所述聚-丙交酯-共-乙交酯包括源自以下成分的丙交酯部分:L-丙交酯、D-丙交酯、DL-丙交酯、以及D-丙交酯和L-丙交酯两种组合。在另一实施方案中,所述有聚-丙交酯-共-乙交酯包括源自以下成分的丙交酯部分:L-丙交酯(以形成聚-L-丙交酯-共-乙交酯),D-丙交酯(以形成聚-D-丙交酯-共-乙交酯),或DL-丙交酯,或D-丙交酯和L-丙交酯两种的组合(以形成聚-DL-丙交酯-共-乙交酯)。所述涂层可以是聚-丙交酯-共-乙交酯(PLGA)50:50,其以在每mL的二氯甲烷中约20、约25、约30、约35、约40、约45、约50、约55、约60、约65、约70、约75或者约80mg。在一个优选的实施方案中,所述PLGA50:50可以是在约42.5mg/mL二氯甲烷中。在示例性的协议中,PLGA被溶解在溶剂(例如二氯甲烷)中,以作为液体溶液形成涂层,被施加到所述支架。在另一实施方案中,所述涂层被提供所述模型或支架的约40%w/w至60%w/w、约41%w/w至59%w/w、约42%w/w至58%w/w、约43%w/w至57%w/w、约44%w/w至56%w/w、约45%w/w至55%w/w、约46%w/w至54%w/w、约47%w/w至53%w/w、约48%w/w至52%w/w、或约49%w/w至51%w/w。在另一实施方案中,所述涂层被提供所述模型或支架的约40%w/w、约41%w/w、约42%w/w、约43%w/w、约44%w/w、约45%w/w、约46%w/w、约47%w/w、约48%w/w、约49%w/w、约50%w/w、约51%w/w、约52%w/w、约53%w/w、约54%w/w、约55%w/w、约56%w/w、约57%w/w、约58%w/w、约59%w/w、或约60%w/w。在另一方面中,本发明的所述支架在植入前(在所述聚合物模型或支架接种细胞之前或之后)可用添加剂或药物处理,例如,以促进在植入后新组织的所述再生。因此,例如,生长因子、细胞因子、细胞外模型或支架组件,和其它生物活性材料可以被添加到所述聚合物模型或支架中,以促进新组织的接枝愈合和再生。一般地,将根据被重建、替换或扩大的所述器官或组织来选择这样的添加剂,以确保适当的新组织在所述嫁接的器官或组织中形成(用于促进骨愈合的此添加剂的例子,参见,例如,Kirker-Head,C.A.Vet.Surg.24(5):408-19(1995))。例如,当聚合物模型(任选接种内皮细胞)用于增强血管组织,血管内皮生长因子(VEGF),(参见,例如,美国专利号5654273)可用于促进新生血管组织的所述再生。可以加入过量的生长因子和其它添加剂(例如表皮生长因子(EGF)、肝素结合表皮样生长因子(HBGF)、成纤维细胞生长因子(FGF)、细胞因子、基因、蛋白质,等)任何数量此生长因子(如有的话),其可通过将细胞接种于所述聚合物模型来生产,如果使用添加的细胞。优选这些添加剂提供足够的量,以促进适合于组织或器官(需要重建、替换或扩大(例如,通过诱导或加速渗透宿主细胞进入嫁接))的新组织的再生。其它有用的添加剂包括抗菌剂(例如抗生素)。一个优选的支持模型或支架由交叉纤维组成,一旦所述细胞植入后,其可以通过短距离之间的营养物质的扩散让细胞生存。所述细胞支持模型或支架被血管化,与植入后细胞团的扩展一致。在植入前,在体外构建三维构造结构,可便于体内植入后的再生事件,并可能将对于所述模型炎症反应的风险降到最低,从而避免嫁接挛缩和收缩。在使用前,可以使用任何已知的方法对该聚合物模型或支架进行消毒。所用的方法取决于所述聚合物模型所使用材料。灭菌方法的实例包括蒸汽、干热、辐射、气体(如环氧乙烷)、气体和煮沸。可以使用的方法,如,例如,溶剂浇铸、压缩成形、长丝牵伸、啮合、浸出、编织和涂层成形使组成支架的所述合成材料成形。在溶剂浇铸中,一种或多种聚合物溶液为适当的溶剂(如二氯甲烷),浇铸为分支类型的浮雕结构。溶剂蒸发后,得到薄膜。在压缩成形中,在高达每平方英寸30,000磅压力下,聚合物被压成适当的类型。长丝牵伸涉及从所述熔融聚合物牵伸,以及编织涉及通过压缩纤维成毡状材料以形成网状。在浸出中,含有两种材料的溶液扩散成接近最终形式结构的形状。接下来,使用溶剂以溶解掉组分之一,导致孔的形成(见Mikos,美国专利号5514378,通过引用纳入本文)。在成核中,支架形状的薄膜暴露于放射性裂变产物中,以创建辐射破坏材料的轨道。接下来,用酸或碱对所述聚碳酸酯板进行蚀刻,将辐射损坏的材料轨道转入孔中。最后,可使用激光来塑造和灼烧单个洞,通过许多材料以形成具有均匀孔径大小的结构。涂层是指涂层或用材料渗透聚合物结构,例如,液化的共聚物(聚-DL-丙交酯-共-乙交酯50:50,80mg/ml二氯甲烷),以改变其机械性能。可以进行一层或多层涂层,直到达到所述所需的机械性能。这些成型技术也可以组合采用,例如,可以将聚合物模型或支架编织,压缩成形,并粘合在一起。此外可通过不同的工序对不同的聚合物材料形状连接在一起,以形成复合材料形状。所述复合物的形状可以是层状结构。例如,聚合物模型或支架可以连接到一个或多个聚合物模型上,以形成多层的聚合物模型或支架结构。该附件也可以通过液体聚合物胶合或缝合进行。此外,可以通过激光或其它标准加工技术使该聚合物模型或支架形成固体块和形状,达到其所需的最终形式。激光整形是指使用激光除去材料的工序。在一个优选实施方案中,由非编织聚乙醇酸(PGA)毛毡和聚(乳酸-共-乙醇酸)聚合物(PLGA)形成支架。在Bertram等,美国出版申请号20070276507(其全部内容通过引用纳入本文)中所述,本发明的所述聚合物模型或支架材料可以被形成任何数目的所需构型,以满足整体系统,几何或空间限制的任何数量。该模型可以为三维模型形状,以符合层状组织管腔器官或组织构造的尺寸和形状。例如,所述聚合物用于膀胱重建模型,可以使用适合的三维模型以符合膀胱的全部或部分的尺寸和形状。当然,所述聚合物模型可以为不同大小和形状,适合于符合患者的不同尺寸的膀胱。任选地,所述聚合物模型应是合适的,在其生物降解后,所述所得的重建膀胱为可折叠的,其排空的方式类似于自然膀胱。所述聚合物模型也可以形成其它方式,以适应所述患者的特殊需要。例如,先前受伤或残疾的患者,可能具有不同的腹腔,并可能需要膀胱替换支架、膀胱扩大支架、膀胱导管支架、和逼尿肌等价支架适于装配。在一方面中,本发明考虑适合用于本文所述的平滑肌细胞群体的额外支架。例如,提供适合用于植入到眼睛的支架。A.扩增或替换支架在另一方面中,所述聚合物模型或支架被形成以符合膀胱的部分。在一个实施方案中,所述成型的模型符合替代至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或至少约95%的接受者现有膀胱。在另一方面中,所述聚合物模型或支架被形成以符合100%的或全部的膀胱。在一个实施方案中,所述聚合物模型包括第一植入的、生物相容的、合成的或天然的聚合物模型或支架(其具有至少两个单独的表面),以及第二植入的、生物相容的、合成的或天然的聚合物模型或支架(其具有至少两个独立的表面);它们适于相互匹配,并且当匹配时被形成以符合需要治疗的管腔器官或组织构造的至少部分。所述第一和第二聚合物模型,可以由一个整体单元细分成两个或更多个不同的部分形成,或由两个或多个不同的部分形成,适于匹配。在一些实施方案中,所述第一和第二聚合物模型一旦匹配,可用于管腔器官或组织构造的重建、扩大,或替换。在一些实施方案中,所述第一和第二聚合物模型都是对称的,而在其它实施方案中,所述第一和第二聚合物模型是不对称的。在一个实施方案中,所述第一聚合物模型或支架具有半球形或准半球形的形状(具有一个封闭的、半球形的端口和开放的赤道边界),并且所述第二聚合物模型或支架为圈形,适于与所述第一聚合物模型的赤道边界相匹配。在另一实施方案中,所述第一和第二聚合物模型分别为半球形或准半球形的形状(具有封闭的、半球形的端口和开放的赤道边界)。在又一实施方案中,每一个所述第一和第二聚合物模型包括圆形或半圆形的底座,并有至少2个花瓣沿径向每个底座延伸。在这个实施方案中,所述第一和第二聚合物模型的所述底座和花瓣形状部分适合于匹配,以建立中空的球形或准球形模型或支架,如此使得在匹配的聚合物模型的一侧创建带凸缘的纵向、椭圆形的开口,以及在所述纵向开口的相反一侧上创建圆形的开口。在另一实施方案中,所述第一和第二聚合物模型由3个部分组成,包括顶部、正面和侧部,适于匹配。在本实施方案中,至少使用3个,最好是四个垂直的接缝来匹配所述3个不同的部分,从而形成冠形的新膀胱结构。所述冠形结构优选作为装置单独使用,用于管腔器官的重建、扩大,或替换。在一个实施方案中,所述结构为指膀胱扩大支架。一个膀胱增大支架的实施例见图1A-D所示。在另一实施方案中,所述结构为膀胱替换支架。一个膀胱替换支架的实施例见图2A-D所示。此外,所述第一聚合物模型,所述第二聚合物模型,或两者,可含有至少一个容器或端口,以适于接收管状容器或插入物(其中所述结构连接到天然容器或管道是必要的)。所述容器或插入为其本身,例如,圆柱形或管状聚合物模型,每一个具有至少一个位于圆筒形聚合物第一端的凸缘。所述容器或插入物,优选地,包括所述相同的生物相容性材料作为第一或第二聚合物模型。在一些实施方案中,所述容器或插入物还包含垫圈,以适于适应周围的所述圆筒状或管状容器或插入聚合物模型。例如,所述垫圈为水凝胶。所述圆筒状或管状容器或插入物可以任选地包含垫圈。所述垫圈可能为水凝胶。此外,所述圆筒状或管状插入物可以自稳定。在另一实施方案中,所述容器或端口适于接收管状容器或插入物,其中所述支架或模型(一旦接种细胞)与天然容器或管道的连接是必要的,也适用于其它以下讨论的所述模型。在一方面中,所述支架为器官或组织构造替换支架,其包括至少两个模型。在一个实施方案中,所述支架包括的具有第一表面的第一模型,以及具有第一表面的第二模型。所述第一模型和所述第二模型可以被配置或适于匹配。在另一实施方案中,所述第一模型和所述第二模型匹配时可适合于符合管腔器官的至少部分。所述第一和第二模型可包括生物相容性材料。所述生物相容材料可包括可生物降解的材料。在一个实施方案中,所述第一模型可具有半球形状,封闭端和开放的赤道边界,及所述第二模型可具有圈形的,其被配置或适于与所述第一模型的赤道边界匹配。所述封闭端可能会呈拱形。在另一实施方案中,每一个所述第一模型和所述第二模型可具有半球形状,具有封闭端和开放的赤道边界。所述封闭端可能会呈拱形。在又一实施方案中,所述第一模型可进一步包括沿所述第一模型的至少一个边界的带凸缘的区域。所述第二模型可进一步包括沿所述第二模型的至少一个边界的带凸缘的区域,并且其中所述第二模型的所述凸缘区域适于与所述第一模型的所述凸缘区域匹配。在一个实施方案中,所述支架包括第一、生物相容的模型和第二、生物相容的模型,其中所述第一和第二模型均可以包括底座,并可以被配置或适于匹配。在一个实施方案中,所述第一和第二的模型匹配时可被形成以符合管腔器官的至少部分。在另一实施方案中,所述第一和第二模型可进一步包括至少两个从每个底座径向延伸的花瓣。在另外一个实施方案中,每个所述第一和第二模型可最初源自一包括一底座和至少四个花瓣的模板。在一个配置中,一对相对的花瓣的长度可能比其它花瓣更短。在另一实施方案中,所述第一和第二模型可以是两个不同的单元,适于匹配。在一个实施方案中,所述第一和第二模型底座适于配合。在一些实施方案中,所述第一和第二模型通过所述第一和第二模型的花瓣形状部分相匹配。在其它实施方案中,所述第一和第二模型可以被配置或适于形成中空的球形或准球形形状(在所述第一和第二模型之间的第一匹配点具有纵向开口,以及在所述第一和第二模型之间的第二匹配点具有圆形开口(其相对于纵向开口相反)。所述支架结构可进一步包括至少一个翼片,其纳入所述第一或第二模型的底座。在另一实施方案中,所述纵向开口具有一凸缘和至少一个翼片被设置在纵向开口的唇上。另一方面,所述模型或模型能够连接到天然容器。在一个实施方案中,所述第一个模型、所述第二模型、或两者,每个被配置或适于接收天然容器。在另一实施方案中,所述第一模型、所述第二模型、或两者,进一步包括至少一个插座。所述至少一个插座可以被配置或适于接收管状插入物。所述管状插入物可以被布置在插座之内。在一些实施方案中,所述管状插入物具有端。所述插入物可具有位于此端中的至少一个凸缘。在另一实施方案中,所述管状插入物可配置或适于连接到天然容器。在进一步的实施方案中,所述支架围绕所述管状插入物具有表面和垫圈。所述垫圈可配置的或适于在所述结构的所述凸缘和所述表面之间形成不漏水的密封。在一些实施方案中,所述垫圈包括水凝胶。图1和图2提供了支架配置代表性的描述,其包括至少两个模型。在一方面中,所述支架为器官或组织构造扩大支架,包括一个或多个模型。在一个实施方案中,所述支架包括第一模型,其具有底座和多个凹口,其中所述第一模型适于形成半形状,在组装时以符合管腔器官的至少一部分。在另一实施方案中,所述支架包括第二个和第三模型,其中所述第一、第二和第三模型可被配置或适于匹配,并在匹配时形成以符合管腔器官的至少一部分。所述第一、第二和第三聚合物模型可源自一模板,包括三个细分的部分。在另一实施方案中,第一、第二和第三的模型来自三个不同的模板,并可能被配置或适应配合。在另外一个实施例中,所述第一、第二、和/或第三个模型包括生物相容性材料。所述生物相容性材料可包括可生物降解的材料。在另一方面,所述支架由具有不同形状或配置的部分组成。在一个实施方案中,所述支架可以包括第一、第二和第三聚合物模型,其分别对应顶部部分、正面部分和侧面部分,使得当一起匹配时形成头冠形状。在另一实施方案中,所述正面部分和所述侧面部分可以每个包括第一边缘和第二边缘。所述正面部分的第一边缘可以连接到所述侧面部分的所述第一边缘。所述正面部分的所述第二边缘可以连接到所述侧面部分的所述第二边缘。在一个其它实施方案中,所述第一边缘可以由缝合线连接和/或所述第二边缘可以由缝合线连接。在其它实施方案中,所述正面边缘可以包括具有第一边缘和第二边缘的凹口。所述第一和第二边缘可以被连接,例如通过缝合线。在另一实施方案中,所述顶部部分可以具有第一边缘,所述侧面部分可以具有第三边缘,所述正面部分可以具有第三边缘。所述顶部部分的所述第一边缘可以连接到所述侧面部分的第三边缘,和/或所述顶部部分的第一边缘可以连接到所述正面部分的所述第三边缘。所述第一和第三边缘可以通过缝合线连接。在另一实施方案中,每个凹口可以具有第一边缘和第二边缘。这些边缘可以连接,例如通过缝合线连接。在其它实施方案中,所述侧面部分可以包括至少一个翼片。在所有的实施方案中,在支架中每个单独的模型或者所有的模型可以包括生物可降解材料。所述材料可以选自:聚乙醇酸、聚乳酸、以及乙酸醇和乳酸的共聚物。在其它实施方案中,所述模型或者模具包括聚乙醇酸、以及乙酸醇和乳酸的共聚物。在一个实施方案中,所述管腔器官是管道形的或者中空的器官。所述器官可以是泌尿生殖器官。在另一实施方案中,所述泌尿生殖器官选自:膀胱、输尿管和尿道。在一个其它实施方案中,所述泌尿生殖器官是膀胱或者膀胱区段。在某些实施方案中,所述使用的支架被配置或者适合于体内形成再生膀胱组织,其具有天然膀胱组织的相容性。在一个实施方案中,所述匹配的模型和沉积的细胞形成可植入式的结构。在另一实施方案中,所述至少第一细胞群体包括本文描述的肌肉细胞群体。所述肌肉群体可以是平滑肌细胞群体。在另一实施方案中,所述支架可以具有至少第一细胞群体,其沉积在所述模型的第一表面上或其中,所述第二模型的第一表面上或其中,或两者上或其中。在一个其他实施方案中,所述支架可以进一步包括第二细胞群体,其沉积在所述第一模型的第二表面上或其中,第二模型的第二表面上或其中,或两者上或其中。所述第二细胞群体包括尿道上皮细胞。本文所述的扩大和替换支架,以及制作方法和相同的使用,参见在Bertram等,美国公开专利申请号20070276507(其全部内容通过引用方式纳入本文)进一步描述。B.泌尿导管支架本发明提供了新的尿流改道或导管支架,其可以接种细胞,并用作为受试者所述尿流改道结构中胃肠道组织的替换。例如,遭受回肠循环分流的患者经根治性膀胱切除术治疗后,可应用本文所述的新尿流改道。在一方面中,本发明考虑的导管支架或模型适用于作为有需要的受试者的尿流改道,从本文所述的方法形成。所述导管支架的一端可被连接到一个或多个输尿管,而且其另一端可被连接到所述受试者的身体外部的储尿器。在一个实施方案中,所述导管可通过造口退出受试者的身体。在另一实施方案中,该聚合物模型包括第一植入的、生物相容的合成聚合物模型或提供的管状形式支架。在一些实施方案中,所述管状支架包括第一端配置以连接到所述受试者的输尿管。在另一实施方案中,所述第一支架进一步包括第二端配置以在所述受试者中形成造口或括约肌。在另一实施方案中,所述第一支架进一步包括至少一个侧部开口配置以连接到的至少一个输尿管。在一些实施方案中,所述第一支架包括第一侧开口配置以连接到第一输尿管和第二侧开口(被配置为连接到第二输尿管)。在一方面中,所述支架被设计为弹性的,以附着到所述受试者的一个或两个输尿管。在一个实施方案中,所述支架可以具有一个或多个开口用于在所述管状结构的一侧连接输尿管。在另一实施方案中,所述支架可在管状结构的一端具有开口用于连接输尿管。连接输尿管到所述结构的一端而不是一侧,如果在所述北连接的输尿管端部和所述支架端部之间的距离小于所述输尿管端部和所述支架侧面之间的距离,可使在所述输尿管上存较小的应变。一般情况下,所述支架、或其部分,被配置以连接所述受试者身体部分,例如:输尿管、腹壁,皮肤等,而且这样的配置结构包括但不限于,所述管状模型开放的或封闭的端部,配置缝合的端部或侧开口(或以其它方式连接到受试者的输尿管、腹壁、皮肤等)。那些在本
技术领域:
的普通技术人员将会理解,不同的配置将取决于所述接受者所述腹腔的特定尺寸。在一方面中,所述管状导管支架包括所述管道的一个端部,其作为尿液的流出端,所述来自一个或两个输尿管的尿液经过所述管状支架,最终所述接收者流出。在一个实施方案中,所述支架的流出端被配置,在所述接收者的腹腔壁结束。图12(平板A)解释了所述支架的示例性形态。在另一实施方案中,所述支架的流出端被配置经过所述腹壁(即经腹的)延伸,并且直接与所述皮肤造口(即经皮肤的)的皮下层连接。图12(平板B)解释了所述支架的示例性形态。在一个其他实施方案中,所述管状结构包括第一端(所述第一端包括平坦边缘),以及第二端(所述第二端包括不均匀或不平坦的边缘)。所述不均匀的边缘可以包括圆形底座和大量花瓣(从所述底座径向延伸)。所述花瓣的数量可以是1、2、3、4、5或6。所述不平坦边缘可以包括一系列的花瓣,例如在图3A中所示的。在一个实施方案中,所述管状结构可以具有适合于在有需要的患者中的尿流改道系统或者导管使用的形式。在另一实施方案中,所述系统将尿液(来自一个或两个输尿管)转移至腹壁部分,例如在膀胱造口术的情况下。在其它实施方案中,所述系统将膀胱连接至所述尿道。在又一实施方案中,第一系统可以将来自一个或多个输尿管的尿液转移到腹壁部分,并且第二系统可以将来自膀胱的尿液转移至腹壁部分。在所有实施方案中,所述系统可以将来自一个或多个输尿管的尿液转移至腹壁部分,例如形成造口。在另一实施方案中,所述管状模型或者支架是尿流改道或者导管支架。在一个实施方案中,所述尿流改道系统的管状构造是矩形的、圆形的或者三角形横截面面积。图3B解释了本文考虑的一些不同横截面的形态。在另一实施方案中,管状构造保留足够的刚性以在植入后维持开放。在一个其他实施方案中,所述管状构造的刚性被保留,使用或不使用在所述管腔中的导管。当使用导管时,它可以放置在所述管状构造的腔内空间中以提供附加的开放性。在一个其它实施方案中,所述导管支架可以进一步包括第二支架,其以圆形或卵圆形的连接器形式,所述连接器配置以将所述第一支架的所述第一端连接到输尿管。在又一实施方案中,所述导管支架可以进一步包括第三支架(其以垫圈环的形式配置以形成造口或括约肌),和所述第一管状支架的第二端在受试者中创建造口。图3C解释了多种尿流改道结构(A:开放的要求卵形;B:开放的要求卵形容器,C:封闭的卵形容器和三管)。在一些实施方案中,所述管状构造可以进一步包括垫圈构造(其连接到组织、器官或者身体部分),以实现在创建节制的造口或括约肌时吻合。在另一实施方案中,所述垫圈具有的厚度约小于1mm、约小于1.5mm、约小于2mm、约小于2.5mm、约小于3mm、约小于3.5mm、约小于4mm、约小于4.5mm、或者约小于5mm。在一个实施方案中,所述尿流改道或导管支架被形成的形态示于图3A中。在一个其他实施方案中,所述管状构造包括第一端(包括平坦边缘)和第二端(包括不均匀或不平坦边缘)。所述不均匀边缘可以包括一个或多个固定件,其被配置以连接到所述受试者的外部区域,例如在所述受试者外部形成造口。在一个实施方案中,所述管状构造的所述第一和第二端的形式可以在图3A中解释。所述固定件的数量可以是1、2、3、4、5或6。图4A描绘了人类泌尿系统的正常解剖的部分。在一个实施方案中,所述管状构造具有的形式适合在有需要的患者中作为尿流改道或者导管使用。在另一实施方案中,所述导管将来自一个或多个输尿管的尿液转移到腹壁部分,例如,在输尿管造口术的情况下(图4B,4D)。在其它实施方案中,所述导管将来自所述膀胱的尿液转移至腹壁部分,例如在膀胱造口术的情况下(图4C)。在又一其它实施方案中,所述导管将所述膀胱连接到所述尿道(图4D)。在又一实施方案中,第一导管可以将来自一个或多个输尿管的尿液转移至腹壁部分,第二导管将来自膀胱的尿液转移至腹壁部分。在所有实施方案中,所述导管将来自一个或多个输尿管的尿液转移至腹壁部分(图4B)。在所有实施方案中,所述导管可以被配置以形成造口。在一个实施方案中,所述尿流改道或者导管支架的管状构造的横截面是矩形的、圆形的、或者三角形的。在另一实施方案中,所述管状构造保持足够的刚性,以在植入后保持开放。在一个其他实施方案中,所述管状构造的刚性被保留,使用或者不使用在管腔中的导管。在某些实施方案中,尿流改道支架进一步包括导管,所述导管被配置以放置在植入后管状构造的管腔空间。在一个实施方案中,所述导管是Foley-like气囊式导管。当使用导管时,它可以放置在管状构造的管腔空间中,以提供附加的开放性。这些本领域普通技术人员可以理解,其它适合在本发明中使用的现有技术中已知的导管。在另一实施方案中,所述支架管道壁的厚度小于约2mm、小于约2.5mm、小于约3.5mm、小于约4mm、小于约4.5mm、小于约5mm、小于约5.5mm、或者小于约6mm。在一些实施方案中,所述支架可以具有变化的外部和内部直径。在一个实施方案中,所述支架的端部可以是扩口的、非-扩口的、密封的或者圆形的。在其它实施方案中,所述支架是可以渗透尿液的。在一个实施方案中,所述支架的孔尺寸大约大于约0微米至约500微米。在另一实施方案中,所述孔尺寸从约100微米至约200微米。在另一实施方案中,所述孔尺寸从约150微米至约200微米。在其它实施方案中,所述孔尺寸约100微米、约110微米、约120微米、约130微米、约140微米、约150微米、约160微米、约170微米、约180微米、约190微米、或者约200微米。在一些实施方案中,所述孔尺寸约100微米、约200微米、约300微米、约400微米、约500微米、或者约600微米。在其它实施方案中,所述支架包括孔结构,其实单一的孔尺寸分布,多种孔尺寸分布,或者孔梯度分布。在另一实施方案中,所述支架材料是可缝合的,并且可以和组织形成抗泄漏的连接。在其它实施方案中,选择所述管状支架材料,以维持在整个植入使用期间的开放性,支持细胞连接和宿主组织的生长,和保持弹性。在另一实施方案中,所述材料具有胀破强度,超过对胀破强度的所述压力时,它将会暴露在正常的体内液体循环中。在其它实施方案中,所述材料具有的降解时间与宿主组织生长时间相称。C.肌肉等价支架在一方面中本发明的所述聚合物模型或支架是肌肉等价支架。在一个实施方案中,所述肌肉等价支架是逼尿肌肌肉等价支架。在另一实施方案中,所述支架适合于腹腔镜植入。在一方面中,所述聚合物模型包括聚合物模型或支架,其被形成以符合在需要所述治疗的所述器官或组织构造的至少部分,以及充分的尺寸以用于腹腔植入。在某些实施方案中,本发明所述聚合物模型或者支架的长度在约3和约20cm之间。在一个实施方案中,所述聚合物模型或支架的最大长度是约20cm。在另一实施方案中,所述聚合物模型或支架最大长度约15cm。在另一实施方案中,所述聚合物模型或支架最大长度约10cm。在另一实施方案中。所述聚合物模型或支架最大长度约8cm。在另一实施方案中,所述聚合物模型或支架最大长度约4cm。在又一实施方案中,所述聚合物模型或支架最大长度约3cm。在某些实施方案中,本发明所述聚合物模型或支架的宽度在约1和约8cm之间。在一些实施方案中,所述聚合物模型或支架最大宽度约4cm。在其它实施方案中,所述聚合物模型或支架最大宽度约3cm。在又其它的实施方案中,所述聚合物模型或支架最大宽度约5cm。在一个实施方案中,所述聚合物模型或支架具有三维(3-D)形状。在另一实施方案中,所述聚合物模型或支架具有平面形状。在一个实施方案中,所述平面形状的聚合物模型或支架包括预处理区域,以允许更多弹性。在某些实施方案中,所述预处理区域涂覆在具有折缝的区域中。在一个实施方案中,所述聚合物模型或支架具有充分的延展性,以被卷起的、被折叠的或者相反的适合于通过腹腔镜管道和/或端口植入的形状。在这种实施方案中,所述聚合物模型或支架具有充分的延展性,以非卷起的、非折叠的或者相反的恢复到在通过腹腔镜管道和/或端口插入后的形状。在一个实施方案中,所述聚合物模型或支架在通过腹腔镜管道和/或端口植入之前,被切成2、3、4、5、6、7、8、9或10个条带。在某些实施方案中,在通过腹腔镜管道和/或端口植入之前,所述2、3、4、5、6、7、8、9或10个条带是匹配的。所述2、3、4、5、6、7、8、9或10个条带可以是(使用粘着剂、钉书钉、缝合线或其它本领域技术人员已知的技术)匹配的。在这种实施方案中,所述2、3、4、5、6、7、8、9或10个匹配的条带是折叠的和/或堆叠的,以穿过腹腔镜导管和/或端口。在这种实施方案中,所述2、3、4、5、6、7、8、9或10个条带(在通过腹腔镜导管和/或端口插入后)是非折叠的和/或者非堆叠的。在一些实施方案中,所述预先放置的匹配的意思是(在通过腹腔镜导管和/或端口插入后)适当紧密的。在一个实施方案中,所述聚合物模型包括第一可植入的、生物相容的、合成的或天然的聚合物模型或者支架,其具有补丁的形式或者条带的形式。在一个实施方案中,所述补丁具有合适的形式,适合作为逼尿肌肌肉等价物在有需要的患者膀胱中使用。在一个其他实施方案中,所述补丁具有合适的形式,适合于增加有需要的患者的现有膀胱的体积容量。在某些实施方案中,所述补丁增加所述膀胱的尺寸,在约50mL和约500mL之间。在一些实施方案中,所述补丁将增加膀胱尺寸,增加量约50mL。在一些实施方案中,所述补丁使所述膀胱尺寸增加约50mL。在一个实施方案中,表面积增加30cm2,使200ml的膀胱的容积增加至250ml。在另一实施方案中,表面积增加25cm2,使350ml的膀胱的容积增加至400ml。在一个实施方案中,所述支架具有约30cm2的二维表面积。在另一实施方案中,所述支架具有约25cm2的二维表面积。在一个实施方案中,所述补丁是条带的、盘状的、方形的、椭球形的或者其它合适的形态。在其它实施方案中,所述补丁具有预折叠的形式,例如像手风琴。图5A-B示出了肌肉等价支架或者聚合物模型的例子。在一个实施方案中,所述聚合物模型或支架是双楔形状,例如,在图5A所示的形状。在另一实施方案中,所述聚合物模型成形为图6-9中所示的形态之一。在所有实施方案中,所述聚合物模型或支架被成形以使对所述膀胱和模型或支架的应力最小。在另一实施方案中,所述聚合物模型包括第一可植入的、生物相容的、合成的或者天然聚合物模型或支架(具有补丁的形式或条带的形式)。在一个实施方案中,所述补丁具有合适的形式,以作为逼尿肌肌肉等价物在有需要的患者的膀胱中使用。在一个其它实施方案中,所述补丁具有合适的形式,以增加有需要患者的所述现有膀胱的容积容量。在一些实施方案中,所述补丁将增加膀胱尺寸,增量50ml。在一个实施方案中,所述补丁的形式是条带、盘状的、方形的、椭球形的或者其它合适的形态。在其它实施方案中,所述补丁具有预折叠的形式,例如像手风琴。在一个实施方案中,所述聚合物模型被成型,以符合至少部分的所述泌尿系统的管腔器官或者组织构造,例如在图1-9中显示的形态之一。在所有实施方案中,用于这些模型或者支架的所述生物相容性材料,例如是生物可降解性的。在所有实施方案中,所述生物相容性材料可以是聚乙醇酸。在所有实施方案中,所述聚合物模型或支架被涂覆有生物相容的和生物可降解性的形状可设置材料。在一个实施方案中,所述形状可设置材料可以包括液态共聚物。在另一实施方案中,所述液态共聚物可以包括液化的丙交酯/乙交酯共聚物。在一个实施方案中,所述液态共聚物可以包括聚-丙交酯-共-乙交酯。所述液态共聚物可以包括聚-D-丙交酯-共-乙交酯、聚-L-丙交酯-共-乙交酯、或者聚-DL-丙交酯-共-乙交酯。D.肠道组织支架本发明提供的支架适合形成胃肠道组织结构,例如,食管组织或肠支架。在一方面中,本发明的所述聚合物模型或支架适合用于在所述部分胃肠道、或其上或其内部植入。在一方面中,所述聚合物模型包括聚合物模型或支架,被形成以符合至少部分的有需要治疗的所述胃肠(GI)道。合适的所述GI部分,包括但不限于,食管、小肠、大肠、胃、结肠、或肛门括约肌组织。在一个优选的实施方案中,所述GI支架由非编织的polygycolicacid(PGA)/聚(乳酸-共-乙醇酸)(PLGA)聚合物、VICRYLTM编织网、和编织PGA形成。在一个优选的实施方案中,所述PLGA/PGA聚合物支架为规则的(例如,3毫米厚)的或薄的(例如,0.5毫米厚)。在一个实施方案中,所述GI聚合物模型包括第一植入的、生物相容的、合成的或天然的聚合物模型或支架,其具有补丁的形式、或条带的形式。在一个实施方案中,所述补丁具有适合用作GI组织支架的形式,用于有需要的患者的GI组织中。在另外一个实施方案中,所述补丁具有的形式适合用于在有需要的患者中现有的GI组织的再生、替换、扩大,或重建。在一个实施方案中,所述补丁的形式为条带、盘状的、方形的、椭球形,或任何其它适当的形态。在其它实施方案中,所述补丁具有预先折叠的形式,例如,类似于手风琴。在所有的实施方案中,用于GI模型或支架的所述生物相容性材料,例如,可生物降解的。在所有的实施方案中,所述生物相容性材料可以是聚乙醇酸。在一些实施方案中,所述聚合物GI模型或支架涂有生物相容性的和生物可降解性的形状可设置材料,如本文所述。本发明考虑将表面褶皱/波纹的静电管状复合材料应用于GI组织或器官的再生、重建、扩大或替换。所述复合材料可能为静电,其模仿GI组织的外形。其中所述GI组织天然为管腔的,所述外形可模仿所述管腔表面或所述外部,非管腔表面。管状复合材料的外表面最初为褶皱静电,其可能适合用作为GI组织支架。如果所述复合材料由内而外反转,这提供了用于内部或管腔侧上褶皱的放置。这种定向模仿了所述小肠管腔绒毛特性的组织结构。提供单一的管状复合材料,其外形特征再现了GI组织(例如,食管或小肠),这提供了策略,以促进在本文所述的所述GI结构在GL相关疾病的应用。所述GI代表同心组织的管状复合材料,其具有组织学亚结构和根据空间位置而变化的外形特征的。用于再生所述GI组件的组织工程方法一般集中于使用材料(如SIS,硅树脂,或聚偏氟乙烯)替换或扩大,所述材料通常没有接种SMC、上皮细胞、或其它细胞类型。这种方法的成功具有有限性或多变性,如再生的同心组织的肌肉组织和上皮层所测量的(Jwo等2008,Brit.J.Surgery95:657-663;JansenPL等,2004,EurSurgRes36:104-111;UenoT等,2007,JGastrointestSurg11:918-922;HoeppnerJ等,2009,JGastrointestSurg13:113-119;KaiharaSetal,,2000,69(9):1927-1932;NakaseY等,2008supra;TakimotoY等,1993,ASAIOJ39:M736-739;LopesMF等,2006,DisEsophagus19:254-259;Gonzalez-SaezLA等,2003,EurSurgRes35:372-376;AnsaloniL等,2006,Trans.Proc38:1844-1848;PekmezciS等,1997,TurkJMedRes15;SaxenaAK等,2009,JPedSurg44:896-901;GreikscheitTC等,2004,AnnSurg240)。与此相反,本发明设想利用的平滑肌细胞接种生物材料为基础的平台的所述胃肠道的再生途径,已证明在所述膀胱和膀胱衍生物(JayoMJ等,2008:RegenMed3:671-682)的再生是成功的。静电纺丝为使用带电的聚合物溶液(RamakrishnaS,等,2005:Anintroductiontoelectrospinningandnanofibers.WorldScientificPublishingCo.)射流制作生物材料的工艺。众多可生物降解的和非生物降解聚合物可能为静电纺丝进入管状复合材料,所述管状复合材料适合应用于管状器官系统(包括胃肠道,例如,食管、小肠、结肠,或肛门括约肌的组件)再生。这种聚合物的例子包括但不限于,PGA,PLCL和聚氨酯。已经熟知这样的材料可支持细胞的迁移和增殖(RamakrishnaS,等,2005supra)。基于迭代静电纺丝协议(见Rapoport等,美国专利申请公开号:20090227026,其全部内容通过引用并入本文),已经开发了策略用于某些器官系统局部特征的重组。简而言之,二进制静电纺丝方法可用于:第一轮的静电纺丝用于创建管道,所述管道围绕限定直径的芯轴。然后通过插入多个额外的芯轴强行扩大这种管状结构,以提高其工作直径数倍。然后以所述扩展的管状结构为模板进行第二轮的静电纺丝。从所述管状复合材料的管腔去除所有芯轴,然后导致所述管状结构复归到其原始直径。因此,来自所述第二层的过量的静电材料被折叠成一系列从所述外部,所述管状复合材料非管腔表面突出的褶边或波纹。这样的管状构造可能适合于在例如所述食管或小肠再生中的应用,如图10A-C中所示。管状结构的倒置重新定位了所述表面褶皱朝向所述内部的、管腔表面的,以创建管腔局部,概述了所述小肠的所述管腔表面的绒毛特性。在这种方式下,单一的静电管状复合物可以具有食管或小肠再生的双重应用,基于是否其局部特征面向管腔或外部表面。可能由内向外翻转所述具有外部褶皱的管道,以创建类似于小肠绒毛的管腔表面波纹。因此,单一的管状复合物与表面褶皱可能至少被应用朝向于食管(外部表面上的褶皱,如在图10C中示出)或小肠(内部、管腔的表面上的褶皱,如在图10B中示出的)的再生。E.呼吸组织支架本发明提供的支架适合于形成呼吸组织结构,例如,肺组织支架。在一方面中,本发明的所述聚合物模型或支架适合植入在肺的部分上或其内部。在一方面中,所述聚合物模型包括聚合物模型或支架,其被形成以符合至少部分的需要治疗的天然呼吸组织。合适的天然呼吸组织包括但不限于,肺、肺泡组织、和细支气管组织。在所有实施方案中,所述呼吸组织支架是可植入的,例如,植入到肺部中。在所有的实施方案中,所述支架是可生物降解的。在所有实施方案中,所述支架具有生物相容性。所述支架适合接种第一细胞群体和/或第二细胞群体。在所有的实施方案中,所述第一细胞群体为源自脂肪的平滑肌细胞群体。在所有的实施方案中,所述第二细胞群体为源自呼吸道的细胞群体。在所有的实施方案中,所述第二细胞群体源自肺。在所有实施方案中,所述结构为呼吸组织构造。在所有的实施方案中,所述结构对至少一个平滑肌细胞标记物为阳性。在所有的实施方案中,所述结构对至少一个呼吸组织标记物为阳性。在所有的实施方案中,所述呼吸组织标记物为下列中的一个或多个:细支气管标记、肺泡标记、和上皮标记。在所有的实施方案中,所述结构包括一个或多个肺泡形成单元(AFU)。在所有实施方案中,所述结构包括具有协调节奏的收缩功能的细胞。在所有的实施方案中,在植入后,所述结构适于形成呼吸组织。在所有的实施方案中,所述呼吸组织为肺组织。在所有的实施方案中,所述肺组织包括肺泡组织和/或细支气管组织。F.血管支架如Rapoport等,美国公开申请号20090227026(其全部内容通过引用的方式并入本文)所述,天然血管具有的多层层状构造和特定的结构特征(起伏,褶皱,扭结),促进了在不同应力的不同程度上机械接合的的胶原蛋白和弹性纤维层的平行排列。典型观察天然动脉在弹性层中为褶皱,但周围的胶原蛋白层中没有褶皱。此一般构建的例外记录为在长须鲸中记录的独特结构,其中在胶原组分中存在新的结缔组织设计,其恰好为拉伸元素,具有很高的褶皱(Gosline&Shadwick(1998)AmericanScientist86:535-541))。如Rapoport等所述,组织工程支架和方法同样可以采取通常见于天然动脉的逆向方法,即所述支架的所述拉伸层具有褶皱,但不是所述弹性层。这种方法是有利的,因为相比在弹性层中以赋予它们的而言,其更容易在拉伸层内赋予褶皱。适用于本发明中的血管支架可具有多层状的或层叠的结构。在一个实施方案中,所述支架包括(a)第一管状元件,其包含弹性元件,外表面和内部管腔表面;和(b)第二管状元件,其包含拉伸元件,与所述第一管状元件外表面连接的外表面和内部管腔表面。在另一实施方案中,所述第二管状元件是褶皱的。存在于本文描述的所述组织工程支架的所述褶皱在Rapoport等.美国公布的申请号20090227026中示例,显示了其在所述支架所述外表面上的外观。在其它实施方案中,所述褶皱的第二管状元件具有纤维网,其中所述纤维方向为朝向圆周方向。可以在所述第一和第二管状元件上添加额外的管状元件。所述第一管状元件的所述管腔表面和所述第二管状元件的所述外表面都可以进行进一步的操作,如,例如,形成组织工程的血管(TEBV)。如本文所述,本发明的所述血管支架可用于通过将一种或多种细胞群体纳入支架制作TEBV。所述支架所述的层状结构提供了更天然的容器形态,其可能有助于所述预期细胞群体分区,如平滑肌细胞、血管内皮细胞和成纤维细胞等。本文所述支架的所述弹性元件赋予的支架有应对大规模的变形应力的能力,所述变形是完全可回收和可重复的。所述弹性体元件具有的弹性组分,可能为天然组分、人工合成的组分、一种以上的天然组分的混合物、一种以上的合成组分的混合物,天然的和合成组分的混合物,或其任意组合。在一般情况下,有机或天然组分为蛋白质,通常存在于天然组织构造中,或可源自天然组织构造,或可以重组产生或基于已知的编码所述蛋白质和/或其氨基酸序列的核酸序列来合成。例如,弹性蛋白天然存在于动脉并可作为自然组分用于本发明的所述血管支架。天然组分可以是血管支架和/或TEBV的一部分,如本文所述,还包括或不包括的合成组分。在一些实施方案中,所述第一管状元件的所述弹性元件包括有机或天然组分,例如弹性蛋白,包括但不限于弹性蛋白、面筋、麦醇溶蛋白、abductin、蛛丝,和节肢弹性蛋白或预节肢弹性蛋白(Elvin等,(2005)自然.Oct12:437(7061):999-1002)。那些在本领域的普通技术人员将会理解其它天然弹性蛋白质,其可适合用于在本发明的所述支架。当所述完整的血液支架被诉诸于进一步操作,为了构建组织工程血管的目的,使用天然材料具有优势。例如,当特定的细胞群体被培养,在或者接种在所述支架上,存在于所述支架中的所述天然弹性蛋白,促进了适当的细胞与所述支架相互作用。在其它实施方案中,所述弹性元件包括合成组分。合成弹性元件的例子包括但不限于:乳胶、聚氨基甲酸乙酯(PU)、聚已酸内酯(PCL)、聚-L-丙交酯酸(PLLA)、polydiaxanone(PDO)、聚(L-丙交酯-共-己内酮)(PLCL)和聚(etherurethaneurea)(PEUU)。在一个实施方案中,本发明考虑了第一管状元件,其中所述弹性元件包括天然弹性组份和合成弹性组分。本发明所述支架的拉伸元件赋予了所述支架刚性或可拉伸性,以允许所述支架在应对应力时能抗延伸。所述拉伸元件具有的拉伸组分,可以是天然组分、合成组分、一种以上天然组分的混合物、一种以上合成组分的混合物、天然和合成组分的混合物、或其任意组合。在另一实施方案中,所述第二管状元件的拉伸元件包括有机或天然组分,例如纤维状蛋白质,包括但不限于:胶原、纤维素、丝和角蛋白。本领域普通技术人员可以理解到其它的适合于本发明支架中使用的天然纤维状蛋白质。在其它实施方案中,所述拉伸元件是合成组分。合成拉伸组分的例子,包括但不限于:尼龙、(聚对苯二甲酸乙二酯(PET))(聚四氟乙烯)、聚酯、聚乙醇酸(PGA)、聚乳酸-共-乙醇酸(PLGA)和poly(etherurethaneurea)(PEUU)。在一个实施方案中,本发明考虑了第二管状元件,其中所述拉伸元件包括天然拉伸组分和合成拉伸组分所述支架的弹性和拉伸元件可以含有天然和合成组分的不同组合。例如,支架可以含有天然弹性组份和/或天然拉伸组分、以及合成弹性组分和/或合成拉伸组分。在本发明一方面中,所述TE支架不限于在第一管状元件上具有第二管状元件的两层结构,如上文所述的。在一些实施方案中,所述支架包括额外的管状元件,例如在第二管状元件上的第三管状元件,在第三管状元件上的第四管状元件,在第四管状元件上的第五管状元件等等。另外,如本文所描述的,所述额外的管状元件可以含有弹性元件(例如天然的和/或合成的)或拉伸元件(例如天然的和/或合成的)。所述额外的管状元件可以通过本文所描述的技术结合。在一方面中,在所述弹性元件含有的弹性组分和在所述拉伸元件中含有的拉伸组分,每个都具有不同的弹性模量。在一个实施方案中,所述弹性元件的弹性组分的弹性模量具有第一弹性模量,并且所述拉伸元件的拉伸组分具有第二弹性模量。在优选的实施方案中,所述第二弹性模量比所述第一弹性模量大至少约一个数量级。在一个实施方案中,所述第二弹性模量比所述第一弹性模量大约一个数量级,约2个数量级,约3个数量级,约4个数量级,或额外的数量级。例如,Rapoport等,美国出版申请号20090227026的实施例1示出了所述拉伸组分PDO和Vicryl分别具有3GPa和9-18Gpa的弹性模量,与之相比的,所述弹性组分乳胶的弹性模量为0.3Mpa至0.5Mpa。另一方面,本发明的所述TE支架具有的构造和功能性能,基本上与在天然血管中发现的相似。本领域普通技术人员将理解到所述众多的参数,可以用于表明本发明的所述支架模仿或者接近类似于天然血管,包括但不限于包括但不限于:对应力和应变的响应、顺应性、杨氏模量、孔隙度、强度等。在一个实施方案中,本发明的所述支架特征在于,具有以各向异性的方式对应力和应变机械响应的能力。本领域普通技术人员将可以理解,在现有技术中大量公认的参数对于表征组织工程支架的行为是有效的的(Rapoport等,美国出版申请号20090227026)。这种参数对于表征本发明的组织工程支架(并且特别地,在测定所述支架是否具有与天然血管相似的基本性能)是有效的。表1提供了表征规范,基于所述项目的文献,以提供支架或TEBV的机械性能(其与天然血管相似)。本发明涉及组织工程支架,其特征在于表1中的数值,并具有与天然血管相似的机械性能,优选的(i)对应力和应变的机械响应,由J-形应力/应变曲线;(ii)抗压裂;(iii)粘弹性;(iv)(i)-(iii)的任意组合。另外,所述支架特征在于可以获得多种细胞类型,为了接种细胞以形成TEBV的目的。表1在一个实施方案中,本发明的组织工程支架表现的J-形应力/应变曲线特性归属于(i)约0.1MPa至约0.5Mpa的圆周管道弹性模量1,(ii)约3.0MPa至约6.0Mpa的圆周管道弹性模量2;以及(iii)约0.57至约1.12的圆周向模量转换,及其任意的组合。在另一实施方案中,所述圆周管道弹性模量1为约0.1MPa、0.13MPa、约0.15MPa、约0.17MPa、约0.2MPa、约0.22MPa、约0.25MPa、约0.27MPa、约0.3MPa、约0.32MPa、约0.35MPa、约0.37MPa、约0.4MPa、约0.42MPa、约0.45MPa、约0.47MPa、或者约0.5Mpa。在另一实施方案中,所述圆周管道弹性模量2为约3.0MPa、约3.2MPa、约3.5MPa、约3.7MPa、约4.0MPa、约4.2MPa、约4.5MPa、约4.7MPa、约5.0MPa、约5.2MPa、约5.5MPa、约5.7MPa、或者约6.0Mpa。在另一实施方案中,所述圆周向模量转换is约0.57、约0.59、约0.61、约0.63、约0.65、约0.67、约0.69、约0.71、约0.73、约0.75、约0.77、约0.79、约0.81、约0.83、约0.85、约0.87、约0.89、约0.91、约0.93、约0.95、约0.97、约0.99、约1.01、约1.03、约1.05、约1.07、约1.09、约1.11、或者约1.12。在另一实施方案中,利于抗断裂性的性能为(i)约0.45MJ/m3至1.0MJ/m3的圆周向管道韧性;(ii)约0.1MJ/m3至0.5MJ/m3的轴向管道韧性;或(iii)(i)和(ii)的组合。生物材料的所述韧性是一个参数,该参数有利于测定其的抗断裂性。显然,抗断裂或撕裂是TE支架所期望的特征,因为其有助于确保源自其的任何TEBV或血管移植物的通畅。支配天然血管受变形以响应于循环载荷流体的所述应力和应变。因此,其在纵向或轴向方式和/或圆周方式的分裂或断裂是危险的。类似于天然血管,所述源自本发明的所述TE支架和TEBV的血管移植物也有断裂的风险。本发明涉及发现特定的轴向韧性和/或特定的圆周韧性,有助于TE支架抗断裂或撕裂。在一个实施方案中,所述圆周向管道韧性为约0.45MJ/m3,约0.50MJ/m3,约0.55MJ/m3,约0.60MJ/m3,约0.65MJ/m3,约0.70MJ/m3,约0.75MJ/m3,约为0.80MJ/m3,约0.85MJ/m3,约0.90MJ/m3,约0.95MJ/m3,约1.0MJ/m3。在另一实施方案中,所述轴向管道韧性为约0.1MJ/m3、约0.15MJ/m3,约0.20MJ/m3,约0.25MJ/m3,约0.30MJ/m3,约0.35MJ/m3,约0.40MJ/m3,约0.45MJ/m3,或约0.50MJ/m3。在另一实施方案中,本发明的所述TE支架,其特征在于以下的一种或多种:i)支架,其对应力和应变的机械响应以J-形应力/应变曲线为特征;ii)抗断裂支架;和iii)粘弹性支架。在另一实施方案中,所述TE支架的粘弹性性能其特征在于(i)角正切约0.05至0.3;(ii)储存模量约400MPa至0.12MPa;或(iii)(i)和(ii)的组合。粘弹性材料呈现出响应于变形的粘性和弹性特性。同时,当施加应力时粘性材料的抗拉性与时间线性相关,弹性材料即刻响应应力,而且一旦应力除去迅速恢复到其原始状态。粘弹性材料对应力响应呈现出时间依赖性的应变,其通常在无定形材料内涉及原子或分子的扩散。作为天然血管显示粘弹性以应对流体的所述循环加载,此特征对本发明的TE支架是可取的,将被用于创建TEBV或血管移植。本发明涉及本发明TE支架所述粘弹性的所述发现,其特征在于特定的角正切和/或特定的储存模量值。在一个实施方案中,所述角正切约0.05、约0.06、约0.07、约0.08、约0.09、约0.10、约0.11、约0.12、约0.13、约0.14、约0.15、约0.16、约0.17、约0.18、约0.19、约0.20、约0.21、约0.22、约0.23、约0.24、约0.25、约0.26、约0.27、约0.28、约0.29、或约0.30。在另一实施方案中,所述储存模量为约400MPa、约350MPa、约300MPa、约250MPa、约200MPa、约150MPa、约100MPa、约90MPa、约80MPa、约70MPa、约60MPa、约50MPa、约40MPa、约30MPa、约20MPa、约10MPa、约9MPa、约8MPa、约7MPa、约6MPa、约5MPa、约4MPa、约3MPa、约2MPa、约1MPa、约0.9MPa、约0.8MPa、约0.7MPa、约0.6MPa、约0.5MPa、约0.4MPa、约0.3MPa、约0.2MPa、约0.19MPa、约0.18MPa、约0.17MPa、约0.16MPa、约0.15MPa、约0.14MPa、约0.13MPa、或约0.12MPa。有几种本
技术领域:
的普通技术人员公知的技术适合用于识别和表征本发明所述支架的理想性能。这些技术包括但不限于,胀裂压力测试;在圆周方向上(应力/应变图中提供的结果)的准静态机械测试(又名拉伸试验);测定孔隙率和孔的大小(例如,通过水银压入法);细胞附件检测;和降解速率;移植顺应性的压力/容积曲线测量。5.结构在一方面中,本发明提供了一种或多种聚合支架或模型,其接种至少一种细胞群体。这种已接种细胞群体的支架,并可在本文中称为“结构”。在一个实施方案中,所述细胞接种的聚合物模型或模型形成结构,所述结构被形成或适于符合需要此结构的受试者天然管腔器官或组织构造的至少部分。所述天然管腔器官或组织构造可为层状组织的。细胞接种的聚合物模型或模型可以形成选自所述组(包括:膀胱替换结构、膀胱增大结构、膀胱导管结构,和逼尿肌等价结构)的新膀胱结构。此外,提供其它的细胞接种的聚合物模型,其形成选自所述组(包括:呼吸组织构造、胃肠道组织构造、新血管结构,和眼组织构造)的结构。那些在本领域的技术人员将理解,可通过本领域中已知的各种方法来接种或沉积本文所述的一种或多种细胞群体。例如,生物反应器孵化和培养,(Bertram等,美国出版申请20070276507;McAllister等,美国专利号7,112,218;Auger等,美国专利号5,618,718;Niklason等,美国专利号6,537,567));压力诱导接种(Torigoe等,(2007)细胞移植.,16(7):729-39;Wang等,(2006)生物材料.May;27(13):2738-46);和静电接种(Bowlin等,美国专利号5,723,324,其全部内容通过引用纳入本文)也可使用。此外,最近的技术,同时覆盖细胞静电纤维气溶胶可适合于接种或沉积(Stankus等,(2007)生物材料,28:2738-2746)。在另一方面中,本发明为本文所述的任意结构提供了以任何特定细胞密度的细胞接种的支架。在一个实施方案中,支架接种平滑肌细胞群体的细胞密度约20x106至约30x106。在另一实施方案中,所述细胞密度约1x106至约40x106,约1x106至约30x106,约1x106至约20x106,约1x106至约10x106,或约1x106至约5x106。在进一步的实施方案中,所述密度约20x106至约98x106。在另一实施方案中,所述密度约21x106至约97x106,约22x106至约95x106,约23x106至约93x106,约24x106至约91x106,约25x106至约89x106,约26x106至约87x106,约28x106至约85x106,约29x106至约83x106,约30x106至约80x106,约35x106至约75x106,约40x106至约70x106,约45x106至约65x106,或者约50x106至约60x106。在一优选实施方案中,所述密度约24x106至约91x106。在另一实施方案中,所述密度约2.5x106至约40x106,约5x106至约40x106,约7.5x106至约35x106,约10x106至约30x106,约15x106至约25x106,和约17.5x106至约22.5x106。在另一实施方案中,所述细胞密度约1x106,约2x106,约3x106,约4x106,约5x106,约6x106,约7x106,约8x106,约9x106,约10x106,约11x106,约12x106,约13x106,约14x106,约15x106,约16x106,约17x106,约18x106,约19x106,约20x106,约21x106,约22x106,约23x106,约24x106,约25x106,约26x106,约27x106,约28x106,约29x106,约30x106,约31x106,约32x106,约33x106,约34x106,约35x106,约36x106,约37x106,约38x106,约39x106,约40x106,约41x106,约42x106,约43x106,约44x106,约45x106,约46x106,约47x106,约48x106,约49x106,约50x106,约51x106,约52x106,约53x106,约54x106,约55x106,约56x106,约57x106,约58x106,约59x106,约60x106,约61x106,约62x106,约63x106,约64x106,约65x106,约66x106,约67x106,约68x106,约69x106,约70x106,约71x106,约72x106,约73x106,约74x106,约75x106,约76x106,约77x106,约78x106,约79x106,约80x106,约81x106约82x106,约83x106,约84x106,约85x106,约86x106,约87x106,约88x106,约89x106,约90x106,约91x106,约92x106,约93x106,约94x106,约95x106,约96x106,约97x106,约98x106,或约99x106。在进一步的实施方案中,本发明提供了以支架中特定细胞密度(每cm2)的细胞接种的支架。在一个实施方案中,所述密度约3,000细胞/cm2至约15,000细胞/cm2,约3,500细胞/cm2至约14,500细胞/cm2,约4,000细胞/cm2至约14,000细胞/cm2,约4,500细胞/cm2至约13,500细胞/cm2,约5,000细胞/cm2至约13,000细胞/cm2,约4,500细胞/cm2至约13,500细胞/cm2,约5,000细胞/cm2至约13,000细胞/cm2,约5,500细胞/cm2至约12,500细胞/cm2,约6,000细胞/cm2至约12,000细胞/cm2,约6,500细胞/cm2至约11,500细胞/cm2,约7,000细胞/cm2至约11,000细胞/cm2,约7,500细胞/cm2至约10,500细胞/cm2,约8,000细胞/cm2至约10,000细胞/cm2,约7,500细胞/cm2至约9,500细胞/cm2,或约8,000细胞/cm2至约9,000细胞/cm2。在优选实施方案中,所述浓度约3,000细胞/cm2至约7,000细胞/cm2,或约9,000细胞/cm2至约15,000细胞/cm2。在优选实施方案中,所述浓度约9.5x104细胞/cm2,约10x104细胞/cm2,约10.5x104细胞/cm2,约11x104细胞/cm2,约11.5x104细胞/cm2,约12x104细胞/cm2,约12.5x104细胞/cm2,约13x104细胞/cm2,约13.5x104细胞/cm2,约14x104细胞/cm2,约14.5x104细胞/cm2,或约15x104细胞/cm2。在一个实施方案中,细胞的所述沉积包括使支架与细胞附着增强蛋白接触的步骤。在另一实施方案中,所述增强蛋白质为以下中的一种或多种:纤维连接蛋白、胶原蛋白,和MATRIGELTM。在另一实施方案中,所述支架不含有细胞附着增强蛋白。在另一实施方案中,细胞的沉积包括在使支架与细胞群体接触后的所述培养步骤。在又一实施方案中,所述培养可包括在生物反应器的脉动和/或稳流条件。如本文所述的从脂肪或外周血中分离的平滑肌细胞群体,然后可以接种于如本文所述的支架上,形成结构。以下为用于在支架上接种细胞协议的具有代表性的实施例。源自脂肪或外周血的平滑肌细胞可扩展至最多7周,以产生接种支架所需足够的所述细胞数量。适于接种支架的所述细胞密度描述如下。在收获细胞用于接种支架以产生结构之前,源自脂肪的平滑肌细胞有可能扩大2代。在用于收获接种之前,源自外周血的平滑肌细胞培养中可能会扩大3-4代。准备细胞接种的支架:可削切合适的材料(例如,PGAfelt)成一定尺寸,缝合成适当的形状,并涂以材料(例如,PLGA)。然后采用合适的方法(例如,环氧乙烷)对所述支架材料进行灭菌。在细胞接种前的一天,可用饱和度60%乙醇/40%的D-PBS、100%的D-PBS、D-MEM/10%FBS或α-MEM/10%FBS连续对所述灭菌的支架进行预润湿,随后在室温下,用D-MEM/10%FBS或α-MEM/10%FBS进行过夜孵育。然后,所述支架可以接种源自脂肪或外周血的成熟平滑肌细胞,而且所述接种的结构在5%CO2的37℃潮湿培养箱中成熟,直到植入到受试者中(例如,7天前)。那些在本领域的普通技术人员将理解用于制备细胞接种支架和接种细胞到支架的附加方法。在一方面中,本发明提供了在较短时间期限内制备结构的方法,其对所述受试者等待植入结构有利。据报道,源自SVF的未分化的脂肪干细胞在分化成平滑肌细胞(Jack等,2009supra)之前,必须在诱导培养基上孵育6周。在一个实施方案中,该方法包括以下步骤:a)获得人体脂肪组织样本;b)从所述样品中分离完全分化的平滑肌细胞群体;c)培养所述细胞群体;和d)使所述细胞群体与成型聚合物模型细胞结构接触,其中步骤a),b),c)和d)在约45天或更短的时间内进行。在另一实施方案中,进行所述分离步骤没有进行细胞选择。在另一实施方案中,获得步骤a)后,所述分离步骤b)在约72小时或更短的时间内进行。在又一个实施例中,所述培养步骤c)在约4星期或更短的时间内进行。在其它实施例中,所述接触步骤d)在约10天或更短的时间内进行。在另一实施方案中,步骤a),b),c)和d)在约28天或更短的时间内进行。在另一实施方案中,在获得步骤a)后,所述分离步骤b)在约48小时或更短的时间内进行。在一个实施方案中,所述培养步骤c)在约2周或更短的时间内进行。在另一实施方案中,所述步骤d)在约5天或更短的时间内进行。在所有的实施方案中,所述人体脂肪组织样品从非自体来源获得。在另一实施方案中,所述方法进一步包括检测表达平滑肌细胞标记物的所述步骤。在另一实施方案中,表达为mRNA表达。在进一步的实施方案中,所述表达为多肽表达。在一个实施方案中,所述多肽表达由细胞内免疫荧光检测。在一个实施方案中,所述支架包括如本文所述的细胞群体。在另一实施方案中,所述支架基本上由如本文所述的细胞群体组成。在另一实施方案中,所述支架由如本文所述的细胞群体组成。A.泌尿系统结构本发明提供了用于所述泌尿系统天然管腔器官或组织构造的重建、更换、扩增、或再生的结构。所述泌尿系统的所述器官或组织构造,也可以被称为泌尿生殖器或泌尿生殖器官或组织构造。所述天然器官或组织构造可为层状组织。在另一实施方案中,含有所述模型和细胞的所述结构不含任何其它细胞群体。在一个优选的实施方案中,所述结构不含上皮细胞。这些结构用于提供有需要的受试者管腔器官或组织构造,如生殖泌尿器官,包括例如,所述膀胱、输尿管和尿道。所述受试者可能需要重建、扩增或替换此器官或组织。在一个实施方案中,所述管腔器官或组织构造为膀胱或其部分,并且所述聚合物模型或支架在所述模型表面具有平滑肌细胞沉积。所述结构也可以用于提供尿流改道或导管、或逼尿肌肌肉等价物。在一方面中,本发明提供了接种如本文描述的细胞群体的支架或模型。如本文所述,本文所述的所述膀胱扩增或替代支架可包括至少一个、或至少两个模型。所述模型可能为聚合物和/或生物相容性。所述第一聚合物模型或所述第二聚合物模型,如果有的话,或两者,在所述第一聚合物模型第一表面或内部,在所述第二聚合物模型的第一表面,或在两者上至少具有一种细胞群体沉积,以形成模型结构或支架细胞,其中,至少一种细胞群体基本上包括肌肉细胞群体。所述肌肉细胞群体,例如,平滑肌细胞群体。在另一实施方案中,所述第一表面和所述第二表面每个都为第一和第二聚合物模型的外表面。形成膀胱导管、尿流改道或泌尿导管结构的所述支架或模型将接种本文所述的细胞群体。这种支架已接种细胞群体,并在本文中可称为“结构”。在一个实施方案中,所述尿流改道或膀胱导管结构由如本文所述的一个或多个支架和如本文所述的一个或多个所述支架表面沉积的细胞群体组成。用于形成肌肉等价结构的支架或模型可用于增强有需要的受试者现有的管腔器官或组织构造,如生殖泌尿器官,包括例如,所述膀胱。所述受试者可能需要扩张或治疗这样的器官或组织。在一个实施方案中,所述管腔器官或组织构造为膀胱或其一部分,及所述聚合物模型或支架,在所述模型表面具有平滑肌细胞的沉积。在一个实施方案中,所述结构用于提供逼尿肌肌肉等价物。那些在本领域的普通技术人员将理解用于在模型或支架上沉积细胞群体的几种合适方法。在一方面中,所述结构适合于在有需要的受试者中植入新的器官或组织构造。在一个实施方案中,所述结构包括产生所述细胞因子MCP-1的细胞群体。在另一实施方案中,所述MCP-1诱导迁移所述受试者或接受者的天然间充质干细胞到植入部位。在一个实施方案中,所述迁移接受者的骨髓间充质干细胞有助于所述新器官或组织构造的再生。在一方面中,本发明的所述结构适于提供植入后所述受试者的特定特征。在一个实施方案中,所述结构适于为所述受试者提供植入后的再生。在另一实施方案中,所述结构适于促进受试者在所述植入位点的再生。例如,在植入后,再生组织可以在植入位点形成所述结构本身。在另一实施方案中,所述结构可以对植入后的所述受试者赋予功能属性。例如,尿分流结构可适于允许所述受试者的尿液从第一输尿管(例如,第一侧开口部)到所述支架的所述管状内部通过,和/或适于提供临时存储和尿液(例如,管状支架)离开受试者的通道。在一个实施方案中,尿流改道结构可适于在植入物上提供上皮黏膜。在另一实施方案中,结构可适用于在受试者中提供新的器官或组织构造发育的稳态调节。在一方面中,本发明提供了适于在尿流改道结构管状支架的第一端部和腹壁部分之间的连接位点植入的网状构造,如本文所述。在一个实施方案中,在植入如本文所述的尿流改道结构后,所述网状构造适于方便形成新泌尿导管。在另一实施方案中,所述网状构造适于在皮下脂肪和骨骼肌之间植入。在另一实施方案中,所述网状构造适于提供造口的通畅。在另一实施方案中,所述网状构造位于辅助腹壁的开口(例如,造口门位置)的位置。在一个优选的实施方案中,所述网状构造为疝气补丁,更优选为皮下疝补丁。用于与泌尿系统器官或组织构造的所述结构可以接种如本文所述的平滑肌细胞群体。所述SMC群可从来源(例如脂肪或外周血)获得,所述来源不是(属于所述重建、替换、扩大、或再生的所述受试者的)所述器官或组织构造,例如对于需要所述结构的受试者而言,其中来源为自体或非自体(例如,同种异体的或同源的)。在另一方面,本发明涉及的结构用于泌尿系统的天然管腔器官或组织构造的重建、替换、扩大、或再生,其含有源自膀胱来源的平滑肌细胞(SMC),其为非自体来源。所述非自体来源可以是同种异体的的或同源的。所述非自体膀胱源的SMC可能会根据本文所述的协议接种在合适的支架上。在一个优选的实施方案中,所述结构从支架和膀胱来源的SMC形成,但不含尿道上皮细胞。所述膀胱来源的SMC可接种到膀胱扩大、膀胱更换、泌尿导管,或肌肉等价支架上,以形成结构。B.胃肠道组织构造在一方面中,本发明提供了一个或多个接种细胞群体的胃肠道(GI)相关的聚合物支架或模型。此GI支架已至少接种一种细胞群体,并且本文中可称为“结构”。在一个实施方案中,所述支架接种不是源自胃肠道(GI)组织源的细胞群体。所述非GI源可以是脂肪或外周血。在另一实施方案中,所述细胞群体为SMC群体。所述支架可基本上无其他细胞群体,包括,例如,胃肠道细胞群体。所述支架材料可包括,组成,或基本上由一个细胞群体(例如,不是源自GI组织的SMC群体)组成。在另一实施方案中,所述支架可以是GI组织支架,例如,食管组织或肠道支架。在一个实施方案中,可以从有需要的受试者的脂肪组织或外周血中分离出自体SMC细胞群体。所述细胞群体可以接种到支架上适合植入到受试者所述GI系统内的位点。本发明所述细胞群体的优点为:如果所述受试者具有GI系统缺陷的话,该适当的SMC可能不提供源自所述受试者胃肠道系统的来源,例如,所述GI系统癌症。所述细胞群体可用于受试者胃肠道系统部分或全部被除去的情况,如食管癌的情况。当受试者的食管或食管的一部分除去后,自体SMC群体可以从脂肪活检中分离、培养、在合适的支架上接种,并植入到受试者中,以提供新的食管或新的食管组织构造。在另一方面中,本发明提供了一种或多种聚合物支架或模型,其接种SMC群体和GI细胞群体。在一个实施方案中,所述细胞接种的聚合物模型或模型形成了胃肠道(GI)组织结构或新的GI结构。在另一方面中,通过使用所述SMC群体,本发明涉及的结构适于促进所述沉积或接种的GI细胞群体。已经发现,在GI支架上或其内部沉积或者接种脂肪来源的SMC群体可能提高GI细胞群体随后的接种或沉积。在一个实施方案中,所述结构具有事先沉积的SMC群体,以方便GI细胞群体在支架表面上或内部迁移或接种。在另一实施方案中,预先沉积SMC群体的结构有利于GI细胞群体的迁移,以使所述支架和/或所述沉积SMC群体接触。GI细胞群体的所述迁移可能是在体外或在体内。在另外一个实施方案中,所述GI细胞群体源自其中之一:食管、小肠、大肠、胃、结肠,或肛门括约肌。根据本文所述的协议,细胞可接种于GI支架上。实施例11和13提供了在GI支架上接种细胞群体的示例性方法。那些在本领域的普通技术人员将会理解用于制备接种细胞的支架和在支架上接种细胞的附加方法。在一个实施方案中,所述GI支架包括如本文所述的细胞群体。在另一实施方案中,所述GI支架包括脂肪源的SMC群体和GI细胞群体。所述GI的细胞群体可能为食管细胞群体或小肠细胞群体。在另一实施方案中,所述接种基本上由如本文所述的脂肪来源的SMC群体和GI细胞群体组成。在另一实施方案中,所述支架由如本文所述的脂肪来源的SMC群体和GI细胞群体组成。另一方面,本发明提供的结构只接种平滑肌细胞群体。在一个实施方案中,所述结构只接种脂肪来源的或血液来源的SMC群体。此结构没有任何其它胃肠道细胞群体,包括但不限于,食管细胞群体(例如,食管上皮细胞群体)、小肠细胞群体、大肠的细胞群体、胃细胞群体,结肠细胞群体,或肛门括约肌细胞群体。在另一实施方案中,所述结构没有成纤维细胞群体(例如,皮肤成纤维细胞群体)。在另一实施方案中,所述SMC(仅)结构选自:食管、小肠、大肠、胃、结肠,或肛门括约肌。在另外一个实施方案中,所述结构包含,由以下或基本上由支架和平滑肌细胞群体(例如,脂肪或血液源的SMC群体)组成。在另一方面,本发明的所述结构科具有的某种结构和功能特性使其特别有利地用于本文所述的治疗方法。在一个实施方案中,所述结构由作为模型提供的支架组成,所述模型具有第一表面、和直接接种在所述第一表面上或其中的细胞群体。所述结构可只有一种细胞群体。在一个实施方案中,所述一种细胞群体为平滑肌细胞群体。所述支架在其外表面或管腔表面可以具有褶皱,如上所述。在另一实施方案中,所述结构由接种了平滑肌细胞(SMC)群的支架组成,其中所述结构具有吸引或促进另一细胞群体向的所述SMC接种的结构迁移的能力。实施例13提供了此功能能力的论证。所述迁移细胞群体可能为食管细胞群体、小肠细胞群体、大肠细胞群体、胃细胞群体、结肠细胞群体、或肛门括约肌细胞群体。在另外一个实施方案中,所述迁移的细胞群体可能为食管上皮细胞群体。完整的、天然的食管由上皮细胞层的管腔层组成。这是有利的,对于没有接种上皮细胞的SMC接种的结构,使其具有吸引或促进来自食管组织的上皮细胞(在植入受试者之前)迁移到所述结构上或所述结构中的功能性能力。在另一实施方案中,第一支架或聚合物模型(和/或第二支架或聚合物模型,如果有,或两者)包括至少一种沉积于所述第一聚合物的模型(和/或所述第二聚合物模型的第一表面,或两者)的第一表面上的SMC群体,以形成模型或支架加细胞的结构,其中,至少一种细胞群体包括SMC群体。所述SMC为脂肪或血液来源的平滑肌细胞群体。在一方面中,本文所述的结构,在植入后适于或能够为受试者提供再生的GI器官或GI组织。所述再生/再生GI器官或GI组织方面,见实施例8(食管)和9(小肠)所述。在一方面中,本发明提供了用于治疗有需要的受试者的胃肠(GI)疾病,和使用所述相同的治疗方法。在一个实施方案中,所述结构包括(a)支架;(b)沉积在所述支架第一表面上或其内部的,并且不是源自胃肠道组织的第一细胞群体;和(c)源自胃肠道组织的第二细胞群体。所述第一细胞群体可源自脂肪。所述第一细胞群体可以是平滑肌细胞群体。在另一实施方案中,所述SMC群体至少对一个平滑肌细胞标记物为阳性。在另外一个实施方案中,所述第二细胞群体源自从食管、小肠、大肠、胃、结肠、或肛门括约肌。在又一实施方案中,所述结构对至少一个GI标记物为阳性。所述GI标记物可以为上皮细胞标记物。在一个实施方案中,所述第二细胞群体在所述支架的第二表面上沉积。在另一实施方案中,所述第二细胞群体与沉积的第一细胞群体接触。在另一实施方案中,所述结构包括具有协调节奏收缩功能的细胞。在另一实施方案中,所述结构植入后适于形成胃-肠道组织。所述GI组织可能为食管、小肠、大肠、胃、结肠、或肛门括约肌。在另一实施方案中,所述结构在植入时形成再生的GI组织。在一个实施方案中,所述再生GI组织为食管、小肠、大肠、胃、结肠,或肛门括约肌组织。在另一实施方案中,所述再生的组织为食管组织。所述再生食管组织可能具有管腔黏膜表面和/或固有层和黏膜肌层。在一个优选的实施方案中,所述再生GI组织为食管组织。在另一实施方案中,所述结构在植入时适合于形成表皮管腔黏膜表面。在所有实施例中,所述支架为GI支架。在所有的实施方案中,所述GI组织支架为食管组织支架、小肠组织支架、大肠组织支架、胃组织支架、结肠组织支架、或肛门括约肌组织支架。在所有实施方案中,所述结构为GI组织构造。在所有的实施方案中,所述GI组织结构为食管组织结构、小肠组织结构、大肠组织结构、胃组织结构、结肠组织结构、或肛门括约肌组织结构。C.呼吸组织结构在一方面中,本发明提供了接种本文所述的细胞群体的呼吸组织结构。这种支架已接种了细胞群体,并在本文中可称为“结构”。在一个实施方案中,所述呼吸组织结构由如本文所述的一个或多个支架和沉积在如本文所述的一个或多个支架的一个或多个表面上的细胞群体组成。所述支架接种的平滑肌细胞(SMC)群体源自自体或非自体来源。在一个实施方案中,可以从有需要的受试者的所述脂肪组织或外周血中分离出自体SMC细胞群体。可以接种所述细胞群体到适于植入到所述受试者肺内的位点的支架上。本发明的所述细胞群体的优点在于:如果受试者的呼吸系统有缺陷,如肺癌,那么将不能获得源自所述受试者的肺脏的合适的SMC。所述细胞群体可用于受试者的肺部分或全部被除去的情况,如在肺癌的情况。取出受试者的肺或肺组织的部分后,自体SMC群体可从活检中分离、培养、接种于合适的支架上,并植入到受试者中,以提供新肺或新的肺组织构造。本发明还提供了呼吸组织结构,其包括支架,在所述支架第一表面上或其内部沉积的、并且不是源自呼吸组织的第一细胞群体;和源自呼吸组织的第二细胞群体。在一个实施方案中,所述第一细胞群体源自脂肪。在另一实施方案中,所述第一细胞群体为平滑肌细胞群体(SMC)。所述SMC群体可能被接种在支架上,如本文所描述的每个协议,在这之后所述呼吸细胞群体可接种于预接种SMC的所述支架上。那些在本领域的普通技术人员将会理解,不同的方法可能合适用于接种细胞群体。在另外一个实施方案中,所述结构对至少一个平滑肌细胞标记物为阳性。在又一实施方案中,所述结构对一个或多个以下的SMC标记物为阳性:心肌素、α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、肌间线蛋白、肌成纤维细胞抗原,SM22、和其任意组合。在一个实施方案中,所述第二细胞群体源自肺。在另一实施方案中,所述结构对至少一个呼吸组织标记物为阳性。在又一实施方案中,所述呼吸标记物为下列中的一个或多个:细支气管标记物、肺泡标记物、和上皮标记物。在另外一个实施方案中,所述结构对一个或多个以下的呼吸组织标记为阳性:Clara细胞分泌蛋白(CCSP)、Prosurfactant蛋白C(ProSP-C)、KRT18、分泌球蛋白,家族1A,成员1(子宫球蛋白或SCGB1A1)、表面活性剂蛋白Al(SFTPA1)、和其任意组合。在一个实施方案中,所述细支气管标记物为CCSP和/或SCGB1Al,所述肺泡标记物为proSP-C和/或SFTPA1,及所述上皮标记物为KRT18。在另一实施方案中,所述第二细胞群体在所述支架的第二表面上或其内部沉积。在另一实施方案中,所述第二细胞群体与沉积的第一细胞群体接触。在又一实施方案中,所述结构包括一个或多个肺泡形成单位(AFU)。在一个实施方案中,所述结构包括的细胞具有协调节奏收缩的功能。在另一实施方案中,所述结构植入后适于形成呼吸组织。在其它实施方案中,所述呼吸组织为肺组织。所述肺组织可包括肺泡组织和/或细支气管组织。这些结构用于给有需要的受试者提供组织构造,如肺组织构造。所述受试者可能需要重建、扩增或替换的呼吸组织。在一个实施方案中,所述呼吸组织为肺或其部分,并且所述聚合物模型或支架在所述模型的表面上具有平滑肌细胞沉积。在一方面中,本发明的所述呼吸组织结构适于提供植入受试者后的特定特征。在一个实施方案中,所述结构适于提供植入受试者后的再生。在另一实施方案中,所述结构适于促进受试者所述植入位点的再生。例如,植入后,再生组织可以在植入位点形成所述结构本身。在另一实施方案中,所述结构具有植入受试者后的功能属性。在一个实施方案中,所述结构可适于在植入位点形成肺泡形成单元(AFU)。在一方面中,本发明涉及使用脂肪来源的平滑肌细胞接种的支架作为基板接种肺细胞悬浮液,以使得肺泡形成单元(AFU)数目的增加(与尚未接种脂肪来源的平滑肌细胞支架相比)。就本文所述的本领域的当前情况,其对于肺组织再生而言,为潜在的深远改善。再生医学基础的方法使用完整特征的自体分化细胞类型比非自体细胞类型更加具有优势,例如,同种异基因胎儿源(Andrade等,2007supra)或未分化的,多能的,干/祖细胞(Shigemura等,2006supra)。脂肪来源的平滑肌细胞相比其他细胞有一定的优势,在文献中已经描述(BasuandLudlow,TrendsBiotechnol.2010Oct;28(10):526-33.Epub2010Aug25)。本发明涉及的呼吸组织结构适于通过使用SMC群体来促进呼吸细胞群体的沉积或接种。已经发现,在呼吸组织支架上或其内部沉积或接种脂肪来源的SMC群体可能提高随后的所述接种或沉积呼吸细胞群体。在一个实施方案中,所述结构事先沉积SMC群体有利于在支架上或在表面内迁移或接种呼吸细胞群体。在另一实施方案中,结构事先沉积SMC群体有利于呼吸细胞群体的所述迁移以使所述支架和/或所述沉积SMC群体接触。所述呼吸细胞群体的所述迁移可能是在体外或在体内。在另一方面,本发明提供了一种或多种聚合物支架或模型,其接种了SMC群体和呼吸细胞群体。在一个实施方案中,所述细胞接种的聚合物模型或模型形成呼吸系统组织结构。在一方面中,本发明提供了肌肉等价结构,可用于给有需要的受试者增强现有的呼吸器官或组织构造,如肺。所述受试者可能需要扩张或治疗这样的器官或组织。在一个实施方案中,所述呼吸组织为肺或其部分,并且所述聚合物模型或支架,其具有在所述模型表面沉积的平滑肌细胞。D.血管结构本发明涉及血管支架和制作所述相同的方法。操作所述支架以形成血管结构。在一方面中,本发明涉及血管结构。在一个实施方案中,所述结构包括:a)具有第一和第二表面的生物相容性管状支架;以及b)源自非血管源的第一细胞群体,其在所述支架第一表面上或其内部沉积。在另一实施方案中,所述第一细胞群体为平滑肌细胞群体。在另外一个实施方案中,所述第二细胞群体可源自非血管源。所述第二细胞群体可在支架第二表面上或内部沉积。在另一实施方案中,所述第二细胞群体为内皮细胞群体。在所有的实施方案中,所述非血管源为脂肪组织。在所有的实施方案中,所述非血管源为外周血。在另一实施方案中,所述管状支架的所述第一表面为外表面。在一个优选的实施方案中,外表面为褶皱的。在另外一个实施方案中,所述管状支架的所述第二表面为内部的、管腔表面。在所有的实施方案中,所述支架可包括合成材料。在所有的实施方案中,所述支架可包括天然材料。在另一实施方案中,所述第一细胞群体为平滑肌细胞群体。在另一个实施方案中,所述第二细胞群体可源自非血管源。所述第二细胞群体可以沉积在所述支架的第二表面上或其内部。在另一实施方案中,所述第二细胞群体为内皮细胞群体。在所有实施方案中,非血管源为脂肪组织。在所有的实施方案中,所述非血管源为外周血。在另一实施方案中,所述管状支架的所述第一表面为外表面。在一个优选的实施方案中,所述外表面为褶皱的。在另外一个实施方案中,所述管状支架的所述第二表面为内部的、管腔表面。在所有的实施方案中,所述支架可包括合成材料。在所有的实施方案中,所述支架可包括天然材料。在一个实施方案中,用于获取所述第一或第二细胞群体的非血管源为所述受试者自体的。在另一实施方案中,用于获得所述第一或第二细胞群体的非血管源为受试者非自体的。另一方面,本发明提供了源自本发明支架的血管结构。鉴于其大量相似的天然血管,所述支架特别适合于修饰以创建所述结构,又可作为血管旁路移植术用于心血管疾病的治疗。血管旁路移植术包括动静脉(AV)分流。在一个优选的实施方案中,本发明的所述支架可以用来创建血管结构,其具有较小的直径,通常小于6毫米,用于治疗心血管疾病。如本文所讨论的,所述支架的某些实施方案已经显示表现出J形应力/应变曲线为特征对应力和应变的机械响应,其归因于弹性模量和模量转换的范围及其任意组合。除了所述模量参数,也所述支架所表现出的其他属性,使其具有在血管移植中使用的吸引力。在一方面中,本发明的所述支架显示出一定的特性,使它们特别适合制作血管结构,起初用于血管移植,并确保植入的血管移植保持通畅。这些性质包括但不限于,那些允许在支架上接种的所述细胞,那些提供抗断裂性的支架,和那些提供粘弹性的支架。在一个实施方案中,所述性能有利于在支架上接种所述细胞,其归因于孔隙梯度,其中所述孔直径从所述外膜或外部侧的约100微米逐渐减小到管状元件的所述管腔或内侧的约5至约15微米。孔隙直径为在支架上或支架内接种细胞成功的重要因素,这是在本领域中公知的。例如,孔隙直径必须足够大,使各种细胞类型的迁移到所述支架的表面并通过支架,使它们可以与其它迁移细胞以体内观察到的类似的方式相互作用。本发明涉及所述发现特定的孔梯度有助于细胞的成功接种。在一个实施方案中,所述孔梯度使得所述支架易通过细胞,从而提高其细胞接种容量。在另一实施方案中,孔梯度为约100微米(外侧)至约5微米(内侧),约(外侧)100微米至约6微米(内侧),约100微米(外侧)至约7微米(内侧),约100微米(外侧)至约8微米(内侧),约100微米(外侧)至约9微米(内侧),或约100微米(外侧)至约10微米(内侧)。在一方面中,所述孔梯度提供的结构,其有利于在所述管腔上、TE支架内侧接种细胞,以及在外部的、TE支架外部、外膜侧接种所述细胞。在一个实施方案中,在所述管腔的、内表面上的较小的孔尺寸,适合于在所述内部表面内接种内皮细胞;在所述外部的、外膜侧的较大的孔尺寸适合于在外部表面内接种平滑肌细胞。在另一实施方案中,接种所述内皮细胞以在所述TE支架内部、管腔表面形成单层或平薄片状结构,和/或在所述TE支架所述外部的、外膜表面上和/或其内接种所述平滑肌细胞。在一些实施方案中,超出一定孔径,接种于所述TE支架上及整个内部、管腔表面的所述内皮细胞,无法朝向外部、外膜表面迁移。在优选的实施方案中,所述孔的大小约15至约20微米。在另优选的实施方案中,所述孔的大小约15微米、约16微米、约17微米、约18微米、约19微米,或约20微米。另一方面,本发明提供了本文所述的源自血管支架的血管结构。作为结果,所述结构表现出基本上类似于天然血管那些已发现的的结构和功能特性。在一个实施方案中,本发明的所述TEBV特点为有能力以各向异性的方式机械响应应力及应变。在另一实施方案中,所述TEBV具有(i)有利于所述支架抗断裂的特征;和/或(ii)有利于所述支架粘弹性的特征。另一方面,本发明的所述组织工程血管(TEBV)可调节某些与以下植入后观察到的血管移植相关并发症。在一个实施方案中,所述TEBV调节植入后的顺应性差异(compliancemismatch)。在另一实施方案中,所述调节包括一个或多个以下:抗动脉瘤形成、耐扩张、抗断裂、抗血栓形成、抗吻合口增生、和耐内膜增生。那些本领域的技术人员将会理解由所述TEBV调节的额外因素。在一方面中,本发明提供的血管结构含有如本文所述的支架和细胞群体。在一个实施方案中,支架可被操纵以形成血管结构,其适合于移植到有需要的哺乳动物。例如,支架可通过如本文所述的方法添加一种或多种细胞群体操纵。那些本领域的普通技术人员将会理解,本发明的所述血管结构可能适用于许多类型的血管,包括但不限于,颈动脉、锁骨下动脉、腹腔干、肠系膜动脉、肾动脉、髂动脉、小动脉、毛细血管、小静脉、锁骨下静脉、颈内静脉、肾静脉,髂总静脉,腔静脉。所述血管结构的第二管状元件的内部和/或所述结构的第二管状元件的外部表面上可具有第一细胞群体。在优选实施方案中,所述第一细胞群体为平滑肌细胞群体。那些在本
技术领域:
的技术人员将会理解,不同类型的平滑肌细胞(SMC)可适合用于本发明(见Bertram等,美国出版申请20070190037和Ludlow等,美国出版申请号20100131075,二者的全部内容通过引用纳入本文),包括但不限于,人主动脉平滑肌细胞、人脐动脉平滑肌细胞、人肺动脉平滑肌细胞、人类冠状动脉平滑肌细胞、人支气管平滑肌细胞、人类桡动脉平滑肌细胞,以及人类隐静脉或颈内静脉平滑肌细胞。如上文Bertram等人所述,所述平滑肌细胞可从各种来源分离,包括例如,源自活受试者的活检及从尸体恢复的整个器官。如上文Ludlow等所述,所述SMC可从脂肪组织或外周血中获得。所述SMC可能为需要所述结构治疗的受试者的自体细胞并从所述受试者分离的活检中分离,预期为结构的接受者。所述SMC可能为需要治疗的受试者的非自体,并从合适供体获得的活检中分离。在一个实施方案中,接种于支架上的所述平滑肌细胞群体源自非血管源。在另一实施方案中,本发明的所述结构没有源自血管源的细胞。在本发明的所述血管结构可包括,基本上由,或由源自非血管源的平滑肌细胞群体组成。所述SMC群体可源自脂肪组织或外周血。在另一实施方案中,所述结构在所述内部或管腔表面包含第二细胞群体。在优选的实施方案中,所述第二细胞群体为内皮细胞群体。那些本领域的技术人员将理解,不同类型的内皮细胞(EC)可能适合用于本发明(见美国出版申请20070190037,其全部内容通过引用纳入本文),包括但不限于,动脉和静脉EC,如人类冠状动脉内皮细胞、人类主动脉内皮细胞、人类肺动脉内皮细胞、真皮微血管内皮细胞、人脐静脉内皮细胞、人脐静脉血管内皮细胞、人隐静脉内皮细胞、人颈内静脉内皮细胞、人体桡动脉内皮细胞和人乳内动脉内皮细胞。EC可从各种来源分离,包括但不限于,脂肪组织、外周血、血管软组织、循环内皮细胞和内皮细胞的前体(如骨髓祖细胞,外周血干细胞和胚胎干细胞)(见Bischoff等,美国出版申请20040044403和Raffi等,美国专利6,852,533,其中每个其全部内容通过引用纳入本文)。那些本领域的技术人员将理解,可以通过本领域中已知的各种方法接种或沉积本文所述的一种或多种细胞群体。例如,也可使用生物反应器孵化和培养,(Bertram等,美国出版申请20070276507;McAllister等,美国专利7,112,218;Auger等,美国专利5,618,718;Niklason等,美国专利6,537,567);压力诱导接种(Torigoe等,(2007)CellTransplant.,16(7):729-39;Wang等,(2006)Biomaterials.May;27(13):2738-46);和静电接种(Bowlin等,美国专利号5,723,324)。此外,最新技术,以细胞的气溶胶同步涂覆静电纺纤维可适合于接种或沉积(Stankus等,(2007)Biomaterials,28:2738-2746)。在一个实施方案中,细胞的所述沉积包括将管状支架与细胞附着增强蛋白接触的步骤。在另一实施方案中,所述增强蛋白质为以下一个或多个:纤维连接蛋白、胶原蛋白、和MATRIGELTM。在另一实施方案中,所述管状支架不含有细胞附着增强蛋白。在另一实施方案中,细胞的沉积包括使管状支架与一种或多种细胞群体接触后的培养步骤。在又一实施方案中,所述培养可包括由通过脉动和/或稳流在生物反应器中的调控。E.眼睛组织结构另一方面,本发明考虑本文所述的SMC群体用于眼部疾病治疗的应用。眼部疾病为所述受试者具有眼睛缺陷,由于所述眼部肌肉功能不正常造成。在所述眼睛中,平滑肌作为睫状肌存在并控制所述眼睛适应于对不同距离物体的观察,及调节通过巩膜静脉窦的水状液体的所述流量。然后平滑肌也存在于所述眼睛的虹膜中。发生如老花眼和远视眼疾病的个体可受益于这些SMC群体。在一个实施方案中,可从有需要的受试者中的脂肪组织或外周血中分离非自体SMC细胞群体。所述细胞群体可以接种到支架上适合于植入所述受试者所述眼睛内部的位点。本发明所述细胞群体的优点是,合适的SMC可能不能获得,对于用于源自所述受试者的眼睛的来源,如果所述受试者的眼睛有缺陷或由于眼睛组织的有限获得性或由于难以进行活体检查。非自体SMC群体可从活检中分离、培养、接种在合适的支架上,并植入到受试者中以提供新的眼睛组织。在另一实施方案中,本发明的所述平滑肌细胞群体可以从非眼睛来源获得并施用于具有眼睛疾病的受试者中,而无需使用支架。那些在本领域的普通技术人员将理解合适的植入方法。所述非眼睛来源可能为自体或非自体。6.使用方法A.使用管腔器官和组织构造结构在一方面中,本发明考虑用于给有需要治疗的受试者提供层状组织管腔器官或组织构造的方法。在一个实施方案中,所述受试者可能需要重建、再生、扩大或替换器官或组织。在一个实施方案中,所述方法包括提供生物相容的合成或天然聚合物模型被成形以符合在有需要器官或组织构造中的至少部分的器官或组织构造。所述提供步骤可随后进行沉积至少一种所述受试者的非自体细胞群体,并且所述细胞群体不是源自所述重建,再生,扩大或替换的受试者相应的器官或组织构造。所述沉积步骤可包括在所述聚合物模型上培养所述细胞群体。在所述模型上沉积所述细胞群体以提供结构之后,它可以在治疗位点植入到患者体内,以形成所述所需的层状组织管腔器官或组织构造。在另一方面,本发明提供了用于给有需要的受试者提供层状组织管腔器官或组织构造的方法。在一个实施方案中,所述方法包括以下步骤:a)提供生物相容的合成或天然聚合物模型,其被形成以符合在需要治疗的器官或组织构造的至少部分;b)在所述聚合物模型第一区域上或内部沉积所述受试者非自体的细胞群体,而且所述细胞群体不是源自新的器官或组织构造相应的器官或组织;和)在所述受试者中植入成型的聚合物模型细胞结构以形成层状组织管腔器官或组织构造。本发明还提供了用非天然器官或人造器官替换天然管腔器官或组织构造的方法。所述替换器官为非天然或人造,在这个意义上,它不是所述天然器官的原始形式,但仍然能够有相同或大致类似方式的功能。受试者的所述天然器官或组织构造可能通过植入本文所述的构造以形成非天然器官或人造器官,而被非天然器官或人造器官替换。所述非天然器官或人造器官包括所述受试者接受所述结构的自体或非自体细胞。在植入的初始阶段和以后有限时间内,所述结构由可生物降解支架接种的细胞组成,但所述支架降解后,非天然器官或人造器官将不包含合成成分,如支架。所述非天然器官或人工器官已形成所述植入结构。在另外一个实施方案中,非天然器官或人造器官形成的植入结构,包括但不限于,膀胱扩大结构、膀胱替换结构、泌尿导管结构、肌肉等价结构、呼吸组织构造、胃肠组织构造、或血管结构。在所有实施方案中,本发明的所述方法进一步包括将所述管腔器官或组织构造用所述受试者的网膜、肠系膜、肌肉筋膜、和/或腹膜包装的步骤,以允许血管形成。在一个实施方案中,所述支架、细胞群体、以及本文所描述的方法还可进一步用于本文所述疾病的治疗中有用药物的所述制备。所述疾病包括受试者中所需的层状组织管腔器官或组织构造的再生、重建、增加或替换的任何病症。在另一实施方案中,在植入结构上沉积的所述细胞产生MCP-1,并在植入位点释放,刺激天然骨髓间充质干细胞(MSC)向植入位点迁移。在另一实施方案中,所述天然骨髓间充质干细胞促进和/或增强在所述植入位点的所述植入构造的再生。如上所述,本发明的所述结构可含有需要治疗的受试者的非自体细胞群体。此外,在不使用支架的情况下,本发明的所述细胞群体可以给有疾病的受试者施用。那些在本领域的普通技术人员将理解合适的植入方法。所述非自体细胞群体可能为同种异体的或同源的。在一个实施方案中,在不需要免疫抑制剂的情况下,任何含有非自体细胞的结构和/或细胞本身可以给有需要的受试者施用。所述免疫抑制剂,包括但不限于,硫唑嘌呤、环磷酰胺、咪唑立宾、环孢素、他克莫司水合物、苯丁酸氮芥、氯苯扎利二钠、金诺芬、前列地尔、盐酸胍立莫司(GusperimusHydrochloride)、biosynsorb、鼠单克隆抗体、alefacept、喷司他丁、达利珠单抗、西罗莫司、霉酚酸酯、leflonomide、巴利昔单抗、dornaseα、bindarid、克拉屈滨、吡美莫司、伊洛白介素、西利珠单抗、依法利珠单抗、依维莫司、阿尼莫司、gavilimomab、法拉莫单抗、氯法拉滨、雷帕霉素、siplizumab、saireito、LDP-03、CD4、SR-43551、SK&F-106615、IDEC-114、IDEC-131、FTY-720、TSK-204、LF-080299、A-86281、A-802715、GVH-313、HMR-1279、ZD-7349、IPL-423323、CBP-101、MT-1345、CNI-1493、CBP-2011、J-695、LJP-920、L-732531、ABX-RB2、AP-1903、IDPS、BMS-205820、BMS-224818、CTLA4-lg、ER-49890、ER-38925、ISAtx-247、RDP-58、PNU-156804、LJP-1082、TMC-95A、TV-4710、PTR-262-MG,和AGI-1096(见美国专利号7563822)。那些在本领域的普通技术人员将会理解其它不需要的免疫抑制剂。在另一方面中,本发明提供了在植入新器官或组织构造后的预后评价方法。在一个实施方案中,本发明包括下述步骤(a)检测在从所述受试者获得的测试样品中的MCP-1的表达水平;(b)测定MCP-1表达在测试样品中相对于对照样品(或者对照参考值)的表达水平;以及(c)基于对MCP-1表达水平的测定,预测所述患者的再生的预后,其中MCP-1在所述测试样品中有较高水平的表达,相对于所述对照样品(或对照参考值),是在所述受试者中再生的预后。在另一方面中,本发明提供了患者的预后评价方法(在所述患者中植入新的器官或组织构造后),所述方法包括:(a)获得患者生物样品;以及(b)检测在所述生物样品中的MCP-1表达,其中MCP-1表达是在所述患者中再生的预后。在一些实施方案中,在所述患者生物样品中相对于对照样品(或对照参考值)增加的MCP-1表达,是在所述患者中再生的预后。在一些实施方案中,在所述患者样品中相对于所述对照样品(或对照参考值)降低的MCP-1表达,与所述患者中再生的预后无关。所述患者样品可能是包括体液,例如血液或者尿液。在一些实施方案中,所述测定步骤包括利用由合适的处理器为以下所述目的而执行的软件程序:(i)测量在测试样品和对照中的MCP-1表达的差异水平;和/或(ii)对从在测试样品和对照中测量的MCP-1表达差异水平进行分析。在现有技术中已知的合适的软件和处理器是可以商业获得的。所述程序可以体现储存在有形媒介上的软件中,所述有形媒介例如CD-ROM、软盘、硬盘驱动器、DVD或者与所述处理器关联的存储器,但是本领域普通技术人员可以理解所述整个程序或者其部分可以选择性地由处理器以外的其它装置执行,和/或体现在固件中,和/或以已知的方式体现在硬件中。在所述测定步骤后,所述测量结果、发现、诊断、预期和/或治疗建议通常被记录和传达给技术人员,例如医生和/或患者。在某些实施方案中,计算机将被用于将这种信息传递给有关各方,如患者和/或主诊医生。在一些实施方案中,执行试验或试验结果的分析在国家或司法管辖区(其与所述结果或诊断被传达的国家或司法管辖区不同)进行。在优选的实施方案中,根据在测试受试者中测量的所述MCP-1表达水平而作出的预后、预期和/或治疗建议尽可能快地传达给所述受试者,在完成所述分析以及形成所述预后和/或预期后。所述结果和/或相关信息可以通过所述受试者的治疗医生传达给所述受试者。可选择地,所述结果可以直接传达给测试受试者,通过任何传达方式,包括书面、电子形式的通讯(如电子邮件,或电话)。通过使用计算机(例如电子邮件通信),可以促进通信。在某些实施方案中,含有预后测试结果、和/或来自所述测试的结论、和/或基于所述测试的治疗建议的通信,可以形成和自动传递给所述受试者,使用计算机硬件和软件,这对在电信学领域的技术人员是熟悉的。医疗保健为主的通信系统的一个实施例的描述参见于美国专利号6,283,761;尽管如此,本发明不限于利用这种特定通信系统的方法。在本发明方法的某些实施方案中,本方法步骤的所有的或者一些,包括样品检测、再生的预后和/或预期,并且检测结果或预后的通信,可以在不同的司法权管辖区(例如外国)进行。在另一方面中,本文描述的所述预后方法给所述移植成功的各相关方提供了信息、以及再生的康复/治疗方案。在一个实施方案中,所述方法包括检测在来自所述受试者的测试样品中的MCP-1表达水平的步骤;(b)测定在所述测试样品中,MCP-1表达相对于对照样品(或者对照参考值)的表达水平;以及(c)基于所述MCP-1表达水平的测定,预测所述患者再生的预后,其中在所述测试样品中MCP-1表达的较高水平(相对于所述对照样品(或对照参考值)),是新呼吸组织再生的指示状态。如本文所描述的,“再生预后”或者“再生的预后”,通常是指植入本文所描述的结构后的可能过程或结果的预测或预期。在一个实施方案中,再生预后包括以下的一种或多种的预测或预期:在通过植入本文所描述的结构以替换膀胱或扩大膀胱后的膀胱功能的发育或改善;在植入本文所描述的结构后,膀胱容量或者改良后的膀胱容量的发育;或者在植入本文所描述的结构后膀胱顺应性或改良后的膀胱顺应性的发育;在植入本文所描述的组织结构后(在重建、扩大或者替换的胃肠道组织后),胃肠道(GI)功能或者GI容量的发育;在通过植入本文所描述的结构以替换或扩大呼吸组织后,功能性肺脏的发育或完善;或者在植入本文所描述结构后肺脏容量或者改良的肺脏容量的发育。如本文所描述的,“再生的组织”是指新组织构造的所述组织,其在植入本文所描述的结构后发育。所述再生的结构可以是膀胱或者膀胱的部分、尿道管、胃肠组织、或者全肺或肺部分。所述再生的组织可以包括具有基本的平滑肌的连续尿道上皮。在所有的实施方案中,本发明涉及的方法为有需要的受试者提供了新的器官或组织构造,包括植入后监测步骤。在一个实施方案中,为如本文所描述的有需要治疗的受试者提供器官或组织构造的方法可以包括如本文所描述的再生的预后评价的植入后步骤。在另一个实施方案中,监测植入后结构的所述功效和性能,例如通过在植入后不同时间点的超声成像、肾盂造影、以及尿液和血液分析。在一个实施方案中,所述支架、细胞群体、结构和本文所描述的方法可以进一步用于制备药物,所述药物用于本文所描述疾病的治疗。所述疾病包括在受试者中需要再生、重建、扩大或者替换天然管腔器官或组织构造的任何病情。所述器官或组织构造可以是层状组织的。B.使用泌尿系统器官和组织构造结构本发明提供用于所述泌尿系统的天然管腔器官或组织构造的重建、替换、扩大,或再生的结构的使用方法。所述泌尿系统的所述器官或组织构造,也可以被称为为泌尿生殖道或泌尿生殖道器官或组织构造。所述天然器官或组织构造可能为层状组织。在另一方面,本发明提供了为有需要的受试者提供新膀胱其部分的方法。在一个实施方案中,所述方法包括:a)提供生物相容性合成的或天然的聚合物模型,其被形成以符合膀胱或其部分;b)在所述聚合物模型第一区域上或其内部,沉积所述受试者的非自体细胞群体,并且所述细胞群体不是源自所述受试者的膀胱;以及c)在受试者中植入合适的聚合物模型细胞结构以形成新膀胱或其部分。在另一实施方案中,本方法所述步骤b)的所述细胞群体,其含有一种或多种具有收缩功能的外周血来源的平滑肌细胞,其对平滑肌细胞的标记物为阳性,或步骤b)所述的细胞群体,其含有一种或多种具有收缩功能的脂肪组织来源的平滑肌细胞,其对平滑肌细胞的标记物为阳性。在另外一个实施例中,所述收缩功能的细胞群体是钙依赖性的。在所有的实施方案中,本发明的所述方法利用植入结构基于膀胱替换支架、膀胱增大支架、膀胱导管支架,或逼尿肌等价支架,其已经接了种本文所述的细胞群体。在所有实施方案中,本发明的所述方法进一步包括用所述受试者的网膜、肠系膜、肌肉筋膜,和/或腹膜将所述植入结构包裹的步骤,以允许血管形成。当植入本文所描述的任何泌尿系统结构时,可使用所述包裹步骤。所述器官或组织构造为膀胱或膀胱的部分。在另外一个实施方案中,形成所述层状组织管腔器官或组织构造在体内表现出天然膀胱组织的顺应性。在另一方面,本发明提供了用于为有需要的受试者中有缺陷膀胱提供尿流改道或导管的方法。在一个实施方案中,为有需要的受试者提供尿流改道的方法包括下列步骤:(a)提供生物相容性导管支架;(b)在所述支架的第一区域上或其内部,沉积所述受试者非自体的第一细胞群体,所述第一细胞群体基本上为肌肉细胞群体;及(c)在所述受试者中植入步骤(b)中的所述支架,并可以形成管道,允许尿液从所述受试者排出。在另一实施方案中,所述生物相容性材料是可生物降解的。在其它实施方案中,所述生物相容材料为聚乙醇酸。在又一实施方案中,所述第一细胞群体基本上为平滑肌细胞群体。在一个实施方案中,所述方法包括如本文所述的提供尿流改道或导管支架的步骤。在其它附加的实施方案中,所述尿流改道或导管支架在多个部分中提供,如本文所述的第一、第二,和第三支架。在另一实施方案中,所述方法进一步包括沉积细胞群体的步骤,其不是源自所述有缺陷的膀胱以形成尿流改道或导管结构。在另一实施方案中,所述沉积步骤可包括在所述支架上培养所述细胞群体。在一些实施方案中,所述方法进一步包括在有需要的患者中植入所述尿流改道结构的步骤。在另一实施方案中,所述植入在所述有缺陷膀胱的所述部位。在一个实施方案中,所述结构的开口端(例如,配置连接到腹壁的第一端)与所述皮肤(造口)相吻合,通过所述腹部或耻骨壁,以形成造口或括约肌。在另一实施方案中,通过造口开口插入导管并进入所述结构的管腔以提供尿液流出。图11A-B示出了植入的导管结构的形态。在另一实施方案中,本发明的所述方法进一步包括所述步骤:在植入尿流改道结构后,监测所述导管阻塞物的存在。所述阻塞物可能由所述积聚的碎屑引起。所述方法可进一步包括以下步骤:如果检测到阻塞物,从所述导管的管腔中除去阻塞物(例如,清创术)。在一方面中,本发明在临时的基础上为有需要的受试者提供了尿流改道。在一个实施方案中,临时尿流改道或导管结构被植入到受试者体内,以形成造口开口,而且暂时通过造口将导管或其它设备插入到所述导管结构的管腔。临时管道提供了允许尿液从受试者排除的优势为,同时也尝试了长期解决有缺陷的膀胱问题。例如,可在植入接种有细胞群体(例如,见Bertram等,同上文)的新膀胱结构之前、之后或同步进行导管结构的所述植入。图11B显示了植入临时尿流改道结构组分的实施例。在一个实施方案中,本发明的所述方法进一步包括用所述受试者的网膜、肠系膜、肌肉筋膜,和/或腹膜将所述植入的尿流改道包裹的步骤,以允许血管形成。在一方面中,本发明为有需要的受试者提供了永久性基础上的尿流改道。图13示出了永久性尿流改道结构的所述植入组分的实施例。在一个实施方案中,本文所述的结构可用于前列腺尿道替换和尿流改道。对于需要根治性前列腺切除术以去除前列腺尿道的受试者而言,此过程是必要的。在其它实施方案中,所述结构可用做经皮导流管,以形成阀样扭结的可控导管。在一个额外的实施方案中,所述结构可用于膀胱颈部吊索和包裹材料,所述包裹材料在膀胱颈手术和具有可控渠道或导尿开口的泌尿出口中使用。此实施方案中的实施例见图14中所示。尿液通过尿道口离开身体,所述尿道口为独特结构,其包含防止开口发生局部和/或上行性感染的功能,在女性阴道前庭及男性舟状窝排空。具体而言,此区域的所述皮肤黏膜为非角化的复层鳞状上皮,包含糖原丰富的细胞,以提供保护的内源性底物乳酸菌菌群。另外,作为所述上皮接近所述皮肤,其与酸磷酸酶活性和溶菌酶等免疫反应性相联系,指示分泌杀菌化合物(HolsteinAF等,(1991)CellTissueRes264:23)的巨噬细胞的存在。在一方面中,本文所述的尿流改道或新的泌尿导管(NUC)结构可导致形成尿道黏膜和皮肤上皮之间的天然过渡,其具有在天然尿道中观察到的上皮黏膜区的结构特点。所述过渡区域可作为上皮黏膜。在一个实施方案中,所述结构适于在植入体上以形成上皮黏膜。在一个实施方案中,所述上皮黏膜包括前庭区和上皮黏膜区。在另一实施方案中,所述前庭区与上皮黏膜区相邻。在另一实施方案中,所述上皮黏膜区位于所述结构的基质端部,连接到所述受试者的腹壁和皮肤。在一般情况下,天然存在的上皮黏膜区的特征在于:存在黏膜和皮肤,以及通常存在于身体孔的附近,其中所述外部皮肤端和黏膜覆盖所述身体开始的所述内部。在将尿流改道的第一末端植入到所述受试者后,由本发明方法和所述构建体提供的上皮黏膜形成。在进一步的实施方案中,所述上皮黏膜的特征在于:存在上皮细胞,其第一次出现在所述前庭区并通过所述上皮黏膜区朝所述结构的造口端逐渐扩大或增大。在另一实施方案中,所述上皮细胞的特征在于:表达上皮细胞标记物。在进一步的实施方案中,所述上皮细胞标志为细胞角蛋白。所述细胞角蛋白为一个或多个本领域中已知的细胞角蛋白,包括但不限于,细胞角蛋白1至19。在另外一个实施方案中,用anti-pancytokeratin(AE-1/AE3)抗体和/或细胞角蛋白7(CK-7)的抗体来检测所述细胞角蛋白。表5.4和图15显示植入的尿流改道或导管实施例的不同区域。第5和6切片对应于(i)所述颅端:所述导管的造口、颅、和中间部分,及(ii)所述尾端:分别为所述导管剩余中间部分和所述左/右输尿管导管联接处。在又一实施方案中,上皮覆盖所述导管尾节的管腔表面,其对为CK-7阳性,如抗-CK-7抗体(例如,第6切片)检测到的。在一个其它的实施方案中,上皮覆盖颅的管腔表面和所述导管的中间方面,其对CK-7为阴性,如抗-CK-7抗体(例如,第5切片)检测到的。在一个实施方案中,上皮覆盖所述导管尾部分的管腔表面,其对AE1/AE3(例如,第6切片)为阳性。在另一实施方案中,上皮细胞覆盖所述导管的颅和中间方面的管腔表面,其对AE1/AE3为阴性,如抗AE1/AE3抗体(例如,第5切片)检测到的。另一方面,所述尿流改道,其特征在于由平滑肌细胞(SMC)标记物表达。在一个实施方案中,所述SMC标记物为α-平滑肌肌动蛋白(SMA)和/或调宁蛋白。在另一实施方案中,所述SMC标记用抗α-平滑肌肌动蛋白(SMA)抗体和/或抗调宁蛋白抗体检测。在另外一个实施方案中,在所述导管的尾部区域的所述导管壁或外表面组分对SMA为阳性,如抗-SMA的抗体(例如,第6切片)检测的。在另一实施方案中,(在所述颅端的和中间的导管节的)所述导管壁或外表面组分对SMA为阴性,如抗-SMA抗体(例如,第5切片)检测到的。在另外一个实施方案中,在所述导管的尾部区域的所述导管壁或外表面组分对调宁蛋白为阳性,如抗调宁蛋白的抗体(例如,第6切片)检测的。在一个其它的实施方案中,在所述颅端的和中间的导管节的导管壁或外表面组分对调宁蛋白为阴性,如抗调宁蛋白抗体(例如,第5切片)检测的。本文所述结构有能力形成上皮黏膜,提供了通过腹壁造口实现尿流改道的重大挑战的解决方案。经皮设备的所述寿命往往受出口部位感染(KnabeC等(1999)Biomaterials20:503)而受到妨碍,这是可以接受的。经皮设备,如导管、插管,假肢附件和葡萄糖传感器,无论其拟定的医疗目标如何,渗透所述皮肤,破坏其保护屏障,并产生细菌入侵(IsenhathSN等(2007)JBiomedMaterResA83:915)的窦道。因愈合不良,缺乏的生物相容性,或机械应力分布损坏产生的皮肤表皮,可能会导致更多的失败风险(vonRecumAFandParkJB.(1981)CritRevBioeng5:37)。另一方面,所述尿流改道结构通过与接受者的组织相互作用,再生管状类器官。在一个实施方案中,与所述接受者组织的相互作用的所述结构是通过经腹放置进行的。在另外一个实施方案中,所述管状类器官允许尿液从所述输尿管流出接受者体外。尿液流出接受者体外的同时保持天然的功能特性,所述天然的功能特性在膀胱、尿道和造口(即,尿道口或开口)中发现的。所述黏膜皮肤联接处类似于在所述在前尿道开口发现的联接处;分别在所述人类女性的所述阴道前庭和男性的舟状窝。这些天然的联接处被黏膜区覆盖,关键的湿-干表面可以提供防止上行性感染的保护。这些黏膜区域的所述鳞状上皮为1)糖原丰富的,2)分泌的(能够释放酶和杀菌剂),和3)噬菌的;并能迅速迁移到受伤表面。在一方面中,本发明为有需要的受试者提供了皮肤黏膜联接(MCJ)的方法。所述MCJ类似于天然存在的上皮黏膜区,其特征在于,存在黏膜和皮肤,其通常存在于所述身体的孔口附近,其中所述外部皮肤两端和所述黏膜覆盖所述身体开始的内部。在一个实施方案中,所述方法包括所述步骤:提供由本文所述的支架和本文描述的细胞群体组成的结构。在另一实施方案中,所述方法进一步包括所述步骤:给有需要所述结构的受试者施用适于暴露于空气的第一部分(例如,管状结构的第一端)和不暴露于空气中的第二部分(例如,管状结构的第二端),使得植入所述结构后形成MCJ。可以根据实施例中所述的方法或根据本领域认可的方法移植支架至器官或有待扩大的组织。通过将所述移植材料缝合到所述靶器官,可以将所述模型或支架移植到所述受试者的器官或组织。在所有的实施方案中,所述方法提供了尿流改道或导管结构,进一步包括施用网状构造。在另一实施方案中,所述施用步骤包括在皮下脂肪层和骨骼肌之间插入网状构造。在一个实施方案中,所述网状构造皮下植入。在另一实施方案中,在所述第一端和所述腹壁节之间的所述结合位点植入所述网格结构。在另一实施方案中,植入本文所述的尿流改道结构后,所述网状构造有利于形成新的泌尿导管。在另外一个实施方案中,所述网状构造提供了造口的通畅。在一个优选的实施方案中,所述网状构造为疝气补丁,优选为皮下疝补丁。在另外一个实施方案中,所述网状构造适于施用于有肠症风险的受试者。例如,如果所述小肠的一部分位于选定的腹壁开口上,由于与通过所述肠道的食物通路蠕动相关,所述肠道可能突出朝向或通过所述开口。本
技术领域:
的普通技术人员可以根据检查所述腹壁开口的所述选定位置和所述受试者的肠道,来评估所述受试者是否有肠道突起的风险。进行这样的评估之后,本领域的普通技术人员的人可以确定所述受试者是否应该被施用本文所述的尿流改道结构和网状构造。在一方面中,本发明提供有需要的受试者用于治疗泌尿系统疾病的方法。合适的受试者包括任何单一的人类受试者,如患者,符合治疗,其正在经历或经历过一种或多种症状、病症、或其它器官功能缺陷或失效的指标,包括有缺陷的、损坏的或无功能泌尿系统。在一般情况下,所述受试者为需要再生、重建、扩大,或替换层状组织的管腔器官或组织构造的受试者。此受试者包括但不限于,新诊断的或先前诊断及现在遇到复发或再发,或有缺乏器官功能或失效的风险,无论所述原因如何。所述受试者可能先前已经接受器官功能不足或失效病症的治疗,或未经治疗。受试者可能为尿流改道的候选人,包括但不限于,患有膀胱癌而需要膀胱切除术的的受试者,患有神经性膀胱功能障碍而影响肾功能的受试者,患有辐射损伤到所述膀胱的受试者,和患有顽固性失禁的受试者。所述受试者可能被新诊断为需要尿流改道,或先前诊断为需要尿流改道而现在遇到并发症,或有缺陷、损坏或非功能性泌尿系统的风险,无论所述原因如何。所述受试者以前可能已治疗过泌尿系统相关的缺陷、损坏或无功能病症,或未经治疗。本文所述的所述细胞群体所述受试者的非自体。所述技术也可以用于扩大需要这种治疗的患者现有的层状组织管腔器官或组织构造。例如,可通过提供聚合物模型或支架来扩大现有的层状组织管腔器官或组织构造,其被成形以符合需要治疗的器官或组织构造的至少一部分,并具有足够的腹腔镜的植入大小;在所述聚合物模型的第一区域上或其内部,沉积所述受试者非自体的细胞群体,而且其不是源自相应的器官或组织构造,;以及腹腔镜植入所述成形的聚合物模型结构腹腔镜到所述受试者所述治疗部位,使得现有的层状组织管腔器官或组织构造扩大。图7e描述了用于本文所述的植入肌肉等价支架可能的手术方法。图7f描述了在空虚的和完整膀胱的植入部位。图7g描述了具有手术切口的膀胱模型,示出了在切片表面创建的椭球体。塑料管可用做所述有限空间的模型,以适于通过本发明的折叠或卷的聚合物模型或支架。所述技术也可以用于增加需要这种治疗的患者的膀胱容积。例如,可通过提供生物相容性合成的或天然的聚合物模型来增加膀胱容积,被成形以符合需要所述治疗的器官或组织构造的至少一部分,并具有足够的腹腔镜的植入大小;在所述聚合物模型的第一区域上或其内部,沉积所述受试者非自体的细胞群体,并且其不是源自相应的器官或组织构造(其属于增加容量的所述受试者);以及腹腔镜植入所述合适的聚合物模型结构腹腔镜到所述受试者所述治疗部位,使得膀胱容积增加。在一个实施方案中,所述即时发明的所述模型或支架适合于增加膀胱容积容量约50mL。在其它实施方案中,所述即时发明的所述模型或所述支架适合增加膀胱容积容量约100mL。在其它实施方案中,所述即时发明的所述模型或支架适合于增加膀胱容积容量约60、约70、约80,或约90mL。所述的技术还可进一步用于需要这种治疗的患者膀胱切口部位的扩大。例如,可通过提供生物相容性合成的或天然的聚合物模型来扩大膀胱切口部位,被成形以符合需要所述治疗的器官或组织构造的至少一部分,并具有足够的腹腔镜的植入大小;b)在所述聚合物模型的第一区域上或其内部,沉积所述受试者非自体的细胞群体,并且其不是源自相应的器官或组织构造(其属于增加容量的所述受试者);和c)腹腔镜植入所述合适的聚合物模型结构腹腔镜到所述受试者所述治疗部位,使得所述膀胱切口部位膨胀。本发明的另一非限制性使用包括:在需要此治疗的患者中,用于所述治疗尿失禁的方法。例如,可通过提供生物相容性合成的或天然的聚合物模型来治疗尿失禁,被成形以符合需要所述治疗的器官或组织构造的至少一部分,并具有足够的腹腔镜的植入大小;在所述聚合物模型的第一区域上或其内部,沉积所述受试者非自体的细胞群体,并且其不是源自相应的器官或组织构造(其属于治疗的所述受试者);以及腹腔镜植入所述合适的聚合物模型结构腹腔镜到所述受试者所述治疗部位,使得膀胱容量增加。在另一方面中,本发明涉及用于天然管腔器官或包含非自体来源膀胱源的平滑肌细胞(SMC)的泌尿系统的重建、更换、扩大、或再生的结构的使用方法。所述天然器官或组织构造可为层状组织。非自体的源可以为同种异体源或同源的。在一个优选的实施方案中,所述治疗的方法包括使用结构形成支架和膀胱源的SMC,但无上皮细胞。所述膀胱源的SMC可接种到膀胱扩大、膀胱更换、泌尿导管、或肌肉等价支架上,以形成结构。所述结构包含非自体膀胱源的SMC,可用于本文所述的治疗方法。在另一方面,本发明提供的植入到有需要的受试者后的新膀胱再生方法,其基于生物机械刺激或循环。在一方面中,所述方法适合促进已植入的新膀胱膀胱的所述再生,用于膀胱或膀胱部分的所述扩增或替代。在一个实施方案中,所述新膀胱结构由接种细胞的新膀胱模型或支架形成。在另一实施方案中,所述新膀胱支架为膀胱替代支架、膀胱扩大术支架、膀胱导管支架、或逼尿肌等价支架。在一方面中,本发明的所述方法应用的植入新膀胱的结构从接种至少一种细胞群体的新膀胱支架形成。在一个实施方案中,所述细胞接种的聚合物模型(或模型)为膀胱替换支架、膀胱扩大支架、膀胱导管支架、或逼尿肌等价支架。在一个实施方案中,所述至少一种细胞群体大致包括肌肉细胞群体。在另一实施方案中,所述肌肉细胞群体可以是平滑肌细胞群体。接种不同密度的细胞可能是适当的,如本文所述。在一方面中,本发明的所述方法是在植入新膀胱后,不同时间和不同持续时间进行的。在一个实施方案中,所述循环的进行在:在一段时间的每天,在一段时间的每周,或每隔一周的基础上。在另一实施方案中,所述每天循环方案的持续时间为约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周,或超过14周。循环的示例性协议见实施例18所述。在一个实施方案中,受试者的日常循环协议可能包括所述步骤为:填充所述新膀胱约一小时,排空所述填充的新膀胱约一小时,并允许所述新膀胱排水自如,通常过夜。所述协议可以在所述受试者所述循环方案的一天之内进行。在第一天之后,这种日常序列可以连续进行数日。在一个实施方案中,在一天之后可以进行此循环协议,其中所述填充步骤持续时间增加至约两个小时,约三个小时,或约四个小时,或超过约四个小时。在另一实施方案中,在允许所述新膀胱自由排水之前,所述填充和排空步骤可重复超过每天一次。在另一实施方案中,所述受试者植入后插入导管,并通过夹紧和松开所述受试者的导管来控制所述循环时间。那些在本
技术领域:
的普通技术人员将会理解,本发明仔细考虑的额外的循环方案。循环协议的实施例如下所示。植入后的新膀胱结构(由如本文所述的新膀胱模型或支架接种细胞形成),在植入后约1个月开始每2周(14±2天的间隔)进行循环并持续进行,直到约90天。进行评估特定类型后,但在其它类型,如荧光成像评估之前,将完成循环,如所述植入新膀胱的顺应性测量。在10-25mL/min速率的所述顺应性测量完成后,通过重新用无菌生理盐水(温暖培养箱)膨胀膀胱来进行循环。所述循环将重复至少5-10次。将达到所述起始压力为0-10mmHg,并与所述起始时间一起记录。对每个循环,将会记录时间、传送的等渗溶液的体积、以及获得的所述压力,在导管周围观察的泄漏时间(也称为泄漏点)的时候,或当所述传送的体积等于刚进行的顺应性测量时,无论哪个先达到。在一个实施方案中,本发明提供了在受试者中促进植入的新膀胱再生的方法,其中包括的步骤为(a)在所述植入的新膀胱中填充流体;(b)排空步骤(a)所述填充的新膀胱。在另一实施方案中,所述方法包括步骤(c)重复步骤(a)和(b)。在另外一个实施方案中,所述方法开始于植入后的前2周。在一个实施方案中,所述步骤(a)和(b)每天、每周、或每隔一周进行。在一些其它实施方案中,约一小时进行所述填充步骤(a),及约一小时进行所述排空步骤(b)。在又一实施方案中,直到植入约至少6周后进行步骤a)和b)。在另外一个实施方案中,植入不超过10周后进行步骤a)和b)。在另一实施方案中,植入超过约10周后进行步骤a)和b)。在其它实施方案中,所述填充包括扩大所述新膀胱。在另一实施方案中,与受试者中未发生循环的新膀胱相比,所述再生包括增加所述新膀胱的容量。在一个实施方案中,与受试者中未发生循环的新膀胱相比,所述再生包括增加所述新膀胱顺应性。在其它实施方案中,与受试者中未发生循环的新膀胱相比,所述再生包括增加在所述新膀胱中胞外模型发育。在一个实施方案中,所述增加外模型发育包括所述弹性蛋白纤维的发育。另一方面,本发明涉及的方法用于提供哺乳动物新膀胱的稳态调控发育,使得植入的新膀胱响应于所述接受者需要。在一个实施方案中,植入的新膀胱的增长大小与接受者相称。在另一实施方案中,所述方法提供受试者新膀胱的稳态调控发育,包括步骤:(a)提供生物相容性聚合物支架;(b)在所述支架第一区域上或内部沉积第一细胞群体,所述第一细胞群体基本上为肌肉细胞群体;及(c)植入步骤(b)的所述支架到所述受试者以建立稳态调控发育。在一个实施方案中,所述稳态调控发育包括恢复器官的大小和结构。在另一实施方案中,所述稳态调控发育包括与体重相称的新膀胱容量。在一个实施方案中,在植入后约4个月,可达到新膀胱容量的所述比例。在另一实施方案中,所述方法提供的在受试者中的新膀胱的稳态调控发育的方法包括以下步骤:监测所述植入的新膀胱的稳态调控发育或发展的所述状态。所述监测可包括膀胱造影的程序以显示植入新膀胱的所述位置和形状,和/或测定尿动力学的顺应性和容量。本发明的所述方法应用于治疗泌尿系统相关疾病的受试者。这些受试者包括任何单一的人类受试者,包括患者、符合治疗条件的,正在经历或经历了一种或多种体征、症状、或其它器官功能不足或缺乏的指标,包括缺陷,损坏的或无功能的泌尿系统。这样的受试者包括但不限于,新诊断或先前诊断的受试者和现在经历复发或旧病复发,或在器官功能不足或缺乏的风险,而不管所述病因如何。所述受试者可能已经先前治疗器官功能不足或缺乏相关的疾病,或未经治疗。受试者可能为尿流改道的候选人,包括但不限于,有膀胱癌而需要全膀胱切除术的受试者,有神经性膀胱功能障碍而影响肾功能的受试者,具有辐射损伤膀胱的受试者,和具有顽固性失禁的受试者。所述受试者可能新诊断为需要尿流改道,或先前诊断为需要尿流改道及现在遇到并发症,或有缺陷,损坏或无功能性泌尿系统的风险,而不管所述病因如何。所述受试者以前可能已经治疗过有缺陷,损坏或无功能泌尿系统的疾病,或未经治疗。C.使用胃肠道组织构造在一方面中,本发明考虑为需要这种治疗的受试者提供GI的器官或GI组织构造的方法。在一个实施方案中,所述GI器官或组织构造可能为层状组织管腔器官或组织构造。在另一实施方案中,所述受试者可能需要重建、扩大,或替换器官或组织。在一个实施方案中,所述方法包括提供生物相容的合成的或天然的聚合物模型的步骤,被形成以符合有需要的器官或组织构造的GI器官或GI组织构造的至少一部分。所述提供步骤可随后沉积至少一种所述受试者自体或非自体的细胞群体(其不是源自对应的GI器官或GI组织构造,所述GI器官或GI组织构造术语所述重建,扩增或替代的所述受试者)。所述沉积步骤可包括在所述聚合物模型上培养所述细胞群体。在所述模型上沉积所述细胞群体以后提供结构,其可以被植入到患者体内需要治疗的位点,以形成所需层状组织的GI器官或GI组织构造。在一个实施方案中,所述层状组织的管腔GI器官或GI组织构造为食管或部分食管或小肠或小肠的一部分。在另一方面,本发明涉及为有需要的受试者提供GI器官或GI组织构造的方法。在一个实施方案中,所述方法包括以下步骤:a)提供生物相容性合成的或天然的聚合物模型,被成形以符合需要所述治疗的GI器官或GI组织构造的至少一部分;b)在所述聚合物模型上或内部沉积的细胞群体(不是源自GI器官或GI组织);和c)在所述受试者中植入所述合适的聚合物模型细胞结构以形成所述GI器官或组织构造。在另一方面,本发明提供了为有需要的受试者提供GI器官或GI组织构造的方法。在一个实施方案中,所述方法包括:a)提供生物相容性合成的或天然的聚合物模型,被形成以符合GI器官或GI组织构造;b)在所述聚合物模型第一区域上或内部,沉积细胞群体(不是源自GI器官或GI组织);以及c)向受试者植入合适的聚合物模型细胞结构以形成GI器官或组织构造。在另一实施方案中,本文所述方法的步骤b)的所述细胞群体包含一个或多个具有收缩功能的外周血来源的平滑肌细胞,其对平滑肌细胞标记物为阳性,或步骤b)中的所述细胞群体,包含一个或多个具有收缩功能的脂肪组织来源的平滑肌细胞,其对平滑肌细胞的标记物为阳性。在另一实施方案中,所述细胞群体生物所述收缩功能为钙依赖性的。在另一方面中,本发明为有需要的受试者中有缺陷的GI系统提供了GI结构的方法。在一个实施方案中,为有需要的受试者提供GI结构的所述方法包括以下步骤:(a)提供生物相容性GI组织支架;(b)在所述支架的第一区域上或内部沉积第一细胞群体,所述第一细胞群体大致为肌肉细胞群体;(c)在受试者中植入步骤(b)的所述支架,以在所述受试者中形成GI组织。所述方法可进一步包括的所述支架的第一区域上或内部沉积第二细胞群体的步骤,和/或使所述第二细胞群体与步骤(b)后沉积的所述第一细胞群体接触。在另一实施方案中,所述生物相容性材料是可生物降解的。在其它实施方案中,生物相容的材料为聚乙醇酸。在又一实施方案中,所述第一细胞群体基本上为平滑肌细胞群体。在另一实施方案中,所述第二细胞群体为GI细胞群体,例如,食管细胞群体,小肠细胞群体,等。在一个实施方案中,本发明的所述方法进一步包括用受试者的网膜、肠系膜、肌肉筋膜,和/或腹膜将所述植入的GI组织构造包裹的步骤,以允许血管形成。在一方面中,本发明考虑本文所述的平滑肌细胞群体在GI-相关疾病的应用。本文也考虑治疗食管相关疾病的方法。所述食管包含平滑肌及在所述受试者中的食管相关疾病为由于不正确功能而具有的缺陷食管,例如,功能失调性食管肌肉。据报道,在施用时,某些细胞群体可能为所述食管提供有益效果(例如,Nakase(2008)见上文)。另一方面,本发明提供了用于治疗GI-相关疾病的方法。所述术语“胃肠道功能疾病”、“GI疾病”、“胃肠道相关疾病”或“GI-相关疾病”是指在由食管、胃、小肠和大肠、肛门括约肌和肛门组成的胃肠道的任何缺陷。所述缺陷可能为发生在胃肠道内任何点的结构缺陷,以及可引起障碍或堵塞的原因,可导致呕吐,以及吞咽困难和排便问题。所述缺陷还可以包括沿胃肠道内的中断或间隙。那些在本
技术领域:
的普通技术人员将会理解,各种GI疾病可能合于用本文所述的结构和方法治疗。在一个实施方案中,所述GI相关疾病的合适治疗为食管相关疾病,包括但不限于,Barrett食管、食管闭锁、长隙食管闭锁、气管食管瘘、气管食管远端瘘闭锁、气管食管近端闭锁及食管气管双瘘闭锁。在另一实施方案中,所述GI相关疾病为进行小肠切除术导致的小肠相关疾病,必要时呈现一定的适应症的患者。例如,个体发生发炎性肠道疾病、创伤、肠系膜血管疾病、肠扭转、先天性闭锁和新生儿坏死性小肠结肠炎而进行大量的切除。此切除的常见的后果为短肠综合症(SBS),这将导致正常养分和流体吸收的中断,包括钙、镁、锌、铁、维生素B12,和脂溶性维生素的缺乏,并且其特征在于,腹泻、脱水、营养吸收不良和随之而来的营养不良。在另一实施方案中,所述GI相关的疾病具有癌症性质,包括但不限于,食管癌、胃癌、肠癌、括约肌癌,或结肠癌。另一方面中,本发明提供了有需要的受试者肠道组织的再生、重建、扩大或替换的方法。在一个实施方案中,所述方法包括施用肠道组织构造的步骤,包括(a)支架;(b)不是自肠道组织的第一细胞群体在所述支架支架的第一表面上或内部沉积;及(c)源自肠道组织的第二细胞群体。在另外一个实施方案中,所述第一细胞群体源自脂肪。在另一实施方案中,所述第一细胞群体为平滑肌细胞(SMC)群。所述SMC群体可能对至少一种平滑肌细胞标记物为阳性。在又一实施方案中,所述第二细胞群体源自食管、小肠、大肠、胃、结肠,或肛门括约肌。在一个实施方案中,所述结构对至少一个胃肠(GI)的组织标记物为阳性。所述GI组织标记物可以为上皮细胞标记物。在另一实施方案中,所述结构包括的细胞具有协调的有节奏的收缩功能。在另外一个实施方案中,所述结构植入后,适于形成肠道组织。在又一实施方案中,所述GI组织为食管、小肠、大肠、胃、结肠,或肛门括约肌组织。在另一实施方案中,所述方法包括在施用步骤之前,从所述受试者中获取一个或多个样品的步骤。在另外一个实施方案中,所述方法包括从所述样品中分离一种或多种细胞群体以及如本文所述的培养步骤。在又一实施方案中,所述方法包括使GI组织支架与一种或多种细胞群体接触的步骤,如本文所述,以形成GI组织构造。在一方面中,本发明提供了本文所述结构的使用,用于有需要的受试者的GI-相关疾病治疗中所用药物的制备。在一个实施方案中,所述结构为食管组织构造,其包括接种平滑肌细胞群体和食管细胞群体的食管组织支架。在另一实施方案中,所述GI相关疾病为食管相关的疾病。在一个实施方案中,所述结构为肠道组织构造,其包括接种平滑肌细胞群体和肠细胞群体的肠组织支架。所述肠细胞群体可源自小肠。在另一实施方案中,所述GI相关的疾病为肠道相关疾病。本发明的所述方法应用于治疗胃肠功能疾病的受试者。这些受试者包括任何单一的人类受试者,包括患者、符合治疗条件的,正在经历或经历了一种或多种体征、症状、或其它胃肠道(GI)功能不足或缺乏的指标,包括缺陷、损坏或无功能的肠道系统。这样的受试者包括但不限于,新诊断或先前诊断的受试者和现在经历复发或旧病复发,或者是GI功能不足或缺乏的风险,而不管所述病因如何。可能已经先前治疗所述受试者胃肠道功能不足或缺乏相关的疾病,或未经治疗。受试者可能为具有GI-相关疾病的候选人,包括但不限于,具有食管相关的疾病,胃相关的疾病,肠相关的疾病,或肛门括约肌相关疾病的受试者。所述受试者可能为新诊断的需要治疗这种疾病,或先前诊断的需要治疗这种疾病而现在遇到并发症,或有缺陷,损坏或非功能食管、胃、肠,肛门括约肌的风险,而不管所述病因如何。所述受试者可能已经先前治疗过缺陷,损坏或非功能性食管、胃、肠,肛门括约肌相关的疾病,或未经治疗。D.使用呼吸组织结构在一方面中,本发明考虑为需要这种治疗的受试者提供呼吸组织构造的方法。在一个实施方案中,所述受试者可能需要重建、再生、扩大,或替换呼吸组织,如肺、肺组织、肺泡组织和支气管组织。在一个实施方案中,所述方法包括提供生物相容性合成的或天然的聚合物模型,被形成以符合所需器官或组织构造的呼吸组织至少一部分的步骤。所述提供步骤之后,在所述模型上沉积不是源自呼吸组织的第一细胞群体。所述第一细胞群体为SMC群体。所述沉积步骤可包括在所述聚合物模型上培养所述第一细胞群体。在所述模型上沉积所述第一细胞群体以后,可在所述模型上沉积第二细胞群体,使其所述模型和/或沉积的第一细胞群体接触,以形成结构。所述第二细胞群体可以为呼吸细胞群体。所述结构可能为呼吸结构,其可被植入到患者体内的治疗位点,以形成所述所需的呼吸组织构造。在一个实施方案中,所述呼吸组织构造为肺的一部分。在一个实施方案中,所述第一和/或所述第二细胞群体为所需治疗受试者自体同源的。在另一实施方案中,所述第一和/或所述第二细胞群体为所需治疗受试者非自体同源的。在另一方面中,本发明提供了有需要的受试者呼吸组织的再生、重建、扩大或替换的方法。在一个实施方案中,所述方法包括施用呼吸组织结构的步骤,包括(a)支架;(b)不是源自呼吸组织的第一细胞群体在所述支架支架的第一表面上或内部沉积;及(c)源自呼吸组织的第二细胞群体。本发明提供的支架适于形成呼吸组织结构,例如,接种细胞的呼吸组织支架。在一个实施方案中,所述支架包括如本文所述的细胞群体。在另一实施方案中,所述支架包括源自脂肪的SMC群体和呼吸细胞群体。在另一实施方案中,所述支架基本上由脂肪来源的SMC群体和呼吸细胞群体组成,如本文所述。在另外一个实施方案中,所述支架由源自脂肪的SMC群体和呼吸细胞群体组成,如本文所述。所述细胞群体可能为所述受试者的自体或非自体。在另一实施方案中,所述细胞沉积在植入的结构上产生MCP-1并在植入位点释放。MCP-1可刺激天然间充质干细胞(MSC)移植到植入位点。在另外一个实施方案中,所述天然MSCs可促进和/或增强所述植入结构在所述植入位点的再生。在一个实施方案中,所述沉积的细胞群体为如本文所述的源自脂肪组织的平滑肌细胞(SMC)群体。在另一实施方案中,所述SMC群体包括至少一个具有收缩功能及对平滑肌细胞标记物为阳性的细胞,如心肌素、α-平滑肌肌动蛋白、调宁蛋白、肌球蛋白重链、BAALC、结蛋白、肌成纤维细胞抗原、SM22,及其任意组合。在其它实施方案中,所述SMC群体包括至少一个论证为心肌素(MYOCD)表达的细胞。所述MYOCD表达可能为编码MYCOD多肽的核酸或MYOCD多肽的表达。在另一实施方案中,所述SMC的所述收缩功能为钙依赖。在另一实施方案中,所述聚合物模型中植入脂肪来源的SMC群体和呼吸细胞群体。在所有的实施方案中,本发明的所述方法利用结构进行植入,所述结构根据已接种如本文所述细胞群体的呼吸组织支架。在另一实施方案中,本文所述的呼吸组织的再生、重建、扩大或替换的所述方法包括步骤:a)提供生物相容性合成的或天然的聚合物模型,被形成以符合所需治疗受试者所述呼吸组织的至少一部分;b)在所述聚合物模型的第一区域上或内部沉积第一细胞群体,其细胞密度如本文所述所,所述第一细胞群体基本上为SMC群体;c)在所述聚合物模型的第二区域上或内部沉积第二细胞群体(和/或接触所述沉积的第一细胞群体),其细胞密度如本文所述;以及d)在受试者所述治疗位点植入所述合适的聚合物模型细胞结构,用于形成所述呼吸组织构造。在另外一个实施方案中,在体内形成的所述呼吸组织构造显示出自然呼吸组织的行为。在另外一个实施方案中,所述呼吸组织构造显示出协调有节奏的收缩功能。在一方面中,本发明的方法适用于植入的呼吸组织结构,所述呼吸组织结构由接种呼吸组织支架接种第一和第二细胞群体形成。在一个实施方案中,所述第一细胞群体为脂肪来源的平滑肌细胞群体,以及所述第二细胞群体为呼吸道细胞群体。不同密度的细胞接种可以是适当的,如本文所述。在另一实施方案中,本发明的所述平滑肌细胞群体可以施用于具有呼吸疾病的受试者,而无需使用支架,如通过移植物移入。那些在本领域的普通技术人员将理解合适的移植物移入的方法。本发明的方法应用于治疗具有呼吸系统疾病的受试者。气道平滑肌存在于大多数脊椎动物的支气管枝中。患有呼吸系统疾病的受试者由于肺肌肉的功能不当,具有缺陷的呼吸道系统。据报道,某些细胞群体施用于肺时,可以提供有益的影响(例如,Ohnishi等,IntJChronObstructPulmonDis.2008December;3(4):509-514)。患有肺癌的个体也可从中受益。可以通过本文所述的治疗方法受益的受试者包括任何单一的人类受试者(包括符合治疗的患者),其正在经历或已经经历了一种或多种症状、病症、或其它呼吸功能不足或故障的指标,包括不足、损坏或者非功能性呼吸系统。这样的受试者包括但不限于,新诊断的或先前诊断的以及现在遇到反复或复发,或者是具有呼吸功能缺乏或故障的风险,无论所述病因如何。所述受试者可能已经被治疗呼吸功能不足的或故障的相关病症,或未经治疗。受试者可能是患有肺相关疾病的候选人,包括但不限于,受试者患有慢性阻塞性肺疾病(COPD)(即,慢性支气管炎,肺气肿)、肺癌、特发性肺纤维化(IPF)、哮喘、阻塞性和限制性气道疾病、肺发育不良(例如,早产)。所述受试者可能是新诊断的为需要治疗肺相关疾病的,或以前诊断为需要治疗肺相关疾病的而现在遇到并发症,或有不足、损坏或非功能肺的风险,无论所述病因如何。所述受试者以前可能已经治疗过不足、损坏或非功能肺的相关疾病,或未经治疗。E.使用血管结构所述血管支架和结构可以在需要其的受试者中治疗心血管疾病的方法中使用。在一个实施方案中,该方法包括植入血管结构的步骤。在另一个实施方案中,所述血管结构可以包括:a)生物相容性管状支架,具有第一和第二表面;以及b)源自非血管来源的第一细胞群,在所述支架第一表面上或其内部沉积。在一个实施方案中,所述第一细胞群为平滑肌细胞群。治疗心血管疾病的所述方法,可以包括识别有需要的受试者的步骤。可从所述受试者中获得一个或多个活检或样品。在另一实施方案中,所述方法包括以下步骤:从所述样品中分离一个或多个细胞群,并在支架上培养一个或多个细胞群,以提供结构或TEBV。在另一实施方案中,所述培养包括在生物反应器中细胞接种的支架的调节。在一个实施方案中,所述调节包括在生物反应器中稳定的和/或脉动的流体。在另一实施方案中,该方法包括所述细胞接种的移植,调节TEBV到需要治疗所述心血管疾病或病症的受试者中。那些在本领域的普通技术人员将会理解,适合于由本发明方法治疗的各种心血管疾病。在一般情况下,所述心血管疾病为可以受益于通道形成或在两个天然血管之间的吻合术的疾病,其中血液从第一天然血管直接被分流到第二天然血管。例如,所述第一天然血管可以为动脉以及所述第二天然血管可以为静脉,如在动静脉(AV)分流术的情况下。在本发明的方法和结构也可以适用于多种其它分流术,包括但不限于,Blalock-Taussig分流术,心血管分流术,左到右的分流术,从右到左的分流术,一个LaVeen腹腔静脉分流术、门腔静脉分流术、和脾肾静脉分流术。在另一实施方案中,本发明提供本文所述的TE支架和/或TEBV的使用,用于制备在有需要的受试者的心血管疾病的治疗中有用的药物。所述支架还提供了在制备血管结构中的使用。所述血管结构用于治疗心血管疾病。本发明的方法应用于治疗患有心血管疾病的受试者。这些受试者包括任何单一的人类受试者(包括符合治疗的患者),其正在经历或已经经历了一种或多种症状、病症、或其它心血管功能不足或故障的指标。这些受试者包括但不限于,新诊断或以前诊断的受试者,而现在遇到了反复或复发,或具有心血管功能不足或故障的风险,无论所述病因如何。所述受试者可能已经先前治疗过与心血管功能不足或故障相关的疾病,或未经治疗。以下提供的实施例仅用于说明的目的,并且不打算以任何方式限制本发明的范围。本说明书中引用的所有专利、专利申请、和参考文献其全部内容通过引用的方式纳入本文。实施例实施例1-外周血和脂肪组织作为SMC的来源源自血液的细胞如在Ludlow等,美国出版专利申请号20100131075(其整体通过引用的方式纳入本文)中描述的,已经成功地将平滑肌细胞从犬、猪和人类外周血分离。在实施例1中描述的所有结果可以在Ludlow等中找到。简而言之,50ml的外周血与磷酸盐缓冲盐水1:1的稀释液(PBS;100mL的终体积)被制备,并在Histopaque(一种密度梯度材料)上分层,并在1,354xg、室温下离心20分钟。在离心后,按照梯度密度清楚地界定四层(从顶部到底部):血清、血沉棕黄层、Histopaque和红血球。单核细胞位于血沉棕黄层中,它显示为不透明的白色/灰色带。所述血沉棕黄层被回收,并转移到单独的50ml锥形管中。用PBS稀释到50mL。在711xg、室温离心所述样品10分钟,以沉淀细胞。使小球重悬并培养所述细胞。当通过随后的细胞传代达到合适的细胞数目时,将部分样品固定并终点分析处理,包括平滑肌细胞蛋白质的免疫检测表达、平滑肌细胞mRNA转录的核酸检测、细胞收缩、细胞因子和酶的合成。结果培养基选择。将单一的40-50mL犬外周血样品的单核部分在六种不同的培养基配方中重悬,并接种到6-孔Primaria或胶原蛋白涂层平板中。在培养一周后,在所有条件中(DMEM培养基分离体没有显示)观察到小的粘附集落和小细胞聚集体,但是细胞类型的特征是难以辨别的。小的集落和细胞聚集体在Primaria培养皿观察到,当在α-MEM+10%FBS、具有所有随附补充剂的EGM-2培养基、具有选定的随附补充剂的EGM-2(没有VEGF和FGF2)中生长,以及I型胶原蛋白涂覆的组织培养塑料板(在相同的培养基中生长)。在外周血培养物(在DMEM配方中生长)中观察到相似的结果。在培养两周后,在α-MEM中在Primaria和胶原蛋白涂层平板上,观察到生长集落和小单层。从形态学看,这些集落出现平滑肌或者内皮。平滑肌或内皮生长集落的形态也在其它培养基/基质条件下形成。一些巨噬细胞最初保持在α-MEM中,但并没有延续到随后的传代中。在具有10%FBS的αMEM中,在Primaria平板上分离的细胞为平滑肌或巨噬细胞形态。在这些条件下分离的没有内皮细胞。在αMEM/10%FBS中的I型胶原平板上分离的细胞是平滑肌、内皮和巨噬细胞形态。其他培养基/基质配方(如EGM-2和补充20%FBS的DMEM)也允许生长出间充质细胞和内皮样细胞。在这12种培养基/基质条件下,具有α-MEM/10%FBS的Primaria平板含有最均质的平滑肌细胞分离群,不含内皮细胞的生长集落。细胞在Primaria平板上分离,并在Nunclon表面(在α-MEM/10%FBS中)上扩展,展示了经典的“丘陵和山谷”的形态,这是典型的平滑肌细胞(SMC),并与在其他研究中的描述是一致(Kassis等(2006);Koerner等(2006);Simper等(2002),上文)。这些细胞也维持这种形态几个传代。如在Ludlow等(美国专利申请号20100131075)的图16中所示的,猪颈动脉SMC(H)和狗膀胱SMC(I)中的图像被示出进行比较。后期传代的平滑肌细胞(F,G)变得更大,更加蔓延,看起来更像成熟的SMC。早期的传代(A-E)与从猪颈动脉(H)和狗膀胱SMC(I)分离的平滑肌细胞(SMC)相似。平滑肌细胞的后期传代(F,G)更大,并且更加蔓延;表示了平滑肌的表型。源自脂肪的细胞按照下面的步骤,已经从猪脂肪组织分离出平滑肌细胞。所有的步骤在生物安全罩中进行。获得脂肪样品。在生物安全容器中使用之前,在室温或4℃贮存不超过24小时。制备胶原酶溶液,通过在每100ml的PBS中添加lgm的BSA和0.lgm的胶原酶。通过0.2μm过滤装置过滤所述溶液。加热至37℃。每个脂肪体积添加等量体积的胶原酶溶液到离心瓶中。需要1个组织体积的胶原酶溶液(即,10ml的胶原酶溶液,每10ml脂肪组织)。用消毒剂擦拭管子、加盖、石蜡膜包裹,并放置在37℃摇床上的培养器中60分钟。在300xg、室温离心5分钟。将管子从离心机取出,剧烈震动它们10秒,以彻底地混合所述细胞。这是完成从原代脂肪细胞分离基质细胞。再次离心300xg,5分钟。小心吸在上面的油,原代脂肪细胞(黄色层的浮动细胞)和胶原酶溶液。留下在沉淀上的约10ml棕色胶原酶溶液,使基质血管部分(底部的暗红色细胞)不被干扰。在含1%BSA的PBS和过滤器(使用Steri-Flip)中重悬所述沉淀细胞。在300xg离心所述细胞5分钟,并吸去剩余的胶原酶溶液。当抽吸时,所述移液管的前端应该从顶部吸取,使所述油尽可能彻底地除去。所述细胞沉淀应紧密地塞满在底部。添加10ml的组织培养基到每个离心管中,并重悬所述细胞。收集所述细胞到一支管中,并再次离心。吸出上清液。使所述细胞悬浮在10毫升培养基中。根据适当数量的烧瓶,将所述细胞平均分离。在平板接种24-72小时后,从烧瓶吸出培养基。用PBS洗涤并吸掉。每个烧瓶添加原始体积的新鲜培养基。细胞将生长到80-90%的汇合度(Confluence),然后传代、冻结作为P1(1代)细胞或分化。当通过随后的细胞传代达到合适的细胞数目时,将部分样品固定并进行平滑肌细胞蛋白质表达的免疫检测。在培养基中3至5天后,对所述培养物的形态学进行评估。源自脂肪组织的人类和猪的细胞表现出平滑肌细胞的形态特征(图17Ludlow等,美国专利申请号20100131075)。所述细胞表现出丘陵和山谷的形态,并表现出附加特征,例如为细长形的、扁平的、传代后成纤维细胞样的、伸长的并且布置在平行的行中,和“陀螺”外观的生长,所有这些都是典型的培养的平滑肌细胞。平滑肌标记物。收缩的基因(和它们编码的蛋白质)表达的增加与SMC的成熟相关。我们确定从血液或脂肪组织分离的平滑肌细胞是否表达所述平滑肌细胞标记物心肌素、平滑肌α肌动蛋白、SM22、肌球蛋白重链和钙调蛋白;是通过分离总RNA,并进行半定量RT-PCR。结果表明,这些细胞在基因水平上表达所有这些平滑肌细胞标记物,符合平滑肌细胞标记物在膀胱平滑肌细胞中的发现。这些数据支持了这一观点,这些从外周血或脂肪组织分离的平滑肌细胞具有平滑肌细胞的属性。表型特征。我们已经表明,这些外周血分离的平滑肌细胞,表现出平滑肌基因表达以及特定的平滑肌收缩蛋白的转录调节。进行RT-PCR分析,对SMC标记物心肌素、平滑肌α-肌动蛋白、SM22、平滑肌肌球蛋白重链和钙调蛋白(参见Ludlow等,美国专利申请号20100131075,图19)的基因表达。样品是来自从猪脂肪、外周血和膀胱分离的平滑肌细胞(第4代)。从脂肪组织分离的SMC,在每个传代之间可以培养3-5天,而从血液中分离出的SMC在第一传代之前可以培养14天,然后在其它传代可以培养3-5天。使用β-肌动蛋白的基因表达,作为用于凝胶内部加载对照。脂肪和外周血细胞分离株的表达特性可与膀胱SMC相媲美。利用各种抗体(针对平滑肌细胞表达的蛋白质标记物)进行免疫荧光染色。在从猪的脂肪、外周血和膀胱分离的平滑肌细胞中,所述标记物α-肌动蛋白、SM22、钙调蛋白和平滑肌肌球蛋白被检测。这些蛋白质都参与了平滑肌细胞的收缩功能。多个传代的平滑肌细胞对平滑肌α肌动蛋白、SM22、钙调蛋白、平滑肌肌球蛋白重链染色阳性。在平滑肌细胞中,这些蛋白质的亚细胞定位几乎相同,与膀胱SMC相比。在这些细胞所述应力纤维中这些蛋白质的具体染色被记录。这种染色模式是典型的,并且对平滑肌细胞是预期的。观察从人类外周血分离的平滑肌细胞在传代5(参见Ludlow等,美国专利申请号20100131075的图20)的免疫染色。平滑肌α肌动蛋白、SM22和钙调蛋白的探针被使用。平滑肌α肌动蛋白和钙调蛋白(顶部右侧平板)的双重染色揭示了这两种蛋白在相同细胞内的共表达。这种一个以上平滑肌细胞标记物的(在单一细胞中)同时表达进一步支持了这些平滑肌细胞的概念。收缩性。由于所述源自外周血的平滑肌细胞表达平滑肌收缩蛋白,我们进行了三维凝胶收缩分析,以评估它们的类似SMC功能。SMC已经被表明,自发诱导胶原基质的收缩,当安装在三维凝胶中(Travis等,(2001)CircRes88:77-83)。源自脂肪组织的平滑肌细胞,也被测试收缩性。如在Ludlow等,美国专利申请号20100131075的图21中所示的,源自猪血液的(A)和源自猪脂肪组织的(B)细胞收缩到一定程度,可与膀胱平滑肌细胞(C)相比。向混合物中加入EDTA抑制收缩,从而支持这一思想:收缩是依赖于钙的,平滑肌细胞的另一个特点。这些数据表明,直径减少依赖于收缩细胞,以及所述细胞功能在这方面的能力。将所述细胞以500,000个细胞/ml接种,并被发现能够收缩;这通过两天后的胶原蛋白凝胶直径减少,得到证明。猪膀胱平滑肌细胞,被作为阳性对照。为了证明该收缩的钙离子依赖性,钙离子螯合剂EDTA被添加到分别的样品中,以抑制收缩。这些结果证实了细胞中以钙依赖性的方式收缩的能力,与膀胱来源的平滑肌细胞相似。生长动力学。为了在细胞治疗应用中利用平滑肌细胞,确定所要求的细胞数量是否能够在可接受的时间范围内达到,这是重要的。来自犬和猪的研究结果表明平滑肌集落(来自40ml样品的外周血)可以早至接种后7天被观察到,并且可以在14天内很容易地传代。在一项研究中,120万个细胞在培养18天后(第2代结束)获得,此时它们被冷冻保存。这些特殊的细胞在约50天后被解冻,并常规传代(当约80%的汇合度时),以确定生长动力学。在解冻后6天所述细胞群扩大到1670万个细胞(第3代结束)。再经过7天的培养,所述细胞群达到3170万个细胞(第4代结束)。初步研究表明,在大约30天的培养后,可以达到30百万个细胞。所述细胞被发现具有有限的增殖潜能。Ludlow等,美国专利申请号20100131075的图22表明,从人类脂肪组织分离的平滑肌细胞的生长,为每单位面积的回收的细胞的数目的函数。这些数据表明,在第4和5代之间,回收的细胞的数目开始下降,支持这一论点:即这些细胞具有有限制的和有限的增殖能力,这是祖细胞的特征,但不是真正的干细胞。Ludlow等、美国专利申请号20100131075的图23表明,从猪脂肪组织、外周血和膀胱平滑肌分离的平滑肌细胞,为每个传代回收细胞数目的函数。如解释的,细胞数目的动态扩增在第2和第3代之间达到(超过2-4周的时间范围),能回收数千万的细胞。这证明了源自脂肪的细胞的有限制的或有限的增殖潜能。增殖的接触性抑制。从外周血和脂肪组织分离的平滑肌细胞表现增殖的接触性抑制。例如,这些细胞的形态学评估表明了在数个传代期间存在增殖的接触性抑制。所述细胞在彼此接触后没有继续增殖。与此相反,MSC没有表现增殖的接触性抑制,并且他们能被观察到在彼此顶部堆积,与在转换的细胞培养物中的集落形成类似。例如,Zhou等报道了来自鼠骨髓的单核细胞部分的MSC的分离物和培养物,并且观察到在传代3代以后,所述培养的MSC表现失去了接触性抑制(参见第10850页和图1A)(CancerRes.2006;66(22):10849-10854)。细胞因子MCP-1的生产。MCP-1是膀胱逼尿肌细胞的正常产物。在主动脉平滑肌细胞中,MCP-1起到了在再生中发挥作用。为了定量人类外周血平滑肌细胞产生的MCP-1,采用了来自R&DSYSTEM的基于ELISA分析系统。一式两份对培养基样品进行分析,并与标准曲线比较,以提供估计的MCP-1水平,报道为ug/24小时/百万个细胞。测定从人类膀胱平滑肌、脂肪、外周血和膀胱尿路上皮(阴性对照)分离的细胞的细胞因子MCP-1的表达。图24Ludlow等(美国专利申请号20100131075)表示,来自这个分析的结果表明,源自人类外周血和人类脂肪组织的平滑肌细胞产生的MCP-1水平,可以与人类膀胱平滑肌细胞相媲美。这些数据支持这样的结论:就像膀胱SMC一样,从脂肪和外周血分离的平滑肌细胞表达MCP-1。此外,这些数据表明,产生的MCP-1可能在再生中发挥关键作用,通过直接或间接引起肌肉祖细胞被募集/迁移、或在所述结构内部中增殖。从脂肪分离的平滑肌细胞表现了几个平滑肌细胞特征。我们的研究表明,所述细胞能容易地从脂肪分离,使用标准酶消化和低速离心程序。细胞可以迅速扩增,也许达到大约3千万个细胞,在一个月的时间内。我们的研究进一步证明了,这些细胞,实际上,代表了平滑肌细胞群体,而不是真正的干细胞群,因为平滑肌标记物在早至第3代存在。而且,所述分离的平滑肌细胞具有收缩功能,其在标准胶原凝胶收缩分析中被表明。平滑肌细胞的特征。我们已经表明,在随后的传代期间,保留了平滑肌细胞的形态。平滑肌标记物在基因和蛋白水平都具有良好的相关性。细胞因子诱导。由脂肪平滑肌细胞的MCP-1表达已经导致我们推测,MCP-1的产生可能在新的器官或组织构造的再生中发挥关键作用(通过直接或间接引起原生间充质干细胞被募集/迁移、或在所述构造内部增殖)。实施例2-MCP-1生产和细胞密度分析来自膀胱平滑肌细胞培养的条件培养基,使用市售试剂盒检测和定量分析MCP-1。来自9个结构(3个,来自3个接种水平的每个水平)的条件培养基样品和配对的(被用于接种所述结构的)SMC细胞,被测试了MCP-1水平。其结果示于表2.1中。表2.1cIL2cIL6cIL10cMCP-1cIFNgcTNFacTGFb测试ID样品IDpg/mlpg/mlpg/mlpg/mlpg/mlpg/mlpg/ml1TT1﹤1.0﹤9.81.0﹤3.7﹤2.4﹤0.22TT2﹤1.08.8﹤2.039.6﹤2.4﹤0.2为了对存在于所述结构培养基中的MCP-1进行定量,采用了来自R&DSYSTEM的基于ELISA的分析系统(专门用于犬MCP-1)。样品一式两份进行分析,并与标准曲线比较,以提供在结构培养基中估计的MCP-1水平。如Ludlow等(美国专利申请号20100131075)的图25中所示的,该分析的结果显示,在MCP-1生产和细胞接种密度之间正相关。表2.2显示了,结构培养基的MCP-1定量,其由R&DSystemELISA测定。表Table2.3显示了,来自每个组的MCP-1平均水平的比较,其中可以看到,所得最终的比率与接种密度之间的差值平行。表2.2结果表明了,在细胞数目和在所述培养基中检测的MCP-1水平之间正相关。先前已经指出,一些来自再生的犬膀胱(接种了大约9百万细胞)的组织,处理后用于SMC外植,相对于在原生和再生的犬组织的典型观察,含有更多脂肪。所述外植的组织是非常柔软的,并且当观察所述外植体时,其含有更大比例的脂肪组织,相对于观察的天然组织。表2.3当存在脂肪组织时,在这些外植体平板上的培养基还在通常观察的表面上展现了“光泽”。这些观察表明在再生膀胱组织的脂肪沉积/脂肪形成中,MCP-l/CCR-2相互作用的角色。实施例3-源自脂肪的平滑肌细胞与间充质干细胞(MSC)相比脂肪组织代表异质细胞群体,由内皮细胞、脂肪细胞、平滑肌细胞和具有有限间叶细胞分化潜能的祖细胞组成。如在Ludlow等(美国出版专利申请号20100131075)(其整体通过引用的方式并入本文)和Basu等,TissueEngPartCMethods.2011Apr2[提前打印的Epub]中描述的,定量RT-PCR、抗原表达、蛋白质指纹图谱、生长动力学和功能分析,以定量评估所述粘附物的细胞组成,来自于人类脂肪的基质血管部分(SVF)。结果发现,培养基配方影响平滑肌细胞小室的脂肪SVF的富集。这些源自人类脂肪的平滑肌细胞(Ad-SMC)与间充质干细胞(MSC)或者其它源自脂肪的祖细胞群,具有表现型和功能性的区别。起始“0代”贴壁的人类SVF-来源的细胞群体的的细胞组成,使用定量real-timePCR方法(TAQMANTM)研究。已经发现:来自所述起始贴壁的人类SVF-来源的细胞群体(由表达内皮、平滑肌和脂肪组织相关标记物的细胞组成),可能识别和培养这种细胞群体:其通过SVF来源细胞在限制的培养基条件下的扩增,具有显著区别的生物属性,所述培养基条件选择对抗MSC的生长(Gongetal.2009.TissueEngineeringpartA15:1-11;Lundetal.Cytotherapy11,189-197(2009))。尽管在所述标记物(这些标记物和MSC历史性相关)的表达中部分重叠,这些细胞群清晰地具有显著的平滑肌细胞表型,相对于MSC,基于关键核和细胞表面标记物的表达分析的FAC和RT-PCR(反转录PCR)分析。当与MSC相比,该群体也显著减少内皮细胞。平滑肌细胞表型的表现与传代数目、脂肪供体来源、或者具有重组细胞因子和生长因子的定向分化的要求是独立的。另外,该平滑肌细胞富集群体具有独特的蛋白质组学特征,其与MSC具有清楚的区别。最终,我们充分利用了该类平滑肌细胞群体和MSC对血栓素A2类似物U46619完全相反的反应,记录了在所述两个细胞类型之间清晰的功能二分法。总之,这些数据支持了这个结论:该群体被更精确地描述为源自脂肪的平滑肌细胞(Ad-SMC)群体,并且代表了分别的和独特的细胞种类,与其他类别的源自脂肪的细胞(包括内皮细胞和MSC))相比。方法和材料。脂肪组织的制备。通过皮下或者通过吸脂获取人类脂肪样品(Zen-Bio,ResearchTrianglePark,NC),并且用等体积的PBS/庆大霉素(Gibco)(5μg/ml)洗涤3-5次。脂肪用过滤无菌胶原酶I(Worthington)(0.l%、1%BSA,在DMEM-HG(Gibco)中)在37℃消化1小时,然后在50ML的圆锥管中,在300g离心5分钟。在PBS/1%BSA中重悬所述基质血管部分,并且通过1005μmSteriflip真空过滤器过滤。所述细胞群体在300g、5分钟被再次沉淀,并且DMEM-HG+10%FBS+5μg/ml庆大霉素中再次重悬。在第二代结束的源自骨髓MSC,从商业提供商(Lonza)获得。为了研究培养基类型对平滑肌细胞标记物表达的影响,所述来源SVF的细胞或者被悬浮在α-MEM(Gibco)+10%FBS,SMCM(ScienCell)或者L15(Sigma)中。Taq-ManqRT-PCR。使用RNeasyPlusMiniKit(Qiagen)纯化RNA,按照生产商的说明书。使用SuperscriptVILOcDNA合成试剂盒(Invitrogen),按照生产商的说明书,从2μg的RNA形成cDNA。在cDNA合成之后,每个样品以1:10稀释。启动qRT-PCR,使用下述的TaqMan引物以及在下面列出的探针:10μ1mastermix(2X),1μ1引物/探针,9μ1cDNA(1:10稀释)。使用下述的TaqMan引物,以评估平滑肌、内皮和脂肪形成基因的表达:SmαA(平滑肌α肌动蛋白):Hs00909449_ml,SM22:Hs00162558_ml,心肌素:Hs00538076_ml,SMMHC(平滑肌肌球蛋白重链):Hs00224610_ml,钙调蛋白:Hs00154543_ml,脂联素:Hs00605917_ml,FABP-4(脂肪酸结合蛋白#4):Hs1086177_ml,CDH5/VECAD(血管内皮钙粘蛋白):Hs00174344_ml,vWF(血管性血友病因子):Hs00169795_ml,PECAM1(血小板内皮细胞粘附分子#1):Hs00169777_ml,FLT1/VEGFR(VEGF受体):Hs01052936_ml,KDR/FLK1(胎肝激酶#1):Hs00176676_ml,TEK(酪氨酸激酶,内皮的):Hs00945155_ml。使用18srRNA作为内源性对照,并且将所有样品进行(针对膀胱平滑肌细胞cDNA)校正。所有的引物/探针从美国应用生物系统公司(AppliedBiosystems)获得。所有的反应在ABI7300实时热循环仪(ABI7300realtimethermalcycler)上进行,使用默认循环参数。通过比较Ct值,使用相对定量(RelativeQuantitation,RQ)方法,进行PCR数据分析。阵列-RT-PCR。基于阵列的实时qRT-PCR分析,35个循环,按照生产商的说明书使用SABiosciencesMSC(PAHS-082A)和细胞表面标记物PCR阵列平台(CellSurfaceMarkerPCRarrayplatform)(PAHS-055A)。FAC分析。每个数据点0.5×106-1×106个细胞在2%多聚甲醛中固定,并且Fc受体被阻断以防止非特异性结合。细胞然后与细胞表面标记物直接共轭的抗体一起孵育,所述细胞表面标记物是:CD31、CD45、CD54、CD56、CD73、CD90、CD105、CD117或者CD133(BDBiosciences公司),这些按照生厂商的建议。进行最终洗涤(PBS,0.1%TritonX-100)之后,利用BDFACSAria1或者GuavaEasyCyteMini快速分析系统(GuavaEasyCyteMiniExpressAssaysystem),并使用适当荧光通道,进行抗原检测。每个样品至少需要5000-10000事件。2D蛋白组学分析。源自骨髓的MSC和Ad-SMC对照的传代(P2的结束)在裂解缓冲液(50mMTrispH8;150mMNaC1;0.5%NP40和蛋白酶抑制剂,Roche)中裂解,并且来自每种细胞类型的40μg的蛋白裂解液在pH4.0-7.0ZoomIEFstrip(Invitrogen)上(按照生产商的说明书)运行。然后每个条带(strip)被加载到4-12%Bis/Tris丙烯酰胺凝胶,并进行第二维运行。所述凝胶用SYPRORuby染料(Invitrogen),按照生产商的说明书染色。源自骨髓的MSC和Ad-SMC对照的传代(P2的结束)在裂解缓冲液(50mMTrispH8;150mMNaC1;0.5%NP40和蛋白酶抑制剂,Roche)中裂解,并且来自每种细胞类型的40μg的蛋白裂解液在pH4.0-7.0ZoomIEFstrip(Invitrogen)上(按照生产商的说明书)运行。然后每个条带被加载到4-12%Bis/Tris丙烯酰胺凝胶,并进行第二维运行。所述凝胶用SYPRORuby染料(Invitrogen),按照生产商的说明书染色。结果。在Ad-SVF中的标记物表达(Ludlow等,美国出版专利申请号20100131075的图91)。我们对来源于基质血管部分脂肪组织的细胞群体(其在接种后的最初24-48小时内贴壁在组织培养烧瓶上),进行了定量TaqManRT-PCR分析,使用一组定义的内皮细胞、脂肪细胞和平滑肌细胞特异性TaqMan引物。这有助于在最初贴壁细胞群体中分析表达标记物,并且建立后续(传代、时间和培养基配方对平滑肌细胞特异性基因表达的影响)分析的基线。在起始的24小时以内,观察到在所述贴壁的细胞群体中,FABP-4和脂联素的低的但可检测的水平;这与存在残余脂肪细胞一致。与此相似地,由VECAD、vWF、PECAM、FLTI、FLK和TEK表达定义的内皮群体在这个时间点存在。由SM_A、SM22、心肌素、SMMHC和钙调蛋白表达定义的平滑肌细胞群体,也在早期贴壁细胞群体内观察到。我们能在接种的24-28小时内,在比较的水平检测所有三种细胞群体。如下文讨论的,将平滑肌细胞从该细胞群体的混合物中分离。平滑肌标记物的表达依赖于培养基类型。由于脂肪是由多种细胞类型组成的异质性组织,平滑肌细胞在内皮细胞或MSC间的富集可能被培养基配方影响,这种观点是合理的。从骨髓和脂肪分离未分化的MSC,密切依赖于培养基组成(Gong等2009,上文)。特别地,在所述培养基中存在升高水平的葡萄糖,或者高密度生长,似乎选择对抗MSC的扩增(Lundetal.2009,上文;Stolzing等,RejuvRes2006;9:31-35)。我们解释,培养基配方的调节可能对平滑肌细胞的富集有用,以消耗MSC和其它细胞群体为代价。如在Ludlow等,美国出版专利申请号20100131075的图92中所示出的(由培养基类型表达的SMC标记物的Taqman分析),来自脂肪-SVF的平滑肌细胞富集群体的表达紧密依赖于在DMEM-HG中的生长。在α-MEM、SMCM或者L15中扩增与减少的平滑肌细胞表型(由SmαA、SM22、心肌素、SMMHC和钙调蛋白表达的减少所显示的)显著相关。Ad-SMC比MSC更加接近类似平滑肌细胞。我们使用半定量RT-PCR,评估Ad-SMC和MSC的平滑肌细胞相关基因表达特征。如在Ludlow等,美国出版专利申请号20100131075的图93所示的,关键平滑肌标记物钙调蛋白、心肌素和SMMHC的表达在Ad-SMC中明显地更加显著(当其与MSC相比时),这支持了我们的假说:比起MSC,该细胞群体与平滑肌细胞更加相似。然后我们评价了SMC特异性标记物在多个独立脂肪制剂(n=4)之间、以及在培养物中5个传代的稳定性。如在Ludlow等,美国出版专利申请号20100131075的图94(脂肪传代之间的RT-PCR)所示的,SmαA、SM22、SMMHC、心肌素和钙调蛋白在传代之间的表达是显著恒定的,并且与供体独立,这证明了:平滑肌细胞表型的表达随时间推移是稳定的。这些现象与Ad-SMC一致,Ad-SMC将是更充分地分化、表型稳定的细胞群体。基于阵列的RT-PCR分析,在Ad-SMC和MSC之间的关键标记物基因表达具有显著差异。我们使用SABiosciencesMSCMarker阵列平板,以系统地识别基因表达在对照的传代(P2)Ad-SMC和MSC之间的差异。该平板描绘了涉及MSC多能性和自我更新的84种基因的表达状态。对关键标记物的概述,由在Ad-SMC和MSC之间的区别所识别的,在表3.1中示出。在Ad-SMC中(相对于MSC),观察到GDF5、HGF、LIF、MCAM、RUNX2和VCAM1显著(至少10倍)地下调。在Ad-SMC中(与MSC比较),观察到BMP6、CD44和ILlβ显著地(至少10倍)地上调。观察到在基因表达中的这些关键差异,保持传代或细胞样品(n=6,数据未显示)的独立一致。使用SABiosciences表面标记物阵列继续基因表达分析。表3.1关键结果的概述在表3.2中示出,其中我们已经检测了Ad-SMC,在P0&P4。表3.2*=调节倍数的变化﹥|10.0|如同所述平滑肌细胞特异性标记物MYH10、MYH9和MYOCD一样,成纤维细胞的/间质的标记物ALCAM、COL1A1和COL1A2的表达在传代之间维持。所述群体对所述脂肪细胞标记物RETN是阴性的,表明贴壁脂肪细胞的污染最小。重要地,尽管Ad-SMC在4个传代以内获得了HLAMHCII阴性的状态,但是它们起初是HLAMHCII阳性的,这是与MHCII阴性的MSC的关键区别。另一个有趣是现象是:Ad-SMC随着传代逐步减少了内皮的,根据所述内皮标记物ENG、ICAM2、NOS3、PECAM1、SELP、TEK、VECAM和VWF的下调的通常趋势判断。该数据是独立地通过RTPCR分析确认,在Ludlow等,美国出版专利申请号20100131075的图95中。为了进一步地比较在源自脂肪的平滑肌细胞(Ad-SMC)和间充质干细胞(MSC)之间的基因表达谱,对人类间充质干细胞标记物(SABiosciences;PCRArrayCatalog#PAHS-082A)进行了基于PCR的基因阵列分析(数据未示出)。所述结果解释了在Ad-SMC、MSC、以及具有良好特点的非MSC细胞类型(人类主动脉内皮细胞(HuAEC))之间同源基因表达的程度。在分析的所述84个人类MSC基因中,人类Ad-SMC与在初始分离的人类MSC享有仅27%(84个基因中的23个)的同源性(数据未示出)。与之相反,所述具有良好特点的非MSC(即HuAEC)与MSC享用49%同源性(84个基因中的41)(数据未示出)。这支持了结论:与HuAEC相比,所述Ad-SMC与MSC享有显著较少的同源性,所述HuAEC是已知的非MSC细胞类型。因此,与HuAEC相比,所述Ad-SMC甚至更不像MSC,进一步支持了所述结论:所述从脂肪组织分离的Ad-SMC细胞是Ad-SMC,而不是MSC。Ad-SMC的所述细胞表面性能与所定义的MSC显著不同。我们观察到,MSC和Ad-MSC两者都享有所述表面标记物CD73、CD90、CD105和CD166的表达,所述标记物通常与MSC相联系(表3.1)。尽管如此,如下文所讨论的,这些标记物没有内在的生物学意义,除了它们以往与MSC的联系。由所述细胞表面标记物RT-PCR分析产生的基因表达结果通常在所述比较FAC分析中反应,所述比较FAC分析在Ludlow等,美国出版专利申请号20100131075(图96A-C(Ad-SMC)和图97A-B(MSC))中示出,这表明了:Ad-SMC是CD31+、CD45+、CD54+、CD56+、CD90+、CD105+。重要地,Ad-SMC是CD45+和CD54+的,这是和MSC的明显区别,所述MSC是CD45-CD117-。CD73的表达与源自脂肪的基质血管部分的先前报道一致(daSilvaMeirelles等.JCellSci.,119:2204(2006)),但是与源自骨髓的MSC不同。传代对照的MSC和Ad-SMC具有独特的蛋白质组学标记。Ludlow等,美国出版专利申请号20100131075的图38显示了:MSC、源自膀胱的SMC、Ad-SMC和人类主动脉平滑肌细胞的完整蛋白组学标记的比较分析。所述顶部的两个平板表明了,Ad-SMC与MSC有区别,并且与从脂肪组织分离的MSC、以及其它类别的干细胞和祖细胞明显地不同(Roche等;Proteomics2009;9:223-232;Noel等.ExpCellRes2008;314:1575-1584)。在两个凝胶上的箭头突出显示了在MSC和Ad-SMC之间的一个区别;在所述pH梯度和分子量范围以内,在不同的独特位点的蛋白质浓度。MSC具有的蛋白质浓度更接近于7.0的pH,并且大于或者等于60,000分子量。与之相反,AdSMC具有这种蛋白质浓度更接近4.0的pH,并且小于60,000的分子量。与MSC相比,AdSMC具有更多的蛋白存在(具有的pI高于7),由沿着所述在pH7.0的凝胶的右侧外边缘的涂抹(smear)所指示的。膀胱平滑肌细胞被作为对照分析。所述框表示在所有样品间的相似区域。这是清晰的:所述AdSMC蛋白性能是最像源自膀胱的SMC的性能(较低的左侧平板),其与MSC观察的模式不同。主动脉平滑肌细胞也作为额外的平滑肌细胞对照(较低的右侧平板)被分析。所述主动脉平滑肌细胞和膀胱平滑肌细胞的蛋白质组学标记几乎是相同的。一并考虑,对AdSMC,在膀胱和主动脉平滑肌细胞的性能之间的高程度相似性,这与所述MSC的性能明显地不同,这支持了所述结论:从脂肪组织分离的是SMC,不是MSC。所有的凝胶用SPRYORuby染色,使蛋白质模式可视化。Ad-SMC的生长动力学与MSC显著不同。所述Ad-SMC的增殖潜力与MSC显著不同,所述MSC已经被成功扩大直到40个传代(Bruder等,JCellBiochem.,64:278-294(1997))。如在Ludlow等,美国出版专利申请号20100131075的图99显示的,Ad-SMC在培养所述第4-第5天后,其增殖能力显示了明显的下降。我们也观察到,不像MSC,Ad-SMC表现出增殖的接触依赖性抑制。这些观察现象证明了,所述Ad-SMC没有自我更新的能力,并且因此通过定义不是干细胞或祖细胞。MSC的增殖没有表现接触依赖性抑制,并且可以观察到它们堆积在彼此的顶部(与在转化的细胞培养物中的集落形成相似)。这与先前的观察一致(Zhou等,2006supra)。Ad-SMC和MSC对U46619的治疗具有明显相反的反应。作为我们对小分子靶向信号级联参与激活平滑肌细胞相关发育途径的进行评估的努力的一部分,我们专注于U46619(一血栓素A2模拟物),所述U46619的功效包括增加细胞间Ca2+水平和激活RhoA、CaM和MLC激酶信号级联反应。如先前所报道的(Kim等,2009,StemCells.27(1):191-199),我们已经确认了:用U46619(1μM)的治疗导致所述关键平滑肌细胞标记物心肌素和AMMHC在MSC中的上调。尽管如此,Ad-SMC通过明显下调心肌素和SMMHC表达,以对所述相同的治疗作出反应(如在Ludlow等,美国出版专利申请号20100131075的图100中所示的(泳道:1-MSC对照;2-MSC+U46619;3-Ad-SMC对照;4-Ad-SMC+U46619;5-H20;和6-SMC)。这些结果提供了明显的证据证明在Ad-SMC和MSC之间的功能性二分。功能性标记物的表达。Ludlow等,美国出版专利申请号20100131075的图101提供了中胚层分化标记物的RT-PCR分析的结果。泳道内容:1:MSC对照的;2:MSC实验的;3:AdSMC对照的;4:AdMSC实验的;5:外周血对照的;6:外周血实验的;以及7:H2O。中胚层分化标记物在MSC和AdSMC中的表达,经历了成脂分化。相对于MSC,AdSMC在标准条件(n=l)下的生长表现了显著较高的骨桥蛋白(osteopontin)表达。相对于MSC,Oct4B(Oct4A的剪接变异体作为多项分化潜能的显著标记物),在源自脂肪的细胞中显著上调(Kotoula等,2008,StemCells26(1):290-l)。MSC和源自脂肪的细胞都不表达Oct4A。Ludlow等,美国出版专利申请号20100131075的图102显示了Oct4A/Oct4B在MSC/AdSMC中表达的RT-PCR分析结构。泳道内容:1:膀胱SMC;2:HFF-1(人类成纤维细胞);3:MSC;4:AdSMC;5:外周血;6:H2O。密切相关的转录同工型Oct4A和Oct4B在MSC、AdSMC、成纤维细胞和SMC系中的表达被评估。没有观察到多项分化潜能标记物Oct4A(Gongetal.2009supra)的表达,但是评估的所有细胞系都表达了Oct4B(n=l)。这项研究表明了:从所述脂肪的P0贴壁的基质血管部分直接分离的Ad-SMC,依赖于所述培养基配方。平滑肌细胞标记物的表达是强大的和一致的,并且与供体来源和传代之间是独立的。我们已经表明:根据基因表达、蛋白质组学和表面标记物分析证明,Ad-SMC表型与MSC明显区别;并且根据它们对靶向平滑肌细胞相关的信号通路的药物的反应评估,Ad-SMC与MSC有功能性区别。与其它已出版报道相反,这些平滑肌细胞的分离不要求伴随有TGF-β和其它相关小分子的定向分化。Ad-SMC可以在4-5个传代内扩增至107个细胞,并表达全范围的平滑肌细胞相关标记物,并且在功能上可以与源自膀胱的SMC相媲美,包括在体外(Ca2+依赖的收缩性)和在体内(在猪膀胱切除模型中的新导管再生)(Basuetal.InternationalSocietyforStemCellResearch,7thAnnualMeeting,July8-11,2009)。这些数据支持了这个结论:此群体是更精确描述的源自脂肪的平滑肌细胞(Ad-SMC)群体;并且与其它类别的源自脂肪的细胞(包括内皮细胞和MSC)相比,其代表了单独的和显著的群体。实施例4-来自非膀胱细胞源的新泌尿导管Ludlow等,美国出版专利申请号20100131075和Ludlow等,美国临时申请号:61/330,774(其全部内容通过引用的方式纳入本文)描述了从猪外周血和脂肪分离的平滑肌细胞及其特征。所述外周血-和脂肪来源的平滑肌细胞,可用于接种合成的、可生物降解的管状支架构造,并将这些接种的支架植入到猪的膀胱切除术模型中,导致新泌尿导管的成功再生。根据实施例1(另见实施例3,Ludlow等,美国临时申请号:61/330,774)所述的协议,分别从猪膀胱、脂肪和外周血中获得平滑肌细胞。源自猪外周血单核部分的直接平板涂覆导致了具有典型平滑肌细胞形态的生长集落。所有(100%)筛选的动物(n=24)生成平滑肌细胞集落,在从50毫升的外周血中零代回收2.44×103-2.37×106的平滑肌细胞。平滑肌细胞的回收不受培养基配方、细胞密度或表面涂层变化的影响(数据未示出)。类似的方法被用于研究皮下的的或源自脂肪提取物的脂肪的作为平滑肌细胞来源的潜在应用。我们能够从猪脂肪中产生平滑肌细胞的集落(可扩展到单层),效率(n=24)为100%,细胞回收率为1.37×105-4.36×105细胞/g脂肪组织。相比之下,可以从膀胱组织中分离的平滑肌细胞,其回收率为1.29×106-9.3×106细胞/g膀胱组织。从外周血或脂肪中扩大的平滑肌细胞集落导致形成有典型旋转的单层细胞,所述旋转是培养的源自膀胱的平滑肌细胞具有的“山丘和山谷”组织特性。通过半定量RT-PCR和免疫荧光分析来证实了平滑肌收缩相关蛋白质(心肌素、SM22、α-平滑肌肌动蛋白(SMαA)、平滑肌肌球蛋白重链(SMMHC)和钙调蛋白(CNN))的表达增加。在胶原蛋白凝胶矩阵和三维Ca2+依赖的收缩实验中,通过Ca2+依赖性收缩来证实每个源自猪膀胱-、脂肪-、以及外周血的平滑肌细胞的收缩性。EDTA作为已知Ca2+螯合剂抑制收缩性。还评估了猪(A)膀胱-,(B)脂肪-,和(C)外周血-来源的平滑肌细胞的生长动力学。据观察,在接种后的7天内,平滑肌细胞集落(来自50ml的猪外周血样品或7-25g猪脂肪)是可识别的,而且在14天内可以传代。在2-4周(n=24)内,从膀胱、外周血或脂肪回收100万到数1000万的平滑肌细胞。在收获细胞之前,膀胱和脂肪来源的平滑肌细胞扩大2代,以接种合成的、新的泌尿导管支架。外周血来源的平滑肌细胞扩大3-4代以产生相同的细胞数量。平均而言,30-40×l06的平滑肌细胞用于接种新的泌尿导管支架。材料和方法。从猪膀胱、脂肪和外周血产生平滑肌细胞。从膀胱&脂肪活检以及外周血中分离的平滑肌细胞用于产生新的泌尿导管结构。在计划植入最终新泌尿导管的大约8周之前,从每24个Gottingen猪中获得1cm2的膀胱活检样品、2cm2脂肪活检样品和50mL外周血。分离膀胱来源的平滑肌细胞,从所述膀胱活检中解剖分离所述尿路上皮细胞层,而剩余的平滑肌层切成lmm2片并布置到所述组织培养板的表面上。在生物安全柜中干燥活检片10-30分钟。添加DMEM-HG(Gibco)+10%FBS到活检样品上并在湿润的37℃、5%CO2的培养箱中孵育所述培养板。用PBS清洗3次脂肪组织(7-25g),用解剖刀和剪刀切碎,转移到50mL的圆锥管中,并在0.3%胶原酶(Worthington)溶液和含1%BSA的DMEM-HG中,37℃下孵育60分钟。不断摇晃所述管,或定期震荡以利于消化。在600g下,所述基质血管部分离心沉淀10分钟,并在DMEM-HG+10%FBS中再悬浮。然后所述基质血管部分用于接种零代。在PBS中1:1稀释25毫升猪的外周血,并在50毫升的圆锥管中,用25ml的Histopaque-1077(Sigma)分层。离心(800g,30分钟)后,收集所述单核部分,用PBS清洗一次,并重新悬浮在α-MEM/10%FBS(Invitrogen公司)中接种零代。新泌尿导管细胞/支架复合物的装配。分别扩大膀胱、脂肪和外周血来源的平滑肌细胞至7周以产生接种NUC支架所需的所述107细胞。在收获用于接种支架以生产最终的结构之前,扩大膀胱和脂肪来源的平滑肌细胞2代。在收获之前,外周血来源的平滑肌细胞培养扩大到P3-4代,用于支架接种。为制作所述NUC支架,将PGA毛毡切成一定尺寸,缝合成NUC的所述形状,并涂覆PLGA。然后用环氧乙烷对该结构灭菌。在细胞接种的前一天,通过浸润60%乙醇/40%D-PBS、100%D-PBS、D-MEM/10%FBS或α-MEM/10%FBS对所述NUC支架连续预湿,然后在D-MEM/10%FBS或α-MEW/10%FBS中,在室温下过夜孵育。然后所述NUC支架接种膀胱-、脂肪-、或外周血来源的平滑肌细胞,并且所述接种的结构在37℃下、5%C02的湿润孵化器中成熟,直到在第7天前准备移植。分离RNA并进行半定量RT-PCR分析。使用RNeasyPlusRNA迷你分离试剂盒(RNeasyPlusRNAMiniisolationkit,Qiagen),从猪膀胱、脂肪和外周血来源的平滑肌细胞中分离RNA。使用QuantitectcDNA合成试剂盒(Invitrogen)反转录每个样品的1μg的RNA样本。下列平滑肌细胞的特异性引物被用于进行RT-PCR反应(5'-3'):β-肌动蛋白(F:TTCTACAATGAGCTGCGTGTG(SEQIDNO:1),R:CGTTCACACTTCATGATGGAGT)(SEQIDNO:2),SM22(transgelin)(F:GATCCAACTGGTTTATGAAGAAAGC,(SEQIDNO:3)R:TCTAACTGATGATCTGCCGAGGTC(SEQIDNO:4)),SMaA(F:CCAGCAGATGTGGATCAGCA(SEQIDNO:5),R:AAGCATTTGCGGTGGACAAT(SEQIDNO:6)),SMMHC(F:GCTCAGAAAGTTTGCCACCTC(SEQIDNO:7)R:TCCTGCTCCAGGATGAAC(SEQIDNO:8)),CNN(钙调蛋白)(F:CATGTCCTCTGCTCACTTCAAC(SEQIDNO:9),R:CCCCTCGATCCACTCTCTCA(SEQIDNO:10)),MYOCD(F:AAGAGCACAGGGTCTCCTCA(SEQIDNO:11),R:ACTCCGAGTCATTTGCTGCT(SEQIDNO:12))。循环条件:95°变性(2分钟),95°变性(45s),退火(45s),72°延伸(45s),72°最后延伸(5分钟)。35个循环(心肌素40个循环)。退火温度:β-肌动蛋白=58°,SM22=56°,SMaA=55°,SMMHC=60°,CNN=51°,MYOCD=52°。使用GoTaqGreenPCR混合物(Promega)进行PCR反应,并在iQcycler(Bio-Rad)上循环。免疫-荧光分析。以下所述抗体用于免疫-荧光分析:SMαA(Dako#M0851),CNN(Dako#M3556),SM-MHC(Sigma#M7786),心肌素(SantaCruz#SC3428),SM22(Abcam#ab28811-100),抗-msIgG/Alexafluor488(Invitrogen#A21121),抗-msIgG2a/Alexafluor488(Invitrogen#A21131),抗-gtIgG/Alexafuor488(Invitrogen#A11055)。所有的初级抗体使用的最终浓度为5μg/ml,除了SMMHC的使用浓度为10μg/ml。收缩试验。如前所述(Travis等,2001,见上文)进行收缩试验。生长动力学。从组织分离至接种所述新的泌尿导管支架的平滑肌细胞,通过一系列传代扩大,汇合度≥70%。实施例5-研究Yorkshire猪,以评估新的泌尿导管移植这项研究将评估超过8周时间,新的泌尿导管在雌性Yorkshire猪模型中的移植。本研究的目的是确定手术切除所述膀胱(根治性膀胱切除术)后,在使用接种了异体平滑肌细胞的新膀胱导管结构用于组织再生以及转移所述输尿管至所述新膀胱导管构造植入系统的流入端时,皮肤造口创建方法的安全性和功能性。腹膜将被用于包裹所述整个结构。所述结构的排水流出端将被定位和连接到手术造口以使小便通过。在完成所述复苏期(56天+/-5),对所述动物实施安乐死,并进行尸解以收获所述肾脏、导管和有关器官和组织用于组织学制备和病理检查。三只动物进行一个主要程序。移植接种同种异体SMC的新膀胱导管结构。装置植入包括皮肤造口创建用于排尿。在这项研究中,将创建造口,这将解决人的腹部造口连接新膀胱导管结构的要求。研究设计。六(6)只YorkShire猪尿进行了泌尿膀胱(膀胱全切除术)的手术切除。评估疝气补丁,以避免在具有腹部造口的四足动物中潜在的肠道疝气/器官的取出。进行两个阶段的造口形成方法的评估,A和B(表5.1)。简而言之,在阶段A进行评估外翻造口形成的方法,以及在阶段B进行评估平面造口形成的方法。表5.2描述了所述四个阶段的研究,并且表5.3总结了所述研究计划。测试件。所述测试件为具有异体脂肪来源的SMC的PGA/PLGA新的泌尿导管结构。所述支架是由合成的丙交酯/共羟基乙酸聚合物组成,其接种异体脂肪来源的SMC。所述测试件在22℃±5下储存。所述试验件通过下面描述的外科手术植入到动物中。从异体脂肪源获得平滑肌细胞,但在外科手术过程期间或之后没有使用免疫抑制治疗。表5.1No.=编号;SMC=平滑肌细胞;*在移植后的20到63天选择安乐死表5.2阶段概述A一般测试件结构(接种同种异体的平滑肌细胞)B3只动物的手术移植程序C存活:手术后护理和监视、观察、数据收集D预尸解接着&尸解,并具有组织收获和组织学表5.3在手术准备前,每只动物被服用镇静剂,然后麻醉。然后对每只动物插管,以接收吸入剂诱导和维持麻醉。然后清洗所述手术面积,并用布帘覆盖以进行无菌手术。在手术前进行所述准备。在移植期间监测生命特征。输尿管换位通过导管以及膀胱切除术。通过剖腹手术进行输尿管换位程序。正中切口的制成在腹部开始5厘米的颅端至脐部延伸约15厘米尾端。确定腹膜,仔细从腹部空间分离,直到所述组织足够长以覆盖所述新泌尿导管结构,并形成可以通过体壁退出的导管。测量所述腹膜并切割,以包裹所述结构,并形成导管,所述导管将从体壁向外延伸。用3-0Vicryl在所述结构周围缝合所述腹膜。注意采取措施,确保组织保持完好和血管化。然后所述泌尿膀胱被暴露和清空尿液,注意避免尿液进入腹腔。供给膀胱的动脉和静脉被确定,并结扎。识别所述输尿管,以上升的方式插入两个7FR14cm的非吸收输尿管支架,并小心从膀胱横断所述输尿管。将横断的所述尿道缝合在一起。然后除去膀胱。左侧输尿管从所述周围的腹膜后筋膜颅端延伸的,进行了仔细的释放,直到有足够的流动性,以到达右侧。将所述右输尿管解剖以自由到达所述结构的末端。用3-0Vicryl以简单的连续图案,将所述输尿管缝合至所述结构上。于腹部壁上乳腺外侧,创建造口。在手术过程中,有可能发展变化的皮肤造口创建方法。将所述腹膜导管从腹膜取出并缝合到所述皮肤。将手术粘合剂沿着缝合线设置,并且所述腹膜从此处退出体壁。通过用于未来去除的人造口从腹部取出连接到所述支架的所述缝线股,并将造口纽扣/合适长度的导尿管插入到所述造口中,允许7-21天的充分排水(完成后约一个星期,所述支架将被移除,有意识地或麻醉下(如果需要的话))。一旦固定,所述腹壁切口非吸收性聚丙烯缝线缝合关闭。皮肤以常规的方式关闭。所述动物被允许恢复。非常谨慎处理和操作腹膜,以防止血液通过脉管系统止住。所述输尿管不可降解的支架保留在原处大约7天,除非诊断评估显示需要他们过早地去除它们(例如,肾梗阻)。所述手术在每个动物上在第0天进行一次。造口纽扣(stomabutton)护理和维护&切口位点评估。造口纽扣:在所述确定性手术后,所述造口的导尿管(DaVINC生成的造口纽扣或等价物:在不同的时间点上,根据需要,3-10cm)将被重新插入,并用缝线固定到所述动物。所述造口纽扣被保持在原处,基于所述研究期间每个案子的需要和可能性。当它不滴水时,所述造口纽扣用无菌生理盐水冲洗,以确保开放。在第7天和第21天之间,支架材料进行降解,并且颗粒物(蛋白质相关)开始在尿液中流出来。这可能会导致造口纽扣的阻塞,和在所述结构能力以上或以外滞留尿量。因此,如果必要,对所述造口或新导管进行清创术。频率/时间:每日观察,然后维护(根据需要,当观察到导尿管不滴水时)。所需的时间大约15分钟。切口位点评估:所述切口位点每天进行评估,在最初的14天或直至痊愈。根据需要,将清洗造口区域和周围组织。观察尿液引流的造口,评估切口位点,关于其裂开、异常排除、气味、刺激性或任何异常情况。频率/时间:最初的14天每日,或直至痊愈,和/或根据所述设施兽医的判断。所需的时间大约15分钟。停滞的造口组织清创术过程:具有停滞组织的动物在所述造口/导管以内,会经历清创术过程。根据协议,动物将被注射镇静剂。小切口,可能会在所述造口上制备,以方便插入用于清创术的镊子。所述停滞的组织将会视觉/触觉地识别,并且握住镊子轻轻地拽。一旦所有的停滞组织被去除,所述造口/导管可以用生理盐水冲洗。如果在清创术过程中需要切口,它将被用缝合线关闭。造口纽扣会被重新插入,并用缝合线固定到所述动物。动物将被收回在单独的笼子中。频率/时间:所需时间约45分钟。恢复:紧随每个手术完成后,动物将被允许从麻醉中恢复过来,并转移到饲养笼。此期间会发生在任何外科手术结束时,约1小时。研究期间手术后植入后的临床观察:在植入后,对动物单个个体食物摄入和排泄的/尿液输出的评估,将每天进行,在植入后持续8周。在植入后/重新植入手术后,进行观察5天:临床观察持续8周。生存:在植入后/重新植入手术后恢复动物存活56+/-5天的时间段。在此期间,对动物进行健康评估。动物牺牲和尸解。物理检测-在安乐死之前,所有的动物都将被评估。所述检测包括记录所述动物的一般情况:直肠体温、呼吸频率、心跳率和毛细血管再充盈时间。尸解-所有动物进行尸体解剖。肾脏、导管、输尿管和造口是具体的重点。对肾脏、输尿管、导管、造口、胸部、腹部&盆腔、他们的器官和组织进行总的评价。如果有观察到任何肉眼损害、粘附和/或器官的变化(包括生殖),他们将会被进行评估、拍照、并收集以用于组织病理学评估。完整的新膀胱导管面积将被可视化和原位拍摄。根据解剖员的判断,可以拍摄另外的照片和/或肉眼损害。通过灌注福尔马林至所述造口内,并使所述导管和输尿管膨胀,用福尔马林固定导管。这项工作将用Foley(或等价物)的导管进行,同时绑紧造口以保持压力。每只动物,尸解将进行约1/2小时,在第56天(±5天)。结果。在腹部中从输尿管到造口,通过新的泌尿导管(NUC)植入手术,成功建立尿流改道。通过造口收集尿液的可能性表示了NUC植入术的成功。评估疝补丁,以避免在具有腹部造口的四足动物中潜在的肠道疝/脏器的取出。对固定的泌尿器官进行收集、修剪、检查、石蜡包埋,切片。用苏木精伊红(H&E)和Masson’Trichrome(弹性蛋白)对切片染色。打开腹腔,植入测试件的结果和手术方法被可视化和原位数字化拍照。取出整块的肾脏和输尿管导管。所述输尿管进行了测定,然后将其从所述导管分离(通过距离所述吻合部位横向切片3-4厘米)。获得肾脏、输尿管、淋巴结、及任何其他肉眼可见的损害的代表性部分。在组织学处理前,所有的组织样本被放置在10%中性缓冲福尔马林(NBF)中,持续24-48小时。在固定后,根据所述再生植入物的大小和形状,打开导管,沿纵向(平行于所述流体)或横向(垂直于所述流体)。图15示出了修剪计划。在固定导管组织(纵向一分为二)后,显示了用于组织学评估的多种目标区域(虚线突出的圈)。提交组织学处理(4-7个盒)的组织样本(盒的数量)根据导管的尺寸变化。尿流的方向由箭头表示。表5.4中列出的组织取样。有些导管长度太短而不适应修剪方案,所以所述可用的导管被分为较少的节。表5.4*UCJ-输尿管-导管连接在组织修剪期间,拍摄数字化照片用于解释的目的。在固定后,将组织常规处理成宏观切片或者微观切片,并苏木精伊红(H&E)和Masson的Trichrome染色。另外,对3号动物进行4种免疫组织化学染色,对平滑肌用抗α-平滑肌肌动蛋白和钙调蛋白,对上皮/尿路上皮用anti-pancytokeratin(AE-1/AE3)和anticytokeratin7(CK-7)。所有切片进行了显微镜评估。所有切片显微镜进行了评估。在适当的情况下,对动物个体数据的显微镜观察给予评分,根据在文字表5.5中列出的标准评分为“0”至“4”。宏观和微观的结果。形成所有的动物肉眼所见和微观的相关性的综合列表。也收集了新的泌尿导管的动物个体微观数据。评估了每个动物的上尿道的数据,以分析造口狭窄对间歇性局部阻塞的发病率的影响。如下概述的,结果(例如,输尿管积水、肾盂积水、肾盂肾炎)与造口狭窄现象一致。表5.5阶段A动物(1,2,和3号)自体脂肪造口(动物1号):这种手术方法导致发红造口的构建,所述造口保持开放直到预定尸解时间点(63天)。造口的开放,主要通过在初始手术的时间点设置造口(插管)端口,保留在原位直到后续的重建手术。所述重建手术包括黏膜反转,这被发现在预防造口-皮肤狭窄部位导致的狭窄和后续阻塞是无效的。硅树脂环造口(动物2号):这种手术方法导致凸起的造口的构建,在前30天所述造口保通常。进行所述造口(插管)端口的设置和后续的造口修复/重建、以及皮肤补丁修复/重建,以防止造口变狭窄,从植入30天后至植入60天后(所述预定的尸解时间)。所述初始硅树脂造口构建和所述皮肤补丁重建方法没有阻止造口狭窄。快门皮肤外翻造口(动物3号):这种手术方法导致发红造口的构建,所述造口保持开放直到预定尸解时间点(32天)。造口端口被用于在所述造口管腔中固定输尿管支架绳,以防止输尿管支架绳外部暴露,并尽量减少手术后泌尿造口位点的环境残骸污染。阶段B动物(4,5,和6号)疝气补丁:利用大的腹壁缺损和疝气补丁导致在发红造口保持开放直至尸解。所述腹内疝气补丁表现出与所述NUC腹壁的整合并且可能不适合。所述皮下疝气补丁足以防止形成疝气,是可接受使用的。免疫组织化学。在植入后的32天,只对3号动物进行免疫组化学分析(IHC),以表征所述导管的新组织,特别是在造口处。在犬的研究中,预先分析同样的时间点,以评估新膀胱组织的组成,随后新膀胱扩大TM移殖(JayoII2008年,见上文),其接种两种细胞类型:膀胱来源的上皮细胞和SMC,其中在这项研究中的所述新泌尿导管测试件只接种脂肪来源的SMC。细胞角蛋白7(CK-7)-所述上皮细胞覆盖所述导管的所述颅端和中间部分(第5切片-表5.4)的管腔表面,染色对CK-7为阴性。然而,所述管腔上皮细胞第6切片(所述导管的尾端部分),染色对CK-7为阳性。Pancytokeratin(AE1/AE3)-存在于第5切片(表5.4)(所述导管的颅端和中间部分)的所述管腔上皮细胞染色对AE1/AE3为阴性,除了在皮肤-造口接口处的上皮细胞。在第6切片(从输尿管吻合口附近的尾端部分)中,覆盖管腔表面的的上皮细胞染色对AEl/AE3为阳性。抗α-平滑肌肌动蛋白(SMA)-来自第5(表5.4)切片的导管壁组分在颅端和中间导管,对SMA染色为阴性。第6切片(表5.4)的所述壁组成,在所述导管的尾部区域,染色对SMA为弱阳性。钙调蛋白(CLP)-来自在所述颅端和中间导管的第5切片和在所述导管尾部区域的第6切片(表5.4)的导管壁的组成,对CLP染色为弱阳性。这些研究结果与先前报道(JayoII(2008)见上文)的相一致。此外,上皮细胞覆盖所述皮肤造口接口的新组织和所述导管颅端和中间部分的管腔表面。结论:在所述造口的构建/重建中使用的所述脂肪、硅树脂和快门方法用于第一批三只动物(1,2,和3)显示皮下造口紧束导致狭窄。在发红造口的形成中使用腹内疝气补丁(在肌肉和内脏之间)表现出过度的炎症宿主反应导致阻塞和随后的瘘管形成。在发红造口的形成中使用皮下疝气补丁(在皮下脂肪和骨骼肌之间)仅引起轻度至中度的炎症和显著降低的造口-皮肤紧束,导致延长的造口开放。所述造口处尿流梗阻的发病率,主要是由造口狭窄或使用内部(在肌肉和内脏之间)补丁引发,其导致形成瘘管。上泌尿道发现的所述发生率与造口狭窄的观察相一致。在植入后的32天,在所述皮肤造口接口和所述管腔黏膜表面形成类天然的黏膜皮肤连接,由在导管的所述颅端和和所述中间部分观察到的所述细胞角蛋白-7和pancytokeratin阳性上皮细胞作为证明。在植入后的32天,所述猪的导管组织的新组织组成与犬的新膀胱组织在植入后在等价的(JayoII(2008年)时间上相一致,表明由犬的新膀胱扩大和猪的新泌尿导管引起的泌尿组织再生的等价结果。由在犬中(JayoII(2008年),见上文)新膀胱扩大以及在猪中由新泌尿导管引发所述等价的泌尿新组织的形成,进一步表明接种有两种细胞类型(膀胱来源的尿路上皮细胞和平滑肌细胞)或一种细胞类型(脂肪来源的平滑肌细胞)的测试件的所述再生能力是类似的。实施例6-从成年大鼠中分离肺组织细胞简言之,用PBS漂洗肺组织。在冰上切碎组织彻底打破胸膜。在室温(RT)下,用胶原酶IV消化并振动所述切碎的组织20分钟,然后研碎并通过重力沉淀,吸移所述上清液。重复两次所述消化和研碎步骤。最终消化后,研碎所述样品并用100uMSteriflip过滤。然后,用DMEM+10%FBS中和所述样品,并在300xg下沉淀细胞5分钟。用DMEM+10%FBS洗涤细胞沉淀3次,最后一次洗涤后,在500xg下沉淀细胞5分钟。细胞再悬浮于50/50培养基[50%DMEM高葡萄糖(4.5g/L),50%KSFM含有HurEGF1-53、BPE、5%FBS、1XAnti-Anti和1X的胰岛素-转铁球蛋白-硒(InsulinTransferrinSelinium,ITS)]。实施例7-在3D培养中分离的肺细胞的细支气管和肺泡特异性标记物的基因和蛋白表达如在实施例6中分离的细胞,在Matrigel、凝胶泡沫和聚-乳酸-共-乙醇酸共聚物(PLGA)泡沫上铺板,并保持在50/50的培养基中,以测试假说:这些细胞可被分离并表达与其肺原点一致的标记物。结果:测试的标记物:CCSP(Clara细胞分泌蛋白)为支气管上皮细胞;proSP-C(Pro-surfactantProtein)为肺泡上皮细胞。图16A显示:在Matrigel>14天的大鼠肺消化增长中,从肺泡形成单元表达Clara细胞分泌蛋白并用ClaraC(Millipore)1/2000(绿色)免疫组化染色。DAPI用于核染色(蓝色)。图16B显示:在Matrigel>14天的大鼠肺消化增长中,从肺泡形成单元表达Prosurfactant蛋白C并用ProSP-C(Millipore)1/2000(绿色)免疫组化染色。DAPI用于核染色(蓝色)。图16C显示:在明胶海绵上,10到11天的肺泡细胞中,从肺泡形成单元表达Prosurfactant蛋白C并用ProSP-C1/2000(绿色)染色。DAPI用于核染色(蓝色)。图16D显示:在明胶海绵上(10到11天)的肺泡细胞中,从肺泡形成单元表达ProsurfactantC的全貌图,用ProSP-C1/2000(绿色)染色。DAPI用于核染色(蓝色)。图17显示:在PLGA泡沫上,10到11天的肺泡细胞中,从肺泡形成单元表达Clara细胞蛋白,并用Clara细胞1/2000(绿色)染色。图18示出从肺泡形成单元中表达KRT18。KRT18为肺的特定细胞角蛋白和上皮细胞标记物。如果IEC1592为阴性,则肺D11被用作校准器,因此,其得到默认的RQ值1.0。图18还描绘从肺泡形成单元表达SCGB1A1。SCGBlA1(分泌球蛋白、家族1A、成员1(子宫珠蛋白))为Clara细胞标记物。SCGB1A1的强表达证实Clara细胞的IF染色。图18还示出了从肺泡形成单元表达SFTPA1。SFTPAl(表面活性蛋白A1)为肺泡上皮细胞标记物。如果IEC1592为阴性,则肺D11用作为校准器,因此,其得到默认的RQ值1.0。细支气管和肺泡特异性标记物的基因和蛋白表达支持了如下结论:已成功地分离这些细胞类型并使用2个不同的支持材料进行三维培养。已经从肺组织细胞分离中观察到自发形成的搏动细胞体。这是在几个细胞培养条件下(包括但不是唯一,使用基质胶),具有卫星流细胞的三维细胞簇。所述细胞的特征在于在这些细胞簇为上皮、平滑和骨骼肌细胞及神经源,如分别抗vWF、钙调蛋白、和连接蛋白43的抗体进行的免疫反应性评估的。已经显示:所述细胞簇有节率的搏动并显示在体外的收缩性。实施例8-在基质胶(Matrigel)上肺AFU来源的体生长连接蛋白43检测细胞-细胞间的通道。这些通道的集落组装产生连接间隙。在细胞生长的发育和调控中间隙连接通讯是很重要的。图19示出了连接蛋白43染色大鼠肺AFU的共焦图像。图19的所述左侧板描述了AFU典型的“葡萄串”外观。所述右侧板中描述了AFU内明显的空腔。在基质胶上从肺AFU观察到搏动体的形成。搏动体表现出自发性的收缩。最后,分离的大鼠肺细胞似乎能够在3-维培养过程中形成AFU结构。实施例9-明胶海绵和PLGA支架(有和没有预接种Ad-SMC)上的肺AFU图20描述了明胶海绵和PLGA支架(有和没有预接种Ad-SMC)上的肺AFU(上部左侧板-明胶海绵预接种Ad-SMC,然后接种分离的肺细胞;上部右侧板-明胶海绵没有预接种Ad-SMC,然后接种分离的肺细胞;底部左侧板-明胶海绵预接种AD-SMC,然后接种分离的肺细胞;下方右侧板-明胶海绵没有预接种Ad-SMC,然后接种分离的肺细胞;箭头描述预接种Ad-SMC的支架上形成明显的AFU);只接种分离的肺细胞,没有预接种Ad-SMC在支架上不明显。图21显示了顶部左侧板上,明胶海绵(-)Ad-SMC用抗Clara细胞蛋白抗体染色;顶部右侧板显示明胶海绵(-)AD-SMC的时相图;底部左侧板显示明胶海绵(+)AD-SMC用抗Clara细胞蛋白抗体染色;以及底部右侧面板显示明胶海绵(+)AD-SMC的时相图。与顶部左侧板相比,底部左侧板染色强度的增加表明:存在Ad-SMC支持大鼠肺细胞增殖。图22显示了在顶部左侧板上,明胶海绵(-)Ad-SMC用抗表面活性蛋白C抗体染色;顶部右侧板显示明胶海绵(-)AD-SMC的时相图;底部左侧板显示明胶海绵(+)AD-SMC用抗表面活性蛋白C抗体染色;以及底部右侧板显示明胶海绵(+)AD-SMC的时相图(底部板的箭头描述了明显的AFU形成)。与顶部左侧板相比,底部左侧板染色强度的增加表明:存在Ad-SMC支持大鼠肺细胞AFU形成。图23描述了在顶部左侧板上,PLGA支架(+)Ad-SMC用抗Clara细胞蛋白抗体染色;顶部右侧板-PLGA支架(+)AD-SMC的时相图;以及底部左侧板显示免疫荧光和时相图的合并(顶部板的箭头描述了明显的AFU形成)。图24显示了明胶海绵支架(+)Ad-SMC用抗表面活性蛋白C抗体染色;顶部右侧板显示明胶海绵支架(-)AD-SMC的时相图;底部左侧板显示免疫荧光和时相图的合并(板的箭头描述了明胶海绵内部的中空空间)。总之,AD-SMC有利于增加大鼠肺细胞增殖。与没有预培养Ad-SMC的支架相比,在接种大鼠肺细胞之前,预培养具有Ad-SMC的明胶海绵和PLGA支架材料明显增加了大鼠肺细胞AFU的形成。在明胶海绵内大鼠肺细胞围绕中空空间的边缘生长,模仿完整的肺中肺泡结构的所述外观。实施例10-从脂肪分离平滑肌细胞以接种GI支架从14只雄性Lewis大鼠皮下获得腹部脂肪样品,并用等体积的DMEM-HG/抗生素/抗真菌的(Invitrogen-Gibco)(5ug/ml)洗涤3次。在37℃下,用过滤灭菌胶原酶I(0.3%,1%BSA,在DMEM-HG中)消化脂肪1小时,然后在50ml圆锥管中,300g离心5分钟。通过100μm的Steriflip真空过滤器过滤所述基质血管部分(SVF),以除去脂肪和残余组织,然后用DMEM-HG+10%FBS中和。沉淀所述细胞群并在300g下再次进行洗涤5分钟,并再悬浮于DMEM-HG+10%FBS+抗生素/抗真菌5μg/ml中。初级脂肪组织来源的平滑肌细胞(Ad-SMC)铺板并保持在SMC生长培养基(DMEM-HG/抗生素/抗真菌(5μg/ml)(补充10%胎牛血清(FBS,Invitrogen-Gibco))中。在37℃下,湿润、含5%CO2的气体中孵育培养物。用胰蛋白酶(Invitrogen-Gibco)消化从组织培养塑料去除细胞,并重新铺板到新鲜的培养皿上,在70-90%的汇合度下进行传代。观察到大鼠源自脂肪的细胞形态(传代1,20X),而且与在其它物种,包括犬、猪和人类预先培养的脂肪来源的细胞表现相同。免疫荧光。从所述培养皿除去培养基,用磷酸盐缓冲盐水(PBS)漂洗所述贴壁细胞3次。用2%多聚甲醛/PBS在4℃下过夜固定细胞,然后用PBS漂洗三次。用钙调蛋白和平滑肌α肌动蛋白初级抗体(3μg/mL终浓度)过夜孵育细胞,在通透缓冲液(PBS含0.2%的TritonX-100和2%正常山羊血清)中稀释。然后用PBS漂洗3次,加入最终浓度为lμg/mL的二级抗体并孵育30分钟。用Hoechst染料染色细胞核(蓝色),并在用荧光显微镜(LeicaDMI4000B)观察之前用PBS漂洗3次。进行免疫染色以确认在蛋白质水平上这些细胞表达平滑肌细胞标记物的子集。根据我们的经验,选择钙调蛋白和平滑肌α-肌动蛋白,与其它(未发表的数据)相比,在静态培养的细胞中这些蛋白质是可最可靠检测的。从脂肪中分离的大鼠细胞中观察到的所述丝状染色与从其它组织分离的平滑肌细胞染色是相同的。观察到钙调蛋白和平滑肌α-肌动蛋白的免疫染色,并提供支持:所述分离和培养的细胞为大鼠脂肪来源的平滑肌细胞(Ad-SMC)。钙调蛋白和平滑肌α-肌动蛋白的表达与预先其它物种,包括犬,猪和人类培养的Ad-SMC表现相同。TaqMan实时定量RT-PCR。按照厂家说明,使用RNeasyPlusMini试剂盒(Qiagen)从大鼠的Ad-SMC中纯化RNA。按照厂家说明,使用SuperscriptVILOcDNA合成试剂盒(Invitrogen),从2μg的RNA中产生cDNA。cDNA合成后,将各样品稀释1:6。使用10μl预混液(2X),1μl引物/探针,9μlcDNA(1:6稀释)进行qRT-PCR。随后TaqMan引物/探针用于评估平滑肌细胞、内皮细胞和脂肪细胞的基因表达:SMαA(平滑肌α肌动蛋白)、SM22、MYOCD(心肌素)、SMMHC(平滑肌肌球蛋白重链)、CNNl(钙调蛋白)、ADIPOQ(脂联素)、FABP-4(脂肪酸结合蛋白#4)、CDH5/VECAD(血管内皮细胞钙粘蛋白)、vWF(血管性血友病因子)、PECAMl(血小板内皮细胞粘附分子#1)、和KDR/FLK1(胎肝激酶#1)。PPIB(肽基脯氨酰异构酶B)用作内源性对照,所有样品针对大鼠脂肪组织的cDNA进行校准。所有引物/探针获自AppliedBiosystems。在ABI7300实时热循环仪中使用默认循环参数进行所有的反应。通过比较Ct值,使用相对定量(RQ)方法进行PCR数据分析。提取总RNA并进行定量RT-PCR,以评估指定的传过多代的平滑肌标记物基因心肌素、平滑肌α肌动蛋白、transgelin、肌球蛋白重链、和钙调蛋白的表达。这些蛋白质都参与了平滑肌细胞的所述收缩功能。我们的研究结果表明,从细胞大鼠脂肪组织分离的细胞在转录水平上表达所有这些指定的平滑肌细胞标记物。在分离(P0)及后续的3代(P1、P2和P3)后立即培养的细胞中,观察到标记物的表达,在这之后,终止培养。总体而言,原始大鼠培养物(P0)种存在SMC标记物的表达,并在随后的传代(P1-P3)中增加。这种表达模式与以前其它物种,包括犬、猪和人类中培养的Ad-SMC表现相同。在培养中观察到脂肪细胞标记物脂联素、和脂肪酸结合蛋白4、和上皮标记钙粘蛋白-5、血小板/上皮细胞粘附分子、激酶插入结构域受体、和vonWillebrand因子的表达,随后紧接着分离(P0)。这是预期的,因为这些类型的细胞也存在于脂肪组织中。这些标记物在所述第一代(P1)的表达显著降低,并在随后的传代(P2,P3)中几乎检测不到。这种损失脂肪细胞和内皮细胞标记物表达的模式反映出先前从其它物种(包括犬、猪和人类)培养的Ad-SMC。利用分子和蛋白质分析,已经证实:我们可以从大鼠皮下脂肪分离脂肪来源的平滑肌细胞(AD-SMC)。大鼠Ad-SMC与从犬、猪和人类脂肪组织分离出的Ad-SMC具有相同的特性。实施例11-GI支架接种平滑肌细胞测试了所述平滑肌细胞在生物材料上的相容性。对几个支架材料进行了测试,包括如下:PCL泡沫:a)23-53μm;b)106-150μm;c)150-250μm;d)250-300μm;PLCL泡沫(150-250μm);规则PLGA/PGA毛毡(3mm厚);薄PLGA/PGA毛毡(0.5mm厚);明胶PLGA/PGA毛毡;Vicryl编织PGA网;编织PGA管。支架材料的准备-准备泡沫,其它额外材料通过商业从供应商购买。在室内进行涂覆所述PGA毛毡。准备材料后,从各材料(n=3)中获得5mm的冲头,并保持在干燥器中,直至准备使用。接种支架的培养-用60%乙醇对支架进行约20分钟简单消毒,并用1XPBS冲洗5分钟。使用平滑肌细胞(SMC)培养基预湿支架15分钟。随后,采用超低细胞附着的24孔板将15μlSMC培养基中的3×105的大鼠Ad-SMC接种到每个支架。允许所述细胞附着到所述支架,在37℃的湿培养箱中进行3小时。MTS试验-经过2小时的所述细胞附着后,所述板的各孔填充PBS,并放置在摇臂上进行5分钟,吸取所述PBS,然后更换新鲜的PBS;重复3次。进行此程序以从所述支架去除任何未附着的细胞。在PBS中最后一次洗涤后,在所述支架上进行所述MTS试验(非破坏性的细胞增殖检测;试剂盒购自Promega),以测定细胞在所述材料上的快速附着。简而言之,施用于每个支架的MTS溶液比率为20μlMTS到100μlSMC培养基。加入所述MTS溶液后,在摇杆上孵育所述支架1小时。每个支架的所述溶液被放置在96孔板中并在Elisa板读数器上490nm处读取吸光度水平。然后用1XPBS冲洗所述支架,直到除去所有的MTS溶液。继续在所述支架上加入新鲜的SMC培养基,在37℃下附加培养7天。此时,进行另一个MTS检测,以评估细胞附着。图25A-C显示在各种生物材料上平滑肌细胞的附着/增殖。尽管接种2小时后,所述PCL和PLCL支架具有较低的细胞附着值(见所述MTS测定吸光度读数),与PGA支架相比,在这些材料上的所述活的/死的图像似乎表现出更好的细胞覆盖。与其它支架相比较,具有23-53和106-150μm孔径大小的PCL支架似乎具有最非活的细胞。第7天前,所述MTS测定吸光度读数显示,所述编织网和规则PLGA/PGA支架具有最高的吸光度读数,从而具有更高的细胞增殖率。接种2小时后也可以看到这种大致趋势,除了薄PLGA/PGA毛毡外,其在第7天前有生长的下降。这可能归因于所述毛毡的“薄”和存在的纤维数量以及可能不存在用于细胞增殖和生长的任何更多空间的事实。图26示出了沉积在各种生物材料上试验活的/死的平滑肌细胞的所述结果。活的/死的活性/细胞毒性试剂盒购自Invitrogen。经过2天的培养,对支架上的所述活的/死的细胞进行试验,以评估活性。使用大鼠Ad-SM以及各种生物材料支持物进行细胞附着和活力研究,其移动用规则PLGA/PGA,薄PLGA/PGA,Vicryl编织网和编织PGA管道作为概念研究在体内证明的测试件。关于附着生物材料的细胞方面,大鼠Ad-SMC的表现像从犬、猪和人类脂肪组织分离的Ad-SMC。PGA/PLGA支架,已经成功地应用于再生膀胱(Basu和Ludlow,TrendsinBiotechnology,28:528-533,2010;Jayo等,(2008年)RegenMed3,671-682),接种Ad-SMC并在培养基中孵育7天。这时,在钙黄绿素AM(绿色)和乙锭同型二聚体1(红色)中孵育接种的支架,分别标记活的和死细胞。如图27A所示,所述支架覆盖以活细胞,如绿色荧光指示的,表明使用的所述生物材料支持大鼠Ad-SMC附着和活力。高倍率(图27B)揭示沿支架纤维附着的详细信息。实施例12-分离食管细胞从装运箱中取出大鼠食管组织,放置在DMEM+5μg/mL庆大霉素(清洗液(Washsolution))中和频繁旋转5分钟。然后将所述组织放入到新鲜的清洗液(Washsolution)中。在将组织切碎成均匀的大小之前,总共重复此过程3次。切碎组织,然后放置到含有消化液(300U/mL胶原酶,类型IV-Worthington/Dispase-Stem细胞在DMEM中;20mL/lg组织)的50mL的离心管中。在37℃下消化进行30分钟。在KSFM培养基中使用20%FBS达到酶中和。然后混合所述消化组织,通过100μMSteriflip过滤器过滤,以确保没有大的组织片段延续。然后在300g下离心此材料5分钟以沉淀细胞。然后用KSFM洗涤此细胞沉淀。所述细胞计数并铺板于培养基(KSFM+2%FBS或KGM(50:50的KSFM与补充剂+含1XAnti/Anti、IXITS的DMEM10%FBS)。如图28中所示,在初始附件(板1上部左侧),似乎有圆形和细长细胞类型的混合群体。随后的传代(P1;其余板2-4)进一步揭示了培养物包括圆形和长形的细胞类型。TaqManqRT-PCR。根据厂商说明,使用RNeasyPlusMini试剂盒(Qiagen)纯化大鼠Ad-SMC的RNA。根据厂商说明,使用SuperscriptVlLOcDNA合成试剂盒(Invitrogen),从2μg的RNA中产生cDNA。cDNA合成后,将各样品1:6稀释。使用10μL预混液(2X),1μL引物/探针,9μLcDNA(1:6稀释)进行qRT-PCR。随后使用TaqMan引物评估上皮基因:KRT8(角蛋白8),vWF(vonWillebrand因子)的表达。PPIB(肽基脯氨酰异构酶B)用作为内源性对照以及所有样品针对大鼠全食管组织cDNA进行了校准。所有引物/探针获自AppliedBiosystems。在ABI7300实时热循环仪中使用默认循环参数进行所有的反应。通过比较Ct值,使用相对相对定量(RQ)方法进行PCR数据分析。如图29A所示,食管组织(Eso#1org;ESO#2org)和培养的食管细胞(EsoIEC)中观察上皮细胞标记KRT8和vWF基因的表达。免疫荧光。从所述培养皿除去培养基,所述贴壁细胞用磷酸盐缓冲盐水(PBS)漂洗3次。用2%多聚甲醛/PBS在4℃下过夜固定细胞,然后用PBS漂洗三次。用CNN1(钙调蛋白)、SMα-肌动蛋白(平滑肌α-肌动蛋白),CK8,18,19(细胞角蛋白8,18,19)初级抗体(3-5μg/mL终浓度)过夜孵育细胞,在通透缓冲液(PBS含0.2%的TritonX-100和2%正常山羊血清)中稀释。然后用PBS漂洗3次,加入最终浓度为1μg/mL的二级抗体并孵育30分钟。用Hoechst染料染色细胞核(蓝色),并在用荧光显微镜(LeicaDMI4000B)观察之前用PBS漂洗3次。如图29B中显示,细胞角蛋白8,18,19染色进一步支持这些培养物包含的上皮细胞的定量RT-PCR数据。钙调蛋白和平滑肌α肌动蛋白进行染色,以确定这些培养物是否含有平滑肌细胞。这些结果支持这样的结论:即大鼠食管细胞培养物至少由上皮细胞和平滑肌细胞的异构群组成。实施例13-食管细胞迁移到GI支架上开发体外试验是为了评估食管细胞迁移到规则PLGA/PGA支架材料的能力。简而言之,使用无菌活检冲头(见下面图左侧板)将限定直径的圆形孔切入支架。然后将食管组织插入此孔(见下图右侧板)以及所述整个盒中在生长培养基KGM(50:50的KSFM与补充剂+DMEM-HG+辅以抗生素/抗真菌的5%FBS;5μg/mL,和1X胰岛素/转移/硒(Invitrogen))中,在37℃下,湿润的、5%CO2的空气中孵育8天。完整的、天然的食管由上皮细胞的内部管腔层组成。为了解决接种SMC的支架是否仅仅可以促进食管上皮细胞的迁移,可进行实验,即手术切除的啮齿动物食管组织外植体被插入到先前未接种或已经接种Ad-SMC的支架盒中。图30示出了所述实验的设计,其中手术切除的啮齿动物食管组织外植体插入到单独的支架盒(中间板下方)中或接种Ad-SMC的支架盒中(右侧板)。在孵育8天之后,用角蛋白抗体(作为上皮细胞的标记物)固定和染色所述支架盒。绿色荧光的更大分布表明,与先前没有预接种大鼠Ad-SMC(图27C)的支架盒相比,食管上皮细胞从所述组织进入到先前预接种大鼠Ad-SMC(图27D)支架盒的迁移距离更大。正如预期的那样,支架盒只接种大鼠Ad-SMC,没有插入食管组织,检测上皮细胞(图27E)是无效的。虽然没有对迁移到支架的上皮细胞的数目进行定量,与图27C相比,在图27D中的所述支架前缘处的荧光密度的增加表明:预接种Ad-SMC导致迁移到所述生物材料中的食管细胞的数目更大。图31显示从组织向接种脂肪的PGA/PLGA涂覆的支架迁移/附着角蛋白+食管细胞增加。图31显示的绿色荧光更大的分布表明:相比不含有大鼠Ad-SMC(中间板)而言,更多的食管上皮细胞从所述组织迁移到首先接种大鼠Ad-SMC(右侧板)的所述支架盒。正如预期的那样,接种大鼠Ad-SMC的盒仅作为对照(没有插入食管组织)显示不存在上皮细胞(左侧板)。在本实验的变化中,将薄PLGA涂覆的PGA毛毡缝合到大鼠食管,培养12天至14天,将所述支架切割并用DAPI染色。如图32(两个板)所示,食管细胞已经迁移到支架上,如所述白点(DAPI染色)所指示的。实施例14-植入食管组织结构下面的研究涉及大鼠脂肪平滑肌细胞(SMC)的分离、基因型和表型特性,其目的是实施组织工程技术用于食管组织替换。已经发现:脂肪来源的SMC可用于接种合成的、生物可降解的支架补丁,将这些接种的支架植入到大鼠食管损伤模型导致成功再生所述层状组织食管壁。从大鼠脂肪分离和培养平滑肌细胞。根据实施例1和4(也参见Ludlow等,美国出版专利申请号20100131075)协议,分离和培养SMC。体外食管细胞迁移分析。如实施例13所描述进行分析。支架生产。所述支架材料包括涂有聚-DL-丙交酯-共-乙交酯共聚物(PLGA)的聚乙醇酸(PGA)网。提供PGA作为非编织毛毡,其形式为20cm×30cm×0.75cm的片材,堆积密度为70mg/cc(ConcordiaMedical)。在使用前,PLGA(50:50,Durect公司,IV=0.55-0.75)溶解在二氯甲烷中。通过浸入到含有PLGA溶液(液化共聚物(聚-DL-丙交酯共-乙交酯50:50,80mg/ml二氯甲烷)的烧杯中涂布所述PGA网。加入此涂层以达到足够的机械稳定性。然后,所述涂覆的PGA网格被切割成一定的尺寸,用环氧乙烷灭菌,并存储在干燥剂室中,直至使用。结构植入物制造。SMC生长培养基,无菌的支架(3mmx5mm)在SMC生长培养基中水合,并接种50,000细胞,以制备所述移植结构。该结构覆盖以生长培养基,并在植入前5天,在37℃下湿润的、含5%CO2的气体中孵育。动物外科。在麻醉下,雌性Lewis大鼠(约28天龄)接受上中线剖腹手术。固定腹部食管,并在腹段食管贲门5毫米近端制作测量宽度约3mm和长度约5mm的缺损,用植入的结构替换,使用间断缝合的非吸收性7-0丝(Ethicon)。然后所述结构用大网膜覆盖。在庆大霉素(0.1mg)腹腔注射后,关闭腹部。手术后,所述大鼠回到其笼中,并允许无限制地口服软的食物并摄入水,为期7天。在此时间后,允许所述大鼠无限制地口服硬的大鼠饲料并摄入水。组织学评估。在尸解中,组织中含有所述组织工程食管,由不可吸收缝合线确定和勾画,固定在10%福尔马林缓冲液(Sigma)。选择食管壁(缺损部位)的切片在一系列乙醇中脱水,石蜡包埋。切断切片(5μm)并用苏木精&伊红和Masson'sTrichrome染色(PremierLaboratoryLLC,Longmont,CO.),以可视化基质的和肌肉组成。图33A示出了手术创建的食管缺损和随后结构植入。由于所述食管是膨胀的,以允许通过操作空间,手术切除导致所述缺损为有点椭圆形的形状(图33A-左侧板)。植入后,用于固定所述结构的不可吸收缝合线在植入物的边缘被故意地制成可见的,因此,它们可以用来划定尸解时再生食管组织的边界(图33A中-右侧板)。在移植后的3.5,10,12,和16周处死动物。表14.1总结了这些时间点观察到的病理结果。图33B显示了在植入后1天的组织学。通过所述缺损的横截切片显示植入结构足够地附着到缺损边缘。在网膜包裹侧,具有组织早期组织再生愈合响应,其特征在于由渗透到所述结构新容器(新生血管)、轻度炎症浸润(嗜中性和单核)、游离的和血管内红细胞、以及嗜酸性纤维蛋白的空间。也存在细菌集落的多灶性聚集。所述支架的管腔表面没有证据显示上皮。存在胰腺组织,并具有急性出血性胰腺炎。在解剖学上,所述手术部位在所用的胰腺及使用的网膜附近。应该注意的是,医源性或手术后的炎症可能会意外诱捕所述胰腺的头部或尾部。图14.1图34显示了新生血管(血管生成)。所述左侧板:40倍放大H&E染色(极化的)的切片示出所述缺损部位内的结构支架材料。右侧板:绿色方形区域(左)的更大倍率(600倍),在结构(F)的所述植入的支架纤维中呈现显著的血管再生(箭头)。图35示出了在植入后8天的组织学。切片取自植入物的中心。切片2(纵向);在本切片捕获治疗位点的中心,其示出了支架足够地附着到所述缺损的边缘。在所述管腔表面中没有明显的上皮形成的证据。所述底层壁显示早期组织包括:肉芽/纤维结缔组织、新生血管和边缘附近平滑肌束的灶状再生,但更接近植入物的中心没有观察到,其中似乎是大部分所述支架材料(由于组织切割工件)。总之,在中心和中间外围主要有中度慢性活动性炎症。所述网膜包裹侧面显示了早期组织(包括纤维结缔组织以及肝)附着于网膜,无显著伤害。没有钙化、坏疽或细菌集落的证据。图36示出了植入后8天的组织学。切片取自植入物的周边。切片1(纵向);在本切片中捕获治疗位点的外围方面,支架补丁(结构)与所述缺损边缘表现出足够的附着,及管腔表面的完全上皮形成。食管壁的早期再生,其特征在于组织肉芽/成纤维结缔组织与存在的平滑肌束、新生血管形成和轻度炎性浸润、主要巨噬细胞和淋巴细胞与缝合材料周围的一些巨细胞。生物材料(支架)的降解几乎是完全(-90%)的,如使用偏光过滤器观察到微小残留纤维。没有任何钙化、坏疽或细菌集落证据。所述上覆的网膜表现出明显的附着肺组织相关的慢性活动性炎症,其似乎已经被列入(缝合到)网膜。同样,肝组织内也有缝合材料附着网膜的痕迹。在植入后8天,缺损部位(外周)的管腔表面完全由上皮覆盖,其具有潜在的再生肌束和组织肉芽组织,有轻微的炎症反应,通常在愈合/再生过程中是预期的。在植入后8天,所述缺损的中心显示管腔表面没有明显的上皮形成证据。有肉芽组织围绕的适量的支架材料,其边缘具有再生肌肉束和中度慢性炎症。图37A显示,在植入后10周,合并的食管结构。图37B切片1(横向)的详细信息:天然食管切片有开口(箭头)进入到前胃(F)。用食管结构处理的所述缺损部位是不存在的。图37C显示切片2(横向)的详细信息:天然食管切片具有部分缺损部位远端边缘。有管腔黏膜表面具有完整的上皮再形成,以及黏膜下层再生(固有层和黏膜肌层)。所述外肌层显示不完全的部分再生,包括纤维血管结缔组织和平滑肌细胞,所述平滑肌细胞没有完全布置成圆形/纵向束的形成。最小的支架材料(纤维)主要分布在上覆的大网膜内部和外肌层内。有灶状的最小的慢性炎症(巨噬细胞/淋巴细胞),无钙化、坏疽或细菌集落的证据。图37D显示切片3(横向)的详细信息:新食管、天然食管和处理部位。植入10周后处死动物,以及食管的连续切片,含有完整的天然组织定位到植入部位的前部和后部,除去并处理用于组织学评估(图41D-第一板)。植入部位和相对的天然完整组织的横截切片用H&E(红色)和Masson'sTrichrome染色(蓝色)(图37D-第二板)。完整的上皮所述植入部位和完整天然食管(图37D-第四板)相对壁的更大倍率显示管腔黏膜表面及所述植入部位(图37D-第三板)黏膜下层完整的上皮再形成。此位点的所述外肌层显示的再生证据包括纤维血管结缔组织和平滑肌细胞。然而,所述平滑肌细胞不完全布置成圆形/纵向束的形成,在原生组织中是显而易见的。观察到最小的支架材料(纤维),在目前看来,其似乎仅限于所述上覆大网膜和外肌层。植入部位出现包含最小的灶状慢性炎症,无钙化、坏疽或细菌集落的证据。10周后,食管结构的移植导致新食管再生,其特征在于形成全部三壁层:黏膜,肌层和浆膜层。实施例15-植入小肠组织结构组织工程原理已成功地应用于开发可植入的细胞/生物材料复合物用于重建管腔器官的层壁结构(例如,膀胱),其中在植入复合物(又名结构)后,催化新器官生成并导致功能器官的再生。所述器官再生技术PlatformTM(Tengion公司)已成功地应用了这些原理开发自体再生产物用于尿流改道及其它泌尿道应用,作为使用胃肠道片段(现行护理标准)的替代。小肠(SI)表示管状器官的层状壁结构的特定迭代变化。这里给出的结果证明扩大基础性的器官再生的平台的潜力,除了所述尿路至多于其它管状器官尿路,特别是SI。来自大鼠内脏脂肪的平滑肌细胞(AD-SMC)体外扩大并用于填充生物材料以植入SI(BasuJ,等。第7届ISSCR会议,2009年)。(另见实施例4的协议)。支架生产。支架包括涂有聚-DL-丙交酯-共-乙交酯(PLGA)的聚乙醇酸(PGA)网。作为非编织毛毡供给PGA,其所述形式为20cm×30cm×0.75mm片材,堆积密度为70mg/cc(ConcordiaMedical)。在使用前,PLGA(50:50,Durect公司,IV=0.55-0.75)溶解在二氯甲烷中。通过浸入到含有PLGA溶液(液化共聚物(聚-DL-丙交酯共-乙交酯50:50,80mg/ml二氯甲烷)的烧杯中涂覆所述PGA网。添加该涂层以达到足够的机械稳定性。然后将所述涂覆的PGA网切成一定尺寸,用环氧乙烷灭菌,并存储在干燥剂室中直至使用。或者,通过在hexafluoropropanol(Sigma公司)中静电纺丝10%的PCL的溶液到4mm直径的心轴上制作管状SI支架。结构移植制造。在SMC生长培养基内水合无菌支架(补丁或管道)并接种50,000细胞以制造结构用于移植。所述结构覆盖生长培养基,并在植入前,在37℃下、在湿润的、含有5%CO2的空气中温育5天。来自大鼠内脏脂肪的平滑肌细胞(AD-SMC)体外扩大并用于填充生物材料以植入SI。Ad-SMC接种到PGA编织网或PGA或PCL管上以组装SI补丁或管结构(图38)。用非可吸收的缝合线缝合SI补丁结构,在矩形缺损上(5mm×4mm),其切成所述SI壁完全暴露管腔。管状SI结构(1mm长,4mm内径)用于连接横向剥离后所述SI的前部分和远侧部分,并除去天然SI的1cm部分。动物外科。在麻醉下,雌性Lewis大鼠(约28天龄)接受下腹中线剖腹手术。固定小肠并制作测量宽度约3mm和长度约5mm的缺损,用植入的结构替换,使用间断缝合的非吸收性7-0丝(Ethicon)。作为选择,从宿主中完全切除小肠1cm的管状部分,并使用连续缝合非吸收性7-0丝(图39A-B)端到端连接1cm的管状结构。图39C示出了补丁结构植入小肠的实施例,围绕所述补丁的边缘可见深色非吸收性的缝合材料。然后所述结构覆盖大网膜。庆大霉素(0.1mg)腹腔注射后,关闭腹部。手术后,所述大鼠回到了它们的笼子,并允许无限制地口服软的食物并摄入水为期7天。在此时间后,允许所述大鼠无限制的口服硬的大鼠饲料并摄入水。对收获的大鼠进行时间为4天至20周的植入后再生组织学评估。组织学评估。在尸解中,组织中含有再生小肠,由不可吸收缝合线确定和划定,固定在10%福尔马林缓冲液(Sigma)中。从所述小肠壁缺损部位选定的切片在一系列乙醇中脱水,用石蜡包埋。切割切片(5μm),并用苏木精-伊红和Masson'sTrichrome(PremierLaboratoryLLC,Longmont,CO)染色,以可视化基质和肌肉组分。非可吸收缝线标记所述缺损部位允许天然SI和新SI组织相比较,以评估管腔黏膜层和肌肉层的再生,其包括天然SI壁。以SI结构为基础的补丁的肠壁完全再生。为了论证所述小肠的再生,包括矩形4X5mm、vicryl聚合物组成的补丁型结构被用于纠正在雌性Lewis大鼠(n=4)所述SI壁中手术引起的缺损。在实施安乐死和再生区域恢复(如由非吸收缝合线所限定的)之前,允许试验动物恢复8-20周。通过对试验动物(摘要未示出)进行组织学分析,以评估再生的程度。植入后8周前观察到所述管腔黏膜表面的上皮再形成。在此时间点前,生物材料的几乎完全降解是显著的。没有明显的慢性炎症。更重要的是,如在图40A中所示,在植入后8周前观察到包括所述肌层的所有三层小肠壁的完全再生。图40A上面左侧板(Trichrome,10x纵向,肠);上面右侧板(Trichrome,40x植入/缺损部位),左下(所示具有肠内容物的管腔;亚肉眼、小肠(纵向开口的)、暴露管腔(肠内容物)和缺损部位(虚线),右下(Trichrome,40x正常肠)。在植入后的16周,SI补丁处理部位(图40B-C)的纵向切片显示了肠黏膜和黏膜下层的完全再生以及肌肉层的部分再生,没有残余支架纤维,钙化、坏疽或细菌集落的证据。图40B的左上板显示了亚肉眼、小肠和缺损部位(虚线椭圆区域)。右上面板显示了Trichrome、X10的植入/缺损部位。所述2个左下板显示了Trichrome、X400的植入/缺损部位及再生的肌束是可见的-边缘(左)和中心(右)的缺损。所述右下方板显示了Trichrome、X40的植入/缺损部位(双头虚线)。图40C提供了该面板更大的版本。来自管状SI结构的肠壁部分再生。手术切除约1cm的天然大鼠SI后,通过直接端对端吻合(n=6)植入管状SI结构(图41)。管状结构由Ad-SMC接种的(PGA或PCL组成的)生物高分子组成。植入后,允许宿主啮齿动物恢复时间为4天至5个月(摘要未显示)。以扼要方式努力介导管状结构中SI壁的再生,因外科手术程序发育相关的困难,观察到的SI补丁是复杂的,包括不完全的吻合、狭窄、多余的缝合材料,从结构挤压生物材料,结构的血管缺乏或不完整及粘连及相关的肠梗阻(摘要未显示)。尽管存在这些困难,观察到再生结果的初步指标。在植入14天后,注意到结构所述管腔黏膜表面的部分上皮再生。没有观察到肌层的相关再生,注意到只有最小的的生物材料降解。肠壁的初步再生与纤维血管层的形成相关。植入后14天前,也观察到增长的纤维血管组织以及伴随的新生血管。植入后10周之前,观察到生物材料(PGA)完全降解。注意到所述结构的管腔黏膜表面的显著的上皮再生,与相关的纤维血管组织浸润。观察到缺乏上皮再生,很可能是由于显著的细菌集落。重要的是,所述管壁的再生伴随着多灶性聚集的肌肉纤维的形成,主要位于吻合口的边缘(图41)。图41所述左上板显示了二分小肠后的亚肉眼图像,显示了PGA管段。所述右上板显示了植入部位(Trichrome,x10,箭头指示吻合)。所述左侧的第一下板显示了HE,x400显示的腔面,由细菌集落(染色嗜碱性)覆盖。所述管壁为高度血管化的。所述第二下板显示Trichrome,×10显示的管壁(中档)纵截面。第三下板显示所述管腔(HE,×400)显示管腔表面,由细菌集落(染色嗜碱性)覆盖。所述右侧的第四下板显示了Trichrome,x40显示吻合部位(近端)和PGA管腔表面上的上皮再生程度。植入后5个月,生物材料(PGA)完全降解,并注意到所述管腔黏膜表面的上皮细胞层几乎完全再生。通过多灶状聚集的肌纤维和束浸润具有潜在成纤维血管结缔组织的黏膜上皮细胞,主要靠近所述缺陷(图42)的边缘。图42的左上板显示了二分小肠后的亚肉眼图像,显示了PGA管段(双头黑色箭头表示)。所述右上方板显示了植入部位,Trichrome,X10。所述4个下板显示了TrichromeX100,TrichromeX10,TrichromeX100,和三色X40(从左至右)。实施例16-评估用于食管或小肠结构的生物材料目前用于患者需要的食管或小肠(SI)组织替代的治疗策略往往与副作用相关,其对生活质量产生负面影响。为了解决这个问题,本研究旨在应用组织工程的原理再生这些器官。以前,这些原理已被成功地用于开发用于植入细胞/生物材料复合材料以重建膀胱,及层壁结构的其它管状器官。在这种情况下,植入复合物(又名,结构)后催化新器官形成并导致功能器官的再生(BasuandLudlow.TrendsBiotechnol.2010;28(10):526-33;BasuJ.第7届年度ISSCR会议,2009;JayoMJ.RegenMed2008;3:671;JosephD.JUrol2009;181:555)。方法:对不同形式和组成的生物材料进行评估。通过溶剂铸微粒沥滤法制作孔径为23-300μm的聚己内酯(PCL)泡沫以及各种形式的涂有聚-DL-丙交酯-共-乙交酯共聚物(PLGA)的聚乙交酯(PGA)纤维。这些包括涂层PGA非编织网(PGAnw),编织网(PGAw)和编织管(PGAb)。来自大鼠内脏脂肪(Ad-SMC)的平滑肌细胞在体外扩大,并用于接种生物材料在体外和体内评估(Basu2009见上文)。通过活体/死体染色,细胞附着/增殖试验(MTS)和扫描电子显微镜(SEM)对体外非细胞生物材料的相互作用进行评估。为评估食管和SI在体内的再生,修剪PGAw和PGAnw至5mmx4mm的矩形小块,并接种Ad-SMC制作结构。Ad-SMC的PGAb用于制作管状SI结构。用非吸收缝线缝合食管和SI的补丁结构,将所述组织壁切成约5mm×4毫米的矩形缺损以在成年大鼠中暴露所述管腔。管状SI结构(10mm长,4mm内径)用于连接横向剥离后所述SI的前部分和远侧部分。大网膜缝合在所述结构上,以提供血管形成的来源。动物处死的时间点为移植后的6天到20周。在尸解中,收集组织,固定在福尔马林中并用石蜡包埋,用于切片及用Trichome染色。所述非吸收缝线标记所述缺损部位允许比较所述原生和所述再生组织。结果:体外实验显示:所有材料具有可接受的细胞活力、增殖和形态。图43-左:在PCL泡沫上,大鼠的Ad-SMC活体/死体染色,孔径150-250μm,10X。右:在PGAnw上的大鼠Ad-SMC扫描电镜图像,170X。在所述较小孔PCL泡沫上可见较低的细胞活力和增殖。也在体内进行了分析。图37D显示:在植入10周后,通过所述PGAnw食管补丁结构的缺损部位切片。图40显示:植入8周(图40A)和16周后(图40B-C),所述PGAwSI补丁结构。图41显示:10周时的所述PGAbSI管状结构。在图42中,所述PGAbSI管状结构,植入20周后,所述管腔黏膜表面和黏膜下层显示完全的上皮再形成,以及所述外肌层的部分再生。没有证据表明残余支架纤维钙化、坏疽或细菌集落。PGA和PCL生物材料显示出体外Ad-SMC的生物相容性。PGA材料适用于生产食管和SI补丁以及SI管状结构。在体内植入PGA补丁结构导致在10周和16周内,分别再生食管和SI组织。在体内植入PGAb管状结构导致在20周内再生SI组织。实施例17-从外周血及脂肪组织中分离和扩大内皮细胞已经从外周血和脂肪来源成功分离内皮细胞(Daiju等,2005年。循环111:926-931;Shepherd等,2006年,FASEBJ.20:E1124-El132;melero-MartinJM等,2007年,Blood109(11):4761-4768;Kern等,1983年,J.Clin。Invest.71:1822-1829;Planat-benardV等,2004年,循环109:656-663)。也报道了通过在培养基中补充血管内皮细胞生长因子(VEGF)促进来自外周血来源的内皮细胞的培养。血液来源的细胞-细胞分离和培养:简而言之,从健康人类志愿者中获得外周血,随后在无菌条件下静脉穿刺(venapuncture)和收集。用DPBS,稀释肝素化血液或白细胞预备(新鲜至24小时龄)2到4倍,并在Histopaque1077等体积上分层。然后在400-800xg下旋转30至45分钟梯度。取回单独分离条带中的细胞并用DPBS洗涤。再悬浮于选择的(α-MEM补充10ng/mlVEGF;α-MEM中含有10%FBS、不补充VEGF)培养基中,然后涂覆细胞到I型胶原、纤连蛋白或胶原蛋白IV(或其组合物)涂覆的板上,例如每P100添加相当于原来全血体积的5-20ml。在每隔2-4天用新鲜培养基持续更换和喂养之前,涂覆的细胞被放置在37C/5%的CO2中,24-96小时。集落的生长发生在7-21天之内。胰蛋白酶消化并接种4000-8000细胞/cm2后,进行细胞传代2代。具有或没有VEGF的EGM-2个培养基也可以用于培养细胞。培养的外周血细胞的细胞形态:如上所述,外周血细胞分离后,在此培养基中培养细胞2-3周,并检验它们的形态(见图44,板B)。外周血细胞的对照培养物被保持在此培养基中,含有10%FBS,无VEGF添加剂(板A)。相比HuAEC(其作为阳性对照(板C)),外周血细胞形态保持在这两种培养基中。外周血细胞保持在10%的含血清的培养基中,不补充VEGF,表现出成纤维细胞状的细胞形态(板A)。随后这些细胞培养在培养基中,添加10ng/mlVEGF(板B),细胞表现出缩短的、圆形的或长方体形状的内皮样形态,与对照的内皮细胞培养的相同(板C)。因此,从外周血中分离的内皮样细胞可以成功地在培养基(补充有VEGF)中培养。培养的外周血细胞的内皮细胞基因表达分析:用于RT-PCR分析的细胞样品取自:被保持在10%的含血清的培养基中(不补充VEGF(图45,泳道1))的培养物,以及保持在补充10ng/mlVEGF(泳道2)的培养基中的培养物。不含任何PCR引物的蒸馏水被用作阴性对照(泳道3),同时HuAEC被用作为内皮细胞基因标记物表达(泳道4)的阳性对照。表17.1提供了用于RT-PCR分析中的内皮细胞基因标记物的列表。B-肌动蛋白被用作凝胶的加载对照。当在补充或不补充VEGF的培养基中培养时,观察到这些内皮细胞标记物的表达。因此,确定可以从外周血进行分离和培养内皮细胞。表17.1.选择内皮细胞基因标记物用于RT-PCR分析标记物基因缩写内皮细胞钙黏着蛋白5CDH5/VECAD内皮细胞vonWillebrand因子vWF内皮细胞血小板内皮细胞黏着分子PECAM1内皮细胞FMS-相关的酪氨酸激酶IFLT1/VEGFR内皮细胞激酶插入域受体KDR/FLK1内皮细胞酪氨酸激酶TEK源自脂肪的细胞-细胞的分离和培养:通过供应商从皮下或吸脂术获得人脂肪样品,并用等体积的PBS/庆大霉素(Gibco)(5μl/ml)洗涤3-5次。在37℃下,用过滤-灭菌的胶原酶I(Worthington)(0.1%,DMEM-HG中1%BSA(Gibco))消化脂肪1小时,然后在50mL圆锥管中300g下离心5分钟。所述基质血管部分再悬浮于PBS/1%BSA中,并通过100μm的Steriflip真空过滤器过滤。所述细胞群在300g下再次沉淀5分钟,再悬浮,并在α-MEM中培养,所述α-MEM补充10ng/ml的VEGF;α-MEM含有10%FBS,不补充VEGF;或DMEM含10%FBS。有或没有VEGF的EGM-2培养基也可以用于培养细胞。培养的源自脂肪的细胞的细胞形态:如上所述,在分离脂肪细胞后,在此培养基中培养细胞2-3周,并检查其形态(参见图46,板B)。源自脂肪的细胞对照的培养物保持在含10%FBS培养基中,其不补充VEGF(板A)。相比HuAEC(其用作为阳性对照(板C)),源自脂肪的细胞形态保持在这两种培养基中。源自脂肪的细胞保持在含10%血清的培养基中,不补充VEGF,维持平滑肌细胞样形态,包括细长的、旋转的细胞(板A)。随后在培养基中培养这些细胞,补充10ng/ml的VEGF(板B),细胞表现出缩短的、圆形的或立方形的形状的内皮样形态,与对照的内皮细胞培养物(C组)所见的相同。因此,从脂肪组织分离的内皮样细胞可以成功地在培养基中培养(提供VEGF)。源自脂肪的细胞的内皮细胞基因标记物的表达:分离源自脂肪的细胞并在DMEM+10%FBS中培养,目的是通过RT-PCR(见表17.1。标记物列表)表达分析内皮细胞基因。初始涂覆后在24-和48-小时采取细胞样品,而且也用于随后的传代(P0到P3)。人类主动脉内皮细胞(HuAEC)被用来作为标记物表达的阳性对照。图48显示了培养在含10%FBS中的源自脂肪的细胞的内皮细胞基因表达分析的所述RT-PCR结果。在初始分离后,源自脂肪的细胞含有内皮细胞群,其如6个内皮细胞标记物(初始涂覆后24小时和48小时)基因表达证明的。在DMEM10%FCS中培养和传代时失去这些基因的表达,如失去内皮细胞的基因表达(P0-P3)所示的。因此,内皮细胞群体存在于脂肪组织,可在初始细胞分离后确定。用于RT-PCR分析的细胞样品取自保持在含10%血清培养基(不补充VEGF)的培养物中(图47中,泳道1和3),以及保持在补充10ng/mlVEGF培养基的培养物中(泳道2和4)。不含任何的PCR引物的蒸馏水用作为阴性对照(泳道5),同时HuAEC用作为内皮细胞基因标记物表达(泳道6)的阳性对照。B-肌动蛋白被用作凝胶的装载对照。在补充有VEGF的培养基中培养时,观察到的一个或多个这些内皮细胞标记物的增强表达。从而确定可以从脂肪组织中分离和培养内皮细胞。有或没有VEGF的EGM-2培养基也可用于培养细胞。实施例18—犬类研究,以评估新膀胱和新泌尿导管的移植在体内进行研究,以确定用于组织再生和替换而移植的新膀胱结构(NBR)或新泌尿导管(NUC)的所述功能结果。取10只动物进行所述研究。在所述最终植入手术之前,3只动物进行了膀胱活检程序,捐赠自体细胞用于所述支架接种。在最终手术前,这些动物恢复数天。所有的动物都进行了尿道保留膀胱切除术并植入Tengion的新膀胱结构。11只动物中的2只植入接种有自体SMC的结构,而其余8只动物植入接种有异体SMC的结构。动物存活43天至187天。在存活期间,所述动物的新器官总共循环0-162小时。通过尿动力学评估、指定时间点的膀胱造影照片、以及偶尔的膀胱镜检查来监测新器官的发育。使用超声和分析尿液和血液来监测肾脏健康。在生存期结束时,收集uritogenital系统组织并进行组织学分析。成功移植了10只动物并存活了43至188天。由终端医疗条件(即新膀胱穿孔、肾脏感染、或肾积水),在选择性时间点处死11只研究动物中的4只;并在第13周,处死1只动物用于组织病理学评估的目的。存活所述其余6只,完成预定的生存期。研究设计。对总共10只犬进行评估(7只雌性,3只阉割的雄性),作为在健康动物中的完全膀胱替代。在此之前,并在恢复期间,在指定的时间点采集血液和尿液样本,分析和记录。植入约1周后,所述动物发育的新器官通过堵塞所述尿道开口进行循环,通过球囊导尿管以允许所述膀胱填充尿液,然后在预定的时间点去除堵塞,直到证明所述动物是有自制能力的,允许开始“自然循环”。对所述新器官进行定期的透视成像、泄漏点压力监测(LPP)、超声波检查、和膀胱镜评价以及在不定期时间点来衡量新器官的能力,评估新器官的壁厚,并通过整个持续的研究来监测新器官、输尿管和肾脏的所述状况。表18.1提供了每个动物的信息。手术。在动物的处理、进行技术规程及手术准备之前,使动物服用镇静剂。表18.1*雄性为阉割的活检。在腹部制作中线切口,对1号和4号动物直接从尾部开始到肚脐,所述1号和4号动物预计植入自体结构。将所述泌尿膀胱暴露并清空尿液。从所述膀胱切除一个2cmx2cm的尖圆顶片的尿膀胱组织。所述尿膀胱组织被立即无菌保存在组织培养基中用于分离细胞。然后使用可吸收的缝合材料,所述膀胱的缺损被至少密封两层。然后再次使用适当大小的可吸收缝合线材料,以皮下方式密封所述皮肤。根据本文所述的协议制备结构。结构移植。将无菌的Foley球囊导尿管放入膀胱中,并在腹部制作正中切口,直接从尾部开始到肚脐。确定所述网膜,保持为两层,并分为头部和尾部两半。暴露所述泌尿膀胱并排空所述膀胱尿液。在膀胱内制作中线纵行切口,以协助医生确定所述三角区,包括其中在所述背侧进入所述输尿管和在所述三角区清空输尿管孔。在三角区域内的所述输尿管下方的所述骨盆入口围绕所述尿道颈部约五点左右穿过适当大小的Vicryl缝线。然后从所述膀胱切除所述输尿管,留下所述膀胱壁的部分和所述输尿管开口的完整三角区。所述11只动物(动物编号:4-9)中的6只,具有横切了右侧或左侧的输尿管,在输尿管开口的移除所述膀胱壁/三角残留物。从所述输尿管开口到所述肾以上升的方式将输尿管支架放入一个或两个输尿管中。然后切除所述整个膀胱,固定在所述尿道颈部周围的缝合线附近。从所述培养基无菌除去所述结构,并在所述操作过程中使用无菌注射器或湿纱布轻轻注入无菌生理pH盐水,以保持湿润。通过将所述Vicryl缝线预先固定所述尿道颈部,将所述结构的尾部开口与尿道连接。吻合后,使用无菌8毫米打孔机在所述结构的背侧中点处的大约8点钟和4点钟的位置,创建动物编号:1的输尿管开口。在动物编号:4-11,调整所述背侧上的所述输尿管开口位置至约10和2点的位置,或接近三角/自然的位置,以促进尿液引流进入所述结构。然后缝合每个输尿管口到所述结构适当的开口上。Prolene缝线被连接到每个输尿管支架的前端以促进手术后的去除。然后将头部和尾部的网膜半部分拉过来改在所述结构上,并使用外科胶粘剂在所述网膜组织中止血。目视检查所述包裹在网膜中的所述结构,至完全覆盖所述结构,以保证足够闭合和水密性。所述腹部切口成层关闭,并且所述皮肤用可吸收缝合线以皮下方式关闭。对于动物1和3-9,所述Foley球囊导尿管固定所述动物,并保持原位,以方便的术后的尿疏散、收集和/或循环。对于动物10和11,见以下“泌尿导尿管&端口系统移植”。所述输尿管非降解支架固定在所有的动物中。表18.1列出了当支架从每个动物中移除时,移植后的天数。泌尿导尿管&端口系统移植:在动物编号:1,2和4-9的生存期期间,这里指出所述动物的Foley导尿管被所述动物提前除去,尽管努力阻止所述动物获取所述导尿管(例如,Elizabethan项圈和将导尿管缝合于动物上)。为了解决这些问题,动物编号10和11每只通过外科手术植入两个独立的、内在的泌尿端口和导尿管系统,以取代动物第1,2,和4-9中使用的单一Foley球囊导尿管系统。在植入过程中使用荷包缝合技术将8-9Fr.球囊导尿管植入到所述膀胱颈部的尿道以内。一旦所述导尿管的所述球囊端部被固定到所述尿道,所述导尿管被传送到所述动物的侧面,其中端口被连接和植入到皮下囊袋中。然后对该系统进行测试,以确保功能,通过用~3mL生理盐水溶液膨胀所述球囊并视觉检查所述尿道阻塞。所述导尿管插入位点在所述结构顶点处的背侧,在输尿管吻合的一侧。一旦固定到所述结构,所述导尿管被传送到所述动物的侧面,其中端口被连接并植入到皮下囊袋,与所述球囊导尿管端口分开。循环:在动物1、2和4-9中的内在的Foley球囊导尿管管被用作控制具有所述动物自身尿液的新器官的填充和排空。在循环期的开始,所述导尿管的末端被阻塞,以防止尿液从所述导尿管泄露,并且所述导尿管球囊在输尿管开口处膨胀以阻止尿液从所述新器官排空。所述新器官然后被允许尿液自然填充,每天两次约4小时。在每个4小时循环时间的末期,所述尿液从所述新器官虹吸,使用Foley导尿管,并且记录收集的尿液的量。动物编号10和11,使用所述植入的端口和导尿管系统循环。通过所述皮下端口,所述植入的球囊用生理盐水填充,以阻塞尿液流约4小时。所述新器官然后通过所述尿液端口和导尿管系统清空。循环的进行(表4)在动物到动物之间变化,根据动物容忍所述循环过程的能力或自制的实现。顺应性监测-尿流动力学。在预定的时间点进行泄露点压力(LPP)测试,同时所述动物被服用镇静剂。对于动物编号1、2和4-9,没有内在的端口和导尿管,清理所述区域,并且插入所述内在的Folley球囊导尿管,用~3ml的生理盐水溶液膨胀以阻塞所述输尿管开口。然后从新器官中,使用Foley导尿管和注射器去除剩余的尿液。将与校正输液泵(含有无菌生理盐水)连接的生理压力换能器(SP844)监测设备与所述Foley导尿管的管腔连接。所述生理盐水溶液以20ml/min的速率注入到所述新器官中,并且持续监测所述压力,和电子记录直到生理盐水开始在所述尿道管附近泄露(即泄露点)。一旦识别到泄露,停止所述注入,记录所述体积(LPP容量)和压力(膀胱内压泄露点)。在所述新器官内的生理盐水体积的确认,通过吸入新器官内容物到容器中,并记录所述收集的体积。动物编号10-11,其具有内在的端口和导尿管,用碘和乙醇擦洗,然后在所述端口部位喷洒聚维酮。所述内在的Foley球囊导尿管用约3ml的生理盐水膨胀,以堵塞所述输尿管开口。使用内在的导尿管和注射器,从新器官去除剩余的尿液。将与校正输液泵(含有无菌生理盐水)连接的生理压力换能器(SP844)监测设备与所述Foley导尿管的管腔连接;并且测量所述泄露点体积和压力,通过吸取新器官内容物(如对动物1、2和4-9的描述),确认体积。成像-膀胱造影。在预定时间点拍摄荧光图像,同时所述动物被服用镇静剂。对于动物1、2和4-9,不具有内在的端口和导尿管,清理所述区域,并且插入所述内在的Foley球囊导尿管,然后用约3ML的生理盐水溶液使其膨胀以阻塞所述尿道开口。使用Foley导尿管和注射器,从所述新器官中取出剩余的尿液。动物编号10-11,其具有内在的端口和导管,用碘和乙醇擦洗,然后在所述端口部位喷洒聚维酮。所述内在的Foley球囊导尿管用约3ML的生理盐水使其膨胀,以阻塞所述尿道开口。使用内在的导尿管和注射器,从所述新器官去除剩余的尿液。通过所述导尿管,将3:1的生理盐水/对照溶液注射到新器官。一旦所述新器官被填充到基于LPP的容量,前/后的(AP)和侧面荧光图像被拍摄,以评估所述新器官的特征和条件。记录所述逐渐灌输的体积(CYG容量)。所有图像是电子存档。然后使用内在的导尿管和注射器,将所述生理盐水/对照溶液从所述新器官吸走。超声波:预定的时间点进行新器官和肾脏的超声成像,同时给动物注射镇静剂。测量和记录空虚和充满的新器官的壁厚度。测量和记录左、右肾的长度和宽度。结构被成功移植到杂种犬中。11只犬中的7只存活,直到预定的或选择的牺牲,植入后11只犬中的6只存活170-187天。在43天前,当检查所述第一个结构时,结构愈合已达到稳定状态,而且产生的新器官包括尿路上皮、黏膜下层、肌肉和浆膜层/网膜层。所有新器官有足够优良的上皮形成、平滑肌形成和神经分布。其在尸检时独立于临床结果或分类capacitybased(新膀胱或新-膀胱导管)。在正常膀胱中,来自所述结构的平滑肌细胞在典型位置(其驻留其中),重新建模成为肌肉层(肌层)。观察到所述肌层作为三个单独的层(典型在狗中),并作为一层或两层的捆绑肌纤维(典型在人体中)。所有的介绍为假定的功能。用自体和异体结构制剂成功替换整个犬膀胱得到了证实。植入自体结构的两种动物,存活到或超过预定的24周的研究期限。植入同种异体结构的3只动物也存活到或超过研究期限。4个异体结构的接受者未能存活到其预定的尸检,但是所有4个似乎为非生产性相关的。观察几个新器官监测参数的阳性趋势,包括:动物体重增量的增加,新器官体积容量和在整个研究期间大多数动物尿流动力学顺应性。此外,所述新器官壁的厚度稍薄,但可比犬膀胱的一般厚度。对所有动物进行循环;1号动物除外,其不循环,但能够恢复其天然的膀胱的容量及完全的研究(≥24周生存期)。第5,6,10,和11号动物被循环,至少的小时数为从32-64小时。在这些动物中,在临床并发症需要动物安乐死之前,6和11号的存活时间最短。10只动物中超过6只的存活时间≥24周,而且5/6的动物的平均循环为146小时。手术后新器官循环的质量和数量影响新器官再生的结果(例如,新膀胱或新膀胱导管)。并在这组动物中注意到存活的增加。细胞密度在4.0E+06到106E+06SMC的范围内变化。出于功能性目的,总膀胱再生被定义为如下结果:在尸解时,如果植入后尸解发生在≤120天,为≥50%的天然膀胱和/或结构的体积;如果植入后尸解发生在>120天,为≥65%的天然膀胱和/或结构的体积。所述10只动物中,8只获得了新膀胱的结果,而2只取得了新膀胱导管的结果。已经论证了植入自体或异体结构用于组织再生和替换的功能性结果。10只动物均成功植入并存活43天至188天。该研究建立了新膀胱替代产品,可在犬科动物模型中测试全膀胱切除术和输尿管再植术。手术后的新器官循环的质量和数量影响新器官再生的结果(例如,新膀胱或新膀胱导管)。出于功能性目的,如观察到的膀胱再生:如果植入后尸解发生在≤120天,体积的容量达到≥50%的所述天然膀胱和/或结构的体积;以及,如果植入后尸检发生在>120天,体积的容量达到≥65%的所述天然膀胱和/或结构的体积。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1