一种牙髓干细胞组合物及其应用的制作方法
本发明涉及医学领域,具体的说是涉及一种牙髓干细胞组合物及其应用。
背景技术:
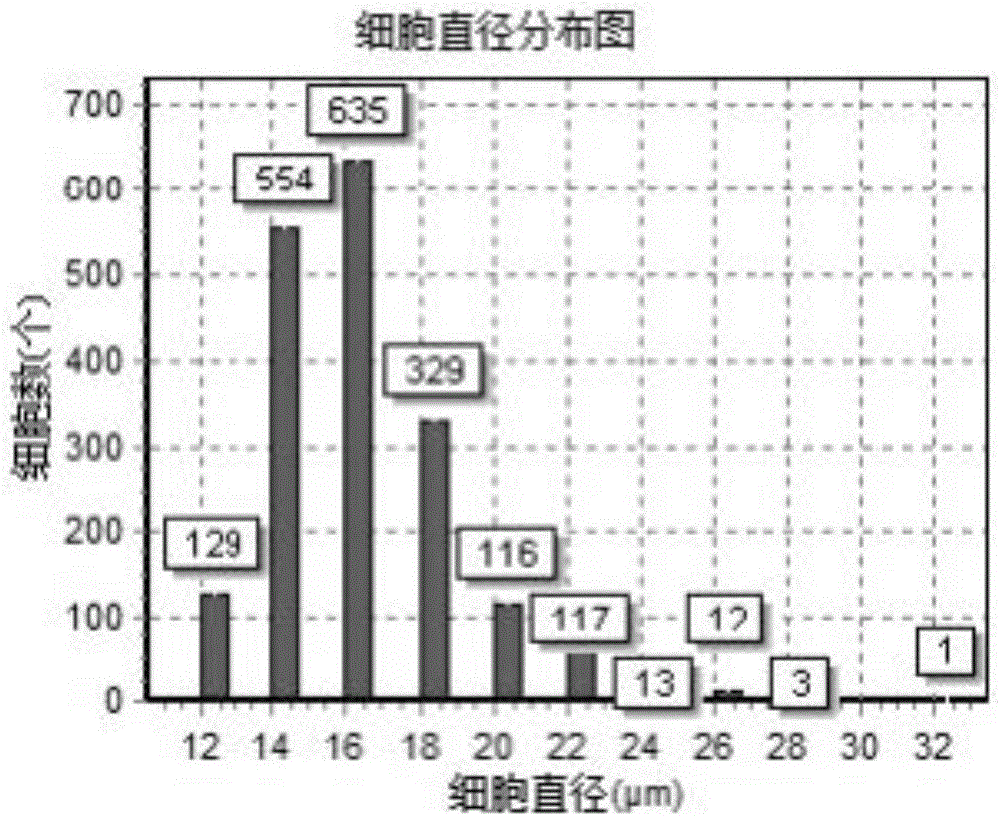
:关节炎是与年龄密切相关的常见的关节疾病,随着老龄化社会的到来,在老年人口中骨性关节炎的发病率有增加趋势,骨性关节炎早期病理改变为软骨的退变及破坏,其发病机制尚不明确,缺乏特异性的治疗手段。最终的病理过程是细胞机制合成与降解的平衡收破坏引起的关节组织破坏。膝关节骨性关节炎是累及关节软骨、软骨下骨、半月板及滑膜等整个关节组织的复杂的慢性病变,容易引起软骨代谢的改变,这种改变起始于关节软骨的结构变化,滑膜的炎症影响和参与这个过程已被广泛认可。现有治疗方法中,比较新颖的治疗措施是采用细胞生物技术进行骨关节炎的治疗,其中大部分是运用胚胎干细胞、脐带间充质干细胞、脂肪间充质干细胞及骨髓间充质干细胞进行脊椎或是关节炎等软骨病变相关研究。但是,这些细胞疗法面临着伦理及取材困难以及取材时对患者造成痛苦等问题。技术实现要素:有鉴于此,本发明的目的在于一种牙髓干细胞组合物及其应用,使得所述组合物对骨关节炎有显著的疗效,安全性更高。为了实现上述目的,本发明提供如下技术方案:一种牙髓干细胞组合物,包括牙髓干细胞、白介素-10和葡萄糖注射液。针对现有干细胞取材以及在治疗骨关节炎效果方面欠佳的问题,本发明选用牙髓干细胞、白介素-10以及葡萄糖注射液组成新型组合物,对骨关节炎具有较为显著的疗效。其中,作为优选,所述牙髓干细胞浓度为8.0×106-1.5×107个/ml,在本发明中的具体实施方式中,可以具体选择1.0×107个/ml。所述牙髓干细胞的分离培养可按照常规方法进行,如按照文献GronthosS,MankaniM,BrahimJ,etal.Postnatalhumandentalpulpstemcells(DPSCs)invitroandinvivo[J].ProcNatlAcadSciUSA,2000,97(25):13625-13630.中记载的制备方法进行,本发明提供了如下方法:在保证牙髓未被破坏的情况下,将拔除的健康智齿或其他用于分离干细胞的牙齿立即转移至预冷高浓度双抗中(双抗:链霉素及青霉素),浸泡15min,用D-Hank’s液反复冲洗3次,在无菌操作台劈开牙齿,取出牙髓组织。用眼剪把牙髓组织剪成0.3-0.5mm3块状,加入4mg/ml浓度的Ⅰ型胶原酶,消化至肉眼看到不成块状的悬液,过筛,清洗之后接种培养(DMEM/F12+10%FBS),每3天换液,细胞汇合度75%-85%时进行传代培养。本发明优选采用的牙髓干细胞为传代至第3-4代的细胞,收集方法如下:牙髓干细胞传代到第3-4代,汇合度在85-90%时,用PBS清洗两遍后,加入2-3mL0.25%胰酶-0.02%EDTA;置于倒置显微镜下观察,80%细胞皱缩变圆时,加入5-8mL含10%FBS的DMEM培养基终止酶解,用移液枪反复吹打细胞,直至细胞全部脱落。把细胞悬液转移至50mL离心管中,500-700g离心4-5min。离心结束后倒弃上清液,往细胞沉淀中加入20-30mL的生理盐水重悬细胞,500-700g离心4-5min,弃上清液(该步骤重复一次)。作为优选,所述白介素-10的浓度为1.0-5.0ng/ml;在本发明具体实施方式中,可具体选择3.0ng/ml。作为优选,所述葡萄糖注射液为10%葡萄糖注射液。以本发明所述组合物为试验对象,牙髓干细胞及10%葡萄糖为阳性对照,各组对兔骨关节炎模型进行注射治疗,结果显示,在9周的时间内,本发明处理组下的软骨厚度增厚速度较快,与阳性对照组呈现显著性差异,表明本发明所述组合物对骨关节炎具有显著的疗效。同时,采用软骨病理学Mankin评分对比各组的修复性,结果显示本发明各实验组安全性最高。基于此技术效果,本发明提出了所述组合物在制备治疗骨关节炎中产品中的应用。由以上技术方案可知,本发明组合物选择牙髓干细胞、白介素-10和葡萄糖注射液作为治疗骨关节炎的成分,组合物组成简单,牙髓干细胞为自体细胞,取材不受限制,并且整体对骨关节炎的效果优于单纯的牙髓干细胞和间充干细胞,具有广阔的应用前景。附图说明图1所示为牙髓干细胞的直径分布图;图2所示为牙髓干细胞染色镜检图。具体实施方式本发明实施例公开了一种牙髓干细胞组合物及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明产品和应用已通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。在本发明具体实施方式中,本发明选用普通级瞬木反射正常的健康大白兔为实验对象,雌雄随机选取50只(购于广东省实验动物中心),兔龄4-5个月,分为阴性组,模型组、阳性对照组1、阳性对照组2及本发明实验组,每组各10只,适应性喂养1周后进行实验。牙髓干细胞的提取通过拔除大白兔磨牙按照本发明提供的方法进行分离培养,然后进行传代。以下就本发明所提供的一种牙髓干细胞组合物及其应用做进一步说明。实施例1:牙髓干细胞的分离培养和传代1、分离和传代大白兔在局麻的状态下拔出一颗磨牙,在保证牙髓未被破坏的情况下,立即转移至预冷高浓度双抗中(双抗:链霉素及青霉素),浸泡15min,用D-Hank’s液反复冲洗3次,在无菌操作台劈开牙齿,取出牙髓组织。用眼剪把牙髓组织剪成0.3-0.5mm3块状,加入4mg/ml浓度的Ⅰ型胶原酶,消化至肉眼看到不成块状的悬液,过筛,清洗之后接种培养(DMEM/F12+10%FBS),每3天换液,细胞汇合度75%-85%时进行传代培养。牙髓干细胞传代到第3代,汇合度在85-90%时,用PBS清洗两遍后,加入2-3mL0.25%胰酶-0.02%EDTA;置于倒置显微镜下观察,80%细胞皱缩变圆时,加入5-8mL含10%FBS的DMEM培养基终止酶解,用移液枪反复吹打细胞,直至细胞全部脱落。把细胞悬液转移至50mL离心管中,500-700g离心4-5min。离心结束后倒弃上清液,往细胞沉淀中加入20-30mL的生理盐水重悬细胞,500-700g离心4-5min,弃上清液(该步骤重复一次)。2、牙髓干细胞检测牙髓干细胞收集前24h抽取培养液上清检测细菌、真菌、内毒素和支原体,结果均呈阴性,表明牙髓干细胞微生物量达标;牙髓干细胞收集时对其直径和活力进行检测和观察,结果见图1和图2,由图1和图2可见,牙髓干细胞在P3代时,细胞大小均匀、形态均为梭型,融合至85%时呈现漩涡状。消化收集时,细胞97%拒染(死细胞被染成蓝色,活细胞拒染),细胞直径在14-18um之间,符合牙髓干细胞体积大小分布,说明了牙髓干细胞并没有出现体积变大等异常现象,活力较好。牙髓干细胞表面抗原流式检测结果显示,牙髓干细胞高表达CD146和CD90,表达率分别为99.9%,100%;低表达CD34和CD45,表达率分别为0.1%、0.2%,符合间充质干细胞表面抗原特征,说明了牙髓干细胞并没有出现分化的现象,仍维持着干细胞的特点。实施例2:本发明所述牙髓干细胞组合物1.0×107个/ml牙髓干细胞,3.0ng/ml白介素-10,10%葡萄糖注射液;实施例3:本发明所述牙髓干细胞组合物8.0×106个/ml牙髓干细胞,1.0ng/ml白介素-10,10%葡萄糖注射液;实施例4:本发明所述牙髓干细胞组合物1.5×107个/ml牙髓干细胞,5.0ng/ml白介素-10,10%葡萄糖注射液;实施例5:骨关节炎治疗效果对比按照文献《实验兔膝骨关节炎模型的建立及鉴定曾俊华》(马笃军,彭力平,何升华,余阗,陈达.中国临床研究.2016(05):679-682.)制作兔骨关节炎模型,造模时间为4-5周。阴性组兔不造模注射10%葡萄糖溶液,模型组兔造模并注射10%葡萄糖,阳性对照组兔造模注射牙髓干细胞及10%葡萄糖,实验组1-3兔造模注射本发明实施例2-4组合物,各组细胞浓度相同,均以经皮穿刺为关节区局部多点注射,每周注射一次,连续注射三周。为了评价骨关节炎形态学是否改变,在首次注射后的第1周、第3周、第6周、第9周进行一次MRI扫描,对比软骨厚度的变化情况,结果见表1。表1MRI评价软骨厚度(x±S,n=3,mm)组别只数第1周第3周第6周第9周阴性组101.15±0.161.15±0.341.14±0.341.15±0.22模型组100.57±0.410.59±0.350.62±0.180.63±0.32阳性对照组100.57±0.200.60±0.330.68±0.150.70±0.21实验组1100.56±0.450.79±0.43**0.88±0.26**1.01±0.05**实验组2100.56±0.230.76±0.18**0.84±0.22**0.95±0.12**实验组3100.57±0.070.75±0.13**0.84±0.08**0.96±0.14**注:**表示实验组1,2,3分别与模型组,阳性组对照组有极显著性差异,P<0.01;由表1可得出,阴性组的软骨厚度在第9周内并没有出现大的变化,软骨厚度维持在一个稳定的水平,且厚度并没有出现差异性减少。而模型组,其存在一定的自我修复机制,软骨厚度在第9周内有所增加,但其厚度增厚速度慢,并不能起到明显的改善作用。阳性对照的软骨厚度经过9周的修复后,其软骨厚度与模型组相比有较好的改善,但是尚未达到显著性差异,而本发明各实验组的软骨厚度与阳性对照组相比均具有显著性差异,表明本发明牙髓干细胞组合物可用于治疗骨关节炎,且治疗效果较好。同时,对各组进行修复情况评分,以软骨病理学Mankin评分标准进行评述,结果见表2。表2软骨病理学Mankin评分比较(x±S)注:**表示实验组1,2,3分别与模型组,阳性组对照组有极显著性差异,P<0.01;由表2可得出,阴性组的软骨病理学Mankin评分在9周内并没有出现大的变化,软骨组织维持在一个稳定的水平,并没有出现病理性变化。而模型组,其存在一定的自我修复机制,软骨病理学Mankin分值在9周内有所下降,但其改善速度慢,并不能起到明显的改善作用。阳性对照组软骨厚度经过9周的修复后,其软骨病理学Mankin分值与模型组相比更小,但是尚未达到显著性差异;而本发明各实验组分值虽然与阴性组相比仍具有一定差异,但是相比阳性对照组分值更小且达到显著性差异,起到明显的改善作用。以上所述只是用于理解本发明的方法及其核心思想,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1