磷脂‑糖胺聚糖仿生细胞外基质纳米膜及其制备方法与应用与流程
本发明涉及细胞外基质材料技术领域,具体涉及一种磷脂-糖胺聚糖仿生细胞外基质纳米膜及其制备方法与应用。
背景技术:
I型糖尿病是一种自身免疫性疾病,它是由于机体免疫系统功能障碍,导致胰岛β-细胞坏死,从而引起糖代谢功能障碍。尽管据International Diabetes Federation(IDF)统计,I型糖尿病患者仅占总糖尿病患者的10%,但I型糖尿病发病较早,多发于儿童及青少年,因此患病时间较长,如血糖控制不当会引发包括心脏、肾脏、肝脏、神经及眼部等多重器官并发症,严重影响患者的生活质量并对社会及家庭造成巨大经济负担。目前,注射胰岛素是主要的治疗I型糖尿病的方法,该方法虽可以有效控制患者血糖,却无法根治I型糖尿病,也无法对患者代谢功能紊乱等做出更为精准的控制。另外,长期服用胰岛素也会造成体重增加,不利于进行血糖检测及对其他心血管并发症的调控。
胰岛移植可被认为是治疗I型糖尿病手段中最具有潜力的治愈性治疗手段。自2000年Edmonton胰岛移植方法成功使7名糖尿病患者实现100%脱离对胰岛素的依赖后,胰岛移植这一手段成为有可能完全治愈I型糖尿病最具潜力的途径。但Edmonton protocol主要通过直接向肝脏门静脉注射胰岛的方法进行胰岛移植,随后的临床结果表明,在接受治疗的糖尿病患者中,胰岛移植术后,超过90%的患者在5年内均病情复发,重新进行胰岛素治疗。导致病情复发的主要原因在于移植后的胰岛在患者体内,因胰岛移植位置、免疫反应等诸多原因无法及时完成血运重建,导致胰岛流失加速,从而加大胰岛移植手术在所需胰岛数量上的要求。而胰岛移植手术的另一个瓶颈恰恰是供体数量有限,因此造成恶性循环,使目前胰岛移植无法前行。因此如何完善胰岛移植手段,使胰岛能够更好的被纳入接受移植患者的循环系统,从而解决胰岛流失问题,是现阶段针对胰岛移植研究的重点方向。
采用生物材料辅助胰岛移植的相关研究也在近年来被广泛关注。目前胰岛移植所采用的生物材料众多且各有优缺,可大体分为包裹型材料和半包裹型材料两大类。半包裹材料中的多孔支架类生物材料,能够为胰岛移植创造除传统移植点之外的新移植部位,但无法从根本解决接受胰岛移植患者免疫排斥等基本问题。包裹型材料包括水凝胶、微胶囊等,因为这类材料可以将胰岛完全包裹,因此能够解决移植手术后患者机体对移植胰岛的免疫排斥反应,但也由于这类材料对胰岛的完全包裹,不利于毛细血管的形成,因此在胰岛移植后血运重建等方面有所欠缺。
技术实现要素:
针对现有技术中的缺陷,本发明目的在于提供一种磷脂-糖胺聚糖仿生细胞外基质纳米膜及其制备方法与应用,以在模拟细胞外环境的同时,提高仿生细胞外基质纳米膜的生物相容性;使其在包裹胰岛细胞团时,提高胰岛细胞的活性,增强胰岛细胞释放胰岛素的功能;而且,该制备方法简单,反应条件温和,操作简便。
为实现上述目的,本发明提供的技术方案为:
第一方面,本发明提供了一种仿生细胞外基质纳米膜的制备方法,包括如下步骤:S1:将糖胺聚糖溶于磷酸盐缓冲溶液中,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂,得到混合液,再将混合液去除氧气后活化;其中,添加剂为1-羟基苯并三氮唑或N-羟基丁二酰亚胺;S2:将磷脂溶于复配乳液中,然后加入到S1得到的产物中进行反应;其中,复配乳液包括水和有机溶剂;S3:将S2得到的产物干燥,得到仿生细胞外基质纳米膜。需要说明的是,S1中,将糖胺聚糖溶于磷酸盐缓冲溶液,优选将盛放糖胺聚糖和磷酸盐缓冲溶液的反应器中的氧气去除,得到混合液后,也需要去除氧气,因为混合液中的物质需要在无氧的条件下进行活化。
在本发明的进一步实施方式中,S1中,糖胺聚糖、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂的物质的量比为1:1:(1~10);S2中,磷脂和复配乳液的质量比为1:(10~100),复配乳液中,有机溶剂和水的体积比为1:(1~100);糖胺聚糖和磷脂的质量比为1:(1~100)。
在本发明的进一步实施方式中,S1中:糖胺聚糖包括肝素、透明质酸和硫酸软骨素中的一种或几种,糖胺聚糖的相对分子质量为8000~14000;S2中:磷脂包括1,2-二油酰-sn-甘油-3-磷酰乙醇胺、L-磷脂酰乙醇胺、1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺、1,2-二棕榈酰基-sn-丙三基-3-磷酸乙醇氨、1,2-二肉豆蔻酰-sn-丙三基-3-磷脂酰乙醇胺、1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺、胆固醇甲酰胺和花生四烯酰胺中的一种或几种。
在本发明的进一步实施方式中,S2中:有机溶剂包括乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺中的一种或几种;水为双蒸水。
在本发明的进一步实施方式中,S1中,将糖胺聚糖溶于磷酸盐缓冲溶液中具体包括:将糖胺聚糖加入磷酸盐缓冲溶液中,得到糖胺聚糖与磷酸盐缓冲溶液的混合物,然后在0~37℃的条件下超声10~30min;其中,超声的功率为20~400W,磷酸盐缓冲溶液的pH值为6.0~6.8,在糖胺聚糖与磷酸盐缓冲溶液的混合物中,糖胺聚糖的质量分数为10%~50%。需要说明的是,超声是为了使糖胺聚糖和磷酸盐缓冲溶液充分溶解。
在本发明的进一步实施方式中,S1中,活化的温度为0~37℃,活化的时间为15~45min;S2中,反应的温度为0~100℃,反应的时间为0.5~72h;S3中,干燥为冷冻干燥,冷冻干燥的温度为-60℃~-80℃,冷冻干燥的时间为2~48h。需要说明的是,冷冻干燥时,可以将S2得到的产物置于48孔板或96孔板,然后进行冷冻干燥。
第二方面,本发明提供了上述的方法制备得到的仿生细胞外基质纳米膜。
第三方面,本发明提供了一种荧光仿生细胞外基质纳米膜的制备方法,包括上述仿生细胞外基质纳米膜的制备方法的所有步骤,并在S2中的反应后,还包括步骤:在反应后的产物中加入荧光物质进行避光反应;其中,糖胺聚糖和荧光物质的物质的量比为1:1000,荧光物质为5-FAM-乙二胺或AF488-N-羟基琥珀酰亚胺(即Alexa 488-N-羟基琥珀酰亚胺酯),避光反应的温度为15~30℃,避光反应的时间为15~60min。
第四方面,本发明提供了上述的方法制备得到的荧光仿生细胞外基质纳米膜。
第五方面,本发明提供了上述的仿生细胞外基质纳米膜或荧光仿生细胞外基质纳米膜在制备胰岛培养或胰岛移植产品中的应用。
本发明采用的磷脂,在动植物、细菌等微生物中是构成其生物膜、核膜以及类脂膜的重要组成部分,能参与到各种生理活动中。磷脂具有两亲分子结构,含有磷酸根的极性端具有亲水作用,而长长的碳氢非极性链具有很强亲脂性,在体液环境下,上述特性使得磷脂分子倾向于定向排列、组装成为磷脂双分子层,构成热力学稳定的片层或组装体结构。这种生物膜骨架既能保持蛋白质的镶嵌和附着,也能够帮助细胞通过磷脂双分子层和外界进行物质和能量的交换。本发明采用的糖胺聚糖是细胞外基质中的重要成分,带有大量的负电荷从而具有很强的亲水性,对保持疏松结缔组织中的水分有重要意义;糖胺聚糖是多价阴离子,对K、Na、Ca、Mg等离子有较大的亲和力,因此能调节这些离子在组织中的分布;糖胺聚糖有很大的粘滞性,附在关节面上具有润滑和保护作用,有促进创伤愈合的作用。并且,糖胺聚糖具有较高的抗凝血活性,将抗凝生物活性物质通过适当方式固定于材料表面,制备负载生物活性物质的抗凝血材料,可以利用材料表面生物活性物质和血液的相互作用来实现所需的抗凝血功能,从而可以作为植入型生物医用材料。
本发明提供的技术方案,具有以下的优点:(1)本发明利用磷脂的生理活性以及对细胞膜具有热力学亲和作用,且利用糖胺聚糖(天然聚阴离子的多糖)具有的抗凝血活性,采用磷脂修饰糖胺聚糖,制备出磷脂-糖胺聚糖仿生细胞外基质纳米膜。在磷脂和糖胺聚糖的亲疏水相互作用力的驱动下进行层层组装,利用不同磷脂疏水分子链的长度能够实现在分子水平上控制膜的组成,从而控制纳米膜结构,由于磷脂在细胞膜的滞留能力,在细胞膜表面能够形成类似磷脂双分子层的结构,从而实现在细胞膜表面组装的厚度以及与细胞膜融合速度、滞留时间的精确控制。(2)本发明所用的材料均为FDA已经认证的医用材料,提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜具有很强的细胞亲和性和生物相容性,能够促进细胞的附着和保证细胞活力,能够为胰岛细胞提供更接近活体细胞外基质的生存环境,紧密结合胰岛细胞的表面,微创即可注入活体,并能提供微量元素的摄取;该磷脂-糖胺聚糖仿生细胞外基质纳米膜与细胞外基质成分类似,仿生效果大大优于现有胰岛移植材料,从而能够成为最为理想的细胞和组织培养生物材料。(3)将胰岛细胞团包裹在本发明提供的荧光仿生细胞外基质纳米膜中,通过在膜表面连接的小分子荧光基团,可清晰看到该纳米膜在胰岛细胞表面的组装结构。(4)通过死活染色的测定方法,可以发现,胰岛细胞包裹在本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜中,14天后存活率接近100%,远远超过现有技术中的培养支架,通过倒置荧光显微镜可以看见胰岛细胞呈现周围血管化组织;胰岛素释放实验发现胰岛细胞释放胰岛素功能明显增强,细胞活力大幅提高。(5)本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜通过结合糖胺聚糖等具有生物活性的因子,生物化学性能稳定,可以促进移植后胰岛在体内的血管化,改善胰岛移植后胰岛的功能及存活性,有效降低炎症环境中胰岛细胞死亡率,并缓解血液介导的急性炎症反应,可提高临床胰岛移植效率。(6)本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜的制备方法简单,反应条件温和,操作简便,易于工业化,制备得到的磷脂-糖胺聚糖仿生细胞外基质纳米膜可以应用于制备胰岛培养支架或胰岛细胞培养基的添加剂等。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
图1为本发明实施例中的荧光仿生细胞外基质纳米膜的反应过程示意图;
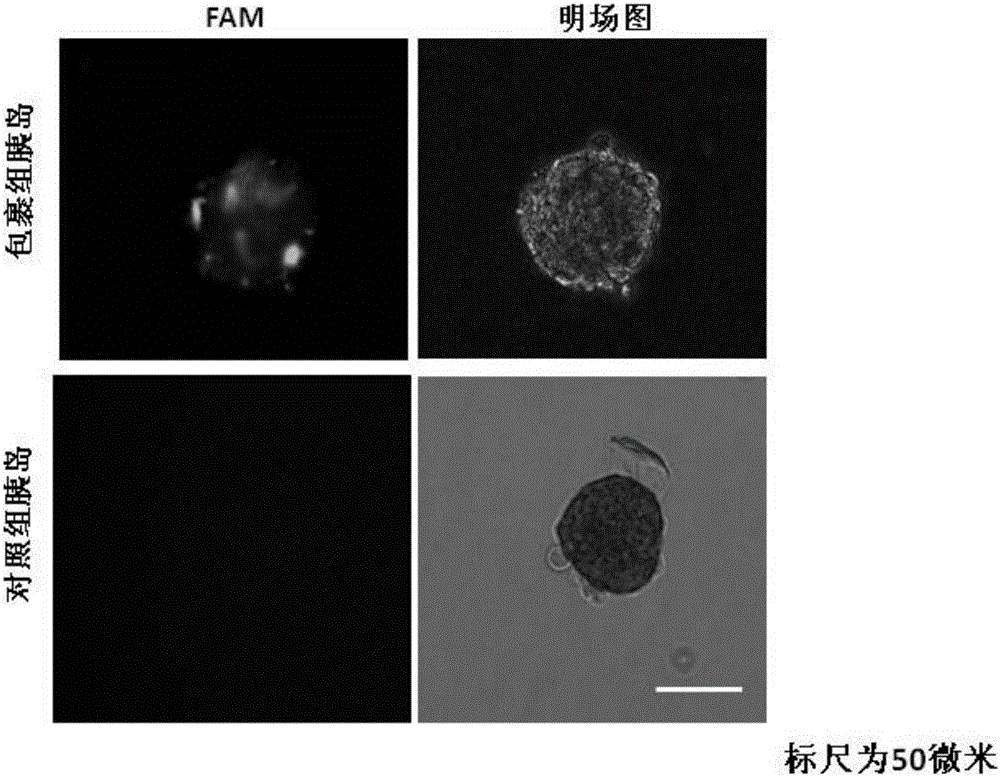
图2为本发明实施例中的经荧光仿生细胞外基质纳米膜包裹的胰岛和未被包裹的胰岛的荧光显微镜图;
图3为本发明实施例中的经荧光仿生细胞外基质纳米膜包裹的胰岛和未被包裹的胰岛的细胞死亡率比较图;
图4为本发明实施例中的经荧光仿生细胞外基质纳米膜包裹的胰岛和未被包裹的胰岛在高糖刺激下胰岛素释放能力比较图;
图5为本发明实施例中的经荧光仿生细胞外基质纳米膜包裹的胰岛和未被包裹的胰岛的凝血时间比较图;
图6为本发明实施例中的经荧光仿生细胞外基质纳米膜包裹的胰岛和未被包裹的胰岛在炎症环境下细胞死亡率比较图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
以下实施例中的定量试验,均设置三次重复实验,数据为三次重复实验的平均值或平均值±标准差。
本发明提供一种仿生细胞外基质纳米膜的制备方法,包括如下步骤:
S1:将糖胺聚糖溶于磷酸盐缓冲溶液中,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂,得到混合液,再将混合液去除氧气后活化;其中,添加剂为1-羟基苯并三氮唑或N-羟基丁二酰亚胺;
优选地,糖胺聚糖、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂的物质的量比为1:1:(1~10);糖胺聚糖包括肝素、透明质酸和硫酸软骨素中的一种或几种,糖胺聚糖的相对分子质量为8000~14000;将糖胺聚糖溶于磷酸盐缓冲溶液中具体包括:将糖胺聚糖加入磷酸盐缓冲溶液中,得到糖胺聚糖与磷酸盐缓冲溶液的混合物,然后在0~37℃的条件下超声10~30min;其中,超声的功率为20~400W,磷酸盐缓冲溶液的pH值为6.0~6.8,在糖胺聚糖与磷酸盐缓冲溶液的混合物中,糖胺聚糖的质量分数为10%~50%;活化的温度为0~37℃,活化的时间为15~45min。
S2:将磷脂溶于复配乳液中,然后加入到S1得到的产物中进行反应;其中,复配乳液包括水和有机溶剂;
优选地,磷脂和复配乳液的质量比为1:(10~100),复配乳液中,有机溶剂和水的体积比为1:(1~100);糖胺聚糖和磷脂的质量比为1:(1~100);磷脂包括1,2-二油酰-sn-甘油-3-磷酰乙醇胺、L-磷脂酰乙醇胺、1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺、1,2-二棕榈酰基-sn-丙三基-3-磷酸乙醇氨、1,2-二肉豆蔻酰-sn-丙三基-3-磷脂酰乙醇胺、1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺、胆固醇甲酰胺和花生四烯酰胺中的一种或几种。有机溶剂包括乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺中的一种或几种;水为双蒸水;反应的温度为0~100℃,反应的时间为0.5~72h。
S3:将S2得到的产物干燥,得到仿生细胞外基质纳米膜。
优选地,干燥为冷冻干燥,冷冻干燥的温度为-60℃~-80℃,冷冻干燥的时间为2~48h。
另外,本发明提供一种荧光仿生细胞外基质纳米膜的制备方法,包括如下步骤:
S1:将糖胺聚糖溶于磷酸盐缓冲溶液中,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂,得到混合液,再将混合液去除氧气后活化;其中,添加剂为1-羟基苯并三氮唑或N-羟基丁二酰亚胺;
优选地,糖胺聚糖、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和添加剂的物质的量比为1:1:(1~10);糖胺聚糖包括肝素、透明质酸和硫酸软骨素中的一种或几种,糖胺聚糖的相对分子质量为8000~14000;将糖胺聚糖溶于磷酸盐缓冲溶液中具体包括:将糖胺聚糖加入磷酸盐缓冲溶液中,得到糖胺聚糖与磷酸盐缓冲溶液的混合物,然后在0~37℃的条件下超声10~30min;其中,超声的功率为20~400W,磷酸盐缓冲溶液的pH值为6.0~6.8,在糖胺聚糖与磷酸盐缓冲溶液的混合物中,糖胺聚糖的质量分数为10%~50%;活化的温度为0~37℃,活化的时间为15~45min。
S2:将磷脂溶于复配乳液中,然后加入到S1得到的产物中进行反应;在反应后的产物中加入荧光物质进行避光反应;其中,复配乳液包括水和有机溶剂;糖胺聚糖和荧光物质的物质的量比为1:1000,荧光物质为5-FAM-乙二胺或AF488-N-羟基琥珀酰亚胺,避光反应的温度为15~30℃,避光反应的时间为15~60min。
优选地,磷脂和复配乳液的质量比为1:(10~100),复配乳液中,有机溶剂和水的体积比为1:(1~100);糖胺聚糖和磷脂的质量比为1:(1~100);磷脂包括1,2-二油酰-sn-甘油-3-磷酰乙醇胺、L-磷脂酰乙醇胺、1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺、1,2-二棕榈酰基-sn-丙三基-3-磷酸乙醇氨、1,2-二肉豆蔻酰-sn-丙三基-3-磷脂酰乙醇胺、1,2-二油酰基-sn-丙三基-3-磷脂酰乙醇胺、胆固醇甲酰胺和花生四烯酰胺中的一种或几种。有机溶剂包括乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺中的一种或几种;水为双蒸水;反应的温度为0~100℃,反应的时间为0.5~72h。
S3:将S2得到的产物干燥,得到荧光仿生细胞外基质纳米膜。
优选地,干燥为冷冻干燥,冷冻干燥的温度为-60℃~-80℃,冷冻干燥的时间为2~48h。
需要说明的是,5-FAM-乙二胺和AF488-N-羟基琥珀酰亚胺的分子结构式分别为:具体的荧光仿生细胞外基质纳米膜的反应过程示意图如图1所示。
下面结合具体实施例对本发明提供的仿生细胞外基质纳米膜及其制备方法和荧光仿生细胞外基质纳米膜及其制备方法作进一步说明。需要说明的是,实施一至实施例四中的肝素的质量,可以是微克级别,也可以是千克级别,实施例的效果相同。
实施例一
本实施例提供的是仿生细胞外基质纳米膜及其制备方法,制备过程包括:
S1:将相对分子质量为12000的肝素溶于pH值为6.4的磷酸盐缓冲溶液中,得到肝素与磷酸盐缓冲溶液的混合物,其中,在肝素与磷酸盐缓冲溶液的混合物中,肝素的质量分数为30%。将肝素与磷酸盐缓冲溶液的混合物在25℃的条件下超声20min,超声的功率为200W,并去除反应容器内的氧气,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑,得到混合液,将混合液去除氧气,在25℃条件下活化30min,其中,肝素、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑的物质的量比为1:1:5。
S2:将双蒸水和有机溶剂配制成复配乳液,其中有机溶剂和水的体积比为1:50,有机溶剂为乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺的混合液体。将1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺溶解于复配乳液中,然后加入到S1得到的产物中,在50℃条件下反应36h,其中,1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺和复配乳液的质量比为1:55,并且肝素和1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺的质量比为1:50。
S3:将S2得到的产物在-80℃冷冻干燥48h,得到仿生细胞外基质纳米膜,其化学分子结构式如分子结构式一所示:
分子结构式一:1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺-肝素
实施例二
本实施例提供的是仿生细胞外基质纳米膜及其制备方法,制备过程包括:
S1:将相对分子质量为8000的透明质酸溶于pH值为6.0的磷酸盐缓冲溶液中,得到透明质酸与磷酸盐缓冲溶液的混合物,其中,在透明质酸与磷酸盐缓冲溶液的混合物中,透明质酸的质量分数为10%。将透明质酸与磷酸盐缓冲溶液的混合物在5℃的条件下超声10min,超声的功率为400W,并去除反应容器内的氧气,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑,得到混合液,将混合液去除氧气,在5℃条件下活化15min,其中,透明质酸、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑的物质的量比为1:1:1。
S2:将双蒸水和有机溶剂配制成复配乳液,其中有机溶剂和水的体积比为1:1,有机溶剂为乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺的混合液体。将1,2-二油酰-sn-甘油-3-磷酰乙醇胺溶解于复配乳液中,然后加入到S1得到的产物中,在5℃条件下反应0.5h,其中,1,2-二油酰-sn-甘油-3-磷酰乙醇胺和复配乳液的质量比为1:10,并且透明质酸和1,2-二油酰-sn-甘油-3-磷酰乙醇胺的质量比为1:1。
S3:将S2得到的产物在-80℃冷冻干燥48h,得到仿生细胞外基质纳米膜,其化学分子结构式如分子结构式二所示:
分子结构式二:1,2-二油酰-sn-甘油-3-磷酸乙醇胺-透明质酸
实施例三
本实施例提供的是仿生细胞外基质纳米膜及其制备方法,制备过程包括:
S1:将相对分子质量为14000的硫酸软骨素溶于pH值为6.8的磷酸盐缓冲溶液中,得到硫酸软骨素与磷酸盐缓冲溶液的混合物,其中,在硫酸软骨素与磷酸盐缓冲溶液的混合物中,硫酸软骨素的质量分数为50%。将硫酸软骨素与磷酸盐缓冲溶液的混合物在37℃的条件下超声30min,超声的功率为20W,并去除反应容器内的氧气,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑,得到混合液,将混合液去除氧气,在37℃条件下活化45min,其中,硫酸软骨素、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑的物质的量比为1:1:10。
S2:将双蒸水和有机溶剂配制成复配乳液,其中有机溶剂和水的体积比为1:100,有机溶剂为乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺的混合液体。将1,2-二油酰-sn-甘油-3-磷酰乙醇胺溶解于复配乳液中,然后加入到S1得到的产物中,在100℃条件下反应72h,其中,1,2-二油酰-sn-甘油-3-磷酰乙醇胺和复配乳液的质量比为1:100,并且硫酸软骨素和1,2-二油酰-sn-甘油-3-磷酰乙醇胺的质量比为1:100。
S3:将S2得到的产物在-80℃冷冻干燥48h,得到仿生细胞外基质纳米膜,其化学分子结构式如分子结构式三所示:
分子结构式三:1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺-硫酸软骨素
实施例四
本实施例提供的是荧光仿生细胞外基质纳米膜(1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺-肝素)及其制备方法,制备过程包括:
S1:将相对分子质量为12000的肝素溶于pH值为6.4的磷酸盐缓冲溶液中,得到肝素与磷酸盐缓冲溶液的混合物,其中,在肝素与磷酸盐缓冲溶液的混合物中,肝素的质量分数为30%。将肝素与磷酸盐缓冲溶液的混合物在25℃的条件下超声20min,超声的功率为200W,并去除反应容器内的氧气,然后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑,得到混合液,将混合液去除氧气,在0~37℃条件下活化30min,其中,肝素、1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1-羟基苯并三氮唑的物质的量比为1:1:5。
S2:将双蒸水和有机溶剂配制成复配乳液,其中有机溶剂和水的体积比为1:50,有机溶剂为乙醇、异丙醇、二氯甲烷、三氯甲烷、二甲亚砜和二甲基甲酰胺的混合液体。将1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺溶解于复配乳液中,然后加入到S1得到的产物中,在50℃条件下反应36h,其中,1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺和复配乳液的质量比为1:55,并且肝素和1,2-二硬酯酰-sn-甘油-3-磷酰乙醇胺的质量比为1:50。
在反应后的产物中加入5-FAM-乙二胺,肝素和5-FAM-乙二胺的物质的量比为1:1000,在20℃的条件下避光反应30min。
S3:将S2得到的产物在-80℃冷冻干燥48h,得到荧光仿生细胞外基质纳米膜。
将本发明实施例一制备得到的仿生细胞外基质纳米膜和实施例四制备得到的荧光仿生细胞外基质纳米膜,通过功能学试验来系统评价。
1、胰岛的形态变化
试验方法:通过胆管灌注胶原酶的方法,经Histopaque分离获取成年雄性ICR小鼠胰岛(每个胰岛包含3000~5000个胰岛细胞),随机分为A组和B组,A组的胰岛用实施例四制备得到的荧光仿生细胞外基质纳米膜进行包裹,使荧光仿生细胞外基质纳米膜均匀附着于胰岛表面,B组的胰岛不进行包裹,作为对照组。利用倒置荧光显微镜分别观察A组(包裹组)和B组(对照组)的细胞形态。
试验结果:具体结果如图2所示。由于荧光仿生细胞外基质纳米膜中结合了荧光分子FAM,因此经荧光仿生细胞外基质纳米膜包裹的胰岛图层(左上)可在荧光显微镜下观察得到(光亮部分),且包裹后的胰岛体积较对照组未有明显改变,因此不会影响胰岛的营养及氧气等供应,有利于胰岛活力保存。
2、胰岛细胞死亡比例测定
试验方法:通过胆管灌注胶原酶的方法,经Histopaque分离获取成年雄性ICR小鼠胰岛(每个胰岛包含3000~5000个胰岛细胞),随机分为A1组、A2组和B组,A1组和A2组的胰岛用实施例一制备得到的仿生细胞外基质纳米膜进行包裹,使仿生细胞外基质纳米膜均匀附着于胰岛表面,B组的胰岛不进行包裹,作为对照组。将A1组、A2组和B组的胰岛在体外培育环境(37℃,95%氧气/5%二氧化碳,RPMI1640培养基)中,保存14天后,使用死活荧光染色方法(利用BioVision Life/Dead staining试剂盒)分别对A1组、A2组和B组的胰岛进行标记,即使用可穿透细胞膜的小分子绿色荧光染料标记活细胞,同时使用无法穿透细胞膜的红色荧光染料PI标记死亡细胞,然后通过对A1组、A2组和B组的每个胰岛中红色的细胞进行定量分析,来确认A1组、A2组和B组的每个胰岛内的细胞的存活和死亡比例;其中,A1组中仿生细胞外基质纳米膜中对应的原料肝素在RPMI1640培养基中的质量浓度为5mg/mL,A2组中仿生细胞外基质纳米膜中对应的原料肝素在RPMI1640培养基中的质量浓度为10mg/mL。
试验结果:结果如图3所示,通过使用死活荧光染色方法发现,保存14天后,A1组的被仿生细胞外基质纳米膜包裹的胰岛平均死亡细胞数仅为6.5±1.062个,A2组的被仿生细胞外基质纳米膜包裹的胰岛平均死亡细胞数仅为3.273±0.5271个,而B组不被包裹的胰岛平均死亡细胞数仅为12.55±1.856个,A2组的胰岛细胞死亡率大约为B组的胰岛细胞死亡率的26%,由此说明了,采用本发明提供的仿生细胞外基质纳米膜,可以大大降低胰岛细胞的死亡率,提高其存活率。经推测,可能是由于仿生细胞外基质纳米膜中的糖胺聚糖成分可促进胰岛内血管网络的保存,从而保证胰岛内部细胞的养分供给。从我们的试验中也观察到,随着仿生细胞外基质纳米膜中对应的原料肝素在RPMI1640培养基中的质量浓度的增加(由5mg/mL到10mg/mL),胰岛细胞存活也有所提升。说明该仿生细胞外基质纳米膜可用于胰岛表面修饰及包裹,并有利于胰岛培养及存活。
3、胰岛功能及活性的测定
试验方法:通过胆管灌注胶原酶的方法,经Histopaque分离获取成年雄性ICR小鼠胰岛(每个胰岛包含3000~5000个胰岛细胞),随机分为A1组、A2组和B组,A1组和A2组的胰岛用实施例一制备得到的仿生细胞外基质纳米膜进行包裹,使仿生细胞外基质纳米膜均匀附着于胰岛表面,B组的胰岛不进行包裹,作为对照组。将A1组、A2组和B组的胰岛在体外培育环境(37℃,95%氧气/5%二氧化碳,RPMI1640培养基)中,保存14天后,对A1组、A2组和B组的胰岛分别进行高糖刺激,即分别在A1组、A2组和B组的胰岛中加入2mmol/L或20mmol/L的高浓度葡萄糖溶液,刺激半小时后收集上清,并分别检测上清中胰岛素的含量,以测定不同组的胰岛在高糖刺激下胰岛素释放的能力,用于评价胰岛功能及活性;其中,A1组中仿生细胞外基质纳米膜中对应的原料肝素在RPMI1640培养基中的质量浓度为5mg/mL,A2组中仿生细胞外基质纳米膜中对应的原料肝素在RPMI1640培养基中的质量浓度为10mg/mL。
试验结果:结果如图4所示,发现胰岛细胞释放胰岛素功能未受影响,表明本发明提供的仿生细胞外基质纳米膜有利于对胰岛活力以及功能的保存,且很安全。
4、凝血试验
试验方法:通过胆管灌注胶原酶的方法,经Histopaque分离获取成年雄性ICR小鼠胰岛(每个胰岛包含3000~5000个胰岛细胞),随机分为A组和B组,A组的胰岛用实施例一制备得到的仿生细胞外基质纳米膜进行包裹,使仿生细胞外基质纳米膜均匀附着于胰岛表面,B组的胰岛不进行包裹,作为对照组。将A组和B组的胰岛在体外培育环境(37℃,95%氧气/5%二氧化碳,RPMI1640培养基)中,保存14天后,将A组(包裹组)和B组(对照组)的胰岛分别置于糖尿病患者的全血样本中,使用临床APPT仪器检测不同组的胰岛注入血液后的凝血时间。
试验结果:结果如图5所示,A组的被仿生细胞外基质纳米膜包裹的胰岛的平均凝血时间为125.5±0.1764秒,而B组不被包裹的胰岛的平均凝血时间为29.33±0.1764秒,A组(包裹组)vs.B组(对照组)的P<0.001,即对于A组的被仿生细胞外基质纳米膜包裹的胰岛而言,凝血时间较B组不被包裹的胰岛延长4倍。试验结果说明由于抗凝因子糖胺聚糖的存在,A组的被仿生细胞外基质纳米膜包裹的胰岛还表现出显著的抗凝功效,可有效降低移植时常见的瞬间血液引发的免疫效应,从而保护移植后胰岛的存活。
5、炎症环境下胰岛存活试验
试验方法:通过胆管灌注胶原酶的方法,经Histopaque分离获取成年雄性ICR小鼠胰岛(每个胰岛包含3000~5000个胰岛细胞),随机分为A组和B组,A组的胰岛用实施例一制备得到的仿生细胞外基质纳米膜进行包裹,使仿生细胞外基质纳米膜均匀附着于胰岛表面,B组的胰岛不进行包裹,作为对照组。将A组(肝素化材料组)和B组(对照组)的胰岛在体外培育环境(37℃,95%氧气/5%二氧化碳,RPMI1640培养基)中,保存14天后,分别在将A组和B组的胰岛的培养基中加入促炎症因子肿瘤坏死因子(TNF-alpH值a)和细菌脂多糖(LPS)诱导炎症并引发细胞死亡。然后利用Annexin V和PI两种荧光分子对凋亡及死亡细胞进行标记后,使用流式细胞荧光定量仪对荧光强度进行测定,分别计算出不同组的胰岛的细胞死亡率。
试验结果:结果如图6所示,在促炎症因子肿瘤坏死因子(TNF-alpH值a)和细菌脂多糖(LPS)环境中,A组的被仿生细胞外基质纳米膜包裹的胰岛的平均死亡率为52.4±2.4%,而B组不被包裹的胰岛的平均死亡率为66.74±1.49%,A组(肝素化材料组)vs.B组(对照组)的P<0.05。试验结果说明,在炎症诱导下,被仿生细胞外基质纳米膜包裹的胰岛的细胞死亡率有所降低,这显示了仿生细胞外基质纳米膜对于机体或体外炎症环境中的胰岛的存活具有保护作用。
血液介导的急性炎症反应(Instant blood-mediated inflammatory response)是临床中胰岛移植/细胞治疗/器官移植的一大难题,具体表现为凝血造成的急性血栓、炎症引发的细胞死亡等,危害患者健康。而本发明提供的仿生细胞外基质纳米膜,可用于胰岛表面功能修饰,从而提高胰岛存活、保存胰岛功能并提高临床胰岛移植手术中,可以减少血液介导的急性炎症反应引发的胰岛流失,从而提高该手术的成功率和患者生活品质。
需要说明的是,除了上述实施例一至实施例四列举的情况,选用其他的原料配比和制备方法参数也是可行的。在S1中:超声的温度优选为5~30℃,超声功率优选为150~250W,在糖胺聚糖与磷酸盐缓冲溶液的混合物中,糖胺聚糖的质量分数优选为25%~35%;活化的温度优选为5~30℃;在S2中:磷脂和复配乳液的质量比优选为1:(45~60),复配乳液中,有机溶剂和水的体积比优选为1:(40~60),糖胺聚糖和磷脂的质量比优选为1:(40~60),反应的温度优选为40~60℃,反应的时间优选为30~50h;在S3中:冷冻干燥的温度优选为-70℃~-80℃,冷冻干燥的时间优选为36~48h。
本发明提供的技术方案,具有以下的优点:(1)本发明利用磷脂的生理活性以及对细胞膜具有热力学亲和作用,且利用糖胺聚糖(天然聚阴离子的多糖)具有的抗凝血活性,采用磷脂修饰糖胺聚糖,制备出磷脂-糖胺聚糖仿生细胞外基质纳米膜。在磷脂和糖胺聚糖的亲疏水相互作用力的驱动下进行层层组装,能够实现在分子水平上控制膜的组成、结构和厚度的精确控制。(2)本发明所用的材料均为FDA已经认证的医用材料,提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜具有很强的细胞亲和性和生物相容性,能够促进细胞的附着和保证细胞活力,能够为胰岛细胞提供更接近活体细胞外基质的生存环境,紧密结合胰岛细胞的表面,微创即可注入活体,并能提供微量元素的摄取;该磷脂-糖胺聚糖仿生细胞外基质纳米膜与细胞外基质成分类似,仿生效果大大优于现有胰岛移植材料,从而能够成为最为理想的细胞和组织培养生物材料。(3)将胰岛细胞团包裹在本发明提供的荧光仿生细胞外基质纳米膜中,通过在膜表面连接的小分子荧光基团,可清晰看到该纳米膜在胰岛细胞表面的组装结构。(4)通过死活染色的测定方法,可以发现,胰岛细胞包裹在本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜中,14天后存活率接近100%,远远超过现有技术中的培养支架,通过倒置荧光显微镜可以看见胰岛细胞呈现周围血管化组织;胰岛素释放实验发现胰岛细胞释放胰岛素功能明显增强,细胞活力大幅提高。(5)本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜通过结合糖胺聚糖等具有生物活性的因子,生物化学性能稳定,可以促进移植后胰岛在体内的血管化,改善胰岛移植后胰岛的功能及存活性,有效降低炎症环境中胰岛细胞死亡率,并缓解血液介导的急性炎症反应,可提高临床胰岛移植效率。(6)本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜的制备方法简单,反应条件温和,操作简便,易于工业化,制备得到的磷脂-糖胺聚糖仿生细胞外基质纳米膜可以应用于制备胰岛培养支架或胰岛细胞培养基的添加剂等;而现有技术中,胰岛移植使用的海藻酸钠在制备过程中,由于制备条件及原材料差异,批次间有较大差异,对胰岛移植术后胰岛及接受胰岛移植患者体内条件均有不同程度的影响;本发明提供的磷脂-糖胺聚糖仿生细胞外基质纳米膜可以有效克服这些缺点。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型,而并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
- 还没有人留言评论。精彩留言会获得点赞!