一种含有喹硫平或其药学上可接受的盐的缓释片及其制备方法与流程
本发明属于药物制剂领域,具体涉及一种含有喹硫平或其药学上可接受的盐的缓释片及其制备方法。
背景技术:
:富马酸喹硫平是一种用于精神分裂、抑郁发作的双相情感障碍及中度至重度躁狂发作的双相情感障碍治疗药物,由阿斯利康公司研究开发并于2008年10月在美国获得批准上市,化学名称为11-{4-[2-(2-羟基乙氧基)乙基]-1-哌嗪基}二苯并[b,f][1,4]硫氮杂富马酸盐,化学结构式如下所示。分子式:C42H50N6O4S2·C4H4O4;分子量:883.11。富马酸喹硫平化学结构通式:富马酸喹硫平缓释片为亲水凝胶骨架缓释片,是应用亲水性聚合物为骨架材料制成的药物制剂,口服后遇消化液发生水化作用生成凝胶,药物通过扩散或/和凝胶骨架溶蚀的方式释药。在口服缓释控释制剂中,亲水凝胶骨架缓释片因工艺简单,生产周期短,成本低,效率高而占有重要地位。但是,由于生产工艺本身的局限性,凝胶骨架缓释片为单释放单元系统,易引起药物,尤其是水溶性药物的突释及溶出差异性大的问题。因此,寻找一种处方或工艺能控制药物恒速释放并稳定是业内致力解决的问题。专利文献CN200780053817.3(原研药专利:US2008287418A1)公开了一种包含喹硫平或其可用药用盐的制剂,其中所述喹硫平的含量约为9.6%重量至约10.4%重量,并且其中所述制剂包含30%重量的羟丙甲纤维素和约7.2%重量的柠檬酸钠。专利文献CN201110127555.9公开了一种富马酸喹硫平缓释片制备工艺。该工艺采用溶蚀性缓释辅料为阻滞剂,采用熔融法固体分散技术制备缓释颗粒,压片。其为缓释骨架片,外包速释薄膜包衣工艺制备。专利文献CN201110137879.0公开了一种富马酸喹硫平组合物的缓释片剂,包括富马酸喹硫平、有机酸盐、缓释材料和其它药用辅料,所述的缓释材料为K型羟丙甲纤维素;且各组分重量百分配比为:富马酸喹硫平25%~40%,有机酸盐2%~8%,缓释材料5%~30%,其它药用辅料为余量。专利文献CN200810138434.2公开了一种喹硫平缓释片及其制备方法。该缓释片按照重量百分比计含有5%~50%具有pH依赖性溶解度的缓释骨架材料,优选含有15%~35%具有pH依赖性溶解度的缓释骨架材料。专利文献CN201010253723.4涉及喹硫平缓释片,其至少包含有作为活性成分的喹硫平或其药学上可接受的盐,作为缓释骨架材料的乙基纤维素,以及低粘度的水溶性粘合剂,其中乙基纤维素的平均粒径不超过80μm,优选的不超过40μm。上述专利文献公开的富马酸喹硫平缓释片,均使用缓释材料与原料药混合制粒压片,这是由于该生产工艺简单,效率高等。但是该制备方法在实际制备过程中易导致溶出差异性大、重现性差等,上述专利文献均未解决这一问题。采取何种方法来避免溶出度差异性大,重现性差是缓释骨架片,特别是亲水凝胶骨架片的研究重点,也是业界公认的研究难点。技术实现要素:针对上述现有技术的不足,本发明的目的是提供一种含有喹硫平或其药学上可接受的盐的缓释片及其制备方法。本发明的含有喹硫平或其药学上可接受的盐的缓释片的溶出度差异性小、重现性好、生物利用度高。本发明提供的含有喹硫平或其药学上可接受的盐的缓释片,其包含:颗粒1,其包含喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂;颗粒2,其包含喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂;其中,所述颗粒1和颗粒2通过不同的湿法制粒过程制备而成。本发明人通过大量实验发现,所述颗粒1和颗粒2的不同的湿法制粒过程影响颗粒的成型,从而可以影响并控制药物释放度。优选地,所述颗粒1的湿法制粒时间为2~5min,加水量为物料总重量的10%~28%;所述颗粒2的湿法制粒时间为6~15min,加水量为物料总重量的30%~45%。更优选地,所述颗粒1的湿法制粒时间为3~5min;加水量为物料总重量的18%~28%;所述颗粒2的湿法制粒时间为8~12min;加水量为物料总重量的35%~45%。所述颗粒1和颗粒2通过不同的湿法制粒时间及加水量来影响颗粒的成型,从而控制药物释放度。所述颗粒1通过上述条件进行湿法制粒,可以保证缓释片前期的释放;所述颗粒2通过上述条件进行湿法制粒,可以保证缓释片后期的释放恒定。即,本发明的缓释片是通过两步湿法制粒,再将颗粒混合后压片。所制备的颗粒1结构较为松散,而颗粒2结构紧实,两者混合后制得的骨架片胶的成型性好,溶出差异小,稳定性好。优选地,所述颗粒1和颗粒2的重量比为1:1~5,更优选为1:1~3。优选地,所述颗粒1中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为1~5:2~4:1:1~4;所述颗粒2中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为1~5:2~4:1:1~4。更优选地,所述颗粒1中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为3~4:2~3:1:1~2;所述颗粒2中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为3~4:2~3:1:1~2。优选地,所述亲水凝胶骨架材料包含:(a)具有粘度为80~120mPa·s的羟丙甲纤维素,和(b)具有粘度为3000~5600mPa·s的羟丙甲纤维素;更优选地,所述具有粘度为80~120mPa·s的羟丙甲纤维素和具有粘度为3000~5600mPa·s的羟丙甲纤维素的重量比为1~6:1。进一步优选地,所述具有粘度为80~120mPa·s的羟丙甲纤维素为羟丙甲纤维素K100lv;具有粘度为3000~5600mPa·s的羟丙甲纤维素为羟丙甲纤维素K4M。本发明人发现,单独使用一种型号的HPMC无法很好地控制药物的释放。两种型号的HPMC混合使用时需要满足上述的比例及合适的用量。这是由于用量较小时不能快速在片剂表面形成连续的凝胶层,会使缓释片局部迅速水化崩解,造成突释。优选地,所述颗粒1和颗粒2中,所述pH调节剂均为枸橼酸钠;所述赋形剂选自微晶纤维素和乳糖,且两者的重量比为3~1:1~3;优选为2~1:1。优选地,所述喹硫平或其药学上可接受的盐为富马酸喹硫平。本发明提供的含有喹硫平或其药学上可接受的盐的缓释片的制备方法,其包括以下步骤:(1)将颗粒1的原料喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂至于湿法制粒机中;将上述物料总重量的10%~28%的水雾化加入上述物料湿法制粒2~5min得到湿颗粒,湿整粒,干燥,干整粒,得到颗粒1;将颗粒2的原料喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂至于湿法制粒机中;将上述物料总重量的30%~45%的水雾化加入上述物料湿法制粒6~15min得到湿颗粒,湿整粒,干燥,干整粒,得到颗粒2;(2)将上述颗粒1和颗粒2与润滑剂混合,压片。优选地,所述颗粒1的湿法制粒时间为3~5min;加水量为物料总重量的18~28%;所述颗粒2的湿法制粒时间为8~12min;加水量为物料总重量的35~45%。优选地,所述喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂使用之前通过0.6mm的筛网。优选地,所述湿法制粒机的搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。优选地,所述溶液雾化加入的时间为3分钟内。优选地,所述湿整粒是过2.0mm的筛网。优选地,所述干燥是置于60℃的烘箱中使水分低于2%。优选地,所述干整粒是通过1.0mm的筛网。将原料(特别是喹硫平或其药学上可接受的盐)粉碎并过筛处理(优选地,所述喹硫平或其药学上可接受的盐的粒径小于0.15mm。),可以确保活性成分溶出速率的恒定,并能在规定时间内释放完全。所述颗粒1和颗粒2的制备中,均采用雾化加液,同时进行过度制粒,保证颗粒疏松、均匀,且无大块,从而提高工艺的稳定性。优选地,步骤(2)中,所述颗粒1和颗粒2的重量比为1:1~5,更优选为1:1~3。优选地,所述颗粒1中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为1~5:2~4:1:1~4;所述颗粒2中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为1~5:2~4:1:1~4。更优选地,所述颗粒1中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为3~4:2~3:1:1~2;所述颗粒2中,喹硫平或其药学上可接受的盐、亲水凝胶骨架材料、pH调节剂和赋形剂的重量比为3~4:2~3:1:1~2。优选地,所述亲水凝胶骨架材料包含:(a)具有粘度为80~120mPa·s的羟丙甲纤维素,和(b)具有粘度为3000~5600mPa·s的羟丙甲纤维素;更优选地,所述具有粘度为80~120mPa·s的羟丙甲纤维素和具有粘度为3000~5600mPa·s的羟丙甲纤维素的重量比为1~6:1;进一步优选地,所述具有粘度为80~120mPa·s的羟丙甲纤维素为羟丙甲纤维素K100lv;具有粘度为3000~5600mPa·s的羟丙甲纤维素为羟丙甲纤维素K4M。优选地,所述颗粒1和颗粒2中,所述pH调节剂为枸橼酸钠;所述赋形剂选自微晶纤维素和乳糖,且两者的重量比为3~1:1~3;优选为2~1:1。喹硫平或其药学上可接受的盐的溶解度具有pH依赖性,在生理pH条件下,随着pH升高溶解度降低。因此,加入pH调节剂,活性成分在人体的吸收主要在小肠,可以确保产品好的生物利用度。优选地,所述喹硫平或其药学上可接受的盐为富马酸喹硫平。所述制备方法制备的缓释片可以防止缓释制剂突释、溶出度差异大及重复性差等问题,提高产品的生物利用度。附图说明图1为对比例2制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图。图2为实施例1制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图。图3为实施例2制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图。图4为实施例3制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图。具体实施方式为了更好的理解和阐明本发明,以下就本发明提供的含有喹硫平或其药学上可接受的盐的缓释片剂及其制备方法给出示例性说明,但其不应被理解为对
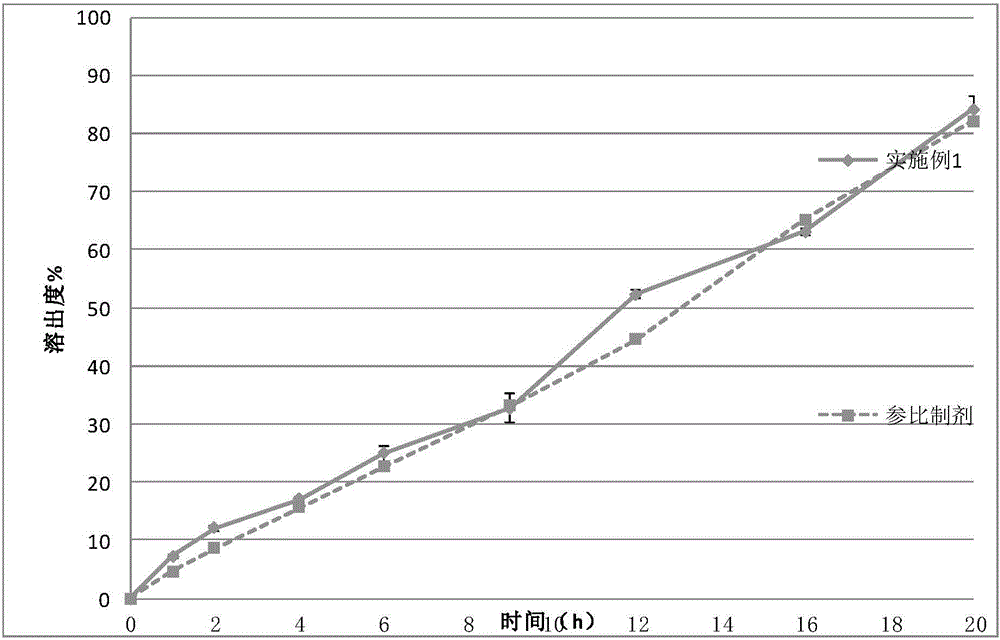
发明内容的限制。以下实施例中所用设备仪器主要包括:G20型湿法混合制粒机;BSL-25型混合机;FZB型粉碎整粒机;ZP10A型压片机;YD-35片剂硬度仪;RC806溶出仪。溶出方法:释放度-二部附录XD第一法;溶出度-二部附录XC第一法(中国药典2015年版),溶液C1000ml为溶剂,篮法,转速:200rpm溶液C:取一水合柠檬酸9.459g、氢氧化钠5.08g、磷酸氢二钠1.79g,加水溶解并稀释至1000ml,混匀,即得,pH6.80;原研药生产厂家:阿斯利康,批号:AA0159对比例1处方如表1所示。表1:1000片富马酸喹硫平缓释片(200mg/片)处方按照上表中处方量将乳糖、微晶纤维素、枸橼酸钠、富马酸喹硫平、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内缓缓加入物料总重量30%的量的纯化水进行制粒,看颗粒成型性再混合2min,出料。颗粒通过2.0mm的圆形筛网湿整粒。问题:颗粒不均匀,大团块较多,整粒困难,实验无法继续进行。对比例2处方如表2所示。表2:1000片富马酸喹硫平缓释片(200mg/片)处方#材料单剂量(mg)1000片处方量(g)1富马酸喹硫平230.00230.002乳糖51.6851.683微晶纤维素51.6751.674羟丙甲纤维素K4MCR29.5029.505羟丙甲纤维素K100lvCR147.50147.506枸橼酸钠70.8070.807硬脂酸镁8.858.85总重590590按照上表中处方量将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量30%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒,将处方量的硬脂酸镁过20目筛后和上述颗粒混合均匀,压片,包薄膜衣。图1为对比例2制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图(标准偏差的大小由图中竖线的长短表示)。由图1可以看出,竖线很长,标准偏差大,溶出差异大,说明对比例2制备的缓释片剂与原研药的溶出差异性大,无法满足要求。实施例1处方如表3所示:表3:2000片富马酸喹硫平缓释片(200mg/片)处方按照上表中处方量的颗粒1将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量18%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;按照上表中处方量的颗粒2将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量40%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,再混合4min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;将颗粒1和颗粒2混合均匀后,与过20目筛的硬脂酸镁混合,压片,包薄膜衣。图2为实施例1制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图(标准偏差的大小由图中竖线的长短表示)。由图2可以看出,竖线很短,标准偏差小,溶出差异小,说明实施例1制备的缓释片剂与原研药的溶出差异性小。实施例2处方如表3所示:表3:3000片富马酸喹硫平缓释片(200mg/片)处方按照上表中处方量的颗粒1将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量18%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;按照上表中处方量的颗粒2将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量40%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,再混合1min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;将颗粒1和颗粒2混合均匀后,与过20目筛的硬脂酸镁混合,压片,包薄膜衣。图3为实施例2制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图(标准偏差的大小由图中竖线的长短表示)。由图3可以看出,竖线很短,标准偏差小,溶出差异小,说明实施例2制备的缓释片剂与原研药的溶出差异性小。实施例3处方如表3所示:表3:3500片富马酸喹硫平缓释片(200mg/片)处方按照上表中处方量的颗粒1将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量18%的量的纯化水通过压力泵进行雾化后加入进行制粒,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;按照上表中处方量的颗粒2将乳糖、微晶纤维素、富马酸喹硫平、枸橼酸钠、羟丙甲纤维素K4MCR及羟丙甲纤维素K100lvCR依次通过0.6mm圆形筛网的整粒机过筛。收集物料并置于湿法混合制粒机中,设置搅拌速度为100~200转/分,切割刀速度为1000~2500转/分。干混后在3min内将物料总重量40%的量的纯化水通过压力泵进行雾化后加入进行制粒,看颗粒成型性再混合2min,再混合4min,出料。颗粒通过2.0mm的圆形筛网湿整粒,将湿颗粒置于60℃鼓风干燥箱中干燥至水分<2%,通过1.0mm的圆形筛网进行干整粒;将颗粒1和颗粒2混合均匀后,与过20目筛的硬脂酸镁混合,压片,包薄膜衣。图4为实施例3制备的缓释片剂与原研药在pH6.8磷酸盐缓冲液介质中的溶出度曲线图(标准偏差的大小由图中竖线的长短表示)。由图4可以看出,竖线很短,标准偏差小,溶出差异小,说明实施例3制备的缓释片剂与原研药的溶出差异性小。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1