前列腺素D2在制备治疗胃癌药物中的应用的制作方法
本发明属于肿瘤治疗药物技术领域,涉及前列腺素D2(PGD2)在制备治疗胃癌药物中的应用。
背景技术:
PGD2是前列腺素的一种,是重要的细胞信号分子,它的合成主要通过以下的生物过程:细胞膜上的磷脂酶A 转化成花生四烯酸,后者在环氧化酶(包括COX-1 和COX-2)的催化下,被分解成不稳定的中间产物前列腺素H2,前列腺素H2又被三种不同的酶:前列腺素D合成酶(PGDS),前列腺素E合成酶及前列腺素F合成酶转化为更稳定的PGD2,PGE2,PGF2。PGDS前列腺素系列的关键酶系,又包括脂质运载蛋白型PGD 合成酶(L-PTGDS)和造血型PGD合成酶(H-PTGDS);
研究表明前列腺素具有抑制炎症,减少胃酸分泌,胃肠平滑肌蠕动等作用,因此目前临床上的用途主要用于治疗哮喘、胃肠溃疡病、休克、高血压及心血管疾病。
增殖和迁移是肿瘤细胞最重要的生物学特征,某种程度上反应了肿瘤的生长速度和远端转移能力;PGD2在肿瘤中的作用及机制极少被研究,虽有零星报道证明PGD2可能抑制脑部肿瘤增殖,但是PGD2对胃癌细胞增殖和迁移是否有作用,目前并无报道。
CRTH2又叫GPR44,是PGD2特异性受体之一,主要表达于Th2细胞中,但据The Human Protein Atlas网站(http://www.proteinatlas.org/)中的信息,此受体亦可以表达于胃粘膜中,然而其作用并不清楚。本发明通过基因的敲减实验首次公开,PGD2对肿瘤细胞体外扩增和迁移的抑制作用依赖于CRTH2受体。
肿瘤干细胞被认为是肿瘤发生发展甚至是耐药的种子细胞,自我更新能力是肿瘤干细胞的重要特征,对肿瘤干细胞自我更新能力的抑制作用是肿瘤治疗研究的热点,PGD2及相关的信号传导是否影响肿瘤干细胞扩增和分化国内外仍无公开报道。已有的研究结果显示,PGD2合成限速酶L-PTGDS和受体CRTH2的表达与胃癌干细胞标记Sall4、Lgr5的表达呈负向相关,证明PGD2/CRTH2信号可能调控为干细胞的自我更新。本专利首次公开PGD2对胃癌肿瘤干细胞的调控作用。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提出PGD2在胃癌治疗发展中的新用途以及PGD2在胃癌抑制药物方面的新应用。
本发明提供一种PGD2在制备治疗胃癌药物中的应用。
进一步的,本发明提供一种PGD2在抑制胃癌细胞扩增和迁移的新应用。
本发明通过试验证明,PGD2能够有效地抑制肿瘤细胞体外扩增和迁移,本发明首次公开PGD2可以有效的控制胃癌细胞的生长。
本发明涉及的PGD2抑制胃癌细胞增殖和迁移的证明过程还包括抑制PGD2合成的关键酶和受体表达,反向证明PGD2对胃癌细胞的作用。通过干扰PGD2合成的关键酶(L-PTGDS),降低内源性PGD2的分泌,以及降低受体CRTH2表达证明内源性PGD2对肿瘤细胞体外扩增和迁移的抑制作用。
在一具体实例中,PGD2能够抑制胃癌细胞株HGC-27和SGC-7901的体外扩增和迁移能力;
在一具体实例中,通过小发卡RNA(shRNA)的敲减胃癌中PGD2合成的限速酶L-PTGDS及PGD2受体分子CRTH2,证明内源性PGD2对肿瘤细胞体外增殖和迁移的抑制作用,并提示这种作用是通过CRTH2信号完成。
本发明还提供的一种PGD2在抑制胃癌细胞干性基因表达和自我更新的新应用;
本发明还通过试验证明,本发明涉及的PGD2还能够抑制胃癌细胞肿瘤干细胞标记的表达和肿瘤细胞的自我更新能力;PGD2能够下调干细胞相关基因的表达,并抑制胃癌干细胞的自我更新能力,具有极佳的临床应用价值。
在一具体实例中,外源性PGD2能够有效地控制HGC-27和SGC-7901细胞的成球能力(自我更新能力)和干细胞相关基因的表达,为PGD2体外抑制胃癌生长提供理论依据;
在一具体实例中,通过小发卡RNA(shRNA)的敲减胃癌中PGD2合成的限速酶L-PTGDS及PGD2受体分子CRTH2,证明内源性PGD2对能够有效地控制HGC-27和SGC-7901细胞的成球能力(自我更新能力),提示这种作用是通过CRTH2受体完成。
本发明还提供一种治疗胃癌的药物,所述药物包含有效成分前列腺素D2。
所述药物还包括药学上可接受的载体,为本领域公知常识,在此不做赘述。
本发明的有益效果:
由上述描述不难发现,本发明涉及的是PGD2的新应用和控制胃癌细胞生长的新方法,与现有PGD2用途相比,具有以下的特点:
(1)外源性PGD2直接处理能够有效地控制胃癌细胞株的体外克隆能力(增殖扩增能力)和迁移能力,将合成PGD2的限速酶L-PTGDS和PGD2作用受体CRTH2应用小发卡RNA进行敲减后,胃癌细胞的体外扩增能力和迁移能力有明显的上调,反向证明内源性的PGD2对胃癌细胞的作用,证明PGD2通过CRTH2受体抑制肿瘤细胞相关生物学特性,因此本发明具有重要的临床意义。
(2)外源性的PGD2刺激能够有效地控制胃癌细胞株的干细胞相关基因的表达和肿瘤干细胞的自我更新能力,将合成PGD2的限速酶L-PTGDS和PGD2作用受体CRTH2应用小发卡RNA进行敲减后,对胃癌干细胞的这种抑制作用消失,由此本发明首次公开PGD2通过CRTH2受体抑制肿瘤细胞干细胞特性的新作用和控制胃癌进展的新机制,因此本发明具有重要的临床意义。
附图说明
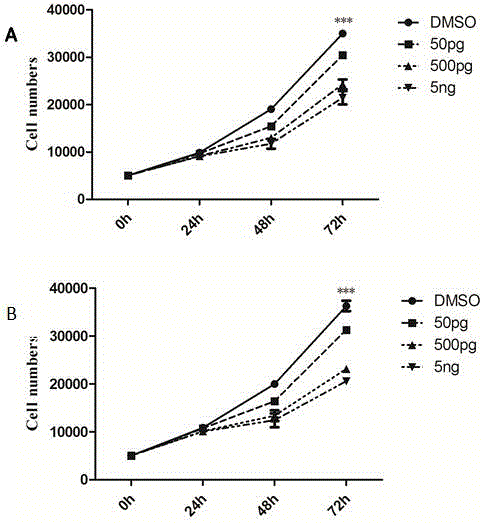
图1为不同浓度的PGD2对SGC-7901(图A)和HGC-27(图B)细胞增殖的抑制作用(***表示DMSO组与其他各组比较的统计学p值均小于0.001);
图2为不同浓度的PGD2对SGC-7901细胞迁移的抑制作用;A:Transwell检测细胞迁移能力100x;B:依据A图结果,计数每高倍镜下细胞数量(p<0.001表示DMSO组与其他各组比较的统计学p值均小于0.001);
图3为不同浓度的PGD2对HGC-27细胞迁移的抑制作用;A:Transwell检测细胞迁移能力100x;B:依据A图结果,计数每高倍镜下细胞数量(p<0.001表示DMSO组与其他各组比较的统计学p值均小于0.001);
图4为成球实验检测外源性的PGD2抑制HGC-27细胞自我更新能力(***表示DMSO组与其他各组比较p<0.001)。
图5为成球实验检测外源性的PGD2抑制SGC-7901细胞自我更新能力(***表示DMSO组与其他各组比较p<0.001)。
图6为定量PCR检测外源性的PGD2抑制HGC-27(图A)和SGC-7901(图B)细胞干性标记基因mRNA的表达(*表示p<0.05;**表示p<0.01;***表示DMSO组与其他各组比较p<0.001)。
图7为Western Blot检测外源性的PGD2抑制HGC-27细胞(图A)和SGC-7901细胞(图B)Sall4、Nanog、Oct4蛋白表达。
图8为HGC-27和SGC-7901中敲减L-PTGDS及CRTH2的表达;A:定量PCR检测HGC-27细胞中L-PTGDS及CRTH2的表达;B:定量PCR检测SGC-7901细胞中L-PTGDS及CRTH2的表达;C:ELISA检测HGC-27细胞敲减L-PTGDS及CRTH2后,上清中PGD2因子的含量(***表示shGFP组与其他各组比较的统计学p值均小于0.001)。
图9为克隆形成实验检测L-PTGDS及CRTH2敲减对HGC-27增殖的影响;A:克隆形成的大体照片;B:对A图中克隆的统计结果,计数每高倍镜视野中克隆个数(***表示shGFP组与其他各组比较的统计学p值均小于0.001)
图10为克隆形成实验检测L-PTGDS及CRTH2敲减对SGC-7901增殖的影响;A:克隆形成的大体照片;B:对A图中克隆的统计结果,计数每高倍镜视野中克隆个数(***表示shGFP组与其他各组比较的统计学p值均小于0.001);
图11为Transwell实验检测L-PTGDS及CRTH2敲减对HGC-27细胞迁移的影响;A:Transwell膜下方穿过细胞的照片100x;B:对A图中迁过细胞数量的统计结果,计数每高倍镜视野中克隆个数(***表示shGFP组与其他各组比较的统计学p值均小于0.001);
图12为Transwell实验检测L-PTGDS及CRTH2敲减对HGC-27细胞迁移的影响;A:Transwell膜下方穿过细胞的照片100x;B:对A图中迁过细胞数量的统计结果,计数每高倍镜视野中克隆个数(***表示shGFP组与其他各组比较的统计学p值均小于0.001)。
图13为成球实验检测L-PTGDS和CRTH2敲减后HGC-27细胞自我更新能力(***表示shGFP组与其他各组比较p<0.001)。
图14为定量PCR检测L-PTGDS和CRTH2敲减后HGC-27细胞(图A)和SGC-7901细胞(图B)干性标记基因mRNA的表达(*表示p<0.05;**表示p<0.01;***表示DMSO组与其他各组比较p<0.001)。
图15为Western Blot检测L-PTGDS和CRTH2敲减后HGC-27和SGC-7901细胞Sall4、Nanog、Oct4蛋白表达。
图16为成球实验检测外源性的PGD2对L-PTGDS和CRTH2敲减后HGC-27细胞自我更新能力的影响(**表示p<0.01;***表示DMSO组与其他各组比较p<0.001)。
具体实施实例
以下结合具体实施例对本发明更好的阐述,以便与对本发明更好的理解。
实施例所使用的主要材料和来源分别如下:
细胞培养试剂:1640 DMEM(Gibco公司产品)、胎牛血清(Gibco公司产品)、胰蛋白酶(Sigma公司产品)、二氧化碳培养箱(Forma公司)、无血清培养基(上海依科赛公司)、human EGF因子(Gibco公司)、human FGF因子(Gibco公司)、B27(Gibco公司)、RNA提取试剂盒(上海英骏公司)、细胞蛋白提取试剂盒(碧云天公司)、逆转录试剂盒(南京诺维赞公司)、Western Blot相关试剂(碧云天公司);结晶紫(上海碧云天试剂有限公司)。
倒置显微镜、生物显微镜、超净工作台、台式离心机;
PGD2纯品(美国Sigma公司)、24(6)孔培养板(Corning公司)、Transwell迁移板(Corning公司);敲减L-PTGDS及CRTH2的shRNA慢病毒(简称:shL-PTGDS及shCRTH2)及对照病毒(shGFP)(赛业(广州)生物科技有限公司)、定量PCR mix(南京诺维赞生物科技有限公司)、定量PCR排管(Biorad公司)。
胃癌细胞株HGC-27、SGC-7901购自中科院上海细胞所。
实施例1:外源性的PGD2抑制胃癌细胞株SGC7901和HGC-27的体外扩增和迁移
(1) PGD2纯品的稀释:由美国Sigma公司购得PGD2因子(1mg装),加入100μL的二甲亚砜(DMSO)试剂进行溶解,稀释成浓度为100ng/μL的母液,再用空白1640DMEM培养液将母液按1:1000的比例稀释为100pg/μL的营养液(后续步骤所提提到的应用液均为此浓度);
(2) 外源性PGD2对肿瘤细胞体外增殖影响:将HGC-27和SGC-7901细胞种在24孔板中,细胞密度为5000/孔,同时加入不同量的PGD2应用液进行刺激,使细胞接触的终浓度为:50pg/mL, 500pg/mL 和5ng/mL,DMSO为对照。在不同浓度PGD2作用24h,48h,72h后计数每孔细胞的数量,结果显示,从24h开始,与阴性对照DMSO相比,PGD2抑制HGC-27和SGC-7901细胞数量的增加,并且这种抑制作用与PGD2作用浓度呈依赖关系,浓度越高抑制越明显,如图1,图中***表示DMSO组与其他各组比较的统计学p值均小于0.001。
(3)外源性PGD2对肿瘤细胞体外迁移作用的影响:将HGC-27和SGC-7901细胞种在6板中,细胞密度为100000/孔,待细胞完全贴壁后加入不同量的PGD2应用液进行刺激,使细胞接触的终浓度为:50pg/mL, 500pg/mL和5ng/mL,DMSO为对照。PGD2刺激48h后,通过胰酶消化各孔细胞后计数,将不同浓度PGD2作用后的细胞以100000种在Transwell小室中(用无血清的1640DMEM稀释),Transwell孔的下室加500μL含有10%胎牛血清的1640DMEM培养液,放入培养箱中继续培养12h,取出Transwell板通过4%多聚甲醛进行固定后应用结晶紫进行染色,通过棉签将培养小室膜上方细胞擦净,计数膜下方细胞的数量,结果显示,与阴性对照DMSO相比,PGD2显著得抑制HGC-27和SGC-7901迁移能力,并且这种抑制作用与PGD2作用浓度呈依赖关系,浓度越高对HGC-27和SGC-7901迁移抑制作用越明显(图2,图3)。
实施例2:外源性的PGD2抑制胃癌细胞自我更新能力和相关基因表达
PGD2纯品的稀释同实施例1。
(1) 外源性PGD2对肿瘤细胞成球能力(自我更新能力)的抑制作用:首先配置干细胞无血清培养基(配方为:20ng/mL EGF、10ng/mL FGF、1:50 B27因子),将HGC-27和SGC-7901细胞种在6孔板中,培养条件为无血清干细胞培养液,细胞密度为5000/孔,同时加入不同量的PGD2应用液进行刺激,使细胞接触的终浓度为:50pg/mL、 500pg/mL 和5ng/mL,DMSO为对照,培养7天后,40倍显微镜下观察成球个数(直径大于70μm即为为一个球),200倍下观察成球大小,结果显示,与阴性对照DMSO相比,外源性的PGD2显著地抑制了HGC-27和SGC-7901细胞成球的数量和球体的大小,并且这种抑制作用与PGD2作用浓度呈依赖关系,浓度越高抑制越明显(图4,图5),这一结果就表明PGD2抑制胃癌干细胞的自我更新能力;
(2)外源性PGD2抑制胃癌干细胞相关基因的表达:将HGC-27和SGC-7901细胞种在6孔板中(2块),培养条件为无血清干细胞培养液,细胞密度为500000/孔,同时加入不同量的PGD2应用液进行刺激,使细胞接触的终浓度为:50pg/mL, 500pg/mL 和5ng/mL,DMSO为对照,培养48h后,取一块6孔板进行RNA提取工作(按照RNA提取试剂盒说明书进行),逆转录后检测PGD2对Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA表达情况的影响,结果显示外源性的PGD2显著地抑制了HGC-27和SGC-7901细胞Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA,并且这种抑制作用与PGD2作用浓度呈依赖关系,浓度越高抑制越明显(图6);取同样:50pg/mL, 500pg/mL 和5ng/mL PGD2刺激的另一块6孔板进行蛋白提取(按照蛋白提取试剂盒说明书),通过Western Blot检测外源性的PGD2对HGC-27和SGC-7901细胞Sall4、Oct4、Nanog的蛋白水平表达的影响,结果显示,外源性的PGD2显著地抑制了HGC-27和SGC-7901细胞all4、Oct4、Nanog的蛋白的表达,并且这种抑制作用与PGD2作用浓度呈依赖关系,浓度越高抑制越明显(图7)。
表1 引物序列如下
实施例3:通过小发卡RNA(shRNA)敲减胃癌中PGD2合成的限速酶L-PTGDS及PGD2受体分子CRTH2,证明内源性PGD2对肿瘤细胞体外增殖和迁移的抑制作用,并提示这种作用是通过CRTH2信号完成。
对实施例3中涉及的关键分子进行介绍:L-PTGDS是PGD2合成的关键酶,换言之,L-PTGDS表达量影响细胞自身分泌PGD2的量,敲减L-PTGDS的表达可以有效地的减少PGD2的分泌;而CRTH2是PGD2结合重要受体,主要表达于细胞膜上,是PGD2向细胞内传导信号重要分子,敲减CRTH2可以阻断PGD2对靶细胞的功能。
对本发明实施例3具体实施步骤描述如下:
(1)敲减L-PTGDS及CRTH2细胞株的构建:通过南京诺维赞公司构建shL-PTGDS及shCRTH2的慢病毒,依据公司提供的转染步骤对HGC-27和SGC-7901细胞中L-PTGDS和CRTH2的表达进行敲减,以shGFP为敲减的阴性对照,依据慢病毒转染的说明书操作步骤获得了shGFP,shL-PTGDS及shCRTH2的稳定细胞株;
(2)HGC-27及SGC-7901细胞中L-PTGDS和CRTH2敲减效果的检测:获得shGFP,shL-PTGDS及shCRTH2细胞株后,通过定量PCR分析敲减的效果,结果显示shL-PTGDS转染HGC-27和SGC-7901细胞中L-PTGDS表达减低,shCRTH2转染组CRTH2敲减成功(图8A, 8B),重要的是,HGC-27细胞中敲减L-PTGDS后自分泌的PGD2分泌量减少(图8C);
表2.CRTH2和L-PTGDS的PCR扩增的引物序列如下:
(3)降低内源性PGD2分泌和阻断其受体后胃癌细胞株增殖能力的检测:本发明通过克隆形成实验分析了shL-PTGDS(通过shRNA干扰L-PTGDS表达的肿瘤细胞)及shCRTH2细胞(通过shRNA干扰CRTH2表达的肿瘤细胞)的增殖能力,将1000个细胞种于6孔板中,二氧化碳培养箱正常培养7天后对其结晶紫的染色,观察其形成克隆的大小和多少,结果显示,L-PTGDS和CRTH2敲减后HGC-27和SGC-7901细胞的体外扩增速度明显的高于对照细胞(shGFP)(图9 和图10),此结果表明内源性PGD2对胃癌细胞增殖具有抑制作用。
(4)降低内源性PGD2分泌和阻断其受体后胃癌细胞株迁移能力的检测:本发明通过Transwell实验分析了shL-PTGDS及shCRTH2细胞的迁移能力,将100000个待检细胞悬浮于200微升的无血清的DMEM中并将其种于Transwell小室的上方,小室下方加入500微升的有血清的培养基,放入二氧化碳培养箱中12h后,将小室取出,通过结晶紫染色观察迁移至小室下方细胞的多少,结果显示,L-PTGDS和CRTH2敲减后HGC-27和SGC-7901细胞迁移速度明显的高于shGFP对照细胞(图11 和图12),此结果提示内源性PGD2对抑制HGC-27和SGC-7901细胞迁移作用。
实施例4:通过小发卡RNA(shRNA)敲减胃癌中PGD2合成的限速酶L-PTGDS及PGD2受体分子CRTH2,证明内源性PGD2对肿瘤细胞自我更新和基因表达的抑制作用。
敲减L-PTGDS及CRTH2细胞株的构建及敲减效果监测同实施例3。
(1)降低内源性PGD2分泌和阻断其受体后胃癌细胞株成球能力的检测:本发明通过成球实验分析了shL-PTGDS及shCRTH2细胞的自我更新能力,结果显示,L-PTGDS和CRTH2敲减后HGC-27和SGC-7901细胞的成球能力明显的高于对照细胞(shGFP)(图13),此结果表明内源性PGD2对胃癌细胞成球能力明显地抑制作用。
(2)降低内源性PGD2分泌和阻断其受体对胃癌细胞株干性基因表达的影响:本发明通过定量PCR实验分析了shL-PTGDS及shCRTH2细胞的Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA表达,结果显示,L-PTGDS和CRTH2敲减后HGC-27和SGC-7901细胞的Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因明显的高于对照细胞(shGFP)(图14);Western Blot检测Sall4、Nanog、Oct4蛋白水平的检测也显示了同样的结果(图15)。
(3)为了进一步证明PGD2对胃癌干细胞的作用,将外源性的PGD2(5ng/mL)刺激shGFP、shL-PTGDS、shCRTH2细胞,结果显示,5ng/ml的PGD2抑制了shGFP和shL-PTGDS细胞的成球能力,而对shCRTH2细胞无明显地作用(图 16),这一结果表明外源性PGD2回补了了shL-PTGDS敲减引起的PGD2的缺失,而PGD2这种作用是通过CRTH2完成的。
- 还没有人留言评论。精彩留言会获得点赞!