基于框架诱导自组装的多功能负载囊泡及其制备方法与流程
本发明涉及生物技术领域,具体地,涉及负载囊泡,以及制备负载囊泡的方法。
背景技术:
近年来,两亲分子囊泡由于它的分子可设计性,组装体结构与表面性能的可操控性,在药物载体领域得到了越来越广泛的关注。为了满足不同的需要,大量的囊泡被设计和制造出来以实现不同尺寸形状,表面性质以及透过率等等。然而,迄今为止,我们仍然缺乏一种多功能的综合性囊泡来实现多种功能。
由此,多功能的综合性囊泡有待研究。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明的一个目的在于提出一种负载囊泡,大小和尺寸的均可调控,并且能够负载多种物质,例如亲水性物质,疏水性物质以及短链核苷酸等,是一种多功能的综合性负载囊泡。
因而,根据本发明的一个方面,本发明提供了一种负载囊泡。根据本发明的实施例,该负载囊泡包括:
dna修饰的纳米粒,所述dna修饰的纳米粒包括:
纳米粒;
修饰dna,所述修饰dna与所述纳米粒相连;
囊泡层,所述囊泡层包覆在所述dna修饰的纳米粒的外部,且所述囊泡层是由组装dna构成的,且所述组装dna部分与所述修饰dna片段互补相连;以及
负载物,所述负载物的负载部位为以下至少一种:
(1)位于所述纳米粒表面;
(2)位于所述囊泡层内;
(3)位于所述囊泡层上。
根据本发明实施例的负载囊泡,大小和尺寸的均可调控,并且能够负载多种物质,例如亲水性物质,疏水性物质以及短链核苷酸等,是一种多功能的综合性负载囊泡,便于多种物质的转运。
另外,根据本发明上述实施例的负载囊泡还可以具有如下附加的技术特征:
根据本发明的实施例,所述纳米粒为金纳米粒。
根据本发明的实施例,所述修饰dna为巯基dna。
根据本发明的实施例,所述组装dna为ppo-b-dna。
根据本发明的实施例,所述组装dna为ppo-s-s-dna。
根据本发明的实施例,该负载囊泡进一步包括:dna-b-peg,所述dna-b-peg与所述组装dna的部分dna片段互补相连。
根据本发明的另一方面,本发明提供了一种制备负载囊泡的方法。根据本发明的实施例,该方法包括:
(1)将修饰dna加入到纳米粒溶液中,以便得到dna修饰的纳米粒;
(2)将所述dna修饰的纳米粒加入含有负载物和组装dna的溶液中进行自组装,以便获得负载囊泡。
根据本发明实施例的制备负载囊泡的方法,通过框架诱导自组装的策略,通过搭建的框架来实现负载囊泡的大小和尺寸的可调控的性能,并且在有顺序的组装过程中可以同时负载多种物质,例如亲水性物质,疏水性物质以及短链核苷酸等等,从而得到多功能的综合性负载囊泡。
根据本发明的实施例,步骤(1)中,所述纳米粒的浓度为所述修饰dna浓度的150-250倍。根据本发明的优选实施例,步骤(1)中,所述纳米粒的浓度为所述修饰dna浓度的200倍。
根据本发明的实施例,步骤(2)中,所述组装dna的浓度是所述dna修饰的纳米粒浓度的100-200倍。根据本发明的优选实施例,步骤(2)中,所述组装dna的浓度是所述dna修饰的纳米粒浓度的150倍。
根据本发明的实施例,该方法进一步包括:将所述负载囊泡加入含有dna-b-peg的溶液中,以便得到调节表面电势后的负载囊泡。
根据本发明的实施例,该方法进一步包括:将所述负载囊泡加入含有链霉亲和素的溶液中,以便得到具有生物素靶向性的负载囊泡。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
图1显示了根据本发明一个实施例的负载囊泡的结构示意图;
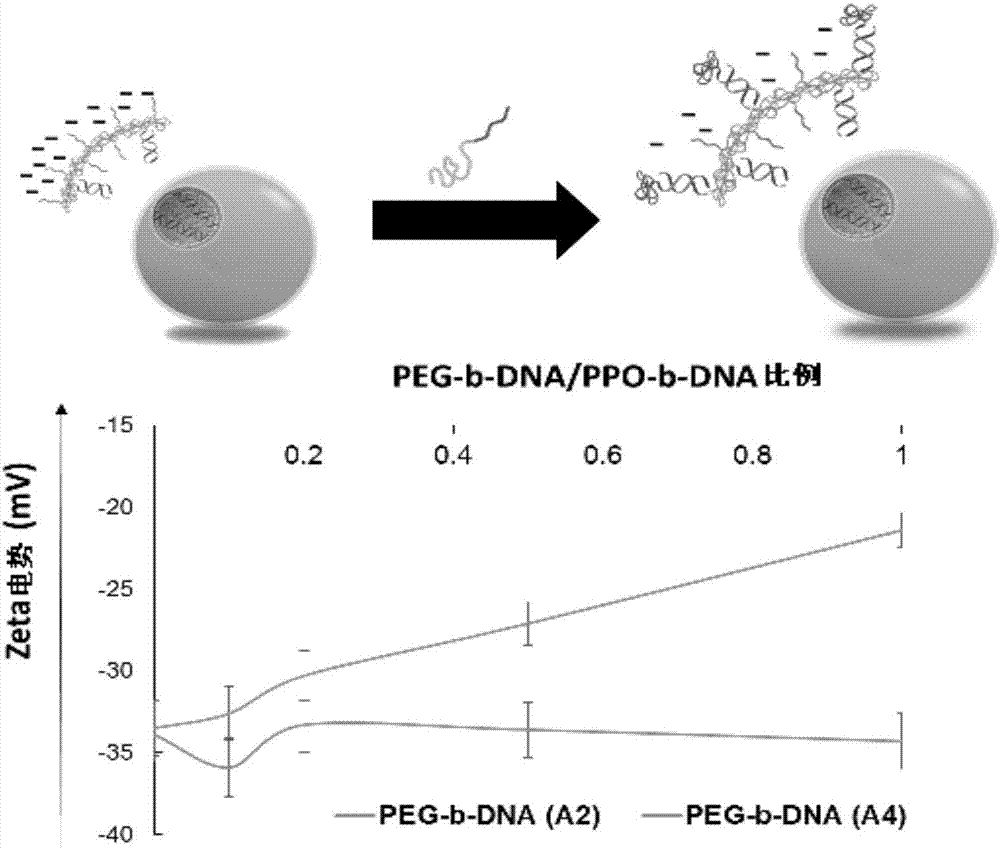
图2显示了根据本发明一个实施例的peg-b-dna修饰负载囊泡的方法及负载囊泡的电势变化示意图;
图3显示了根据本发明一个实施例的制备负载囊泡的方法的流程示意图;
图4显示了根据本发明一个实施例的制备负载囊泡的方法的流程示意图;
图5显示了根据本发明一个实施例的制备负载囊泡的过程中各物质的粒径示意图;
图6显示了根据本发明一个实施例的制备负载囊泡的过程中各物质的电镜示意图;
图7显示了根据本发明一个实施例的负载囊泡负载负载物的流程和电势变化示意图;
图8显示了根据本发明一个实施例的负载囊泡靶向转移的示意图;
图9显示了根据本发明一个实施例的负载囊泡靶向转移过程中各物质的电镜示意图;
图10显示了根据本发明一个实施例的负载囊泡相应性解散和可控释放的示意图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
根据本发明的一个方面,本发明提供了一种负载囊泡。参考图1,根据本发明的实施例,对该负载囊泡进行解释说明,该负载囊泡包括:dna修饰的纳米粒100、囊泡层200和负载物300。根据本发明的实施例,dna修饰的纳米粒100包括:纳米粒110和修饰dna120,该修饰dna120与纳米粒110相连。根据本发明的实施例,囊泡层200包覆在dna修饰的纳米粒100的外部,且该囊泡层200是由组装dna构成的,且该组装dna部分与修饰dna片段互补相连。根据本发明的实施例,负载物300的负载部位为以下至少一种:(1)与纳米粒相连;(2)位于囊泡层内;(3)位于囊泡层上,其中不同的物质负载的部位不同,例如dna分子可以与纳米粒相连,亲水性物质可以位于囊泡层内,而疏水性物质可以位于囊泡层上。
其中,需要说明书的是,负载物的种类不受特别的限制,可以是亲水性物质,疏水性物质以及短链核苷酸等,并且,该负载囊泡可以同时负载多种物质。
根据本发明的实施例,纳米粒110为选自金纳米粒。
根据本发明的实施例,修饰dna为巯基dna。由此,巯基与金纳米粒能形成s-au键,便于将修饰dna连接在纳米粒上。
根据本发明的一些具体实施例,修饰dna可以具有以下核苷酸序列:
5’-ctatcctctcatcac-3’(seqidno:1)
5’-gctcactcagtatcaaca-3’(seqidno:2)
5’-tggtgaagtagatgtgta-3’(seqidno:3)
5’-tttttt-3’(seqidno:4)
根据本发明的实施例,组装dna为ppo-b-dna。由此,该组装dna具有温度响应性,在温度超过25℃即具有疏水性质,从而可通过加热升温快速制备囊泡。
根据本发明的一些具体实施例,组装dna具有以下核苷酸序列:
5’-gtgatgagaggatag-3’(seqidno:5)
根据本发明的实施例,所述组装dna为ppo-s-s-dna。由此,利用ppo-s-s-dna中的二硫键在框架上引入氧化还原响应性的二硫键,从而利用框架诱导自组装的策略得到具有响应性的囊泡。利用还原剂谷胱甘肽处理响应性的囊泡,切断了框架上的二硫键,进而实现了负载囊泡对小分子的可控性释放。此外,在该实验中,所用谷胱甘肽为细胞内10mm的浓度,这也为该囊泡在细胞内作用提供了依据。
根据本发明的实施例,该负载囊泡进一步包括:dna-b-peg,该dna-b-peg与组装dna的部分dna片段互补相连。利用dna-b-peg调节囊泡层的负电性,可以使囊泡在生物体内具有更长的循环时间,并能调节负载囊泡与目标细胞结合,实现负载物的靶向转运。
其中,dna-b-peg调节囊泡层的负电性的原理如下:由于peg不带电,通过调节dna-b-peg的加入比例,可以改变囊泡层200的表面电势。如图2所述,逐渐增加dna-b-peg的加入量,使囊泡层200的表面电势逐渐由dna的负电性向不显电性偏移,而加入不互补的dna-b-peg则没有类似的变化。
根据本发明的另一方面,本发明提供了一种制备负载囊泡的方法。参考图3,根据本发明的实施例,对该制备负载囊泡的方法进行解释说明,该方法包括:
s100dna修饰
根据本发明的实施例,将修饰dna加入到纳米粒溶液中,得到dna修饰的纳米粒。
根据本发明的实施例,在步骤s100中,溶液中,纳米粒的浓度为修饰dna浓度的150-250倍。根据本发明的优选实施例,在该步骤中,溶液中,纳米粒的浓度为修饰dna浓度的200倍。由此,该种密度dna修饰的纳米粒子表面,使组装dna更易于自组装形成囊泡层。
s200自组装
根据本发明的实施例,将dna修饰的纳米粒加入含有负载物和组装dna的溶液中进行自组装,获得负载囊泡。由此,通过框架诱导自组装的策略,通过搭建的框架来实现负载囊泡的大小和尺寸的可调控的性能,并且在有顺序的组装过程中可以同时负载多种物质,例如亲水性物质,疏水性物质以及短链核苷酸等等,从而得到多功能的综合性负载囊泡。
根据本发明的实施例,自组装的过程包括:将组装dna加入到含有dna修饰的纳米粒的溶液中,加热升温至37℃,之后缓慢退火至室温。由此,制备得到的负载囊泡数目多,并且尺寸均一。
根据本发明的实施例,在步骤200中,所述组装dna的浓度是所述dna修饰的纳米粒浓度的100-200倍。根据本发明的优选实施例,步骤(2)中,所述组装dna的浓度是所述dna修饰的纳米粒浓度的150倍。
根据本发明的实施例,该方法进一步包括:将负载囊泡加入含有dna-b-peg的溶液中,得到调节表面电势后的负载囊泡。由此,利用dna-b-peg调节囊泡层的负电性,使负载囊泡根据不同的细胞的不同带电性,延长其循环时间,并能与目标细胞结合。
根据本发明的实施例,该方法进一步包括:将负载囊泡加入含有链霉亲和素的溶液中,得到具有生物素靶向性的负载囊泡。由此,利用链霉亲和素与生物素结合的性能,使负载囊泡可以靶向生物素基体,并且该种模式可以推广到其他特异性相互作用,实现靶向目标细胞的功能。
其中,需要说明的是,制备负载囊泡的过程可以通过动态光散射进行跟踪,参考图4-6,对该制备负载囊泡的过程进一步说明,其中,图4提供了制备负载囊泡的过程;图5提供了一个具体实施例中,纳米粒、dna修饰的纳米粒和负载囊泡的粒径范围,如图所示,分别为11.02,19.77以及33.26纳米;而图6a-6c依次分别提供了负载囊泡、经修饰后负载囊泡和其放大的电镜照片,从电镜照片中可以观察到各照片中的颗粒的粒径范围,与图5的粒径范围相符,并且,图6c中,负载囊泡的数目众多,尺寸相对均一。由此,上述过程表明,本发明实施例的方法能够在纳米粒表面修饰dna,同时组装dna-双亲分子已组装到金颗粒外围形成稳定的囊泡,从而,该方法能够制备得到负载囊泡。
下面参考具体实施例,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品,例如可以采购自sigma公司。
实施例1
利用本发明实施例的负载囊泡负载亲水物质,疏水物质以及短链核苷酸,其中,荧光素钠,尼罗红和fam修饰的dna分别代表亲水物质,疏水物质以及短链核苷酸。针对荧光素钠,将10nm囊泡在1mm的荧光素钠溶液中形成,之后经过透析与未形成囊泡的样品做荧光光谱对比;对于尼罗红,将囊泡形成之后加入尼罗红溶液,与未加入囊泡的尼罗红溶液进行对比,对于fam-dna,我们控制熔点,在熔点上下分别进行荧光光谱的测定,实验步骤具体如下:
(1)将金纳米粒加入到含有修饰dna的溶液中,得到dna修饰的金纳米粒,其中,修饰dna的核苷酸序列如下:
5’-ctatcctctcatcac-3’(seqidno:1)
(2)将dna修饰的金纳米粒分别加入到含有荧光素钠、尼罗红和fam修饰的dna的dna-b-ppo溶液中,其中,dna-b-ppo的终浓度为10μm,加热升温至37℃过夜,分别得到负载三种负载物的负载囊泡,其中,fam修饰的dna的核苷酸序列为如下其中一种:
5’-tgttgatactgagtgagc-3’(seqidno:6)
5’-ttttacacatctacttca-3’(seqidno:7)
dna-b-ppo的核苷酸序列如下:
5’-gtgatgagaggatag-3’(seqidno:5)
(3)分别取3种含有不同负载物的负载囊泡溶液,离心沉降后再溶于纯水中,稀释10倍,通过荧光光谱仪对其进行检测,与上述参照样品进行对比,参照样品分别为未形成囊泡的荧光素钠溶液、尼罗红溶液和fam-dna溶液。实验过程和结果如图7所示,相对于参照样品,载有负载物的负载囊泡的荧光信号有了明显的增强,说明本实施例中所设定的几种物质均能够成功的在该种囊泡中进行负载。
实验结果表明,本发明实施例的负载囊泡能够负载多种物质,例如亲水性物质,疏水性物质以及短链核苷酸等,是一种多功能的综合性负载囊泡,便于多种物质的转运。
实施例2
本实施例中,利用dna-b-peg和链霉亲和素改变负载囊泡的外围表面电势和实现负载囊泡的靶向转运功能,具体实验过程如下:
(1)将金纳米粒加入到含有修饰dna的溶液中,得到dna修饰的金纳米粒,其中,修饰dna的核苷酸序列如下:
5’-ctatcctctcatcac-3’(seqidno:1)
(2)将dna修饰的金纳米粒加入到含有dna-b-ppo的溶液中,其中,dna-b-ppo的终浓度为10μm,加热升温至37℃过夜,得到负载囊泡,其中,dna-b-ppo的核苷酸序列如下:
5’-gtgatgagaggatag-3’(seqidno:5)
(3)将负载囊泡加入到含有dna-b-peg的溶液中,得到dna-b-peg修饰的负载囊泡。
(4)将负载囊泡加入到dna-生物素和10倍过量的链霉亲和素,之后通过超滤清洗出去杂质,由于链霉亲和素与生物素具有靶向识别的作用,该修饰过的囊泡可以识别生物素修饰的dna折纸,结果如图8和9所示,其中,图8为dna-b-peg修饰的负载囊泡靶向识别生物素修饰的dna折纸的过程,图9为各物质的电镜照片,其中,图9a为dna折纸的电镜照片,图9b为dna-b-peg修饰的负载囊泡富集在生物素修饰的dna折纸上的电镜照片,图9c为富集dna-b-peg修饰的负载囊泡的dna折纸上的放大电镜照片。
实施例3
在负载囊泡的囊泡层框架上引入氧化还原响应性的二硫键,利用框架诱导自组装的策略制备响应性的囊泡。模拟细胞内的还原环境,使用细胞内浓度水平的还原剂谷胱甘肽处理响应性的囊泡,切断了框架上的二硫键,进而实现了可控的囊泡解组装,具体实验过程如下:
(1)将金纳米粒加入到含有修饰dna的溶液中,得到dna修饰的金纳米粒,其中,修饰dna的核苷酸序列如下:
5’-ctatcctctcatcac-3’(seqidno:1)
(2)将dna修饰的金纳米粒加入到含有dna-s-s-ppo的溶液中,其中,dna-s-s-ppo的终浓度为10μm,加热升温至37℃过夜,得到负载囊泡,其中,dna-s-s-ppo的核苷酸序列如下:
5’-s-s-gtgatgagaggatag-3’(seqidno:8)
(3)将负载囊泡溶液平均分为两部分,其中一部分加入还原型谷胱甘肽,至终浓度为10mm,处理8小时后加入修饰的5nm金颗粒,外围无法互补一圈小的金颗粒。另一部分没有用谷胱甘肽处理的囊泡,其外围可以很好地互补。
(4)按照步骤(1)和(2)的方法制备负载囊泡,其中,不同的是含有dna-s-s-ppo的溶液还含有1mm的荧光素钠,得到负载荧光素钠的囊泡。
(5)将负载荧光素钠的囊泡进行透析以除去游离的荧光素钠。
(6)加入还原型谷胱甘肽至终浓度为10mm,利用荧光光谱仪检测释放出来的荧光素钠。如图10所示,在还原型谷胱甘肽的处理下,囊泡中小分子荧光素钠有着明显加强的释放速率。
由此,囊泡层框架上引入氧化还原响应性的二硫键的负载囊泡利用还原型谷胱甘肽可控制的囊泡解组装,从而实现负载囊泡对小分子的可控性释放。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
sequencelisting
<110>清华大学
<120>负载囊泡及其制备方法
<130>pidc3168933
<160>8
<170>patentinversion3.3
<210>1
<211>15
<212>dna
<213>artificial
<220>
<223>修饰dna
<400>1
ctatcctctcatcac15
<210>2
<211>18
<212>dna
<213>artificial
<220>
<223>修饰dna
<400>2
gctcactcagtatcaaca18
<210>3
<211>18
<212>dna
<213>artificial
<220>
<223>修饰dna
<400>3
tggtgaagtagatgtgta18
<210>4
<211>6
<212>dna
<213>artificial
<220>
<223>修饰dna
<400>4
tttttt6
<210>5
<211>15
<212>dna
<213>artificial
<220>
<223>组装dna
<400>5
gtgatgagaggatag15
<210>6
<211>18
<212>dna
<213>artificial
<220>
<223>fam修饰的dna
<400>6
tgttgatactgagtgagc18
<210>7
<211>18
<212>dna
<213>artificial
<220>
<223>fam修饰的dna
<400>7
ttttacacatctacttca18
<210>8
<211>17
<212>dna
<213>artificial
<220>
<223>dna-s-s-ppo
<400>8
ssgtgatgagaggatag17
- 还没有人留言评论。精彩留言会获得点赞!