一氧化氮响应的载药囊泡、制备方法及其应用与流程
本发明属于有机合成、超分子化学及纳米材料技术领域,具体涉及一种具有1,4-二氢吡啶(dhp)单元的两亲分子vno的一氧化氮响应的载药囊泡、制备方法及其应用。
背景技术:
药物传输系统(dds)对于疾病的治疗具有十分重要的意义。设计一种药物传输系统的时候尤其需要考虑两个因素:系统类型,以及实现药物控制释放的响应机制。系统类型通常包括树枝状分子,胶束,囊泡,凝胶等。其中,囊泡由于具有水相内腔和酯质双分子层,因此同时具有负载亲水性或疏水性药物的能力,这使囊泡成为一种极有潜力的药物传输系统。而实现药物控制释放的响应机制主要包括ph、酶、氧化还原反应、温度、磁场以及光照等。
一氧化氮是自然界已发现的最小的分子之一。最初,一氧化氮作为一种环境污染物而受到人们的关注。但是,在随后的研究中科学家们发现,一氧化氮在生物体内以一种信使分子的形式广泛参与了很多生理活动并对免疫系统、神经系统和心脑血管系统产生影响。因此,一氧化氮与多种疾病相关,例如帕金森病、高血压、心脏病等。值得一提的是,近年来的研究表明癌症与一氧化氮浓度的升高也密切相关。将对一氧化氮的研究与疾病治疗相结合,是现今一个研究热点。
综上,一氧化氮响应的囊泡型药物载体的研究具有重要意义,它可以为相关疾病的诊断和治疗提供一种新的途径,甚至可能会起到无法替代的作用。目前尚未发现有相关的专利发明被报道。
技术实现要素:
本发明的一个目的是解决至少上述问题或缺陷,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种以1,4-二氢吡啶(dhp)为响应开关的两亲分子vno,该分子可以在缓冲溶液中通过自主装形成包载药物的囊泡,并且可以在一氧化氮刺激下实现包载药物的释放,该载药囊泡具有很好的生物相容性。
本发明还有一个目的是提供一氧化氮响应的载药囊泡的合成方法,以及该一氧化氮响应的载药囊泡在亲水性或疏水性药物的包载及控制释放中的应用。
为了实现根据本发明的这些目的和其它优点,提供了一种一氧化氮响应的载药囊泡,其构成成分为含有1,4-二氢吡啶单元的两亲分子vno,所述两亲分子vno的结构式如下:
优选的是,其中,所述两亲分子vno由以下制备方法制备,其合成路线如下:
所述制备方法的具体步骤包括:
步骤i、按比例称取式1化合物、对羟基苯乙醇以及催化剂于无水溶剂中,碱性条件下反应5小时后,柱层析分离得到式2化合物;
步骤ii、将所述步骤i得到的式2化合物和氧化剂于无水溶剂中,将式2化合物中的羟基氧化为醛基后,产物与乙酰乙酸十六酯、浓氨水溶于溶剂中,在氩气气氛下反应20小时后,柱层析分离得到式3化合物;
步骤iii、将所述步骤ii得到的式3化合物于无水溶剂中,加入三氟乙酸酸去除羟基保护基团叔丁基二甲基硅基tbs,反应30分钟后,减压蒸馏除去溶剂,加入碳酸氢钠去除残余的三氟乙酸,柱层析分离得到式4化合物;
步骤iv、称取所述步骤iii得到的式4化合物和碱于无水溶剂中,滴加2-氯-2-氧-1,3,2-二氧磷杂环戊烷,反应30分钟后,抽滤,滤液旋干得到的粗产物与三甲胺在密封条件下反应15小时后,抽滤,洗涤,得到两亲分子vno。
优选的是,其中,在所述步骤i中,催化剂为碘化钾,碱为碳酸钾。
优选的是,其中,在所述步骤ii中,所述氧化剂为戴斯-马丁氧化剂。
优选的是,其中,在所述步骤iv中,所述碱为咪唑。
本发明的目的还可以进一步由一氧化氮响应的载药囊泡的制备方法来实现,该方法如下步骤:将两亲分子vno溶于有机溶剂后,旋干,得到脂质薄膜,向所述脂质薄膜中加入含有水溶性药物的pbs缓冲溶液,涡流震荡、超声驱动以及挤压的外力诱导下通过自组装形成一氧化氮响应的载药囊泡,并通过葡聚糖凝胶柱除去未利用的水溶性药物;其中,pbs缓冲溶液的ph为7.4,摩尔浓度为50mm。
优选的是,其中,有机溶剂为二氯甲烷,水溶性药物为200mm的羧基荧光素,涡流震荡时间为2分钟,超声驱动的时间为10分钟,温度为50℃;挤压选用的滤膜孔径为100nm,挤压次数为20次。
优选的是,其中,形成的一氧化氮响应的载药囊泡的粒径分布范围为90~200nm。
为了实现根据本发明的这些目的和其它优点,还提供了一氧化氮响应的载药囊泡在亲水性或疏水性药物的包载及控制释放中的应用。
优选的是,其中,控制释放的应用是在一氧化氮刺激下实现的,实现控制释放的方法包括:向载药囊泡的水溶液中加入饱和一氧化氮溶液后,载药囊泡破裂释放包载药物;或者刺激raw264.7细胞产生内源型一氧化氮后,通过内吞作用进入细胞的载药囊泡破裂释放包载药物。
本发明至少包括以下有益效果:
1、通过汉奇反应合成了两亲分子vno的基本骨架,该反应操作简单,且可以根据具体需求预先对各单体模块进行修饰,最后组合得到一系列具有不同性能的两亲分子,合成方法可拓展性强;
2、两亲分子具有1,4-二氢吡啶(dhp)单元,该结构对一氧化氮的响应具有很好的专一性和灵敏度,从而赋予载药囊泡很强的控制释放能力;
3、通过本发明提供的方法制备的载药囊泡粒径在90-200nm之间,平均粒径约为138nm,该粒径的囊泡易于被细胞内吞从而使负载药物在细胞内释放;
4、该两亲分子及其代谢产物毒性很小,具有很好的生物相容性,因而具有较大的实际应用潜力。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
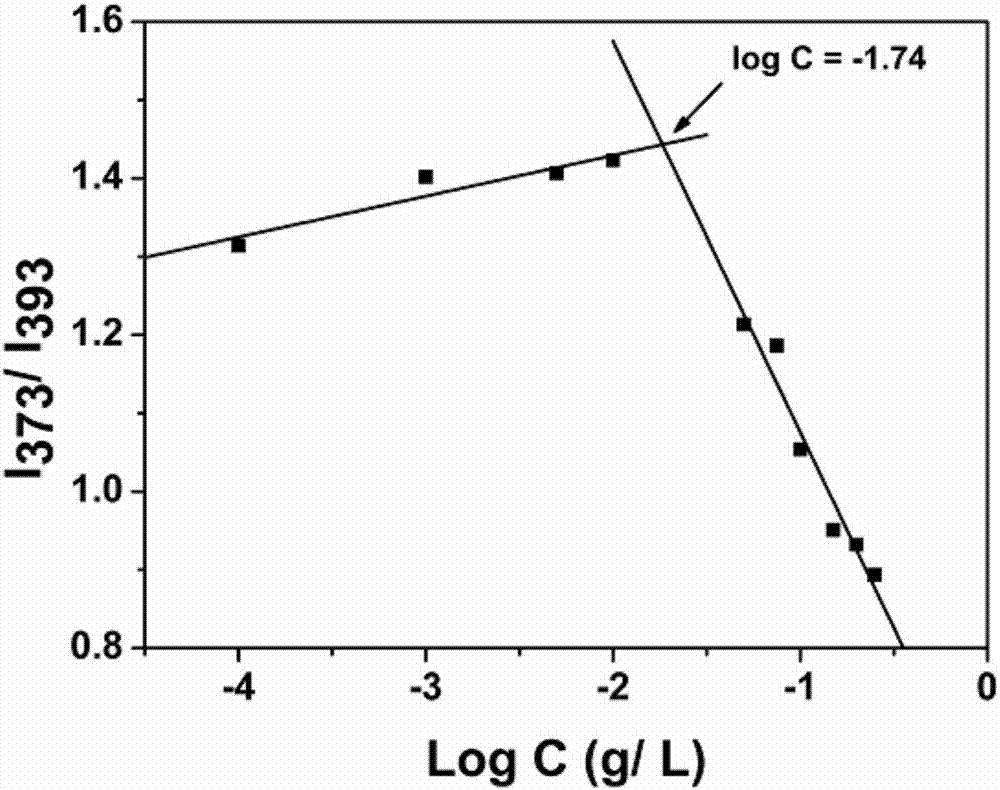
图1为本发明的两亲分子vno临界胶束浓度测定曲线示意图;
图2为本发明实施例中一氧化氮响应的载药囊泡粒径分布;
图3为本发明实施例中一氧化氮响应的载药囊泡透射电镜图
图4为本发明实施中的载药囊泡的药物完全释放曲线示意图;
图5为本发明实施中的载药囊泡在不同当量一氧化氮作用下的药物释放量随时间变化曲线示意图;
图6为本发明实施中的载药囊泡与不同当量一氧化氮作用后的释放曲线示意图;
图7为本发明实施中两亲分子vno的细胞毒性实验结果示意图;
图8为本发明实施中的载药囊泡被细胞内吞后的表达照片图(荧光/明场)。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
<实例1>
一种一氧化氮响应的载药囊泡,其构成成分为含有1,4-二氢吡啶单元的两亲分子vno,所述两亲分子vno的结构式如下:
上述两亲分子vno由以下制备方法制备,其合成路线如下:
所述制备方法的具体步骤包括:
步骤i、将化合物1(26.7g,100mmol)、对羟基苯乙醇(13.8g,100mmol)、碳酸钾(48g,400mmol)和碘化钾(1.7g,10mmol)加入到300ml乙腈中,加入少量4a分子筛,加热回流5h以上,tlc跟踪至反应完全。冷却至室温,抽滤,滤渣用100ml乙腈洗涤。合并滤液,旋蒸除去溶剂,粗产品以乙酸乙酯/石油醚=1/4为流动相,硅胶柱分离,得到25.6g无色油状液体式2化合物(产率79%);
步骤ii、将式2化合物(16.2g,50mmol)溶于100ml二氯甲烷中,将戴斯马丁氧化剂(dmp,23.3g,55mmol)分批逐次加入到溶液中,全部加完后室温搅拌2h.以硅胶作为助滤剂抽滤,并用100ml二氯甲烷洗涤硅胶。旋蒸除去溶剂,得到14.2g淡黄色油状液体;
将此淡黄色油状液体和式1化合物(14.4g,44mmol)加入到200ml乙醇中,滴加20ml25%浓氨水。氮气保护下回流20h。冷却至室温,旋蒸除去溶剂,粗产品以乙酸乙酯/石油醚=1/6为流动相,硅胶柱分离,得到14.9g白色固体式3化合物(产率35%);
步骤iii、将式3化合物(9.4g,10mmol)溶解在50ml二氯甲烷中,滴加三氟乙酸(1.4g,12mmol),室温搅拌0.5h,然后向母液中加入30ml饱和碳酸氢钠溶液,充分震荡后分液,水相用乙酸乙酯萃取(50ml×2次)。合并有机相,无水硫酸钠干燥,旋蒸除去溶剂,粗产品以乙酸乙酯/石油醚=1/3为流动相,硅胶柱分离,得到7.6g白色固体式4化合物,产率93%;
步骤iv、将式4化合物(4.1g,5mmol)和咪唑(340mg,5mmol)溶于15ml甲苯中,冰浴下加入2-氯-2-氧-1,3,2-二氧磷杂环戊烷(710mg,5mmol)。加完后逐渐升至室温,搅拌0.5h。过滤除去不溶物,滤渣用5ml甲苯洗涤。合并滤液,旋蒸除去溶剂,得到4.3g白色固体;
将此白色固体加到20ml耐压瓶中,加入10ml三甲胺溶液(2m乙腈溶液,20mmol)。封闭后加热至80℃反应15h。反应体系在冰水浴中冷却,析出固体。抽滤,固体用10ml乙腈洗涤,干燥,得到5.2g白色固体即两亲分子vno,产率88%。
式2化合物的结构式及表征如下:
1hnmr(400mhz,cdcl3)δ7.07(d,j=8.5hz,2h),6.79(d,j=8.6hz,2h),3.91(t,j=6.5hz,2h),3.77(t,j=6.5hz,2h),3.62(t,j=6.3hz,2h),2.75(t,j=6.5hz,2h),1.78(tt,j=8.6,6.3hz,2h),1.68–1.57(m,2h),0.84(s,9h),0.00(s,6h).13cnmr(100mhz,cdcl3)151.67,130.52,129.9,114.54,67.76,63.67,62.83,38.33,29.37,26.0,25.91,18.33,-5.25;esi-ms:m/zc18h32o3sina[m+na]+,calcd.347.2,found347.3.
式3化合物的结构式及表征如下:
mp.46~48℃,1hnmr(400mhz,meodδ6.79(d,j=8.5hz,2h),6.63(d,j=8.6hz,2h),4.03(t,j=5.8hz,1h),3.95–3.77(m,6h),3.63(t,j=6.2hz,2h),2.36(d,j=5.8hz,2h),2.11(s,5h),1.79–1.68(m,2h),1.60(dq,j=9.8,6.4hz,2h),1.52(p,j=6.4hz,4h),1.20(s,48h),0.83(d,j=7.6hz,15h),0.00(s,6h).13cnmr(101mhz,cdcl3)δ167.89,157.36,145.43,145.40,131.18,130.94,113.33,101.64,67.78,63.74,63.01,62.85,41.16,35.42,32.81,31.92,29.71,29.69,29.66,29.64,29.61,29.60,29.44,29.41,29.36,28.77,26.20,25.98,25.94,25.75,22.68,19.09,18.32,14.11,-5.31.esi-ms:m/zc58h103no6sina[m+h]+,calcd.938.7627,found.938.7620.
式4化合物的结构式及表征如下:
mp.83~84℃,1hnmr(400mhz,cdcl3)δ6.89(d,j=8.5hz,2h),6.71(d,j=8.5hz,2h),5.24(s,1h),4.18(t,j=5.0hz,1h),4.03(ddt,j=18.9,16.4,6.4hz,6h),3.71(t,j=6.2hz,2h),2.52(d,j=5.0hz,2h),2.14(s,5h),1.92–1.80(m,2h),1.74(dq,j=9.4,6.8,6.3hz,2h),1.63(p,j=6.8hz,4h),1.25(s,48h),0.88(t,j=6.7hz,6h).13cnmr(101mhz,cdcl3)δ167.92,156.98,145.59,131.43,131.05,113.45,101.43,67.75,63.76,62.58,41.08,35.39,31.92,29.71,29.66,29.64,29.53,29.36,28.79,26.20,25.79,22.69,19.05,14.12.esi-ms:m/zc52h89no6na[m+h]+,calcd.824.6762,found.824.6757.
两亲分子vno的结构式及表征如下:
mp.46~48℃,1hnmr(400mhz,meod)δ6.86(d,j=8.3hz,1h),6.72(d,j=8.4hz,1h),4.26(s,1h),4.14(t,j=5.4hz,1h),4.09–3.81(m,4h),3.70–3.57(m,1h),3.22(s,3h),2.45(d,j=5.5hz,1h),2.16(s,2h),1.92–1.74(m,2h),1.62(q,j=6.7hz,2h),1.29(s,21h),0.90(t,j=6.7hz,3h).13cnmr(101mhz,thf-d8)δ167.50,157.66,147.58,131.53,131.26,113.34,99.70,67.62,64.89,63.04,59.49,53.91,41.23,35.60,32.19,30.03,30.01,29.94,29.75,29.64,29.30,27.75,26.59,26.12,22.88,17.85,13.79,0.00.
除以上表征外,通过芘荧光法测定两亲分子vno的临界胶束浓度为18mg/l。测定曲线如图1所示。
<实例2>
由实施例1中两亲分子vno制备一氧化氮响应的载药囊泡的方法:
以两亲分子vno在pbs缓冲溶液(50mm,ph7.4)中制备载药囊泡的方法,所述方法具体如下:
称取两亲分子vno(5.0mg,5μmol)于50ml圆底烧瓶中,加入10ml二氯甲烷使之溶解。旋转蒸发除去溶剂后,得到一层附着于烧瓶内壁的脂质薄膜。向瓶中加入1ml羧基荧光素溶液(cf,200mm,溶解于pbs缓冲溶液中,并加入1滴5mnaoh溶液助溶)。将圆底烧杯涡流震荡2分钟,使薄膜脱落。然后50℃水浴中超声10分钟,得到大单室囊泡。将此溶液通过100nm孔径的滤膜反复挤压20次以上,使囊泡的粒径基本分布在预期范围(90-200纳米),最后,以pbs缓冲液为流动相,通过葡聚糖凝胶柱去除游离的羧基荧光素。得到的脂质体悬液用pbs缓冲液定容至500ml备用。两亲分子vno浓度为10μm。
包裹羧基荧光素(模拟药)的囊泡通过动态光散射实验(dls,图2)和透射电子显微镜拍照(tem,图3)表征。dls结果显示粒径分布在90-200nm的较窄范围,平均粒径约138nm;从tem照片获得的结果与dls基本相符。少量囊泡显示出较小的尺寸(数十纳米),可能是tem拍照过程中,囊泡在真空环境下失水造成的。
<实例3>
载药囊泡的药物体外释放:
以490nm为激发波长,测定载药囊泡储备液在加入tritonx-100(0.5%)前后的荧光光谱,如图4所示。以加入tritonx-100后脂质体储备液发射光谱在520nm处荧光强度为模拟药完全释放后的荧光强度。
向载药囊泡储备液中加入不同当量的一氧化氮储备液,体系荧光发射光谱在520nm处荧光强度随时间变化的曲线如图5所示。从图中可以看出:1)荧光强度在反应进行20min时基本不再变化,标志反应已进行完全,载药囊泡不再释放模拟药;2)当加入3当量一氧化氮时,荧光强度已接近可达到的最大值,标志3当量一氧化氮可以使模拟药基本释放完全;3)在不加入一氧化氮时,荧光强度基本没有变化,说明载药囊泡具有较好的稳定性。载药囊泡与不同当量一氧化氮反应完全的荧光谱图如图6所示。
<实例4>
两亲分子vno及其代谢产物的细胞毒性分析:
为了测定两亲分子vno及其代谢产物的生物相容性,我们利用四种细胞hela,a549,hek293t以及raw264.7通过mtt法测定其细胞毒性。细胞在每孔104数量级的96孔板中进行种植培养。生长环境为含有5%二氧化碳的空气气氛,温度为37℃。在对数级增长阶段进行收割,然后将细胞分组,分别用5μm,10μm,20μm,40μm,60μm,80μm,100μm浓度的vno及其代谢产物与细胞作用,培养12小时后,加入mtt的pbs溶液(20μl,5mg/ml),继续培养4小时。除去残留的培养基,向每组中加入100μldmso,通过酶标仪在490nm处对每组细胞进行检测。
各实验组的细胞毒性分析见图7。其中,图7a为raw264.7细胞毒性实验结果,图7b为a549细胞毒性实验结果,图7c为hek293t细胞毒性实验结果,图7d为hela细胞毒性实验结果,由细胞毒性实验可见,即使在较高浓度下,细胞存活性依然很高,可以达到80%以上,说明两亲分子vno及其与一氧化氮的代谢产物细胞毒性均很低,具有很好的生物相容性。
<实例5>
载药囊泡的药物细胞内释放:
为了测定由两亲分子vno制备的载药囊泡在细胞内的刺激释放效果,选取生长良好的小鼠巨噬细胞raw264.7进行模拟药的细胞内释放实验。细胞在含有5%二氧化碳的空气气氛,温度为37℃的环境下培养24h,然后分为以下四组:
1)对照组;
2)加入脂多糖(lps,1μg/ml)作用4小时,刺激诱导型一氧化氮合成酶(inos)产生内源型一氧化氮;
3)加入lps(1μg/ml),同时加入ng-甲基-l-精氨酸(l-nma,2mm)作用4小时,阻断内源型一氧化氮产生;
4)加入一氧化氮储备液(30μl)作用10分钟,作为外源型一氧化氮。
然后向上述4组中分别加入脂质体储备液(10μm),继续作用20分钟。无论细胞中有内源型或外源型一氧化氮,都可以在绿色通道下观察到较强的荧光。而当无外界刺激产生一氧化氮,或者产生一氧化氮的过程被阻断时,只能观察到微弱的荧光,如图8所示。其中8a~8d为荧光照片,8e~8h为明场照片。通过此实验说明:1)该载药囊泡容易通过细胞内吞作用,将模拟药物运输到细胞中;2)载药囊泡可以与细胞内的一氧化氮发生反应,达到控制释放模拟药物的目的。
综上所述,本发明提供的一氧化氮响应的载药囊泡由两亲分子vno在pbs缓冲溶液中形成,两亲分子vno的合成方法简单,且拓展性强。一氧化氮响应的载药囊泡具有很好的一氧化氮响应性,在药物负载和控制释放领域有很好的应用前景。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!