一种便携可穿戴可血液净化用器件及其制备方法和应用与流程
本发明涉及医疗器件技术领域。更具体地,涉及一种便携可穿戴可血液净化用器件及其制备方法和应用。
背景技术:
血液净化是治疗急/慢性肾功能衰竭、风湿免疫类等疾病的一种重要的手段。血液净化的方式主要包括血液透析、血液灌流、血液滤过、血浆置换等。
血液透析是通过将体内血液引流至体外一个由空心纤维膜组成的透析器中,利用血液与电解质溶液(透析液)在空心纤维内外弥散/对流进行物质交换的原理,将体内的代谢废物清除,同时维持体内电解质和酸碱平衡,最后将净化的血液输回体内的一种治疗方法。血液透析的优点在于可有效去除体内过量的水,离子及小分子物质,缺点在于选择性不高,需大量透析液,对中分子物质的清除效果不理想。
血液灌流是通过将体内血液引流至体外装有固体吸附剂的灌流器中,以清除某些外源性或内源性毒素,并将净化的血液输回体内的一种治疗方法。血液灌流的优点在于可实现对小分子、中分子和大分子物质的选择性清除,缺点在于不能除去大量水,无法调节酸碱平衡和电解质平衡。
血液滤过是模仿了肾小球的滤过作用,通过将体内血液引流至体外一个由超滤膜组成的滤器中,在滤过压的作用下将体内的代谢废物清除,同时补充与血浆液体成分相似的电解质溶液,以达到血液净化的目的。血液滤过的优点在于对中分子物质清除高,缺点是对小分子物质的清除效果不如血液透析,需补充替代液,成本较高,治疗过程中可能发生并发症。
血浆置换是将体内血液引流至体外,利用膜式血浆分离方法将血浆从全血中分离出来,然后补充等量的新鲜冷冻血浆或人血白蛋白等置换液,以清除体内的代谢废物,达到血液净化的目的。血浆置换的优点在于能有效去除高分子量的有害物质,但缺点也非常明显,丢失了血液中许多有用的成分,造成很大浪费,需大量新血浆或血制品,费用昂贵,容易引起交叉感染及机体的排异反应等。
据统计,目前我国仅患有终末期肾病(esrd)的病人数就约为200多万人,而在实际血液净化过程中,患者每周往往需要去医院进行3-4次,一次4-5小时的透析,给病人的日常生活带来了极大的困扰和痛苦。
因此,为了改善病人的生活质量,同时使医院原本紧张的资源状况得以缓解,从而降低医院的运行成本,使其它优势资源得到更为充分的利用,需要提供一种新型的便携可穿戴可血液净化用器件。
技术实现要素:
本发明的一个目的在于提供一种便携可穿戴可血液净化用器件。
本发明的另一个目的在于提供一种便携可穿戴可血液净化用器件的制备方法。
本发明的第三个目的在于提供一种便携可穿戴可血液净化用器件的应用。
为达到上述目的,本发明采用下述技术方案:
一种便携可穿戴可血液净化用器件,包括第一微流控通道基片、固设于第一微流控通道基片上的多孔膜和固设于多孔膜上的第二微流控通道基片;所述第一微流控通道基片的上表面设有第一微流控通道,所述第二微流控通道基片的下表面设有第二微流控通道;所述第一微流控通道和第二微流控通道互相吻合,二者形成可供液体流动的通道;所述第一微流控通道基片和第二微流控通道基片的两端均设有进出样口;所述第一微流控通道或第二微流控通道内固设有多孔微球。本发明的便携可穿戴可血液净化用器件通过在两个设计好的微流控通道中间键合多孔膜和在其中一个微流控通道中负载多孔聚合物微球材料,多孔膜和多孔微球的相互协同集合了传统血液透析和血液灌流的优势,实现了对小分子、中分子和大分子的高效去除;采用微流控技术,实现了血液净化器微型化、便携及可穿戴。
优选地,所述微流控通道基片的材料采用微流控芯片常用材料即可,包括但不限于聚甲基丙烯酸甲酯、聚酰胺、聚碳酸酯、聚对苯二甲酸乙二醇酯、聚乙烯、聚二甲基硅氧烷、环氧树脂、聚氨酯、丙烯酸、橡胶、氟塑料。
优选地,所述便携可穿戴可血液净化用器件为立方体形。
优选地,所述便携可穿戴可血液净化用器件的长为1-200mm;进一步地,在本发明的某些具体实施方式中,例如,所述便携可穿戴可血液净化用器件的长为1mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm、160mm、170mm、180mm、190mm、200mm等;优选地,所述便携可穿戴可血液净化用器件的长为10~190mm、20~180mm、30~170mm、40~160mm、50~150mm、60~140mm、70~130mm、80~120mm、90~110mm等;更优选地,所述便携可穿戴可血液净化用器件的长为1~190mm、1~180mm、1~170mm、1~160mm、1~150mm、1~140mm、1~130mm、1~120mm、1~110mm、1~100mm、1~90mm、1~80mm、1~70mm、1~60mm、1~50mm、1~40mm、1~30mm、1~20mm、1~10mm等。
优选地,所述便携可穿戴可血液净化用器件的宽为1-200mm;进一步地,在本发明的某些具体实施方式中,例如,所述便携可穿戴可血液净化用器件的宽为1mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm、160mm、170mm、180mm、190mm、200mm等;优选地,所述便携可穿戴可血液净化用器件的宽为10~190mm、20~180mm、30~170mm、40~160mm、50~150mm、60~140mm、70~130mm、80~120mm、90~110mm等;更优选地,所述便携可穿戴可血液净化用器件的宽为1~190mm、1~180mm、1~170mm、1~160mm、1~150mm、1~140mm、1~130mm、1~120mm、1~110mm、1~100mm、1~90mm、1~80mm、1~70mm、1~60mm、1~50mm、1~40mm、1~30mm、1~20mm、1~10mm等。
优选地,所述便携可穿戴可血液净化用器件的高1-200mm;进一步地,在本发明的某些具体实施方式中,例如,所述便携可穿戴可血液净化用器件的高为1mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm、160mm、170mm、180mm、190mm、200mm等;优选地,所述便携可穿戴可血液净化用器件的高为10~190mm、20~180mm、30~170mm、40~160mm、50~150mm、60~140mm、70~130mm、80~120mm、90~110mm等;更优选地,所述便携可穿戴可血液净化用器件的高为1~190mm、1~180mm、1~170mm、1~160mm、1~150mm、1~140mm、1~130mm、1~120mm、1~110mm、1~100mm、1~90mm、1~80mm、1~70mm、1~60mm、1~50mm、1~40mm、1~30mm、1~20mm、1~10mm等。本发明中的血液净化器尺寸小,便于携带,大大改善病人的生活质量。
优选地,所述微流控通道基片中微流控通道结构为蛇形、阵列平行形或阵列s形。本发明的微流控通道结构实现了净化器两侧基片中的溶液对流,有利于溶液的扩散和渗透,清除效果更佳。
优选地,所述微流控通道基片中微流控通道的尺寸小于血液净化用器件的尺寸。
优选地,所述微流控通道的深度为10-400μm;进一步地,在本发明的某些具体实施方式中,例如,所述微流控通道的深度为10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm等;优选地,所述微流控通道的深度为10~300μm、10~200μm、10~100μm、10~50μm、10~20μm等;更优选地,所述微流控通道的深度为20~400μm、30~300μm、40~200μm、50~100μm、60~90μm、70~80μm等。
优选地,所述微流控通道的宽度为10-10000μm;进一步地,在本发明的某些具体实施方式中,例如,所述微流控通道的宽度为10μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm、、2000μm、3000μm、4000μm、5000μm、6000μm、7000μm、8000μm、9000μm、10000μm等;优选地,所述微流控通道的宽度为10~9000μm、10~8000μm、10~7000μm、10~6000μm、10~5000μm、10~4000μm、10~3000μm、10~2000μm、10~1000μm、10~900μm、10~800μm、10~700μm、10~600μm、10~500μm、10~400μm、10~300μm、10~200μm、10~100μm等;更优选地,所述微流控通道的宽度为1000~10000μm、2000~9000μm、3000~9000μm、4000~7000μm、5000~6000μm等。
优选地,所述微流控通道的间距为10-10000μm;进一步地,在本发明的某些具体实施方式中,例如,所述微流控通道的间距为10μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1000μm、、2000μm、3000μm、4000μm、5000μm、6000μm、7000μm、8000μm、9000μm、10000μm等;优选地,所述微流控通道的间距为10~9000μm、10~8000μm、10~7000μm、10~6000μm、10~5000μm、10~4000μm、10~3000μm、10~2000μm、10~1000μm、10~900μm、10~800μm、10~700μm、10~600μm、10~500μm、10~400μm、10~300μm、10~200μm、10~100μm等;更优选地,所述微流控通道的间距为1000~10000μm、2000~9000μm、3000~9000μm、4000~7000μm、5000~6000μm等。本发明遵循微流控技术,微流控通道内的液体为薄层流动,使多孔膜两侧的溶液在对流过程中快速扩散和渗透,进行溶质交换,因此微流控通道的参数影响分子的清除效率,在所述通道参数下,分子清除效果好。
优选地,所述多孔膜为至少一层;更优选地,所述多孔膜为单层。本发明技术人员在研究过程中发现,采用单层多孔膜即可有效过滤,具有很好的清除效果。
优选地,所述多孔膜材料为临床中相对应透析器的透析膜材料;优选地,所述多孔膜材料包括但不限于聚酰胺膜(pa)、聚四氟乙烯膜(ptfe)、聚碳酸酯膜(pc)、聚砜膜(ps)、聚醚砜膜(pes)、纤维素膜、铜仿膜、铜氨膜、血仿膜、双醋酸及三醋酸膜、聚丙烯晴膜(pan),聚甲基丙烯酸甲酯(pmma),聚乳酸膜(pla)、胶原膜或甲壳素膜。所述多孔膜材料的两侧溶液对流,溶质分子在膜两侧进行扩散和渗透,达到清除目标分子的作用。
优选地,所述多孔微球的孔径为1~300nm;进一步地,在本发明的某些具体实施方式中,例如,所述多孔微球的孔径为1nm、10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、110nm、120nm、130mm、140nm、150nm、160nm、170nm、180nm、190nm、200nm、210nm、220nm、230nm、240nm、250nm、260nm、270nm、280nm、290nm、300nm等;优选地,所述多孔微球的孔径为1~290nm、1~280nm、1~270nm、1~260nm、1~250nm、1~240nm、1~230nm、1~220nm、1~210nm、1~200nm、1~190nm、1~180nm、1~170nm、1~160nm、1~150nm、1~140nm、1~130nm、1~120nm、1~110nm、1~100nm、1~90nm、1~80nm、1~70nm、1~60nm、1~50nm、1~40nm、1~30nm、1~20nm、1~10nm等;优选地,所述多孔微球的孔径为10~290nm、20~280nm、30~270nm、40~260nm、50~250nm、60~240nm、70~230nm、80~220nm、90~210nm、100~200nm、110~190nm、120~180nm、130~170nm、140~160nm等;更优选地,所述多孔微球的孔径为10~300nm、20~300nm、50~300nm、100~300nm、150~300nm、200~300nm、250~300nm等。本发明技术人员在研究过程中发现不同微球孔径对体内分子清除效果影响不同;所述微球孔径越大,清除效果越好。
优选地,所述多孔微球为具有核壳结构的聚合物多孔微球,所述核层为疏水不带电聚合物,所述壳层为亲水带电聚合物。
优选地,所述亲水带电聚合物为聚丙烯酸、聚甲基丙烯酸、聚丙烯酰胺、聚苯乙烯磺酸钠、聚甲基丙烯酰胺、聚异丙基丙烯酰胺、聚衣康酸、聚马来酸、聚马来酸酐、聚n,n-亚甲基双丙烯酰胺、聚3-烯丙氧基-2-羟基-1-丙烷磺酸钠盐或聚β-(丙烯酰氧)丙酸。本发明发现,采用所述亲水带电聚合物可以通过静电相互作用吸附目标分子,提高清除效果。
优选地,所述疏水不带电聚合物为聚苯乙烯、聚二乙烯基苯、聚邻-氯苯乙烯、聚1,2-二氯乙烯、聚甲基丙烯酸甲酯、聚甲基丙烯酸乙酯、聚三氯乙烯、聚甲基丙烯酸丁酯、聚丙烯酸六氟丁酯、聚甲基丙烯酸六氟丁酯、聚9-乙烯基蒽、聚乙烯基环己烷、聚环己基乙烯基醚或聚乙烯基正丁醚。本发明采用所述疏水不带电聚合物通过疏水性相互作用吸附目标分子,提高清除效果。
为达到上述第二个目的,本发明采用下述技术方案:
一种便携可穿戴可血液净化用器件的制备方法,包括如下步骤:通过氧等离子体处理微流控通道基片,将多孔微球水溶液填满处理后的微流控通道基片中的微流控通道,放置后令多孔微球固定于所述微流控通道内,对两层微流控通道基片的两端均进行打孔从而得到进出样口,在打孔后的两层微流控通道基片中间放置多孔膜,封装键合即可得到便携可穿戴可血液净化用器件。本发明通过氧等离子体处理微流控通道基片使得微流控通道基片亲水,从而使得多孔微球更容易铺展固定;在基片封装前,通过打孔器对微流控通道基片进行打孔,打孔是一个贯穿基片的操作,如果在基片封装后打孔,则多余的部分不方便拿出,因此需要在基片封装前打孔。
优选地,所述多孔微球水溶液的浓度为1~500mg/ml;本发明技术人员在研究过程中发现不同微球浓度对体内分子清除效果影响不同,所述的多孔微球的浓度上限为多孔微球能够分散在水中的最大浓度,所述微球水溶液的浓度越大,清除效果越好。进一步地,在本发明的某些具体实施方式中,例如,所述多孔微球水溶液的浓度为1mg/ml、10mg/ml、50mg/ml、100mg/ml、200mg/ml、300mg/ml、400mg/ml、500mg/ml等;优选地,所述多孔微球水溶液的浓度为1~400mg/ml、1~300mg/ml、1~200mg/ml、1~100mg/ml、1~80mg/ml、1~60mg/ml、1~40mg/ml、1~20mg/ml等;优选地,所述多孔微球水溶液的浓度为10~500mg/ml、20~400mg/ml、30~300mg/ml、40~200mg/ml、50~100mg/ml、60~90mg/ml、70~80mg/ml等;更优选地,所述多孔微球水溶液的浓度为20~500mg/ml、50~500mg/ml、100~500mg/ml、2000~500mg/ml、300~500mg/ml、400~500mg/ml等。
优选地,所述填充多孔微球水溶液的微流控通道基片的放置温度为20~50℃;进一步地,在本发明的某些具体实施方式中,例如,所述放置温度为20℃、30℃、40℃、50℃等;优选地,所述放置温度为20~40℃、20~30℃、20~25℃等;更优选地,所述放置温度为30~50℃、40~50℃等。
优选地,所述填充多孔微球水溶液的微流控通道基片的放置时间为4~24h后;进一步地,在本发明的某些具体实施方式中,例如,所述放置时间为4h、6h、8h、10h、12h、14h、16h、18h、20h、22h、24h等;优选地,所述放置时间为4~22h、4~20h、4~18h、4~16h、4~14h、4~12h、4~10h、4~8h、4~6h等;更优选地,所述放置时间为6~22h、8~20h、10~18h、12~16h、13~14h等。
优选地,所述封装方法为两层微流控通道基片蘸取血液净化器件基材前聚液的稀释液,然后在两层微流控通道基片中间放置多孔膜后固化。
优选地,所述固化温度为50~200℃;进一步地,在本发明的某些具体实施方式中,例如,所述固化温度为50℃、60℃、70℃、80℃、90℃、100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃等;优选地,所述固化温度为50~190℃、50~180℃、50~170℃、50~160℃、50~150℃、50~140℃、50~130℃、50~120℃、50~110℃、50~100℃、50~90℃、50~80℃、50~70℃、50~60℃等;更优选地,所述固化温度为60~190℃、70~180℃、80~170℃、90~160℃、100~150℃、110~140℃、120~130℃等。
优选地,所述固化时间为20min~48h;进一步地,在本发明的某些具体实施方式中,例如,所述固化时间为20min、40min、1h、2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、22h、24h等;优选地,所述固化时间为20min~22h、20min~20h、20min~18h、20min~16h、20min~14h、20min~12h、20min~10h、20min~8h、20min~6h、20min~4h、20min~2h、20min~1h、20min~40min等;优选地,所述固化时间为40min~22h、1~20h、2~18h、4~16h、6~14h、8~14h、10~14h、12~14h等。本发明发现,固化温度和时间影响微流控通道基片的成型情况和粘度,在本发明所述固化温度和时间下,两者的封装的效果好。
优选地,所述血液净化器件基材前聚液包括但不限于甲基丙烯酸甲酯、酰胺、碳酸酯、对苯二甲酸乙二醇酯、乙烯、二甲基硅氧烷、环氧树脂、聚氨酯、丙烯酸、橡胶或氟塑料。
优选地,所述可血液净化用器件基材前聚液采用正己烷稀释;稀释后血液净化器件基材前聚液的浓度为5~100%。本发明采用正己烷稀释前聚液是为了降低前聚液粘度,便于控制旋涂过程中的厚度。
优选地,所述制备方法具体包括如下步骤:
1)微流控通道基片的制备:采用二次模塑成型工艺制备两个微流控通道基片;
2)多孔微球的负载:氧等离子体处理步骤1)中一个微流控通道基片,将浓度为1~500mg/ml的多孔微球水溶液填满所述基片的通道,20~50℃放置4~24h,多孔微球固定在微流控通道中,冲洗后在所述微流控通道基片的进出样口处打孔,并同样在另一个没有做任何处理的微流控通道基片的进出样口处打孔;
3)集成便携可穿戴可血液净化用器件:步骤2)得到的两个微流控通道基片均匀蘸取血液净化器件基材前聚液的稀释液,在两片微流控通道基片中间夹一层多孔膜,完全贴合后封装键合,得到便携可穿戴可血液净化用器件。
优选地,所述氧等离子体处理时间为1min~1h;进一步地,在本发明的某些具体实施方式中,例如,所述处理时间为1min、10min、20min、30min、40min、50min、1h等;优选地,所述处理时间为1~50min、1~40min、1~30min、1~20min、1~10min、1~8min、1~6min、1~4min、1~2min等;优选地,所述处理时间为10~50min、20~40min、30~35min等。
优选地,所述二次模塑成型工艺制备两个微流控通道基片包括如下步骤:
i)一次复型阳模的制备:将血液净化器件基材前聚液与固化剂或引发剂1~100:1混合后浇注在固定有刻蚀好的疏水化处理的硅片基微流控通道模板的模具中,抽真空除去搅拌时产生的气泡,50~200℃固化0.33~48h得到一次复型阳模;所述固化剂为硅烷偶联剂,环氧树脂固化剂(脂肪胺、脂环胺、芳香胺、聚酰胺、酸酐、树脂类、叔胺),所述引发剂为过氧化二苯甲酰、偶氮二异丁腈;所述疏水化处理为用等离子机处理后放入真空干燥箱中,置于1h,1h,2h,2h-全氟癸基三氯硅烷环境中,真空环境下80℃过夜(>12h)。这一步处理的目的是在表面修饰一层氟硅烷疏水层,避免基片与模板粘结从而影响样品质量,加大模板清洗难度;
ii)二次复型制备血液净化器件的微流控通道基片:将上述得到的一次复型阳模进行疏水化处理,并将按1~100:1比例配好的血液净化器件基材前聚液与固化剂或引发剂溶液浇注在上述疏水化处理的一次复型阳模中,抽真空,50~200℃固化0.33~48h,得到血液净化器件的微流控通道基片。
本发明中多孔膜和多孔微球的相互协同,集合了传统血液透析和血液灌流的优势,可实现了对小分子、中分子和大分子的高效去除;采用微流控技术,实现了血液净化器的微型化、便携及可穿戴,有利于改善病人的生活质量,缓解医院紧张的资源状况。本发明的技术方案为一个统一的整体,每个技术特征都不是线性独立的,不同技术特征之间会互相影响,因此本发明最终技术效果的实现,必须依赖于所有技术特征有机集成的一个不可拆分的整体,而不是若干技术特征的简单加和。
另外,如无特殊说明,本发明中所用原料均可通过市售商购获得,本发明所记载的任何范围包括端值以及端值之间的任何数值以及端值或者端值之间的任意数值所构成的任意子范围。
本发明的有益效果如下:
(1)本发明集合了传统血液透析和血液灌流的优势,可实现对目标分子,即小分子、中分子和大分子的高效去除。
(2)本发明设计制备的血液净化器微型、便携、可穿戴,有望大大改善病人的生活质量。
(3)本发明所述血液净化器制备工艺简单、实验条件易控,具有一定的工业化应用价值。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
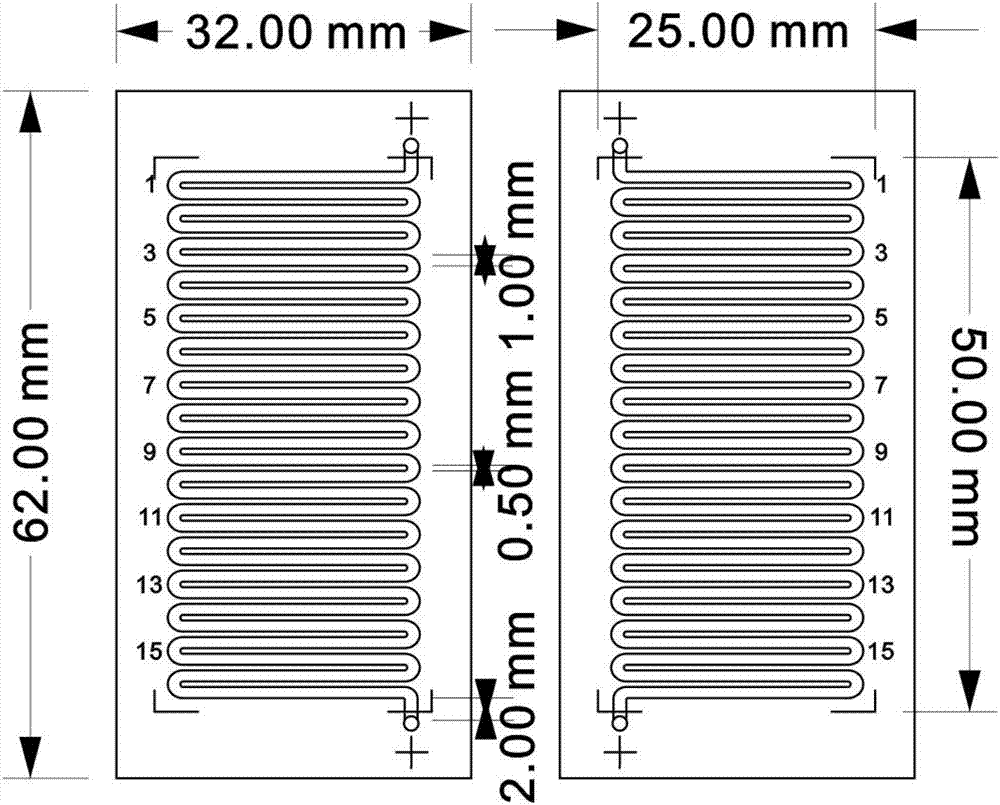
图1示出本发明实施例1制备的蛇形通道便携可穿戴可血液净化用器件的示意图。
图2示出本发明实施例1制备的蛇形通道便携可穿戴可血液净化用器件的微流控通道基片示意图。
图3示出本发明实施例1可血液净化用器件对尿素的清除效果曲线图。
图4示出本发明实施例1可血液净化用器件对肌酐的清除效果曲线图。
图5示出本发明实施例1可血液净化用器件对大分子溶菌酶的清除效果曲线图。
其中,101-第一微流控通道基片,102-第二微流控通道基片,201-第一微流控通道,202-第二微流控通道,3-多孔膜,4-多孔微球。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上;术语“上”、“下”、“表面”、“底面”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
实施例1
一种便携可穿戴可血液净化用器件,如图1~2所示,包括第一微流控通道基片101、固设于第一微流控通道基片101表面的一层多孔膜3和固设于多孔膜3表面的第二微流控通道基片102,所述第一微流控通道基片101的表面刻蚀有第一微流控通道201,所述第二微流控通道基片102的底面刻蚀有第二微流控通道202,所述第一微流控通道201和第二微流控通道202互相吻合,所述第一微流控通道基片101和第二微流控通道基片102的两端均设有进出样口,所述第一微流控通道基片101的微流控通道201内固设有多孔微球4。
所述微流控通道基片中微流控通道结构为蛇形,所述微流控通道宽1mm,深100μm,通道间距为0.5mm。
所述便携可穿戴可血液净化用器件为立方体形,长62mm,宽32mm,高7.5mm。
所述多孔微球的孔径为50nm±20nm。
所述便携可穿戴可血液净化用器件的制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材聚二甲基硅氧烷(pdms)前聚液与固化剂按8:1的比例混合后浇注在固定有刻蚀好的疏水化处理的蛇形硅片基通道模板的模具中,抽真空除去搅拌时产生的气泡,80℃条件下固化2h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pdms阳模,并进行疏水化处理。随后,将pdms前聚液与固化剂按10:1的比例进行混合,在pdms阳模凹槽中浇注成型后,80℃条件下固化40min,从pdms阳模中揭下为pdms基片,得到血液净化器件的微流控通道基片;
3)聚苯乙烯-聚二乙烯基苯-聚丙烯酸多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一片氧等离子体处理10min,并将浓度为100mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定24h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pdms稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为2000转30s,4000转60s,在上述制备的两个pdms基片倒扣在涂有pdms的培养皿表面以蘸取一定厚度的pdms,并在两片pdms基片中间夹一层孔径为5微米的多孔聚酰胺膜,在显微镜下使两个pdms基材中的通道完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,测试结果如图3~5所示,该血液净化器对尿素的清除率达90.2%±3.6%,对肌酐的清除率达91.8%±3.4%,对溶菌酶的清除效率达73.4%±6.1%。
实施例2
一种便携可穿戴可血液净化用器件,结构同实施例1,不同之处仅在于:
所述便携可穿戴可血液净化用器件长60mm,宽30mm,高6mm。
所述多孔微球的孔径为10nm±2nm。
制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材聚二甲基硅氧烷(pdms)前聚液与固化剂按8:1的比例混合后浇注在固定有刻蚀好的疏水化处理的蛇形硅片基通道模板的模具中,抽真空除去搅拌时产生的气泡,100℃条件下固化1h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pdms阳模,并进行疏水化处理。随后,将pdms前聚液与固化剂按5:1的比例进行混合,在pdms阳模凹槽中浇注成型后,100℃条件下固化30min,从pdms阳模中揭下为pdms基片,得到血液净化器件的微流控通道基片;
3)聚苯乙烯-聚二乙烯基苯-聚丙烯酸多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一个通道基材经氧等离子体处理20min,并将浓度为100mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定24h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pdms稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为2000转30s,4000转60s,在上述制备的两个pdms基材倒扣在涂有pdms的培养皿表面以蘸取一定厚度的pdms,并在两片pdms基片中间夹一层孔径为5微米的多孔聚醚砜膜,在显微镜下使两个pdms基材中的通道完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,该血液净化器对尿素的清除率达85.6%±4.2%,对肌酐的清除率达85.8%±2.8%,对溶菌酶的清除效率达52.3%±3.6%。
实施例3
一种便携可穿戴可血液净化用器件,结构同实施例1,不同之处仅在于:
所述便携可穿戴可血液净化用器件长40mm,宽40mm,高5mm。
所述微流控通道宽1mm,深200μm,通道间距为1mm。
制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材聚二甲基硅氧烷(pdms)前聚液与固化剂按8:1的比例混合后浇注在固定有刻蚀好的疏水化处理的蛇形硅片基通道模板的模具中,抽真空除去搅拌时产生的气泡,80℃条件下固化1h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pdms阳模,并进行疏水化处理。随后,将pdms前聚液与固化剂按10:1的比例进行混合,在pdms阳模凹槽中浇注成型后,80℃条件下固化30min,从pdms阳模中揭下为pdms基片,得到血液净化器件的微流控通道基片;
3)聚甲基丙烯酸丁酯-聚二乙烯基苯-聚丙烯酸多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一片经氧等离子体处理10min,并将浓度为100mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定12h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pdms稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为2000转30s,4000转60s,在上述制备的两个pdms基片倒扣在涂有pdms的培养皿表面以蘸取一定厚度的pdms,并在两片pdms基片中间夹一层孔径为220nm的多孔聚酰胺膜,在显微镜下使两个pdms基材中的通道完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,该血液净化器对尿素的清除率达88.9%±2.4%,对肌酐的清除率达90.2%±3.3%,对溶菌酶的清除效率达68.8%±2.1%。
实施例4
一种便携可穿戴可血液净化用器件,结构同实施例1,不同之处仅在于:
所述便携可穿戴可血液净化用器件长30mm,宽30mm,高6mm。
制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材聚二甲基硅氧烷(pdms)前聚液与固化剂按8:1的比例混合后浇注在固定有刻蚀好的疏水化处理的蛇形硅片基通道模板的模具中,抽真空除去搅拌时产生的气泡,100℃条件下固化1h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pdms阳模,并进行疏水化处理。随后,将pdms前聚液与固化剂按10:1的比例进行混合,在pdms阳模凹槽中浇注成型后,80℃条件下固化40min,从pdms阳模中揭下为pdms基片,得到血液净化器件的微流控通道基片;
3)聚苯乙烯-聚二乙烯基苯-聚丙烯酰胺多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一片经氧等离子体处理15min,并将浓度为50mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定24h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pdms稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为2000转30s,4000转60s,在上述制备的两个pdms基片倒扣在涂有pdms的培养皿表面以蘸取一定厚度的pdms,并在两片pdms基片中间夹一层孔径为450nm的多孔聚酰胺膜,在显微镜下使两个pdms基材中的通道完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,该血液净化器对尿素的清除率达87.9%±1.8%,对肌酐的清除率达90.4%±2.2%,对溶菌酶的清除效率达60.5%±2.7%。
实施例5
一种便携可穿戴可血液净化用器件,结构同实施例1,不同之处仅在于:
所述便携可穿戴可血液净化用器件长60mm,宽30mm,高6mm。
所述微流控通道宽1mm,深100μm,通道间距为1mm。
制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材甲基丙烯酸甲酯(mma)前聚液与引发剂按40:1的比例混合后浇注在刻蚀好的蛇形硅片基通道模板上,抽真空除去搅拌时产生的气泡,100℃条件下固化1h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pmma阳模,并进行疏水化处理。随后,将pmma前聚液与引发剂按50:1的比例进行混合,在pmma阳模凹槽中浇注成型后,80℃条件下固化1h,从pmma阳模中揭下为pmma基片,得到血液净化器件的微流控通道基片;
3)聚甲基丙烯酸丁酯-聚二乙烯基苯-聚丙烯酸多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一片经氧等离子体处理10min,并将浓度为50mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定24h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pmma的稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为2000转30s,4000转60s,在上述制备的两个pmma基材倒扣在涂有pmma的培养皿表面以蘸取一定厚度的pmma,并在两片pmma基片中间夹一层孔径为5微米的多孔聚醚砜膜,在显微镜下使两个pmma基材中的通道其完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,该血液净化器对尿素的清除率达80.6%±4.2%,对肌酐的清除率达85.4%±2.0%,对溶菌酶的清除效率达58.4%±3.2%。
实施例6
一种便携可穿戴可血液净化用器件,结构同实施例1,不同之处仅在于:
所述便携可穿戴可血液净化用器件长60mm,宽50mm,高8mm。
所述微流控通道宽1mm,深100μm,通道间距为1mm。
制备步骤如下:
1)一次复型阳模的制备:将血液净化器件基材甲基丙烯酸甲酯(mma)前聚液与引发剂按50:1的比例混合后浇注在刻蚀好的蛇形硅片基通道模板上,抽真空除去搅拌时产生的气泡,100℃条件下固化1h,得到一次复型阳模;
2)二次复型制备血液净化器件的微流控通道基片:从硅片基模具上揭下为pmma阳模,并进行疏水化处理。随后,将pmma前聚液与引发剂按30:1的比例进行混合,在pmma阳模凹槽中浇注成型后,100℃条件下固化1h,从pmma阳模中揭下为pmma基片,得到血液净化器件的微流控通道基片;
3)聚苯乙烯-聚二乙烯基苯-聚丙烯酰胺多孔微球材料(其中聚二乙烯基苯为交联剂)的负载:将通过上述方法制备的微流控通道基片中的一片经氧等离子体处理20min,并将浓度为100mg/ml的多孔微球水溶液填满所述基片的通道,室温下固定24h,用乙醇冲洗除去未固定的多孔微球,并在微通道进出样口处打孔,同样,在另外一个没有做任何处理的微通道基片进出样口处打孔;
4)便携可穿戴可血液净化用器件的集成:将10%v/v正己烷的pmma稀释溶液用匀胶旋涂机旋涂在培养皿表面,匀胶机转速为3000转30s,6000转60s,在上述制备的两个pmma基材倒扣在涂有pmma的培养皿表面以蘸取一定厚度的pmma,并在两片pmma基片中间夹一层孔径为5微米的多孔聚砜膜,在显微镜下使两个pmma基材中的通道完全贴合,80℃下固化2h,得到便携式、可穿戴血液净化器。
通过体外模拟测试,经过三次循环测试,该血液净化器对尿素的清除率达87.6%±1.6%,对肌酐的清除率达90.0%±3.7%,对溶菌酶的清除效率达65.7%±2.6%。
结论:本发明中微流控通道基片、多孔膜和多孔微球之间相互配合,协同作用,使血液净化器的作用效果最优,缺少任一组件都会导致血液净化器在某些方面有不同程度的减弱。本发明的产品不仅微型、便携、可穿戴,而且集合了传统血液透析和血液灌流的优势,可实现对小分子、中分子和大分子的高效去除。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!