一种多级结构仿生血管网络组织工程支架的制备方法与流程
本发明属于组织工程支架领域,特别涉及一种多级结构仿生血管网络组织工程支架的制备方法。
背景技术:
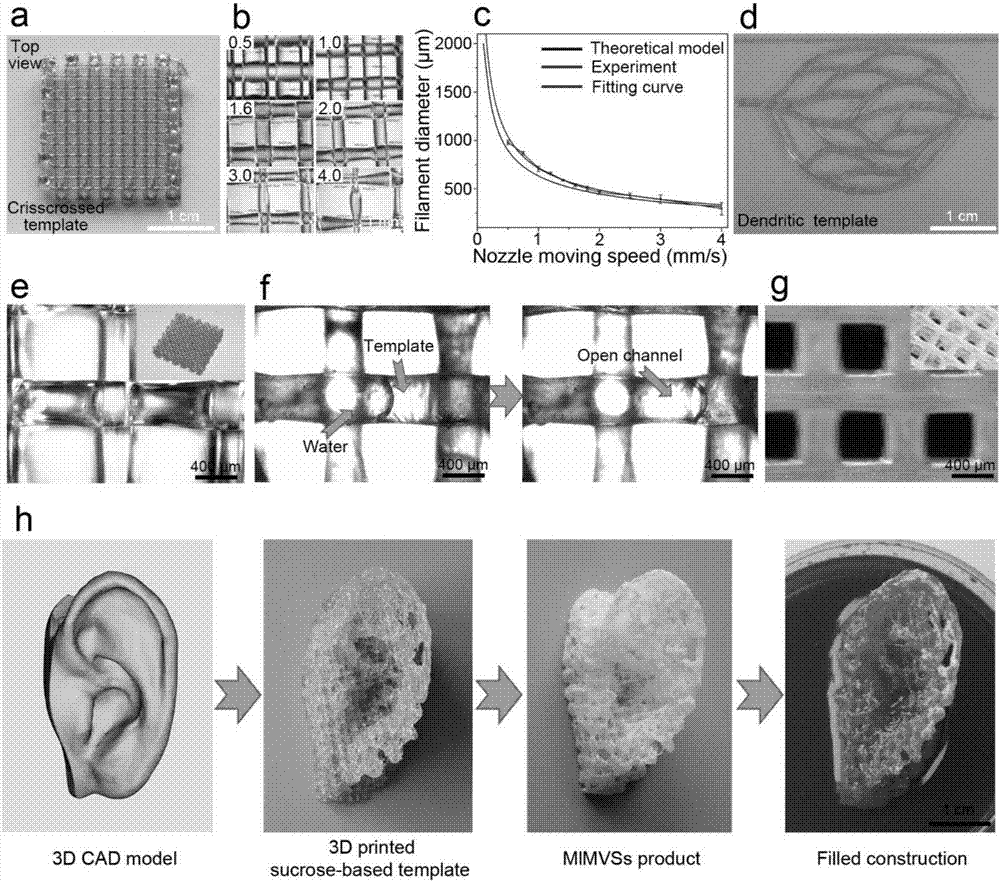
:现有的大多数组织工程构建体都不具有理想的微血管网络,其扩散交换能力和物质运输性能较差,组织当中高密度细胞无法得到充分的物质交换而快速形成坏死中心,从而难于构筑厚密的组织特别是维持其长期的活性[j.p.armstrong,r.shakur,j.p.horne,s.c.dickinson,c.t.armstrong,k.lau,j.kadiwala,r.lowe,a.seddon,s.mann,j.l.anderson,a.w.perrimananda.p.hollander,natcommun,2015,6,7405.]。因此,构造出包含仿生天然血管网络的工程组织,并且能在体内外维持细胞在其中长时间的生存和重塑是组织工程领域中一大公认的难点与挑战[f.a.auger,l.gibotandd.lacroix,annurevbiomedeng,2013,15,177-200.]、[t.dvir,b.p.timko,d.s.kohaneandr.langer,natnanotechnol,2011,6,13-22.]。为此,以激光微刻蚀,微模成型法等为代表的微加工技术被研究以制备微流体器件,从而引入仿生的血管网络,试图解决上述组织工程血管化的问题[b.zhang,m.montgomery,m.d.chamberlain,s.ogawa,a.korolj,a.pahnke,l.a.wells,s.masse,j.kim,l.reis,a.momen,s.s.nunes,a.r.wheeler,k.nanthakumar,g.keller,m.v.seftonandm.radisic,natmater,2016,doi:10.1038/nmat4570.]、[e.w.esch,a.bahinskiandd.huh,natrevdrugdiscov,2015,14,248-260.]。然而,这些方法只适用于少部分很有限的生物材料,而且往往需要很复杂的步骤才能制备成一定的三维结构。因此,这种技术的自由度以及功能性都不够,无法满足再生医学中对于材料以及形态结构的个性化需求。近年来,3d打印技术的兴起为该难题的解决提供了契机,3d打印能个性化精确构筑三维结构,被认为是最有可能人工制备复杂血管化组织的方法之一[s.v.murphyanda.atala,natbiotechnol,2014,32,773-785.]。当前的研究主要集中在,利用特殊设计的打印方式、倒模材料者固化方式在水凝胶的内部构建微通道模拟血管网络结构[w.jia,p.s.gungor-ozkerim,y.s.zhang,k.yue,k.zhu,w.liu,q.pi,b.byambaa,m.r.dokmeci,s.r.shinanda.khademhosseini,biomaterials,2016,106,58-68.]、[w.zhu,x.qu,j.zhu,x.ma,s.patel,j.liu,p.wang,c.s.lai,m.gou,y.xu,k.zhangands.chen,biomaterials,2017,124,106-115.]、[w.wu,a.deconinckandj.a.lewis,advancedmaterials,2011,23,h178-183.]。然而,水凝胶通常是非常柔软的,只适合用于少部分的软组织,在体内动态的力学环境中易发生形变而导致运输通道阻塞。最近,载有细胞的水凝胶和可牺牲材料以及可降解聚合物一起进行集成3d打印,通过这种方法在引入通道网络的同时来提高支架的整体稳定性[h.w.kang,s.j.lee,i.k.ko,c.kengla,j.j.yooanda.atala,natbiotechnol,2016,doi:10.1038/nbt.3413.]。但是,这些集成结构只简单地模拟血管网络的空腔,而且只能适用于非常有限的打印材料以避免熔融挤出的高温对附近水凝胶中细胞的伤害。由于涉及活细胞,因此对制备条件和使用环境的要求都是极为严格的,在实际的使用中存储运输等都会存在较大的问题。近年来以纯人工合成材料为核心的无细胞体内原位组织工程的概念悄然兴起。其基本理念是将纯的人工合成材料制备的组织工程支架直接植入体内缺损部位,通过募集人体体内自身细胞和生物活性因子,利用得天独厚的天然的人体环境,诱导干细胞分化,引导细胞聚集体、细胞外基质的有序再生,原位实现缺损组织的修复[w.wu,r.a.allenandy.wang,natmed,2012,18,1148-1153.]、[c.h.lee,j.l.cook,a.mendelson,e.k.moioli,h.yaoandj.j.mao,lancet,2010,376,440-448.]。据此构建纯人工材料的仿生血管网络也是该领域的潜在发展方向之一。但是受限于3d打印精度和材料加工的流动变形性的限制,目前未见报道利用3d打印技术制备整体连通且具备物质交换功能的薄壁仿生血管网络支架(微血管网络直径100-1000微米,壁厚10-50微米,表面微孔孔径1-5微米)。在仿生血管网络构筑中还有一个重要而目前基本上被大家忽视的一个问题就是仿生血管网络的力学性能。比如上述3d打印构建的凝胶基质,其力学性能就较差,在应力作用下易变形堵塞而无法恢复,从而不能有效地履行其血管的功能。不仅如此,和天然血管力学性能相匹配的仿生支架也是其能最终促进血管再生的关键[q.z.chen,s.l.liangandg.a.thouas,prog.polym.sci.,2013,38,584-671.]。细胞生物学和发育生物学的研究都清晰地表明基质的力学性能显著地影响细胞的功能和组织的生长,同时力学刺激对细胞的行为也有深刻的影响[p.a.janmeyandc.a.mcculloch,annu.rev.biomed.eng.,2007,9,1-34.]。因此,一个理想的仿生血管网络组织工程支架,不仅要从结构设计和构建上仿生,还要从力学性能的弹性和匹配性上进行调控。技术实现要素:本发明所要解决的技术问题是提供一种多级结构仿生血管网络组织工程支架的制备方法,该方法所制备的组织工程支架,可在结构和力学上双效仿生血管网络,方法简单、快捷、适用于多种生物材料,具有良好的应用前景。本发明提供了一种多级结构仿生血管网络组织工程支架的制备方法,包括:(1)利用cad软件构建立方体网状结构的模型,然后在3d打印机的加热腔内加满蔗糖粉末,设定加热腔温度130~150℃、喷嘴温度120~140℃、加热时间60~90min,通过3d打印得到糖模板;(2)配制浓度为3wt%~5wt%的聚合物材料溶液,将步骤(1)中的糖模板浸没在聚合物材料溶液中,浸渍后取出,干燥,得到含有聚合物涂层的糖模板;然后将含有聚合物涂层的糖模板通过相分离除去蔗糖,冷冻干燥,得到多级结构仿生血管网络组织工程支架;其中,多级结构包括中空的管道网络组成的框架以及在管道的内外表面以及管壁内部构建有均匀分布的三级微纳空隙结构。所述步骤(1)中的模型长宽为20mm×20mm,网络间隙为1.2mm~1.8mm,交叉角度设计为45°~90°。所述步骤(1)中的3d打印具体参数为:层高为0.4~0.6mm,零件位置为x轴100、y轴100,填充类型为90°,xy轴运动速度为1~2mm/s,t2轴挤料速度为0.001~0.01mm/s。所述步骤(2)中的聚合物材料为塑性材料、热塑性弹性材料、热塑性非弹性材料或热固性弹性材料。优选的,所述步骤(2)中的聚合物材料为聚己内酯pcl、聚氨酯pu、聚癸二酸甘油酯pgs、聚氯乙烯pvc、聚醚砜pes、聚醚醚酮peek、聚醚酰亚胺pai、聚苯硫醚pps、酚醛树脂、脲醛树脂中的一种。所述步骤(2)中的聚合物材料溶液采用的溶剂为四氢呋喃thf、六氟异丙醇hfip或二氯甲烷dcm。配制聚合物溶液的具体过程如下:称量0.3~0.5g聚合物溶于10ml四氢呋喃(thf)或六氟异丙醇(hfip)或二氯甲烷(dcm)中,室温下磁力搅拌2h形成澄清无浑浊的溶液,得到浓度为3wt%~5wt%的溶液。所述步骤(2)中的浸渍时间为10s~20s。所述步骤(2)中的相分离具体为:在蒸馏水中透析,透析时间为12h~24h;透析过程中每3h换一次水。所述步骤(2)中得到的多级结构仿生血管网络组织工程支架结构可控、整体相互连通、管壁分布有均匀微孔结构、具有物质交换运输作用,平均孔隙率为95.35±1.14%。可通过接入进出口管道制备得到微流体器件。所述步骤(2)中得到的多级结构仿生血管网络组织工程支架进一步与水凝胶复合得到复合支架。本发明的多级结构仿生血管网络组织工程支架有如下特点:①利用3d打印技术个性化定制控制支架的宏观初级框架结构,以匹配患者所需的缺损部位的轮廓和外形;②支架的构建单元为中空的管道网络,这种二级管道网络整体是相互连通的,具有良好可灌注性,提供物质运输的通道,从而模拟血管网的灌注流动功能;③在管道的内外表面以及管壁内部构建出特定均匀分布的三级微纳空隙结构,使其管道具有良好的通透性,可发生管内外的物质交换,更好地模拟血管物质交换的功能。支架可被设计和升级为微流体器件,以适应细胞动态培养的需求。本发明具有良好的通用性,可适用于包括热塑性非弹性材料、热塑性弹性材料、热固性弹性材料等多种生物材料;支架具有良好的弹性,且力学性能可根据使用材料进行广泛调节。这种多层次结构仿生血管网支架具有良好的扩展性,可作为内置功能性小分子运输网络,与多种组织工程支架制备技术相结合,进一步引入微纳米多孔体系,从而构建含有仿生血管网的复合组织工程支架。这种仿生血管网可在与水凝胶复合的支架体系中,有效的发挥物质的运输和交换功能,维持细胞的生存和生长。有益效果(1)本发明制备的具有多级空隙结构的三维中空支架,在结构设计上,从三重不同尺度的结构上对血管网络进行仿生:利用3d打印技术个性化定制优势以制备图案化的模板,从而控制支架宏观的初级的框架结构,以便匹配患者所需的缺损部位的轮廓和外形;在模板上利用合成生物材料涂层进行倒模,从而获得壁厚大大低于现有3d打印精度的薄壁网络结构,以克服3d打印现有技术瓶颈,这种二级管道网络整体是相互连通的,提供物质运输的通道;通过对涂层构建工艺中相分离条件的控制,从而在管道的内外表面以及管壁内部构建出特定均匀分布的三级微纳空隙结构,使其管道具有良好的通透性,更好地模拟血管物质交换的功能,而这也是目前直接3d打印无法做到的。(2)本发明所使用的模板为食用级蔗糖为原料,仅通过简单的高温加热使其焦糖化后即可获得稳定可控的良好打印性。模板在后续处理过程中,能够快速的溶解于水中,去除充分。(3)本发明的多级结构仿生血管网络组织工程支架(hvss),可接入进出口管道制备出微流体器件,支架管道整体具有良好的连通性,可满足灌注式的使用需求。通过灌注实验验证了支架中空结构的连通性以及灌注培养的可行性,小分子物质可在管道网络中进行运输和传递。(4)本发明的多级结构仿生血管网络组织工程支架的管壁具有良好的可渗透性,可满足小分子物质在管道内外的物质交换作用需求。(5)本发明的多级结构仿生血管网络组织工程支架的制备方法具有很好的普适性,可适用于广泛的生物材料的加工。包括以聚己内酯(pcl)为代表的塑性材料,以聚氨酯(pu)为代表的热塑性弹性材料,以及以聚癸二酸甘油酯(pgs)为代表的热固性弹性材料等。且制备简单快捷,具有良好的应用前景。(6)本发明的多级结构仿生血管网络组织工程支架的制备方法,可以应用在具有良好生物相容性和可降解性、能在一定程度上模拟天然血管组织力学性质的生物弹性体上,赋予支架可调节的优良弹性性能,从而实现对天然血管网络在结构形态和力学性能上的双效仿生。(7)本发明的多级结构仿生血管网络组织工程支架具有良好的扩展性,可以作为内在的小分子运输系统,与多种组织工程支架制备技术相结合,进一步引入微纳米多孔体系,从而构建含有仿生血管网的复合组织工程支架。(8)本发明的多级结构仿生血管网络组织工程支架可在与水凝胶复合的支架体系中,有效的发挥物质的运输和交换功能,维持细胞的生存和生长。(9)本发明的多级结构仿生血管网络组织工程支架在大鼠皮下移植后,在不添加其他生长因子仅靠材料自身性能的条件下,与传统的3d打印支架相比,设计特殊结构的hvss支架具有更好促进体内血管再生效果;若辅助使用促进血管新生的生长因子会有更好的效果,其中水凝胶可作为缓释载体使生长因子逐步缓释,并且由于hvss的存在可兼顾降解性,提供必要的力学支撑和通道网络,为组织、血管提供生长的空间和环境。附图说明图1为本发明多级结构仿生血管网络组织工程支架的制备原理图;图2为3d打印蔗糖模板的宏观结构(a)、不同打印条件下模板的结构(b)、微结构的可控性(c)以及在结构上仿生血管网络的3d打印模板(d);蔗糖模板的显微结构(e)、模板的溶解导致管道网络的形成(f)、成型后支架的管道网络结构(g);以人耳为模型制备大块的、厚的仿生血管网络人耳支架(h);图3为仿生血管网络组织工程支架的三重结构,其中,设计原理示意图(a-c);支架的表面宏观结构和sem微观结构(d-g);支架管道径向截面的示意图和sem图(h-k);支架管道轴向剖面的示意图和sem图(l-o);图4为支架管道上微孔尺寸(a);延展性、弹性及耐疲劳性测试(b-d);支架微流体器件(e)、可灌注性网络通道(f)及封闭式的出入口(g);支架的开放性和可渗透性测试(h);图5为弹性仿生血管网络支架、热塑性弹性聚氨酯pcl-pu支架及其微观结构(a-h);热固性弹性聚酯pgsu支架及其微观结构(i-p);图6为pcl-pu支架与pgsu支架的性能测试(a-g);图7为以nacl颗粒和蔗糖模板作为双重模板所制备的多级孔支架(a-e);将仿生血管网络支架作为载体,进行微生物发酵,在管道网络上分泌纳米纤维素,引入纳米纤维状结构,分布与支架管道的间隙中(f-j);将仿生血管网络支架作为载体,与静电纺丝技术结合,将聚合物纳米纤维分布于管道表面和间隙中(k-o);将海藻酸钠水凝胶对支架进行封装,并设计接入出入口,形成可灌注式的微流体,小分子物质可在管道内流动、运输并通过渗透性管壁扩散至水凝胶内部(p-r);图8为仿生血管网络组织工程支架的生物相容性测试(a-n);图9为直接打印的pcl支架、hvss支架、hvss-水凝胶复合支架的血管生长对比(a-i)。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。实施例1(1)3d打印“可牺牲”的糖模板①建立模型:利用cad软件构建立方体网状结构的模型,大小为20mm×20mm,网络间隙设计为1.2mm,交叉角度为45°,设计路径模拟3d打印机喷头的路径;②设置打印机参数:在3d打印机的加热腔内加满蔗糖粉末,设定加热腔温度150℃、喷嘴温度135℃,加热时间70min,③设置3d打印软件参数:层高为0.5mm,零件位置为x轴100、y轴100,填充类型为90°,xy轴运动速度为1.2mm/s,t2轴挤料速度为0.005mm/s,得到糖模板。(2)三维中空支架的制备①配制溶液:称量0.4gpcl固体溶于10mlthf中,室温下磁力搅拌2h形成澄清无浑浊的溶液,得到浓度为4wt%的pcl/thf溶液;②浸渍法制备pcl涂层:将糖模板直接浸没在装有4wt%pcl/thf溶液的玻璃培养皿中,浸渍10s后取出,沥尽支架表面的多余液体,室温通风环境下自然干燥20min。③溶出蔗糖:将含有pcl涂层的蔗糖模型支架浸没在装有蒸馏水的培养皿中,透析12h除去蔗糖,期间每3h换一次水,析出后的pcl支架真空干燥至恒重,得到多级结构仿生血管网络组织工程支架(以下简称三维中空支架)。(3)拟血管网络微流体的制备①试剂溶液的配制:称量0.4g海藻酸钠固体粉末,溶于20ml蒸馏水中,室温下磁力搅拌24h至溶液均匀无浑浊,配置得到浓度为2wt%的海藻酸钠溶液;称量2.5gcacl2固体,溶于50ml蒸馏水中,玻璃棒搅拌至溶液澄清无浑浊,配置得到浓度为5wt%的cacl2溶液,放于塑料喷雾瓶中;称量0.6gpcl固体,溶于10mlthf中,室温下磁力搅拌2h形成澄清无浑浊的溶液,配置得到浓度为6wt%的pcl/thf溶液;称量活性红染料粉末,溶于50ml蒸馏水中,玻璃棒搅拌至溶液澄清无浑浊,配置得到浓度为1%的染料溶液;称量30g蔗糖,溶于15ml蒸馏水中,150℃油浴加热,磁力搅拌配置成高浓度的蔗糖溶液,加热搅拌45min至拉丝可立即凝固。粘结导入管:取大小为5mm×5mm的两层的糖支架,将内径为0.3mm的毛细管截成1cm左右的小段,取两小段毛细管与糖支架的两侧相连;②制备pcl涂层:用4wt%pcl/thf溶液浸渍法制备pcl涂层,室温通风环境下自然干燥20min。毛细管与支架连接处用6wt%pcl/thf溶液涂覆加固,室温通风环境下自然干燥10min;③微流体通过软管与两支连接在注射泵上的注射器相接,两台注射泵一台注射,一台抽取,进行灌注实验。(4)三维中空支架的微观结构观察①用nikon公司生产的eclipsee400pol光学显微镜对支架的孔隙、直径、管路交叉结构进行观察和测量,如图1。②用jeol公司生产的扫描电子显微镜观察经真空干燥后的支架材料,包括其表面、截面、孔隙结构及中空管道形态,如图2。(6)三维中空支架的孔隙率测定采用乙醇密度法测量孔隙率。支架经冷冻干燥后于干燥器中恒重24h,分析天平称量其质量m0。将支架放入1.5ml离心管中,完全浸没在无水乙醇中12h,测量离心管、乙醇与支架的总质量为m1。用镊子小心地将支架从瓶中取出,取出的支架吸满乙醇液体又不滴落为准,支架放置在干净的培养皿上。用天平称量剩余乙醇和离心管的总质量为m2。pcl密度ρpcl为1.145g/cm3,20℃下无水乙醇密度ρ乙醇为0.789g/ml。支架的孔隙率计算公式如下,表1pcl支架孔隙率样品123456孔隙率(%)96.8295.0196.5896.3393.8494.03样品789101112孔隙率(%)93.8096.3596.6095.1394.7594.95(7)可灌注性实验用容量为10ml的注射器抽取5ml浓度1%的红色染料溶液。将拟血管网络微流体两侧的毛细管与两根四氟软管相连,其中一根软管与装有染料的注射器相连,另一根软管与空注射器相连。两支注射器分别与两台注射泵相连,连接装有染料的注射器的注射泵选择注射模式,流速设置为1ml/h,连接装空注射器的注射泵选择抽取模式,流速也设置为1ml/h。搭建完成后,同时开启两台注射泵,光学显微镜下观察并记录灌注实验的现象。如图7所示,经观察发现,灌注初期,海藻酸钠包埋支架呈无色透明,灌注时肉眼可观察到染料在包埋物内部管路的流动情况,染液从支架的一端进入,通过三维支架中空管路流通至整个支架各个区域,最终汇集到另一端,再通过毛细管被可抽取的注射泵收集起来。当灌注速率与抽取速率匹配时就可长时间维持灌注系统的流通。灌注超过15min时,海藻酸钠胶体变成红色透明状态,这是由于为了模拟血液中的营养物质和代谢废物,选用的染料是小分子物质,小分子物质经包埋物内部管道流过支架的同时通过管道内壁上的微孔扩散进入凝胶。灌注5h后的包埋物呈红色,表面只有少量液体。这很好的说明本支架具有良好的连通性和可灌注性,而且小分子物质能简便的渗透到凝胶中,有利于细胞生长过程中营养物质的运输和代谢废物的传递。(8)三维中空支架的生物相容性测试如图8所示,将混匀有大鼠心肌细胞(h9c2)的海藻酸钠溶液对仿生血管网络支架进行钙化凝胶封装包埋(e,f)。同时,采用纯水凝胶-细胞(a,b)、含细胞的水凝胶与直接打印的pcl支架复合体作为对比参照(i,j)。培养五天后,对三组样本live-dead染色后进行共聚焦扫描测试,从正面和截面观测三组样本内部细胞活死分布情况。从共聚焦三维扫描的活死细胞分布图可看出,其中正面所展示的纯水凝胶组内部的活死细胞分布均匀(d),而截面所展示的在水凝胶表面的细胞存活状态比内部更好(g);而hvss-水凝胶组和pcl支架-水凝胶组内部的细胞活死状态的分布呈现差异性(e-f)。从区域的统计定量分析可看出(j),其中在hvss-水凝胶组中,心肌细胞在靠近管道结构的区域表达出更高的存活率(e,h);而在pcl支架-水凝胶组中,靠近支架纤维的细胞存活率相对较低,死细胞的表达量更高(f,i)。对三组样本的1、3、5天进行cck-8实验,分析细胞的活力状态,其中hvss-水凝胶组的表现出的细胞活力最好,呈增加趋势,也印证了hvss的通道网络结构对维持细胞生存、增殖所综合反映的活力状态的有利影响。(9)三维中空支架的体内血管再生测试如图9所示,将直接打印的pcl支架、hvss支架、hvss-水凝胶复支架、纯水凝胶支架共4组植入体内4周后,分别进行免疫组化染色,标记与血管生长相关的因子,包括cd-31、vwf,在共聚焦显微镜下观测血管标记物的分布状态,cd-31和cd-54显色为绿,vwf显色为红色。hvss比实心pcl支架的血管新生因子的阳性表达量要高,hvss-水凝胶组比hvss的血管标记物表达更高,二者均含有pavss的管道网络结构,而二者的差异在于水凝胶和生长因子的使用,因此认为这是血管生长因子对于血管新生的重要促进作用,而水凝胶是作为降解缓释的载体而存在。而纯水凝胶的血管新生情况与pavss-水凝胶大体相同。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1