高分子聚电解质诱导胶原纤维内仿生钙化的方法及其应用与流程
本发明属于仿生矿化材料及组织工程支架材料领域,涉及高分子聚电解质诱导胶原纤维内仿生钙化的方法及其应用。
背景技术:
当今社会随着人口老龄化、外伤、肿瘤等原因造成的骨组织缺损不断增加,人们对植骨材料的需求也日益增多。在现有的骨替代材料中,自体骨、异体骨是常用的移植材料,但是它们普遍存在来源有限、手术操作复杂,免疫排斥、骨愈合时间长、愈合率低,耐受性差及并发症多等问题,因此合成结构功能高度仿生的人工骨再生修复材料是解决这一问题的关键。
天然的骨组织主要由无机矿物质(即磷酸钙)、i型胶原和非胶原蛋白构成。其中i型胶原蛋白是脊椎动物骨、牙等硬组织中的主要有机基质,具有来源广泛、合成简单、生物相容性良好、韧性较强等特点。而磷酸钙因其可以作为生物活性剂、基因或各种生物分子的载体以及作为骨移植材料的无机矿物质成分来源,在生物材料领域的应用前景极为广泛。如何用仿生合成的方法,实现磷酸钙在i型胶原纤维内的有序沉积,恢复自然矿化单位中胶原分子与矿物质从微观水平到介观水平再到宏观水平分级有序的结合形式,从而达到优良的机械性能,是该领域的研究热点和难点,针对该问题的探索也必将为新一代的骨、牙等硬组织修复材料的研发提供全新的思路。
技术实现要素:
针对现有骨缺损修复材料的缺陷或不足,本发明的目的在于提供两种类型的高分子聚电解质——聚阳离子和聚阴离子诱导胶原纤维内仿生钙化的方法;制备的高分子聚电解质诱导胶原纤维内仿生钙化材料作为硬组织缺损修复材料的应用。
为此,本发明采取的技术方案包括:
高分子聚电解质诱导胶原纤维内仿生钙化的方法,该方法包括:
将胶原支架在含有聚阳离子的磷酸钙矿化液或者含有聚阴离子的磷酸钙矿化液中进行处理,得到仿生钙化胶原支架材料。
具体的,所述的含有聚阳离子的磷酸钙矿化液为聚丙烯氯化铵稳定的磷酸钙溶液、聚乙烯亚胺稳定的磷酸钙溶液或聚二烯丙基二甲基氯化铵稳定的磷酸钙溶液。
更具体的,所述的聚丙烯氯化铵稳定的磷酸钙溶液为将聚丙烯氯化铵按照200~800μg/ml的比例加入到磷酸钙溶液中得到的溶液;
所述的聚乙烯亚胺稳定的磷酸钙溶液为按1.0%~5.0%体积分数的比例将聚乙烯亚胺与磷酸钙溶液混合得到的溶液;
所述的聚二烯丙基二甲基氯化铵稳定的磷酸钙溶液为按2.5%~5.0%体积分数的比例将聚二烯丙基二甲基氯化铵与磷酸钙溶液混合得到的溶液。
最好的,所述的聚阳离子的供体为聚丙烯氯化铵、聚乙烯亚胺或聚二烯丙基二甲基氯化铵;
聚丙烯氯化铵的分子量为150kda,聚乙烯亚胺的分子量为70kda,聚二烯丙基二甲基氯化铵的分子量为100kda。
具体的,所述的含有聚阴离子的磷酸钙矿化液为聚天冬氨酸稳定的磷酸钙溶液、聚丙烯酸稳定的磷酸钙溶液或聚谷氨酸稳定的磷酸钙溶液。
更具体的,所述的聚天冬氨酸稳定的磷酸钙溶液为按50~300μg/ml的比例将聚天冬氨酸钠溶于磷酸钙溶液中得到的溶液;
所述的聚丙烯酸稳定的磷酸钙溶液为按20~1000μg/ml的比例将聚丙烯酸溶于磷酸钙溶液中得到的溶液;
所述的聚谷氨酸稳定的磷酸钙溶液为按20~1000μg/ml的比例将聚谷氨酸溶于磷酸钙溶液中得到的溶液。
最好的,所述的聚阴离子的供体为聚天冬氨酸、聚丙烯酸或聚谷氨酸;
聚天冬氨酸的分子量为50kda,聚丙烯酸的分子量为450kda,聚谷氨酸的分子量为200kda。
任一所述的高分子聚电解质诱导胶原纤维内仿生钙化的方法,其特征在于,所述的磷酸钙矿化液为磷酸钙溶液,磷酸钙溶液为含有9mm的cacl2和4.2mm的k2hpo4的水溶液。
任一方法得到的高分子聚电解质诱导胶原纤维内仿生钙化材料作为硬组织缺损修复材料的应用。
与现有技术相比,本发明所形成的纤维内钙化仿生胶原支架相比于其他骨修复材料具有明显的优越性,体现在:
(1)纤维内的矿化模式更高程度的模拟了自然骨组织的矿化形式,显著增强了胶原纤维的机械强度,并能够为细胞生长提供更好的内环境,是理想的骨缺损再生修复材料;
(2)材料中将磷酸钙矿物质成分整合入i型胶原纤维内并在其中有序沉积,无定形磷酸钙前体在纤维内进一步转换为羟基磷灰石晶体的特点综合了胶原纤维的生物相容性、羟基磷灰石的骨传导性及运载基因或各种生物分子的能力,并且在生物体内具有适当的降解能力;
(3)纳米羟基磷灰石的强吸附性,使得材料的可修饰性强,且不同的修饰位点及修饰机理有利于对材料实现多重功能化改性;
(4)与传统矿化中胶原与矿物质的无序混合不同,本发明中采用仿生矿化的方法,利用高分子聚电解质对超饱和磷酸钙溶液的稳定及引导作用,实现了胶原纤维内部的有序矿化,模拟了自然骨组织胶原纤维与矿物质有序排列的纤维内矿化形式,而这种纤维内矿化形式是构成自然骨组织7级分级结构的基础,不仅决定了骨组织在纳米尺度上的力学性能,更对其整体机械和生物学特性起着决定性作用。
附图说明
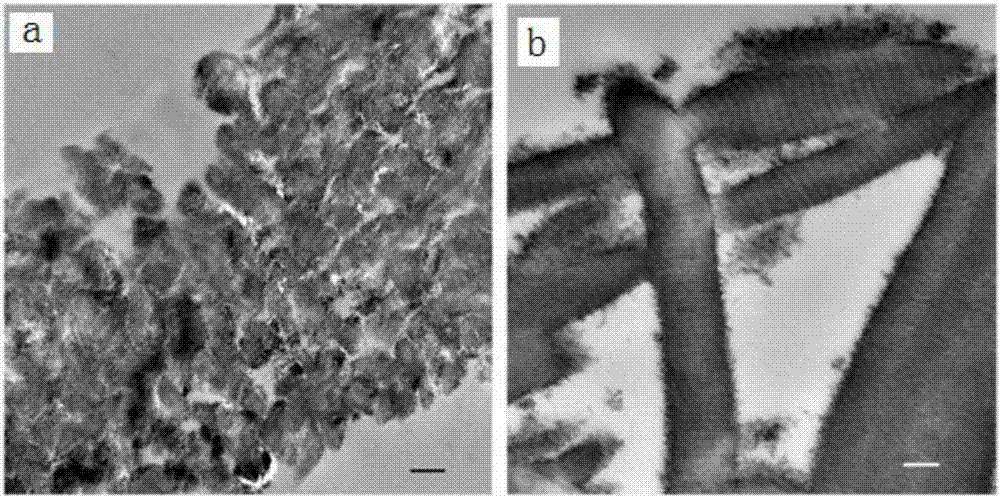
图1为实施例1构建的材料的钙化胶原的透射电镜图;
其中,图1(a)表示低倍(放大倍数为500nm)观察下,整个胶原纤维束呈现高电子密度的状态,无机矿物质全部存在于胶原纤维内部,胶原纤维周围空间内的很少;图1(b)显示高倍(放大倍数为200nm)观察下,纤维内矿物质即羟基磷灰石晶体充实了胶原纤维内部空隙,可见胶原纤维内部羟基磷灰石晶体有序沉积所反映出的胶原纤维的规律性横纹结构;
图2为实施例1的胶原支架仿生钙化处理前后的对比图,其中,c表示钙化前胶原支架;d表示湿润后胶原支架体积有所增大,e表示经实施例1的钙化方法钙化后的胶原支架的体积明显增大;
图3为分子动力学模拟观察实施例1的胶原支架仿生钙化过程中胶原纤维内外的分子及离子变化情况;
图4为实施例1的胶原支架仿生硅化处理前后的官能团变化示意图;
图5为实施例1聚阳离子诱导纤维内钙化前后胶原纤维内、外环境中的离子变化示意图;
图6为将实施例1得到的成骨材料经热重分析表征钙化胶原纤维的热稳定性和组份;
图7为将实施例1得到的成骨材料经分子动力学模拟观察仿生钙化过程中胶原纤维内外的分子及离子变化情况;
图8为将实施例1得到的成骨材料经聚阳离子诱导纤维内钙化前后胶原纤维内、外环境中的离子变化示意图;
以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
本研究利用聚电解质对超饱和磷酸钙溶液的稳定作用,稳定并引导纳米级的磷酸钙无定形液相前体渗透进入i型胶原纤维内,在纤维内有序沉积并逐步转化为磷灰石晶体,形成了仿生胶原纤维内钙化支架材料。该材料具有良好的机械性能、生物相容性以及适当的生物体内降解能力,是理想的骨缺损再生修复材料。此外,由于此前该领域内的研究均采用阴离子聚电解质进行仿生矿化的探索,本研究创造性地实现了利用阳离子聚电解质(聚丙烯氯化铵、聚乙烯亚胺、聚二烯丙基二甲基氯化铵)诱导纤维内钙化,并据此提出了在胶原纤维内、外环境中维持渗透压和电荷双平衡以促进纤维内矿化的新机制,颠覆了传统上认为库伦引力是诱导纤维内矿化的唯一机制的认识,极大地丰富了生物矿化的理论系统,在生物矿化机制研究领域中具有重要里程碑式的作用。
天然骨的矿化过程存在三个关键的要素:胶原纤维,无定形矿物质前体,非胶原蛋白。其中,非胶原蛋白调控的纤维内矿化决定了骨组织优异的力学特性和生物学特征,理解其中的机理并模拟这一过程成为仿生矿化的关键一步。
常见的非胶原蛋白有dspp(牙本质涎磷蛋白),dmp-1(成牙本质基质蛋白),bsp(骨涎蛋白),骨钙素,骨形态发生蛋白2,骨桥蛋白等,这些蛋白的共同特点是富含谷氨酸、天冬氨酸,因此存在大量羧基,此外这些蛋白上的丝氨酸经磷酸化作用后生成磷酸丝氨酸,进一步增强了非胶原蛋白的阴离子特性。而此前已经有研究证实胶原纤维的周期性结构(称为d周期)中存在abcde5类条带,其中位于孔区的a带和c带具有明显的正电荷。因此形成了目前在国际上关于纤维内矿化机制的研究中占主导地位的正负电荷相吸的库伦引力理论,即带负电荷的矿化前体会与带正电荷的胶原位点间相互吸引,构成了纤维内矿化形成的动力。基于这一理论,几乎所有的体外研究都使用富含羧基的酸性聚电解质来模拟非胶原蛋白的功能,并集中于聚阴离子诱导的纤维内矿化上。
本发明在国际上首次发现聚阳离子也可以稳定钙磷溶液形成带正电荷的矿化前体,并成功诱导了聚阳离子稳定的磷酸钙矿化液对胶原纤维的纤维内矿化。所合成的纤维内钙化胶原支架材料以胶原纤维为支架材料,纳米级的羟基磷灰石晶体在胶原纤维内有序排列,羟基磷灰石晶体对胶原起增强作用,胶原对羟基磷灰石晶体起增韧作用,由此赋予材料良好的力学性能。此外,胶原纤维模拟了活体内细胞外基质的重要构成骨架,具有良好的生物相容性;而羟基磷灰石属于多孔性网状结构,具有天然的孔隙及孔隙率,为新生骨样组织的长入和各种营养物质的输入提供了场所,同时也为诱导新骨生成的物质提供所需空间,具有优异的生物稳定性和生物功能性。这种合成速度快、免疫原性低、机械强度好、生物活性高的多分级仿生矿化骨替代材料为骨缺损的修复提供了更好的解决途径,具有传统骨替代材料无法比拟的优越性。
此外,本发明进一步通过改良的液相色谱法、分子动力学模拟和液相原子力显微镜技术反复推导、验证,提出了基于渗透压和电荷双平衡(即gibbs-donnan平衡)的纤维内仿生矿化理论。这一新理论的提出颠覆了传统上认为库伦引力是形成纤维内矿化的唯一机制的认识,极大地丰富了生物矿化机制的理论基础。
以下是发明人提供的具体实施例,以对本发明的技术方案作进一步解释说明。
实施例1:
(1)以10mmhepes缓冲液为溶剂分别制备9mmcacl2·2h2o溶液及4.2mmk2hpo4溶液,将上述溶液等容混合,制得磷酸钙溶液(终浓度:4.5mmcacl2·2h2o/2.1mmk2hpo4);
(2)按200ug/ml的比例将聚丙烯氯化铵(平均分子量150kda)溶于磷酸钙溶液中,利用聚丙烯氯化铵对超饱和磷酸钙溶液的稳定作用,制得聚丙烯氯化铵稳定的无定型液相磷酸钙前体溶液。
(3)将胶原海绵或是完全脱矿的骨胶原基质置于聚丙烯氯化铵稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚丙烯氯化铵稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
按照实施例1所述,本发明所构建新型仿生钙化胶原支架材料具有以下特点:
如图1所示,通过tem观察发现,实施例1构建的聚阳离子诱导的纤维内仿生钙化胶原支架材料实现了羟基磷灰石晶体在胶原纤维内部有序沉积及胶原纤维内部的完全矿化。
如图2所示,未经钙化处理的重组胶原海绵干燥情况下塌陷明显(图2c),湿润后体积有所增加(图2d),仿生钙化处理后,由于无机矿物质含量的大量增加,体积明显增大,硬度及弹性明显增加(图2e)。
如图3所示,仿生钙化处理后重组胶原海绵的microct重建图像可见支架内外得到了均匀一致的钙化。
如图4所示,傅里叶红外光谱观察胶原钙化前后官能团的变化,仿生钙化处理后,在960cm-1、1020cm-1处出现了羟基磷灰石晶体中磷酸根离子的伸缩振动峰,560cm-1、602cm-1处出现的吸收峰代表羟基磷灰石o-p-o键的弯曲振动,873cm-1、1413cm-1处出现的吸收峰表示羟基磷灰石晶体内c-o键的伸缩、弯曲振动。以上峰型互为补充,综合说明钙化后的胶原纤维内存在着羟基磷灰石晶体的官能团。
如图5所示,广角x射线衍射检测发现胶原纤维钙化后出现了矿物质晶体的衍射峰,在衍射角(2θ)=25.86°、31.5°、32.2°、32.8°、34.0°、39.5°、46.6°处出现的002、211、112、300、202、310、222特征性衍射峰表明纤维内矿物质的主要形式为羟基磷灰石(ca5(po4)3(oh))。
如图6所示,通过热重分析表征钙化胶原纤维的热稳定性和组份。由质量保留曲线和微分质量保留曲线可见钙化胶原纤维加热过程中主要出现了五个热峰:15~200℃时物理吸附于胶原纤维上的水分子分解;250℃时与胶原连接较为松散的水分子分解;336℃时紧密连接在胶原上的水分子分解;478℃时胶原有机质降解;580℃时胶原纤维内的无定形磷酸钙开始转化为磷酸八钙和羟基磷灰石并逐渐达到稳定的平台期,此时质量保留率为64.6%,即钙化后的胶原纤维矿物质含量达64.6%。
表1不同分子量的化合物进入胶原纤维内的体积分数
如表1所示,胶原纤维自身具有选择性渗透的功能,分子量大于40kda的粒子会被完全排斥在胶原分子外,分子量小于6kda的粒子可以自由通过胶原纤维内的任何空间,而介于二者之间的粒子则可以部分进入胶原纤维内部。这构成了纤维内矿化的尺寸排斥假说。为了证实这一假说适用于高分子阳离子聚电解质(如聚丙烯氯化铵、聚乙烯亚胺、聚二烯丙基二甲基氯化铵)介导的纤维内钙化并探索可以自由通过胶原纤维内的低聚电解质会对这一过程产生的影响,我们使用改良的尺寸排阻色谱法,以二甲基亚砜(dmso,分子量78da)为低分子量对照,以牛血清白蛋白(bsa,分子量66kda)为高分子量对照,以脱矿骨粉为固定相,测定不同分子量的物质可以进入胶原纤维分子内部的体积百分数。在表1中,低分子量的二甲基亚砜可以自由通过固定相——骨粉胶原分子内的任何区域,其洗脱体积即代表了胶原纤维分子内的总体积(100%);而高分子量的牛血清白蛋白(洗脱体积分数0.33%)则基本上全部被排斥在胶原纤维外,由于不用穿过胶原纤维,这部分流动相的洗脱图会更早的出现。因此,含有不同尺寸分子的混合液体(如聚天冬氨酸+柠檬酸、聚丙烯氯化铵+精胺)的洗脱图会出现与分子量相对应的两个洗脱峰。根据上述理论,检测出聚天冬氨酸分子可以进入胶原纤维分子内的体积分数为32.67%,聚丙烯氯化铵为50.50%;精胺为98.64%;柠檬酸为99.34%;聚天冬氨酸+柠檬酸混合液体可以进入胶原纤维分子内的体积分数分别为33.33%和99.17%,聚丙烯氯化铵+精胺则分别为49.67%和99.83%。
如图7所示,分子动力学模拟观察仿生钙化过程中胶原纤维内外的分子及离子变化情况,纤维内的水分子不断被纳米级的无定形磷酸钙前体取代,表现为钙离子含量的持续增加和水分子、钠离子、氯离子含量的持续减少(图a、b、c)。均方根偏差法(rmsd)(图d)分析结果显示,胶原支架上原子的位置随着动力学模拟时间的增加明显偏离初始位置,表明胶原分子出现收缩;溶剂可及表面积(sasa)(图e)测试显示在阳离子/阴离子聚电解质稳定的矿化体系中,胶原分子的溶剂可及表面积分别降低了0.99%和1.16%,从另一个侧面证实了随着水分子从纤维内大量迁出,胶原结构出现收缩,为纳米级的无定形磷酸钙前体渗透进入纤维内提供了所需的空间。
如图8所示,聚阳离子诱导纤维内钙化前后胶原纤维内、外环境中的离子变化示意图,据此提出了基于渗透压和电荷双平衡(即gibbs-donnan平衡)的纤维内仿生矿化新机制:1.由于高分子量的阳离子聚电解质不能全部渗入胶原纤维内的空间里(如表1所示),有一部分的聚电解质存在于胶原纤维外,这部分电解质本身携带正电荷,因此会在其周围吸引负价离子并排斥正价离子,使胶原纤维外阳离子浓度降低。2.大量阳离子(如钠离子)(图a)会从纤维内扩散至纤维外以降低胶原内、外离子的浓度梯度差,大量正价离子的迁入使纤维外环境的电势能升高,为了维持纤维内、外的电势能平衡,大量阴离子(如氯离子)(图b)随后扩散到纤维外环境中。3.阴、阳离子的迁入造成了纤维外环境中的离子浓度剧烈增加,渗透压升高,为了维持纤维内、外环境的渗透平衡,纤维内的水分子随之扩散至纤维外(图c)。4.纤维内的空间由于大量水分子、离子的迁出而形成负压环境,促使具有流体性质的磷酸钙纳米前体渗透进入纤维内(图d),随着磷酸钙纳米前体在纤维内的有序沉积并发生一系列的相转换,最终形成了纤维内钙化。
实施例2:
该实施例与实施例1不同之处在于:
(2)按400μg/ml的比例将聚丙烯氯化铵(平均分子量150kda)溶于磷酸钙溶液中,利用聚丙烯氯化铵对超饱和磷酸钙溶液的稳定作用,制得聚丙烯氯化铵稳定的无定型液相磷酸钙前体溶液。
(3)将完全脱矿的骨胶原置于聚丙烯氯化铵稳定的磷酸钙矿化液中,37℃恒温下孵育14天,每天更换新鲜的聚丙烯氯化铵稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化骨胶原支架材料。
实施例3:
该实施例与实施例1不同之处在于:
(2)按800μg/ml的比例将聚丙烯氯化铵(平均分子量150kda)溶于磷酸钙溶液中,利用聚丙烯氯化铵对超饱和磷酸钙溶液的稳定作用,制得聚丙烯氯化铵稳定的无定型液相磷酸钙前体溶液。
(3)将完全脱矿的骨胶原置于聚丙烯氯化铵稳定的磷酸钙矿化液中,37℃恒温下孵育14天,每天更换新鲜的聚丙烯氯化铵稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化骨胶原支架材料。
实施例4:
该实施例与实施例1不同之处在于:
(2)按1.44%体积分数的比例将高分子量的聚乙烯亚胺(平均分子量70kda)粘稠液体与磷酸钙溶液混合,利用聚乙烯亚胺对超饱和磷酸钙溶液的稳定作用,制得稳定的聚乙烯亚胺稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚乙烯亚胺稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚乙烯亚胺稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例5:
该实施例与实施例1不同之处在于:
(2)按4.32%体积分数的比例将高分子量的聚乙烯亚胺(平均分子量70kda)粘稠液体与磷酸钙溶液混合,利用聚乙烯亚胺对超饱和磷酸钙溶液的稳定作用,制得稳定的聚乙烯亚胺稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚乙烯亚胺稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚乙烯亚胺稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例6:
该实施例与实施例1不同之处在于:
(2)按2.5%体积分数的比例将聚二烯丙基二甲基氯化铵(平均分子量100kda)与磷酸钙溶液混合,利用聚乙烯亚胺对超饱和磷酸钙溶液的稳定作用,制得稳定的聚乙烯亚胺稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚乙烯亚胺稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚乙烯亚胺稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例7:
该实施例与实施例1不同之处在于:
(2)按5%体积分数的比例将聚二烯丙基二甲基氯化铵(平均分子量100kda)与磷酸钙溶液混合,利用聚乙烯亚胺对超饱和磷酸钙溶液的稳定作用,制得稳定的聚乙烯亚胺稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚乙烯亚胺稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚乙烯亚胺稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例8:
该实施例与实施例1不同之处在于:
(2)按75μg/ml的比例将聚天冬氨酸(平均分子量50kda)溶于磷酸钙溶液中,利用聚天冬氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚天冬氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚天冬氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚天冬氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例9:
该实施例与实施例1不同之处在于:
(2)按200μg/ml的比例将聚天冬氨酸(平均分子量50kda)溶于磷酸钙溶液中,利用聚天冬氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚天冬氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚天冬氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚天冬氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例10:
该实施例与实施例1不同之处在于:
(2)按300μg/ml的比例将聚天冬氨酸(平均分子量50kda)溶于磷酸钙溶液中,利用聚天冬氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚天冬氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚天冬氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚天冬氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例11:
该实施例与实施例1不同之处在于:
(2)按50μg/ml的比例将高分子量的聚丙烯酸(平均分子量450kda)溶于磷酸钙溶液中,利用聚丙烯酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚丙烯酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚丙烯酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚丙烯酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例12:
(2)按500μg/ml的比例将高分子量的聚丙烯酸(平均分子量450kda)溶于磷酸钙溶液中,利用聚丙烯酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚丙烯酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚丙烯酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚丙烯酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例13:
(2)按1000μg/ml的比例将高分子量的聚丙烯酸(平均分子量450kda)溶于磷酸钙溶液中,利用聚丙烯酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚丙烯酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚丙烯酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚丙烯酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例14:
(2)按50μg/ml的比例将聚谷氨酸(平均分子量200kda)溶于磷酸钙溶液中,利用聚谷氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚谷氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚谷氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚谷氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例15:
(2)按500μg/ml的比例将聚谷氨酸(平均分子量200kda)溶于磷酸钙溶液中,利用聚谷氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚谷氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚谷氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚谷氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
实施例16:
(2)按1000μg/ml的比例将聚谷氨酸(平均分子量200kda)溶于磷酸钙溶液中,利用聚谷氨酸对超饱和磷酸钙溶液的稳定作用,制得稳定的聚谷氨酸稳定的磷酸钙矿化液;
(3)将胶原海绵置于聚谷氨酸稳定的磷酸钙矿化液中,37℃恒温下孵育7天,每天更换新鲜的聚谷氨酸稳定的磷酸钙矿化液,使用蒸馏水反复冲洗后,干燥备用,制得胶原纤维内仿生钙化材料。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施方式仅限于此,对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单的推演或替换,都应当视为属于本发明由所提交的权利要求书确定专利保护范围。
- 还没有人留言评论。精彩留言会获得点赞!