冬凌草甲素在制备抗心肌重构药物中的用途的制作方法
本发明涉及医药和细胞生物学技术领域,特别涉及冬凌草甲素在制备抗心肌重构药物中的用途。
背景技术:
心血管疾病是全球公共卫生的重大问题,据统计,2014年中国心血管病死亡率仍居各种疾病之首,高于肿瘤及其他疾病;随着诊疗水平提高,加上人口老龄化及国民心血管危险因素的普遍暴露,我国心血管病带病生存人群数量增加,心血管病负担持续快速加重,而现存心血管疾病的药物或介入治疗各有其弊端,亟待寻求新型防治心血管疾病的药物。
临床和基础研究均证实,心血管疾病进展中,心肌重构是心功能由代偿向失代偿演变,最终发生心力衰竭的基础与核心机制。心肌重构(cardiacremodeling,cr),是心脏为适应长期存在的损伤因素而做出的慢性代偿性改变。重构心肌从组织形态到功能代谢等均呈现异常,主要表现为:形态功能上,室壁厚度增加、僵硬且运动不协调,心泵功能减弱;细胞水平上,心肌细胞肥大、排列紊乱、核质比增加,细胞外基质中胶原过度沉积,间质纤维化;分子水平上,胚胎基因重新启动转录,代谢相关通路蛋白表达与磷酸化修饰水平改变。已有多组学的研究和动物实验证实,蛋白激酶b(pkb,又称akt),哺乳动物雷帕霉素靶蛋白(mtor)和糖原合成酶激酶-3β(gsk3β)等多个基因及其上下游通路与心肌重构发生发展有密切联系。目前临床应用的抗心肌重构药物多作用于降低交感神经兴奋性、抑制肾素-血管紧张素系统激活,但均不能完全阻断压力或神经体液负荷下的心肌重构。
冬凌草甲素(oridonin,ori),是从冬凌草等唇形科植物中提取出的天然二萜类化合物,其生物利用度高、性质稳定,有多种较便捷的提取方法,具有临床使用的潜在价值。目前关于冬凌草甲素的研究集中于其对多种肿瘤细胞的抗增殖和促凋亡作用:有防治胃癌的研究证实,冬凌草甲素通过细胞周期蛋白p53和半胱天冬蛋白酶-3(caspase-3)途径,发挥抗癌作用;有研究将冬凌草甲素应用于前列腺癌,发现其作用于天然免疫相关的信号通路,对前列腺癌起保护作用;bu等人在胰腺癌细胞相关研究中报道了冬凌草甲素通过丝氨酸-苏氨酸蛋白激酶(mapk)通路介导caspase激活,促进癌细胞凋亡。心肌细胞作为终末分化细胞,其细胞周期、代谢模式、信号转导通路与肿瘤细胞有很大区别,目前尚未有冬凌草甲素用于心肌重构药物的研究。
技术实现要素:
本发明所要解决的技术问题是针对上述现有技术存在的不足而提供冬凌草甲素在制备抗心肌重构药物中的用途,抑制压力过负荷引起的心肌细胞肥大、心肌间质纤维化,具有抗心肌重构效果显著、心脏毒性小等优点。
本发明为解决上述提出的问题所采用的技术方案为:
冬凌草甲素在制备抗心肌重构药物中的用途。冬凌草甲素的分子式c20h28o6,分子量364.44,结构如式1所示。
进一步地,冬凌草甲素在制备抗心肌重构药物中的用途中,冬凌草甲素应用于心肌细胞的安全剂量范围以对心肌细胞没有明显细胞毒性作用为原则。优选地,冬凌草甲素加入体外培养的心肌细胞的培养液中,抑制刺激条件下心肌细胞的肥大,所述的冬凌草甲素的药物浓度在5-50μm为安全剂量范围。
进一步地,冬凌草甲素在制备抗心肌重构药物中的用途中,冬凌草甲素在小鼠中的应用量按20-50mg/kg体重量灌胃给药。
本发明公开了冬凌草甲素在制备抗心肌重构药物中的用途,后续具体实施例方式中主要以野生型c57小鼠为实验对象,通过主动脉缩窄术建立心肌重构模型,冬凌草甲素灌胃给药进行干预,来验证冬凌草甲素在治疗心肌重构中的用途。结果证实,中药提取物冬凌草甲素可以抑制压力负荷诱导的心肌肥大和心肌纤维化:与c57小鼠不加药相比,冬凌草甲素给药组小鼠心重/体重比下降,心肌肥大标志物转录水平降低;间质胶原纤维沉积减少;心功能损伤程度减轻;心肌重构相关的akt/mtor通路蛋白磷酸化水平下降。因此,冬凌草甲素可对心肌重构起保护作用,可用于制备防治心肌重构的药物。
在此基础上,本发明还提供一种抗心肌重构药物,其包含冬凌草甲素,可以为仅含冬凌草甲的单一组分药物,也可以为含冬凌草甲素的药物组合物。其中,含冬凌草甲素的药物组合物包括冬凌草甲素,以及与冬凌草甲素同时施用后对治疗心肌重构有积极作用的药物成分和/或使冬凌草甲素稳定性提高的药学上可接受的成分和/或制药学上可接受的辅助成分。
进一步地,本发明所提供的抗心肌重构药物,其剂型可以为粉剂、颗粒剂、片剂、胶囊剂、丸剂、溶液、悬浮液或注射液等。
与现有技术相比,本发明的有益效果是:
1、本发明提出冬凌草甲素可减轻心肌重构,对心肌重构起保护作用,防止心功能恶化,并为心肌重构的防治提供更多有靶点针对性的治疗药物提供了可能。
2、本发明提供了冬凌草甲素在制备抗心肌重构药物中的新的药用用途,冬凌草甲素可以抑制或者延缓压力负荷引起的心肌细胞肥大、心肌间质纤维化,具有抗心肌重构效果显著、用药量少、心脏毒性小等优点。
附图说明
图1是实施例1中不加药对照组和②-⑥组减去相应空白对照后的细胞活力检测结果,即应用细胞计数试剂盒检测细胞活力,测得产物450nm吸光度值,计算得到存活细胞百分比。
图2是实施例2中离体心肌细胞肥大结果。其中,a、b分别为免疫荧光图和细胞面积图;c为细胞肥大标志物anp、bnp、β-mhc转录水平图。
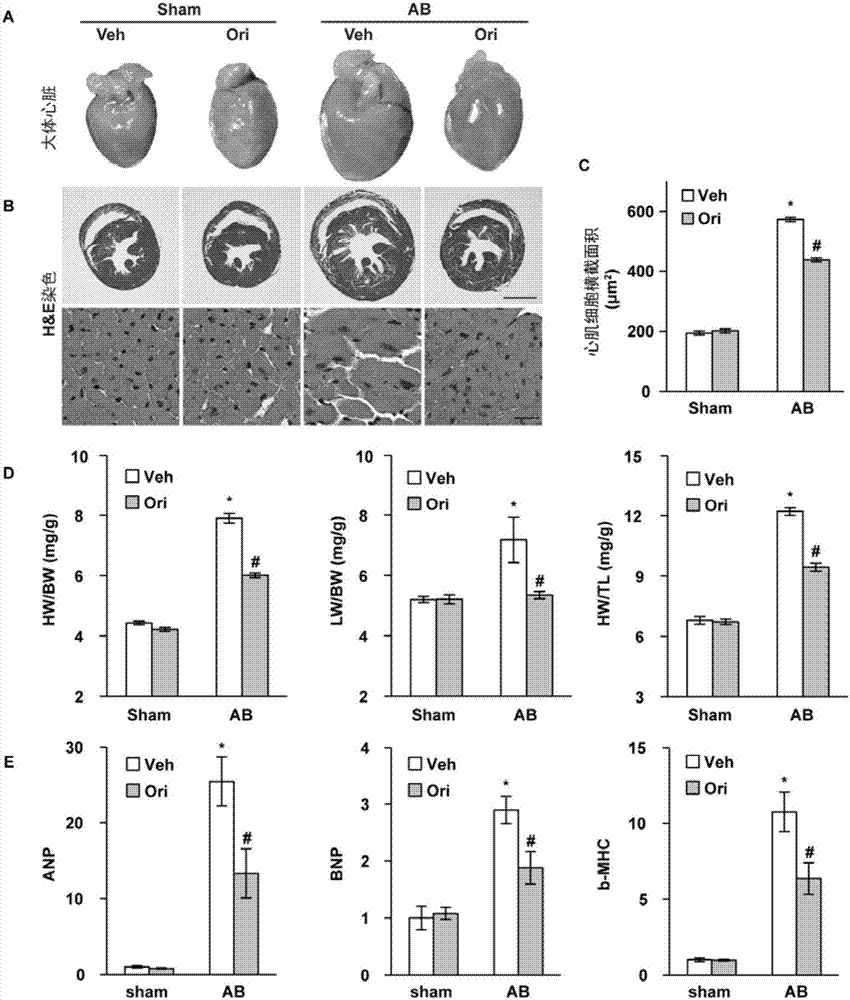
图3是实施例3中在体心肌肥厚结果。c57小鼠行主动脉弓缩窄手术(ab手术)或假手术组(sham),灌胃给予冬凌草甲素溶液或0.1%dmso生理盐水后,心脏大体形态拍照(图3a)、he染色拍照(图3b)、心肌细胞横截面积统计(图3c);心重/体重比(hw/bw)、肺重/体重比(lw/bw)及心重/胫骨长度比(hw/tl)统计(图3d);心肌肥厚标志物anp、bnp、β-mhc转录水平统计(图3e)。
图4是实施例4中在体心肌纤维化结果。c57小鼠行主动脉弓缩窄手术(ab手术)或假手术,灌胃给予冬凌草甲素溶液或0.1%dmso生理盐水后,心脏psr染色拍照(图4a)、心肌间质胶原容积分数统计(图4b),纤维胶原分泌标志物collageniα、collageniiiα和ctgf转录水平统计(图4c)。
图5是实施例5中心功能检测结果。c57小鼠行主动脉弓缩窄手术(ab手术)或假手术,灌胃给予冬凌草甲素溶液或0.1%dmso生理盐水后,左心室舒张期内径、收缩期内径、左室射血分数、短轴缩短率统计。
图6是实施例6中akt信号通路westernblot检测图和荧光数值统计。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明不仅仅局限于下面的实施例。
下述实施例中,体外心肌细胞培养、动物饲养、药物来源、配置、给药方式具体采用如下方式,但是并仅限于下述方式。
体外心肌细胞培养:离体实验选用原代sd乳鼠心肌细胞,胰酶(gibco25200)消化贴壁后,用含有15%胎牛血清(fbs,hyclonesv30087)的dmem/f-12培养基(gibco11330)培养于37℃,5%二氧化碳培养箱。
动物饲养:在体实验选用8-10周龄、体重在23.5-27.5g,雄性c57bl/6小鼠(购自北京华阜康生物科技有限公司)(简称c57小鼠),饲养于武汉大学心血管病研究所实验动物中心。饲养环境spf级,设独立进回风净化笼具(individalventilationcages,ivc),恒温(22±2℃)恒湿(55±15%),每12小时明暗交替,每5只小鼠一笼,进食钴-60照射灭菌标准鼠饲料,饮用高压灭菌水,小鼠自由进食、水。
药物来源:药物冬凌草甲素购自上海融禾医药科技发展有限公司,批号160427,纯度>98%。离体实验的体外心肌细胞用药时,冬凌草甲素溶于二甲基亚砜(dimethylsulfoxide,dmso,sigmad2650)和细胞培养基,配成10mm储存液,分装保存于-20℃待用;在体实验的小鼠用药时,冬凌草甲素溶液的浓度为5mg/ml,溶于0.1%dmso生理盐水,现用现配。
药物配置:离体实验的体外心肌细胞用药时,取0.5-5μl的10mm冬凌草甲素储存液溶于1ml细胞培养基,即药物冬凌草甲素在其中的终浓度5-50μm,给药时间24小时。
给药方式:在体实验的小鼠灌胃给药,按40mg/kg体重量给药,以每只小鼠平均25g体重计算,一次灌胃配置好的冬凌草甲素溶液约为0.2ml×小鼠只数,术后第四天开始给药,每天一次,持续4周。
实施例1冬凌草甲素对离体心肌细胞毒性检测
(1)原代心肌细胞培养
出生3天内的sd乳鼠用75%酒精消毒,在超净工作台开胸取出心脏,用dmem/f12培养基清洗后剪成1-2mm3的碎片,加入稀释的胰酶消化液8ml,于磁力搅拌器上水浴加热、转速150rpm,消化15分钟,静止数秒弃去上含杂质的清液,之后重复消化步骤并吸取心肌细胞消化液,加入预冷的含20%fbs的dmem/f12培养基中,重复消化4-5次,收集好的心肌细胞悬液。
将收集好的心肌细胞悬液以1500rpm离心8分钟,弃上清液并加入适量培养基重悬细胞,然后经40μm滤网过滤后接种在1-2个100mm的培养皿中进行差时贴壁,90分钟后吸取未贴壁的心肌细胞悬液过滤,台盼蓝拒染法计数并调整心肌细胞浓度为2.5~3×105个/ml,加入5-溴脱氧尿嘧啶核苷(brdu,终浓度0.1mm)抑制非心肌细胞生长。
将上述培养皿中的心肌细胞接种到96孔板中,每孔100μl含5000个心肌细胞,置37℃,5%二氧化碳培养箱,孵育48小时,pbs清洗并更换培养基。
(2)心肌细胞加药和计数
本实施例对于上述步骤(1)体外分离、培养了sd乳鼠心肌细胞,细胞培养基中加入冬凌草甲素溶液对该sd乳鼠心肌细胞培养24小时,其中冬凌草甲素在细胞培养基中的药物最终浓度分别为5μm、20μm、50μm、100μm和200μm,并设置不加药对照组,并分别设置空白对照组,每组6孔。具体检测分组设置如下:
①不加药对照组,即细胞培养基中对sd乳鼠心肌细胞培养24小时,(记作veh);
②冬凌草甲素5μm组,即冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为5μm,对sd乳鼠心肌细胞培养24小时,记作ori5μm;
③冬凌草甲素20μμm组,即冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为20μm,对sd乳鼠心肌细胞培养24小时,记作ori20μm;
④冬凌草甲素50μm组,即冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为50μm,对sd乳鼠心肌细胞培养24小时,记作ori50μm;
⑤冬凌草甲素100μm组,即冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为100μm,对sd乳鼠心肌细胞培养24小时,记作ori100μm;
⑥冬凌草甲素200μm组,即冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为200μm,对sd乳鼠心肌细胞培养24小时,记作ori200μm;
⑦用细胞培养液作空白对照组,依据②-⑥组中冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度,向细胞培养基中加入对应量的冬凌草甲素溶液,培养24小时。
上述各组中每孔加入10微升wst-8法细胞计数试剂(cellcountingkit-8,cck-8,碧云天c0038),在细胞培养箱内孵育1小时,用酶标仪测定各组450nm吸光度(opticaldensity,od)值,统计各组减去相应的空白对照的od值,设不加药对照组细胞为全部存活,计算各组细胞存活百分比。结果如图1所示。
由图1可知:冬凌草甲素在培养sd乳鼠心肌细胞的细胞培养基中的最终浓度为5μm-50μm时,细胞活力与不加药对照组相比没有明显差异,直至冬凌草甲素的药物浓度达100μm以上,细胞活性开始下降(图1),说明冬凌草甲素100μm以内是其作用于细胞的安全浓度。因此,本实施例通过检测细胞活力和进行毒性分析,明确了冬凌草甲素应用于心肌细胞的安全剂量范围5-50μm(*:p<0.05vscontrol组)。
实施例2冬凌草甲素对离体心肌细胞肥大的影响
心肌重构在细胞水平表现为心肌细胞的体积增大,而细胞体积增大主要源于各种因素造成的肥厚相关基因的转录异常。离体乳鼠心肌细胞可一定程度代表在体细胞的病理生理变化;angii是心脏遭受长期过度压力负荷、肾素-血管紧张素系统激活时的主要神经体液刺激因素。用angii刺激离体心肌细胞可以较好模拟在体心肌重构的过程,用于观察冬凌草甲素对压力负荷下心肌细胞重构的保护作用。本实施例具体模拟与证实过程如下:
(1)原代心肌细胞培养
同实施例1,心肌细胞接种到6孔板和置有细胞爬片的24孔板中。
(2)血管紧张素ⅱ刺激心肌细胞和冬凌草甲素给药干预
依据实施例1所述的药物安全剂量,原代心肌细胞随机分为5组,①加pbs不加药对照组(veh);②血管紧张素ii刺激组(angii);③血管紧张素ii加冬凌草甲素5μm组(angii+ori5μm);④血管紧张素ii加冬凌草甲素20μm组(angii+ori20μm);⑤血管紧张素ii加冬凌草甲素50μm组(angii+ori50μm)。上述5组,孵育24小时,其中,涉及到血管紧张素ii的,均采用1μm血管紧张素ii(angiotensinii,angⅱ,sigmaa9525)刺激;加pbs不加药对照组加入相应量的pbs缓冲液而不添加冬凌草甲素;涉及到添加冬凌草素的,需添加冬凌草甲素储存液至冬凌草甲素的浓度分别为5μm、20μm、50μm。
(3)心肌细胞免疫荧光染色观察细胞面积
经过步骤(1、2)处理所得的细胞爬片用pbs清洗后多聚甲醛固定,pbs漂洗并用0.5%tritonx-100通透;3%牛血清白蛋白(bovineserumalbumin,bsa)室温封闭;3%bsa稀释anti-α-actinin(millipore05-384)一抗并滴加于爬片,4℃孵育过夜;pbs稀释alexa
通过在荧光显微镜下观察,由图2a、图2b可知:血管紧张素ⅱ刺激24h后的心肌细胞面积明显大于pbs组,心肌细胞明显肥大,而加入冬凌草甲素的心肌细胞肥大则显著减小,细胞增大受到抑制,细胞面积减小;心肌细胞所处环境中,冬凌草甲素的浓度为20μm时,对细胞肥大的抑制程度大于5μm,而当培养基中冬凌草甲素浓度增至50μm,对心肌肥大的抑制作用未见进一步增加(*:p<0.05vspbs组,#:p<0.05vsangⅱ组,**:剂量间差异p<0.05)。这说明对于心肌细胞而言,其培养环境中冬凌草甲素5μm的浓度即可对压力过负荷时,内分泌体液因素造成的心肌细胞肥大产生有效抑制作用;其抑制作用在5μm-20μm剂量范围内呈现一定的浓度依赖效应。
(4)实时定量pcr检测心肌细胞肥厚标志物
经过步骤(1、2)处理所得的心肌细胞提取总rna,逆转录为cdna,用实时定量pcr(realtimepcr,rt-pcr)仪(rochelightcycler480ii)检测心肌细胞中心房钠尿肽(atrialnatriureticpeptide,anp)、脑型钠尿肽(brainnatriureticpeptide,bnp)和β型肌球蛋白重链(β-myosinheavychain,β-mhc)的mrna水平。所用引物如下:
如图3c所示,相对于血管紧张素ii刺激组(angii),加入冬凌草甲素的组中,angⅱ刺激造成的心肌细胞anp、bnp、β-mhc转录升高受到抑制,细胞肥大标志物anp、bnp、β-mhc转录水平下降(*:p<0.05vspbs组,#:p<0.05vsangⅱ组,**:剂量间差异p<0.05);培养环境中冬凌草甲素的浓度为20μm时,对肥厚标志物anp、bnp的抑制程度大于5μm,说明培养环境中冬凌草甲素浓度为5μm足以在转录水平抑制心肌肥厚的发生发展,即对致重构刺激下的离体心肌细胞发挥了较好的保护作用,且在5μm-20μm剂量范围内呈现一定的浓度依赖效应,为进一步在体实验药物作用提供了基础。
实施例3在体应用冬凌草甲素对压力过负荷造成的心肌肥厚的影响
(1)小鼠压力过负荷心肌重构模型的建立和冬凌草甲素给药
以胸主动脉缩窄术,建立压力负荷诱导心肌重构模型。将8-10周龄、体重在23.5-27.5g,雄性c57小鼠纳入实验,随机分为4组,每组10-12只小鼠,具体如下:
①假手术不加药组(shamveh),
②假手术冬凌草甲素给药组(shamori);
③ab手术不加药组(abveh),
④ab手术冬凌草甲素给药组(abori)。
其中,ab手术组(包括ab手术不加药组、ab手术冬凌草甲素给药组)中,小鼠麻醉、备皮、行无创气管插管并连接呼吸机,右侧卧位固定,沿第2-3肋间水平开胸游离胸主动脉,将7-0手术缝线穿过主动脉下方,将去尖的27号针头平行于主动脉置于缝线上,连同主动脉和针头一起牢固结扎,然后立即抽出针头,造成主动脉70%狭窄后抽出胸腔气体关胸;假手术组(包括假手术不加药组、假手术冬凌草甲素给药组)只挂线不结扎。术后观察小鼠及时苏醒、基本生命体征、进食和活动状况正常。
术后第四天起,分别向假手术组和ab手术组中的冬凌草甲素给药组小鼠灌胃给冬凌草甲素溶液,冬凌草甲素溶液浓度为5mg/ml,以0.1%dmso生理盐水溶适量冬凌草甲素粉末;小鼠称重,按40mg/kg体重量给药,每只小鼠灌胃冬凌草甲素灌胃液约0.2毫升,每天灌胃给药一次,持续给药4周;术后第四天起,分别向假手术组和ab手术组中的不加药组小鼠灌等量0.1%dmso生理盐水,每天灌胃一次,持续4周。
(2)小鼠心脏取材,组织形态水平评价小鼠心肌肥厚
首先,4周后,假手术组、ab手术组的小鼠称量体重后处死取心脏,挤血后称心脏重量(mg);剪下完整肺脏除去液体,称量肺重量(mg);暴露一侧胫骨的两端,测量胫骨长度(cm)。
其次,取小鼠心脏置于体积分数10%甲醛中固定48小时,拍大体照片;修剪心脏并置于包埋框中脱水处理、透明、浸蜡包埋,制作病理切片并烘烤备用。
苏木素-伊红(he)染色检测细胞面积:切片在二甲苯中脱蜡,100%-70%梯度酒精水合,水洗后染苏木素染液(珠海贝索,ba-4041),1%盐酸酒精分色,scott液蓝化,染伊红染液(珠海贝索,ba-4024),蒸馏水洗去浮色,70%-100%梯度酒精脱水,二甲苯透明后立即封片,通风橱内吹干后显微镜拍照。he染色拍照图统计细胞横截面积:每张图片选择6个以上边界清楚、核大致位于中央的细胞,用image-proplus6.0软件计算细胞面积。
如图3所示,c57小鼠行主动脉弓缩窄手术(ab手术组)或假手术组,灌胃给予冬凌草甲素溶液或0.1%dmso生理盐水后,心脏大体形态拍照(图3a)、he染色拍照(图3b)、心肌细胞横截面积统计(图3c);心重/体重比(hw/bw)、肺重/体重比(lw/bw)及心重/胫骨长度比(hw/tl)统计(图3d);心肌肥厚标志物anp、bnp、β-mhc转录水平统计(图3e)。
由图3可知:与心脏大体形态拍照所见(图3a)相似,he染色拍照可见,假手术给药组的心肌细胞与假手术未给药组相比,细胞面积和形态无明显变化。ab手术组中的不加药组心肌细胞横截面积明显增大,而冬凌草甲素给药组的心肌细胞肥大程度减轻;且ab手术组中的不加药组肌丝排列紊乱、松散,心肌细胞形态不规整,胞核增大,核仁模糊,冬凌草甲素给药组的心肌细胞排列较不加药组整齐、致密,形态较完整,胞核及核仁结构未明显改变(图3b)。心肌细胞面积统计结果统计学差异显著(*:p<0.05vsveh组,#:p<0.05vsab组)(图3c),证实冬凌草甲素给药能够明显降低ab术造成的细胞层面的心肌肥厚。
统计各组小鼠心重/体重比(hw/bw)、肺重/体重比(lw/bw)和心重/胫骨长度比(hw/tl),结果如图3d所示,假手术组中给药组与未加药组相比,上述指标无明显变化,而ab手术组中给药组比未加药组相比,心重、肺重降低(*:p<0.05vsveh组,#:p<0.05vsab组),证实冬凌草甲素给药能够明显降低ab术造成的心重增加。
(3)小鼠心肌肥厚标志物转录检测
小鼠心脏组织研磨提取总rna,逆转录为cdna,同前,用实时定量pcr检测小鼠心脏中anp、bnp和β-mhc的mrna水平。所用引物如下:
如图3e所示,ab手术组中,不加药组造成anp、bnp、β-mhc转录水平均明显升高,而冬凌草甲素给药组中,上述肥厚标志物的转录受到不同程度的抑制。
心肌重构在大体形态上多表现为心脏体积的增大,左心室重量增加,左心室壁厚度增加;心肌细胞是终末分化细胞,不进行有丝分裂增殖数量,在各种生理或病理性促增殖刺激或损伤下,主要发生细胞肥大:心肌细胞体积增大、肌节数量增多、排列紊乱;小鼠的胸主动脉结扎术是国际上常用的研究心肌重构的在体动物模型。在长期过当压力负荷刺激下,心肌从大体组织形态到细胞发生上述恶化改变,而冬凌草甲素灌胃可以改善组织病理水平和基因转录水平的心肌重构。
实施例4在体应用冬凌草甲素对ab手术造成的心脏纤维化的影响
(1)小鼠压力过负荷心肌重构模型的建立和冬凌草甲素给药
同实施例3。
(2)小鼠心脏取材和组织形态水平评价小鼠心脏纤维化
小鼠心脏取材同实施例3。
天狼星红(psr)染色检测胶原容积分数:小鼠心脏取材、固定、脱水、包埋、切片后,二甲苯脱蜡,梯度酒精水合,0.2%磷钼酸处理后用0.1%天狼猩红苦味酸溶液染色90分钟,0.01n盐酸4次,梯度酒精脱水,二甲苯透明后立即封片,通风橱内吹干后显微镜拍照。psr染色拍照图统计(image-proplus6.0软件),计算胶原容积分数=胶原面积/(总面积-空白面积)×100%。
如图4a、b所示,ab手术组中,不加药的小鼠心肌间质胶原含量增加,血管周围胶原增加更明显,且胶原增粗,排列紊乱;而冬凌草甲素给药组中,冬凌草甲素抑制压力过负荷造成的心肌间质胶原沉积与分泌(*:p<0.05vsveh组,#:p<0.05vsab组),间质和血管周纤维染色面积均减少。
(3)小鼠心脏纤维化标志物转录检测
同实施例3,用实时定量pcr检测小鼠心脏中一型胶原(collageniα)、三型胶原(collageniii)和结缔组织生长因子(connectivetissuegrowthfactor,ctgf)的mrna水平。所用引物如下:
如图4c所示,ab手术组中,冬凌草甲素给药后,成纤维细胞的增殖标志ctgf和分泌型胶原collageniα、collageniii的转录均被冬凌草甲素抑制;与不加药相比,冬凌草甲素抑制压力过负荷造成的心脏成纤维细胞过度增殖与胶原沉积。
心脏组织主要由心肌细胞和间质组成,在损伤或病理生理刺激下,除发生细胞肥大,还出现间质纤维化。发生纤维化的心脏间质中,成纤维细胞增殖并转化,胶原分泌增加,各型胶原比例平衡失调,胶原沉积降解失平衡,最终胶原纤维过度沉积、密度增加。苦味酸-天狼猩红染色可在组织形态学上进行纤维化评价;rt-pcr对纤维化标志物和分泌型胶原的转录进行检测。
实施例5在体应用冬凌草甲素对心功能的影响
(1)小鼠压力负荷心肌重构模型的建立和冬凌草甲素给药
同实施例3。
(2)超声心动图检测心功能
设置高频超声诊断仪(天津成信公司)参数;小鼠称重并记录,心前区备皮,固定于麻醉面罩,以1.5%-2.5%异氟烷吸入麻醉,取左侧卧位,心前区均匀涂抹超声耦合剂,选取标准左心室乳头肌短轴切面,测量左室舒张末期内径、左室收缩末期内径、左室射血分数及短轴缩短率等。
上述检测结果经统计分析得出,如图5所示,ab手术组中,冬凌草甲素用药后,左心室舒张期内径、收缩期内径的增大不及ab手术组中的不加药明显,左室射血分数在给药组有一定程度保留、短轴缩短率下降不明显。结果表明,与ab手术组中的不加药相比,冬凌草甲素抑制压力负荷造成的左室内径增大,维持左室射血分数水平,维持短轴缩短率(*:p<0.05vsveh组,#:p<0.05vsab组)。
压力负荷造成的心肌重构发生发展中,左心室重量增加,左心室壁厚度增加,心肌细胞排列紊乱,心室壁僵硬且运动不协调。在超声心动图检测中,可见左室舒张期、收缩期内径均增大,反映左心输出功能的左室射血分数、短轴缩短率下降。因此,本实施例证实冬凌草甲素用药后,心肌肥厚改善、心功能得以一定程度保留。
实施例6在体应用冬凌草甲素对akt激酶相关通路的影响
(1)小鼠压力负荷诱导心肌重构模型的建立和冬凌草甲素给药
同实施例3。
(2)免疫印迹法检测心肌重构相关通路蛋白表达
小鼠心脏组织研磨提取总蛋白,bca(thermo23227)法蛋白定量,sds-page-westernblot免疫印迹法检测akt信号通路磷酸化蛋白和总蛋白表达量。所用一抗抗体如下(“p-”表示磷酸化蛋白,“t-”表示总蛋白):
结果如图6所示,可知:ab手术组中,akt/mtor信号通路蛋白磷酸化激活;冬凌草甲素用药后,介导心肌重构的蛋白akt及其下游gsk3β、mtor的蛋白磷酸化水平下降,mtor下游的重构相关蛋白p70s6k、eif-4e蛋白磷酸化水平下降(“p-”表示磷酸化蛋白,“t-”表示总蛋白;*:p<0.05vsveh组,#:p<0.05vsab组)。上述总蛋白的水平在各组间无明显差异。也就是说,主动脉弓缩窄手术显著促进akt/mtor、gsk3β、p70s6k、eif-4e信号通路,冬凌草甲素给药后抑制akt/mtor、gsk3β、p70s6k、eif-4e信号通路。
akt是和细胞增殖与凋亡密切相关的调节因子,可受多个位点磷酸化修饰的调控,活化的akt进一步通过磷酸化作用激活其下游底物如gsk3β和mtor;mtor可对生长因子、胰岛素、肾上腺素、血管紧张素等多种细胞外刺激产生应答,进而通过磷酸化蛋白翻译过程中的某些调节因子,参与多项细胞功能:其中研究比较集中的是p70s6k和eif-4e,它们通过控制细胞生长、增殖以及代谢相关的蛋白的转录翻译与修饰,导致心肌代谢障碍、肥厚性生长直至功能恶化。
由以上实施例可知,冬凌草甲素应用于心肌细胞有较大的安全剂量范围,在体和离体应用冬凌草甲素可显著抑制心肌肥厚,冬凌草甲素能防治心脏纤维化发生发展,保护心功能,冬凌草甲素对心肌重构的保护是通过akt/mtor信号通路发挥作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
<110>武汉大学
<120>冬凌草甲素在制备抗心肌重构药物中的用途
<160>22
<210>1
<211>20
<212>rna
<213>artificialsequence
<220>
<223>r-gapdh-forward
<400>1
gacatgccgcctggagaaac20
<210>2
<211>20
<212>rna
<213>artificialsequence
<220>
<223>r-gapdh-reverse
<400>2
agcccaggatgccctttagt20
<210>3
<211>24
<212>rna
<213>artificialsequence
<220>
<223>r-anp-forward
<400>3
aaagcaaactgagggctctgctcg24
<210>4
<211>22
<212>rna
<213>artificialsequence
<220>
<223>r-anp-reverse
<400>4
ttcggtaccggaagctgttgca22
<210>5
<211>22
<212>rna
<213>artificialsequence
<220>
<223>r-bnp-forward
<400>5
ttccttaatctgtcgccgctgg22
<210>6
<211>22
<212>rna
<213>artificialsequence
<220>
<223>r-bnp-reverse
<400>6
cagcagcttctgcatcgtggat22
<210>7
<211>20
<212>rna
<213>artificialsequence
<220>
<223>r-βmhc-forward
<400>7
tctggacagctccccattct20
<210>8
<211>22
<212>rna
<213>artificialsequence
<220>
<223>r-βmhc-reverse
<400>8
caaggctaacctggagaagatg22
<210>9
<211>20
<212>rna
<213>artificialsequence
<220>
<223>m-gapdh-foward
<400>9
actccactcacggcaaattc20
<210>10
<211>20
<212>rna
<213>artificialsequence
<220>
m-gapdh-reverse
<400>10
tctccatggtggtgaagaca20
<210>11
<211>20
<212>rna
<213>artificialsequence
<220>
<223>m-anp-foward
<400>11
acctgctagaccacctggag20
<210>12
<211>25
<212>rna
<213>artificialsequence
<220>
<223>m-anp-reverse
<400>12
ccttggctgttatcttcggtaccgg25
<210>13
<211>21
<212>rna
<213>artificialsequence
<220>
<223>m-bnp-foward
<400>13
gaggtcactcctatcctctgg21
<210>14
<211>22
<212>rna
<213>artificialsequence
<220>
<223>m-bnp-reverse
<400>14
gccatttcctccgacttttctc22
<210>15
<211>19
<212>rna
<213>artificialsequence
<220>
<223>m-βmhc-foward
<400>15
ccgagtcccaggtcaacaa19
<210>16
<211>19
<212>rna
<213>artificialsequence
<220>
<223>m-βmhc-reverse
<400>16
cttcacgggcacccttgga19
<210>17
<211>20
<212>rna
<213>artificialsequence
<220>
<223>m-collageniα-foward
<400>19
aggcttcagtggtttggatg20
<210>18
<211>20
<212>rna
<213>artificialsequence
<220>
<223>m-collageniα-reverse
<400>18
caccaacagcaccatcgtta20
<210>19
<211>20
<212>rna
<213>artificialsequence
<220>
<223>m-collageniii-foward
<400>19
cccaacccagagatcccatt20
<210>20
<211>22
<212>rna
<213>artificialsequence
<220>
<223>m-collageniii-reverse
<400>20
gaagcacaggagcaggtgtaga22
<210>21
<211>18
<212>rna
<213>artificialsequence
<220>
<223>m-ctgf-foward
<400>21
tgacccctgcgacccaca18
<210>22
<211>24
<212>rna
<213>artificialsequence
<220>
<223>m-ctgf-reverse
<400>22
tacaccgacccaccgaagacacag24
- 还没有人留言评论。精彩留言会获得点赞!