一种伊曲康唑复合微粒的制备方法与流程
本发明涉及一种伊曲康唑复合微粒的制备方法。
背景技术:
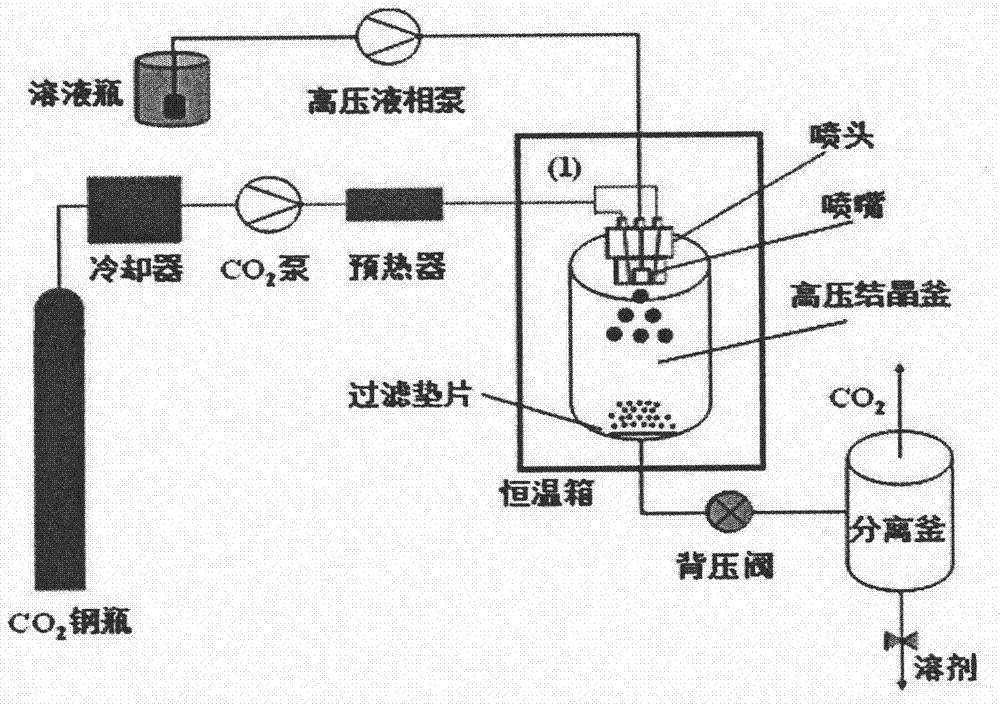
:伊曲康唑为三唑类的抗真菌药,伊曲康唑具有强亲脂性,极难溶于水,在中性ph值下其水溶液的饱和溶解度<1ng/ml,在ph=1的盐酸溶液中饱和溶解度为6μg/ml,其口服生物利用度由药物在胃肠道中的溶解速率决定。由于伊曲康唑难溶于水,使得其在胃肠道中的溶解速率小,口服生物利用度低。斯皮仁诺(sporanox,主要成分为伊曲康唑)注射液、口服液和胶囊是目前商品化的伊曲康唑制剂。注射液和口服液通过将伊曲康唑与2-羟丙基-β-环糊精络合增加其溶解性,但是2-羟丙基-β-环糊精主要经过肾脏消除,所以对于严重肾功能障碍的患者,其消除时间会大幅延长,可能导致蓄积中毒。cn201510057090.2公开了一种运用超临界流体结晶技术制备伊曲康唑高效制剂的方法,该方法包括下列四个步骤:1)混合溶液的配制:在伊曲康唑和占伊曲康唑质量百分比42.8%、25%、18.2%、50%的l-抗坏血酸的混合物中加入甲醇和二氯甲烷的混合溶剂,溶解后,加入羟丙甲纤维素及普朗尼克f-127,再加入二氯甲烷,使完全溶解;2)co2进料:将钢瓶内的co2通过压力调节阀输入超临界流体结晶设备体系的高压结晶釜内;3)复合微粒析出:将步骤1)得到的溶液经超临界流体结晶设备体系的喷嘴喷入高压结晶釜内,复合微粒从溶液中析出并收集于高压结晶釜的底部;4)将得到的复合微粒装胶囊。超临界流体结晶技术使伊曲康唑与高分子辅料形成微米级复合微粒,保证了药物的溶解度,而提高药物的生物利用度和疗效,并避免使用2-羟丙基-β-环糊精,减小药物的毒副作用。但cn201510057090.2中使用了l-抗坏血酸和普朗尼克f-127,l-抗坏血酸在二氯甲烷/甲醇溶解性很差,制备过程中易造成进样管路堵塞;且l-抗坏血酸易被氧化变性,不利于产品的储存。f-127作为新型的高分子非离子表面活性剂,价格高且不宜过量使用。使用甲醇作为溶剂,需严格控制残留,也不利于生产放大。技术实现要素:本发明要解决的技术问题是提供一种适合工业化生产,成分安全的伊曲康唑复合微粒。为解决上述技术问题,本发明公开了一种伊曲康唑复合微粒的制备方法,其通过超临界流体结晶设备体系制备,所述复合微粒由重量百分比为30-60%的伊曲康唑与30%-60%的羟丙甲纤维素及0%-20%的聚乙二醇6000溶于二氯甲烷/乙醇的混合溶剂,超临界流体结晶析出制备。制备过程包括如下步骤:1)混合溶液的配制:在伊曲康唑和羟丙甲纤维素及聚乙二醇6000的混合物中加入乙醇/二氯甲烷的混合溶剂,完全溶解;2)co2进料:液化co2由高压泵经对称的两个通道与溶液通道成45°或60°连续引入超临界流体结晶设备体系的高压结晶釜内,通过加热装置和压力调节阀调控釜内温度和压力,使釜内co2达到超临界状态;3)溶液进样:通过中间溶液通道先通入乙醇/二氯甲烷的混合溶剂,体系达到平衡后,将混合溶剂更换为步骤1)配置的溶液连续进样,溶剂快速与超临界co2充分混合并经釜底流出回收,形成的溶质颗粒沉降于结晶釜底部;4)干燥:进样结束后,继续通入co210-40min以除去残留的有机溶剂,随后泄压,收集高压釜内样品。伊曲康唑与羟丙甲纤维素及聚乙二醇6000的重量百分比优选30%∶55%∶15%,浓度优选25mg/ml;混合溶剂乙醇/二氯甲烷的体积比优选1∶1;co2流率优选50-100ml/min,压力为90-200bar,温度30-70℃,更优选co2流率为50ml/min压力为110bar,温度50℃,溶液流速为1ml/min。本发明公开的伊曲康唑复合微粒可直接压片制备成伊曲康唑分散片,或用于灌装胶囊,或制备成干混悬剂、吸入剂等其他剂型。本发明所使用的辅料羟丙甲纤维素和聚乙二醇均为商品化的伊曲康唑制剂斯皮仁诺配方中的辅料,已经充分验证与伊曲康唑无相容性问题,组方安全稳定有效,制备过程中不使用甲醇,更易于生产放大;我们使用的喷头为3通道,溶液从中间通道经过喷嘴(50-800微米)喷入结晶釜内,co2经对称的两个通道与溶液通道成45°或60°喷入。相比传统的超临界反溶剂技术,溶液和co2成90°角喷入,该改进更利于溶液的分散,及与co2的均匀混合;同时溶液在喷嘴外与co2混合,改善co2和溶液由同一通道喷入釜内造成的喷嘴堵塞;本发明所公开的伊曲康唑复合微粒的制备方法单位时间产率更高,而且得到产品的分散性更好,制备得到的伊曲康唑制剂与伊曲康唑胶囊相似因子>50,符合一致性评价要求。附图说明图1为超临界流体结晶设备的示意图;图2为伊曲康唑原料药的电子显微镜扫描图谱;图3为复合微粒的电子显微镜扫描图谱;图4为伊曲康唑原料药x-粉末衍射图谱;图5为复合微粒的x-粉末衍射图谱;图6为市售斯皮仁诺胶囊和复合微粒制剂溶出曲线。具体实施方式以下通过具体实施例再对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅局限于以下的实例。在不脱离本发明上述技术思想的情况下,根据本领域普通技术知识和惯用手段做出的各种替换或变更,均应包括在本发明的范围内。实施例1处方:物料组成处方配比(%)伊曲康唑35羟丙甲纤维素50聚乙二醇600015制备方法:1)混合溶液的配制:准确称取1.75g伊曲康唑和2.50g羟丙甲纤维素及0.75g聚乙二醇6000的混合物置于500ml锥形瓶中,加入200ml乙醇和二氯甲烷的混合溶剂(体积比1∶2),使完全溶解;2)co2进料:如图1所示,打开co2钢瓶阀门,液化co2由高压泵经釜头对称的两个通道(与中间溶液通道成60o)连续引入超临界流体结晶设备体系的高压结晶釜内,控制流速50ml/min;3)调控温度和压力:通过调节图1所示背压阀,控制高压结晶釜内压力为11mpa,并通过预热器和恒温箱控制釜内温度为50℃,使釜内co2达到超临界状态;4)溶液进样:如图1所示,打开高压液相泵,将步骤1配置的溶液由釜头的中间通道经100μm的喷嘴喷入结晶釜内。通入溶液前,先通入15min的乙醇和二氯甲烷的混合溶剂(体积比1∶2),使体系达到平衡。进样流率控制为1ml/min;5)干燥:进样结束后,继续通入co220min以除去残留的有机溶剂;6)泄压,收集高压釜内样品。实施例2处方:物料组成处方配比(%)伊曲康唑40羟丙甲纤维素50聚乙二醇600010制备方法:1)混合溶液的配制:准确称取1.6g伊曲康唑和2.0g羟丙甲纤维素及0.4g聚乙二醇6000的混合物置于500ml锥形瓶中,加入200ml乙醇和二氯甲烷的混合溶剂(体积比1∶1),使完全溶解;2)co2进料:如图1所示,打开co2钢瓶阀门,液化co2由高压泵经釜头对称的两个通道(与中间溶液通道成45°)连续引入超临界流体结晶设备体系的高压结晶釜内,控制流速75ml/min;3)调控温度和压力:通过调节图1所示背压阀,控制高压结晶釜内压力为11mpa,并通过预热器和恒温箱控制釜内温度为40℃,使釜内co2达到超临界状态;4)溶液进样:如图1所示,打开高压液相泵,将步骤1配置的溶液由釜头的中间通道经200μm的喷嘴喷入结晶釜内。通入溶液前,先通入15min的乙醇和二氯甲烷的混合溶剂(体积比1∶1),使体系达到平衡。进样流率控制为2.5ml/min;5)干燥:进样结束后,继续通入co230min以除去残留的有机溶剂;6)泄压,收集高压釜内样品。实施例3处方:物料组成处方配比(%)伊曲康唑40羟丙甲纤维素40聚乙二醇600020制备方法:1)混合溶液的配制:准确称取2.0g伊曲康唑和2.0g羟丙甲纤维素及1.0g聚乙二醇6000的混合物置于500ml锥形瓶中,加入200ml乙醇和二氯甲烷的混合溶剂(体积比1∶1),使完全溶解;2)co2进料:如图1所示,打开co2钢瓶阀门,液化co2由高压泵经釜头对称的两个通道(与中间溶液通道成60°)连续引入超临界流体结晶设备体系的高压结晶釜内,控制流速75ml/min;3)调控温度和压力:通过调节图1所示背压阀,控制高压结晶釜内压力为12mpa,并通过预热器和恒温箱控制釜内温度为60℃,使釜内co2达到超临界状态;4)溶液进样:如图1所示,打开高压液相泵,将步骤1配置的溶液由釜头的中间通道经100μm的喷嘴喷入结晶釜内。通入溶液前,先通入15min的乙醇和二氯甲烷的混合溶剂(体积比1∶1),使体系达到平衡。进样流率控制为3ml/min;5)干燥:进样结束后,继续通入co220min以除去残留的有机溶剂;6)泄压,收集高压釜内样品。实施例4处方:物料组成处方配比(%)伊曲康唑50羟丙甲纤维素50制备方法:1)混合溶液的配制:准确称取3g伊曲康唑和3g羟丙甲纤维素的混合物置于500ml锥形瓶中,加入200ml乙醇和二氯甲烷的混合溶剂(体积比1∶1),使完全溶解;2)co2进料:如图1所示,打开co2钢瓶阀门,液化co2由高压泵经釜头对称的两个通道(与中间溶液通道成60°)连续引入超临界流体结晶设备体系的高压结晶釜内,控制流速50ml/min;3)调控温度和压力:通过调节图1所示背压阀,控制高压结晶釜内压力为9mpa,并通过预热器和恒温箱控制釜内温度为50℃,使釜内co2达到超临界状态;4)溶液进样:如图1所示,打开高压液相泵,将步骤1配置的溶液由釜头的中间通道经650μm的喷嘴喷入结晶釜内。通入溶液前,先通入15min的乙醇和二氯甲烷的混合溶剂(体积比1∶1),使体系达到平衡。进样流率控制为1ml/min;5)干燥:进样结束后,继续通入co230min以除去残留的有机溶剂;6)泄压,收集高压釜内样品。实施例5处方:物料组成处方配比(%)伊曲康唑40羟丙甲纤维素60制备方法:1)混合溶液的配制:准确称取2.0g伊曲康唑和3.0g羟丙甲纤维素的混合物置于500ml锥形瓶中,加入200ml乙醇和二氯甲烷的混合溶剂(体积比1∶1),使完全溶解;2)co2进料:如图1所示,打开co2钢瓶阀门,液化co2由高压泵经釜头对称的两个通道(与中间溶液通道成60°)连续引入超临界流体结晶设备体系的高压结晶釜内,控制流速75ml/min;3)调控温度和压力:通过调节图1所示背压阀,控制高压结晶釜内压力为13mpa,并通过预热器和恒温箱控制釜内温度为45℃,使釜内co2达到超临界状态;4)溶液进样:如图1所示,打开高压液相泵,将步骤1配置的溶液由釜头的中间通道经200μm的喷嘴喷入结晶釜内。通入溶液前,先通入15min的乙醇和二氯甲烷的混合溶剂(体积比1∶1),使体系达到平衡。进样流率控制为4ml/min;5)干燥:进样结束后,继续通入co220min以除去残留的有机溶剂;6)泄压,收集高压釜内样品。本发明以上实施例所制备的伊曲康唑复合微粒及制剂的分析测试结果:1)设备运行情况:本发明所用超临界流体结晶装置如附图1所示,由于喷头的改进,及配方成分可很好的溶解于所用溶剂中,过程运行平稳,不存在喷嘴堵塞现象,温度波动±0.10℃,压力波动±0.15mpa;2)收率及载药效率:本发明制备过程无繁琐的溶剂去除步骤,样品收率高于90%。而且在本发明所限定的操作温度和压力范围内,伊曲康唑几乎不溶于超临界co2中,所得样品载药效率(实际载药量与理论载药量的百分比)高于95%;3)电子显微镜扫描结果:如附图2所示,伊曲康唑原料药为不规整块状晶体,大小不均。而本发明所制备的样品为蓬松的白色粉末,样品分散均匀,如附图3所示,其基元为直径1微米左右的微球,大小均一,无块状晶体,粉体的这种微结构有利于增溶,在体内有可能发挥更好的效果;4)x-粉末衍射表征结果:如附图4所示,伊曲康唑原料药在衍射角(2θ)为10°-30°的范围内,具有高强度的晶体衍射峰。而本发明所得伊曲康唑复合微粒,如附图5所示,无晶体特征衍射峰,表明复合微粒中所含伊曲康唑由结晶型转化为无定型。与结晶型相比,无定型由于无晶格束缚,自由能大,因此溶解度和溶解速度均较大;4)溶出测试结果:采用浆法(转速50转/分钟),测定50mg伊曲康唑原料和含相同剂量的伊曲康唑的复合微粉,在ph值1.2的水溶液(温度37℃)中的溶出曲线,试验结果如附图6所示。可见,相比伊曲康唑原料,本发明制得复合微粉的溶出得到极大改善,曲线呈现理想的准线性,利于药物的有效吸收,而且与日本橙皮书中公开的伊曲康唑胶囊(50mg,janssenpharmaceuticalk.k.)的溶出曲线相似因子>60,后续相关制剂应用开发中,易于符合一致性评价要求。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1