血液分离系统的制作方法
干细胞具有自我更新以产生更多的干细胞以及成为几乎任何类型的特化细胞(specializedcells)的能力。干细胞研究对于了解人类发展是有用的,并且是当代生物学的最吸引人的领域之一。因此,干细胞对于未来的医学科学提供了令人振奋的希望。
概述
在一个方面中,被描述于此的是一种分离系统,其包括:包含控制器、红血球(rbc)检测模块和泵驱动器的血液分离装置;以及被配置成可逆地附接(可拆卸地附接,reversiblyattachedto)至该血液分离装置的匣盒(卡匣或套筒,cartridge)。该匣盒包括:(i)被配置成容纳(含有,contain)血液样品的第一容器,其中该第一容器包括第一开口;(ii)与第一开口呈流体流动联通的配管(管道,tubing);(iii)与配管呈流体流动联通的泵,其中该泵被配置成将流体从第一容器移动至泵并且容纳流体;和(iv)安装至配管的止回阀,其中该止回阀被配置成允许流体从第一容器流动至泵并且不允许流体从泵流动至第一容器。在一个实施方案中,rbc检测模块被配置成(i)在位于第一开口和泵之间的检测点处检测配管中的红血球,并且(ii)当在配管中检测到红血球时,产生要被传送至控制器的第一信号。rbc检测模块可以配置成向检测点发射光并且检测明确地指示在流体中存在红血球的该光的反射、散射、吸收或荧光。
控制器可以配置成接收来自rbc检测模块的第一信号,并且在接收第一信号之后,产生要被传送至泵驱动器的第二信号。泵驱动器可以配置成接收第二信号,并且在接收该第二信号之后,驱动泵以停止将流体从第一容器移动至该泵。血液分离装置可以进一步包括温度传感器,其被配置成检测第一容器中的流体的温度并且当检测到该温度时产生要被传送至控制器的第三信号。血液分离装置可以进一步包括耦合(连接,couple)至控制器的冷却驱动器,并且其中控制器被配置成在接收第三信号之后,产生并且传送第四信号至该冷却驱动器。冷却驱动器可以配置成接收第四信号并且在接收第四信号之后驱动冷却模块以调节第一容器中的流体的温度。分离装置可以进一步包括支撑件(支架,holder),其被配置成按压第一容器抵靠着冷却模块。分离装置也可以包括散热器(散热片,heatsink),其适于(被调适成,adaptedto)将热从冷却模块传送至血液分离装置的环境。在一个实施方案中,分离装置被配置成经由无线通信与中央控制单元联通。此外,分离装置可以被配置成将匣盒可逆地锁定在分离装置中。
在一个实施方案中,匣盒进一步包括与泵呈流体流动联通的第二容器,其中泵适于将流体从该泵移动至第二容器。泵驱动器可以被配置成,在接收来自控制器的驱动信号之后,驱动泵以将流体从该泵移动至第二容器。匣盒适于,在被安装(固定,fitted)在血液分离装置中时,允许第一容器中的血液样品通过重力分成上层和下层。泵和第二容器两者都可以被配置成可逆地附接至匣盒。
在另一个方面中,本文描述了一种分离血液样品的方法。例如,该方法可以包括本公开内容中所述的分离系统的使用。在一个实施方案中,该方法包括:提供匣盒,该匣盒包括:(i)容纳与二价阳离子螯合抗凝血剂(divalentcationchelatinganticoagulant)混合的血液样品的第一容器,其中该第一容器包括第一开口;(ii)与第一开口呈流体流动联通的配管;(iii)与配管呈流体流动联通的泵,其中该泵被可逆地附接至匣盒并且被配置成将流体从第一容器移动至泵并且保持(hold)流体;和(iv)安装至配管的止回阀,其中该止回阀被配置成允许流体从第一容器流动至泵并且不允许流体从泵流动至第一容器,其中该匣盒被配置成可逆地附接至血液分离装置;将匣盒附接至血液分离装置以使第一容器处于直立定位(inanuprightposition)并且第一开口在该容器的顶部;将第一容器中的血液样品冷却至2℃和12℃;将该血液样品在2℃和12℃下维持6至72小时,由此该血液样品通过重力分成上层和下层;以及将上层的一部分从第一容器经由该第一开口和配管泵送至泵,直至在第一开口和泵之间的检测点处在配管中检测到红血球,其中泵保持上层的该部分。在一个实施方案中,匣盒还包括与该泵呈流体流动联通的第二容器,并且其中该方法还包括将在泵中的该上层部分的一部分泵送至第二容器的步骤,其中该第二容器保持该上层部分的该部分。
一个或更多的实施方案的细节被阐述于附图以及下面的详细说明之中。这些实施方案的其他特征、目的和优点将从详细说明和附图以及权利要求书而变得明显。
附图说明
图1是示意图,其示出了依据本公开内容的实施方案的一种其内插入了抛弃式匣盒(一次性匣盒,disposablecartridge)的血液分离装置。
图2是示意图,其示出了依据本公开内容的实施方案的一种其内插入了抛弃式匣盒的血液分离装置。
图3是流程图,其图解说明了依据本公开内容的实施方案的一种红血球检测过程。
图4是示出了依据本公开内容的实施方案的对应于不同状态的光吸收阈值水平(lightabsorptionthresholdlevels)的图。
图5是流程图,其图解说明了利用依据本公开内容的实施方案的血液分离系统来分离来源于受试者(对象,subject)的血液样品的方法。
具体实施方式
本公开内容描述一种分离系统,其适于分离来源于受试者(如患者)的血液样品。该系统包括能够经由无线或有线通信网路与中央控制单元(例如,台式或手持式计算机)联通的血液分离装置,以及被配置成安装在血液分离装置中的匣盒。
在本公开内容的所有以下段落中提及的诸如成体干细胞的细胞的尺寸(z)可以但不限于被描述或定义为:(1)在细胞生物学领域或干细胞领域中的细胞的尺寸或代表性长度的常规定义,(2)细胞的直径,特别是当该细胞基本上为球形时,(3)细胞的长轴的长度,特别是当该细胞基本上是椭圆形时,(4)当细胞的形状具有近似正方形的形状时,该细胞的宽度,(5)当细胞的形状具有近似矩形的形状时,该细胞的长度,或(6)细胞的最大横截面或横向尺度。该尺寸(z),其为直径、长度、宽度或者最大横断面或横向尺寸,可以但不限于被确定或测量,例如,使用细胞从光学显微镜或诸如扫描电子显微镜(sem)的电子显微镜获得的图像,或使用该细胞从流式细胞仪获得的数据(例如,二维点、轮廓或密度图)。细胞从光学显微镜或电子显微镜获得的图像可以为该细胞的二维(2d)截面或三维(3d)结构。作为一个实例,细胞的尺寸(z)可以通过例如测量该细胞在从光学显微镜或电子显微镜(例如sem)获得的2d截面图像中的最大横截面或横向尺寸而获得。
成体干细胞(也被称为成人干细胞)可在诸如骨髓、脂肪或(外周)血液的器官或组织中发现并且具有全部干细胞的相同基本特征。成体干细胞是未特化的或未分化的细胞,其能够分化成特化的细胞类型。在本公开内容中,成体干细胞不是胚胎干细胞;换言之,这些成体干细胞不是来源、取源(sourced)或收获自从胚胎或胎儿组织。
存在有多种类型的成体干细胞,包括全能干细胞(totipotentstemcells)、万能干细胞(pluripotentstemcells)、多能干细胞(multipotentstemcells)和祖干细胞(progenitorstemcells)(也被称为单能干细胞(unipotentstemcells))。胚叶样干细胞(blsc)是全能干细胞或万能干细胞。极小胚胎样干细胞(vsel)是万能成体干细胞。sb-1细胞和sb-2细胞是万能或多能成体干细胞。
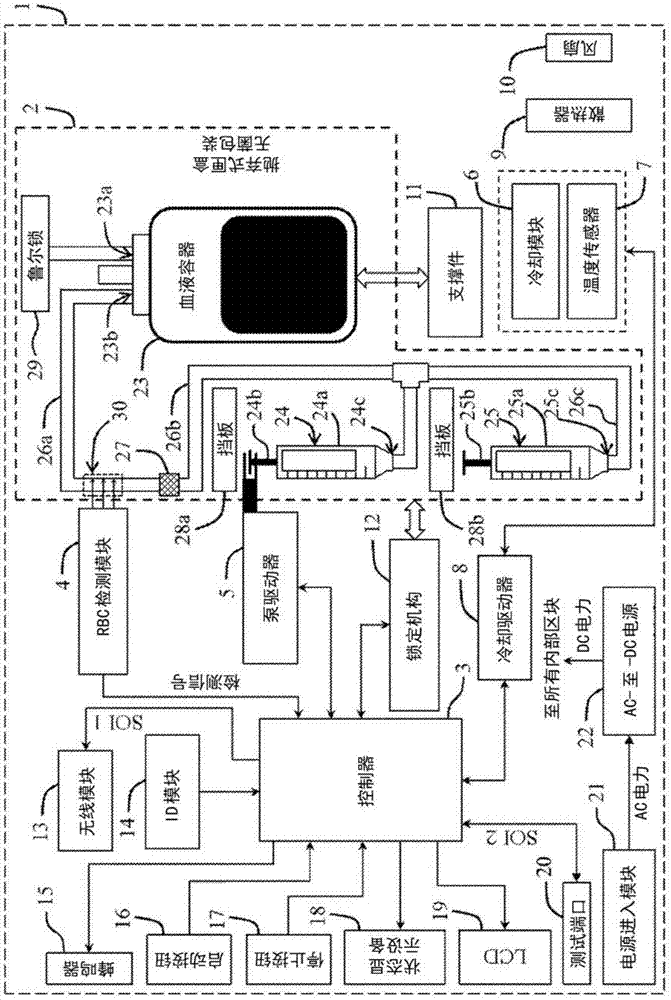
参照图1,一种血液分离系统包括适于经由无线或有线通信网路与中央控制单元(例如,台式或手持式计算机)联通的血液分离装置1,以及被配置成安装在血液分离装置1中的抛弃式匣盒2。该血液分离系统能够分离血液样品,如来自受试者的外周血液样品。该受试者,例如,是人类(例如,儿童、青少年、成人或老年人)或者动物(例如,哺乳动物)。该血液样品含有多个细胞,包括小细胞部分(small-cellportion)和大细胞部分(large-cellportion)。血液样品的小细胞部分含有在尺寸(如通过前面所述的细胞的尺寸(z)定义的)上为介于1微米和6微米之间并且优选为介于2微米和6微米之间的小细胞。该小细胞部分含有血小板(它们在尺寸上可以是小于6微米)和小干细胞。这些小干细胞,其每一个具有一个或多个细胞核,含有小成体干细胞(它们在尺寸上可以是小于或等于6微米),如cd349(+)成体干细胞、lgr5(+)成体干细胞、cd66e(+)成体干细胞(即blsc)和vsel(例如cd133(+)成体干细胞和cd34(+)成体干细胞)。血液样品的大细胞部分含有在尺寸(如通过前面所述的细胞的尺寸(z)定义的)上为大于6微米的大细胞,如在尺寸为大于6微米的大成体干细胞以及含有红血球和白血球(whitebloodcells)的谱系细胞。在被处理之后,血液样品分成包括上层(例如上清液)和下层的两个或更多个分开的层。血液样品的上层含有小细胞部分,而血液样品的下层含有大细胞部分。分离系统适于将血液样品的上层和血液样品的下层分开。
抛弃式匣盒2,例如,可以为经预先灭菌的单次使用的匣盒,该匣盒包括封闭系统,在其内可以进行通过重力的血液分离。参照图1,该抛弃式匣盒2包含:(1)适于容纳血液样品的容器,例如血液容器23(例如,50ml、75ml、100ml、150ml、200ml、250ml、300ml、350ml、400ml、450ml或500ml的血袋),(2)配管,例如与血液容器23呈流体流动联通的管26a、26b和26c的系列或系统,(3)止回阀,例如安装至配管的止回阀27(例如布置在管26a和26b之间),(4)与这些管26b和26c呈流体流动联通的可逆地附接的第一容器,例如泵或注射器24,以及(5)与管26c呈流体流动联通的可逆地附接的第二容器,例如注射器25。
抛弃式匣盒2适于可逆地安装至或插入到血液分离装置1中,使得当抛弃式匣盒2被安装至或插入到血液分离装置1中时,血液容器23处于直立定位并且两个开口23a和23b位于血液容器23的顶部。用于血液收集的鲁尔锁连接器(luerlockconnector)29连接至血液容器23的开口23a以使血液样品经由该鲁尔锁连接器29从受试者流动到血液容器23中。管26a连接至血液容器23的开口23b以使血液样品的上层经由血液容器23的开口23b从血液容器23流动到管26a中。
止回阀27(连接管26a和管26b)可以为允许流体(例如血液样品的上层)仅在第一方向(即从血液容器23至第一注射器24的正向)上流动的机械且单向定向阀,其阻止流体在第二方向(即从第一注射器24至血液容器23的反向)上流动。在第一方向上的流体流动打开止回阀27,而在第二方向上的回流迫使止回阀27关闭。因此,止回阀27(被安装在管26a和26b之间)适于使血液样品在第一方向上从血液容器23依序地经由管26a、止回阀27和管26b流动至第一注射器24,并且避免血液样品在第二方向上从第一注射器24流动至血液容器23。
第一注射器24适于在重力分离之后收集和容纳在血液容器23中的血液样品的上层(包括该血液样品的小细胞部分)。第一注射器24是泵,其包括第一筒(barrel)24a(例如圆柱形管)、在第一筒24a中的第一柱塞(plunger)24b和第一开口24c。第二注射器25适于容纳从第一注射器24经由管26c流动的血液样品的上层的一部分。第二注射器25包括,例如,第二筒25a(例如圆柱形管)、安装在第二筒25a中的第二柱塞25b和第二开口25c。第一注射器24可以适于容纳比第二注射器25更多10%至200%(例如,20%、30%、40%、50%、60%、70%、80%、90%、100%、150%或200%)的流体。例如,第一注射器24可保持60ml的流体,而第二注射器25可保持30ml的流体。
第一柱塞24b被配置成通过血液分离装置1的泵驱动器5来驱动以在第一注射器24的第一筒24a的轴向上相对于第一筒24a移动。例如,当第一柱塞24b通过泵驱动器5驱动而相对于第一筒24a在轴向上被拉动时,血液样品的上层从血液容器23依序地经由管26a、止回阀27、管26b和第一开口24c流动到第一筒24a中。抛弃式匣盒2的挡板(hardstop)28a适于在泵驱动器5发生故障的情况下防止第一柱塞24b从第一筒24a中脱出。当第一注射器24的第一柱塞24b通过泵驱动器5驱动而相对于第一筒24a在轴向上被推动时,在第一筒24a中的血液样品的上层的一部分经由管26c和第二开口25c流动到第二注射器25的第二筒25a中。抛弃式匣盒2的挡板28b适于在泵驱动器5发生故障的情况下防止第二柱塞25b从第二筒25a中脱出。总的来说,第一柱塞24b可以通过血液分离装置1的泵驱动器5在第一筒24a中被拉动和推动,允许第一注射器24经由开口24c吸入和排出液体(例如血液样品的上层)。
抛弃式匣盒2还包括被预先加载在血液容器23中以与血液样品混合的基于二价阳离子螯合的抗凝血剂(divalentcationchelating-basedanticoagulant)。例如,基于二价阳离子螯合的抗凝血剂是乙二胺四乙酸(edta)、柠檬酸盐或其他的钙螯合抗凝血剂。在一个实施方案中,血液容器23容纳一定量的基于二价阳离子螯合的抗凝血剂,其使得在抗凝血剂与血液样品混合之后,血液样品含有每毫升血液样品1.5mg或更多(例如1.5mg至2mg、1.6mg、1.7mg、1.8mg、1.9mg或2mg)的抗凝血剂。在一个实施方案中,如图2中所示的,抛弃式匣盒2还包括被安装至管26a的过滤器31。过滤器31适于过滤血液样品中的白血球(leukocytes)。
参照图1,血液分离装置1,其适于与抛弃式匣盒2一起用于分离在抛弃式匣盒2的血液容器23中放置的血液样品,包括控制器3、耦合至控制器3的rbc检测模块4和耦合至控制器3的泵驱动器5(例如泵用电机或致动器)。rbc检测模块4适于在血液样品流经管26a时,在检测点30处检测血液样品中的红血球,以产生要被传送至控制器3的检测信号。rbc检测模块4包括,例如,适于向在检测点30处的管26a发射光的发光器件和适于检测明确地指示在检测点30处流经管26a的血液样品中有红血球存在的该光的反射、散射、吸收或荧光的传感器。rbc检测模块4可以被定位为使得在开口23a和检测点30之间的流动路径(flowpath)具有比在检测点30和第一开口24c之间的流动路径的距离更小(例如,小1至95%、3%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%)的距离。rbc检测模块4适于当在检测点30处的管26a是清澈的时来进行红血球检测。rbc检测模块4适于容忍气泡、“薄片”(杂散的红血球)的存在以及在血液样品的上层和血液样品的下层之间的线的扩散,以防止在该上层从血液容器23完全转移至第一注射器24之前过早产生将会结束泵送的检测信号。
rbc检测模块4可以适于实现图3中所示的过程。发光器件可以包括发射具有波长为461nm的蓝光的第一发光二极管(led),和发射具有波长为565nm波长的绿光的第二绿光led。传感器可以包括一个或多个适于检测从各个led发射的光的光电二极管(例如,硅光电二极管)。rbc检测模块4可以适于在匣盒安装至血液分离装置之前进行校正序列(calibrationsequence)。在接收校正请求(calibrationrequest)(例如,来自中央控制单元或血液分离装置)之后,对于绿光和蓝光通道的光水平(lightlevel)在这些led开启以及这些led关闭的情况下进行测量。用于各个led的电流独立地设定,要求是一次只进行一次光测量,在这些蓝光和绿光led之间快速地交替。这些校正测量在匣盒没有在血液分离装置中的情况下进行。校正过程设定最大亮度和最大暗度水平。这些水平,以及由这些led所牵动的电流,可以进行检查以确定它们是否有在预期的允许范围内。然后吸收水平在用于绿光和蓝光通道二者的这两个水平之间缩放。参见图4。
参照图3,rbc检测模块具有3个输出信号引脚(outputsignalpins),即状态1(status1)、状态2(status2)和故障(fault)。检测器还具有1个输入信号引脚,即校正请求。如果检测器通过校正,则输出引脚(outputpin)将指示“无管(notube)”状况,例如血液分离装置中不存在匣盒。“无管”状况在绿光和蓝光通道二者检测到近乎最大亮度,例如最少量的光吸收时发生。下一个吸收水平对于“顶层(toplayer)”状况发生,例如当来自匣盒中的血液容器的上层的一部分流经检测点时发生。绿光通道更适于测量此状况。如果绿光吸收水平低于特定水平(参见图4),则这些输出引脚会指示“顶层”状况。下一个吸收水平对于“空管(emptytube)”状况发生。这是里面空无一物的管,或者如果有气泡流经检测点。蓝光通道更适于测量此状况。如果蓝光吸收水平低于特定水平(参见图4),则这些输出引脚会指示“空管”状况。最后一个吸收水平对于“血液”状况发生,例如当红血球流经检测点时发生。蓝光通道更适于测量此状况。如果蓝光吸收水平超过特定水平(参见图4),则这些输出引脚会指示“血液”状况。
参照图1,控制器3,例如,是微控器,其是一个单一集成电路芯片包含处理器内核、内存以及可程序化输入/输出外围设备。控制器3适于接收来自rbc检测模块4的检测信号,并且在接收检测信号之后产生要被传送至泵驱动器5的驱动信号。泵驱动器5适于接收来自控制器3的驱动信号,保持第一注射器24的第一柱塞24b,以及驱动第一柱塞24b相对于第一筒24a沿着第一筒24a的轴向移动。因此,基于检测结果或信号,泵驱动器5被配置成驱动血液容器23中的血液样品的一部分依序地流经位于管26a中的检测点30、止回阀27、管26b和开口24c而到第一筒24a中。
血液分离装置1还包括适于冷却血液容器23中的血液样品的冷却模块6(例如,热电冷却器、蒸汽压缩冷却器或液体冷却器),耦合至控制器3的温度传感器7,和耦合至控制器3和冷却模块6二者并且被调适成基于来自温度传感器7的反馈来驱动冷却模块6的冷却驱动器8(例如,热电驱动器)。温度传感器7适于感测与血液容器23中的血液样品有关联的温度,如抛弃式匣盒2的内部温度,以产生要被传送至控制器3的温度传感器信号。控制器3适于接收温度传感器信号并且基于该温度传感器信号,产生要被传送至冷却驱动器8的冷却信号。冷却驱动器8适于接收冷却信号,并且在接收该冷却信号之后驱动冷却模块6,以冷却与血液容器23中的血液样品有关联的温度。在一个实施方案中,控制器3、冷却模块6、温度传感器7和冷却驱动器8一起适于将与血液容器23中的血液样品有关联的温度冷却和维持至在2摄氏度(℃)和12℃之间的温度,例如2℃、3℃、4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、2至7℃、2至10℃、4至8℃、4至12℃,或6至12℃。血液分离装置1的支撑件11可以被用作传热底座(heattransfermount),其适于从血液容器23将热移出到冷却模块6。血液分离装置1的被动式热交换器(passiveheatexchanger)9(例如散热器)适于从冷却模块6将热传导至血液分离装置1的环境。血液分离装置1的风扇10适于将被传导至被动式热交换器9的热移出至血液分离装置1的环境。在一个实施方案中,支撑件11适于按压血液容器23抵靠着冷却模块6,以增大血液容器23和冷却模块6之间的接触表面积。
血液分离装置1的支撑件11可以适于支撑容纳血液样品的血液容器23以防止其掉落。抛弃式匣盒2适于通过血液分离装置1的锁定机构12(例如电锁机构(electriclockingmechanism))而被锁定在血液分离装置1中。锁定机构12耦合至控制器3并且适于基于自控制器3传送的信号来锁定或松开抛弃式匣盒2。换言之,控制器3适于控制锁定机构12来锁定或松开抛弃式匣盒2。锁定机构12可以与可以为抛弃式的在位开关(in-placeswitch)或检测器耦合。备选地,在位开关或检测器可以整合到锁定机构12中。在位开关或检测器适于确认抛弃式匣盒2是否正确地在血液分离装置1中处于适当位置。
此外,血液分离装置1包括耦合至控制器3的无线模块13、耦合至控制器3的识别(id)模块14、耦合至控制器3的蜂鸣器15、耦合至控制器3的启动按钮16、耦合至控制器3的停止按钮17、耦合至控制器3的状态显示设备18、耦合至控制器3的液晶显示器(lcd)19、耦合至控制器3的测试端口20、电源进入模块21以及耦合至电源进入模块21的ac-至-dc电源供应模块22。
无线模块13适于允许血液分离装置1和中央控制单元之间的无线通信。用于无线通信的通信协议可以为wi-fi协议,如ieee802.11。识别模块14适于具有要被传送至中央控制单元的唯一识别符(即电子产品码),其可以是与给定系统(例如分离系统)内的单一实体(例如血液分离装置1)有关联的数字或字母数字字符串。例如,识别模块14可以为无线射频识别(rfid)芯片或标签,其能够经由无线电波将唯一标识符传送至中央控制单元。中央控制单元能够读取由无线电波所携带的唯一标识符并且经由该唯一标识符来识别血液分离装置1。备选地,识别模块14可以为可擦除的可程序化只读存储器(eprom)芯片,其包括唯一标识符。中央控制单元能够读取储存于eprom芯片内的唯一标识符并且经由该唯一标识符来识别血液分离装置1。
蜂鸣器15可以发出声音来告知使用者异常事件或问题已在血液分离装置1中发生。启动按钮16适于发送启动信号至控制器3以开始用于分离血液容器23内的血液样品的过程。停止按钮17适于发送停止信号至控制器3以中止或终止用于分离血液样品的过程。状态显示设备18,如发光二极管(led),可以发射光以警示使用者注意血液分离装置1的状态,例如电源开启和/或故障状态。液晶显示器(lcd)19(其是利用液晶的光调变性质的平板显示器或其他的电子视觉显示器)适于显示关于用于分离血液样品的过程的信息。测试端口20,如rs-232串行端口,适于在测试和维护期间用于下载日志并且允许非使用者诊断。
电源进入模块21,例如,可以为在血液分离装置1中使用的电化学组件,其整合电源入口与其他组件(如开关和保险丝座)。电源进入模块21适于通过电源线连接外部电源并提供交流电(ac)电输入至ac-至-dc电源供应模块22。ac-至-dc电源供应模块22,如ac-至-dc电压转换器,适于将来自电源进入模块21的ac电力转换成直流电力(dcpower)以供电给所有的这些组件3-20。
血液分离装置1可以进一步包括外壳(housing),其包含上述组件3-22。外壳内的空间(例如插口(socket))被配置成容纳通过锁定机构12要被可拆卸地锁定至血液分离装置1的抛弃式匣盒2。在血液分离装置1中,控制器3适于控制和协调所有的这些组件3-22。例如,控制器3可以执行下列操作:(1)在接收来自中央控制单元或来自启动按钮16的启动指令之后启动用于分离血液样品的过程,(2)操作锁定机构12以在接收来自中央控制单元或启动按钮16的指令或信号之后锁定抛弃式匣盒2或者在接收来自中央控制单元或停止按钮17的指令或信号之后松开抛弃式匣盒2,(3)监测泵驱动器5的电路以检测在第一注射器24被卡住时的过电流或者在第一注射器24没有与泵驱动器5正确地配合时的无电流,(4)即使无线或有线通信退出,仍完成该过程,以及(5)在接收来自中央控制单元或停止按钮17的停止指令或信号之后中止该过程。控制器3可以包含电池后备时钟/计时器(batterybackedupclock/timer)以允许即使失去电力也监测用于分离血液样品的过程持续经过的处理时间。备选地,血液分离装置1可以包含保活电路(keep-alivecircuit),其适于接收来自控制器3的周期性脉冲(至少每秒一次)。如果两个或更多的来自控制器3的脉冲被遗漏或没有被保活电路接收到,则关闭对泵驱动器5和冷却模块6的供电。
总的来说,分离系统包括如图1中图解说明的血液分离装置1(能够与中央控制单元联通)以及被配置成安装在血液分离装置1中的如图1或图2中图解说明的单次使用的匣盒2。中央控制单元适于运行软件以允许使用者通过无线或有线通信来控制血液分离装置1的一个或多个功能。血液分离装置1可以通过其无线模块13或其以太网络模块与中央控制单元联通。血液分离装置1包括一件可重复使用设备,其由对于安全地执行血液分离所必需的所有电子、机械、光学和热控制装置(例如组件3-22)组成。
在另一个实施方案中,提供了一种分离系统,其包括至少两个血液分离装置1(每一个如图1中图解说明的)以及至少两个适于安装在相应血液分离装置1中的单次使用的匣盒2(每一个如图1或图2中图解说明的)。中央控制单元适于运行软件以允许用户通过无线或有线通信来控制一个或多个血液分离装置1的功能。这些血液分离装置1的每一个可以通过其无线模块13或其以太网络模块与中央控制单元联通。中央控制单元能够连接至能够读取被整合到这些匣盒2的每一个中的序列化唯一标识符(serializeduniqueidentifier)的外围装置。例如,外围装置可以为条形码读取器,而序列化的唯一标识符可为打印的条形码。备选地,外围装置可以为无线射频识别(rfid)读取器,而序列化的唯一标识符可以为rfid码。这些序列化的唯一标识符的每一个,例如,可以被关联至个别患者的信息并且在处理和治疗期间的一个或多个点处被读取,以防止患者样品的意外交换。这些血液分离装置1的每一个包括一件可重复使用设备,其由对于安全地执行血液分离所必需的所有电子、机械、光学和热控制装置((例如组件3-22)组成。
使用分离系统来分离血液样品的方法在图5中图解说明。参照图5,在步骤s1中,血液样品从受试者的血液(例如外周血液)无菌地抽出到在抛弃式匣盒2内的容纳基于二价阳离子螯合的抗凝血剂(例如edta或柠檬酸盐)的血液容器23中,并且血液样品与基于二价阳离子螯合的抗凝血剂混合。在步骤s2中,将抛弃式匣盒2插入或固定在血液分离装置1中,即到在血液分离装置1的外壳中的插口中,而在抛弃式匣盒2中的带有血液样品的血液容器23被支撑件11所保持。将抛弃式匣盒2插入或固定到血液分离装置1中,使得血液容器23处于直立定位。因此,在被安装在血液分离装置1中的抛弃式匣盒2中的血液容器23的两个开口23a和23b的每一个处于血液容器23的顶部并且处于在重力坐标中比在抛弃式匣盒2的血液容器23中的血液样品更高的水平处。
接下来,在接收来自中央控制单元或来自血液分离装置1的启动按钮16的启动信号之后,血液分离装置1依序地执行下列步骤s3-s5。在步骤s3中,血液分离装置1的冷却模块6被驱动以冷却在抛弃式匣盒2的血液容器23中的血液样品并且将其维持在特定温度下持续一段预定的时间,例如,3至72小时、3至12小时、3至18小时、3至24小时、3至36小时、3至48小时、3至60小时、6至72小时、6至12小时、6至18小时、6至24小时、6至36小时、6至48小时、6至60小时、12至72小时、12至18小时、12至24小时、12至36小时、12至48小时、12至60小时、16至72小时、16至18小时、16至24小时、16至36小时、16至48小时、16至60小时、24至72小时、24至36小时、24至48小时、24至60小时、36至72小时、36至48小时、36至60小时、48至72小时,或48至60小时。该特定温度可以在2℃和12℃之间,例如为2℃、3℃、4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、2至7℃、2至10℃、4至8℃、4至12℃,或6至12℃。在已被储存于特定温度下历时预定时间段之后,因为重力,例如只有重力,在被安装在血液分离装置1中的抛弃式匣盒2的血液容器23中的血液样品,分成包括上层和下层的两个或更多个分开的层。血液样品的上层含有诸如小类干细胞(smallstem-likecell)(例如小成体干细胞)的悬浮小细胞和血小板。例如,血液样品的上层中的血小板可以为不具活性的。血液样品的下层含有沉积的大细胞,如大成体干细胞、红血球和白血球。因此,在步骤s3中,血液分离装置1通过允许在抛弃式匣盒2的血液容器23内发生大细胞的重力驱动的沉降而起作用,并且预定的时间段被认为是沉降时间。
在步骤s4中,控制器3在重力分离之后传送第一驱动信号至泵驱动器5。在接收第一驱动信号之后,泵驱动器5驱动第一柱塞24b以相对于第一筒24a沿着该第一筒24a的轴向来拉动该第一柱塞24b。因此,在血液容器23中的血液样品的上层被泵送出血液容器23而依序地经由管26a、止回阀27、管26b和第一开口24c而进入第一筒24a中。同时,在血液样品流经管26a时,rbc检测模块4在检测点30处检测该血液样品中是否有红血球,以产生要被传送至控制器3的检测信号(其被传送至控制器3且由其接收)。当rbc检测模块4检测到指示红血球抵达在检测点30处的管26a的光时,它产生检测信号并将该检测信号传送至控制器3。在接收从rbc检测模块4传送来的检测信号之后,控制器3产生第二驱动信号并且将该第二驱动信号传送至泵驱动器5。在接收从控制器3传送来的第二检测信号之后,泵驱动器5停止拉动第一柱塞24b并且将血液样品抽取到第一筒24a中。在步骤s5中,控制器3产生第三驱动信号以命令泵驱动器5相对于第一筒24a沿着该第一筒24a的轴向推动第一柱塞24b,使得被收集在第一筒24a中的血液样品的上层的一部分经由管26c流动到第二筒25a中。一旦第二筒25a被血液样品的上层填充,控制器3产生第四驱动信号以命令泵驱动器5停止推动第一柱塞24b并且停止驱动被收集在第一筒24a中的血液样品的上层流入到第二筒25a中。然后完成用于分离血液样品的过程,并且血液分离装置1向中央控制单元发信号。
血液分离装置1继续将抛弃式匣盒2安全地维持在上述的特定温度(例如,在2℃和12℃之间),直到抛弃式匣盒2被使用者移出。在抛弃式匣盒2从血液分离装置1被移出之后,容纳血液样品的上层的第一注射器24与第二注射器25可从抛弃式匣盒2拆卸出来供个人(例如临床医师、医师或研究人员)用。在第一注射器24或者第二注射器25中的血液样品的上层可用作治疗用细胞混合物或含有干细胞的溶液以供治疗疾病或障碍,如癌症(cancer)、关节炎(arthritis)(例如骨关节炎(osteoarthritis)、牛皮癣性关节炎(psoriaticarthritis)、类风湿性关节炎(rheumatoidarthritis)、强直性脊椎炎(ankylosingspondylitis))、肌腱炎(tendonitis)、肌腱损伤(tendoninjury)或自体免疫疾病或障碍(autoimmunediseaseordisorder)(例如类风湿性关节炎、强直性脊椎炎或全身性红斑狼疮(systemiclupuserythematosus)),用于治疗关节、(肌肉)肌腱、(膝盖)关节软骨、肩膀或脊柱,或用于骨骼-或关节-相关的治疗(例如牙科植入体治疗)。在第一注射器24或者第二注射器25中的血液样品的上层可被保存以供其他应用,如医学分析。
血液分离装置1可由医疗技术员、护理师或医师根据提供的协议在医护点来进行操作。分离系统适于在医护点来制备来自患者全血的含有干细胞的溶液(即血液样品的上层)。术语“自体细胞”意指在遗传上是受试者自己的细胞。
不用进一步的阐述,据信本领域技术人员可以根据本文中的描述来最大程度利用本公开内容。
其他实施方案
在本说明书中公开的所有特征可以以任意组合进行组合。本案说明书中公开的每一个特征可由用于相同的、等效的或类似的目的的替代特征代替。因此,除非另有明确地说明,所公开的每一个特征仅是同属系列的等效或相似特征的示例。
根据以上描述,本领域技术人员可以容易地确定所描述的实施方案的基本特征,并且在不脱离其精神和范围的情况下,可以对这些实施方案进行各种不同的改变和修饰以使其能适应各种不同的用途和情形。因此,其他实施方案也落入权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!