生物可降解输尿管支架、其方法及用途与流程
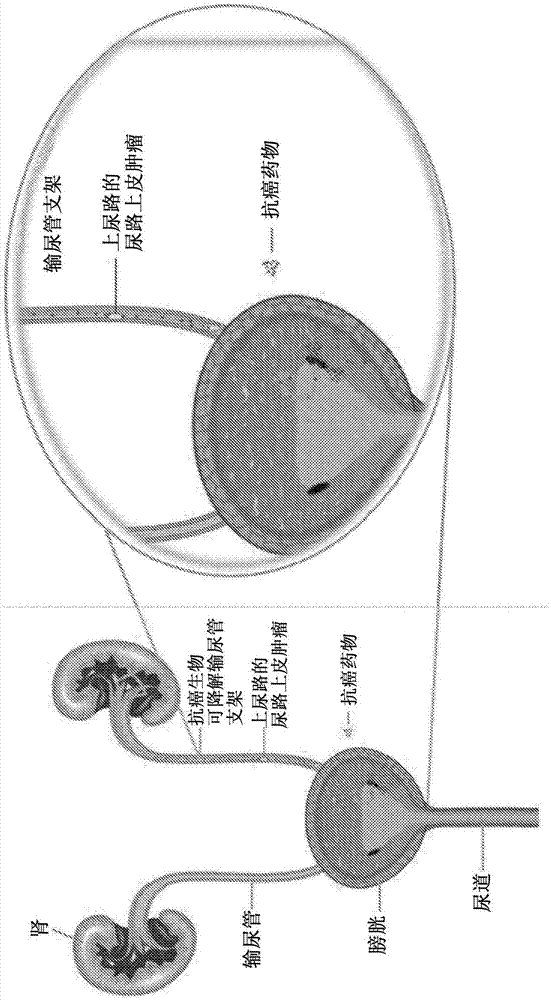
本公开涉及包含抗癌药物的生物可降解输尿管支架,以及涉及在可用于确保通道(即哺乳动物输尿管,例如尿结石、瘤形成或外科手术阻塞的输尿管)的通畅性的药物中使用的组合物。
背景技术
上尿路尿路上皮癌(utuc)占尿路上皮癌的5-10%,并且是一种尚未作为膀胱癌而进行广泛研究的疾病。为了避免常规治疗的问题,例如由于药物保留不良而需要频繁的药物滴注,我们开发了一种生物可降解输尿管支架(bus),通过超临界流体co2(scco2)浸渍有最常用的抗癌药物,即紫杉醇、表柔比星、阿霉素和吉西他滨。在人工尿液(aus)中测量来自药物洗脱支架的抗癌治疗剂的释放动力学。体外释放显示对于四种抗癌药物而言,在第一个72小时中释放更快,在此之后达到稳定水平,并且最终支架在9天后降解。关于由scco2浸渍的药物的量,吉西他滨显示最高的负荷量(19.57μg药物/mg聚合物::2%负荷的),而针对紫杉醇获得最低量(0.067μg药物/mg聚合物:0.01%负荷的)。将癌细胞系(t24)暴露于每种药物的分级浓度(0.01至2000ng/ml)持续4和72小时以确定细胞对每种药物的敏感性(ic50)。抗癌生物可降解输尿管支架与t24和huvec细胞系的直接和间接接触研究证实了用所测试的四种抗癌药物浸渍的bus的抗肿瘤作用,在72小时后降低t24细胞系的活力约75%,并且出现对huvec细胞的最小细胞毒作用。
上尿路尿路上皮癌(utuc)可位于下尿路(膀胱和尿道)或上尿路(肾盂和输尿管)尿路(babjuketal.,2013)。utuc是具有侵袭性的泌尿道癌症,具有多灶性、局部复发和转移的倾向(audenetetal.,2013b)。与膀胱癌相比,它们并不常见,但60%的utuc在诊断时是侵袭性的。尿路上皮癌(uc)是第四种最常见的肿瘤类型(munozandellison,2000)。可用的治疗分为两类:保肾手术和应用辅助局部试剂如卡介苗(bcg)疫苗、丝裂霉素c或其他抗癌药物;并且,在大多数情况下,进行根治性肾切除术,然后进行化疗。utuc是尿路上皮肿瘤,因此预期诸如紫杉醇、阿霉素和吉西他滨的药物具有与在膀胱癌中使用相似的治疗功效(audenetetal.,2013b;hellenthaletal.,2009)。一些研究检查了化疗对utuc的作用,并且基于抗癌药物的辅助化疗似乎存在总体存活和无病生存益处(hellenthaletal.,2009)。
在不同的研究中已经报道了诸如紫杉醇、丝裂霉素c、阿霉素和吉西他滨的药物作为可以掺入聚合物材料中以便在泌尿道中获得膀胱内药物递送(idd)系统的药物(hadaschiketal.,2008;luetal.,2015a;papadopoulosetal.,2015)。对于膀胱内化疗,与亲水性药物相比,疏水性抗癌药物提供了通过尿路上皮具有优异渗透性的独特益处(audenetetal.,2013a;luetal.,2015b)。lifshitz等人探索了一种创新想法。(mitogeltm)是使用具有丝裂霉素的水凝胶,其在体温下固化并且可以提供治疗剂的延长保留和缓慢、持续的释放(d.etal.,2014)。
在这项研究中,我们假设将水凝胶技术与传统的输尿管支架相结合,使用药物洗脱生物可降解输尿管支架递送这些抗癌药物的新概念。不同的药物洗脱输尿管支架已广泛用于心血管和不同的应用(khanetal.,2012;shaikhetal.,2013),但在泌尿外科,它仍然是一个新领域(langeetal.,2015)。一些研究报告了在基于聚氨酯的支架中浸渍药物如三氯生
公开这些事实是为了说明本公开所解决的技术问题。
技术实现要素:
本公开涉及包含抗癌药物的生物可降解输尿管支架,以及在可用于确保通道(即哺乳动物输尿管,例如尿结石、瘤形成或外科手术阻塞的输尿管)的通畅性的药物中使用的组合物。
本公开中公开的生物可降解输尿管支架(bus)出乎意料地允许适当释放抗癌药物,因此延长了治疗的持续时间并提高了治疗效果,并且不影响生物可降解输尿管支架的特性。
本公开的一个方面涉及包含聚合物基质的生物可降解支架,其中
聚合物基质包含10-50%(w/w)的海藻酸盐
45-85%(w/w)的明胶;
用于涂覆所述聚合物基质的聚合物生物可降解树脂;
和不超过10%(w/w)的抗癌药物。
在为了更好结果的实施方式中,本公开的生物可降解支架可以包含不超过5%(w/w)的抗癌药物,优选不超过4.95%(w/w)。
在为了更好结果的实施方式中,本公开的生物可降解支架可以包含至少一种抗癌药物,其选自紫杉醇、表柔比星、阿霉素、吉西他滨和它们的混合物。
在为了更好结果的实施方式中,本发明的生物可降解支架可以包含以下抗癌药物混合物之一:紫杉醇和表柔比星;或紫杉醇和阿霉素;或紫杉醇和吉西他滨;或表柔比星和阿霉素;或表柔比星和吉西他滨;或阿霉素和吉西他滨;或紫杉醇、表柔比星和阿霉素;或表柔比星、阿霉素和吉西他滨;或紫杉醇、表柔比星和吉西他滨。
在为了更好结果的实施方式中,聚合物基质可以包含20-40%(w/w)的海藻酸盐和55-70%(w/w)的明胶。
在为了更好结果的实施方式中,可以将树脂加入到浓度为3-50%(w/v),特别地为10-20%(w/v),更特别地为5-10%(w/v)的溶液中。
在为了更好结果的实施方式中,本公开的生物可降解支架可以进一步包含造影剂,即x射线造影剂。
在为了更好结果的实施方式中,本发明的生物可降解支架可包括
2-5%(w/w)的造影剂,即碳酸铋(iii);
包含20-40%(w/w)的海藻酸盐和55-70%(w/w)的明胶的聚合物基质。
在为了更好结果的实施方式中,本发明的生物可降解支架可以包含5%(w/w)的造影剂,即碳酸铋(iii);包含30%(w/w)的海藻酸盐和65%(w/w)的明胶的聚合物基质。
在为了更好结果的实施方式中,树脂可以选自以下列表:聚己内酯树脂、聚乙交酯及其共聚物:聚(乳酸-共-乙醇酸)与乳酸、聚(乙交酯-共-己内酯)与ε-己内酯和聚(乙交酯-共-三亚甲基碳酸酯)与三亚甲基碳酸酯,或它们的混合物,特别是聚己内酯。
在为了更好结果的实施方式中,造影剂选自以下列表:钡盐、铋盐、尖晶石颜料或它们的混合物,特别是碳酸铋(iii)。
在为了更好结果的实施方式中,本发明的生物可降解支架可以进一步包含交联剂。优选地,其中所述交联剂选自以下列表:包括单价或二价离子的离子交联剂,其中
阳离子是钙、镁、钡、锶、硼、铍、铝、铁、铜、钴、铅或银;
阴离子选自氯离子、硝酸根、磷酸根、柠檬酸根、硼酸根、琥珀酸根、马来酸根或草酸根,或它们的混合物;
特别是氯化钙。
在为了更好结果的实施方式中,本公开的生物可降解支架可以进一步包含选自以下列表的第二抗癌药物:甲氨蝶呤、长春碱、顺铂、粒细胞集落刺激因子、卡铂、5-氟尿嘧啶、异环磷酰胺、培美曲塞、丝裂霉素c、卡培他滨、卡介苗(bcg)或它们的混合物。
在为了更好结果的实施方式中,本发明的生物可降解支架可以进一步包含抗炎剂、抗微生物剂、抗病毒剂或它们的混合物。
在为了更好结果的实施方式中,可将生物可降解支架的抗癌药物浸渍在支架中,优选通过超临界流体co2。
在为了更好结果的实施方式中,支架是输尿管支架。
在本公开的另一方面,涉及生物可降解支架,其可用于再生医学、组织工程中或在处置、预防或治疗癌症或泌尿外科疾病。
在本公开的另一方面,涉及用于在药物中使用的组合物,其包含海藻酸盐、明胶、聚合物生物可降解树脂和不超过10%(w/w)的抗癌药物。
其中在生物可降解支架中施用所述组合物,
其中所述支架包含10-50%(w/w)的海藻酸盐,45-85%(w/w)的明胶;用于涂覆所述聚合物基质的聚合物可生物降解树脂;以及不超过5%(w/w)的抗癌药物。
在为了更好结果的实施方式中,本公开的组合物可以包含5%(w/w)的抗癌药物,优选不超过4.95%(w/w)的抗癌药物。
在为了更好结果的实施方式中,本公开的组合物可以包含至少一种抗癌药物,其选自紫杉醇、表柔比星、阿霉素、吉西他滨和它们的混合物。
在一个实施方式中,本公开的组合物可用于再生医学、组织工程或在处置、预防或治疗癌症或泌尿外科疾病。
附图说明
以下附图提供了用于例示说明书的优选实施方式,并且不应被视为限制本发明的范围。
图1:抗癌药物洗脱性生物可降解输尿管支架作为utuc疗法的潜在药物递送系统的概念的图示。
图2:用于生物可降解输尿管支架的抗癌药物的超临界流体工艺浸渍和装置的图示。
图3:商业不可降解输尿管支架(
图4:对于不同的测试条件,在37℃下从人工尿液aus(ph5.5)中的可生物降解和不可生物降解输尿管支架释放的累积抗癌药物的图示。支架在9天后降解。
图5a和图5b:t24细胞和huvec细胞在暴露于不同浓度的抗癌药物4小时或72小时后的体外生存力的图示。细胞活力表示为对照的百分比。垂直线表示在biostent中由scco2浸渍的药物量。显示的数据是至少3次独立实验的平均值。
图6:t24癌细胞系在通过间接接触暴露72小时后的细胞活力的图示。统计学显著性差异被认为是*p<0.05,p<0.01和p<0.001。
图7:t24癌细胞系和huvec细胞在通过间接接触暴露72小时后的细胞活力的图示。buscoat是具有未浸渍抗癌药物的pcl涂层的bus。统计学显著性差异被认为是*p<0.05,p<0.01和p<0.001。
图8:通过直接接触浸渍有抗癌药物的生物可降解输尿管支架暴露4小时和72小时后的t24细胞形态的光学显微镜图像(10倍)的图示。对照实验在t24细胞和无药物支架中进行72小时。
具体实施方式
本公开涉及包含抗癌药物的生物可降解输尿管支架,以及在可用于确保通道(即哺乳动物输尿管,例如被尿结石、瘤形成或外科手术阻塞的输尿管)的通畅性的药物中使用的组合物。
在一个实施方式中,在生物可降解输尿管支架中,通过超临界流体技术浸渍疏水性抗癌药物、紫杉醇、阿霉素、表柔比星和/或吉西他滨等。
在一个实施方式中,海藻酸钠盐、明胶、氯化钙、氯仿、乙醇和碱式碳酸铋(iii)购自sigma-aldrich(德国)。正磷酸二氢钾盐(potassiumdihydrogenortho-phosphate)(99.5%)和六水合氯化镁(99%)从riedel-de
简而言之,将聚合物溶解在热蒸馏水中(70℃)。将溶液搅拌1小时,并将聚合物溶液注入模具中以获得管状结构。1小时后,将件(piece)从模具中取出并置于醇溶液(100%乙醇)中1小时。然后,将bus在室温下转移到氯化钙(cacl2)的交联溶液中,优选为0.48m。交联后,将bus重新置于醇溶液(100%乙醇)中以获得醇凝胶。使用具有超临界二氧化碳(scco2)的高压容器在40℃和100巴下将本发明主题的生物支架以连续模式干燥90分钟。通过浸入溶解在氯仿中的10%的聚己内酯(pcl)树脂787,优选为(mw80,000gmol-1)进行支架的涂覆。
在一个实施方式中,在本公开的生物可降解输尿管支架(bus)中进行抗癌药物的超临界co2浸渍。根据图2,将制备的生物可降解输尿管支架置于含有抗癌药物(10mg)的高压容器中。在存在和不存在共溶剂的情况下,将抗癌药物浸渍在支架中。使用的scco2浸渍条件是在40℃和100巴下90分钟。将二氧化碳液化并使用隔膜泵(mcpv-71,haskel,德国)泵至期望压力。浸渍以间歇模式进行90分钟,然后是系统的快速降压。当使用共溶剂时,使用10%(v/v)的乙醇。在与共溶剂相同的条件下,用相同的药物浸渍商业不可降解的输尿管支架(
表1-通过超临界流体法浸渍的抗癌药物的每种条件研究的名称。
在一个实施方式中,在浸渍之后,用pcl树脂涂覆一批生物支架,并评估新条件(药物涂层)。
从公式(1)计算抗癌药物浸渍产率(i)。
i(%)=m药物/m支架+m药物x100公式(1)
其中,m支架是该过程开始时的聚合物质量,而m药物是在aus中支架完全降解后释放的相应抗癌药物的质量。从由标准溶液制备的校准曲线计算抗癌药物浓度。使用酶标仪(spectramaxi3,moleculardevices,美国),以每种药物的最大吸光度(pa为227nm,ep和dox为254nm,并且gem为268nm)通过uv光谱分析样品。一式三份进行所有实验。
在一个实施方式中,进行从生物可降解输尿管支架释放的抗癌药物的测定,在人工尿液(aus)中测量开发的抗癌药物洗脱性生物可降解输尿管支架的释放动力学。一式三份地进行从浸渍的生物可降解输尿管支架中的体外抗癌药物(特别是紫杉醇、表柔比星、阿霉素和吉西他滨)释放。称取10mg的经浸渍样品,并在37℃下伴随60rpm的搅拌浸入10ml的aus中。在预定的时间段(0分钟、5分钟、15分钟、30分钟、1小时、3小时、5小时、7.5小时、24小时、48小时、72小时、6天和10天),取出0.5ml的释放溶液的等分试样并且用新鲜的aus替换该体积。从由标准溶液制备的校准曲线计算抗癌药物的浓度。优选地,通过如上所述的紫外光谱法测定药物的浓度。具体地,使用酶标仪(synergyht,bio-tekinstruments,美国),通过紫外光谱分析样品,每种药物的最大吸光度对于pa为227nm,对于ep和dox为254nm,并且对于gem为268nm。
在一个实施方式中,本发明使用人尿路上皮癌细胞系t24(atcc,美国)作为癌细胞系来模拟尿路上皮癌,并且使用人脐静脉内皮细胞huvec(atcc,美国)作为对照,其是非癌细胞系。使用(10%胎牛血清(fbs)、1mm的l-谷氨酰胺和1%的青霉素/链霉素)将t24细胞系和huvec细胞分别培养在rpmi-1640和egmtm-2培养基中,在37℃下,在潮湿的5%co2气氛中维持细胞。
在一个实施方式中,抗癌药物对t24细胞和huvec细胞的体外功效-ic50测定。通过测定在暴露于含有在0.01至2000ng/ml浓度范围下的游离药物的培养基后的t24和huvec细胞的活力来评估紫杉醇、表柔比星、阿霉素和吉西他滨的细胞毒性。通过首先将抗癌药物溶解在dmso(50mg/ml)中来制备培养基中的游离药物,然后将该溶液稀释在培养基中以达到期望浓度。使用标准mtt细胞增殖测定(celltiter
在一个实施方式中,从通过mtt和药物浓度测量的细胞活力曲线的拟合确定ic50。使用graphpad软件(graphpadprism6.00软件,sandiego,美国)进行拟合。
评估通过与t24细胞和huvec(人脐静脉内皮细胞)间接和直接接触的抗癌药物洗脱性生物可降解输尿管支架的体外抗肿瘤/癌作用。
在一个实施方式中,通过间接和直接接触测定t24细胞的活力来评估抗癌药物洗脱性生物可降解输尿管支架在人尿路上皮癌细胞系中的抗癌作用。huvec用作非癌性对照细胞系。使用(10%胎牛血清(fbs)、1mm的l-谷氨酰胺和1%的青霉素/链霉素)将t24细胞系和huvec细胞分别在rpmi-1640和egmtm-2培养基中培养。在将支架置于新鲜培养基中4小时和72小时后,通过间接接触,评估来自生物可降解输尿管支架的释放的药物以及可浸出物的效果。另一方面,通过直接接触,将10mg的支架放置与每个孔中的细胞层直接接触。两个测试均进行4小时和72小时。使用标准mtt测试进行细胞的生存力。简言之,将每孔5000个细胞接种在96孔板中,其中100μl的培养基用于t24和huvec细胞。在孵育24小时后,吸出每孔中的培养基,并在间接接触研究中将细胞暴露于含有支架提取物的培养基。在直接接触中,在支架存在下将细胞暴露于100μl的新鲜培养基。将处理4小时后的细胞在新鲜培养基中进一步培养72小时。之后,用100μl的培养基和20μl的celltiter
在一个实施方式中,进行光学显微镜。为了视觉评估对其形态评估的影响,通过在光学显微镜(axioimagerz1m,zeiss,德国)下观察在4小时和72小时直接接触后在孔板底部培养的细胞。通过直接接触浸渍有抗癌药物的生物可降解输尿管支架,在暴露4小时和72小时后使用放大10倍的t24细胞拍摄图像。对照实验在t24细胞和无药物支架中进行72小时。
在一个实施方式中,所有数据值以平均值±标准差(sd)形式表示。使用graphpadprism6.00软件(sandiego,usa)进行统计分析。统计学意义(使用shapiro-wilk检验评估每个样品的数据分布的正态性(在所有情况下均证实p<0.05)。使用t-检验评估样品之间的显著差异(*p<0.05,p<0.01和p<0.001)使用单因素方差分析(anova)测定3至12个平行测定的平均值,然后对所有成对平均比较进行事后tukey测试。
在一个实施方式中,如前制备来自天然源聚合物的生物可降解输尿管支架(图3),并且通过scco2将抗癌药物装载在bus中,如图2所示。scco2提供优于其他浸渍溶剂的优点,因为它是环境友好、不易燃且无毒的溶剂,是高度丰富且低成本的。此外,在浸渍过程结束时,以及在降压步骤之后,获得干燥形式的最终产物,避免了对后续干燥和纯化步骤的需要。此外,溶剂可以是再循环和再利用的(champeauetal.,2015)。
根据kazarian等人(kazarianandmartirosyan,2002;kazarian,2000),主要有两种描述了超临界流体的浸渍的机制。一种是当将系统降压时药物在溶胀基质中的简单沉积。在该机制中,药物溶解在co2中并被放置与聚合物基质接触预定的时间。在该程序之后,并且在降压时,co2分子迅速离开聚合物基质,溶解的药物沉淀并沉积在聚合物网络中。该机理高度依赖于在接触超临界流体时聚合物基质的溶胀能力。另一方面,据说kazarian等人描述的第二种浸渍机理更依赖于药物对聚合物基质的亲和力。
在一个实施方式中,用于浸渍抗癌药物的条件与用于在存在和不存在共溶剂的情况下用于干燥支架的条件(40℃下100巴和90分钟)相同。已知向scco2添加极性溶剂如乙醇可增加许多极性物质的溶解度,如本研究中使用的药物,其具有大的分子量和/或分子极性,因此在二氧化碳中的溶解度低(yodaetal.,2011)。通过在文献中报道的药物超临界co2中的溶解度来确定10%乙醇的应用(jiaoetal.,2011;suleimanetal.,2005;vandanaandteja,1997;yodaetal.,2011)。
在一个实施方式中,将生物可降解输尿管支架(bus)中的抗癌药物的浸渍效率确定为抗癌药物的质量(μg)/聚合物的质量(mg)的函数。结果列于表2中。在药物etoh条件下,浸渍在支架中的抗癌药物的量更高,正如由于乙醇在增强药物中在co2中的溶解度的共溶剂效应所预期的。纯scco2(pabio)中浸渍的紫杉醇的量为0.046μgmg-1,而在paetoh条件下的那些量高出30%(0.067μgmg-1)。yoda等人(yodaetal.,2011)报道了类似的百分比,其中作者报道了紫杉醇在无定形聚(dl-乳酸)(pdlla)基质中的浸渍。与在该工作中获得的海藻酸盐/明胶基质相比,yoda等人浸渍的紫杉醇的量在pdlla中高出2-3倍。这可以通过药物-co2溶液在疏水性pdlla基质中的更高亲和力来证明(kazarian,2000)。此外,pdlla在scco2存在下也可能比海藻酸盐/明胶聚合物共混物具有更大的溶胀(cooper,2000;yodaetal.,2011)。关于其他药物,结果显示,当使用乙醇作为共溶剂时,ep的浸渍产率增加15%,dox增加12%,并且gem增加8%。在
表2.由scco2浸渍的药物的量(操作条件90分钟,100巴和40℃)(μg药物/mg聚合物)。
在一个实施方式中,进行人工尿液中的体外释放动力学。为了模拟体内条件,在aus中在37℃下进行抗癌药物从浸渍的biostent和商业输尿管支架中的释放。选择人工尿液(ph5.5)作为释放介质并定期更换该介质以提供漏槽(渗透,sink)状态。图4显示了来自支架的药物的释放曲线。
在一个实施方式中,观察到浸渍在bus中的四种抗癌药物的类似释放。比较其中涂覆bus的条件(药物涂层)与未涂覆的条件,可以得出结论,bus的pcl涂层不影响aus中的药物的释放。由于亲水性聚合物明胶+海藻酸盐与疏水性pcl之间的界面粘附性差,pcl层从支架表面分层。在浸入生理aus后,pcl涂层从表面脱离,因此观察到来自涂覆或未涂覆支架的不同药物的释放曲线之间没有显著差异。在商业支架的情况下,所有浸渍的药物在最初的24小时内释放。对于生物可降解系统,值得注意的是,在最初的4小时内,释放了近50%的药物浸渍量,并且剩余的药物在aus中持续释放直至72小时。支架在9天后降解。
在一个实施方式中,在不可降解支架中,我们观察到与bus相比更快的释放。由于合成聚合物的浸渍性差,这种更快的释放可能是合理的。在这种情况下,由于高密度聚合物网络,药物不能深深地渗透到聚合物基质的主体中,而是位于支架表面上或靠近支架表面,因此更容易释放到介质中(luetal.,2015b)。在生物可降解支架的情况下,它由94%的水和高度多孔的聚合物网络组成。此外,aus的酸性和高离子强度可使支架溶胀以促进释放。图4中显示的这四种抗癌药物的释放曲线有望用于utuc中的膀胱内化疗(luetal.,2015a)。
在一个实施方式中,通过细胞活力测试,即mtt测定,研究了抗癌药物(ic50)在与t24和huvec细胞接触时的作用。由此,计算四种药物中的每种药物在两种细胞系中的每种中的ic50。在这种情况下,ic50是抑制细胞存活所需浓度的量度,并且常规用于指定药物的体外效力(sebaugh,2011)。选择t24细胞系作为肌肉浸润性尿路上皮癌,并将huvec细胞用作非癌性对照细胞。在将细胞暴露于不同浓度下的游离药物4小时或72小时后进行细胞毒性评估(图5a和图5b)。四种抗癌药物显示出具有癌细胞系和huvec细胞的存活的浓度依赖性抑制谱。在图5(a和b)中,可以看出,对于两种细胞类型,浓度依赖性细胞毒性的趋势。这些在所有情况下都是类似的,并且预期72小时暴露呈现更高的杀伤效力。比较两个细胞之间的结果,可以得出结论,与huvec细胞相比,癌细胞对抗癌药物更敏感。
在图5(a和b)中,绘制了垂直线,其对应于每种药物在bus中浸渍的药物量。结果表明,对于所有药物,bus中浸渍的药物量均高于t24细胞的ic50值,并且低于huvec细胞的ic50值。重要的是,这表明在该研究中浸渍的bus可能对t24细胞具有细胞毒性作用,但对huvec细胞没有作用。在吉西他滨的情况下,bus中的药物量仍低于huvec的ic50,但理论上的药物量具有影响huvec细胞的能力,在72小时期间将细胞活力降低至接近50%。在直接接触法的情况下,没有观察到对huvec的影响,browne等人提出延迟释放可以降低毒性(browneetal.,2012)。
在一个实施方式中,四种药物对t24和huvec细胞显示出不同的细胞毒性浓度。结果显示t24和huvec对测试的抗癌药物具有时间和浓度依赖性细胞毒性。ic50值列于表3中。对于t24,紫杉醇在4小时暴露时间的ic50为281.98ng/ml,比huvec的相应值(849.81ng/ml)低约3倍。当暴露时间增加至72小时时,两种细胞之间的差异甚至更高,t24为7.30ng/ml,并且huvec细胞为501.50ng/ml。对于其他药物,细胞似乎不太敏感。在这些情况下,在紫杉醇谱中观察到的ic50值在μg/ml范围内而不是ng/ml范围内。与文献相比,72小时后(7.30ngml-1)对紫杉醇获得的值高于hadaschik等人获得的ic50值(2.85ngml-1)(hadaschiketal.,2008)。lu等人(luetal.,2015a)和yu等人(yuetal.,2015)报告了阿霉素对t24癌细胞的ic50,结果也显示出浓度依赖性细胞毒性,但分别呈现不同的ic50值范围,11.6ngml-1和4μgml-1。在吉西他滨的情况下,papadopoulos等人(papadopoulosetal.,2015)
表3。对于t24和huvec细胞,在4小时和74小时的抗癌药物的ic50(±std)
在一个实施方式中,通过支架与细胞的间接和直接接触测定t24细胞和huvec的活力,评价所开发的抗癌生物可降解输尿管支架的抗肿瘤/抗癌作用。图6显示了暴露72小时后通过间接接触测试的四种药物对抗t24癌细胞的结果。使用的对照是无药物培养基中的t24细胞和没有药物浸渍的支架。当与载药支架接触时,t24癌细胞在暴露于测试的不同药物时表现出类似的行为。在与药物释放的培养基接触4小时和72小时后,癌细胞的存活率在大多数情况下分别降低约25%和50%。当乙醇用作共溶剂(药物etoh)并且因此在支架中具有更多浸渍的药物时的条件也具有更高的杀伤效力,在暴露72小时后对于所有药物为约65%。当与未涂覆的支架相比时,考虑到bus(药物coat)涂层的效果,这些显示略低的功效。另一方面,商业支架(药物com)显示出显著较低的杀伤效力(约10%),这可能是由于浸渍结果中观察到的浸渍在支架中的药物量较低。
获得的令人惊讶的结果以及使用具有抗癌药物的输尿管支架治疗输尿管癌的新概念证明了以更接近的方式评估癌细胞活力是合理的。将浸渍的支架与t24癌细胞直接接触4小时72小时,并且还使用huvec作为对照。图6显示了通过直接接触暴露72小时后的t24癌细胞系和huvec细胞的细胞毒性测定。将所测试的不同条件与浸渍支架的杀伤效力进行比较,与通过间接接触t24癌细胞观察到的结果相似。尽管如此,与间接接触结果相比,所有条件都表现出更高的杀伤效力,增加约10%。由于浸渍的药物量较高,药物etoh条件再次显示具有最高的抗癌作用。用作对照细胞的huvec细胞在任何测试条件下孵育72小时后未显示出受损的活力。回顾图5(a和b),预计特别是在吉西他滨与huvec细胞接触的条件下会出现细胞毒性作用,因为支架中浸渍的药物浓度接近且测定的ic50值,但这并未被观察到并且细胞活力保持接近100%。因此,通过scco2浸渍在生物可降解输尿管支架中的抗癌药物的量在t24癌细胞中具有75%的杀伤效力,但这不影响非癌细胞(huvec)。
在一个实施方式中,在utuc的治疗中,仍然没有定义标准化学疗法。用于例如膀胱癌的剂量对于紫杉醇为约50mgm-2,对于阿霉素和表柔比星为30mgm-2,对于吉西他滨在最初的1至3天(nccn,未注明日期)为75mgm-2。因此,难以在此处确定的浓度(表2)与报告的值之间建立比较。尽管如此,此处呈现的体外结果表明,所开发的系统在上尿路中递送此类药物具有显著的潜力,具有证明的体外功效。为了提高bus的杀伤效力,可以将多于一种药物浸渍到聚合物基质中(browne和pandit,2014),因为不同的研究表明,施用多于一种药物(如顺铂和紫杉醇)联合使用可获得更高的细胞毒性和协同作用(hadaschik等人,2008;pu等人,2001)。
在一个实施方式中,通过光学显微镜研究了在t24癌细胞中浸渍有不同抗癌药物的生物可降解输尿管支架的作用。图7显示使用直接接触4小时和72小时后测试的四种不同抗癌药物中的每一种浸渍的生物支架(biostent)接触的t24癌细胞的光学显微镜图像。在4小时暴露时间后,可以看到大多数t24细胞与多边形细胞汇合[40],一些细胞开始呈现指示细胞死亡的圆形形状。当暴露时间增加至72小时时,细胞显示圆形形态,许多细胞分离并漂浮在生长培养基中,证实了浸渍的生物可降解输尿管支架对t24癌细胞的杀伤效力。在对照中,可以看到细胞是正常的汇合。
在一个实施方式中,通过超临界二氧化碳(scco2)用四种抗癌药物(紫杉醇、表柔比星、阿霉素和吉西他滨)浸渍生物可降解输尿管支架(不可降解的)。抗癌药物成功地浸渍到生物可降解输尿管支架中,并且在人工尿液中可持续释放。在所有情况下,当使用bus作为支持物时,在72小时后实现100%的浸渍药物的释放。在商业支架的情况下,浸渍的药物量较低并且所有药物的释放更快,在24小时内达到100%释放。对于所有测试的药物,通过与抗癌生物可降解支架直接接触的体外杀伤效力是相似的。我们的研究结果表明,所开发的浸渍生物可降解输尿管支架可作为抗癌药物的载体,并且潜在地是上尿路上尿路癌治疗的有效和持续的idd系统。
无论何时在本文件中使用的术语“包括”旨在表示所陈述的特征、整数、步骤、组分的存在,而不是排除一个或多个其他特征、整数、步骤、组分或其组的存在或添加。
本领域普通技术人员将理解,除非本文另有指示,否则所描述的特定步骤顺序仅是说明性的,并且可以在不脱离本公开的情况下进行改变。因此,除非另有说明,否则所描述的步骤是无序的,这意味着在可能的情况下,步骤可以任何方便或期望的顺序进行。
不应以任何方式看待本公开限于所描述的实施方式,并且本领域普通技术人员将预见到其修改的许多可能性。
上述实施方式是可组合的。以下权利要求进一步阐述了本公开的特定实施方式。
以下参考文献应在此考虑其全部内容:
aroso,i.m.,craveiro,r.,rocha,
audenet,f.,traxer,o.,bensalah,k.,rouprêt,m.,2013a.upperurinarytractinstillationsinthetreatmentofurothelialcarcinomas:areviewoftechnicalconstraintsandoutcomes.worldj.urol.31,45-52.
audenet,f.,yates,d.r.,cussenot,o.,rouprêt,m.,2013b.theroleofchemotherapyinthetreatmentofurothelialcellcarcinomaoftheupperurinarytract(uut-ucc).urol.oncol.31,407-13.
babjuk,m.,burger,m.,zigeuner,r.,shariat,s.f.,vanrhijn,b.w.g.,compérat,e.,sylvester,r.j.,kaasinen,e.,
barros,a.a.,oliveira,c.,reis,r.l.,lima,e.,duarte,a.r.c.,2015a.ketoprofen-elutingbiodegradableureteralstentsbyco2impregnation:invitrostudy.int.j.pharm.495,651-9.
barros,a.a.,rita,a.,duarte,c.,pires,r.a.,sampaio-marques,b.,ludovico,p.,lima,e.,mano,j.f.,reis,r.l.,2015b.bioresorbableureteralstentsfromnaturaloriginpolymers.j.biomed.mater.res.partbappl.biomater.103,608-617.
berens,a.r.,huvard,g.s.,korsmeyer,r.w.,kunig,f.w.,1992.applicationofcompressedcarbondioxideintheincorporationofadditivesintopolymers.j.appl.polym.sci.46,231-242.
browne,s.,fontana,g.,rodriguez,b.j.,pandit,a.,2012.aprotectiveextracellularmatrix-basedgenedeliveryreservoirfabricatedbyelectrostaticchargemanipulation.mol.pharm.9,3099-106.
browne,s.,pandit,a.,2014.multi-modaldeliveryoftherapeuticsusingbiomaterialscaffolds.j.mater.chem.b,2,6692,-6707.
champeau,m.,thomassin,j.-m.,tassaing,t.,jerome,c.,2015.drugloadingofsuturesbysupercriticalco2impregnation:effectofpolymer/druginteractionsandthermaltransitions.macromol.mater.eng.300,596–610.
cooper,a.i.,2000.polymersynthesisandprocessingusingsupercriticalcarbondioxide.j.mater.chem.10,207-234.
d.,l.,m.,m.,m.,k.,m.,s.,2014.hydrogelbaseddrugretentionsystemforthetreatmentofuppertracturothelialcarcinoma.eur.urol.suppl.13,e25–e25a.elvira,c.,fanovich,a.,fern??ndez,m.,fraile,j.,sanrom??n,j.,domingo,c.,2004.evaluationofdrugdeliverycharacteristicsofmicrospheresofpmma-pcl-cholesterolobtainedbysupercritical-co2impregnationandbydissolution-evaporationtechniques.j.control.release99,231–240.
hadaschik,b.a.,terborg,m.g.,jackson,j.,sowery,r.d.,so,a.i.,burt,h.m.,gleave,m.e.,2008.paclitaxelandcisplatinasintravesicalagentsagainstnon-muscle-invasivebladdercancer.bjuint.101,1347–1355.
hellenthal,n.j.,shariat,s.f.,margulis,v.,karakiewicz,p.i.,roscigno,m.,bolenz,c.,remzi,m.,weizer,a.,zigeuner,r.,bensalah,k.,ng,c.k.,raman,j.d.,kikuchi,e.,montorsi,f.,oya,m.,wood,c.g.,fernandez,m.,evans,c.p.,koppie,t.m.,2009.adjuvantchemotherapyforhighriskuppertracturothelialcarcinoma:resultsfromtheuppertracturothelialcarcinomacollaboration.j.urol.182,900-6.
jiao,z.,chen,z.,wu,y.,ma,s.,2011.determinationofpaclitaxelsolubilityincarbondioxideusingquartzcrystalmicrobalance.chinesej.chem.eng.19,227-231.
kazarian,s.g.,2000.polymerprocessingwithsupercriticalfluids.polym.sci.42,78-101.
kazarian,s.g.,martirosyan,g.g.,2002.spectroscopyofpolymer/drugformulationsprocessedwithsupercriticalfluids:insituatr–irandramanstudyofimpregnationofibuprofenintopvp.int.j.pharm.232,81-90.
khan,w.,farah,s.,domb,a.j.,2012.drugelutingstents:developmentsandcurrentstatus.j.control.release161,703-12.
kikic,i.,sist,p.,2000.applicationsofsupercriticalfluidstopharmaceuticals:controlleddrugreleasesystemsbt-supercriticalfluids:fundamentalsandapplications,in:kiran,e.,debenedetti,p.g.,peters,c.j.(eds.),.springernetherlands,dordrecht,pp.291–306.
kikic,i.,vecchione,f.,2003.supercriticalimpregnationofpolymers.curr.opin.solidstatemater.sci.7,399-405.
krambeck,a.e.,walsh,r.s.,denstedt,j.d.,preminger,g.m.,li,j.,evans,j.c.,lingeman,j.e.,2010.anoveldrugelutingureteralstent:aprospective,randomized,multicenterclinicaltrialtoevaluatethesafetyandeffectivenessofaketorolacloadedureteralstent,j.urol.j.urol.183,1037-1043.
lange,d.,bidnur,s.,hoag,n.,chew,b.h.,2015.ureteralstent-associatedcomplications[mdash]whereweareandwherewearegoing.natrevurol12,17–25.
lu,s.,neoh,k.g.,kang,e.-t.,mahendran,r.,chiong,e.,2015a.mucoadhesivepolyacrylamidenanogelasapotentialhydrophobicdrugcarrierforintravesicalbladdercancertherapy.eur.j.pharm.sci.72,57-68.
lu,s.,neoh,k.g.,kang,e.-t.,mahendran,r.,chiong,e.,2015b.mucoadhesivepolyacrylamidenanogelasapotentialhydrophobicdrugcarrierforintravesicalbladdercancertherapy.eur.j.pharm.sci.72,57-68.
mendez-probst,c.e.,goneau,l.w.,macdonald,k.w.,nott,l.,seney,s.,elwood,c.n.,lange,d.,chew,b.h.,denstedt,j.d.,cadieux,p.a.,2012.theuseoftriclosanelutingstentseffectivelyreducesureteralstentsymptoms:aprospectiverandomizedtrial.bjuint.110,749-754.
munoz,j.j.,ellison,l.m.,2000.uppertracturothelialneoplasms:incidenceandsurvivalduringthelast2decades.j.urol.164,1523-1525.
nccn,n.d.nccnclinicalpracticeguidelinesinoncology(nccn
nunes,a.v,rodriguez-rojo,s.,almeida,a.p.,matias,a.a.,rego,d.,simplicio,a.l.,bronze,m.r.,cocero,m.j.,duarte,c.m.m.,2010.supercriticalfluidsstrategiestoproducehybridstructuresfordrugdelivery.j.control.release148,e11–2.
papadopoulos,e.,yousef,g.,scorilas,a.,2015.gemcitabineimpactsdifferentiallyonbladderandkidneycancercells:distinctmodulationsintheexpressionpatternsofapoptosis-relatedmicrornasandbcl2familygenes.tumorbiol.36,3197-3207.
pu,y.s.,chen,j.,huang,c.y.,guan,j.y.,lu,s.h.,hour,t.c.,2001.cross-resistanceandcombinedcytotoxiceffectsofpaclitaxelandcisplatininbladdercancercells.j.urol.165,2082-5.
sebaugh,j.l.,2011.guidelinesforaccurateec50/ic50estimation.pharm.stat.10,128-134.
shaikh,m.,kichenadasse,g.,choudhury,n.r.,butler,r.,garg,s.,2013.non-vasculardrugelutingstentsaslocalizedcontrolleddrugdeliveryplatform:preclinicalandclinicalexperience.j.control.release172,105-17.
suleiman,d.,antonioest??vez,l.,pulido,j.c.,garc??a,j.e.,mojica,c.,2005.solubilityofanti-inflammatory,anti-cancer,andanti-hivdrugsinsupercriticalcarbondioxide.j.chem.eng.data.
vandana,v.,teja,a.s.,1997.thesolubilityofpaclitaxelinsupercriticalco2andn2o.fluidphaseequilib.135,83-87.
yoda,s.,sato,k.,oyama,h.t.,2011.impregnationofpaclitaxelintopoly(dl-lacticacid)usinghighpressuremixtureofethanolandcarbondioxide.rscadv.1,156-162.
york,p.,kompella,u.b.,shekunov,b.y.,2004.supercriticalfluidtechnologyfordrugproductdevelopment,drugsandthepharmaceuticalsciences.taylor&francis.
yu,q.,zhang,j.,zhang,g.,gan,z.,2015.synthesisandfunctionsofwell-definedpolymer-drugconjugatesasefficientnanocarriersforintravesicalchemotherapyofbladdercancera.macromol.biosci.15,509-520.。
- 还没有人留言评论。精彩留言会获得点赞!