CXCR4抑制剂及其用途的制作方法
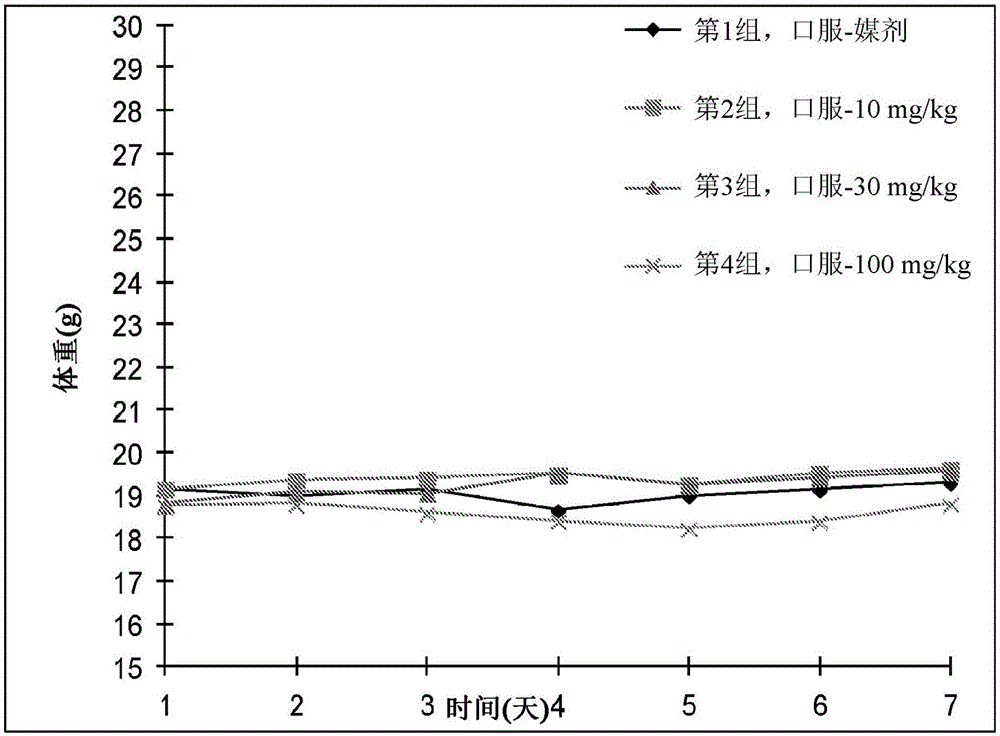
本申请根据35u.s.c.§119(e)要求于2016年6月21日提交的美国临时申请号62/352,816以及于2017年2月8日提交的美国临时申请号62/456,536的权益,所有这些美国临时申请的内容通过引用整体并入本文。本发明涉及用于抑制c-x-c受体4型(cxcr4)的化合物和方法。本发明还提供了包括本发明化合物的药学上可接受的组合物和使用所述组合物治疗各种病状的方法。
背景技术:
:c-x-c趋化因子受体4型(cxcr4),也称为融合素或分化簇184(cd184),是属于i类gpcr或视紫红质样gpcr家族的七跨膜g蛋白偶联受体(gpcr)。在正常生理条件下,cxcr4发挥多种作用,并且主要在造血和免疫系统中表达。cxcr4最初被发现为参与人体免疫缺损病毒(hiv)细胞入侵的共受体之一。随后的研究表明,其在许多组织中表达,包含脑、胸腺、淋巴组织、脾、胃和小肠,以及还有特定细胞类型,如造血干细胞(hsc)、成熟淋巴细胞和成纤维细胞。cxcl12,以前称为sdf-1α,是cxcr4的唯一已知配体。cxcr4在胚胎发育过程中以及响应于损伤和炎症介导干细胞的迁移。已证明cxcr4在人类疾病,如细胞增殖性病状、阿尔茨海默氏病、hiv、类风湿性关节炎、肺纤维化等中具有多种作用。例如,已经在几种肿瘤类型中注意到cxcr4和cxcl12的表达。cxcl12由癌症相关成纤维细胞(caf)表达,并且在肿瘤微环境(tme)中通常以高水平存在。在包含乳腺癌、卵巢癌、肾癌、肺癌和黑素瘤在内的多种肿瘤类型的临床研究中,已经将cxcr4/cxcl12的表达与预后不良以及转移到作为cxcl12表达的位点的淋巴结、肺、肝和大脑的风险增加相关。cxcr4常在黑素瘤细胞上表达,特别是在被认为代表黑素瘤干细胞的cd133+群体上;体外实验和鼠模型已证明cxcl12对此些细胞来说是趋化性的。此外,现已有证据表明cxcl12/cxcr4轴有助于使肿瘤对血管生成抑制剂的反应性(也称为“抗血管逃逸(angiogenicescape)”)丧失或缺乏。在动物癌症模型中,已证明干扰cxcr4功能改变tme并通过如消除肿瘤血管再生和增加cd8+t细胞与treg细胞的比率等多种机制使得肿瘤对免疫攻击敏感。这些效应在异种移植、同基因和转基因癌症模型中使肿瘤负荷显著降低并且使总体存活率增加。参见万哈兰塔(vanharanta)等人(2013)自然医学(natmed)19:50-56;加莱(gale)和麦科尔(mccoll)(1999)生物学论文集(bioessays)21:17-28;海菲尔(highfill)等人(2014)科学转化医学(scitranslmed)6:ra67;法恰贝内(facciabene)等人(2011)自然(nature)475:226-230。这些数据强调了对用于治疗由受体的异常或非期望表达介导的许多疾病和病症的cxcr4抑制剂的显著未满足的需求,例如在细胞增殖性病状中。技术实现要素:现已发现,本发明的化合物及其药学上可接受的组合物作为cxcr4抑制剂是有效的。一方面,本发明提供了一种式i的化合物:或其药学上可接受的盐,其中每个变量的定义和描述如本文所述。另一方面,本发明提供了一种式xii的化合物:或其药学上可接受的盐,其中每个变量的定义和描述如本文所述。本发明化合物及其药学上可接受的组合物可用于治疗与cxc受体4型(cxcr4)相关的各种疾病、病状或病症。此些疾病、病状或病症包含细胞增殖性病状(例如,癌症),如本文所述的病状。附图说明图1示出了对通过口服强饲法施用高达100mg/kg/天的化合物i-3的雄性c57bl/6小鼠的7天毒理学研究的结果。所有小鼠体重在研究期间保持稳定,并且没有观察到明显的毒性迹象。图2示出了对通过口服强饲法施用高达100mg/kg/天的化合物i-3的雄性c57bl/6小鼠的7天毒理学研究的食物消耗测量。图3示出了在雄性c57bl/6小鼠(5周龄)中以30mg/kg单次口服施用后i-3的平均血浆、脑和脑脊液(csf)浓度-时间曲线(n=3/时间点)。图4示出了在雄性c57bl/6小鼠(5周龄)中以30mg/kg重复口服施用后第7天i-3的平均血浆、脑和csf浓度-时间曲线(n=3/时间点)。具体实施方式1.本发明某些实施例的一般描述:本发明的化合物及其药物组合物可用作cxcr4的抑制剂。在不希望受任何特定理论的束缚的情况下,据信本发明的化合物及其药物组合物可以抑制cxcr4的活性,从而治疗如癌症等某些疾病。现已发现,本发明的化合物及其药学上可接受的组合物作为cxcr4抑制剂是有效的。一方面,本发明提供了一种式i的化合物:或其药学上可接受的盐,其中:环a是3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个r1独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6;每个r独立地是氢或选自以下的任选取代的基团:c1-6脂族;3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个l1和l2独立地是共价键或c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代;每个-cy-独立地是二价任选取代的3到8元饱和或部分不饱和的单环碳环;任选取代的亚苯基;具有1到3个独立地选自氮、氧或硫的杂原子的任选取代的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的任选取代的5到6元单环杂芳环;具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环饱和或部分不饱和杂环;或具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环杂芳环;r2是氢、-l2-r6或任选取代的c1-8脂族;r3是氢、任选取代的c1-6脂族或-l3-r6;l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;每个r4独立地是氢、氘、卤素、-cn、-or6或c1-4烷基,或同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s;每个r5独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6,或同一饱和碳原子上的两个r5基团任选地一起形成=nr、=nor、=o、=s或螺环3到6元碳环;每个r6独立地是氢或任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基;m是0、1、2、3或4;n是0、1、2、3或4;并且p是0、1、2、3或4。另一方面,本发明提供了一种式xii的化合物:或其药学上可接受的盐,其中:环a是3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个r1独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6;每个r独立地是氢或选自以下的任选取代的基团:c1-6脂族;3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个l1和l2独立地是共价键或c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代;每个-cy-独立地是二价任选取代的3到8元饱和或部分不饱和的单环碳环;任选取代的亚苯基;具有1到3个独立地选自氮、氧或硫的杂原子的任选取代的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的任选取代的5到6元单环杂芳环;具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环饱和或部分不饱和杂环;或具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环杂芳环;r2是氢、-l2-r6或任选取代的c1-8脂族;r3是氢、任选取代的c1-6脂族或-l3-r6;l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;每个r4独立地是氢、氘、卤素、-cn、-or6或c1-4烷基,或同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s;每个r5独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6,或同一饱和碳原子上的两个r5基团任选地一起形成=nr、=nor、=o、=s或螺环3到6元碳环;每个r6独立地是氢或任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基;m是0、1或2;n是0、1、2、3或4;并且p是0、1、2、3或4。2.化合物及定义:本发明的化合物包含本文总体上描述的化合物,并且通过本文揭示的类别、子类和种类进一步说明。如本文所使用的,除非另有说明,否则以下定义应适用。出于本发明的目的,化学元素根据元素周期表,cas版,化学和物理手册(handbookofchemistryandphysics),第75版进行标识的。此外,有机化学的一般原理描述于“有机化学(organicchemistry)”,托马斯索雷尔(thomassorrell),大学科学书籍(universitysciencebooks),索萨利托:1999,以及“玛奇高等有机化学(march'sadvancedorganicchemistry)”,第5版,编者:史密斯m.b.(smith,m.b.)和玛奇j.(march,j.),约翰·威立父子出版公司(johnwiley&sons),纽约:2001,这些文献的全部内容通过引用并入本文。如本文所使用的,术语“脂族”或“脂族基”意指完全饱和的或含有一或多个不饱和单元的直链的(即,无支链的)或支链的、取代的或未取代的烃链,或完全饱和或含有一或多个不饱和单元,但不是芳香族(在本文中也称为“碳环”、“脂环族”或“环烷基”),单个点附接到分子的其余部分的单环烃或双环烃。除非另有说明,否则脂族基含有1到6个脂族碳原子。在一些实施例中,脂族基含有1到5个脂族碳原子。在其它实施例中,脂族基含有1到4个脂族碳原子。在仍其它实施例中,脂族基含有1到3个脂族碳原子,而在又其它实施例中,脂族基含有1到2个脂族碳原子。在一些实施例中,“脂环族”(或“碳环”或“环烷基”)是指完全饱和或含有一或多个不饱和单元,但不是芳香族,单个点附接到分子的其余部分的单环c3到c6烃。合适的脂族基包含但不限于:直线型或支链的、取代的或未取代的烷基、烯基、炔基及其杂化物,如(环烷基)烷基、(环烯基)烷基或(环烷基)烯基。如本文所使用的,术语“双环”或“双环系统”是指任何双环系统,即碳环或杂环,饱和的或具有一或多个不饱和单元,在环系统的两个环之间具有一或多个共同的原子。因此,所述术语包含任何允许的环融合,如邻位融合或螺环。如本文所使用的,术语“杂双环”是“双环”的子集,其要求一或多个杂原子存在于双环的一个或两个环中。此些杂原子可以存在于环结处并且被任选取代,可以选自氮(包含n-氧化物)、氧、硫(包含氧化形式,如砜和磺酸盐)、磷(包含氧化形式,如磷酸盐)、硼等。在一些实施例中,双环基团具有7到12个环成员和0到4个独立地选自氮、氧或硫的杂原子。如本文所使用的,术语“桥连双环”是指任何双环系统,即碳环或杂环,饱和或部分不饱和的,具有至少一个桥。如iupac所定义的,“桥”是连接两个桥头的由原子构成的无支链的链或原子或价键,其中“桥头”是环系统的任何骨架原子,其结合到三个或三个以上骨架原子(不包含氢)。在一些实施例中,桥连双环基团具有7到12个环成员和0到4个独立地选自氮、氧或硫的杂原子。此些桥连双环基团是本领域公知的,并且包含下文阐述的那些基团,其中每个基团在任何可取代的碳或氮原子处附接到分子的其余部分。除非另有规定,否则桥连双环基团任选地被一或多个针对脂族基所阐述的取代基取代。另外地或可替代地,桥连双环基团的任何可取代氮是任选取代的。示范性双环包含:示范性桥接双环包含:术语“低级烷基”是指c1-4直链或支链烷基。示范性低级烷基是甲基、乙基、丙基、异丙基、丁基、异丁基和叔丁基。术语“低级卤代烷基”是指被一或多个卤素原子取代的c1-4直链或支链烷基。术语“杂原子”是指氧、硫、氮、磷或硅中的一或多种(包含氮、硫、磷或硅的任何氧化形式;任何碱性氮的季铵化形式;或杂环的可取代的氮,例如n(如在3,4-二氢-2h-吡咯基中)、nh(如在吡咯烷基中)或nr+(如在n-取代的吡咯烷基中))。如本文所使用的,术语“不饱和的”是指部分具有一或多个不饱和单元。如本文所使用的,术语“二价c1-8(或c1-6)饱和或不饱和的、直链或支链烃链”是指如本文所定义的直链或支链的二价亚烷基、亚烯基和亚炔基链。术语“亚烷基”是指二价烷基。“亚烷基链”是聚亚甲基,即,-(ch2)n-,其中n是正整数,优选地1到6、1到4、1到3、1到2或2到3。取代的亚烷基链是其中一或多个亚甲基氢原子被取代基替代的聚亚甲基。合适的取代基包含下文针对取代的脂族基描述的取代基。术语“亚烯基”是指二价烯基。取代的亚烯基链是含有至少一个双键的、其中一或多个氢原子被取代基替代的聚亚甲基。合适的取代基包含下文针对取代的脂族基描述的取代基。如本文使用的,术语“环丙烯基”是指以下结构的二价环丙基:术语“卤素”表示f、cl、br或i。单独使用或作为较大部分的一部分,如在“芳烷基”、“芳烷氧基”或“芳氧基烷基”中使用的术语“芳基”是指具有共五到十四个环成员的单环或双环系统,其中所述系统中的至少一个环是芳香族,并且其中所述系统中的每个环含有3到7个环成员。术语“芳基”可以与术语“芳基环”互换使用。在本发明的某些实施例中,“芳基”是指芳环系统,其包含但不限于苯基、联苯基、萘基、蒽基等,其可以携带一或多个取代基。如本文所使用的,术语“芳基”的范围还包含其中芳族环融合到一或多个非芳族环,如茚满基、邻苯二甲酰亚胺基、萘基亚胺基、菲啶基或四氢萘基等的基团。单独使用或作为较大部分,例如“杂芳烷基”或“杂芳烷氧基”的一部分使用的术语“杂芳基”和“杂芳-”是指这样的基团,其具有5到10个环原子,优选地5、6或9个环原子;在循环阵列中共用6、10或14个π电子;并且除碳原子外,还具有一到五个杂原子。术语“杂原子”是指氮、氧或硫,并且包含氮或硫的任何氧化形式,以及碱性氮的任何季铵化形式。杂芳基包含但不限于:噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、恶唑基、异恶唑基、恶二唑基、噻唑基、异噻唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、中氮茚基、嘌呤基、二氮杂萘基和蝶啶基。如本文所使用的,术语“杂芳基”和“杂芳-”还包含其中杂芳环融合到一或多个芳基、脂环族或杂环基环的基团,其中基团或附接点在杂芳环上。非限制性实例包含:吲哚基、异吲哚基、苯噻嗯基、苯并呋喃基、二苯并呋喃基、吲唑基、苯并咪唑基、苯噻唑基、喹啉基、异喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4h-喹嗪基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩恶嗪基、四氢喹啉基、四氢异喹啉基、和吡啶并[2,3-b]-1,4-恶嗪-3(4h)-酮。杂芳基可以是单环或双环的。术语“杂芳基(heteroaryl)”可以与术语“杂芳基环”、“杂芳基(heteroarylgroup)”或“杂芳族”互换使用,其中任何术语包含任选取代的环。术语“杂芳烷基”是指被杂芳基取代的烷基,其中烷基和杂芳基部分独立地是任选取代的。如本文所使用的,术语“杂环(heterocycle)”、“杂环基”、“杂环基团”和“杂环(heterocyclicring)”可互换使用,并且是指稳定的5到7元单环或7到10元双环杂环部分,其是饱和或部分不饱和的并且除碳原子外还具有一或多个,优选地一到四个杂原子,如上所定义的。当关于杂环的环原子使用时,术语“氮”包括取代的氮。作为实例,在具有0到3个选自氧、硫或氮的杂原子的饱和或部分不饱和的环中,氮可以是n(如在3,4-二氢-2h-吡咯基中)、nh(如在吡咯烷基中)或+nr(如在n-取代的吡咯烷基中)。杂环可以在产生稳定结构的任何杂原子或碳原子处连接到其侧基,并且环原子中任一个可以被任选取代。此些饱和或部分不饱和的杂环基团的实例包含但不限于:四氢呋喃基、四氢噻吩基、吡咯烷基、哌啶基、吡咯啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、恶唑烷基、哌嗪基、二恶烷基、二氧戊环基、二氮杂环基、氧氮杂环基、硫氮杂环基、吗啉基、和奎宁环基。术语“杂环”、“杂环基”、“杂环基环”、“杂环基”、“杂环部分”、和“杂环基团”在本文中可互换使用,并且还包含其中杂环基环融合到一或多个芳基、杂芳基或如二氢吲哚基、3h-吲哚基、苯并二氢吡喃基、菲啶基或四氢喹啉基等脂环族环的基团。杂环基可以是单环或双环的。术语“杂环烷基”是指被杂环基取代的烷基,其中烷基和杂环基部分独立地是任选取代的。如本文所使用的,术语“部分不饱和的”是指包含至少一个双键或三键的环部分。术语“部分不饱和的”旨在涵盖具有多个不饱和位点的环,但不旨在包含如本文所定义的芳基或杂芳基部分。如本文所述,本发明的化合物可以含有“任选取代的”部分。通常,术语“取代的”,无论前面是否有术语“任选”,都意味着指定部分的一或多个氢被适当的取代基替代。除非另有说明,否则“任选取代的”基团可以在所述基团的每个可取代位置处具有适当的取代基,并且在任何给定结构中的多于一个位置可以被多于一个选自指定组的取代基取代时,在每个位置处,取代基可以相同或不同。本发明所设想的取代基组合优选地是导致形成稳定或化学上可行的化合物的取代基组合。如本文使用的,术语“稳定的”是指这样的化合物:所述化合物在经历允许其被生产、被检测并且在某些实施例中被恢复、被纯化并且被用于本文揭示的目的中的一或多个的条件时,其基本上不会变化。可取代碳上的每个任选取代基是独立地选自以下的一价取代基:卤素;-(ch2)0-4r°;-(ch2)0-4or°;-o(ch2)0-4ro、-o-(ch2)0-4c(o)or°;-(ch2)0-4ch(or°)2;-(ch2)0-4sr°;-(ch2)0-4ph,其可以被r°取代;-(ch2)0-4o(ch2)0-1ph,其可以被r°取代;-ch=chph,其可以被r°取代;-(ch2)0-4o(ch2)0-1-吡啶基,其可以被r°取代;-no2;-cn;-n3;-(ch2)0-4n(r°)2;-(ch2)0-4n(r°)c(o)r°;-n(r°)c(s)r°;-(ch2)0-4n(r°)c(o)nr°2;-n(r°)c(s)nr°2;-(ch2)0-4n(r°)c(o)or°;-n(r°)n(r°)c(o)r°;-n(r°)n(r°)c(o)nr°2;-n(r°)n(r°)c(o)or°;-(ch2)0-4c(o)r°;-c(s)r°;-(ch2)0-4c(o)or°;-(ch2)0-4c(o)sr°;-(ch2)0-4c(o)osir°3;-(ch2)0-4oc(o)r°;-oc(o)(ch2)0-4sr-、sc(s)sr°;-(ch2)0-4sc(o)r°;-(ch2)0-4c(o)nr°2;-c(s)nr°2;-c(s)sr°;-sc(s)sr°、-(ch2)0-4oc(o)nr°2;-c(o)n(or°)r°;-c(o)c(o)r°;-c(o)ch2c(o)r°;-c(nor°)r°;-(ch2)0-4ssr°;-(ch2)0-4s(o)2r°;-(ch2)0-4s(o)2or°;-(ch2)0-4os(o)2r°;-s(o)2nr°2;-s(o)(nr°)r°;-s(o)2n=c(nr°2)2;-(ch2)0-4s(o)r°;-n(r°)s(o)2nr°2;-n(r°)s(o)2r°;-n(or°)r°;-c(nh)nr°2;-p(o)2r°;-p(o)r°2;-op(o)r°2;-op(o)(or°)2;sir°3;-(c1-4直链或支链亚烷基)o-n(r°)2;或-(c1-4直链或支链亚烷基)c(o)o-n(r°)2。每个r°独立地是氢;c1-6脂族;-ch2ph;-o(ch2)0-1ph;-ch2-(5到6元杂芳基环);或具有0到4个独立地选自氮、氧或硫的杂原子的5到6元饱和的、部分不饱和的或芳基环,或者尽管上文进行了定义,但是两个独立存在的r°结合其一或多个介入原子形成具有0到4个独立地选自氮、氧或硫的杂原子的3到12元饱和的、部分不饱和的或芳基单环或双环,所述杂原子可以被r°的饱和碳原子上的选自=o和=s的二价取代基取代;或者每个r°任选地被独立地选自以下的一价取代基取代:卤素、-(ch2)0-2r·、-(卤代·)、-(ch2)0-2oh、-(ch2)0-2or·、-(ch2)0-2ch(or·)2;-o(卤代·)、-cn、-n3、-(ch2)0-2c(o)r·、-(ch2)0-2c(o)oh、-(ch2)0-2c(o)or·、-(ch2)0-2sr·、-(ch2)0-2sh、-(ch2)0-2nh2、-(ch2)0-2nhr·、-(ch2)0-2nr·2、-no2、-sir·3、-osir·3、-c(o)sr·、-(c1-4直链或支链亚烷基)c(o)or·或-ssr·。每个r·独立地选自c1-4脂族;-ch2ph;-o(ch2)0-1ph;或具有0到4个独立地选自氮、氧或硫的杂原子的5到6元饱和的、部分不饱和的或芳基环,并且其中每个r·是未取代的或者在前面为卤代的情况下仅被一或多个卤素取代;或其中饱和碳上的任选取代基是独立地选自以下的二价取代基:=o、=s、=nnr*2、=nnhc(o)r*、=nnhc(o)or*、=nnhs(o)2r*、=nr*、=nor*、-o(c(r*2))2-3o-或-s(c(r*2))2-3s-,或结合到“任选取代的”基团的邻位可取代的碳的二价取代基是-o(cr*2)2-3o-,其中每个独立出现的r*选自氢、c1-6脂族或未取代的具有0到4个独立地选自氮、氧或硫的杂原子的5到6元饱和的、部分不饱和的或芳基环。当r*是c1-6脂族时,r*任选地被卤素、-r·、-(卤代r·)、-oh、-or·、-o(卤代r·)、-cn、-c(o)oh、-c(o)or·、-nh2、-nhr·、-nr·2或-no2取代,其中每个r·独立地选自c1-4脂族、-ch2ph、-o(ch2)0-1ph或具有0到4个独立地选自氮、氧或硫的杂原子的5到6元饱和的、部分不饱和的或芳基环,并且其中每个r·是未取代的或者在前面为卤代的情况下仅被一或多个卤素取代。可取代的氮上的任选取代基独立地是其中每个独立地是氢、c1-6脂族、未取代的-oph或具有0到4个独立地选自氮、氧或硫的杂原子的未取代的5到6元饱和的、部分不饱和的或芳基环,或者两个独立出现的结合其一或多个介入原子形成具有0到4个独立地选自氮、氧或硫的杂原子的未取代的3到12元饱和的、部分不饱和的或芳基单环或双环;其中当是c1-6脂族时,任选地被卤素、-r·、-(卤代r·)、-oh、-or·、-o(卤代r·)、-cn、-c(o)oh、-c(o)or·、-nh2、-nhr·、-nr·2或-no2取代,其中每个r·独立地选自c1-4脂族、-ch2ph、-o(ch2)0-1ph或具有0到4个独立地选自氮、氧或硫的杂原子的5到6元饱和的、部分不饱和的或芳基环,并且其中每个r·是未取代的或者在前面为卤代的情况下仅被一或多个卤素取代。如本文所使用的,术语“药学上可接受的盐”是指在合理的医学判断范围内适合用于与人和低等动物的组织接触而没有过度毒性、刺激、过敏反应等,并与合理的利益/风险比相称的那些盐。药学上可接受的盐在本领域中是众所周知的。例如,s.m.贝尔热(s.m.berge)等人在药物科学杂志(j.pharmaceuticalsciences),1977,66,1-19中详细描述了药学上可接受的盐,所述文献通过引用并入本文。本发明的化合物的药学上可接受的盐包含衍生自合适的无机和有机酸和碱的盐。药学上可接受的、无毒的酸加成盐的实例是用以下酸形成的具有氨基的盐:无机酸如盐酸、氢溴酸、磷酸、硫酸以及高氯酸;有机酸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸;或通过使用本领域中所使用的其它方法如离子交换形成的具有氨基的盐。其它药学上可接受的盐包含己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑、磺酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸、己酸盐、氢碘酸、2-羟基乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯丙酸盐、磷酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸钠、十一酸盐、戊酸盐等。衍生自适当碱的盐包含碱金属盐、碱土金属盐、铵盐和n+(c1-4烷基)4盐。代表性的碱金属或碱土金属盐包含钠、锂、钾、钙、镁等。适当的情况下,其它药学上可接受的盐包含使用如卤化物、氢氧化物、羧酸盐、硫酸盐、磷酸盐、硝酸盐、低级烷基磺酸盐和芳基磺酸盐的抗衡离子形成的无毒铵、季铵和胺阳离子。除非另有说明,否则本文描述的结构也意味着包含结构的所有异构(例如,对映体、非对映体、和几何体(或构象))形式;例如,每个不对称中心的r和s构型、z和e双键异构体、以及z和e构象异构体。因此,本发明的化合物的单一立体化学异构体以及对映体、非对映体及几何体(或构象)混合物在本发明的范围内。除非另外说明,本发明的化合物的所有互变异构形式在本发明的范围内。此外,除非另外说明,否则本文所描述的结构也意在包含不同之处仅为存在一或多个同位素富集原子的化合物。例如,具有包含由氘或氚替代氢或由13c-或14c-富集碳替代碳的本发明结构的化合物在本发明的范围内。根据本发明,此些化合物可以用作例如分析工具、生物测定中的探针或治疗剂。在某些实施例中,所提供的化合物的弹头部分r1包括一或多个氘原子。如本文所使用的,术语“抑制剂”定义为以可测量的亲和力结合到和/或抑制cxcr4的化合物。在某些实施例中,抑制剂的ic50和/或结合常数小于约100μm、小于约50μm、小于约1μm、小于约500nm、小于约100nm、小于约10nm或小于约1nm。如本文所使用的,术语“可测量的亲和力”和“可测量的抑制”是指包括本发明的化合物或其组合物和cxcr4的样品与和包括cxcr4而不存在所述化合物或其组合物的等效样品之间的cxcr4活性的可测量变化。3.示范性实施例的说明:一方面,本发明提供了一种式i的化合物:或其药学上可接受的盐,其中:环a是3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个r1独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6;每个r独立地是氢或选自以下的任选取代的基团:c1-6脂族;3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个l1和l2独立地是共价键或c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代;每个-cy-独立地是二价任选取代的3到8元饱和或部分不饱和的单环碳环;任选取代的亚苯基;具有1到3个独立地选自氮、氧或硫的杂原子的任选取代的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的任选取代的5到6元单环杂芳环;具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环饱和或部分不饱和杂环;或具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环杂芳环;r2是氢、-l2-r6或任选取代的c1-8脂族;r3是氢、任选取代的c1-6脂族或-l3-r6;l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;每个r4独立地是氢、氘、卤素、-cn、-or6或c1-4烷基,或同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s;每个r5独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6,或同一饱和碳原子上的两个r5基团任选地一起形成=nr、=nor、=o、=s或螺环3到6元碳环;每个r6独立地是氢或任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基;m是0、1、2、3或4;n是0、1、2、3或4;并且p是0、1、2、3或4。另一方面,本发明提供了一种式xii的化合物:或其药学上可接受的盐,其中:环a是3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个r1独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6;每个r独立地是氢或选自以下的任选取代的基团:c1-6脂族;3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环;每个l1和l2独立地是共价键或c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代;每个-cy-独立地是二价任选取代的3到8元饱和或部分不饱和的单环碳环;任选取代的亚苯基;具有1到3个独立地选自氮、氧或硫的杂原子的任选取代的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的任选取代的5到6元单环杂芳环;具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环饱和或部分不饱和杂环;或具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环杂芳环;r2是氢、-l2-r6或任选取代的c1-8脂族;r3是氢、任选取代的c1-6脂族或-l3-r6;l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;每个r4独立地是氢、氘、卤素、-cn、-or6或c1-4烷基,或同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s;每个r5独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6,或同一饱和碳原子上的两个r5基团任选地一起形成=nr、=nor、=o、=s或螺环3到6元碳环;每个r6独立地是氢或任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基;m是0、1或2;n是0、1、2、3或4;并且p是0、1、2、3或4。如上总体上定义的,环a是3到8元饱和或部分不饱和的单环碳环;苯基;8到10元双环芳族碳环;具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环;或具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环。在一些实施例中,环a是3到8元饱和或部分不饱和的单环碳环。在一些实施例中,环a是苯基。在一些实施例中,环a是8到10元双环芳族碳环。在一些实施例中,环a是具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环。在一些实施例中,环a是具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环。在一些实施例中,环a是具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环。在一些实施例中,环a是具有1到2个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环。在一些实施例中,环a选自:在一些实施例中,环a选自在一些实施例中,环a选自在一些实施例中,环a是在一些实施例中,环a不是在一些实施例中,环a不是在一些实施例中,环a不是在一些实施例中,环a不是苯并咪唑。在一些实施例中,环a不是咪唑。在一些实施例中,环a选自下表1中所示的那些。如上文总体上定义的,每个r1独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6。在一些实施例中,r1是r。在一些实施例中,r1是卤素。在一些实施例中,r1是-cn。在一些实施例中,r1是-or。在一些实施例中,r1是-n(r)2。在一些实施例中,r1是-no2。在一些实施例中,r1是-n3。在一些实施例中,r1是-sr。在一些实施例中,r1是-l1-r6。在一些实施例中,r1是氢。在一些实施例中,r1是任选取代的c1-6脂族基。在一些实施例中,r1是任选取代的3到8元饱和或部分不饱和的单环碳环。在一些实施例中,r1是任选取代的苯基。在一些实施例中,r1是任选取代的8到10元双环芳族碳环。在一些实施例中,r1是任选取代的具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环。在一些实施例中,r1是任选取代的具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环。在一些实施例中,r1是任选取代的具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环。在一些实施例中,r1选自-r、卤素、-cn、-or、-n(r)2、-sr、c1-6脂族或-l1-r6,其中l1是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-n(r)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;其中所述c1-6脂族基任选地被1、2或3个独立地选自以下的基团取代:卤素、-cn、-n(r)2、-no2、-n3、=nr、=nor、=o、=s、-or、-sr、-so2r、-s(o)r、-r、-cy-r、-c(o)r、-c(o)or、-oc(o)r、-c(o)n(r)2、-(r)nc(o)r、-oc(o)n(r)2、-(r)nc(o)or、-n(r)c(o)n(r)2、-so2n(r)2、-(r)nso2r、-c(s)r或-c(s)or;并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r1选自氢、卤素、c1-6烷基(任选被1、2或3个卤素取代)、-cn、-n(r)2、-or、-sr、-s(o)r6、-so2r6、-so2nhr6、并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r1选自氢、卤素、c1-6烷基、-cn、-n(r)2、-or、-sr、并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r1选自下表1中所示的那些。如上文总体上定义的,每个l1和l2独立地是共价键或c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代。在一些实施例中,l1是共价键。在一些实施例中,l1是c1-8二价直链或支链烃链。在一些实施例中,l1是c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代。在一些实施例中,l1是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-或-cy-替代,并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,l1选自下表1中所示的那些。在一些实施例中,l2是共价键。在一些实施例中,l2是c1-8二价直链或支链烃链。在一些实施例中,l2是c1-8二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-oc(o)n(r)-、-(r)nc(o)o-、-n(r)c(o)n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-、-c(s)o-、-oc(s)-、-c(s)n(r)-、-(r)nc(s)-、-(r)nc(s)n(r)-或-cy-替代。在一些实施例中,l2是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-n(r)-、-s-、-so-、-so2-、-so2n(r)-、-(r)nso2-、-c(s)-或-cy-替代,并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,l2选自下表1中所示的那些。如上文总体上定义的,每个-cy-独立地是二价任选取代的3到8元饱和或部分不饱和的单环碳环;任选取代的亚苯基;具有1到3个独立地选自氮、氧或硫的杂原子的任选取代的4到8元饱和或部分不饱和的单环杂环;具有1到4个独立地选自氮、氧或硫的杂原子的任选取代的5到6元单环杂芳环;具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环饱和或部分不饱和杂环;或具有1到5个独立地选自氮、氧或硫的杂原子的任选取代的8到10元双环或桥连双环杂芳环。在一些实施例中,-cy-是二价任选取代的3到8元饱和或部分不饱和的单环碳环。在一些实施例中,-cy-是任选取代的亚苯基。在一些实施例中,-cy-是任选取代的具有1到3个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环。在一些实施例中,-cy-是任选取代的具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环。在一些实施例中,-cy-是任选取代的具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环或桥连双环饱和或部分不饱和的杂环。在一些实施例中,-cy-是任选取代的具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环或桥连双环杂芳环。在一些实施例中,-cy-是在一些实施例中,-cy-选自下表1中所示的那些。如上文总体上定义的,r2是氢、-l2-r6或任选取代的c1-8脂族。在一些实施例中,r2是氢。在一些实施例中,r2是-l2-r6。在一些实施例中,r2是任选取代的c1-8脂族。在一些实施例中,r2是氢、任选取代的c1-6脂族或-l2-r6,其中l2是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-n(r)-、-s-、-so-、-so2-、-c(s)-或-cy-替代;其中所述c1-6脂族基任选地被1、2或3个独立地选自以下的基团取代:卤素、-cn、-n(r)2、-no2、-n3、=nr、=nor、=o、=s、-or、-sr、-so2r、-s(o)r、-r、-cy-r、-c(o)r、-c(o)or、-oc(o)r、-c(o)n(r)2、-(r)nc(o)r、-oc(o)n(r)2、-(r)nc(o)or、-n(r)c(o)n(r)2、-so2n(r)2、-(r)nso2r、-c(s)r或-c(s)or;其中且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r2选自氢、c1-6烷基(任选地被1、2或3个卤素取代)、-s(o)r6、-so2r6、-so2nhr6、-(ch2)1-6-n(r)r6、-(ch2)1-6-or6或-(ch2)0-6-cy-r6。在一些实施例中,r2选自氢、-s(o)r6、-so2r6、-so2nhr6、-(ch2)1-6-n(r)r6、-(ch2)1-6-or6、并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r2选自下表1中所示的那些。如上文总体上定义的,r3是氢、任选取代的c1-6脂族或-l3-r6。在一些实施例中,r3是氢。在一些实施例中,r3是任选取代的c1-6脂族。在一些实施例中,r3是-l3-r6。在一些实施例中,r3选自氢、任选地被1、2或3个独立地选自以下的基团取代的c1-6烷基:氘、卤素、-cn、-n(r)2、-no2、-n3、=nr、=nor、=o、=s、-or、-sr、-so2r、-s(o)r、-r、-cy-r、-c(o)r、-c(o)or、-oc(o)r、-c(o)n(r)2、-(r)nc(o)r、-oc(o)n(r)2、-(r)nc(o)or、-n(r)c(o)n(r)2、-so2n(r)2、-(r)nso2r、-c(s)r或-c(s)or。在一些实施例中,r3选自氢、c1-6烷基(任选地被1、2或3个氘或卤素原子取代)、-(ch2)1-6-cn、-(ch2)1-6-n(r)(r6)、-(ch2)1-6-or6或-(ch2)0-6-cy-r6。在一些实施例中,r3选自氢或c1-6烷基(任选地被1、2或3个氘或卤素原子取代)、-(ch2)1-6-cn、-(ch2)1-6-n(r)(r6)、-(ch2)1-6-or6、并且每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r3是氢或任选地被1、2或3个氘原子、卤素原子、苯基、吡啶基、-cn、-n(r)2或-or取代的c1-6烷基,其中每个r独立地是氢、-ch2-苯基、苯基、c1-6烷基、环丙基、环丁基、环戊基、环己基、-ch2f、-chf2、-cf3、-ch2chf2或-ch2cf3;或每个r独立地是氢或甲基;或r是氢。在一些实施例中,r3为氢或任选地被吡啶基、-n(r)2、-cn或1、2或3个氘或卤素原子取代的c1-4烷基,其中r是氢或c1-3烷基。在一些实施例中,r3是氢、甲基、乙基、-cd3或-ch2cf3。在一些实施例中,r3是甲基。在一些实施例中,r3选自下表1中所示的那些。如上文总体上定义的,l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代。在一些实施例中,l3是c1-6二价直链或支链烃链。在一些实施例中,l3是c1-6二价直链或支链烃链,其中所述链的1、2或3个亚甲基单元独立地且任选地被-o-、-c(o)-、-c(o)o-、-oc(o)-、-n(r)-、-c(o)n(r)-、-(r)nc(o)-、-s-、-so-、-so2-、-c(s)-或-cy-替代。在一些实施例中,l3是c1-4二价直链烃链,其中所述链的1个亚甲基单元被-cy-取代。在一些实施例中,l3是-(ch2)-或-(ch2)1-4-cy-。在一些实施例中,l3选自下表1中所示的那些。如上文总体上定义的,每个r4独立地是氢、氘、卤素、-cn、-or6或c1-4烷基,或同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s。在一些实施例中,r4是氢。在一些实施例中,r4是氘。在一些实施例中,r4是卤素。在一些实施例中,r4是-cn。在一些实施例中,r4是-or6。在一些实施例中,r4是c1-4烷基。在一些实施例中,同一碳上的两个r4基团任选地一起形成=nr6、=nor6、=o或=s。在一些实施例中,r4是氢、氘、卤素、-cn、c1-2烷基,或同一碳上的两个r4基团一起形成=o或=s。在一些实施例中,r4选自下表1中所示的那些。如上文总体上定义的,每个r5独立地是r、卤素、-cn、-or、-n(r)2、-no2、-n3、-sr或-l1-r6或同一饱和碳原子上的两个r5基团任选地一起形成=nr、=nor、=o、=s或螺环3到6元碳环。在一些实施例中,r5是r。在一些实施例中,r5是卤素。在一些实施例中,r5是-cn。在一些实施例中,r5是-or。在一些实施例中,r5是-n(r)2。在一些实施例中,r5是-no2。在一些实施例中,r5是-n3。在一些实施例中,r5是-sr。在一些实施例中,r5是-l1-r6。在一些实施例中,同一饱和碳原子上的两个r5基团一起形成=nr、=nor、=o、=s或螺环3到6元碳环。在一些实施例中,r5是氢。在一些实施例中,r5是任选取代的c1-6脂族基。在一些实施例中,r5是任选地被1、2、3或4个氘或卤素原子取代的c1-6烷基。在一些实施例中,r5是任选取代的3到8元饱和或部分不饱和的单环碳环。在一些实施例中,r5是任选取代的苯基。在一些实施例中,r5是任选取代的8到10元双环芳族碳环。在一些实施例中,r5是任选取代的具有1到2个独立地选自氮、氧或硫的杂原子的4到8元饱和或部分不饱和的单环杂环。在一些实施例中,r5是任选取代的具有1到4个独立地选自氮、氧或硫的杂原子的5到6元单环杂芳环。在一些实施例中,r5是任选取代的具有1到5个独立地选自氮、氧或硫的杂原子的8到10元双环杂芳环。在一些实施例中,r5是氢、c1-6烷基、卤素、-cn、-cf3、-cd3、环丙基、乙炔基、-och3、-ocf3或在一些实施例中,r5是甲基。在一些实施例中,r5选自下表1中所示的那些。如上文总体上定义的,每个r6独立地是氢或任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基。在一些实施例中,r6是氢。在一些实施例中,r6是任选地被1、2、3、4、5或6个氘或卤素原子取代的c1-6烷基。在一些实施例中,r6是任选地被1、2或3个卤素取代的c1-3烷基。在一些实施例中,r6选自下表1中所示的那些。如上文总体上定义的,m是0、1、2、3或4。在一些实施例中,m是0。在一些实施例中,m是1。在一些实施例中,m是2。在一些实施例中,m是3。在一些实施例中,m是4。在一些实施例中,m是0、1、2或3。在一些实施例中,m是0、1或2。在一些实施例中,m是1、2或3。如上文总体上定义的,n是0、1、2、3或4。在一些实施例中,n是0。在一些实施例中,n是1。在一些实施例中,n是2。在一些实施例中,n是3。在一些实施例中,n是4。在一些实施例中,n是0、1、2或3。在一些实施例中,n是0、1或2。在一些实施例中,n是1、2或3。如上文总体上定义的,p是0、1、2、3或4。在一些实施例中,p是0。在一些实施例中,p是1。在一些实施例中,p是2。在一些实施例中,p是3。在一些实施例中,p是4。在一些实施例中,p是0、1、2或3。在一些实施例中,p是0、1或2。在一些实施例中,p是1、2或3。在一些实施例中,本发明提供了一种式ii-a或ii-b的化合物:或其药学上可接受的盐,其中环a、r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、m、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式iii的化合物:或其药学上可接受的盐,其中环a、r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式iv的化合物:或其药学上可接受的盐,其中环a、r、r1、r3、r4、r5、r6、l1、l3、-cy-、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式v的化合物:或其药学上可接受的盐,其中环a、r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式vi的化合物:或其药学上可接受的盐,其中r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、m、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式vii-a、vii-b或vii-c的化合物:或其药学上可接受的盐,其中r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、m、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式viii-a、viii-b、viii-c、viii-d或viii-e的化合物:或其药学上可接受的盐,其中r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、和n中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式ix的化合物:或其药学上可接受的盐,其中r、r1、r2、r5、r6、l1、l2、-cy-、m、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式x-a或x-b的化合物:或其药学上可接受的盐,其中r、r5、r6、l1、-cy-、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式xi的化合物:或其药学上可接受的盐,其中r、r1、r2、r6、l1、l2、-cy-、和m中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式xiii或xiv的化合物:或其药学上可接受的盐,其中环a、r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、m、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。在一些实施例中,本发明提供了一种式xv、xvi、xvii、xviii、xix或xx的化合物:或其药学上可接受的盐,其中r、r1、r2、r3、r4、r5、r6、l1、l2、l3、-cy-、m、n、和p中的每一个的定义如上且在本文实施例中单独地或组合地进行描述。本发明的示范性化合物在表1中列出。表1.示范性化合物在一些实施例中,本发明提供了上表1中阐述的化合物或其药学上可接受的盐。4.提供本发明化合物的一般方法:本发明化的合物通常可以通过本领域技术人员已知的针对类似化合物的合成和/或半合成方法以及通过本文实例中详细描述的方法制备或分离。在下述方案中,在描绘了特定保护基团(“pg”)、离去基团(“lg”)或转化条件的情况下,本领域的普通技术人员将认识到其它保护基团、离去基团和转化条件也是合适的并且是预期的。此些基团和转化在以下文献中详细描述:玛奇高等有机化学:反应、机理与结构(reactions,mechanisms,andstructure),m.b.史密斯和j.马奇,第5版,约翰·威立父子出版公司,2001;综合有机转化(comprehensiveorganictransformations),r.c.拉罗克(r.c.larock),第2版,约翰·威立父子出版公司,1999;以及有机合成中的保护基团(protectinggroupsinorganicsynthesis),t.w.格林(t.w.greene)和p.g.m.伍兹(p.g.m.wuts),第3版,约翰·威立父子出版公司,1999,所述文献中的每一个的全部内容通过引用并入本文。如本文所使用的,短语“离去基团”(lg)包含但不限于:卤素(例如,氟化物、氯化物、溴化物、碘化物)、磺酸盐(例如,甲磺酸盐、甲苯磺酸盐、苯磺酸盐、对溴苯磺酸盐、硝基苯磺酸、三氟甲磺酸盐)、重氮盐等。如本文所使用的,短语“氧保护基团”包含例如羰基保护基团、羟基保护基团等。羟基保护基团在本领域中是熟知的,并且包含在以下文献中详述的基团:有机合成中的保护基,t.w.格林和p.g.m.伍兹,第3版,约翰·威立父子出版公司,1999;以及菲利普·考新斯基(philipkocienski),“保护基团(protectinggroups)”,斯图加特乔治·泰米出版社(georgthiemeverlagstuttgart),纽约,1994,所述文献的全部内容通过引用并入本文。合适的羟基保护基团的实例包含但不限于:酯、烯丙基醚、醚、甲硅烷基醚、烷基醚、芳基烷基醚和烷氧基烷基醚。此些酯的实例包含甲酸盐、乙酸盐、碳酸盐和磺酸盐。具体实例包含:甲酸盐、苯酰甲酸酯、氯醋酸盐、三氟醋酸盐、甲氧基乙酸酯、三苯基甲氧基乙酸酯、对氯苯氧基乙酸钠、3-苯基丙酸乙酯、4-氧代戊酸甲脂、4,4-(亚乙基二硫代)戊酸盐、新戊酸酯(三甲基乙酰基)、巴豆酸酯、4-甲氧基-巴豆酸酯、苯酸盐、对苯甲酸节酯、2,4,6-三甲基苯甲酸乙酯、如甲基、9-芴基甲基、乙基、2,2,2-三氯乙酯、2-(三甲硅烷基)乙基、2-(苯磺酰)乙基、乙烯基、烯丙基、和对硝基苄基的碳酸盐。此些甲硅烷基醚的实例包含:三甲硅烷基、三乙基硅烷、叔丁基二甲基硅烷基、叔丁基二苯基硅烷基、三异丙基氯硅烷和其它三烷基甲硅烷基醚。烷基醚包含:甲基、苄基、对甲氧苯甲基、3,4-二甲氧基苄基、三苯甲基、叔丁基、烯丙基和烯丙氧基羰基醚或衍生物。烷氧基烷基醚包含:缩醛,如甲氧基甲基醚、甲基硫代甲基醚、(2-甲氧基乙氧基)甲基醚、苄氧基甲基醚、β-(三甲基甲硅烷基)乙氧基甲基醚以及四氢吡喃醚。芳基烷基醚的实例包含:苄基、对甲氧基苄基(mpm)、3,4-二甲氧基苄基、o-硝基苄基、对硝基苄基、对-卤代苄基、2,6-二氯苄基、对氰基苄基以及2-吡啶甲基和4-吡啶甲基。氨基保护基团在本领域中是众所周知的并且包含在以下文献中详述的基团:有机合成中的保护基团,t.w.格林和p.g.m.伍兹,第3版,约翰·威立父子出版公司,1999;以及菲利普考新斯基,“保护基团”,斯图加特乔治·泰米出版社,纽约,1994,所述文献的全部内容通过引用并入本文。合适的氨基保护基团包含但不限于:芳烷基胺、氨基甲酸酯、环状酰亚胺、烯丙胺、酰胺等。此些基团的实例包含:叔丁氧羰基(boc)、乙氧羰基、甲氧羰基、三氯乙氧基基羰基、烯丙氧基羰基(alloc)、苄氧羰基(cbz)、烯丙基、邻苯二甲酰亚胺、苄基(bn)、芴甲氧羰基(fmoc)、甲酰基、乙酰基、氯乙酰基、二氯乙酰基、三氯乙酰基、苯乙酰基、三氟乙酰基、苯甲酰基等。本领域技术人员将认识到,本发明的化合物中存在的如脂族基、醇、羧酸、酯、酰胺、醛、卤素和腈等各种官能团可以通过本领域熟知的技术相互转化,所述技术包含但不限于还原、氧化、酯化、水解、部分氧化、部分还原、卤化、脱水、部分水合和水合。参见,例如,以及“玛奇高等有机化学”,第5版,编者:史密斯m.b.和玛奇j.,约翰·威立父子出版公司,纽约:2001,所述文献的全部内容通过引用并入本文。此些相互转化可能需要一或多种上述技术,并且在下文中描述了用于合成本发明的化合物的某些方法。一方面,式i或其子式的本发明的某些化合物通常根据下文阐述的方案1制备:方案1在以上方案1中,pg是氮保护基团,并且r1、r2、r3、r4、r5、环a、m、n、和p的每一个的定义如上且在本文实施例中单独地或组合地进行描述。如方案1中总体所示,根据结构a的醛可以例如通过以下通用程序e或f、在存在碱的情况下与如丙酮等酮缩合以产生中间产物b。通用程序在下述的例示中更详细地描述。与胺如nh2r3,例如甲胺和结构c的醛甲胺提供结构d的化合物。在一些实施例中,此些化合物是根据本发明的cxcr4抑制剂。在其它实施例中,根据通用程序a还原结构d的化合物以提供结构e的化合物。任选的脱保护使咪唑nh基团暴露,其可以根据通用程序b、d或g与适当的亲电子试剂反应以提供结构g的化合物。方案2可替代地,如方案2所示,可以根据通用程序a还原结构h的哌啶酮化合物以提供结构i的化合物,并且随后与式lg-r3的合适的亲电子试剂反应,其中lg是指合适的如卤化物或甲磺酸盐等离去基团,从而提供结构j的化合物。如果r2是氢或pg附结到咪唑氮原子,则可以如上文针对方案1所描述的那样进行咪唑氮处的任选脱保护和/或偶联,从而产生结构k的最终化合物。5.用途、配制和施用以及用于共同施用的额外治疗剂药学上可接受的组合物根据本发明的另一个实施例,本发明提供了一种组合物,其包括本发明的化合物或其药学上可接受的衍生物以及药学上可接受的载剂、佐剂或媒剂。本发明的组合物中的化合物的量为使得有效地在生物样品或患者中可测量地抑制cxcr4或其突变体。在某些实施例中,本发明的组合物中的化合物的量为使得有效地在生物样品或患者中可测量地抑制cxcr4或其突变体。在某些实施例中,本发明的组合物被配制成向需要此组合物的患者施用。在一些实施例中,本发明的组合物被配制成向患者经口施用。如本文所使用的,术语“患者”是指动物,优选地哺乳动物,并且最优选地人。术语“药学上可接受的载剂、佐剂或者媒剂”指的是不会破坏与其一起配制的化合物的药理学活性的无毒载剂、佐剂或媒剂。可以用在本发明的组合物中的药学上可接受的载剂、佐剂或者媒剂包含但不限于:离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清蛋白、缓冲物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、部分饱和的组合物脂肪酸的甘油酯混合物、水、盐或者电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、基于纤维素的物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡类、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇以及羊毛脂。“药学上可接受的衍生物”是指本发明的化合物的任何无毒盐、酯、酯盐或其它衍生物,在向接受者施用后,其能够直接或间接地提供本发明的化合物或其抑制活性代谢物或残余物。如本文所使用的,术语“其抑制活性代谢物或残余物”意味着其代谢物或残余物也是cxcr4或其突变体的抑制剂。本发明的组合物可以经口施用、肠胃外施用、通过吸入喷雾施用、局部施用、经直肠施用、经鼻施用经颊施用、经阴道施用或经由植入式储药器施用。在本文所使用的,术语“肠胃外”包含皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内以及颅内注射或输注技术。优选地,组合物经口施用、腹腔内施用或静脉内施用。本发明的组合物的无菌可注射形式可以是水性的或者油性悬浮液。这些悬浮液可以根据本领域中已知的技术、使用适当的分散剂或者湿润剂以及悬浮剂来配制。无菌可注射制剂还可以是非毒性的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如像1.3-丁二醇中的溶液。可以采用的可接受的媒剂和溶剂有水、林格氏溶液(ringer'ssolution)和等渗氯化钠溶液。另外,无菌的不挥发性油常规被用作溶剂或悬浮介质。出于此目的,可以采用任何温和的不挥发性油,包含合成的甘油单酯或甘油二酯。如油酸等脂肪酸及其甘油酯衍生物可用于制备可注射物,天然的药学上可接受的油类如橄榄油或蓖麻油、尤其是其聚氧乙烯化的形式也是如此。这些油溶液或混悬液也可以含有一种长链醇稀释剂或分散剂,如羧甲基纤维素或通常用于配制药学上可接受的剂型,包含乳液和悬浮液的类似分散剂。其它常用的表面活性剂如吐温(tweens)、司盘类(spans)以及其它乳化剂或生物利用率增强剂(通常用于制造药学上可接受的固体、液体或其它剂型)也可以用于配制目的。本发明的药学上可接受的组合物可以是以任何经口可接受的剂型经口施用,所述剂型包含但不局限于胶囊、片剂、水性悬浮液或溶液。在用于经口使用的片剂的情况中,常用的载剂包含乳糖和玉米淀粉。还典型地添加了润滑剂如硬脂酸镁。对于以胶囊形式经口施用,有用的稀释剂包含乳糖和干玉米淀粉。当要求用于经口使用的水性悬浮液时,将活性成分与乳化剂和悬浮剂组合。如果期望的话,还可以加入某些甜化剂、调味剂或者着色剂。可替代地,对于直肠施用,本发明的药学上可接受的组合物可以以栓剂的形式施用。可以通过将药剂与适合的非刺激性赋形剂混合来制备所述组合物,所述赋形剂在室温下是固体但在直肠温度下是液体并且因此将在直肠中融化以释放药物。此些材料包含可可脂、蜂蜡以及聚乙二醇。还可以将本发明的药学上可接受的组合物局部施用,尤其是在治疗靶标包含局部施涂易于接近的区域或者器官时,包含眼部、皮肤或者下部肠道的疾病。用于这些区域或者器官中的每一个的适当的局部配制品是易于制备的。针对下部肠道的局部施涂可以以直肠栓剂配制品(见上文)或适当的灌肠剂配制品实现。还可以使用局部透皮贴剂。对于局部施涂而言,所提供的药学上可接受的组合物可以配制在适当的软膏中,所述软膏含有悬浮或溶解于一或多种载剂中的活性组分。用于本发明的化合物的局部施用的载剂包含但不限于:矿物油、液体石油、白色石油、丙二醇、聚氧乙烯聚氧丙烯化合物、乳化蜡、以及水。可替代地,所提供的药学上可接受的组合物可以配制在适当的洗液或乳膏中,所述洗液或乳膏包含悬浮或溶解于一或多种药学上可接受的载剂中的活性组分。适合的载剂包含但不限于:矿物油、脱水山梨糖醇单硬脂酸酯、聚山梨酯60、十六烷基酯蜡、鲸蜡硬脂醇、2-辛基十二烷醇、苯甲醇和水。对于眼科使用,所提供的药学上可接受的组合物可以配制为等渗ph调节的无菌盐水中的微粉化悬浮液,或优选地,等渗ph调节的无菌盐水中的溶液,有或无防腐剂如苄基氯化铵。可替代地,对于眼科使用,可以将药学上可接受的组合物配制在软膏如凡士林中。本发明的药学上可接受的组合物还可以通过鼻用气溶胶或者吸入剂施用。此些化合物根据药物配制领域中熟知的技术来制备,并且可以使用苯甲醇或其它适合的防腐剂、用于增强生物利用率的吸收促进剂、氟烷、和/或其它常规的增溶剂或分散剂制备为盐水中的溶液。最优选地,本发明的药学上可接受的组合物被配制成经口施用。此些配制品可以与或不与食物一起施用。在一些实施例中,本发明的药学上可接受的组合物被配制成不与食物一起施用。在其它实施例中,本发明的药学上可接受的组合物被配制成与食物一起施用。可以与载剂材料组合以产生单一剂型的组合物的本发明的化合物的量将根据被治疗的主体、具体的施用方式而不同。优选地,所提供的组合物应当配制为使得可以向接受这些组合物的患者施用0.01到100mg/kg体重/天之间的剂量的抑制剂。还应当理解的是,用于任何特定患者的具体剂量以及治疗方案将取决于多种因素,包含所采用的具体化合物的活性、年龄、体重、总体健康、性别、饮食、施用时间、排泄率、药物组合、治疗医生的判断和被治疗的特定疾病的严重程度。本发明的化合物在组合物中的量还将取决于所述组合物中的具体化合物。化合物和药学上可接受的组合物的用途本文所述的化合物和组合物通常可用于抑制cxcr4或其突变体。本发明中用作cxcr4或其突变体的抑制剂的化合物的活性可以在体外、体内或细胞系中进行测定。体外测定包含测定对cxcr4或其突变体的抑制的测定。交替的体外测定对抑制剂结合到cxcr4的能力进行定量。用于测定在本发明中用作cxcr4的抑制剂的化合物的详细条件阐述于下文的实例中。如本文所使用的,术语“治疗(treatment、treat和treating)”是指逆转、缓解、延迟如本文所述的疾病或病状或其一或多种症状的发作或抑制其进展。在一些实施例中,可以在产生一或多种症状后施用治疗。在其它实施例中,可以在不存在症状的情况下施用治疗。例如,可以在症状发作之前(例如,根据症状历史和/或根据遗传或其它易感因素)向易感个体施用治疗。还可以在症状消退后继续治疗,例如以预防或延缓其复发。所提供的化合物是cxcr4的抑制剂,并且因此可用于治疗一或多种与cxcr4活性相关的病状。因此,在某些实施例中,本发明提供了一种用于治疗cxcr4介导的病状的方法,所述方法包括以下步骤:向有需要的患者施用本发明的化合物或者其药学上可接受的组合物。如本文所使用的,术语“cxcr4介导的”病状、疾病和/或病症是指已知cxcr4或其突变体在其中发挥作用的任何疾病或其它有害病症。因此,本发明的另一个实施例涉及治疗或减轻一或多种其中已知cxcr4或其突变体发挥作用的疾病的严重程度。在一些实施例中,本发明提供了一种用于治疗一或多种病状、疾病和/或病症的方法,其中所述病状、疾病或病症包含但不限于细胞增殖性病状。细胞增殖性病状本发明的特征在于用于诊断和预后细胞增殖性病状(例如,癌症)和通过靶向cxcr4治疗这些病状的方法和组合物。本文所述的细胞增殖性病状包含例如,癌症、肥胖症和增殖依赖性疾病。可以使用本领域已知的方法来诊断此些病状。癌症在一个实施例中,癌症包含但不限于:白血病(例如,急性白血病、急性淋巴细胞白血病、急性髓细胞白血病、急性粒细胞性白血病、急性早幼粒细胞白血病、急性粒单核细胞白血病、急性单核细胞白血病、急性红白血病、慢性白血病、慢性粒细胞白血病、慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤(例如,霍奇金病或非霍奇金病)、瓦尔登斯特伦的巨球蛋白血症、多发性骨髓瘤、重链疾病、如肉瘤和癌等实体瘤(例如,纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨原性肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、肾母细胞瘤、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、多形性成胶质细胞瘤(gbm,又称胶质母细胞瘤)、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、神经纤维肉瘤、脑膜瘤、黑素瘤、神经母细胞瘤、和视网膜母细胞瘤)。在一些实施例中,所述癌症是胶质瘤、星形细胞瘤、多形性成胶质细胞瘤(gbm,也称为胶质母细胞瘤)、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、神经鞘瘤、神经纤维肉瘤、脑膜瘤、黑素瘤、神经母细胞瘤或视网膜母细胞瘤。在一些实施例中,所述癌症是听神经瘤、星形细胞瘤(例如i级-毛细胞型星形细胞瘤、ii级-低级星形细胞瘤、iii级-间变型星形细胞瘤或iv级-胶质母细胞瘤(gbm))、脊索瘤、cns淋巴瘤、颅咽管瘤、脑干胶质瘤、室管膜瘤、混合型胶质瘤、视神经胶质瘤、室管膜下瘤、成神经管细胞瘤、脑膜瘤、转移性脑肿瘤、少突神经胶质瘤、垂体瘤、原始神经外胚层(pnet)肿瘤或神经鞘瘤。在一些实施例中,所述癌症是相比成人中,在儿童中更常见的类型,如脑干胶质瘤、颅咽管瘤、室管膜瘤、青少年毛细胞型星形细胞瘤(jpa)、成神经管细胞瘤、视神经胶质瘤、松果体肿瘤、原始神经外胚层肿瘤(pnet)或横纹肌样瘤。在一些实施例中,所述患者是成人。在一些实施例中,所述患者是儿童或小儿患者。在另一个实施例中,癌症包含但不限于:间皮瘤、肝细胞(肝和胆管)癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内黑素瘤、卵巢癌、结肠癌、直肠癌、肛门癌、胃癌、胃肠癌(胃癌,结肠直肠癌和十二指肠癌)、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、睾丸癌、慢性或急性白血病、慢性粒细胞白血病、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、非霍奇金淋巴瘤、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、肾上腺皮质癌、胆囊癌、多发性骨髓瘤、胆管癌、纤维肉瘤、神经母细胞瘤、视网膜母细胞瘤或前述癌症中的一或多种的组合。在一些实施例中,所述癌症选自肝细胞癌、卵巢癌、卵巢上皮癌或输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;胆管肝癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;甲状腺未分化癌;肾上腺皮质腺瘤;胰腺癌;胰腺导管癌或胰脏腺癌;胃肠/胃(gist)癌;淋巴瘤;头颈部鳞状细胞癌(scchn);唾液腺癌;胶质瘤或脑癌;1型神经纤维瘤病相关恶性周围神经鞘瘤(mpnst);华氏巨球蛋白血症;或成神经管细胞瘤。在一些实施例中,所述癌症选自肝细胞癌(hcc)、肝母细胞癌、结肠癌、直肠癌、卵巢癌、卵巢上皮癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、胆管肝癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、甲状腺未分化癌、肾上腺皮质腺瘤、胰腺癌、胰腺导管癌、胰脏腺癌、胶质瘤、1型神经纤维瘤病相关恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或成神经管细胞瘤。在一些实施例中,本发明提供了一种用于治疗呈现为如肉瘤、癌或淋巴瘤的实体瘤的癌症的方法,其包括以下步骤:向有需要的患者施用所揭示的化合物或其药学上可接受的盐。实体瘤通常包括异常组织质量,其通常不包含囊肿或液体区域。在一些实施例中,所述癌症选自:肾细胞癌或肾癌;肝细胞癌(hcc)或肝母细胞癌或肝癌;黑素瘤;乳腺癌;结肠直肠癌(colorectalcarcinoma或colorectalcancer);结肠癌;直肠癌;肛门癌;如非小细胞性肺癌(nsclc)或小细胞性肺癌(sclc)等肺癌;卵巢癌(ovariancancer)、卵巢上皮癌、卵巢癌(ovariancarcinoma)或输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;胆管肝癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;甲状腺未分化癌;肾上腺皮质癌;胰腺癌;胰腺导管癌或胰脏腺癌;胃肠/胃(gist)癌;淋巴瘤;头颈部鳞状细胞癌(scchn);唾液腺癌;胶质瘤或脑癌;1型神经纤维瘤病相关恶性周围神经鞘瘤(mpnst);华氏巨球蛋白血症;或成神经管细胞瘤。在一些实施例中,所述癌症选自:肾细胞癌、肝细胞癌(hcc)、肝母细胞癌、结肠直肠癌(colorectalcarcinoma、colorectalcancer)、结肠癌、直肠癌、肛门癌、卵巢癌(ovariancancer)、卵巢上皮癌、卵巢癌(ovariancarcinoma)、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、胆管肝癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、软骨肉瘤、甲状腺未分化癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰脏腺癌、胶质瘤、脑癌、1型神经纤维瘤病相关恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或成神经管细胞瘤。在一些实施例中,所述癌症选自:肝细胞癌(hcc)、肝母细胞癌、结肠癌、直肠癌、卵巢癌(ovariancancer)、卵巢上皮癌、卵巢癌(ovariancarcinoma)、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、胆管肝癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、甲状腺未分化癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰脏腺癌、胶质瘤、1型神经纤维瘤病相关恶性周围神经鞘瘤(mpnst)、华氏巨球蛋白血症或成神经管细胞瘤。在一些实施例中,所述癌症是肝细胞癌(hcc)。在一些实施例中,所述癌症是肝母细胞癌。在一些实施例中,所述癌症是结肠癌。在一些实施例中,所述癌症是直肠癌。在一些实施例中,所述癌症是卵巢癌(ovariancancer或ovariancarcinoma)。在一些实施例中,所述癌症是卵巢上皮癌。在一些实施例中,所述癌症是输卵管癌。在一些实施例中,所述癌症是乳头状浆液性囊腺癌。在一些实施例中,所述癌症是子宫乳头状浆液性癌(upsc)。在一些实施例中,所述癌症是胆管肝癌。在一些实施例中,所述癌症是软组织和骨滑膜肉瘤。在一些实施例中,所述癌症是横纹肌肉瘤。在一些实施例中,所述癌症是骨肉瘤。在一些实施例中,所述癌症是甲状腺未分化癌。在一些实施例中,所述癌症是肾上腺皮质癌。在一些实施例中,所述癌症是胰腺癌或胰腺导管癌。在一些实施例中,癌是胰脏腺癌。在一些实施例中,所述癌症是胶质瘤。在一些实施例中,所述癌症是恶性外周神经鞘瘤(mpnst)。在一些实施例中,所述癌症是1型神经纤维瘤病相关mpnst。在一些实施例中,所述癌症是华氏巨球蛋白血症。在一些实施例中,所述癌症是成神经管细胞瘤。本发明的特征进一步在于用于病毒相关癌症的诊断、预后和治疗的方法和组合物,所述病毒相关癌症包含:人体免疫缺损病毒(hiv)相关实体瘤、人乳头瘤病毒(hpv)-16阳性无法治愈实体瘤和成人t细胞白血病,其由人类t细胞白血病病毒i型(htlv-i)引起,并且是特征在于htlv-i在白血病细胞中的克隆整合的cd4+t细胞白血病的一种高度侵袭性形式(参见https://clinicaltrials.gov/ct2/show/study/nct02631746);以及胃癌、鼻咽癌、宫颈癌、阴道癌、外阴癌、头颈部鳞状细胞癌和梅克尔(merkel)细胞癌中的病毒相关肿瘤。(参见https://clinicaltrials.gov/ct2/show/study/nct02488759;也可以参见https://clinicaltrials.gov/ct2/show/study/nct0240886;https://clinicaltrials.gov/ct2/show/nct02426892)在一些实施例中,本发明提供了一种用于治疗有需要的患者的肿瘤的方法,其包括:向患者施用本文所述的任何化合物、盐或药物组合物。在一些实施例中,所述肿瘤包括本文所述的任何癌症。在一些实施例中,所述肿瘤包括黑素瘤癌。在一些实施例中,所述肿瘤包括乳腺癌。在一些实施例中,所述肿瘤包括肺癌。在一些实施例中,所述肿瘤包括小细胞肺癌(sclc)。在一些实施例中,所述肿瘤包括非小细胞肺癌(nsclc)。在一些实施例中,通过阻止肿瘤的进一步生长来治疗肿瘤。在一些实施例中,通过相对于治疗前肿瘤的大小将肿瘤的大小(例如,体积或质量)减小至少5%、10%、25%、50%、75%、90%或99%来治疗肿瘤。在一些实施例中,通过相对于治疗前肿瘤的量将患者的肿瘤的量减少至少5%、10%、25%、50%、75%、90%或99%来治疗肿瘤。原发性免疫缺陷在一些实施例中,本发明提供了一种用于治疗一或多种病状、疾病和/或病症的方法,其中所述病状、疾病或病症包含但不限于原发性免疫缺陷疾病或病状,所述方法包括:向有需要的患者施用有效量的所揭示化合物。可通过本发明的方法治疗的原发性免疫缺陷包含:疣、低丙球蛋白血症、感染、先天性骨髓粒细胞缺乏症(myelokathexis,whim)综合症;严重的先天性中性粒细胞减少症(scn),特别是由以下引起的那些:g6pc3缺陷(麦克德莫特(mcdermott)等人(2010)血液(blood)116:2793-2802);gata2缺陷(monomac综合症)(马切伊韦斯克-杜瓦尔(maciejweski-duval)等人(2015)白细胞生物学杂志(j.leukoc.biol.)5ma0815-288r(印刷前的电子出版物);特发性cd4+t淋巴细胞减少症(icl);以及维斯科特-奥尔德里奇综合症(wiskott-aldrichsyndrome)。根据本发明的方法,化合物和组合物可以使用有效治疗以下或减轻其严重程度的任何量和任何施用途径施用:癌症、自身免疫疾病、原发性免疫缺陷、增殖性病状、炎性病状、神经变性或神经病状、精神分裂症、骨相关病状、肝病或心脏病状。所要求的精确量将因受试者、根据受试者的种类、年龄和总体状况;疾病或病症的严重程度;具体药剂;其施用方式等而不同。本发明的化合物优选地以剂量单位形式配制,以便于施用和剂量均一性。如本文所使用的,表达“剂量单位形式”是指适合于待治疗患者的物理上离散的药剂单位。然而,应理解的是,本发明的化合物和组合物的总日用量将在合理的医学判断的范围内由主治医师决定。任何特定患者或生物体的具体有效剂量水平将取决于多种因素,包含所治疗的病状和病状的严重程度;所采用的特定化合物的活性;所采用的特定组合物;患者的年龄、体重、总体健康、性别和饮食;施用时间、施用途径和所采用的特定化合物的排泄率;治疗的持续时间;与所采用的特定化合物组合或同时使用的药物以及医学领域熟知的类似因素。如本文所使用的,术语“患者”是指动物,优选地哺乳动物,并且最优选地人。本发明的药学上可接受的组合物可以经口、经直肠、肠胃外、脑池内、阴道内、腹腔内、局部(如通过粉末、软膏或滴剂)、经颊,作为口腔喷雾或鼻用喷雾等向人和其它动物施用,这取决于所治疗的疾病或病症的严重程度。在某些实施例中,本发明的化合物可以以受试者体重的约0.01mg/kg到约50mg/kg并且优选地约1mg/kg到约25mg/kg的剂量水平每天经口或肠胃外施用、每天一或多次,以获得期望治疗效果。用于经口施用的液体剂型包含但不限于药学上可接受的乳剂、微乳剂、溶液、悬浮液、糖浆和酏剂。除了活性化合物以外,液体剂型可以含有在本领域中常用的惰性稀释剂,例如水或其它溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油(具体地,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和山梨醇酐的脂肪酸酯,以及其混合物。除了惰性稀释剂,所述口服组合物还可以包含佐剂,如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂、以及芳香剂。可注射制剂例如无菌可注射水性或油性悬浮液可以根据已知技术、使用适合的分散剂或湿润剂和悬浮剂来配制。无菌可注射制剂还可以是无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液、悬浮液或乳液,例如像1,3-丁二醇中的溶液。可采用的可接受的媒剂和溶剂有水、林格氏溶液、u.s.p.和等渗氯化钠溶液。另外,无菌的不挥发性油常规被用作溶剂或悬浮介质。出于此目的,可以采用任何温和的不挥发性油,包含合成的甘油单酯或甘油二酯。另外,使用脂肪酸,如油酸来制备注射剂。可注射配制品可以例如通过滤过细菌截留过滤器,或通过并入呈无菌固体组合物形式的灭菌剂来灭菌,这些无菌固体组合物可以在使用前溶解或分散于无菌水或其它无菌可注射介质中。为了延长本发明化合物的效果,通常期望减缓来自皮下或肌内注射的化合物的吸收。这可以通过使用水溶性差的晶体或无定形材料的液体悬浮液来实现。然后,化合物的吸收速率取决于其溶解速率,溶解速率进而可以取决于晶体大小和晶型。可替代地,通过将化合物溶解或悬浮在油性媒剂中来实现肠胃外施用的化合物形式的延迟吸收。通过在可生物降解的聚合物如聚丙交酯-聚乙交酯中形成化合物的微囊基质来制备可注射长效(depot)形式。根据化合物与聚合物的比率以及所采用的特定聚合物的性质,可以对化合物释放速率进行控制。其它可生物降解的聚合物的实例包含聚(原酸酯)和聚(酸酐)。长效可注射配制品还通过将化合物截留在与人体组织相容的脂质体或微乳液中来制备。用于直肠或阴道施用的组合物优选地是栓剂,其可通过将本发明的化合物与适当的非刺激性赋形剂或载剂,如可可脂、聚乙二醇或栓剂蜡相混合来制备,所述赋形剂或载剂在室温下为固体但在体温下为液体并且因此可在直肠或阴道腔中融化并释放活性化合物。用于口服施用的固体剂型包含胶囊、片剂、丸剂、粉末以及颗粒剂。在此些固体剂型中,活性化合物与以下混合:至少一种惰性的药学上可接受的赋形剂或载剂,如柠檬酸钠或磷酸二钙和/或a)填充剂或增充剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露醇以及硅酸,b)粘合剂,如例如,羧甲纤维素、海藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖、以及阿拉伯胶,c)保湿剂,如甘油,d)崩解剂,如琼脂-琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐以及碳酸钠,e)溶液阻滞剂,如石蜡,f)吸收促进剂,如季铵化合物,g)湿润剂,如例如,鲸蜡醇和甘油单硬脂酸酯,h)吸收剂,如高岭土和膨润土以及i)润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠以及其混合物。在胶囊、片剂和丸剂的情况下,剂型还可以包括缓冲剂。类似类型的固体组合物也可以用作软填充明胶胶囊和硬填充明胶胶囊中的填充剂,所述明胶胶囊使用如乳糖(lactose或milksugar)等赋形剂以及高分子量聚乙二醇等。片剂、糖衣丸、胶囊、丸剂以及颗粒剂的固体剂型可以用包衣和外壳,如肠溶包衣和药物配制领域中所熟知的其它包衣来制备。所述剂型可以任选地含有乳浊剂并且其组成还可以使得所述剂型仅或者优先在肠道的特定部分中任选地以延迟的方式释放一或多种活性成分。可以使用的包埋组合物的实例包含聚合物质和蜡。类似类型的固体组合物也可以用作软填充明胶胶囊和硬填充明胶胶囊中的填充剂,所述明胶胶囊使用如乳糖(lactose或milksugar)以及高分子量聚乙二醇等赋形剂。活性化合物还可以与如上所述的一或多种赋形剂一起呈微包囊形式。片剂、糖衣丸、胶囊、丸剂以及颗粒剂的固体剂型可以用包衣和外壳,如肠溶包衣、释放控制包衣和药物配制领域中所熟知的其它包衣来制备。在此些固体剂型中,活性化合物可以与至少一种惰性稀释剂,如蔗糖、乳糖或淀粉混合。在正常的情况下,除了惰性稀释剂以外,此些剂型还可以包括另外的物质,例如,压片润滑剂和其它压片助剂,如硬脂酸镁和微晶纤维素。在胶囊、片剂和丸剂的情况下,剂型还可以包括缓冲剂。所述剂型可以任选地含有乳浊剂并且其组成还可以使得所述剂型仅或者优先在肠道的特定部分中任选地以延迟的方式释放一或多种活性成分。可以使用的包埋组合物的实例包含聚合物质和蜡。用于本发明的化合物的局部或经皮施用的剂型包含软膏剂、糊剂、霜剂、洗剂、凝胶、粉末、溶液、喷雾剂、吸入剂或贴片。活性组分在无菌条件下与药学上可接受的载剂和任何所需要的防腐剂或可能需要的缓冲液混合。眼科配制品、滴耳剂和滴眼剂也被设想为处于本发明的范围内。另外,本发明设想了透皮贴剂的用途,所述透皮贴剂具有使化合物以受控方式递送到身体的附加优点。此些剂型可以通过将化合物溶解或分散于适当介质中来制备。还可以使用吸收促进剂来增加所述化合物穿过皮肤的流量。速率可以通过提供速率控制膜或者将所述化合物分散于聚合物基质或凝胶内来控制。根据一个实施例,本发明涉及一种在生物样品中抑制cxcr4活性的方法,其包括以下步骤:使所述生物样品与本发明化合物或包括所述化合物的组合物接触。根据另一个实施例,本发明涉及一种在生物样品中抑制cxcr4或其突变体活性的方法,其包括以下步骤:使所述生物样品与本发明化合物或包括所述化合物的组合物接触。在某些实施例中,本发明涉及一种在生物样品中不可逆地抑制cxcr4或其突变体活性的方法,其包括以下步骤:使所述生物样品与本发明化合物或包括所述化合物的组合物接触。如本文所使用的,术语“生物样品”包含但不限于:细胞培养物或其萃取物;从哺乳动物或其萃取物中获得的活检材料;以及血液、唾液、尿液、粪便、精液、眼泪或其它体液或其萃取物。本发明的另一个实施例涉及一种抑制患者的cxcr4的方法,其包括以下步骤:向所述患者施用本发明化合物或包括所述化合物的组合物。根据另一个实施例,本发明涉及一种抑制患者的cxcr4或其突变体活性的方法,其包括以下步骤:向所述患者施用本发明化合物或包括所述化合物的组合物。根据某些实施例,本发明涉及一种不可逆地抑制患者的cxcr4或其突变体活性的方法,其包括以下步骤:向给所述患者施用本发明化合物或包括所述化合物的组合物。在其它实施例中,本发明提供了一种用于治疗有需要的患者的由cxcr4或其突变体介导的病状的方法,其包括以下步骤:向所述患者施用本发明化合物或其药学上可接受的组合物。此些病状在本文进行了详细描述。额外治疗剂的共同施用根据待治疗的具体病症或疾病,为了治疗所述病症而通常施用的额外治疗剂也可以存在于本发明的组合物中。如本文所使用的,为了治疗特定疾病或病症而通常施用的额外治疗剂被称为“适合于所治疗的疾病或病症”。在一些实施例中,本发明提供了一种治疗所揭示疾病或病症的方法,其包括:向有需要的患者施用有效量的本文揭示的化合物或其药学上可接受的盐,以及同时或依次共同施用有效量的一或多种额外治疗剂,如本文所述的额外治疗剂。在一些实施例中,所述方法包含:共同施用一种额外治疗剂。在一些实施例中,所述方法包含:共同施用两种额外治疗剂。在一些实施例中,所揭示的化合物和的一或多种额外治疗剂的组合协同起作用。在一些实施例中,额外治疗剂选自免疫刺激性治疗化合物。在一些实施例中,免疫刺激性治疗化合物选自埃罗妥珠单抗(elotuzumab)、米伐木肽(mifamurtide)、toll样受体的激动剂或激活剂或rorγt的激活剂。在一些实施例中,所述方法进一步包括:向所述患者施用第三治疗剂,如免疫检查点抑制剂。在一些实施例中,所述方法包括:向有需要的患者施用三种选自本文揭示的化合物或其药学上可接受的盐、免疫刺激性治疗化合物和免疫检查点抑制剂的治疗剂。可以在本发明中使用的其它检查点抑制剂包含ox40激动剂。正在临床试验中研究的ox40激动剂包含:pf-04518600/pf-8600(辉瑞(pfizer)),其是一种激动性抗ox40抗体,用于转移性肾癌(nct03092856)和晚期癌症和肿瘤(nct02554812;nct05082566);gsk3174998(默克(merck)),其是一种激动性抗ox40抗体,处于1期癌症试验(nct02528357);medi0562(医学免疫(medimmune)/阿斯利康(astrazeneca)),其是一种激动性抗ox40抗体,用于晚期实体瘤(nct02318394和nct02705482);medi6469,其是一种激动性抗ox40抗体(医学免疫/阿斯利康),用于结肠直肠癌(nct02559024)、乳腺癌(nct01862900)、头颈癌(nct02274155)和转移性前列腺癌(nct01303705);以及bms-986178(百时美施贵宝(bristol-myerssquibb)),其是一种激动性抗ox40抗体,用于晚期癌症(nct02737475)。可以在本发明中使用的其它检查点抑制剂包含cd137(也称为4-1bb)激动剂。正在临床试验中研究的cd137激动剂包含:乌托米鲁单抗(utomilumab)(pf-05082566,辉瑞),其是一种激动性抗cd137抗体,用于弥漫性大b细胞淋巴瘤(nct02951156)和晚期癌症和肿瘤(nct02554812和nct05082566);乌瑞鲁单抗(urelumab)(bms-663513,百时美施贵宝),其是一种激动性抗cd137抗体,用于黑素瘤和皮肤癌(nct02652455)和胶质母细胞瘤和胶质肉瘤(nct02658981)。可以在本发明中使用的其它检查点抑制剂包含cd27激动剂。正在临床试验中研究的cd27激动剂包含:万利鲁单抗(varlilumab)(cdx-1127,塞德斯医药(celldextherapeutics)),其是一种激动性抗cd27抗体,用于鳞状细胞头颈癌、卵巢癌、结肠直肠癌、肾细胞癌和胶质母细胞瘤(nct02335918);淋巴瘤(nct01460134);以及胶质瘤和星形细胞瘤(nct02924038)。可以在本发明中使用的其它检查点抑制剂包含糖皮质激素诱导的肿瘤坏死因子受体(gitr)激动剂。正在临床试验中研究的gitr激动剂包含:trx518(锐璞生物医药(leaptherapeutics)),其是一种激动性抗gitr抗体,用于恶性黑素瘤和其它恶性实体瘤(nct01239134和nct02628574);gwn323(诺华(novartis)),其是一种激动性抗gitr抗体,用于实体瘤和淋巴瘤(nct02740270);incagn01876(因塞特(incyte)/安帝君斯(agenus)),其是一种激动性抗gitr抗体,用于晚期癌症(nct02697591和nct03126110);mk-4166(默克),其是一种激动性gitr抗体,用于实体瘤(nct02132754),以及medi1873(医学免疫/阿斯利康),其是一种具有人igg1fc结构域的激动性六聚体gitr配体分子,用于晚期实体瘤(nct02583165)。可以在本发明中使用的其它检查点抑制剂包含诱导型t细胞共刺激剂(icos,也称为cd278)激动剂。正在临床试验中研究的icos激动剂包含:medi-570(医学免疫),其是一种激动性抗icos抗体,用于淋巴瘤(nct02520791);gsk3359609(默克),其是一种激动性抗icos抗体,处于1期(nct02723955);jtx-2011(强司医药(jouncetherapeutics)),其是一种激动性抗icos抗体,处于1期(nct02904226)。可以在本发明中使用的其它检查点抑制剂包含杀伤igg样受体(kir)抑制剂。正在临床试验中研究的kir抑制剂包含:利瑞鲁单抗(lirilumab)(iph2102/bms-986015,因内特制药(innatepharma)/百时美施贵宝),其是一种抗kir抗体,用于白血病(nct01687387、nct02399917、nct02481297、nct02599649)、多发性骨髓瘤(nct02252263)、和淋巴瘤(nct01592370);iph2101(1-7f9,因内特制药),用于骨髓瘤(nct01222286和nct01217203);以及iph4102(因内特制药),其是一种与结合到长胞质尾区(kir3dl2)的三个结构域的抗kir抗体,用于淋巴瘤(nct02593045)。可以在本发明中使用的其它检查点抑制剂包含cd47与信号调节蛋白α(sirpa)之间的相互作用的cd47抑制剂。正在临床试验中研究的cd47/sirpa抑制剂包含:alx-148(阿列索医药(alexotherapeutics)),其是(sirpa)的拮抗变体,结合到cd47并阻止cd47/sirpa介导的信号传导,处于1期(nct03013218);tti-621(sirpa-fc,延龄草医药(trilliumtherapeutics)),其是一种通过将sirpa的n末端cd47结合结构域与人igg1的fc结构域连接而产生的可溶性重组融合蛋白,通过结合人cd47并阻止其向巨噬细胞传递“不吃”信号而起作用,处于1期临床试验(nct02890368和nct02663518);cc-90002(新基(celgene)),其是一种抗cd47抗体,用于白血病(nct02641002);以及hu5f9-g4(四七公司(fortyseven,inc.)),用于结肠直肠肿瘤和实体瘤(nct02953782)、急性髓性白血病(nct02678338)和淋巴瘤(nct02953509)。可以在本发明中使用的其它检查点抑制剂包含cd73抑制剂。正在临床试验中研究的cd73抑制剂包含:medi9447(医学免疫),其是一种抗cd73抗体,用于实体瘤(nct02503774);以及bms-986179(百时美施贵宝),其是一种抗cd73抗体,用于实体瘤(nct02754141)。可以在本发明中使用的其它检查点抑制剂包含:干扰素基因蛋白刺激因子(sting,也称为跨膜蛋白173或tmem173)的激动剂。正在临床试验中研究的sting激动剂包含:mk-1454(默克),其是一种激动性合成环状二核苷酸,用于淋巴瘤(nct03010176);以及adu-s100(miw815,阿杜罗生物技术(adurobiotech)/诺华),其是一种激动性合成环状二核苷酸,处于1期(nct02675439和nct03172936)。可以在本发明中使用的其它检查点抑制剂包含csf1r抑制剂。正在临床试验中研究的csf1r抑制剂包含:吡昔替尼(pexidartinib)(plx3397,普莱克西康(plexxikon)),其是一种csf1r小分子抑制剂,用于结肠直肠癌、胰腺癌、转移性和晚期癌症(nct02777710)以及黑素瘤、非小细胞肺癌、鳞状细胞头颈癌、胃肠道间质瘤(gist)和卵巢癌(nct02452424);以及imc-cs4(ly3022855,礼来(lilly)),其是一种抗csf-1r抗体,用于胰腺癌(nct03153410)、黑素瘤(nct03101254)和实体瘤(nct02718911);以及blz945(4-[2((1r,2r)-2-羟基环己基氨基)-苯并噻唑-6-基氧基]-吡啶-2-羧酸甲酰胺,诺华),其是一种可口服csf1r抑制剂,用于晚期实体瘤(nct02829723)。可以在本发明中使用的其它检查点抑制剂包含nkg2a受体抑制剂。正在临床试验中研究的nkg2a受体抑制剂包含:莫纳利珠单抗(monalizumab)(iph2201,因内特制药),其是一种抗nkg2a抗体,用于头颈部肿瘤(nct02643550)和慢性淋巴细胞白血病(nct02557516)。在一些实施例中,免疫检查点抑制剂选自纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、伊匹单抗(ipilimumab)、阿维鲁单抗(avelumab)、度伐单抗(durvalumab)、阿特朱单抗(atezolizumab)或皮地利珠单抗(pidilizumab)。另一方面,本发明提供了一种治疗有需要的患者的癌症的方法,其中所述方法包括:向所述患者施用本文揭示的化合物或其药学上可接受的盐与一或多种选自吲哚胺(2,3)-加双氧酶(ido)抑制剂、聚adp核糖聚合酶(parp)抑制剂、组蛋白去乙酰化酶(hdac)抑制剂、cdk4/cdk6抑制剂或磷脂酰肌醇3激酶(pi3k)抑制剂的额外治疗剂的组合。在一些实施例中,ido抑制剂选自艾卡哚司他(epacadostat)、多西莫特(indoximod)、卡帕替尼(capmanitib)、gdc-0919、pf-06840003、bms:f001287、phy906/kd108或分解犬尿氨酸的酶。在一些实施例中,parp抑制剂选自奥拉帕尼(olaparib)、芦卡帕尼(rucaparib)/或尼拉帕尼(niraparib)。在一些实施例中,hdac抑制剂选自伏立诺他(vorinostat)、罗米地辛(romidepsin)、帕比司他(panobinostat)、贝利司他(belinostat)、恩替诺特(entinostat)或西达本胺(chidamide)。在一些实施例中,cdk4/6抑制剂选自帕博西尼(palbociclib)、瑞博西尼(ribociclib)、玻玛西尼(abemaciclib)或吡罗西尼(trilaciclib)。在一些实施例中,所述方法进一步包括:向所述患者施用第三治疗剂,如免疫检查点抑制剂。在一些实施例中,所述方法包括:向有需要的患者施用三种选自本文揭示的化合物或其药学上可接受的盐的治疗剂;选自吲哚胺(2,3)-加双氧酶(ido)抑制剂、聚adp核糖聚合酶(parp)抑制剂、组蛋白脱乙酰酶(hdac)抑制剂、cdk4/cdk6抑制剂或磷脂酰肌醇3激酶(pi3k)抑制剂的第二治疗剂;以及选自免疫检查点抑制剂的第三治疗剂。在一些实施例中,免疫检查点抑制剂选自纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、伊匹单抗(ipilimumab)、阿维鲁单抗(avelumab)、度伐单抗(durvalumab)、阿特朱单抗(atezolizumab)或皮地利珠单抗(pidilizumab)。可以在本发明中使用的另一种免疫刺激性治疗剂是重组人白介素15(rhil-15)。已在临床中将rhil-15作为用于黑素瘤和肾细胞癌(nct01021059和nct01369888)和白血病(nct02689453)的疗法进行了测试。可以在本发明中使用的另一种免疫刺激性治疗剂是重组人白介素12(rhil-12)。另一种合适的基于il-15的免疫治疗剂是异二聚体il-15(hetil-15,诺华/奥德姆(admune)),其是一种由络合到可溶性il-15结合蛋白il-15受体α链(il15:sil-15ra)的内源性il-15的合成形式构成的融合络合物,已经在黑素瘤、肾细胞癌、非小细胞肺癌和头颈部鳞状细胞癌的1期临床试验中进行了测试(nct02452268)。已经在临床中针对许多肿瘤适应症(nct02544724和nct02542124)将重组人白介素12(rhil-12)例如作为用于淋巴瘤的疗法(nm-il-12,诺伊医学公司(neumedicines,inc.))进行了测试。在一些实施例中,pi3k抑制剂选自艾代拉尼西(idelalisib)、阿培利司(alpelisib)、他塞利西(taselisib)、皮克立西(pictilisib)、库潘尼西(copanlisib)、达维利西(duvelisib)、pqr309或tgr1202。另一方面,本发明提供了一种治疗有需要的患者的癌症的方法,其中所述方法包括:向所述患者施用本文揭示的化合物或其药学上可接受的盐与一或多种选自铂类治疗剂、紫杉烷、核苷抑制剂或干扰正常dna合成、蛋白质合成、细胞复制或将以其它方式抑制快速增殖细胞的治疗剂的额外治疗剂的组合。在一些实施例中,铂类治疗剂选自顺铂、卡铂、奥沙利铂、奈达铂、吡铂或沙铂。在一些实施例中,紫杉烷选自紫杉醇、多西他赛、白蛋白结合紫杉醇、卡巴他赛(cabazitaxel)、sid530。在一些实施例中,干扰正常dna合成、蛋白质合成、细胞复制或将以其它方式干扰快速增殖细胞复制的治疗剂选自曲贝替定(trabectedin)、二氯甲基二乙胺、长春新碱、替莫唑胺、阿糖孢苷、环己亚硝脲、阿扎胞苷(azacitidine)、高三尖杉酯碱、天冬酰胺酶菊欧文氏菌、甲磺酸艾日布林、卡培他滨(capacetrine)、倍他斯汀(bentamustine)、伊沙匹隆(ixabepilone)、奈拉滨(nelarabine)、氯法拉滨(clorafabine)、曲氟尿苷或地匹福林(tipiracil)。在一些实施例中,所述方法进一步包括:向所述患者施用第三治疗剂,如免疫检查点抑制剂。在一些实施例中,所述方法包括:向有需要的患者施用三种选自本文揭示的化合物或其药学上可接受的盐的治疗剂;选自铂类治疗剂、紫杉烷、核苷抑制剂或干扰正常dna合成、蛋白质合成、细胞复制或将以其它方式抑制快速增殖的细胞的治疗剂的第二治疗剂;以及选自免疫检查点抑制剂的第三治疗剂。在一些实施例中,免疫检查点抑制剂选自纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、伊匹单抗(ipilimumab)、阿维鲁单抗(avelumab)、度伐单抗(durvalumab)、阿特朱单抗(atezolizumab)或皮地利珠单抗(pidilizumab)。在一些实施例中,上述方法中的任何一种进一步包括以下步骤:从患者获得生物样品并测量疾病相关生物标志物的量。在一些实施例中,生物样品是血液样品。在一些实施例中,疾病相关生物标志物选自循环cd8+t细胞或cd8+t细胞与treg细胞的比率。一方面,本发明提供了一种治疗晚期癌症的方法,其包括:施用本文揭示的化合物或其药学上可接受的盐或其药物组合物,作为单一药剂(单一疗法)或与化学治疗剂、靶向治疗剂如激酶抑制剂、和/或免疫调节疗法如免疫检查点抑制剂组合。在一些实施例中,免疫检查点抑制剂是pd-1的抗体。pd-1结合到程序性细胞死亡1受体(pd-1)以阻止受体结合到抑制性配体pdl-1,从而阻碍肿瘤抑制宿主抗肿瘤免疫应答的能力。在一些实施例中,额外治疗剂是激酶抑制剂或vegf-r拮抗剂。可在本发明中使用的经批准的vegf抑制剂和激酶抑制剂包含:贝伐珠单抗(bevacizumab)(基因科技(genentech)/罗氏(roche)),其是一种抗vegf单克隆抗体;雷莫芦单抗(ramucirumab)(礼来),其是一种抗vegfr-2抗体,以及阿柏西普(ziv-aflibercept),也称为阿柏西普(vegftrap)(再生元(regeneron)/赛诺菲(sanofi));vegfr抑制剂,如瑞格菲尼(regorafenib)(拜耳(bayer));凡德他尼(vandetanib)(阿斯利康);阿西替尼(axitinib)(辉瑞);以及乐伐替尼(lenvatinib)(卫材(eisai));raf抑制剂,如索拉菲尼(sorafenib)(拜耳股份公司和文石(onyx));达拉菲尼(dabrafenib)(诺华);以及维莫菲尼(vemurafenib)(基因科技/罗氏);mek抑制剂,例如考比替尼(cobimetanib)(伊克斯雷克斯(exelexis)/基因科技/罗氏);曲美替尼(trametinib)(诺华);bcr-abl酪氨酸激酶抑制剂,如伊马替尼(imatinib)(诺华);尼罗替尼(nilotinib)(诺华);达沙替尼(dasatinib)(百时美施贵宝);博舒替尼(bosutinib)(辉瑞);以及帕纳替尼(ponatinib)(阿瑞雅德制药(ariadpharmaceuticals));her2和egfr抑制剂,如吉非替尼(gefitinib)(阿斯利康);埃罗替尼(erlotinib)(基因科技/瑞士罗氏/安斯泰来(astellas));拉帕替尼(lapatinib)(诺华);阿法替尼(afatinib)(勃林格殷格翰(boehringeringelheim));奥希替尼(osimertinib)(靶向激活的egfr,阿斯利康);以及布加替尼(brigatinib)(阿瑞雅德制药);c-met和vegfr2抑制剂,如卡博替尼(cabozantinib)(伊克斯雷克斯);以及多激酶抑制剂,如舒尼替尼(sunitinib)(辉瑞);帕唑帕尼(pazopanib)(诺华);alk抑制剂,如克唑替尼(crizotinib)(辉瑞);色瑞替尼(ceritinib)(诺华);以及艾乐替尼(alectinib)(基因科技/罗氏);布鲁顿(bruton)酪氨酸激酶抑制剂,如依鲁替尼(ibrutinib)(克里克斯制药(pharmacyclics)/杨森(janssen));以及flt3受体抑制剂,如米哚妥林(midostaurin)(诺华)。正在开发并且可以在本发明中使用的其它激酶抑制剂和vegf-r拮抗剂包含:替沃扎尼(tivozanib)(爱唯欧制药(aveopharmaecuticals));瓦他拉尼(vatalanib)(拜耳/诺华);德立替尼(lucitanib)(克洛维斯肿瘤(clovisoncology));多韦替尼(dovitinib)(tki258,诺华);西奥罗尼(chiauanib)(微芯生物科学(chipscreenbiosciences));cep-11981(瑟法隆(cephalon));利尼伐尼(linifanib)(雅培实验室(abbottlaboratories));来那替尼(neratinib)(hki-272,彪马生物技术(pumabiotechnology));雷多替尼(radotinib)(iy5511,il-杨制药(il-yangpharmaceuticals),南韩);鲁索替尼(ruxolitinib)(因塞特公司(incytecorporation));ptc299(ptc医药(ptctherapeutics));cp-547,632(辉瑞);弗雷替尼(foretinib)(伊克斯雷克斯,葛兰素史克(glaxosmithkline));奎扎替尼(quizartinib)(第一三共(daiichisankyo))以及莫特塞尼(motesanib)(安进(amgen)/武田(takeda))。在一些实施例中,额外治疗剂是mtor抑制剂,其抑制细胞增殖、血管生成和葡萄糖摄取。可在本发明中使用的经批准的mtor抑制剂包含:依维莫司(everolimus)(诺华);替西罗莫司(temsirolimus)(辉瑞);以及西罗莫司(sirolimus)(辉瑞)。在一些实施例中,额外治疗剂是聚adp核糖聚合酶(parp)抑制剂。可在本发明中使用的经批准的parp抑制剂包含:奥拉帕尼(olaparib)(阿斯利康);卢卡帕尼(rucaparib)(克洛维斯肿瘤);以及尼拉帕尼(niraparib)(特萨罗(tesaro))。可以在本发明中使用的其它parp抑制剂包含:塔拉唑帕尼(talazoparib)(mdv3800/bmn673/lt00673,麦迪韦逊(medivation)/辉瑞/拜玛林(biomarin));维利帕尼(veliparib)(abt-888,艾伯维(abbvie));以及bgb-290(百济神州公司(beigene,inc.))。在一些实施例中,额外治疗剂是磷脂酰肌醇3激酶(pi3k)抑制剂。可在本发明中使用的经批准的pi3k抑制剂包含:艾代拉尼西(idelalisib)(吉利德(gilead))。可以在本发明中使用的其它正在研究的pi3k抑制剂包含:阿培利司(byl719,诺华);他塞利西(gdc-0032,基因科技/罗氏);皮克立西(gdc-0941,基因科技/罗氏);库潘尼西(bay806946,拜耳);达维利西(原名为ipi-145,无限制药(infinitypharmaceuticals));pqr309(皮邱尔医药(piqurtherapeutics),瑞士);以及tgr1202(原名为rp5230,tg医药(tgtherapeutics))。在一些实施例中,额外治疗剂是蛋白酶体抑制剂。可在本发明中使用的经批准的蛋白酶体抑制剂包含:硼替佐米(bortezomib)(武田);卡非佐米(carfilzomib)(安进);以及伊沙佐米(ixazomib)(武田)。在一些实施例中,额外治疗剂是组蛋白脱乙酰酶(hdac)抑制剂。可在本发明中使用的经批准的hdac抑制剂包含:伏立诺他(vorinostat)(默克);罗米地辛(romidepsin)(新基);帕比司他(panobinostat)(诺华);以及贝利司他(belinostat)(光谱制药(spectrumpharmaceuticals))。可以在本发明中使用的其它正在研究的hdac抑制剂包含:恩替司他(entinostat)(sndx-275,信达克斯制药(syndaxpharmaceuticals))(nct00866333);以及西达本胺(hbi-8000,微芯生物科学,中国)。在一些实施例中,额外治疗剂是cdk抑制剂,如cdk4/6抑制剂。可在本发明中使用的经批准的cdk4/6抑制剂包含:帕博西尼(辉瑞);以及瑞博西尼(诺华)。可以在本发明中使用的其它正在研究的cdk4/6抑制剂包含:玻玛西尼(ly2835219,礼来);以及吡罗西尼(g1t28,g1医药(g1therapeutics))。在一些实施例中,额外治疗剂是吲哚胺(2,3)-二氧化酶(ido)抑制剂。可以在本发明中使用的其它正在研究的ido抑制剂包含:艾卡哚司他(incb024360,因塞特);多西莫特(nlg-8189,新联基因公司(newlinkgeneticscorporation));卡帕替尼(inc280,诺华);gdc-0919(基因科技/罗氏);pf-06840003(辉瑞);bms:f001287(百时美施贵宝);phy906/kd108(弗陶特提克(phytoceutica));以及分解犬尿氨酸的酶(激酶,kyn医药(kyntherapeutics))。在一些实施例中,额外治疗剂是生长因子拮抗剂,如血小板衍生生长因子(pdgf)或表皮生长因子(egf)或其受体(egfr)的拮抗剂。可在本发明中使用的经批准的pdgf拮抗剂包含奥拉单抗(olaratumab)(礼来)。可在本发明中使用的经批准的egfr拮抗剂包含:西妥昔单抗(cetuximab)(礼来);妥珠单抗(necitumumab)(礼来)、帕尼单抗(panitumumab)(安进);以及奥希替尼(靶向激活的egfr,阿斯利康)。在一些实施例中,额外治疗剂是芳香酶抑制剂。可以在本发明中使用的经批准的芳香酶抑制剂包含:依西美坦(exemestane)(辉瑞);阿那曲唑(anastazole)(阿斯利康)以及来曲唑(letrozole)(诺华)。在一些实施例中,额外治疗剂是刺猬信号通路(hedgehogpathway)拮抗剂。可以在本发明中使用的经批准的刺猬信号通路抑制剂包含索尼德吉(sonidegib)(太阳制药(sunpharmaceuticals));以及维莫德吉(vismodegib)(基因科技),两者都用于治疗基底细胞癌。在一些实施例中,额外治疗剂是叶酸抑制剂。可在本发明中使用的经批准的叶酸抑制剂包含培美曲塞(pemetrexed)(礼来)。在一些实施例中,额外治疗剂是cc趋化因子受体4(ccr4)抑制剂。可以在本发明中使用的正在研究的ccr4抑制剂包含莫加珠单抗(mogamulizumab)(协和发酵麒麟(kyowahakkokirin),日本)。在一些实施例中,额外治疗剂是异柠檬酸脱氢酶(idh)抑制剂。可以在本发明中使用的正在研究的idh抑制剂包含:ag120(新基;nct02677922);ag221(新基,nct02677922;nct02577406);bay1436032(拜耳,nct02746081);idh305(诺华,nct02987010)。在一些实施例中,额外治疗剂是精氨酸酶抑制剂。可以在本发明中使用的正在研究的精氨酸酶抑制剂包含:aeb1102(聚乙二醇化重组精氨酸酶,埃格列亚生物医药(aegleabiotherapeutics)),其处于1期临床试验研究中,用于急性髓性白血病和骨髓增生异常综合征(nct02732184)和实体瘤(nct02561234);以及cb-1158(卡里特拉生物科学(calitherabiosciences))。在一些实施例中,额外治疗剂是谷氨酰胺酶抑制剂。可以在本发明中使用的正在研究的谷氨酰胺酶抑制剂包含cb-839(卡里特拉生物科学)。在一些实施例中,额外治疗剂是结合到肿瘤抗原的抗体,即,在肿瘤细胞的细胞表面上表达的蛋白质。可以在本发明中使用的经批准的结合到肿瘤抗原的抗体包含:利妥昔单抗(rituximab)(基因科技/百健艾迪(biogenidec));奥法木单抗(ofatumumab)(抗cd20,葛兰素史克);阿托珠单抗(obinutuzumab)(抗cd20,基因科技);替伊莫单抗(ibritumomab)(抗cd20和钇-90,光谱制药);达雷木单抗(daratumumab)(抗cd38,杨森生物科技(janssenbiotech));达妥昔单抗(dinutuximab)(抗糖脂gd2,联合医药(unitedtherapeutics));曲妥单抗(trastuzumab)(抗her2,基因科技);曲妥珠单抗-美坦新偶联物(ado-trastuzumabemtansine)(抗her2,融合到与美坦新,基因科技);以及帕妥珠单抗(pertuzumab)(抗her2,基因科技);以及本妥昔单抗(brentuximabvedotin)(抗cd30药物共轭物,西雅图基因(seattlegenetics))。在一些实施例中,额外治疗剂是拓扑异构酶抑制剂。可在本发明中使用的经批准的拓扑异构酶抑制剂包含:伊立替康(irinotecan)(梅里麦克制药(merrimackpharmaceuticals));拓扑替康(topotecan)(葛兰素史克)。可以在本发明中使用的正在研究的拓扑异构酶抑制剂包含匹克生琼(pixantrone)(cti生物制药(ctibiopharma))。在一些实施例中,额外治疗剂是核苷抑制剂或干扰正常dna合成、蛋白质合成、细胞复制或将以其它方式抑制快速增殖细胞的其它治疗剂。此些核苷抑制剂或其它治疗剂包含:曲贝替定(trabectedin)(胍烷化剂,杨森肿瘤(janssenoncology));二氯甲基二乙胺(烷化剂,爱可泰隆制药(aktelionpharmaceuticals));长春新碱(礼来;梯瓦制药(tevapharmaceuticals);塔隆医药(talontherapeutics));替莫唑胺(temozolomide)(烷化剂5-(3-甲基三氮烯-1-基)-咪唑-4-甲酰胺(mtic)的前药,默克);阿糖胞苷注射液(阿糖胞苷,抗代谢胞苷类似物,辉瑞);洛莫司汀(lomustine)(烷化剂,百时美施贵宝;下源生物技术(nextsourcebiotechnology));阿扎胞苷(azacitidine)(胞嘧啶的嘧啶核苷类似物,新基);高三尖杉酯碱(三尖杉碱类生物碱)(蛋白质合成抑制剂,梯瓦制药);天冬酰胺酶菊欧文氏菌(用于耗竭天冬酰胺的酶,伦贝克(lundbeck);eusa制药(eusapharma));甲磺酸艾日布林(微管抑制剂,基于微管蛋白的抗有丝分裂剂,卫材);卡巴他赛(微管抑制剂,基于微管蛋白的抗有丝分裂剂,赛诺菲-安万特(sanofi-aventis));卡培他滨(胸苷酸合成酶抑制剂,(基因科技);苯达莫司汀(bendamustine)(双官能团二氯甲基二乙胺衍生物,据信形成链间dna交联,瑟法隆/梯瓦);伊沙匹隆(埃博霉素b的半合成类似物、微管抑制剂、基于微管蛋白的抗有丝分裂剂,百时美施贵宝);奈拉滨(脱氧鸟苷类似物的前药、核苷代谢抑制剂,诺华);氯法拉滨(核糖核苷酸还原酶抑制剂的前药、脱氧胞苷的竞争性抑制剂,赛诺菲-安万特);以及曲氟尿苷和地匹福林(胸苷类核苷类似物和胸苷磷酸化酶抑制剂,大鹏肿瘤(taihooncology))。在一些实施例中,额外治疗剂是铂类治疗剂,也称为铂类(platins)。铂类引起dna的交联,使得其抑制dna修复和/或dna合成,主要是抑制快速繁殖细胞,如癌细胞。可以在本发明中使用的经批准的铂类治疗剂包含:顺铂(百时美施贵宝);卡铂(百时美施贵宝;以及梯瓦;辉瑞);奥沙利铂(oxaliplatin)(赛诺菲-安万特);以及奈达铂(nedaplatin)(盐野义(shionogi))。已经过临床试验并且可以在本发明中使用的其它铂类治疗剂包含:吡铂(波尼阿德制药(poniardpharmaceuticals));以及赛特铂(satraplatin)(jm-216,阿根尼克斯(agennix))。在一些实施例中,额外治疗剂是紫杉烷化合物,其引起对于细胞分裂来说是必需的微管的破裂。可以在本发明中使用的经批准的紫杉烷化合物包含:紫杉醇(百时美施贵宝)、多西他赛(docetaxel)(赛诺菲-安万特;太阳制药)、白蛋白结合型紫杉醇(阿博利斯(abraxis)/新基)、和卡巴他赛(cabazitaxel)(赛诺菲-安万特)。已经过临床试验并且可以在本发明中使用的其它紫杉烷化合物包含sid530(sk化工有限公司(skchemicals,co.))(nct00931008)。在一些实施例中,额外治疗剂是抗凋亡蛋白的抑制剂,如bcl-2。可以在本发明中使用的经批准的抗凋亡剂包含:维奈托克斯(venetoclax)(艾伯维(abbvie)/基因科技);以及博纳吐单抗(blinatumomab)(安进)。靶向经过临床试验并且可以在本发明中使用的凋亡蛋白的其它治疗剂包含纳威托克斯(navitoclax)(abt-263,雅培)、bcl-2抑制剂(nct02079740)。在一些实施例中,本发明提供了一种治疗前列腺癌的方法,其包括:向有需要的患者施用有效量的本文揭示的化合物或其药学上可接受的盐或其药物组合物与干扰雄激素合成或活性的额外治疗剂的组合。可在本发明中使用的经批准的雄激素受体抑制剂包含:恩杂鲁胺(enzalutamide)(安斯泰来(astellas)/麦迪韦逊医疗);经批准的雄激素合成抑制剂包含阿比特龙(abiraterone)(山陶克(centocor)/奥索(ortho));经批准的促性腺激素释放激素(gnrh)受体的拮抗剂(地加瑞克(degaralix),辉凌制药(ferringpharmaceuticals))。在一些实施例中,额外治疗剂是选择性雌激素受体调节剂(serm),其干扰雌激素的合成或活性。可在本发明中使用的经批准的serm包含雷洛昔芬(raloxifene)(礼来)。在一些实施例中,额外治疗剂是骨吸收抑制剂。抑制骨吸收的经批准的治疗剂是狄诺塞麦(denosumab)(安进),其是一种结合到rankl,阻止结合到在破骨细胞、其前体和破骨细胞样巨细胞表面发现的用骨转移介导实体肿瘤中的骨病理的其受体rank的抗体。抑制骨吸收的其它经批准的治疗剂包含二膦酸盐,如唑来膦酸(诺华)。在一些实施例中,额外治疗剂是两种初级p53抑制蛋白:mdmx和mdm2之间的相互作用的抑制剂。可以在本发明中使用的正在研究的p53抑制蛋白的抑制剂包含alrn-6924(艾勒朗(aileron)),其是等效结合到并破坏mdmx和mdm2与p53的相互作用的钉合肽。alrn-6924目前正在针对aml、晚期骨髓增生异常综合征(mds)和外周t细胞淋巴瘤(ptcl)的治疗的临床试验中进行评估(nct02909972;nct02264613)。在一些实施例中,额外治疗剂是转化生长因子β(tgf-β或tgfβ)的抑制剂。可以在本发明中使用的正在研究的tgfβ蛋白抑制剂包含nis793(诺华),其是一种抗tgfβ抗体,正经历针对包含乳腺癌、肺癌、肝细胞癌、结肠直肠癌、胰腺癌、前列腺癌和肾癌在内的癌症(nct02947165)的治疗的临床测试。在一些实施例中,tgfβ蛋白的抑制剂是苏木单抗(fresolimumab)(gc1008,赛诺菲健赞(sanofi-genzyme)),其正经历针对黑素瘤(nct00923169);肾细胞癌(nct00356460);和非小细胞肺癌(nct02581787)的研究。另外,在一些实施例中,额外治疗剂是tgfβ捕获剂,如康诺利(connolly)等人(2012)国际生物科学杂志(int'lj.biologicalsciences)8:964-978所述。目前在针对实体瘤治疗的临床试验中使用的一种治疗化合物是m7824(默克——原名为msb0011459x),其是一种双特异性抗pd-l1/tgfβ捕获化合物(nct02699515);和(nct02517398)。m7824由融合到人tgfβ受体ii的细胞外结构域的针对pd-l1的完全人igg1抗体构成,充当tgfβ“捕获剂”。额外的共同施用的治疗药剂——靶向治疗剂和免疫调节药物在一些实施例中,额外治疗剂选自靶向治疗剂或免疫调节药物。使用靶向治疗剂或免疫调节药物进行的辅助疗法在单独施用时已经显示出有前途的有效性,但受到随时间推移的肿瘤免疫力发展或免疫应答逃避的限制。在一些实施例中,本发明提供了一种治疗癌症,如本文所述的癌症的方法,其包括:向有需要的患者施用有效量的本文揭示的化合物或其药学上可接受的盐或其药物组合物与如靶向治疗剂或免疫调节药物等额外治疗剂的组合。在一些实施方例中,免疫调节治疗剂特异性地诱导肿瘤细胞的凋亡。可以在本发明中使用的经批准的免疫调节治疗剂包含:泊马度胺(pomalidomide)(新基);来那度胺(lenalidomide)(新基);巨大戟醇甲基丁烯酸酯(leo制药(leopharma))。在其它实施例中,免疫调节治疗剂是癌症疫苗。在一些实施例中,癌症疫苗选自西普鲁塞t(sipuleucel-t)(丹德里昂(dendreon)/威朗制药(valeantpharmaceuticals)),其已被批准用于治疗无症状或最低症状的转移性去势抵抗(激素难治性)前列腺癌;和泰利莫齐拉赫帕雷(talimogenelaherparepvec)(威克斯生物(biovex)/安进,以前称为t-vec),其是一种被批准用于治疗黑素瘤中不可切除的皮肤、皮下和淋巴结病变的经基因修饰的溶瘤病毒疗法。在一些实施例中,额外治疗剂选自溶瘤病毒疗法,如培沙得瓦(pexastimogenedevacirepvec)(pexavec/jx-594,西拉詹(sillajen)/原名为詹尼勒克斯生物医药(jennerexbiotherapeutics)),其是一种被工程化为表达gm-csf的胸苷激酶-(tk-)缺陷型痘苗病毒,用于肝细胞癌(nct02562755)和黑素瘤(nct00429312);佩拉瑞普(pelareorep)(溶瘤生物科技(oncolyticsbiotech)),其是一种不会在非ras激活的细胞中复制的呼吸道肠孤儿病毒(呼肠孤病毒)变体,用于许多癌症,包含结肠直肠癌(nct01622543);前列腺癌(nct01619813);头颈部鳞状细胞癌(nct01166542);胰腺癌(nct00998322);和非小细胞肺癌(nsclc)(nct00861627);埃纳纳图图里耶夫(enadenotucirev)(ng-348,皮斯奥克斯(psioxus),以前称为coload1),其是一种被工程化为表达全长cd80和对t细胞受体cd3蛋白具有特异性的抗体片段的腺病毒,用于卵巢癌(nct02028117);转移性或晚期上皮肿瘤,如结肠直肠癌、膀胱癌、头颈部鳞状细胞癌和唾液腺癌(nct02636036);oncos-102(塔尔沃克斯(targovax)/原名为昂克斯(oncos)),其是一种被工程化为表达gm-csf的腺病毒,用于黑素瘤(nct03003676);以及腹膜疾病、结肠直肠癌或卵巢癌(nct02963831);gl-onc1(glv-1h68/glv-1h153,吉尼卢克斯股份有限公司(geneluxgmbh)),其是一种被工程化为分别表达β半乳糖苷酶(β-gal)/β葡萄糖醛酸酶或β-gal/人碘化钠同向转运体(hnis)的痘苗病毒,在腹膜转移癌(nct01443260);输卵管癌、卵巢癌(nct02759588)中进行研究;或cg0070(冷吉尼斯(coldgenesys)),其是一种被工程化为表达gm-csf的腺病毒,用于膀胱癌(nct02365818)。在一些实施例中,额外治疗剂选自jx-929(西拉詹/原名为詹尼勒克斯生物医药),其是一种被工程化为表达胞嘧啶脱氨酶的tk-和痘苗生长因子缺陷型痘苗病毒,其能够将前药5-氟胞嘧啶转化为细胞毒性药物5-氟尿嘧啶;tg01和tg02(塔尔沃克斯/原名为昂克斯),其是靶向难治疗的ras突变的肽类免疫治疗剂;和tilt-123(tilt生物医药(tiltbiotherapeutics)),其是一种工程化的腺病毒,命名为:ad5/3-e2f-δ24-htnfα-ires-hil20;以及vsv-gp(维拉医药(viratherapeutics)),其是一种被工程化为表达淋巴细胞脉络丛脑膜炎病毒(lcmv)的糖蛋白(gp)的水泡性口炎病毒(vsv),其可以被进一步工程化为表达被设计成提高抗原特异性cd8+t细胞应答的抗原。在一些实施例中,本发明包括:向所述患者施用本文揭示的化合物或其药学上可接受的盐组合被工程化为表达嵌合抗原受体或car的t细胞。被工程化为表达此嵌合抗原受体的t细胞称为car-t细胞。已经构建了由结合结构域组成的car,其可以衍生自天然配体、衍生自对细胞表面抗原具有特异性的单克隆抗体的单链可变片段(scfv)、融合到作为t细胞受体(tcr)的功能末端的内结构域,如来自tcr的cd3-ζ信号传导结构域,其能够在t淋巴细胞中产生激活信号。在抗原结合后,此些car连接到效应细胞中的内源信号传导途径,并产生与由tcr络合物启动的激活信号类似的激活信号。例如,在一些实施例中,car-t细胞是美国专利8,906,682(6月;其全部内容通过引用并入本文)中描述的细胞之一,所述专利揭示了car-t细胞,所述细胞被工程化为包括细胞外结构域,所述结构域具有抗原结合结构域(如结合到cd19的结构域),融合到与t细胞抗原受体络合物ζ链(如cd3ζ)的细胞内信号传导结构域。当在t细胞中表达时,car能够基于抗原结合特异性重定向抗原识别。在cd19的情况下,抗原在恶性b细胞上表达。目前正在进行200多项临床试验,其将car-t用于各种适应症。[https://clinicaltrials.gov/ct2/results?term=chimeric+antigen+receptors&pg=1]。额外的共同施用治疗剂——免疫刺激药物在一些实施例中,额外治疗剂是免疫刺激药物。例如,阻断pd-1和pd-l1抑制轴的抗体可以释放活化的肿瘤反应性t细胞并且已经在临床试验中显示出在越来越多的肿瘤组织学中诱导持久的抗肿瘤反应,包含一些传统上未被认为对免疫疗法敏感的肿瘤类型。参见冈崎,t.(okazaki,t.)等人(2013)自然免疫学(nat.immunol.)14,1212-1218;zou(邹)等人(2016)科学转化医学(sci.transl.med.)8。抗pd-1抗体纳武单抗(百时美施贵宝,也称为ono-4538、mdx1106和bms-936558)已经显示出改善在先前的抗血管生成疗法期间或之后经历疾病进展的rcc患者的总体存活的潜力。在一些实施例中,本发明提供了一种治疗癌症、如本文所述的癌症的方法,其包括:向有需要的患者施用有效量的本文揭示的化合物或其药学上可接受的盐或其药物组合物与额外治疗剂(如免疫刺激药物,如免疫检查点抑制剂)的组合。在一些实施例中,化合物和检查点抑制剂同时或依次施用。在一些实施例中,本文揭示的化合物在免疫检查点抑制剂初始给药之前施用。在某些实施例中,免疫检查点抑制剂在本文揭示的化合物初始给药之前施用。在某些实施例中,免疫检查点抑制剂选自pd-1拮抗剂、pd-l1拮抗剂、或ctla-4拮抗剂。在一些实施例中,cxcr4拮抗剂(如本文揭示的化合物或其药学上可接受的盐)与纳武单抗(抗pd-1抗体,百时美施贵宝);派姆单抗(抗pd-1抗体,默克);伊匹单抗(抗ctla-4抗体,百时美施贵宝);度伐单抗(抗pd-l1抗体,阿斯利康);或阿特珠单抗(抗pd-l1抗体,基因科技科技)组合施用。适用于本发明的其它免疫检查点抑制剂包含:regn2810(再生元),其是一种在患有基底细胞癌(nct03132636);nsclc(nct03088540);皮肤鳞状细胞癌(nct02760498);淋巴瘤(nct02651662);以及黑素瘤(nct03002376)的患者体内测试的抗pd-1抗体;皮地利珠单抗(治愈技术(curetech)),也称为ct-011,其是一种结合到pd-1的抗体,处于针对弥漫性大b细胞淋巴瘤和多发性骨髓瘤的临床试验中;阿维鲁单抗(辉瑞/默克),也称为msb0010718c),其是一种完全人igg1抗pd-l1抗体,处于针对非小细胞肺癌、梅克尔细胞癌、间皮瘤、实体瘤、肾癌、卵巢癌、膀胱癌、头颈癌和胃癌的临床试验中;以及pdr001(诺华),其是一种结合到pd-1的抑制性抗体,处于针对非小细胞肺癌、黑素瘤、三阴性乳腺癌和晚期或转移性实体瘤的临床试验中。替西利姆单抗(tremelimumab)(cp-675,206,阿斯利康)是一种针对ctla-4的完全人单克隆抗体,其已在针对多种适应症的临床试验中进行研究,所述适应症包含:间皮瘤、结直肠癌、肾癌、乳腺癌、肺癌和非小细胞肺癌、胰腺导管腺癌、胰腺癌、生殖细胞癌、头颈部鳞状细胞癌、肝细胞癌、前列腺癌、子宫内膜癌、肝转移癌、肝癌、大b细胞淋巴瘤、卵巢癌、宫颈癌、转移性间变型甲状腺癌、尿路上皮癌、输卵管癌、多发性骨髓瘤、膀胱癌、软组织肉瘤、和黑素瘤。agen-1884(安帝君斯)是一种抗ctla4抗体,其正在针对晚期实体瘤(nct02694822)的1期临床试验研究中进行研究。另一种免疫刺激的范例是使用溶瘤病毒。在一些实施例中,本发明提供了一种用于通过施用cxcr4拮抗剂,如本文揭示的化合物或其药学上可接受的盐或其药物组合物与免疫刺激疗法的组合,如溶瘤病毒来治疗患者的方法。可以在本发明中使用的经批准的免疫刺激性溶瘤病毒包含泰利莫齐拉赫帕雷(活性减毒单纯疱疹病毒,安进)。在一些实施例中,额外治疗剂是视黄酸受体相关孤儿受体γ(rorγt)的激活剂。rorγt是一种转录因子,在cd4+(th17)和cd8+(tc17)t细胞的17型效应子亚群的分化和维持以及表达先天免疫细胞亚群如nk细胞的il-17的分化中起关键作用。可以在本发明中使用的正在研究的rorγt激活剂是lyc-55716(莱塞拉(lycera)),其目前正在针对实体瘤(nct02929862)治疗的临床试验中进行评估。在一些实施例中,额外治疗剂是toll样受体(tlr)的激动剂或激活剂。合适的tlr激活剂包含tlr9的激动剂或激活剂,如sd-101(德纳维(dynavax))。sd-101是一种免疫刺激性cpg,正针对b细胞、滤泡和其它淋巴瘤(nct02254772)对其进行研究。可以在本发明中使用的tlr8激动剂或激活剂包含莫托莫德(motolimod)(vtx-2337,ventirx制药(ventirxpharmaceuticals)),正针对头颈部鳞状细胞癌(nct02124850)和卵巢癌(nct02431559)对其进行研究。可以在本发明中使用的其它检查点抑制剂包含含有蛋白-3的t细胞免疫球蛋白粘蛋白(tim-3)的抑制剂。可以在本发明中使用的tim-3抑制剂包含tsr-022、ly3321367和mbg453。tsr-022(特萨罗)是抗tim-3抗体,正在实体瘤(nct02817633)中对其进行研究。ly3321367(礼来)是抗tim-3抗体,正在实体瘤(nct03099109)中对其进行研究。mbg453(诺华)是抗tim-3抗体,正在晚期恶性肿瘤(nct02608268)中对其进行研究。可以在本发明中使用的其它检查点抑制剂包含具有ig和itim结构域的t细胞免疫受体或tigit即某些t细胞和nk细胞上的免疫受体的抑制剂。可以在本发明中使用的tigit抑制剂包含bms-986207(百时美施贵宝),其是一种抗tigit单克隆抗体(nct02913313);omp-313m32(安可医疗(oncomed));和抗tigit单克隆抗体(nct03119428)。可以在本发明中使用的检查点抑制剂还包含淋巴细胞活化基因-3(lag-3)的抑制剂。可以在本发明中使用的lag-3抑制剂包含bms-986016和regn3767以及imp321。bms-986016(百时美施贵宝),其是一种抗lag-3抗体,正在胶质母细胞瘤和胶质肉瘤(nct02658981)中对其进行研究。regn3767(再生元),其也是一种抗lag-3抗体,正在恶性肿瘤(nct03005782)中对其进行研究。imp321(immutep股份公司(immuteps.a.)),其是一种lag-3-ig融合蛋白,正在黑素瘤(nct02676869);腺癌(nct02614833);以及转移性乳腺癌(nct00349934)中对其进行研究。可以在本发明中与cxcr4抑制剂如本文揭示的化合物组合使用的其它免疫肿瘤学试剂包含:乌瑞鲁单抗(bms-663513,百时美施贵宝),其是一种抗cd137单克隆抗体;万利鲁单抗(cdx-1127,塞德斯医药),其是一种抗cd27单克隆抗体;bms-986178(百时美施贵宝),其是一种抗ox40单克隆抗体;立鲁单抗(iph2102/bms-986015,因内特制药、百时美施贵宝),其是一种抗kir单克隆抗体;莫纳利珠(iph2201,因内特制药、阿斯利康),其是一种抗nkg2a单克隆抗体;安卡利昔单抗(andecaliximab)(gs-5745,吉利德科学(gileadsciences)),其是一种抗mmp9抗体;mk-4166(默克公司(merck&co.)),其是一种抗gitr单克隆抗体。可以在本发明中使用的其它额外治疗剂包含格列姆巴妥木单抗-维德汀-一甲基瑞奥西汀e(glembatumumabvedotin-monomethylauristatine)(mmae)(塞德斯),其是一种连接到细胞毒性mmae的抗糖蛋白nmb(gpnmb)抗体(cr011)。gpnmb是由与癌细胞的转移能力相关的多种肿瘤类型过度表达的蛋白质。本发明的化合物还可以与其它抗增殖化合物组合使用以产生优势。此些抗增殖化合物包含但不限于:检查点抑制剂;芳香酶抑制剂;抗雌激素;拓扑异构酶i抑制剂;拓扑异构酶ii抑制剂;微管活性化合物;烷基化化合物;组蛋白脱乙酰酶抑制剂;诱导细胞分化过程的化合物;环加氧酶抑制剂;mmp抑制剂;mtor抑制剂;抗肿瘤抗代谢物;铂化合物;靶向/降低蛋白质或脂质激酶活性的化合物和另外的抗血管生成化合物;靶向、降低或抑制蛋白质或脂质磷酸酶活性的化合物;促性腺激素释放激素激动剂;抗雄激素;甲硫氨酸氨肽酶抑制剂;基质金属蛋白酶抑制剂;双膦酸盐;生物反应调节剂;抗增殖抗体;乙酰肝素酶抑制剂;ras致癌同种型的抑制剂;端粒酶抑制剂;蛋白酶体抑制剂;用于治疗血液系统恶性肿瘤的化合物;靶向、降低或抑制flt-3活性的化合物;hsp90抑制剂,如来自康福玛医药(conformatherapeutics)的17-aag(17-烯丙基氨基格尔德霉素,nsc330507)、17-dmag(17-二甲基氨基乙基氨基-17-去甲氧基-格尔德霉素,nsc707545)、ipi-504、cnf1010、cnf2024、cnf1010;替莫唑胺驱动蛋白纺锤体蛋白抑制剂,如来自葛兰素史克的sb715992或sb743921、或来自康拜那托雷克斯(combinatorx)的喷他脒/氯丙嗪;mek抑制剂,如来自阿莱生物制药(arraybiopharma)的arry142886、来自阿斯利康的azd6244、来自辉瑞的pd181461、以及甲酰四氢叶酸。如本文所使用的,术语“检查点抑制剂”涉及可用于阻止癌细胞逃避患者免疫系统的药剂。抗肿瘤免疫颠覆的主要机制之一被称为“t细胞耗竭”,其由已经导致抑制性受体的上调的持续抗原暴露引起。这些抑制性受体充当免疫检查点以防止不受控制的免疫反应。pd-1和共抑制受体如细胞毒性t淋巴细胞抗原4(ctla-4、b和t淋巴细胞衰减因子(btla;cd272)、t细胞免疫球蛋白和粘蛋白结构域-3(tim-3)、淋巴细胞活化基因-3(lag-3;cd223)等通常被称为检查点调节子。它们充当允许细胞外信息命令是否应当进行细胞周期进展和其它细胞内信号传导过程的分子“门卫”。一方面,检查点抑制剂是生物治疗剂或小分子。另一方面,检查点抑制剂是单克隆抗体、人源化抗体、完全人抗体、融合蛋白或其组合。在另外的方面,检查点抑制剂抑制选自ctla-4、pdl1、pdl2、pd1、b7-h3、b7-h4、btla、hvem、tim3、gal9、lag3、vista、kir、2b4、cd160、cgen-15049、chk1、chk2、a2ar、b-7家族配体或其组合的检查点蛋白。在额外的方面,检查点抑制剂抑制选自ctla-4、pdl1、pdl2、pd1、b7-h3、b7-h4、btla、hvem、tim3、gal9、lag-3、vista、kir、2b4、cd160、cgen-15049、chk1、chk2、a2ar、b-7家族配体或其组合的检查点蛋白。一方面,检查点抑制剂是免疫刺激剂、t细胞生长因子、白介素、抗体、疫苗或其组合。在另外的方面,白介素是il-7或il-15。在具体的方面,白介素是糖基化的il-7。在额外的方面,疫苗是树突细胞(dc)疫苗。检查点抑制剂包含以统计学上显著的方式阻断或抑制免疫系统的抑制途径的任何药剂。此些抑制剂可以包含小分子抑制剂或可以包含结合到并阻断或抑制免疫检查点受体的抗体或其抗原结合片段或结合到并阻断或抑制免疫检查点受体配体的抗体。可以针对阻断或抑制的说明性检查点分子包含但不限于:ctla-4、pdl1、pdl2、pd1、b7-h3、b7-h4、btla、hvem、gal9、lag3、tim3、vista、kir、2b4(属于cd2分子家族,并在所有nk、γδ和记忆cd8+(αβ)t细胞上表达)、cd160(也称为by55)、cgen-15049、chk1和chk2激酶、a2ar和各种b-7家族配体。b7家族配体包含但不限于:b7-1、b7-2、b7-dc、b7-h1、b7-h2、b7-h3、b7-h4、b7-h5、b7-h6和b7-h7。检查点抑制剂包含结合到并阻断或抑制以下中的一或多种的活性的抗体、或其抗原结合片段、其它结合蛋白、生物治疗剂或小分子:ctla-4、pdl1、pdl2、pd1、btla、hvem、tim3、gal9、lag3、vista、kir、2b4、cd160和cgen-15049。说明性免疫检查点抑制剂包含替西利姆单抗(ctla-4阻断抗体)、抗ox40、pd-l1单克隆抗体(抗b7-h1;medi4736)、mk-3475(pd-1阻断剂)、纳武单抗(阿西替尼;抗pd1抗体)、ct-011(抗pd1抗体)、by55单克隆抗体、amp224(抗pdl1抗体)、bms-936559(抗pdl1抗体)、mpldl3280a(抗pdl1抗体)、msb0010718c(抗pdl1抗体)、以及伊匹单抗(抗ctla-4检查点抑制剂)。检查点蛋白配体包含但不限于:pd-l1、pd-l2、b7-h3、b7-h4、cd28、cd86和tim-3。在某些实施例中,免疫检查点抑制剂选自pd-1拮抗剂、pd-l1拮抗剂和ctla-4拮抗剂。在一些实施例中,检查点抑制剂选自纳武单抗伊匹单抗或派姆单抗在一些实施例中,检查点抑制剂选自兰伯丽珠单抗(lambrolizumab)(mk-3475)、纳武单抗(bms-936558)、皮地利珠单抗(ct-011)、amp-224、mdx-1105、medi4736、mpdl3280a、bms-936559、伊匹单抗、利利单抗(lirlumab)、iph2101,派姆单抗或替西利姆单抗。如本文所使用的,术语“芳香酶抑制剂”涉及抑制雌激素产生,例如分别将底物雄烯二酮和睾酮转化为雌酮和雌二醇的化合物。所述术语包含但不限于:类固醇,尤其是阿他美坦(atamestane)、依西美坦和福美司坦(formestane),以及特别是非类固醇,尤其是氨鲁米特(aminoglutethimide)、洛太米特(roglethimide)、吡啶吡多米特(pyridoglutethimide)、曲洛司坦(trilostane)、睾内酯(testolactone)、酮康唑(ketokonazole)、伏氯唑(vorozole)、法倔唑(fadrozole)、阿那曲唑(anastrozole)和来曲唑(letrozole)。依西美坦以商标名阿诺新tm(aromasintm)销售。福美司坦以商标名兰他隆tm(lentarontm)销售。法倔唑以商标名阿费马tm(afematm)销售。阿那曲唑以商标名瑞宁得tm(arimidextm)销售。来曲唑以商标名弗隆tm(femaratm)或弗马tm(femartm)销售。氨鲁米特以商标名奥里米tm(orimetentm)销售。包括作为芳香酶抑制剂的化学治疗剂的本发明的组合尤其可用于治疗激素受体阳性肿瘤,如乳腺肿瘤。如本文所使用的,术语“抗雌激素”涉及拮抗雌激素受体水平的雌激素的作用的化合物。所述术语包含但不限于它莫西芬(tamoxifen)、氟维司群(fulvestrant)、雷洛昔芬(raloxifene)和盐酸雷洛昔芬(raloxifenehydrochloride)。它莫西芬以商标名诺瓦得士tm(nolvadextm)销售。盐酸雷洛昔芬以商标名易维特tm(evistatm)销售。氟维司群以商标名氟维司群tm(faslodextm)销售。包括作为抗雌激素的化学治疗剂的本发明的组合尤其可用于治疗雌激素受体阳性肿瘤,如乳腺肿瘤。如本文所使用的,术语“抗雄激素”涉及能够抑制雄激素的生物学作用的任何物质,并且包含但不限于比卡鲁胺(bicalutamide)(康士得tm(casodextm))。如本文所使用的,术语“促性腺激素释放激素激动剂”包含但不限于阿巴瑞克(abarelix)、戈舍瑞林(goserelin)和乙酸戈舍瑞林(goserelinacetate)。戈舍瑞林以商标名诺雷德tm(zoladextm)销售。如本文所使用的,术语“拓扑异构酶i抑制剂”包含但不限于:拓扑替康、吉马替康(gimatecan)、伊立替康、喜树碱(camptothecian)及其类似物、9-硝基喜树碱和大分子喜树碱共轭物pnu-166148。伊立替康可以例如按照例如以商标伊立替康tm(camptosartm)销售的形式施用。拓扑替康以商标名拓扑替康tm(hycamptintm)销售。如本文所使用的,术语“拓扑异构酶ii抑制剂”包含但不限于蒽环霉素,如阿霉素(包含脂质体配制品,如楷莱tm(caelyxtm))、道诺霉素、表柔比星、伊达比星和奈莫柔比星、蒽醌——米托蒽醌和洛索蒽醌、以及波多菲洛毒素(podophillotoxine)——依托泊苷和替尼泊苷。依托泊苷以商标名依托泊苷tm(etopophostm)销售。替尼泊苷以商标名vm26-百时(vm26-bristol)销售。阿霉素以商标名阿霉素tm(acriblastintm)或亚德里亚霉素tm(adriamycintm)销售。表柔比星以商标名表柔比星tm(farmorubicintm)销售。伊达比星以商标名伊达比星tm(zavedostm)销售。米托蒽醌以商标名米托蒽醌(novantron)销售。术语“微管活性剂”涉及微管稳定化合物、微管去稳定化合物和微管聚合抑制剂,包含但不限于:紫杉烷,如紫杉醇和多西他赛;长春花生物碱,如长春碱或硫酸长春碱、长春新碱或硫酸长春新碱、和长春瑞滨;圆皮海绵内酯;秋水仙碱和埃坡霉素及其衍生物。紫杉醇以商标名紫杉醇tm(taxoltm)销售。多西他赛以商标名泰索帝tm(taxoteretm)销售。硫酸长春碱以商标名长春碱r.ptm(vinblastinr.ptm)销售。硫酸长春新碱以商标名法莫司汀tm(farmistintm)销售。如本文所使用的,术语“烷化剂”包含但不限于环磷酰胺、异环磷酰胺、美法仑或亚硝基脲(bcnu或膜剂(gliadel))。环磷酰胺以商标名环磷酰胺tm(cyclostintm)销售。异环磷酰胺以商标名和乐生tm(holoxantm)销售。术语“组蛋白脱乙酰酶抑制剂”或“hdac抑制剂”涉及抑制组蛋白脱乙酰酶并具有抗增殖活性的化合物。这包含但不限于辛二酰苯胺异羟肟酸(saha)。术语“抗肿瘤抗代谢物”包含但不限于:5-氟尿嘧啶或5-fu、卡培他滨(capecitabine)、吉西他滨(gemcitabine)、dna去甲基化化合物,如5-氮杂胞苷和地西他滨(decitabine)、甲氨蝶呤和依达曲沙(edatrexate)和叶酸拮抗剂,如培美曲塞(pemetrexed)。卡培他滨以商标名希罗达tm(xelodatm)销售。吉西他滨以商标名健择tm(gemzartm)销售。如本文所使用的术语“铂化合物”包含但不限于卡铂、顺铂(cis-platin)、顺铂(cisplatinum)和奥沙利铂。卡铂可以按照例如以商标卡铂tm(carboplattm)销售的形式施用。奥沙利铂可以按照例如以商标益乐铂定tm(eloxatintm)销售的形式施用。如本文所使用的,术语“靶向/降低蛋白质或脂质激酶活性;或蛋白质或脂质磷酸酶活性的化合物;或另外的抗血管生成化合物”包含但不限于:蛋白酪氨酸激酶和/或丝氨酸和/或苏氨酸激酶抑制剂或脂质激酶抑制剂,如a)靶向、降低或抑制血小板衍生生长因子受体(pdgfr)的活性的化合物,如靶向、降低或抑制pdgfr的活性的化合物,尤其是抑制pdgf受体的化合物,如n-苯基-2-嘧啶-胺衍生物,如伊马替尼、su101、su6668和gfb-111;b)靶向、降低或抑制成纤维细胞生长因子受体(fgfr)的活性的化合物;c)靶向、降低或抑制胰岛素样生长因子受体i(igf-ir)的活性的化合物,如靶向、降低或抑制igf-ir的活性的化合物,尤其是抑制igf-i受体的激酶活性的化合物、或靶向igf-i受体或其生长因子的细胞外结构域的抗体;d)靶向、降低或抑制trk受体酪氨酸激酶家族的活性的化合物或肝配蛋白b4抑制剂;e)靶向、降低或抑制axi受体酪氨酸激酶家族的活性的化合物;f)靶向、降低或抑制ret受体酪氨酸激酶的活性的化合物;g)靶向、降低或抑制kit/scfr受体酪氨酸激酶的活性的化合物,如伊马替尼;h)靶向、降低或抑制作为pdgfr家族的一部分的c-kit受体酪氨酸激酶的活性的化合物,如靶向、降低或抑制c-kit受体酪氨酸激酶家族的活性的化合物,尤其是抑制c-kit受体的化合物,如伊马替尼;i)靶向、降低或抑制c-abl家族成员、其基因融合产物(例如,bcr-abl激酶)和突变体的活性的化合物,如靶向、降低或抑制c-abl家族成员及其基因融合产物,如n-苯基-2-嘧啶-胺衍生物的活性的化合物,如伊马替尼或尼罗替尼(amn107);pd180970;ag957;nsc680410;来自帕克戴维(parkedavis)的pd173955;或达沙替尼(bms-354825);j)靶向、降低或抑制丝氨酸/苏氨酸激酶的蛋白激酶c(pkc)和raf家族的成员;mek、src、jak/泛jak(pan-jak)、fak、pdk1、pkb/akt、ras/mapk、pi3k、syk、tyk2、btk和tec家族的成员;和/或包含星形孢菌素衍生物的细胞周期蛋白依赖性激酶家族(cdk)的成员的活性的化合物,如米哚妥林;另外的化合物的实例包含ucn-01、沙芬戈(safingol)、bay43-9006、苔藓抑素1(bryostatin1)、哌立福辛(perifosine);伊莫福新(llmofosine);ro318220和ro320432;go6976;lsis3521;ly333531/ly379196;异喹啉化合物;fti;pd184352或qan697(p13k抑制剂)或at7519(cdk抑制剂);k)靶向、降低或抑制蛋白酪氨酸激酶抑制剂的活性的化合物,如靶向、降低或抑制蛋白酪氨酸激酶抑制剂的活性的化合物包含甲磺酸伊马替尼(格列卫tm)或酪氨酸磷酸化抑制剂,如酪氨酸磷酸化抑制剂a23/rg-50810;ag99;酪氨酸磷酸化抑制剂ag213;酪氨酸磷酸化抑制剂ag1748;酪氨酸磷酸化抑制剂ag490;酪氨酸磷酸化抑制剂b44;酪氨酸磷酸化抑制剂b44(+)对映体;酪氨酸磷酸化抑制剂ag555;ag494;酪氨酸磷酸化抑制剂ag556、ag957和阿达弗斯汀(adaphostin)(4-{[(2,5-二羟基苯基)甲基]氨基}-苯甲酸金刚烷基酯;nsc680410,阿达弗斯汀);l)靶向、降低或抑制受体酪氨酸激酶(作为同源或异源二聚体的egfr1、erbb2、erbb3、erbb4)及其突变体的表皮生长因子家族的活性的化合物,如靶向、降低或抑制表皮生长因子受体家族的活性的化合物尤其是抑制egf受体酪氨酸激酶家族成员,如egf受体、erbb2、erbb3和erbb4或结合到egf或egf相关配体、cp358774、zd1839、zm105180的化合物、蛋白质或抗体;曲妥珠单抗(赫塞汀tm(herceptintm))、西妥昔单抗(爱必妥tm(erbituxtm))、易瑞沙(iressa)、特罗凯(tarceva)、osi-774、cl-1033、ekb-569、gw-2016、e1.1、e2.4、e2.5、e6.2、e6.4、e2.11、e6.3或e7.6.3和7h-吡咯并-[2,3-d]嘧啶衍生物;m)靶向、降低或抑制c-met受体的活性的化合物,如靶向、降低或抑制c-met的活性的化合物,尤其是抑制c-met受体的激酶活性的化合物、或靶向c-met的细胞外结构域或与结合到hgf的抗体;n)靶向、降低或抑制一或多种jak家族成员(jak1/jak2/jak3/tyk2和/或泛jak)的激酶活性的化合物,包含但不限于prt-062070、sb-1578、巴瑞克替尼(baricitinib)、帕克替尼(pacritinib)、莫美罗替尼(momelotinib)、vx-509、azd-1480、tg-101348、托法替尼(tofacitinib)以及鲁索替尼;o)靶向、降低或抑制pi3激酶(pi3k)的激酶活性的化合物,包含但不限于atu-027、sf-1126、ds-7423、pbi-05204、gsk-2126458、zstk-474、布帕尼西(buparlisib)、皮克特尼西(pictrelisib)、pf-4691502、byl-719、达托尼西(dactolisib)、xl-147、xl-765和艾代拉尼西;以及q)靶向、降低或抑制刺猬蛋白(hh)或平滑受体(smo)途径的信号传导作用的化合物,包含但不限于环杷明、维莫德吉、伊曲康唑(itraconazole)、伊莫德吉(erismodegib)和ipi-926(萨瑞德吉(saridegib))。如本文所使用的,术语“pi3k抑制剂”包含但不限于对磷脂酰肌醇-3-激酶家族中的一或多种酶具有抑制活性的化合物,所述酶包含但不限于pi3kα、pi3kγ、pi3kδ、pi3kβ、pi3k-c2α、pi3k-c2β、pi3k-c2γ、vps34、p110-α、p110-β、p110-γ、p110-δ、p85-α、p85-β、p55-γ、p150、p101和p87。可在本发明中使用的pi3k抑制剂的实例包含但不限于:atu-027、sf-1126、ds-7423、pbi-05204、gsk-2126458、zstk-474、布帕尼西、皮克特尼西、pf-4691502、byl-719、达托尼西、xl-147、xl-765和艾代拉尼西。如本文所用的,术语“bcl-2抑制剂”包含但不限于对b细胞淋巴瘤2蛋白(bcl-2)具有抑制活性的化合物,包含但不限于abt-199、abt-731、abt-737、阿朴棉子酚(apogossypol)、艾森塔(ascenta)的泛bcl-2抑制剂、姜黄素(及其类似物)、双bcl-2/bcl-xl抑制剂(无限制药/诺华制药)、奥利默森钠(genasense)(g3139)、ha14-1(及其类似物;参见wo2008118802)、纳威托克斯(及其类似物,参见us7390799)、nh-1(沈阳药科大学(shenyangpharmaceuticaluniversity))、奥巴托克斯(obatoclax)(及其类似物,参见wo2004106328)、s-001(誉衡药业(gloriapharmaceuticals))、tw系列化合物(密歇根大学(univ.ofmichigan))和维奈托克斯。在一些实施例中,bcl-2抑制剂是小分子治疗剂。在一些实施例中,bcl-2抑制剂是拟肽。如本文所使用的,术语“btk抑制剂”包含但不限于对布鲁顿酪氨酸激酶(btk)具有抑制活性的化合物,包含但不限于avl-292和依鲁替尼。如本文所使用的,术语“syk抑制剂”包含但不限于对脾酪氨酸激酶(syk)具有抑制活性的化合物,包含但不限于prt-062070、r-343、r-333、埃克塞尔(excellair)、prt-062607和福坦替尼(fostamatinib)。btk抑制化合物的另外实例和可通过此些化合物与本发明化合物的组合治疗的病症可以在wo2008039218和wo2011090760中找到,所述文献的全部内容通过引用并入本文。syk抑制化合物的另外实例和可通过此些化合物与本发明化合物的组合治疗的病症可以在wo2003063794、wo2005007623、和wo2006078846中找到,所述文献的全部内容通过引用并入本文。pi3k抑制化合物的另外实例和可通过此些化合物与本发明化合物的组合治疗的病症可以在wo2004019973、wo2004089925、wo2007016176、us8138347、wo2002088112、wo2007084786、wo2007129161、wo2006122806、wo2005113554、和wo2007044729中找到,所述文献的全部内容通过引用并入本文。jak抑制化合物的另外实例和可通过此些化合物与本发明化合物的组合治疗的病症可以在wo2009114512、wo2008109943、wo2007053452、wo2000142246、和wo2007070514中找到,所述文献全部内容通过引用并入本文。另外的抗血管生成化合物包含具有针对其活性的另一种机制的化合物,例如,与蛋白质或脂质激酶抑制无关,例如沙利度胺(thalidomide)(沙利度胺tm(thalomidtm))和tnp-470。可用于与本发明化合物组合使用的蛋白酶体抑制剂的实例包含但不限于:硼替佐米、双硫仑、表焙儿茶素-3-没食子酸盐(egcg)、盐孢菌酰胺a(salinosporamidea)、卡非佐米、onx-0912、cep-18770和mln9708。靶向、降低或抑制蛋白质或脂质磷酸酶的活性的化合物是例如磷酸酶1、磷酸酶2a、或cdc25的抑制剂,如冈田酸或其衍生物。诱导细胞分化过程的化合物包含但不限于视黄酸、α-γ-或δ-生育酚或α-γ-或δ-生育三烯酚。如本文所使用的,术语环氧酶抑制剂包含但不限于:cox-2抑制剂、5-烷基取代的2-芳基氨基苯乙酸和衍生物,如塞来昔布(celecoxib)(西乐葆tm(celebrextm))、罗非昔布(rofecoxib)(万络tm(vioxxtm))、依托昔布(etoricoxib)、伐地昔布(valdecoxib)或5-烷基-2-芳基氨基苯乙酸,如5-甲基-2-(2'-氯-6'-氟苯氨基)苯乙酸、罗美昔布(lumiracoxib)。如本文所使用的,术语“二膦酸盐”包含但不限于依替膦酸(etridonicacid)、氯膦酸(clodronicacid)、替鲁膦酸(tiludronicacid)、帕米膦酸(pamidronicacid)、阿仑膦酸(alendronicacid)、伊班膦酸(ibandronicacid)、利塞膦酸(risedronicacid)和唑来膦酸(zoledronicacid)。依替膦酸以商标名帝罗奈tm(didroneltm)销售。氯膦酸以商标名骨复舒tm(bonefostm)销售。替鲁膦酸以商标名斯凯利tm(skelidtm)销售。帕米膦酸以商标名阿可达tm(arediatm)销售。阿仑膦酸以商标名福善美tm(fosamaxtm)销售。伊班膦酸以商标名邦德纳特tm(bondranattm)销售。利塞膦酸以商标名安妥良tm(actoneltm)销售。唑来膦酸以商标名择泰tm(zometatm)销售。术语“mtor抑制剂”涉及抑制哺乳动物雷帕霉素靶蛋白(mtor)并具有抗增殖活性的化合物,如西罗莫司依维莫司(卓定康tm(certicantm))、cci-779和abt578。如本文所使用的,术语“乙酰肝素酶抑制剂”是指靶向、降低或抑制硫酸肝素降解的化合物。所述术语包含但不限于pi-88。如本文所使用的,术语“生物反应调节剂”是指淋巴因子或干扰素。如本文所使用的,术语“ras致癌同种型的抑制剂”如h-ras、k-ras或n-ras是指靶向、降低或抑制ras的致癌活性的化合物;例如,“法呢基转移酶抑制剂”,如l-744832、dk8g557或r115777(扎内斯特拉tm(zarnestratm))。如本文所使用的,术语“端粒酶抑制剂”是指靶向、降低或抑制端粒酶的活性的化合物。靶向、降低或抑制端粒酶活性的化合物尤其是抑制端粒酶受体的化合物,如端粒抑素。如本文所使用的,术语“甲硫氨酸氨肽酶抑制剂”是指靶向、降低或抑制甲硫氨酸氨肽酶的活性的化合物。靶向、降低或抑制甲硫氨酸氨肽酶的活性的化合物包含但不限于班格酰胺(bengamide)或其衍生物。如本文所使用的,术语“蛋白酶体抑制剂”是指靶向、降低或抑制蛋白酶体的活性的化合物。靶向、降低或抑制蛋白酶体的活性的化合物包含但不限于硼替佐米(万珂tm(velcadetm))和mln341。如本文所使用的,术语“基质金属蛋白酶抑制剂”或(“mmp”抑制剂)包含但不限于:胶原拟肽和非拟肽抑制剂、四环素衍生物,例如异羟肟酸拟肽抑制剂巴马司他(batimastat)及其可口服生物利用类似物马马司他(marimastat)(bb-2516)、普马司他(prinomastat)(ag3340)、马他司他(metastat)(nsc683551)、bms-279251、bay12-9566、taa211、mmi270b或aaj996。如本文所使用的,术语“用于治疗血液系统恶性肿瘤的化合物”包含但不限于fms样酪氨酸激酶抑制剂,其是靶向、降低或抑制fms样酪氨酸激酶受体(flt-3r)的活性的化合物;干扰素、1-β-d-阿拉伯呋喃糖基胞嘧啶(arabinofuransylcytosine,ara-c)和硫亚砜(bisulfan);以及alk抑制剂,其是靶向、减少或抑制间变型淋巴瘤激酶的化合物。靶向、降低或抑制fms样酪氨酸激酶受体(flt-3r)的活性的化合物尤其是抑制flt-3r受体激酶家族的成员的化合物、蛋白质或抗体,如pkc412、米哚妥林、星形孢菌素衍生物、su11248和mln518。如本文所使用的,术语“hsp90抑制剂”包含但不限于靶向、降低或抑制hsp90的固有atp酶活性的化合物;通过泛素蛋白酶体途径降解、靶向、降低或抑制hsp90客户蛋白的化合物。靶向、降低或抑制hsp90的固有atp酶活性的化合物尤其是抑制hsp90的atp酶活性的化合物、蛋白质或抗体,如17-烯丙基氨基、17-去甲氧基格尔德霉素(17aag)、格尔德霉素衍生物;其它格尔德霉素相关化合物;根赤壳菌素和hdac抑制剂。如本文所使用的,术语“抗增殖性抗体”包含但不限于:曲妥珠单抗(赫塞汀tm)、曲妥珠单抗dm1、爱必妥、贝伐珠单抗(阿瓦斯丁tm)、利妥昔单抗pro64553(抗cd40)和2c4抗体。抗体是指完整的单克隆抗体、多克隆抗体、由至少2种完整抗体形成的多特异性抗体和抗体片段,只要其表现出期望的生物活性即可。对于急性髓性白血病(aml)的治疗,本发明的化合物可以与标准白血病疗法组合使用,特别是与用于治疗aml的疗法组合使用。特别地,本发明的化合物可以与例如法呢基转移酶抑制剂和/或可用于治疗aml的如道诺霉素、亚德里亚霉素、ara-c、vp-16、替尼泊苷、米托蒽醌、伊达比星、卡钼(carboplatinum)和pkc412等其它药物组合施用。其它抗白血病化合物包含,例如,ara-c,一种嘧啶类似物,其是脱氧胞苷的2'-α-羟基核糖(阿拉伯糖苷)衍生物。还包含次黄嘌呤、6-巯基嘌呤(6-mp)和磷酸氟达拉滨的嘌呤类似物。靶向、降低或抑制组蛋白脱乙酰酶(hdac)抑制剂的活性的化合物如丁酸钠和辛二酰苯胺异羟肟酸(saha)抑制称为组蛋白脱乙酰酶的酶的活性。特异性hdac抑制剂包含:ms275、saha、fk228(原名为为fr901228)、曲古抑菌素a和us6,552,065中揭示的化合物,包含但不限于:n-羟基-3-[4-[[[2-(2-甲基-1h-吲哚-3-基)-乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺或其药学上可接受的盐和n-羟基-3-[4-[(2-羟基乙基){2-(1h-吲哚-3-基)乙基]-氨基]甲基]苯基]-2e-2-丙烯酰胺或其药学上可接受的盐,尤其是乳酸盐。如本文所使用的,生长抑素受体拮抗剂是指靶向、治疗或抑制生长抑素受体的化合物,如奥曲肽和som230。肿瘤细胞损伤方法指的是如电离辐射等方法。上文和下文所提及的术语“电离辐射”是指作为电磁射线(如x射线和γ射线)或粒子(如α和β粒子)产生的电离辐射。电离辐射在辐射疗法中提供,但不限于此,并且是本领域已知的。参见赫尔曼(hellman)放射疗法的原则(principlesofradiation),癌症:肿瘤学原理与实践(cancer,inprinciplesandpracticeofoncology),德维塔(devita)等人编者,第4版,第1卷,第248到275页(1993)。还包含edg结合剂和核糖核苷酸还原酶抑制剂。如本文所使用的,术语“edg结合剂”是指一类调节淋巴细胞再循环的免疫抑制剂,如fty720。术语“核糖核苷酸还原酶抑制剂”是指嘧啶或嘌呤核苷类似物,包含但不限于:氟达拉滨和/或胞嘧啶阿拉伯糖苷(ara-c)、6-硫鸟嘌呤、5-氟尿嘧啶、克拉屈滨、6-巯基嘌呤(特别是针对all与ara-c组合使用)和/或喷司他丁(pentostatin)。核糖核苷酸还原酶抑制剂特别是羟基脲或2-羟基-1h-异吲哚-1,3-二酮衍生物。还特别地包含vegf的那些化合物、蛋白质或单克隆抗体,如1-(4-氯苯胺基)-4-(4-吡啶基甲基)酞嗪或其药学上可接受的盐、1-(4-氯苯胺基)-4-(4-吡啶基甲基)酞嗪琥珀酸盐;血管抑素tm(angiostatintm);内皮他丁tm(endostatintm);邻氨基苯甲酸酰胺;zd4190;zd6474;su5416;su6668;贝伐珠单抗;或抗vegf抗体或抗vegf受体抗体,如rhumab和rhufab、vegf适体如玛库刚(macugon);flt-4抑制剂、flt-3抑制剂、vegfr-2igg1抗体、血管增生核酶(angiozyme)(rpi4610)和贝伐珠单抗tm(阿瓦斯丁tm)。如本文所使用的,光动力疗法是指使用称为光敏化合物的某些化学物质来治疗或预防癌症的疗法。光动力疗法的实例包含用如维速达尔tm(visudynetm)和卟吩姆钠(porfimersodium)等化合物进行的治疗。如本文所使用的,血管生成抑制类固醇是指阻断或抑制血管生成的化合物,如例如阿奈可他(anecortave)、去炎松(triamcinolone)、氢化可的松(hydrocortisone)、11-α-表氢化皮质醇(11-α-epihydrocotisol)、脱氧皮甾醇(cortexolone)、17α-羟孕酮、皮质酮、去氧皮质酮、睾酮、雌酮和地塞米松(dexamethasone)。含有皮质类固醇的植入物是指如氟轻松和地塞米松等化合物。其它化学治疗化合物包含但不限于植物生物碱、激素化合物和拮抗剂;生物反应调节剂,优选地淋巴因子或干扰素;反义寡核苷酸或寡核苷酸衍生物;shrna或sirna;或其它化合物或具有其它或未知作用机理的化合物。通过代号、通用名或商标名标识的活性化合物的结构可以取自标准纲要“默克索引(themerckindex)”的实际版本或数据库,例如国际专利(patentsinternational)(例如,ims世界出版物(imsworldpublications))。本发明的化合物还可以与已知的治疗方法,例如施用激素或放射物组合使用。在某些实施例中,所提供的化合物用作放射增敏剂,尤其用于治疗对放射疗法表现出不良敏感性的肿瘤。本发明的化合物可以单独施用或与一或多种其它治疗化合物组合施用,可能的组合疗法采取固定组合的形式或本发明化合物与一或多种其它治疗化合物的施用交错或彼此独立给予或固定组合与一或多种其它治疗化合物的组合施用。除此之外或另外,本发明的化合物可以与化学疗法、放射疗法、免疫疗法、光疗法、外科手术介入或这些的组合组合结合施用以特别用于肿瘤治疗。长期疗法同样是可能的,如在如上所述的其它治疗策略的背景下的辅助治疗一样。其它可能的治疗是在肿瘤消退后维持患者状态的疗法,或甚至是化学预防疗法,例如在有风险的患者中。这些额外的药剂可以作为多剂量方案的一部分与含本发明化合物的组合物单独施用。可替代地,那些试剂可以是与本发明的化合物一起混合在单一组合物中的单一剂型的一部分。如果作为多剂量方案的一部分施用,则所述两种活性剂可以同时、顺序地或在彼此相隔一段时间内,通常彼此相隔五小时内递送。如本文所使用的,术语“组合”、“组合的”和相关术语是指根据本发明的治疗剂的同时或顺序地施用。例如,可以将本发明的化合物与另一种治疗剂同时地或者以单独的单位剂型顺序地或者以单个单位剂型一起施用。因此,本发明提供了一种单一单位剂型,所述剂型包括本发明的化合物、额外的治疗剂以及药学上可接受的载剂、佐剂或媒剂。可以与载剂材料组合以产生单一剂型的本发明化合物和额外治疗剂(在包括如上所述的额外治疗剂的那些组合物中)的量将根据所治疗的主体和特定给药模式而变化。优选地,本发明的组合物应当被配置为使得可以施用0.01到100mg/kg体重/天剂量的本发明的化合物。在那些包括额外治疗剂的组合物中,所述额外治疗剂和本发明的化合物可以协同起作用。因此,此些组合物中额外治疗剂的量将小于仅利用所述治疗剂的单一疗法中所需的量。在此些组合物中,可以施用剂为0.01到1,000μg/kg体重/天的额外治疗剂。存在于本发明组合物中的额外的治疗剂的量将不超过通常在包括所述治疗剂作为唯一活性剂的组合物中施用的量。优选地,本发明揭示的组合物中额外治疗剂的量的范围为包括所述药剂作为唯一治疗活性剂的组合物中通常存在的量的约50%到100%。本发明的化合物或其药物组合物也可以结合到用于涂覆可植入医疗装置如假体、人工瓣膜、血管移植物、支架和导管的组合物中。例如,血管支架已被用于克服再狭窄(损伤后血管壁的再狭窄)。然而,使用支架或其它可植入装置的患者会有形成凝块或血小板活化的风险。这些不期望的结效果可以通过用包括激酶抑制剂的药学上可接受的组合物预涂覆装置从而进行防止或减轻。涂有本发明化合物的可植入装置是本发明的另一个实施例。例示通用合成方法以下实例旨在说明本发明并且不应被解释为对其进行限制。除非另有说明,否则此后描述的实例的化合物的一或多种互变异构形式可以在原位和/或隔离地制备。此后描述的实例的化合物的所有互变异构形式应当被视为已揭示。温度以摄氏度给出。如果没有另外提及,则所有蒸发在减压下执行,优选地在15mmhg与100mmhg(=20到133mbar)之间。最终产物、中间产物和起始材料的结构通过标准分析方法,例如微量分析和光谱学特性例如ms、ir、nmr确认。所使用的缩写是本领域中常规的缩写。用于合成本发明的化合物的所有起始材料、结构单元、试剂、酸、碱、脱水剂、溶剂和催化剂是可商购的或者可以通过本领域普通技术人员已知的有机合成方法产生(胡本-外尔(houben-weyl)第4版1952,有机合成方法(methodsoforganicsynthesis),蒂姆(thieme),第21卷)。此外,本发明的化合物可以通过如以下实例中示出的本领域普通技术人员已知的有机合成方法产生。如在以下实例中描绘的,在某些示范性实施例中,化合物是根据以下通用程序制备的。将理解的是,尽管通用方法描绘了本发明的某些化合物的合成,但是以下通用方法以及本领域普通技术人员已知的其它方法可以应用于如本文所描述的所有化合物和这些化合物中的每一种的子类和类别。缩写equiv或eq:摩尔当量o/n:过夜rt:室温uv:紫外线hplc:高压液相色谱法rt:保留时间lcms或lc-ms:液相色谱法-质谱法nmr:核磁共振cc:柱色谱法tlc:薄层色谱法sat:饱和的aq:含水的ac:乙酰基dcm:二氯甲烷dce:二氯乙烷dea:二乙胺dmf:二甲基甲酰胺dmso:二甲亚砜acn或mecn:乙腈dipea:二异丙基乙胺ea或etoac:乙酸乙酯binap:(±)-2,2'-双(二苯基膦基)-1,1'-联二萘tea:三乙胺thf:四氢呋喃tbs:叔丁基二甲基硅烷基khmds:六甲基二硅叠氮钾tf:三氟甲基磺酸盐ms:甲磺酰基nbs:n-溴代琥珀酰亚胺pe:石油醚tfa:三氟乙酸mmpp:单过氧邻苯二甲酸镁hatu:1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶3-氧化物六氟磷酸盐cy:环己基tol:甲苯dmp:戴斯-马丁高碘烷(dess-martinperiodinane)ibx:2-碘酰基苯甲酸pmb:对甲氧苄基sem:[2-(三甲基硅烷基)乙氧基]甲基x磷或x-磷(xphos或x-phos):2-二环己基膦-2',4',6'-三异丙基联苯一般信息:用旋转蒸发器在真空中进行所有蒸发。在室温下真空干燥(1到5mmhg)分析样品。在硅胶板上执行薄层色谱法(tlc),通过uv光(214nm和254nm)使斑点可视化。使用硅胶(200到300目)进行通过柱色谱法和快速色谱法进行的纯化。按体积将溶剂体系报告为混合物。在布鲁克(bruker)400(400mhz)分光义上记录所有1hnmr光谱。以氘代溶剂作为内标,以百万分率(ppm)的δ值报告1h化学位移。数据报告如下:化学位移,多重性(s=单重态,d=双重态,t=三重态,q=四重态,br=宽,m=多重态),耦合常数(hz),积分(即质子数)。在安捷伦(agilent)1200系列6110或6120质谱仪上用电喷雾电离获得lcms光谱,并且除非另有说明外,一般lcms条件如下:沃特世x型桥(watersxbridge)c18柱(50mm*4.6mm*3.5μm),流速:2.0ml/分钟,柱温:40℃。通用程序a(基斯内尔-沃尔夫还原(wolff-kishnerreduction)):将2,6-二芳基哌啶-4-酮(浓度0.1到1.0m)、koh(20当量)和n2h4·h2o(40当量)在二甘醇中的混合物在80℃下并且然后在150℃到200℃之间搅拌约2小时,直至反应完成。冷却至室温后,将反应混合物用水稀释并用dcm萃取。将有机层用水和盐水洗涤,经na2so4干燥,过滤并在真空中浓缩。通过cc纯化残余物以得到2,6-二芳基哌啶。通用程序b(2,6-二芳基哌啶的n-烷基化):在ar气氛下,向2,6-二芳基哌啶(浓度0.1到1.0m)在dmf或acn中的溶液加入对应的卤化物或甲磺酸盐(2当量)和k2co3(2到3当量)。在60℃到80℃下将混合物搅拌过夜。然后将所述混合物用h2o稀释,并用dcm萃取。将组合的有机层用水洗涤,经na2so4干燥,过滤并在真空中浓缩以得到期望的n-烷基化目标。通用程序c(醇与甲磺酰氯的反应):在-70℃下向醇(浓度0.1到1.0m)和et3n(约2.5当量)在dcm中的溶液中逐滴加入mscl(1.2到1.4当量),并将反应混合物在室温下搅拌30分钟。然后将所得混合物用nahco3水溶液淬灭并用dcm萃取。将组合的有机层用水和盐水洗涤,经na2so4干燥并过滤。将滤液在真空中浓缩以得到对应的甲磺酸盐。通用程序d(甲磺酸盐或卤化物与2,6-二芳基哌啶的反应):将2,6-二芳基哌啶(浓度0.1到1.0m)、对应的甲磺酸盐或卤化物(约2到3当量)、ki(0.2到0.3当量)、dipea或et3n(2到3当量)在dmf或acn中的混合物在60℃到80℃下搅拌过夜并过滤。将滤液通过制备型hplc纯化以获得烷基化的2,6-二芳基哌啶。通用程序e(芳醛与丙酮反应以得到4-(杂芳基或芳基)丁-3-烯-2-酮):将对应的芳醛(浓度0.1到1.0m)、丙酮(20当量)和k2co3(1.5到2当量)在甲苯/etoh/h2o(5:2:1)中的混合物在80℃下搅拌约13小时并冷却至室温。用ea稀释后,将反应混合物通过碱性硅胶柱过滤并用dcm/meoh(100/1)洗涤。将滤液在真空中浓缩以得到4-(杂芳基或芳基)丁-3-烯-2-酮,其在不进行进一步纯化的情况下用于下一步骤。通用程序f(芳醛与丙酮反应以得到4-(杂芳基或芳基)丁-3-烯-2-酮):在0℃下向芳醛(浓度0.1到1.0m)在丙酮中的混合物加入naoh(约8m,1.5当量)在h2o中的溶液。将混合物在0℃下搅拌1小时。然后,将其加热至室温并再搅拌2小时。将溶液用35%hcl水将溶液调节为ph8,将hcl经无水na2so4干燥,过滤并在真空中浓缩。通过柱色谱法纯化残余物以得到4-(杂芳基或芳基)丁-3-烯-2-酮。通用方法g(1h-苯并[d]咪唑衍生物的n-烷基化):在n2气氛下向1h-苯并[d]咪唑衍生物的在thf中的溶液(浓度0.1到1m)加入nah(矿物油中60%,约3当量)。将混合物在室温下搅拌约1小时。然后加入适当的烷基溴或甲磺酸盐(约3当量),并且将混合物在70℃下加热过夜。加入水并用etoac萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并在真空中浓缩。通过柱色谱法或制备型hplc纯化残余物以得到期望的1-烷基-1h-苯并[d]咪唑衍生物。通用程序h(n-boc保护胺的n-boc裂解):在室温下向n-boc保护胺(浓度0.1到1m)在dcm中的溶液加入tfa(dcm体积的1/15)。将反应混合物搅拌2小时,然后浓缩并加入饱和的nahco3水溶液,并用dcm萃取混合物。将有机萃取物经na2so4干燥,过滤并浓缩以得到作为期望目标的游离胺。通用程序i(芳基甲醇到芳醛的斯文氧化(swernoxidization)):在-78℃下在n2气氛下在15分钟内向草酰二氯(1.5当量,浓度0.2到2m)在dcm中的溶液加入dmso(3当量),然后将溶液在-78℃下搅拌另外15分钟。将芳基甲醇(1当量,浓度0.1到1m)在dcm/dmso(5:1)中的溶液加入混合物中并在-78℃下搅拌2小时。加入三乙胺(6当量),然后在-78℃下搅拌30分钟,并在室温下搅拌30分钟。将混合物在真空中浓缩并用水稀释。过滤固体产物并在真空下干燥。通用程序j(芳基溴与烷基胺的布赫瓦尔德偶联(buchwaldcoupling)):芳基溴(浓度0.1到1m)、烷基胺(2当量,0.2到2m)、pd2(dba)3(0.1到0.15当量)、x-磷或binap(0.2到0.3当量)、t-buona(4到6当量)或cs2co3(2到4当量)在甲苯中的混合物在75℃到120℃下搅拌过夜。完成后,将反应混合物在真空下浓缩,并通过柱色谱法纯化以得到期望产物。通用程序k(用sem保护1h-苯并[d]咪唑衍生物):将1h-苯并[d]咪唑衍生物(浓度0.1到1m)在thf中的混合物加入nah(4.0当量),然后在0℃下搅拌30分钟,然后加入semcl(2当量)并在室温下搅拌1小时。将混合物用水稀释并用etoac萃取。将组合的有机层用盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。通过柱色谱法纯化残余物以得到期望产物。通用程序l(芳基羧酸酯转化为3-芳基-3-氧代丙酸乙酯):在ar下将芳基羧酸酯(浓度0.1到1m)和乙酸乙酯(6当量)在thf中的溶液在-50℃下搅拌10分钟。加入thf(3当量)中的1mlihmds并在-50℃下搅拌30分钟。用2mhcl淬灭反应,并用甲基叔丁基醚(mtbe)洗涤。将水层用40%naoh水溶液处理以达到ph=9并用dcm萃取。将有机层组合、经mgso4干燥、过滤并蒸发以得到粗3-芳基-3-氧代丙酸乙酯,其在不进行进一步纯化的情况下用于下一步骤。通用程序m(伯胺或仲胺到仲胺或叔胺的还原胺化):向伯胺或仲胺(浓度0.1到1m)、对应的醛或酮(1到2当量)和氰基硼氢化钠(2当量)在meoh中的混合物加入几滴乙酸,并且然后在室温下搅拌混合物2到18小时。将混合物用饱和的nahco3水溶液中和到ph=8到9并用dcm萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并在真空下浓缩以得到仲胺或叔胺。通用程序n(pmb保护胺裂解):将pmb保护胺(浓度0.1到1m)在tfa中的溶液(2ml)在50℃到60℃下搅拌2到5小时。将混合物用饱和的nahco3水溶液中和并用dcm萃取。将有机层用盐水洗涤,经na2so4干燥,过滤并在真空下浓缩。通过制备型hplc或快速柱(flashcolumn)进一步纯化残余物。实例1:合成i-1i-1的合成方案x4-011-4:按照通用程序a,获得呈灰褐色固体的x4-011-4(150mg,26.2%产率),并且h-hnoesy确认其是顺式产物。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:58.3%。保留时间=1.65分钟;ms计算值:292.2;ms实测值:293.2[m+h]+。x4-011-5:按照通用程序d,获得呈白色泡沫的x4-011-5(70.0mg,31.9%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4水溶液)水/ch3cn=9/1(v/v)]和10%[10mmaconh4水溶液)/ch3cn=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:100.00%。保留时间=2.15分钟;ms计算值:493.2;ms实测值:494.3[m+h]+。1hnmr(cdcl3)δ12.0(br,1h),8.40(s,1h),7.77-7.66(m,5h),7.44-7.25(m,2h),7.18-7.16(m,2h),7.01(q,j=4.8hz,1h),4.10(q,j=10.4hz,1h),3.99(q,j=10.0hz,1h),3.32(m,2h),2.39-1.71(m,10h),1.47-1.44(m,5h)。4-((2r,6s)-2-(1h-苯并[d]咪唑-2-基)-6-(3-甲基吡啶-2-基)哌啶-1-基)丁-1-胺(i-1):向x4-011-5(70.0mg,0.14mmol)在乙醇(2ml)中的溶液加入水合肼(0.1ml)。将溶液在室温下搅拌过夜。在减压下去除溶剂并通过制备型hplc纯化以获得呈白色固体的产物i-1(25.0mg,48.5%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.02分钟;ms计算值:363.2;ms实测值:364.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:99.64%。保留时间=7.41分钟。1hnmr(cdcl3)δ8.40(d,j=4.0hz,1h),7.62(br,1h),7.42(d,j=7.2hz,2h),7.16-7.12(m,2h),7.02(q,j=4.8hz,1h),4.07(q,j=10.8hz,1h),3.99(q,j=10.4hz,1h),2.80(m,3h),2.35(s,3h),2.29-2.22(m,3h),2.17-2.09(m,2h),1.54-1.51(m,2h),1.51-1.47(m,1h),1.30-1.21(m,1h),1.15-0.95(m,1h),0.91-0.81(m,2h)。实例2:合成i-2i-2的合成方案x4-012-3:按照通用程序f,获得呈浅黄色固体的x4-012-3(5.5g,54.0%产率)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下保持1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa],并且在此条件下保持0.7分钟)。纯度:93.3%;保留时间=1.11分钟;ms计算值:186.1;ms实测值:187.2[m+h]+。x4-012-4:向x4-012-3(4.0g,21.5mmol)、l-脯氨酸(1.0mg,8.7mmol)和3-甲基皮考林醛(3.4g,28.0mmol)在meoh(200.0ml)中的溶液加入甲胺水溶液(6ml,40%)。将溶液在室温下搅拌过夜。在减压下去除溶剂并通过柱色谱法纯化以获得呈橙色固体的x4-012-4(4.1g,59.6%产率)。通过h-hnoesy确认结构。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]到10%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和90%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],然后在此条件下保持2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],并且在此条件下保持0.7分钟)。纯度:74.83%。保留时间=1.49分钟;ms计算值:320.1;ms实测值:321.2[m+h]+,ms实测值:353.3[m+meoh]+。x4-012-7:按照通用程序a,获得呈白色泡沫的x4-012-7(1.3g,34.0%产率)。使用1hnmr和h-hnoesy确认结构。lc-ms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下保持1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa],并且在此条件下保持0.7分钟)。纯度:97.56%,保留时间=1.17分钟;ms计算值:306.2;ms实测值:307.3[m+h]+。1hnmr(cdcl3)δ11.8(br,h),8.43(d,j=3.6hz,1h),7.70(br,h),7.46(q,j=7.6hz,1h),7.39(br,1h),7.27-7.16(m,2h),7.09(q,j=7.6hz,1h),3.73(dd,j=11.2hz,1h),3.63(dd,j=10.8hz,1h),2.40(s,3h),2.14-1.58(m,9h)。x4-012-8:按照通用程序g,获得呈白色泡沫的x4-012-8(130.0mg,42.5%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]到10%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和90%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],然后在此条件下保持2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],并且在此条件下保持0.7分钟)。纯度:94.67%;保留时间=2.06分钟;ms计算值:493.2;ms实测值:494.3[m+h]+。3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙烷-1-胺(i-2):向x4-012-8(130.0mg,0.25mmol)在乙醇(4.0ml)中的溶液加入水合肼(0.1ml)。将混合物在室温下搅拌过夜。将固体过滤,并将滤液通过制备型hplc纯化以获得呈白色固体的i-2(60.0mg,62.8%产率)。通过h-hnoesy确认结构。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下保持1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn],并且在此条件下保持0.7分钟)。纯度:100.00%,保留时间=1.86分钟;ms计算值:363.2;ms实测值:364.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3]和100%[ch3cn],然后在此条件下保持5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn],并且在此条件下保持5分钟)。纯度:100.00%。保留时间=6.67分钟。1hnmr(cdcl3)δ8.42(s,1h),7.66(t,j=4.0hz,1h),7.38(d,j=6.8hz,1h),7.31(t,j=4.0hz,1h),7.19-7.14(m,2h),7.03(q,j=7.6hz,1h),4.90(m,1h),4.52(br,1h),3.81(d,j=10.8hz,1h),3.53(d,j=11.2hz,1h),2.90(s,2h),2.35(s,3h),2.27-1.84(m,8h),1.77(s,3h),1.69-1.49(m,2h)。实例3:合成i-3、i-3a和i-3bi-3、i-3a和i-3b的合成方案x4-013-2:将rac-x4-013-1(5.00g,28.97mmol)、1-甲基哌嗪(5.8g,57.95mmol)和k2co3(10.01g,72.43mmol)在dmf(80ml)中的混合物在130℃下搅拌过夜,并且然后将混合物在真空中浓缩。将水加入残余物中,并且用dcm(150ml×3)萃取混合物,将组合的有机层用盐水(50ml×2)洗涤,经无水na2so4干燥,过滤并在真空中浓缩。将残余物通过柱色谱法(石油醚/etoac;5:1)纯化以获得呈棕色油的rac-x4-013-2(4.89g,产率:71%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:98%,保留时间=1.44分钟;ms计算值:236.1;ms实测值:237.3[m+h]+。rac-x4-013-3:将rac-x4-013-2(4.89g,20.70mmol)和pd/c(0.5g)在meoh(200ml)中的混合物在室温下在氢气气氛下搅拌过夜。并且然后将混合物过滤,并将滤液在真空中浓缩以获得呈灰色固体的rac-x4-013-3(4.10g,产率:96%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:93%,保留时间=1.26分钟;ms计算值:206.2;ms实测值:207.4[m+h]+。rac-x4-013-4:将rac-x4-013-3(4.10g,19.88mmol)和2-羟基乙酸(3.78g,49.69mmol)在4mhcl水溶液(200ml)中的混合物在90℃下搅拌过夜。将混合物用k2co3中和至ph=8到9,并将固体过滤并在真空中浓缩以获得呈棕色固体的rac-x4-013-4(3.20g,产率:65%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(10mmaconh4水溶液)h2o/mecn=9/1(v/v)]和10%[(10mmaconh4水溶液)h2o/mecn=1/9(v/v)]到10%[(10mmaconh4水溶液)h2o/mecn=9/1(v/v)]和90%[(10mmaconh4水溶液)h2o/mecn=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4水溶液)h2o/mecn=9/1(v/v)]和10%[(10mmaconh4水溶液)h2o/mecn=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:87%,保留时间=0.71分钟;ms计算值:246.1;ms实测值:247.2[m+h]+。rac-x4-013-5:将rac-x4-013-4(3.2g,12.99mmol)和mno2(11.29g,129.92mmol)在dmso(150ml)中的混合物在室温下搅拌过夜,并且然后将混合物过滤。将滤液倒入水中,将悬浮液过滤并在真空中浓缩以获得呈棕色固体的rac-x4-013-5(2.80g,产率:88%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:88%,保留时间=1.27分钟;ms计算值:244.1;ms实测值:245.3[m+h]+。1hnmr(400mhz,dmso-d6):δ13.43(brs,1h),9.91(s,1h),7.29-7.23(m,1h),7.06-7.02(m,1h),6.66-6.57(m,1h),3.58(brs,4h),2.54-2.50(m,3h),2.25(s,4h)。rac-x4-013-6:按照通用程序f,获得呈黄色固体的rac-x4-013-6(1.12g,产率:34%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:97%,保留时间=1.33分钟;ms计算值:284.2;ms实测值:285.2[m+h]+。rac-x4-013-7:向3-甲基皮考林醛(406mg,3.35mmol)、甲胺(0.26ml,3.35mmol)和l-脯氨酸(77mg,0.67mmol)在meoh(55ml)中的混合物加入rac-x4-013-6(794g,2.79mmol),并且使所述混合物在室温下搅拌24小时。然后将溶剂在减压下蒸发,并将混合物通过柱色谱法(dcm/meoh=50:1到20:1)纯化以获得呈黄色固体的rac-x4-013-7(454mg,产率:38%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:49%,保留时间=1.48分钟;ms计算值:418.2;ms实测值:419.4[m+h]+。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-7-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑(i-3):按照通用程序a,获得呈白色固体的i-3(119mg,产率:27%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:98%,保留时间=2.17分钟;ms计算值:404.3;ms实测值:405.4[m+h]+。hplc(安捷伦hplc1200;柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续5分钟)。纯度:96%,保留时间=4.39分钟;ms计算值:404.3;ms实测值:405.4[m+h]+。1hnmr(400mhz,dmso-d6):δ12.19(s,1h),8.38(s,1h),7.55(d,j=4.8hz,1h),7.18-7.15(m,1h),7.07-6.96(m,2h),6.45-6.43(m,1h),3.58(d,j=10.8hz,1h),3.51-3.45(m,5h),2.50(s,6h),2.24(s,3h),2.00-1.81(m,5h),1.65-1.59(m,5h)。通过手性hplc分离50mgi-3以得到i-3a(8.71mg,产率:17%)和i-3b(8.81mg,产率:17%)。上面示出的i-3a和i-3b对映体的结构是任意分配的。使用以下分离方法:柱=纤维素-sc(4.6mm*250mm*5μm),流动相=正己烷(0.1%dea):etoh(0.1%dea)=80:20,波长:214nm和254nm,流速:1.0ml/分钟,温度:40℃。手性hplc(i-3a):ee%:100%(214nm),hplc:保留时间=5.56分钟。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.62分钟;ms计算值:404.3;ms实测值:405.4[m+h]+。1hnmr(400mhz,dmso-d6),(i-3a):δ12.18(s,1h),8.38(s,1h),7.56-7.54(m,1h),7.18-7.15(m,1h),7.00-6.96(m,2h),6.45-6.43(m,1h),3.58(d,j=10.0hz,1h),3.51-3.45(m,5h),2.50(s,6h),2.24(s,3h),2.00-1.81(m,5h),1.65-1.59(m,5h)。手性hplc(i-3b):ee%:98%(214nm),保留时间=7.28分钟。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.62分钟;ms计算值:404.3;ms实测值:405.4[m+h]+。1hnmr(400mhz,dmso-d6),(i-3b):δ12.18(s,1h),8.38(s,1h),7.55(d,j=4.8hz,1h),7.18-7.15(m,1h),7.07-6.96(m,2h),6.45-6.43(m,1h),3.58(d,j=10.8hz,1h),3.51-3.45(m,5h),2.50(s,6h),2.24(s,3h),2.00-1.81(m,5h),1.65-1.59(m,5h)。实例4:合成i-4i-4的合成方案x4-111-1:按照通用程序g,获得呈白色泡沫的x4-111-1(210.0mg,63.4%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:100.00%;保留时间=1.49分钟;ms计算值:507.2;ms实测值:508.3[m+h]+。4-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丁-1-胺(i-4):向x4-111-1(200.0mg,0.39mmol)在乙醇(5.0ml)中的溶液加入水合肼(0.2ml)。将混合物在室温下搅拌过夜。将固体过滤,并将滤液通过制备型hplc纯化以获得呈白色固体的i-4(60.0mg,40.3%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=1.85分钟;ms计算值:377.2;ms实测值:378.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3]和5%[ch3cn],并且在此条件下持续5分钟)。纯度:100.00%。保留时间=6.59分钟。1hnmr(cdcl3)δ8.44(s,1h),7.72(t,j=5.2hz,1h),7.38(d,j=7.2hz,1h),7.35(t,j=5.2hz,1h),7.25-7.20(m,2h),7.07(t,j=6.0hz,1h),4.52(br,2h),3.81(d,j=13.2hz,1h),3.59(br,1h),2.81(t,j=6.4hz,2h),2.43(s,3h),2.15-1.63(m,15h)。实例5:合成i-5i-5的合成方案n,n-二甲基-3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙-1-胺(i-5):按照通用程序g,获得呈白色固体的i-5(40.0mg,26.1%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:99.47%,保留时间=2.26分钟;ms计算值:391.3;ms实测值:392.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:96.34%。保留时间=8.15分钟。1hnmr(cdcl3)δ8.49(s,1h),7.50(t,j=6.4hz,1h,),7.46-7.39(m,2h),7.27-7.23(m,2h),7.10(q,j=7.2hz,1h),4.56(br,1h),4.52(br,1h),3.89(t,j=11.2hz,1h),3.65(br,1h),2.48(s,3h),2.32(s,6h),2.19-1.64(m,13h)。实例6:合成i-6i-6的合成方案x4-113-1:向1,2-二氯乙烷(80ml)、四丁基溴化铵(tbab)(0.5g,1.47mmol)、koh(11.2g,176.27mmol)和k2co3(8.8g,61.69mmol)的搅拌混合物加入咪唑(2.0g,29.38mmol)。将得到的反应混合物在50℃下搅拌5小时。冷却至室温后,滤出不溶材料。将有机溶液用水(2×25ml)洗涤并经无水na2so4干燥。过滤后,将滤液浓缩,并通过柱色谱法纯化与获得呈无色油的x4-113-1(1.6g,41.7%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[总计10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:100.00%;保留时间=0.57分钟;ms计算值:130.0;ms实测值:131.2[m+h]+。1-(2-(1h-咪唑-1-基)乙基)-2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑(i-6):按照通用程序g,获得呈白色固体的i-6(33.0mg,25.2%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:99.47%,保留时间=2.04分钟;ms计算值:400.2;ms实测值:401.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=7.12分钟。1hnmr(cdcl3)δ8.49(d,j=2.8hz,1h),7.96(bs,1h),7.75(d,j=9.2hz,1h),7.51-7.42(m,2h),7.32-7.29(m,3h),7.16(s,1h),7.07(q,j=7.6hz,1h),5.37(br,1h),4.64(br,2h),4.30(br,1h),3.88(br,1h),3.58(br,1h),2.40(s,3h),2.02-1.58(m,9h)。实例7:合成i-7i-7的合成方案1-(2-(1h-吡唑-1-基)乙基)-2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑(i-7):按照通用程序g,获得呈白色固体的i-7(25.0mg,19.1%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%。保留时间=2.29分钟。ms计算值:400.2;ms实测值:401.3[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=8.12分钟。1hnmr(cdcl3)δ8.49(s,1h),8.00-7.73(m,2h),7.62(s,1h),7.47(d,j=7.6hz,1h),7.28-7.26(m,3h),7.07(q,j=7.2hz,1h),6.26(s,1h),5.26(br,2h),4.79-4.59(m,3h),3.80(br,1h),3.60(br,1h),2.47(s,3h),2.19-1.68(m,9h)。实例8:合成i-8i-8的合成方案x4-115-2:按照通用程序c,获得呈黄色油的x4-115-2(350mg,产率71.4%),其在不进行进一步纯化的情况下用于下一步骤。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1-((2-吡啶-2-基)乙基)-1h-苯并[d]咪唑(i-8):按照通用程序g,获得呈白色固体的i-8(18mg,产率:13%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:92%。保留时间=2.33分钟。ms计算值:411.2;ms实测值:412.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:98%。保留时间=8.48分钟。1hnmr(400mhz,cd3od)δ8.59(d,j=3.6hz,1h),8.36(d,j=3.6hz,1h),7.77(s,1h),7.64-7.55(m,3h),7.40-7.22(m,5h),5.04-4.98(m,3h),3.76(d,j=9.6hz,2h),2.53(s,3h),2.16-2.01(m,4h),1.78-1.66(m,6h)。实例9:合成i-9i-9的合成方案rac-x4-149-1:向3-氯皮考林醛(149mg,1.06mmol)、甲胺(0.08ml,1.06mmol)和l-脯氨酸(20mg,0.18mmol)在meoh(15ml)中的混合物加入rac-x4-013-6(250mg,0.88mmol),并且使所述混合物在室温下搅拌24小时。然后将溶剂在减压下蒸发,并浆混合物通过柱色谱法(dcm/meoh=50:1到20:1)纯化以获得呈黄色固体的rac-x4-149-1(224mg,产率:58%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:38%。保留时间=1.51分钟。ms计算值:438.2;ms实测值:439.2[m+h]+。2-((2r,6s)-6-(3-氯吡啶-2-基)-1-甲基哌啶-2-基)-7-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑(i-9):按照通用程序a,获得呈白色固体的i-9(13.21mg,产率:6%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:95%(214nm),保留时间=1.55分钟;ms计算值:424.2;ms实测值:425.2[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4)/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%(214nm)。保留时间=5.13分钟。ms计算值:424.2;ms实测值:425.2[m+h]+。1hnmr(400mhz,dmso-d6):δ12.24(s,1h),8.60-8.59(m,1h),7.93-7.90(m,1h),7.36-7.33(m,1h),7.00-6.95(m,2h),6.44-6.42(m,1h),3.91(d,j=10.0hz,1h),3.56-3.45(m,5h),2.50(s,2h),2.24(s,3h),2.01-1.83(m,5h),1.68-1.61(m,6h)。实例10:合成i-10i-10的合成方案2-((2s,6r)-1-甲基-6-(7-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑-2-基)哌啶-2-基)烟腈(i-10):将i-28(50mg,0.11mmol)、氰化锌(25mg,0.21mmol)和四(三苯基膦)钯(25mg,0.02mmol)在dmf(1ml)中的混合物在150℃下在微波辐射下搅拌30分钟。将悬浮液用二氯甲烷(10ml)和水(3ml)稀释,将水相用二氯甲烷(10ml×2)萃取并在真空中浓缩,将得到的残余物通过制备型hplc纯化以获得呈白色固体的i-10(17.34mg,产率:39%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=2.02分钟;ms计算值:415.2;ms实测值:416.3[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%。保留时间=4.93分钟。ms计算值:415.2;ms实测值:416.3[m+h]+。1hnmr(400mhz,dmso-d6):δ12.01(s,1h),8.88-8.87(m,1h),8.35-8.32(m,1h),7.56-7.53(m,1h),7.05-6.95(m,2h),6.45-6.44(m,1h),3.74-3.70(dd,j=11.2hz,2.8hz,1h),3.58-3.55(dd,j=10.8hz,3.6hz,1h),3.50(brs,4h),2.50(s,2h),2.24(s,3h),2.02-1.90(m,5h),1.79-1.63(m,6h)。实例11:合成i-11i-11的合成方案rac-x4-151-2:向rac-x4-151-1(15g,69.12mmol)在etoh(240ml)、thf(240ml)和h2o(120ml)中的溶液加入铁粉(30.88g,552.94mmol)和nh4cl(44.37g,829.42mmol)。将棕色悬浮液在60℃下搅拌2小时。冷却至室温后,向溶液加入etoac和硅藻土(celite),并搅拌1小时。将固体过滤,并将滤液在真空中浓缩。加入etoac和水,将水层用etoac(150ml×3)萃取,并将组合的有机层在真空中浓缩。通过硅胶柱纯化残余物以获得呈浅棕色固体的rac-x4-151-2(12g,93%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:68%(214nm)。保留时间=1.46分钟。ms计算值:186.0;ms实测值:187.0[m+h]+。rac-x4-151-3:将rac-x4-151-2(12g,64.16mmol)和2-羟基乙酸(12.20g,160.40mmol)在4mhcl水溶液(600ml)中的混合物在90℃下搅拌过夜。将混合物用k2co3中和至ph=8到9后,将固体过滤,并在真空中浓缩以获得呈棕色固体的rac-x4-151-3(13.6g,产率:93%)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[0.05%tfa水溶液]和5%[ch3cn+0.05%tfa]到0%[0.05%tfa水溶液]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[0.05%tfa水溶液]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.09分钟;ms计算值:226.0;ms实测值:227.1[m+h]+。rac-x4-151-4:按照通用程序i,获得呈棕色固体的rac-x4-151-4(7.18g,产率:53%)。1hnmr(400mhz,dmso-d6):δ13.02(brs,1h),9.99(s,1h),7.63-7.58(m,2h),7.37-7.30(m,1h)。rac-x4-151-5:按照通用程序f,获得呈棕色固体的rac-x4-151-5(6.8g,产率:80%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:97%,保留时间=1.51分钟;ms计算值:264.0;ms实测值:265.0[m+h]+。rac-x4-151-6:向3-甲基皮考林醛(2.74g,22.63mmol)、甲胺(1.76ml,22.63mmol)和l-脯氨酸(436mg,3.77mmol)在meoh(400ml)中的混合物加入rac-x4-151-5(5.0g,18.86mmol),并且使所述混合物在室温下搅拌24小时。然后将溶剂在减压下蒸发,并将混合物通过柱色谱法(dcm/meoh=200:1到50:1)纯化以获得呈黄色固体的rac-x4-151-6(4.10g,产率:54%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:67%,保留时间=1.67分钟;ms计算值:398.1;ms实测值:399.2[m+h]+。rac-x4-151-7:按照通用程序a,获得呈黄色固体的rac-x4-151-7(2.9g,产率:73%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.81分钟;ms计算值:384.1;ms实测值:385.1[m+h]+。1hnmr(400mhz,dmso-d6):δ12.67(s,1h),8.39(s,1h),7.56(d,j=7.6hz,1h),7.46(d,j=7.6hz,1h),7.34(d,j=7.6hz,1h),7.189-7.159(m,1h),7.11-7.07(m,1h),3.60-3.55(m,2h),2.50(s,3h),2.05-1.88(m,4h),1.66-1.59(m,5h)。rac-x4-151-8:将rac-x4-151-7(600mg,1.56mmol)、叔丁基4-(4,4,5,5-四甲基-1,3,2-二恶环戊硼烷-2-基)-5,6-二氢吡啶-1(2h)-羧酸盐(722mg,2.34mmol)、1,1'-二(二苯基膦基)二茂铁-二氯化钯(ii)二氯甲烷络合物(255mg,0.312mmol)和k2co3(430mg,3.12mmol)在1,4-二恶烷(10ml)和水(2.5ml)中的混合物在80℃下在微波辐射下搅拌30分钟。反应完成后,将混合物用二氯甲烷(30ml)和水(10ml)稀释并用二氯甲烷(30ml×3)萃取。将组合的有机层收集并在真空中浓缩,并将得到的残余物用硅胶柱纯化,用二氯甲烷/甲醇100:1洗脱以获得呈黄色固体的rac-x4-151-8(348mg,45%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:93%,保留时间=2.06分钟;ms计算值:487.3;ms实测值:488.4[m+h]+。rac-x4-151-9:将rac-x4-151-8(348mg,0.71mmol)和pd(oh)2/c(100mg)在meoh(6ml)中的混合物在室温下在氢气气氛下搅拌20小时。反应完成后,将混合物过滤,并将滤液在真空中浓缩以获得呈黄色固体的rac-x4-151-9(236mg,产率:67%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到10%[10mmaconh4/mecn水溶液=9/1(v/v)]和90%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:89%,保留时间=2.53分钟;ms计算值:489.3;ms实测值:490.3[m+h]+。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-7-(哌啶-4-基)-1h-苯并[d]咪唑(i-11):按照通用程序h,获得呈白色固体的i-11(121mg,产率:64%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:98%,保留时间=1.72分钟;ms计算值:389.3;ms实测值:390.3[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%,保留时间=4.93分钟;ms计算值:389.3;ms实测值:390.3[m+h]+。1hnmr(400mhz,meod):δ8.53(d,j=3.6hz,1h),8.66(d,j=6.8hz,1h),7.40-7.39(m,1h),7.27-7.19(m,2h),7.13-7.11(m,1h),3.75(d,j=10.8hz,1h),3.71-3.68(dd,j=11.2hz,j=2.4hz,1h),3.26-3.24(m,2h),2.97-2.90(m,2h),2.45(s,3h),2.08-1.97(m,4h),1.91-1.67(m,10h)。实例12:合成i-12和i-13i-12和i-13的合成方案x4-153-2:按照通用程序g,获得呈白色泡沫的x4-153-2(300mg,91.3%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:73%;保留时间=2.01分钟;ms计算值:503.3;ms实测值:504.4[m+h]+。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1(哌啶-3-基甲基)-1h-苯并[d]咪唑(i-12):将x4-153-2(300.0mg,0.60mmol)在hcl/etoac(5ml,3.0m)中的溶液在室温下搅拌2小时。将固体过滤,并且将滤饼用etoac(5ml)洗涤。将固体加入ch2cl2(50ml)并且用饱和nahco3水溶液萃取。将有机层用盐水洗涤,经na2so4干燥,并在真空中浓缩以获得呈白色固体的i-12(153.0mg,63.7%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.07分钟;ms计算值:403.3;ms实测值:404.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:99%。保留时间=7.23分钟。1hnmr(cdcl3)δ8.39(s,1h),7.64-7.56(m,3h),7.30-7.24(m,3h),4.44(br,2h),3.84-3.72(m,2h),3.09-2.90(m,2h),2.72-2.30(m,6h),2.08-1.43(m,13h)。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1-((1-甲基哌啶-3-基)甲基)-1h-苯并[d]咪唑(i-13):按照通用程序m,获得呈白色固体的i-13(37.0mg,36%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:91%,保留时间=2.36分钟;ms计算值:417.3;ms实测值:418.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:95%。保留时间=8.63分钟。1hnmr(cdcl3)δ8.39(s,1h),7.68(s,1h),7.36(d,j=6.4hz,1h),7.32(s,1h),7.20-7.00(m,2h),7.01(t,j=3.2hz,1h),4.25(br,1h),4.16(br,1h),3.81-3.63(m,2h),2.70-2.35(m,7h),2.29-1.56(m,16h),1.19-1.06(m,1h)。实例13:合成i-14和i-15i-14和i-15的合成方案x4-155-1:按照通用程序g,获得呈白色泡沫的x4-155-1(240.0mg,73.0%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:91.03%;保留时间=2.32分钟;ms计算值:503.3;ms实测值:504.4[m+h]+。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1(哌啶-4-基甲基)-1h-苯并[d]咪唑(i-14):将x4-155-1(240.0mg,0.48mmol)在hcl/etoac(5ml,3m)中的溶液在室温下搅拌2小时。将固体过滤,并且将滤饼用etoac(5ml)洗涤。将固体加入ch2cl2(50ml)并且用nahco3萃取。将有机层用盐水洗涤,经na2so4干燥,并在真空中浓缩以获得呈白色固体的i-14(120.0mg,62.4%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=1.87分钟;ms计算值:403.3;ms实测值:404.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=6.59分钟。1hnmr(cdcl3)δ8.44(s,1h),7.74(s,1h),7.41(d,j=7.2hz,1h),7.34(s,1h),7.08-7.25(m,2h),7.07(t,j=5.6hz,1h),4.38(br,1h),4.17(br,1h),3.83(d,j=10.4hz,1h),3.71(br,1h),3.11(t,j=4.0hz,2h),2.57-2.40(m,5h),2.34-1.30(m,14h)。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1-((1-甲基哌啶-4-基)甲基)-1h-苯并[d]咪唑(i-15):按照通用程序m,获得呈白色固体的i-15(31.0mg,50.0%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.12分钟;ms计算值:417.3;ms实测值:418.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=7.63分钟。1hnmr(cdcl3)δ8.43(s,1h),7.74(s,1h),7.41(d,j=7.6hz,1h),7.33(s,1h),7.25-7.21(m,2h),7.07(t,j=5.2hz,1h),4.38(br,1h),4.20(br,1h),3.85(d,j=10.4hz,1h),3.71(br,1h),2.92(br,2h),2.40(s,3h),2.29(s,3h),2.19-1.56(m,16h)。实例14:合成i-16、i-17、i-18和i-19i-16、i-17、i-18和i-19的合成方案x4-157-3:按照通用程序i,获得呈灰色固体的x4-157-3(190.0mg,95.5%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=1.61分钟;ms计算值:362.2;ms实测值:381.2[m+18]+。n-甲基-3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙烷-1-胺(i-16):按照通用程序m,获得呈白色固体的i-16(30.0mg,41.1%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=1.91分钟;ms计算值:377.3;ms实测值:378.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=6.83分钟。1hnmr(cdcl3)δ8.38(s,1h),7.66(t,j=4hz,1h),7.38-7.31(m,2h),7.15-7.19(m,2h),7.01(q,j=8.8hz,1h),4.84(br,1h),4.55(br,1h),3.80(d,j=12.4hz,1h),3.50(d,j=9.6hz,1h),2.74(s,2h),2.47(s,3h),2.35(s,3h),1.75-2.22(m,7h),1.71(s,3h),1.68-1.52(m,2h)。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1(3-(4-甲基哌嗪-1-基)丙基l)-1h-苯并[d]咪唑(i-17):按照通用程序m,获得呈白色固体的i-17(20.0mg,27.0%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:99.5%,保留时间=2.12分钟;ms计算值:446.3;ms实测值:447.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:99.55%。保留时间=7.55分钟。1hnmr(cdcl3)δ8.40(s,1h),7.66(t,j=5.2hz,1h),7.37-7.32(m,2h),7.19-7.15(m,2h),7.01(t,j=4.8hz,1h),4.60(br,1h),4.45(br,1h),3.80(d,j=8hz,1h),3.56(d,j=4.4hz,1h),2.80-1.38(br,12h),2.27(s,4h),2.10-1.82(m,6h),1.75(s,3h),1.66-1.57(m,2h)。4-(3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙基)吗啉(i-18):按照通用程序m,获得呈白色固体的i-18(23.0mg,38.4%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:97.70%,保留时间=2.30分钟;ms计算值:433.3;ms实测值:434.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=8.19分钟。1hnmr(cdcl3)δ8.40(s,1h),7.66(t,j=4.8hz,1h),7.32-7.38(m,2h),7.19-7.16(m,2h),7.02(t,j=5.6hz,1h),4.60(br,1h),4.45(br,1h),4.00-3.66(m,6h),2.44(br,9h),2.10-1.92(m,5h),1.71-1.54(m,6h)。n-(3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙基)四氢-2h-吡喃-4-胺(i-19):按照通用程序m,获得呈白色固体的i-19(15.0mg,24.3%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.11分钟;ms计算值:447.3;ms实测值:448.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=7.49分钟。1hnmr(cdcl3)δ8.37(s,1h),7.66(t,j=4.8hz,1h),7.38-7.31(m,2h),7.19-7.15(m,2h),7.02(q,j=5.2hz,1h),4.70(br,1h),4.55(br,1h),3.95(d,j=11.2hz,1h),3.79(d,j=9.2hz,1h),3.55(s,1h),3.35(t,j=11.6hz,1h),2.71-2.80(m,3h),2.37(s,3h),2.09-1.92(m,4h),1.87-1.42(m,12h)。实例15:合成i-20i-20的合成方案x4-157-1:按照通用程序g,获得呈黄色油的x4-157-1(1.0g,产率91.4%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:84%,保留时间=2.44分钟;ms计算值:478.3;ms实测值:479.4[m+h]+。3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑-1-基)丙烷-1-醇(i-20):将x4-157-1(1g,2.09mmol)在6mhcl(2ml)中的溶液搅拌1小时,并且然后用nahco3将混合物淬灭到ph=8到9。将混合物用dcm(50ml×3)萃取,经无水na2so4干燥,过滤并浓缩以得到残余物(100mg),通过制备型hplc纯化所述残余物以得到呈白色固体的i-20(33mg,产率:30.2%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.14分钟;ms计算值:364.2;ms实测值:365.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:97.97%。保留时间=7.60分钟。1hnmr(400mhz,cdcl3)δ8.48(d,j=3.6hz,1h),7.75(d,j=6.8hz,1h),7.52(d,j=7.2hz,1h),7.42(d,j=7.2hz,1h),7.31(s,2h),7.15(t,j=5.2hz,1h),5.54(s,1h),4.22(s,1h),4.03(d,j=10.4hz,1h),3.90(d,j=10.8hz,1h),3.74(t,j=10.8hz,1h),3.55(d,j=10.4hz,1h),2.43(s,3h),2.26-2.19(m,2h),2.09-1.90(m,4h),1.84(s,3h),1.75-1.61(m,2h)。实例16:合成i-21i-21的合成方案x4-011-2:在0℃下向x4-011-1(2g,12.4mmol)和1h-苯并[d]咪唑-2-甲醛(2.72mg,18.6mmol)在meoh(60ml)中的混合物加入naoh(992mg,24.8mmol)在h2o(4ml)中的溶液并且将混合物在室温下搅拌3小时。将溶液用35%hcl水溶液调节为ph8,经无水na2so4干燥,过滤,并且在真空中浓缩。将残余物通过柱色谱法纯化以获得呈黄色固体的x4-011-2(2.7g,75.2%产率)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[0.05%tfa水溶液]和5%[ch3cn+0.05%tfa]到0%[0.05%tfa水溶液]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[0.05%tfa水溶液]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:99%;保留时间=1.32分钟;ms计算值:289.1;ms实测值:290.1[m+h]+。x4-011-3:在室温下将x4-011-2(2.7g,9.3mmol)和nh3.h2o(1.31g,37.3mmol,30%)在meoh(100ml)中的溶液搅拌过夜。在减压下去除溶剂并通过柱色谱法纯化以得到呈黄色固体的x4-011-3(600mg,30%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:55.5%。保留时间=1.40分钟;ms计算值:306.1;ms实测值:307.2[m+h]+。x4-011-4:按照通用程序a,获得呈黄色泡沫的x4-011-4(150mg,26.2%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:80.3%。保留时间=1.52分钟;ms计算值:292.2;ms实测值:293.2[m+h]+。2-((2r,6s)-1-(2-(1h-吡唑-1-基)苄基)-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-苯并[d]咪唑(i-21):按照通用程序d,获得呈白色固体的i-21(30mg,27.9%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=2.43分钟;ms计算值:448.2;ms实测值:449.3[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100%。保留时间=8.67分钟。1hnmr(400mhz,cdcl3)δ12.28(s,1h),8.56(d,j=4.0hz,1h),7.64(d,j=7.2hz,3h),7.48-7.42(m,3h),7.17-7.10(m,4h),6.95-6.82(m,2h),6.40(t,j=2hz,1h),4.04-4.00(m,2h),3.62(s,2h),2.32(s,3h),2.24-2.03(m,2h),1.83-1.59(m,4h)。实例17:合成i-22、i-23和i-24i-22、i-23和i-24的合成方案1-((1-乙基哌啶-4-基)甲基)-2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-yl)哌啶-2-基)-1h-苯并[d]咪唑(i-22):按照通用程序m,获得呈白色固体的i-22(17mg,15.9%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=2.19分钟;ms计算值:431.3;ms实测值:432.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100%。保留时间=7.93分钟。1hnmr(400mhz,cd3od)δ8.36(s,1h),7.65-7.56(m,3h),7.32-7.23(m,3h),4.45(s,2h),3.87-3.77(m,2h),3.06(t,j=10hz,2h),2.62(s,3h),2.51-2.46(m,2h),2.18-1.95(m,7h),1.78-1.53(m,9h),1.13(t,j=7.4hz,3h)。1-((1-异丙基哌啶-4-基)甲基)-2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-yl)哌啶-2-基)-1h-苯并[d]咪唑(i-23):按照通用程序m,获得呈白色固体的i-23(15.7mg,28.4%)。lc-ms(安捷伦lcms1200-6120,流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=2.22分钟;ms计算值:445.3;ms实测值:446.4[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%。保留时间=4.84分钟。1hnmr(400mhz,cd3od)δ8.35(s,1h),7.65-7.56(m,3h),7.32-7.23(m,3h),4.30(s,2h),3.78-3.88(m,2h),2.96(t,j=9.2hz,2h),2.77-2.54(m,4h),2.33-2.05(m,6h),1.93(d,j=12hz,1h),1.78-1.46(m,9h),1.08(d,j=6.4hz,6h)。2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1-((1-(2,2,2-三氟乙烯)哌啶-4-基)甲基)-1h-苯并[d]咪唑(i-24):向i-14(50.0mg,0.12mmol)在thf(10ml)中的溶液加入2,2,2-三氟乙烯三氟甲磺酸盐(34.5mg,0.15mmol)和dipea(31mg,0.24mmol),将混合物在60℃下搅拌4小时。将混合物用dcm稀释并用水洗涤。将有机相经na2so4干燥,过滤并浓缩。将粗材料通过制备型hplc纯化以获得呈白色固体的i-24(10.1mg,16.6%产率)。lc-ms(安捷伦lcms1200-6120,流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=2.83分钟;ms计算值:485.3;ms实测值:486.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:100%。保留时间=10.09分钟。1hnmr(400mhz,cd3od)δ8.37(s,1h),7.65-7.56(m,3h),7.32-7.22(m,3h),4.46(brs,2h),3.82(brs,2h),3.08-3.00(m,4h),2.62(s,1h),2.30-2.05(m,6h),1.93-1.89(m,1h),1.78-1.73(m,5h),1.25(s,4h)。实例18:合成i-25i-25的合成方案x4-183-2:按照通用程序d,获得呈白色泡沫的x4-183-2(80.0mg,73.0%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:73.33%。保留时间=1.84分钟;ms计算值:320.2;ms实测值:321.3[m+h]+。x4-183-3:按照通用程序g,获得呈白色泡沫的x4-183-3(120.0mg,61.9%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:85.76%;保留时间=2.37分钟;ms计算值:517.3;ms实测值:518.3[m+h]+。x4-183-4:将x4-183-3(120.0mg,0.23mmol)在hcl/meoh(5ml,3m)中的溶液在室温下搅拌2小时。将溶剂在减压下去除。将残余物用饱和nahco3稀释并用ch2cl2(30ml)萃取。将组合的有机层用盐水洗涤,经na2so4干燥,并在真空中浓缩以获得呈白色泡沫的x4-183-4(91.0mg,94.0%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=900/100(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:84.10%;保留时间=1.61分钟;ms计算值:417.3;ms实测值:418.3[m+h]+。2-((2r,6s)-1-乙基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1-((1-甲基哌啶-4-基)甲基)-1h-苯并[d]咪唑(i-25):按照通用程序m,获得呈白色固体的i-25(40.0mg,43.0%产率)。lc-ms((安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100.00%,保留时间=2.22分钟;ms计算值:431.3;ms实测值:432.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:95.68%。保留时间=8.12分钟。1hnmr(cdcl3)δ8.34(s,1h),7.70(d,j=4.4hz,1h),7.37(d,j=6.8hz,1h),7.27(s,1h),7.19-7.14(m,2h),7.02(q,j=4.4hz,1h),4.58(br,1h),4.24-4.08(m,3h),2.87(d,j=9.6hz,2h),2.50(s,3h),2.36-1.48(m,21h)。实例19:合成i-26i-26的合成方案x4-184-2:按照通用程序d,获得呈白色泡沫的x4-184-2(80.0mg,31.2%)。1hnmr(cdcl3)δ12.9(s,1h),8.50(d,j=4.4hz,1h),7.73(d,j=6.8hz,1h),7.55-7.43(m,2h),7.30-7.04(m,3h),4.65-4.64(m,2h),3.09-2.93(m,2h),2.40(s,3h),2.20-1.96(m,2h),1.91-1.80(m,2h),1.74-1.72(m,2h)。x4-184-3:按照通用程序g,获得呈白色泡沫的x4-184-3(90.0mg,58.9%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]到10%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和90%[10mmaconh4/ch3cn水溶液=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[10mmaconh4/ch3cn水溶液=9/1(v/v)]和10%[10mmaconh4/ch3cn水溶液=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:92.28%;保留时间=2.66分钟;ms计算值:517.3;ms实测值:518.3[m+h]+。x4-184-4:将x4-184-3(120.0mg,0.23mmol)在hcl/meoh(5ml,3m)中的溶液在室温下搅拌2小时。完成后,将溶剂在减压下去除。将残余物用ch2cl2(30ml)稀释并用nahco3和饱和盐水洗涤,经na2so4干燥,并在真空中浓缩以获得呈白色泡沫的x4-184-4(65.0mg,87.6%产率)。按照通用程序m,获得呈白色固体的i-26(30.0mg,44.8%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn],并且在此条件下保持0.7分钟)。纯度:95.9%,保留时间=2.42分钟;ms计算值:485.3;ms实测值:486.4[m+h]+。hplc(安捷伦hplc1200;柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[0.1%tfa水溶液]和5%[ch3cn+0.1%tfa]到0%[0.1%tfa水溶液]和100%[ch3cn+0.1%tfa],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[0.1%tfa水溶液]和5%[ch3cn+0.1%tfa]并且在此条件下持续5分钟)。纯度:95.51%。保留时间=5.16分钟。1hnmr(cdcl3)δ7.70(dd,j=4.8hz,1h),7.70(dd,j=6.0hz,1h),7.39(dd,j=7.6hz,1h),7.26-7.14(m,2h),7.04(t,j=4.8hz,1h),4.31(d,j=10.4hz,1h),4.01(dd,j=14.8hz,1h),3.33-3.15(m,2h),2.92-2.83(m,2h),2.46(s,3h),2.32-2.10(m,6h),2.01-1.56(m,10h)。实例20:合成i-27i-27的合成方案x4-115-2:按照通用程序c,获得呈黄色油的x4-115-2(700mg,产率85.7%),其在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:74%,保留时间=1.30分钟;ms计算值:201.1;ms实测值:202.2[m+h]+。2-((2r,6s)-6-(3-甲基吡啶-2-基)-1-(2-吡啶-2-基)乙基)哌啶-2-基)-1h-苯并[d]咪唑(i-27):按照通用程序d,获得呈白色固体的i-27(13mg,13.2%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:95.6%,保留时间=2.30分钟;ms计算值:397.5;ms实测值:398.3[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:94.7%。保留时间=8.18分钟。1hnmr(400mhz,cdcl3)δ12.28(s,1h),8.34(d,j=3.6hz,1h),8.19(d,j=4.0hz,1h),7.57(s,1h),7.39(d,j=7.2hz,2h),7.28(t,j=2hz,1h),7.24-7.11(m,2h),7.04(dd,j=4.8,7.6hz,1h),6.87-6.63(m,1h),6.62(d,j=8hz,1h),4.25-4.22(m,1h),4.11(t,j=7.2hz,1h),2.79-2.74(m,2h),2.57-2.53(m,2h),2.36(s,3h),2.14-2.10(m,1h),1.97-1.95(m,1h),1.85-1.81(m,1h),1.70-1.67(m,2h),1.54(s,1h)。实例21:合成i-28i-28的合成方案rac-x4-197-1:向3-溴皮考林醛(683mg,3.67mmol)、甲胺(0.28ml,3.67mmol)和l-脯氨酸(71mg,0.61mmol)在meoh(60ml)中的混合物加入rac-x4-013-6(870mg,3.06mmol),并且使所述混合物在室温下搅拌24小时。然后将溶剂在减压下蒸发,并浆混合物通过柱色谱法(dcm/meoh=50:1到20:1)纯化以获得呈黄色固体的rac-x4-197-1(654mg,产率:44%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:50%,保留时间=1.53分钟;ms计算值:482.1;ms实测值:483.2[m+h]+。2-((2r,6s)-6-(3-溴吡啶-2-基)-1-甲基哌啶-2-基)-7-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑(i-28):按照通用程序a,获得呈白色固体的i-28(204mg,产率:33%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:95%,保留时间=1.74分钟;ms计算值:468.2;ms实测值:469.2[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%,保留时间=5.41分钟;ms计算值:468.2;ms实测值:469.2[m+h]+。1hnmr(400mhz,dmso-d6):δ12.26(s,1h),8.63(s,1h),8.08-8.06(m,1h),7.28-7.25(m,1h),7.00-6.95(m,2h),6.45-6.43(m,1h),3.92(d,j=10.0hz,1h),3.55-3.45(m,5h),2.50(s,2h),2.24(s,3h),1.95-1.83(m,5h),1.68-1.60(m,6h)。实例22:合成i-29i-29的合成方案2-((2r,6s)-1-甲基-6-(吡啶-2-基)哌啶-2-基)-7-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑(i-29):将i-28(70mg,0.15mmol)和pd/c(10mg)在meoh(3ml)中的混合物在室温下在氢气气氛下搅拌2小时。反应完成后,将混合物过滤,并将滤液在真空中浓缩,其通过制备型hplc纯化以获得呈白色固体的i-29(32mg,产率:55%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:99%,保留时间=1.62分钟;ms计算值:390.3;ms实测值:391.2[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]到15%[10mmaconh4/mecn水溶液=9/1(v/v)]和85%[10mmaconh4/mecn水溶液=1/9(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[10mmaconh4/mecn水溶液=9/1(v/v)]和10%[10mmaconh4/mecn水溶液=1/9(v/v)]并且在此条件下持续5分钟)。纯度:100%,保留时间=4.73分钟;ms计算值:390.3;ms实测值:391.2[m+h]+。1hnmr(400mhz,dmso-d6):δ12.15(s,1h),8.48-8.47(m,1h),7.84-7.80(m,1h),7.73-7.71(m,1h),7.28-7.28(m,1h),7.00-6.98(m,2h),6.46-6.44(m,1h),3.55-3.46(m,5h),3.34-3.29(m,2h),2.50(s,2h),2.24(s,3h),1.90-1.70(m,4h),1.61-1.56(m,6h)。实例23:合成i-30i-30的合成方案x4-157-1:按照通用程序g,获得呈黄色油的x4-157-1(280mg,产率:100%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:90%,保留时间=2.46分钟;ms计算值:478.3;ms实测值:479.4[m+h]+。i-20:将x4-157-1(280mg,0.58mmol)在6mhcl(2ml)中的溶液搅拌1小时,并且然后用nahco3将混合物淬灭到ph=8到9。将混合物用dcm(50ml×3)萃取,将组合的有机层经无水na2so4干燥,然后过滤并浓缩。将残余物通过柱色谱法纯化以获得呈黄色油的i-20(170mg,80%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:98%,保留时间=1.64分钟;ms计算值:364.2;ms实测值:365.0[m+h]+。x4-157-3:按照通用程序i,获得呈灰色固体的x4-157-3(100mg,59%)。将化合物在不进行进一步纯化的情况下用于随后的反应步骤。1-(3-(4,4-二氟哌啶-1-基)丙基)-2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-yl)哌啶-2-基)-1h-苯并[d]咪唑(i-30):按照通用程序m,获得呈白色固体的i-30(15mg,12%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:99%,保留时间=2.72分钟;ms计算值:467.6;ms实测值:468.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[10mmnh4hco3水溶液]和5%[ch3cn]到0%[10mmnh4hco3水溶液]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[10mmnh4hco3水溶液]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:99%。保留时间=9.67分钟。1hnmr(400mhz,cdcl3)δ8.41(s,1h),7.64-7.57(m,3h),7.33-7.25(m,3h),4.88(s,1h),4.67(d,j=2.0hz,1h),3.85-3.71(m,2h),2.64-2.50(m,9h),2.23-1.95(m,10h),1.80-1.72(m,5h)。实例24:合成i-61i-61的合成方案i-61的合成方案(续)合成x4-308-a-2向x4-308-a-3(4.00g,18.52mmol)和s1(4.10g,27.71mmol)在甲苯(36ml)和水(4ml)的溶剂中的溶液加入k3po4(11.80g,55.59mmol)、pd(dppf)cl2·dcm(1.51g,1.85mmol)和pcy3(0.52g,1.85mmol)。将混合物在室温下搅拌28小时并过滤;将滤液用水稀释,用etoac萃取并浓缩以得到粗产物,将所述粗产物通过cc纯化以获得呈黄色油的x4-308-a-2(703mg,21.43%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:82.76%。保留时间=1.51分钟;ms计算值:177.1;ms实测值:178.3[m+h]+。合成x4-308-a-1向x4-308-a-2(175mg,0.99mmol)在thf(3.5ml)中的溶液加入nabh4(150mg,3.96mmol)。将混合物在70℃下搅拌过夜,冷却至室温,用冷却水淬灭,用ea萃取并浓缩以得到呈黄色油的x4-308-a-1(120mg,81.45%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:89.49%。保留时间=1.38分钟;ms计算值:149.1;ms实测值:150.3[m+h]+。合成x4-308-a向x4-308-a-1(550mg,3.69mmol)在dcm(3ml)中的溶液加入dmp(1.73g,4.08mmol)。然后将反应混合物在室温下搅拌4小时。tlc表明反应完成后,将反应混合物用nahco3水溶液淬灭并用dcm萃取。将有机层用盐水洗涤,经na2so4干燥并浓缩以得到粗产物,将所述粗产物用柱色谱法纯化以得到呈黄色油的x4-308-a(210mg,38.70%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:98.67%。保留时间=1.51分钟;ms计算值:147.1;ms实测值:148.3[m+h]+。合成rac-x4-013-2将rac-x4-013-1(5.00g,28.97mmol)、1-甲基哌嗪(5.8g,57.95mmol)和k2co3(10.01g,72.43mmol)在dmf(80ml)中的混合物在130℃下搅拌过夜,并且然后将混合物在真空中浓缩。将水加入残余物中,并且用dcm(150ml×3)萃取混合物,将组合的有机层用盐水(50ml×2)洗涤,经无水na2so4干燥,过滤并在真空中浓缩。将残余物通过柱色谱法(pe/ea;5:1)纯化以获得呈棕色油的rac-x4-013-2(4.89g,产率:71%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:98%,保留时间=1.44分钟;ms计算值:236.1;ms实测值:237.3[m+h]+。合成rac-x4-013-3将rac-x4-013-2(4.89g,20.70mmol)和pd/c(0.5g)在meoh(200ml)中的混合物在室温下在氢气气氛下搅拌过夜。将混合物过滤,并将滤液在真空中浓缩以获得呈灰色固体的rac-x4-013-3(4.10g,产率:96%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:93%,保留时间=1.26分钟;ms计算值:206.2;ms实测值:207.4[m+h]+。合成rac-x4-013-4将rac-x4-013-3(4.10g,19.88mmol)和2-羟基乙酸(3.78g,49.69mmol)在4mhcl水溶液(200ml)中的混合物在90℃下搅拌过夜。将混合物用k2co3中和至ph=8到9,将固体过滤并在真空中浓缩以获得呈棕色固体的rac-x4-013-4(3.20g,产率:65%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=9/1(v/v)]和10%[(总计10mmaconh4)h2o/mecn=1/9(v/v)]到10%[(总计10mmaconh4)h2o/mecn=9/1(v/v)]和90%[(总计10mmaconh4)h2o/mecn=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=9/1(v/v)]和10%[(总计10mmaconh4)h2o/mecn=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:87%,保留时间=0.71分钟;ms计算值:246.1;ms实测值:247.2[m+h]+。合成x4-013-5在0℃下向x4-013-4(155g,0.63mol)在无水dmso(3.15l)中的溶液加入ibx(353g,1.26mol,2当量),并且将混合物在室温下搅拌过夜。tlc(dcm/meoh/nh3.h2o=100:10:3)显示反应完成。将混合物通过硅藻土过滤并用甲醇洗涤,将滤液在真空中浓缩以去除甲醇,并且将残余物直接用于下一步骤。合成x4-013-6将x4-013-5在dmso(1.575l)和丙酮(1.575l)中的混合物冷却至0℃,并且向其加入10%naoh(189ml,0.473mol,1.5当量)。将混合物在0℃下搅拌1个小时并通过tlc(dcm/meoh/nh3.h2o=100:10:3)监测。大多数起始材料仍然存在,因此向其加入10%naoh(0.5当量)并在0℃下搅拌30分钟,然后通过tlc(dcm/meoh/nh3.h2o=100:10:3)监测反应,并向其加入10%naoh(0.2当量),再搅拌30分钟,直到所有x4-013-5转化为中间产物1和x4-013-6的混合物。将反应加温至室温并搅拌1小时。通过1mhcl将ph调节为7之后将反应在真空中浓缩以去除丙酮,然后加入k2co3以将ph调节为8到9。将混合物用dcm和甲醇(10:1)萃取,用盐水洗涤,并经na2so4干燥,过滤并在真空中浓缩。将残余物在高真空中浓缩以去除副产物。向其加入dcm,并且将悬浮液过滤并用ea洗涤并在真空中干燥以获得呈黄色固体的x4-013-6(45.5g,50%,2个步骤)。合成x4-299-1向x4-013-6(240mg,0.84mmol)在meoh(2ml)中的溶液加入x4-308-a(149mg,1.01mmol)、l-脯氨酸(39mg,0.34mmol)和menh2水溶液(263mg,40%,3.39mmol)。然后将反应混合物在室温下搅拌过夜。将反应浓缩以得到粗产物,将所述粗产物用cc纯化以得到呈黄色固体的x4-299-1(169mg,45.04%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:52.19%。保留时间=1.49分钟;ms计算值:444.3;ms实测值:445.3[m+h]+。合成i-61按照通用程序a,获得呈白色固体的i-61(8mg,4.89%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:95.00%。保留时间=1.71分钟;ms计算值:430.3;ms实测值:431.4[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[总计10mmaconh4)水/ch3cn=100/900(v/v)]到15%[总计10mmaconh4)水/ch3cn=900/100(v/v)]和85%[总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续5分钟)。纯度:100.00%。保留时间=5.89分钟。1hnmr(400mhz,dmso-d6)δ12.2(s,1h),8.35(s,1h),7.32(d,j=6.0hz,1h),7.16(dd,j=4.8,8.0hz,1h),7.01-6.95(m,2h),6.44(dd,j=0.8,6.4hz,1h),3.90(brs,1h),3.48-3.32(m,5h),3.31-3.00(m,2h),2.51-2.49(m,1h),2.49-2.27(m,1h),2.24(s,3h),2.24-2.00(m1h),2.00-1.69(m4h),1.68(s,3h),1.64-1.60(m,2h),1.04-0.99(m,2h),0.75(s,1h),0.62-0.58(m,1h)。实例25:合成i-76i-76的合成方案合成x4-151-2向x4-151-1(15g,69.12mmol)在etoh(240ml)、thf(240ml)和h2o(120ml)中的溶液加入铁粉(30.88g,552.94mmol)和nh4cl(44.37g,829.42mmol)。将棕色悬浮液在60℃下搅拌2小时。冷却至室温后,向溶液加入etoac和硅藻土,并搅拌1小时。将固体过滤,并将滤液在真空中浓缩。加入etoac和水,将水层用etoac(150ml×3)萃取,并将组合的有机层在真空中浓缩。通过硅胶柱纯化残余物以获得呈浅棕色固体的x4-151-2(12g,93%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:68%(214nm),保留时间=1.46分钟;ms计算值:186.0;ms实测值:187.0[m+h]+。合成rac-x4-151-3将x4-151-2(12g,64.16mmol)和2-羟基乙酸(12.20g,160.40mmol)在4mhcl水溶液(600ml)中的混合物在90℃下搅拌过夜。并且然后将混合物用k2co3中和至ph=8到9,将固体过滤并在真空中浓缩以获得呈棕色固体的x4-151-3(13.6g,产率:93%)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.09分钟;ms计算值:226.0;ms实测值:227.1[m+h]+。合成x4-151-4按照通用程序i,获得呈棕色固体的x4-151-4(7.18g,产率:53%)。1hnmr(400mhz,dmso-d6):δ13.02(brs,1h),9.99(s,1h),7.58-7.63(m,2h),7.37-7.30(m,1h)。合成x4-151-5按照通用程序f,获得呈棕色固体的x4-151-5(6.8g,产率:80%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:97%,保留时间=1.51分钟;ms计算值:264.0;ms实测值:265.0[m+h]+。合成x4-151-6向3-甲基皮考林醛(2.74g,22.63mmol)、甲胺(1.76ml,22.63mmol)和l-脯氨酸(436mg,3.77mmol)在meoh(400ml)中的混合物加入rac-x4-151-5(5.0g,18.86mmol),并且使所述混合物在室温下搅拌24小时。然后将溶剂在减压下蒸发,并将混合物通过柱色谱法(dcm/meoh=200:1到50:1)纯化以获得呈黄色固体的x4-151-6(4.10g,产率:54%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:67%,保留时间=1.67分钟;ms计算值:398.1;ms实测值:399.2[m+h]+。合成x4-151-7按照通用程序a,获得呈黄色固体的x4-151-7(2.9g,产率:73%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.81分钟;ms计算值:384.1;ms实测值:385.1[m+h]+。1hnmr(400mhz,dmso-d6):δ12.67(s,1h),8.39(s,1h),7.56(d,j=7.6hz,1h),7.46(d,j=7.6hz,1h),7.34(d,j=7.6hz,1h),7.19-7.16(m,1h),7.11-7.07(m,1h),3.60-3.55(m,2h),2.50(s,3h),2.05-1.88(m,4h),1.66-1.59(m,5h)。合成x4-151-7-1按照通用程序k,获得呈褐黄色油的x4-151-7-1(7.6g,93%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:98%。保留时间=2.97分钟,3.27分钟;ms计算值:514.2;ms实测值:515.2[m+h]+。合成x4-325-1按照通用程序j,获得呈黄色固体的x4-325-1(84mg,产率:77%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:50%,保留时间=2.43分钟;ms计算值:560.4;ms实测值:561.4[m+h]+。合成i-76向x4-325-1(84mg,0.15mmol)在etoh(1ml)中的溶液加入hcl/二恶烷(4ml),并将混合物在60℃下搅拌4小时。将混合物在真空中浓缩并用dcm(20ml)稀释,向混合物加入饱和nahco3水溶液,直到ph=8到9,并将混合物通过dcm(20ml×3)萃取。将有机层用盐水(10ml×3)洗涤,经na2so4干燥,过滤并在真空中浓缩,将残余物通过制备型hplc纯化以获得呈白色固体的i-76(23.6mg,产率:36%)。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]到15%[总计10mmaconh4)h2o/mecn=900/100(v/v)]和85%[总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续5分钟)。纯度:98%,保留时间=6.81分钟;ms计算值:430.3;ms实测值:431.2[m+h]+。1hnmr(400mhz,dmso-d6):δ12.17(s,1h),8.38(s,1h),7.55(d,j=6.8hz,1h),7.19-7.15(m,1h),7.00-6.96(m,2h),6.45-6.40(m,1h),3.58(d,j=9.6hz,1h),3.53-3.40(m,5h),2.74-2.72(m,3h),2.50(s,3h),2.04-1.82(m,4h),1.71-1.57(m,6h),0.47-0.43(m,2h),0.36-0.33(m,2h)。实例26:合成i-82i-82的合成方案合成x4-348-2向2,3-二甲基吡啶(20.0g,186.65mmol)在dcm(400.0ml)中的溶液加入3-氯苯并过氧酸(m-cpba)(46.7g,270.64mmol)。将溶液在室温下搅拌过夜。加入亚硫酸钠水溶液,并且将所得混合物用二氯甲烷萃取。将有机层经无水硫酸镁干燥,将滤液浓缩,并将滤液在硅胶柱上通过色谱法纯化以得到呈白色固体的x4-348-2(15.0g,65.3%产率)。1hnmr(cdcl3)δ2.34(s,3h),2.51(s,3h),7.03-7.05(m,2h),8.16(s,1h)。合成x4-348-3将x4-348-2(12.4g,100.69mmol)溶于32.0ml浓缩h2so4中,并用10.5ml65%hno3处理。在95℃下将混合物加热5小时。然后将其冷却到0℃,并用10nnaoh处理,直到ph>9。收集沉淀物以得到呈白色固体的x4-348-3(10.0g,59.1%产率)。1hnmr(cdcl3)δ2.57(s,3h),2.58(s,3h),7.12(d,1h,j=6.8hz),8.20(d,1h,j=7.2hz)。合成x4-349-4向x4-348-3(10.0g,59.47mmol)在乙醇(100.0ml)中的溶液缓慢加入乙酰氯(10.6ml,148.68mmol)。将混合物在65℃下搅拌5小时。将溶剂在降压下去除,用水和dcm稀释,逐滴加入naoh水溶液(50%)以将ph调节为7.5到8.5。将有机层用盐水清洗,经na2so4干燥,过滤并在真空中浓缩。将粗x4-349-4(9.4g,100%产率)在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:95.35%;保留时间=0.65分钟;ms计算值:157.0;ms实测值:158.4[m+h]+。合成x4-349-5将乙酸酐(100ml)加入到x4-349-4(9.4g,59.47mmol),并将所得的混合物在110℃下加热1小时。将溶剂在减压下蒸馏出,并且向其加入水,并且将所得混合物用etoac萃取。将所得有机层用水洗涤并经无水硫酸钠干燥,将溶剂在减压下蒸馏出。将所得残余物溶于90%乙醇中,并向其加入氢氧化钠(3.5g,89.19mmol),并将所得混合物在80℃下加热3小时。将溶剂在减压下蒸馏出,加入水,并将所得混合物用dcm萃取。将有机层用盐水洗涤,经无水硫酸钠干燥,过滤,并且将溶剂在减压下去除。将所得残余物通过柱色谱法纯化以获得呈浅绿色固体的x4-349-5(2.4mg,25.6%产率)。1hnmr(cdcl3)δ8.20(d,1h,j=5.2hz),7.25(d,1h,j=5.2hz),4.71(br,1h),4.70(s,2h),2.92(s,3h)。合成x4-349-6向x4-2349-5(1.0g,6.35mmol)在dcm(60ml)中的溶液加入戴斯-马丁高碘烷(4.0g,9.52mmol)。将混合物在室温下搅拌2小时。将固体过滤并将滤液在真空中浓缩。将所得残余物通过柱色谱法纯化以获得呈浅绿色固体的x4-349-6(800.0mg,81.0%产率)。1hnmr(cdcl3)δ10.17(s,1h),8.55(d,1h,j=5.2hz),7.50(d,1h,j=5.2hz),2.73(s,3h)。合成x4-349-7向x4-013-6(1.2g,4.11mmol)、l-脯氨酸(236.8mg,2.06mmol)和x4-349-6(800.0mg,5.14mmol)在meoh(50.0ml)中的溶液加入甲胺水溶液(1.2ml,40%)。将溶液在室温下搅拌过夜并且在减压下浓缩。将残余物通过柱色谱法纯化以获得呈灰色固体的x4-349-7(660.0mg,28.3%产率)。1hnmr(dmso-d6)δ12.35(s,1h),8.38(d,1h,j=5.2hz),7.48(d,1h,j=5.2hz),7.04-6.97(m,2h),6.45(dd,1h,j=7.2hz),4.55(dd,1h,j=12hz),4.43(dd,1h,j=12.0hz),3.47(br,4h),3.27-3.10(m,2h),2.60(s,3h),2.51(br,4h),2.37-2.20(m,5h),1.75(s,3h)。合成x4-349-8向x4-347-7(530.0mg,1.17mmol)在meoh(10.0ml)中的溶液加入硼氢化钠(177.1mg,4.68mmol)。将溶液在室温下搅拌3小时。将溶剂在减压下去除并通过柱色谱法纯化以得到呈白色固体的x4-349-8(350.0mg,65.7%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:94.89%。保留时间=1.53分钟;ms计算值:454.2;ms实测值:455.2[m+h]+。合成x4-349-9向x4-349-8(340.0mg,0.75mmol)和dmap(273.9mg,1.64mmol)、tea(378.1mg,3.74mmol)在dcm(10ml)中的混合物加入氯硫代甲酸苯酯(283.8mg,2.24mmol)。将反应混合物在室温下在n2下搅拌2小时。然后将其用冰水小心地淬灭并用etoac萃取。将有机相用盐水洗涤,经na2so4干燥并浓缩。将粗产物通过柱色谱法纯化以获得呈白色固体的x4-349-9(200.0mg,45.3%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:35.11%。保留时间=2.39分钟;ms计算值:590.2;ms实测值:591.2[m+h]+。合成i-82将x4-349-9(200.0mg,0.34mmol)、n-bu3snh(147.7mg,0.51mmol)和aibn(55.6mg,0.34mmol)在甲苯(3.0ml)中的混合物在110℃下搅拌2小时。将所得溶液在真空中浓缩。将残余物通过制备型hplc纯化以获得呈白色固体的i-82(26.0mg,17.5%产率)。lc-ms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:95.49%,保留时间=1.74分钟;ms计算值:438.2;ms实测值:439.3[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:95.92%。保留时间=8.47分钟。1hnmr(dmso-d6)δ12.4(br,1h),8.35(d,j=4.8hz,1h),7.43(d,j=4.8hz,1h),6.99(d,j=5.2hz,2h),6.44(d,j=2.4hz,1h),3.69-3.45(m,6h),2.62(s,3h),2.51(s,4h),2.24(s,3h),1.97-1.66(m,4h),1.59-1.54(m,5h)。实例27:合成i-83i-83的合成方案合成x4-357-1在0℃下,向x4-013-6(1g,3.5mmol)和3-甲基皮考林醛(639mg,5.28mmol)在meoh(40ml)中的混合物加入naoh(210mg,5.28mmol)在h2o(2ml)中的溶液,并且将混合物在室温下搅拌3小时。用35%hcl水溶液将ph调节为8,经无水na2so4干燥,过滤并在真空中浓缩。将残余物通过柱色谱法纯化以获得呈黄色固体的x4-357-1(1.15g,84.4%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:89.3%。保留时间=1.48分钟;ms计算值:387.2;ms实测值:388.3[m+h]+。合成x4-357-2将x4-357-1(1.15g,2.97mmol)和nh3.h2o(1.39g,11.89mmol,30%)在meoh(50ml)中的溶液在室温下搅拌过夜。将溶剂在减压下去除并通过柱色谱法纯化以得到呈黄色固体的x4-357-2(200mg,16.7%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:91.7%,保留时间=1.40分钟;ms计算值:404.2;ms实测值:405.3[m+h]+。合成i-83按照通用程序a,获得呈米黄色固体的i-83(24mg,12.6%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm×4.6mm×3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn](在3.0分钟),然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn],并且在此条件下持续0.7分钟)。纯度:>99.9%,保留时间=1.960分钟;ms计算值:390.3;ms实测值:391.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:>99.9%。保留时间=7.11分钟。1hnmr(400mhz,dmso-d6)δ12.16(s,1h),8.38(d,j=3.6hz,1h),7.56(d,j=7.6hz,1h),7.21-7.16(m,1h),7.02-6.93(m,2h),6.44(d,j=7.2hz,1h),4.12(t,j=12hz,2h),3.49-3.34(m,4h),3.03(s,1h),2.51(s,4h),2.37(s,3h),2.24(s,3h),2.04-2.01(m,2h),1.83-1.74(m,2h),1.66-1.49(m,2h)。实例28:合成i-88i-88的合成方案制备x4-362-1将x4-013-6(300mg,1.06mmol)、x4-362-s(182mg,1.16mmol)、l-脯氨酸(48.6mg,0.422mmol)和menh2(334mg,40%水溶液,4.23mmol)在meoh(10ml)中的混合物在室温下搅拌过夜。将混合物浓缩并加入水(10ml)。将混合物用二氯甲烷萃取3次,并将组合的有机层用盐水洗涤,经na2so4干燥并过滤。将滤液浓缩以获得棕色固体(643mg,粗产物),其在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:51.6%,保留时间=1.57分钟;ms计算值:454.3;ms实测值:455.3[m+h]+。制备i-88按照通用程序a,获得呈黄色固体的i-88(14mg,4%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下保持2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],并且在此条件下保持0.7分钟)。纯度:95.16%。保留时间=1.77分钟;ms计算值:440.3;ms实测值:441.4[m+h]+。hplc(安捷伦hplc1200;柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到15%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和85%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下保持10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],并且在此条件下保持5分钟。纯度:89.26%。保留时间=5.49分钟。1hnmr(400mhz,dmso-d6)δ12.3(s,1h),9.50(s,1h),8.45(s,1h),7.96(d,j=8.0hz,1h),7.80-7.69(m,3h),7.25-6.99(m,2h),6.45(d,j=2.4hz,1h),3.65-3.39(m,6h),2.60(m,4h),2.33(s,3h),2.30-2.05(m,2h),1.94(d,j=9.6hz,2h),1.78(d,j=14.4hz,2h),1.69(s,3h)。实例29:合成i-108和i-129i-108和i-129的合成方案合成x4-413-1按照通用程序j,获得呈黄色油的x4-413-1(150mg,60%)。合成i-129按照通用程序h,同时将100%tfa用作溶剂,获得呈白色固体的i-129(80mg,产率:83%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:97%,保留时间=1.67分钟;ms计算值:416.6;ms实测值:417.3[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]到15%[总计10mmaconh4)h2o/mecn=900/100(v/v)]和85%[总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续5分钟)。纯度:99%。保留时间=5.15分钟。1hnmr(400mhz,dmso-d6)δ12.19(s,1h),8.39(d,j=3.6hz,1h),7.55(d,j=6.8hz,1h),7.18-7.15(m,1h),6.99-6.94(m,2h),6.38(dd,j=2.0hz,6.4hz,1h),3.60-3.44(m,4h),3.27-3.16(m,2h),2.96(t,j=4.4hz,2h),2.50(t,j=1.6hz,3h),2.01-1.82(m,4h),1.65-1.40(m,5h),0.53(s,4h)。合成i-108按照通用程序m,获得呈白色固体的i-108(25mg,产率:48%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:99%,保留时间=1.98分钟;ms计算值:430.3;ms实测值:431.2[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]到15%[总计10mmaconh4)h2o/mecn=900/100(v/v)]和85%[总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续5分钟)。纯度:100%。保留时间=6.29分钟。1hnmr(400mhz,dmso-d6)δ12.14(s,1h),8.38(d,j=4.0hz,1h),7.56-6.54(m,1h),7.17(dd,j=7.6,4.8hz,1h),6.99-6.94(m,2h),6.42-6.40(m,1h),3.60-3.47(m,4h),3.31-3.19(m,2h),2.95(t,j=4.8hz,2h),2.49(s,3h),2.28(s,3h),2.00-1.85(m,4h),1.65-1.62(m,5h),0.68-0.48(m,4h)。实例30:合成i-120i-120的合成方案合成x4-428-1将x4-426-1(1.5g,4.1mmol)、pmbnh2(1.7g,12.3mmol)在meoh(80ml)中的混合物在室温下搅拌过夜。完成后,将反应混合物浓缩并通过柱色谱法(dcm:meoh=200:1)纯化以得到呈浅黄色固体的x4-428-1(1.5g,68%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:80%,保留时间=2.01分钟;ms计算值:504.1;ms实测值:505.2[m+h]+。合成x4-428-2按照通用程序a,获得呈白色固体的x4-428-2(600mg,产率:41%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:85%,保留时间=2.03分钟;ms计算值:491.1;ms实测值:491.2[m+h]+。合成x4-428-3按照通用程序k,获得呈黄色固体的x4-426-5(600mg,产率:79%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:79%,保留时间=1.83分钟;ms计算值:620.2;ms实测值:621.2[m+h]+。合成x4-428-4按照通用程序j,获得呈白色固体的x4-428-4(160mg,产率:48%)。lcms(安捷伦lcms1200-6110,柱:沃特世x选择(xselect)cshc18(30mm*3mm*2.5μm);柱温:40℃;流速:1.5ml/分钟;流动相:在1.5分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续0.5分钟,最终在0.1分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa])。纯度:96%,保留时间=1.10分钟;ms计算值:666.4;ms实测值:667.3[m+h]+。合成i-120按照通用程序n,获得呈白色固体的i-120(25mg,产率:26%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:>99%,保留时间=1.65分钟;ms计算值:416.3;ms实测值:417.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:>99%。保留时间=7.89分钟。1hnmr(400mhz,dmso-d6):δ12.06(brs,1h),8.37(d,j=4.0hz,1h),7.56(d,j=7.2hz,1h),7.17(dd,j=7.6,4.8hz,1h),6.91(d,j=8.0hz,1h),6.74(d,j=7.6hz,1h),6.41(d,j=7.6hz,1h),5.05-4.96(m,2h),4.16-4.04(m,2h),2.51-2.46(m,1h),2.38-2.26(m,6h),2.04-2.01(m,5h),1.90-1.61(m,6h),1.53-1.51(m,1h),1.50-1.48(m,1h)。实例31:合成i-122i-122的合成方案合成x4-430-0:将3-氯皮考林醛(1.5g,10.64mmol)、(4-甲氧基苯基)甲胺(1.5g,10.64mmol)和mgso4(3.8g,31.9mmol)在ch2cl2(45ml)中的混合物在室温下搅拌过夜。将反应混合物直接用于下一步骤。合成x4-430-1:向以上获得的反应混合物x4-430-0加入meoh(200ml),然后加入x4-013-6(3.02g,10.64mmol)和l-脯氨酸(0.49g,4.30mmol)。将混合物在室温下搅拌过夜并且然后浓缩。将残余物倒入水中,并且用ch2cl2萃取。将组合的有机层用盐水清洗,经na2so4干燥并过滤。将滤液浓缩,并且使用柱色谱法(ch2cl2到ch2cl2/meoh=30/1)纯化残余物以提供呈黄色固体的x4-430-1(2.80g,28%纯度)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:28%(214nm)。保留时间=2.06分钟;ms计算值:544.2;ms实测值:545.2[m+h]+。合成x4-430-2:按照通用程序a,获得呈黄色固体的x4-430-2(450mg,66%纯度,7.9%产率,2个步骤)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:66%(214nm)。保留时间=1.84分钟;ms计算值:530.3;ms实测值:531.4[m+h]+。合成i-122按照通用程序n,获得呈浅黄色固体的i-122(23.0mg,7%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:66%(214nm)。保留时间=1.56分钟;ms计算值:410.2;ms实测值:411.2[m+h]+。hplc(安捷伦hplc1200;柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]到15%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和85%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],然后在此条件下保持10分钟,最终在0.1分钟内变为95%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和5%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],并且在此条件下保持5分钟)。纯度:>99%。保留时间=5.59分钟。1hnmr(400mhz,dmso-d6)δ10.5(brs,1h),8.49(dd,j=4.8hz,1.6hz,1h),7.69(dd,j=8.0hz,1.6hz,1h),7.10-7.20(m,3h),6.67(brs,1h),5.50(dd,j=11.2hz,2.4hz,1h),4.31-4.28(m,1h),3.50(brs,4h),2.74(brs,4h),2.41(s,3h),2.40-2.30(m,1h),2.20-2.00(m,2h),1.80-1.70(m,2h),1.60-1.50(m,1h)。实例32:合成i-130i-130的合成方案合成x4-012-3按照通用程序f,获得呈浅黄色固体的x4-012-2(5.5g,54.0%产率)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:93.3%;保留时间=1.11分钟;ms计算值:186.1;ms实测值:187.2[m+h]+。合成x4-012-4向x4-012-3(4.0g,21.5mmol)、l-脯氨酸(1.0g,8.7mmol)和3-甲基皮考林醛(3.4mg,28.0mmol)在meoh(200.0ml)中的溶液加入甲胺水溶液(6ml,40%)。将溶液在室温下搅拌过夜。在减压下去除溶剂并通过柱色谱法纯化溶剂,以获得呈橙色固体的x4-012-4(4.1g,59.6%产率)。h-hnoesy确认结构。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]到10%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和90%[(总计10mmaconh4)水/ch3cn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=900/100(v/v)]和10%[(总计10mmaconh4)水/ch3cn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:74.83%。保留时间=1.49分钟;ms计算值:320.1;ms实测值:321.2[m+h]+,ms实测值:353.3[m+meoh]+。合成x4-012-7按照通用程序a,获得呈白色泡沫的x4-012-7(1.3g,34.0%产率)。使用1hnmr和h-hnoesy确认结构。lc-ms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:97.56%,保留时间=1.17分钟;ms计算值:306.2;ms实测值:307.3[m+h]+。1hnmr(cdcl3)δ11.8(br,h),8.43(d,1h,j=3.6hz),7.70(br,h),7.46(q,1h,j=7.6hz),7.39(br,1h),7.27-7.16(m,2h),7.09(q,1h,j=7.6hz),3.73(dd,1h,j=11.2hz),3.63(dd,1h,j=10.8hz),2.40(s,3h),1.58-2.14(m,9h)。合成x4-452-2按照通用程序g,获得呈黄色油的x4-452-2(70mg,15%产率)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:95%。保留时间=1.54分钟;ms计算值:489.6;ms实测值:490.3[m+h]+。合成x4-452-3按照通用程序h,获得呈黄色油的x4-453-2(50mg,90%产率)。lcms(安捷伦lcms1200-6110,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]到0%[水+0.05%tfa]和100%[ch3cn+0.05%tfa],然后在此条件下持续1.4分钟,最终在0.05分钟内变为95%[水+0.05%tfa]和5%[ch3cn+0.05%tfa]并且在此条件下持续0.7分钟)。纯度:98%;保留时间=1.06分钟;ms计算值:389.5;ms实测值:390.3[m+h]+。合成i-130按照通用程序m,获得呈白色固体的i-130(15mg,29%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]到10%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和90%[(总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[(总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.69分钟;ms计算值:403.2,ms测量值:404.3[m+h]+。hplc(安捷伦hplc1200,柱:l-柱2ods(150mm*4.6mm*5.0μm);柱温:40℃;流速:1.5ml/分钟;流动相:在5分钟内从90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]到15%[总计10mmaconh4)h2o/mecn=900/100(v/v)]和85%[总计10mmaconh4)h2o/mecn=100/900(v/v)],然后在此条件下持续10分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)h2o/mecn=900/100(v/v)]和10%[总计10mmaconh4)h2o/mecn=100/900(v/v)]并且在此条件下持续5分钟)。纯度:99%。保留时间=5.52分钟。1hnmr(400mhz,dmso-d6)δ8.44-8.32(m,1h),7.64(d,j=7.2hz,1h),7.58-7.56(m,2h),7.18-7.14(m,3h),5.38(s,1h),4.00(s,1h),3.68-3.65(m,1h),3.01-2.91(m,2h),2.69-2.67(m,1h),2.53-2.51(m,2h),2.47-2.43(m,3h),2.31-2.25(m,3h),2.09-2.01(m,2h),1.95-1.85(m,4h),1.74-1.55(m,6h)。实例33:合成额外化合物根据与本文描述的那些方法基本上类似的方法制备额外示范性化合物。以下提供了这些额外化合物的数据以及本文描述其制备的化合物的数据。表2:额外示范性化合物的表征数据实例34:合成i-123i-123的合成方案合成x4-431-1将x4-431-0(10g,45.4mmol)在menh2/meoh(80ml)中的混合物在80℃下搅拌2个小时。将混合物在真空中浓缩。加入饱和nahco3溶液以调节ph=9并用dcm(30mlx3)萃取。将有机层通过na2so4干燥,在真空中过滤和浓缩以获得呈白色固体的x4-431-1(8.0g,产率:80%),其直接用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*3mm*2.5μm);柱温:40℃;流速:1.5ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:97%,保留时间=1.34分钟;ms计算值:230.0;ms实测值:230.9[m+h]+。合成x4-431-2将x4-431-1(7.0g,30.4mmol)在ea(72ml)中的溶液与二氧化铂(100mg)在在h2气氛下搅拌并且在室温下搅拌过夜。将混合物过滤并真空浓缩。将残余物通过反向柱色谱法纯化,用dcm/meoh=200/1洗脱,以获得呈黄色油的x4-431-2(4.2g,产率:69%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*3mm*2.5μm);柱温:40℃;流速:1.5ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:90%,保留时间=0.98分钟;ms计算值:200.0;ms实测值:201.0[m+h]+。合成x4-431-3向x4-431-2(2.0g,10.0mmol)在meoh(200ml)中的混合物加入甲苯中的50%乙基2-氧代乙酸酯(4.1g,40mmol)并在室温下搅拌过夜。将混合物在真空中浓缩。将残余物通过反向柱色谱法纯化,用pe/ea=20/1洗脱,以获得呈黄色油的x4-431-3(800mg,产率:28%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*3mm*2.5μm);柱温:40℃;流速:1.5ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:85%,保留时间=1.09分钟;ms计算值:282.0;ms实测值:283.0[m+h]+。合成x4-431-4按照通用程序j,获得呈黄色固体的x4-431-4(450mg,产率:53%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*3mm*2.5μm);柱温:40℃;流速:1.5ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.5分钟)。纯度:84%,保留时间=0.90分钟;ms计算值:302.2;ms实测值:303.2[m+h]+。合成x4-431-5按照通用程序l,获得呈棕色半固体的x4-431-5(340mg,产率:66%),其在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:89%,保留时间=1.00分钟;ms计算值:344.2;ms实测值:345.3[m+h]+。合成x4-431-6在ar气氛下向x4-431-5(300mg,0.87mmol)和k2co3(120mg,0.87mmol)在ch3cn(9ml)中的溶液加入sm-2(128mg,0.87mmol)。将混合物在室温下搅拌过夜。然后将其倒入nahco3水溶液(30ml)中,并且用dcm(20mlx3)萃取,通过mgso4干燥,过滤并蒸发以获得呈褐色油的粗糙x4-431-6(400mg,93%产率),其在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.7分钟)。纯度:81%,保留时间=1.17分钟;ms计算值:491.3;ms实测值:492.3[m+h]+。合成x4-431-7在100℃下将x4-431-6(400mg,0.81mmol)在浓缩hcl(10ml)中的溶液搅拌2小时。然后将其在真空中浓缩。将残余物溶于h2o(40ml)中,用20%naoh水溶液将ph调节为9,用dcm(3×100ml)萃取,通过mgso4干燥,过滤并蒸发以获得呈褐色油的粗糙x4-431-7(300mg,产率:88%),其在不进行进一步纯化的情况下用于下一步骤。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(30mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在0.5分钟内从90%[水+10mmnh4hco3]和10%[ch3cn]到5%[水+10mmnh4hco3]和95%[ch3cn],然后在此条件下持续1.5分钟,最终在0.1分钟内变为90%[水+10mmnh4hco3]和10%[ch3cn]并且在此条件下持续0.7分钟)。纯度:84%,保留时间=1.08分钟;ms计算值:419.2;ms实测值:420.2[m+h]+。合成i-123将x4-431-7(300mg,0.72mmol)、nh4br(210mg,2.15mmol)、acoh(47mg,0.79mmol)、koh(10mg,0.18mmol)、nabh3cn(68mg,1.08mmol)在干燥ch3oh(7ml)中的混合物在室温下搅拌过夜,并在ar气氛下在70℃下加热额外24小时。然后将其用20mlh2o淬灭,并用dcm(3×100ml)萃取,经mgso4干燥,过滤并蒸发。将残余物通过制备型hplc纯化以获得呈黄色固体的i-123(53mg,产率:18%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:>97.4%,保留时间=1.65分钟;ms计算值:404.3;ms实测值:405.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:91.6%。保留时间=7.90分钟。1hnmr(400mhz,cd3od):δ8.40(d,j=3.6hz,1h),7.58(d,j=7.6hz,1h),7.42(d,j=8.0hz,1h),7.20-7.15(m,2h),7.08(d,j=7.6hz,1h),4.39-4.29(m,2h),4.26(s,3h),3.34-3.31(m,2h),3.19-2.93(m,4h),2.51-2.40(m,8h),2.20-2.19(m,1h),2.09-1.85(m,4h),1.65-1.51(m,1h)。实例35:合成i-165i-165的合成方案x4-172-4:按照通用程序f,获得呈白色固体的x4-172-4(1.5g,53.0%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.4分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:63%,保留时间=0.40分钟;ms计算值:136.1;ms实测值:137.3[m+h]+。x4-172-1:向x4-172-4(1.0g,7.34mmol)、l-脯氨酸(338mg,2.94mmol)和3-甲基吡啶甲醛(1.07g,8.81mmol)在meoh(200.0ml)中的溶液加入甲胺水溶液(8ml,40%)。将溶液在室温下搅拌过夜。将溶剂在减压下去除并通过柱色谱法纯化溶剂,以获得呈黄色固体的x4-172-1(1.4g,70.5%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]到10%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和90%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:61.0%。保留时间=1.09分钟;ms计算值:270.1;ms实测值:271.1[m+h]+。x4-172-2:按照通用程序a,获得呈黄色固体的x4-172-2(560mg,42.2%产率)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在1.6分钟内从90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]到10%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和90%[(总计10mmaconh4)水/ch3cn=1/9(v/v)],然后在此条件下持续2.4分钟,最终在0.1分钟内变为90%[(总计10mmaconh4)水/ch3cn=9/1(v/v)]和10%[(总计10mmaconh4)水/ch3cn=1/9(v/v)]并且在此条件下持续0.7分钟)。纯度:71.9%。保留时间=1.43分钟;ms计算值:256.2;ms实测值:257.2[m+h]+。n,n-二甲基-3-(2-((2r,6s)-1-甲基-6-(3-甲基吡啶-2-基)哌啶-2-基)-1h-咪唑-1-基)丙-1-胺(i-165):按照通用程序g,获得呈黄色油的i-165(15mg,11.3%)。lcms(安捷伦lcms1200-6120,柱:沃特世x型桥c18(50mm*4.6mm*3.5μm);柱温:40℃;流速:2.0ml/分钟;流动相:在3.0分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续1.0分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续0.7分钟)。纯度:100%,保留时间=1.91分钟;ms计算值:341.5;ms实测值:342.4[m+h]+。hplc(安捷伦hplc1200,柱:沃特世x型桥c18(150mm*4.6mm*3.5μm);柱温:40℃;流速:1.0ml/分钟;流动相:在10分钟内从95%[水+10mmnh4hco3]和5%[ch3cn]到0%[水+10mmnh4hco3]和100%[ch3cn],然后在此条件下持续5分钟,最终在0.1分钟内变为95%[水+10mmnh4hco3]和5%[ch3cn]并且在此条件下持续5分钟)。纯度:99%。保留时间=6.87分钟。1hnmr(400mhz,cd3od)δ8.40(d,j=2.4hz,1h),7.64(s,1h),7.24(s,1h),7.15(s,1h),6.92(s,1h),4.44(s,2h),3.63(s,2h),2.46(s,5h),2.29(s,6h),2.03(s,5h),1.72-1.84(m,6h)。实例36:rega筛选测定细胞内cxcl-12诱导的钙动员测定使用钙应答荧光探针和flipr系统来评估由趋化因子或趋化因子衍生肽诱导的细胞内钙动员。cxcr-4转染的u87细胞系(u87.cxcr4)细胞以每孔20,000个细胞接种于明胶涂覆的黑壁96孔板中并孵育12个小时。然后,在37℃下,细胞在测试缓沖液(汉克平衡盐溶液,含有20mmhepes缓冲液和0.2%的牛血清白蛋白,ph为7.4)中在4μm最终浓度下装载有荧光钙探针fluo-2乙酰氧基甲基持续45分钟。然后,通过使用荧光成像读板仪(flipr泰特拉(fliprtetra),分子仪器公司)同时监测所有孔中作为时间的函数的荧光性来在37℃下测量由cxcl-12(25到50ng/ml)诱导的细胞内钙动员。在加入cxcl-12前15分钟,加入测试化合物,然后对其进行监测以查看化合物自身是否诱发信号(声学特性)。趋化因子(cxcl12-af647)结合抑制测定用测试缓沖液(汉克平衡盐溶液,含有20mmhepes缓冲液,0.2%的牛血清白蛋白,ph为7.4)洗涤表达cxcr4的jurkat细胞一次,然后在室温下用以剂量相关浓度稀释于测试缓冲液中的测试化合物孵育15分钟。随后,将cxcl12-af647(25ng/ml)加入到经化合物孵育的细胞中。将细胞在室温下孵育30分钟。然后将细胞在测试缓冲液中洗涤两次,将其固定于pbs中的1%多聚甲醛中并在装配有635-nm红色二极管激光器(碧迪(bectondickinson),美国加利福尼亚州圣荷西(sanjose,ca,usa))的facscalibur流式血细胞计数器的fl4通路上进行分析。根据以下化学式进行计算cxcl12-af647结合的抑制百分比:[1-((mfi-mfinc)/(mfipc-mfinc))]x100,其中mfi是在抑制剂存在的情况下用cxcl12-af647孵育的细胞的平均荧光强度,mfinc是在阴性对照(即,未标记细胞的自发荧光)中测量的平均荧光强度,并且mfipc是阳性对照(即,单独地暴露于cxcl12-af647的细胞)的平均荧光强度。测定结果表3示出了在上述测定中,本发明所选化合物的活性。该化合物编号对应于表1中的化合物编号。具有被指定为“a”的活性的化合物提供0.01到100nm的ic50;具有被指定为“b”的活性的化合物提供>100nm到<1μm的ic50;并且具有被指定为“c”的活性的化合物提供1μm或更大的ic50。表3:ca2+信号传送抑制和cxcl12结合抑制实例37:caco-2渗透性测定测定程序该测定的目的是使用caco-2细胞系评价候药物候选物的肠道吸收潜能。实验程序1.预热在37℃水浴中预热hbss缓冲液2.超声处理从-20℃下取出化合物,超声处理几分钟(不少于1分钟)3.溶液制备供体溶液缓冲液:a到b方向:hbss缓冲液,含0.3%dmso和5μmly:向50mlhbss缓冲液(ph7.4)加入150μldmso和50μlly(5mm)。hbss缓冲液,含0.1%dmso和5μmly:向50mlhbss缓冲液(ph7.4)加入50μldmso和50μlly(5mm)。b到a方向:hbss缓冲液,含0.3%dmso:向50mlhbss缓冲液(ph7.4)加入150μldmso。hbss缓冲液,含0.1%dmso:向50mlhbss缓冲液(ph7.4)加入50μldmso。接收液缓冲液:a到b方向:制备含0.4%dmso的hbss缓冲液:向50mlhbss缓冲液(ph7.4)加入200μldmso。b到a方向:制备hbss缓冲液,含0.4%dmso和5μmly:向50mlhbss缓冲液(ph7.4)加入200μldmso和50μlly(5mm)。表4:制备测试溶液4.测量teer将细胞培养板从培养箱中取出,使用hbss缓冲液洗涤单层细胞,然后在室温下测量teer值。5.离心装入供体室之前,将化合物溶液(来自步骤3)以4000rpm离心5分钟。6.给药基于下表中列出的体积添加溶液(确保取出额外100μl的t0供体样品作为备用)。表5:给药参数7.顶侧lyt0样品为了确定顶侧室中的ly浓度,从顶侧室中取出100μl样品置于不透明板上,作为lyt0。8.预热在37℃下预热顶侧和基底侧板约5分钟,然后通过将顶侧板置于基底板上开始运输。9.孵育在37℃下将板放入培养箱中90分钟。10.标准曲线制备制备20×溶液:对于300μm化合物溶液,向192μl的meoh/h2o(1:1)加入6μl化合物储备溶液。在meoh/h2o(1:1)中制备工作溶液表6:用于标准曲线制备的溶液化合物溶液(μm)溶液(μl)meoh/h2o(μl)最终溶液(μm)300100400→6060100200→2020100400→44100400→0.80.8100300→0.20.2100100→0.1制备1×溶液:3μl(20×)+57μl的0.4%dmsohbss+60μlacn(含is)(柳胺酚或丙咪嗪)---120μl(1×)11.运输终止90分钟孵育后,将顶侧板和基底侧板分离。12.测量ly从基底侧板中取出100μl样品置于不透明板上作为lyt90。13.使用荧光计(激发485nm/发射535nm)测量lyt0和lyt90的ly浓度。14.lc-ms/ms的样品制备供体样品(1:10稀释):6μl供体样品+54μl0.4%dmsohbss+60μlacn(含is)(柳胺酚或丙咪嗪)接收样品:60μl接收样品+60μlacn(含is)(柳胺酚或丙咪嗪)表7:生物分析条件结果研究细节:测试浓度10μm参考化合物:红霉素、美托洛尔、阿替洛尔、荧光黄测试系统:caco-2/hbss溶液孵育条件:在37℃下0.90分钟样品大小:一式二份(n=2)生物分析方法:lc-ms/ms计算经上皮电阻(teer)=(电阻样品-电阻空白)×有效膜面积荧光黄渗透性:papp=(va/(面积×时间))×([rfu]受体-[rfu]空白)/(([rfu]初始,供体-[rfu]空白)×稀释因数)×100药物渗透性:papp=(va/(面积×时间))×([药物]受体/(([药物]初始,供体)×稀释因数)其中,va是受体孔的体积,面积是膜的表面积,并且时间是以秒为单位的总运输时间。米利塞尔(millicell)-24细胞培养板:膜的表面积=0.7cm2,va=0.8ml(a到b)或0.4ml(b到a)结果随机选择的孔的caco-2单层teer值是357±29ω·cm2(平均数±sd)。注:如果teer值>100ω·cm2,则使用单层细胞。注释:1.基于计算的浓度计算papp值。2.该测定中应用的caco-2单层中的大多数示出了如由teer值所指示的紧密连接以及对低渗透性对照荧光黄的低渗透(未示出数据)。3.作为高渗透性对照,美托洛尔示出了在caco-2细胞内a到b和b到a的渗透性均>10×10-6cm/秒。作为低渗透性对照,阿替洛尔示出了在caco-2细胞内a到b和b到a的渗透性均小于5×10-6cm/秒。作为流出底物,红霉素在caco-2细胞内给出的流出率高于116.11。4.如表8中所概述的,示出渗透率<5×10-6cm/秒的化合物显示出低渗透率;示出渗透率为5到10×10-6cm/秒的化合物在a到b方向上显示出适度渗透率;示出渗透率为>10×10-6cm/秒的化合物显示出高渗透率。表8中示出了本发明的所选化合物的渗透率结果。该化合物编号对应于表1中的化合物编号。具有被指定为“a”的比例的化合物提供的比率为:0.1到10;具有被指定为“b”的比例的化合物提供的比率为:>10到<30;并且具有被指定为“c”的比例的化合物提供的比率为:30或更大。表8:所选化合物的caco-papp渗透率实例38:用于在雄性cd1小鼠静脉施用后确定脑和血浆的化合物浓度的药代动力学和脑渗透实验生命概述:研究设计(9只动物)包括施用药物(静脉:3mg/kg(5ml/kg),通过尾静脉注射)以及在0.083、0.5和1小时通过血浆和脑的末端出血采集样本。以0.6mg/ml在50mm柠檬酸盐缓冲液(ph4.0)中制备静脉给药溶液。如下执行血液采集:在异氟醚麻醉下手动限制动物并且通过眶后穿刺将大约150μl的血液/时间点采集到二钾edta管中。将血液样品置于冰上并离心以在15分钟内获得血浆样品(2000g,4℃下5分钟)。如下执行脑采集:在动物头皮上做中线切口并且将皮肤缩回。使用小型骨切割器和咬骨钳,去除覆盖脑的头骨。用抹刀去除脑,并且将脑用冷盐水冲洗。将脑置于有螺旋盖的试管中,并且在-70℃下储存试管,直到分析。血浆样品制备:将30μl样品的等分试样加入到含有50ng/mlis(地塞米松)的150μlmecn中。将混合物涡旋5分钟并在14,000rpm下离心5分钟。注入5μl上清液的等分试样用于lc-ms/ms分析。脑样品制备:将30μl脑匀浆(脑:pbs=1:3,w/v)样品的等分试样加入mecn中的150μlis(地塞米松,50ng/ml)中。将混合物涡旋5分钟并在14,000rpm下离心5分钟。注入5μl上清液的等分试样用于lc-ms/ms分析。分析方法:在以下条件下对lcms/ms-003(api4000,三重四级杆)进行样品分析:使用地塞米松作为内标进行阳离子、esi、mrm检测。hplc条件:流动相a:h2o(0.025%甲酸(fa)和1mmnh4oac);流动相b:meoh(0.025%fa和1mmnh4oac),沃特世x型桥c18(2.1×50mm,2.5μm)柱上,60℃下。表9:小鼠脑摄取试验结果-0到1小时,3个时间点表9中使用以下缩写:cl:清除率(l/小时/kg)t1/2:半衰期(小时计)fu(p)%:未结合的药物与血浆蛋白的比例(%)fu(b)%:未结合的药物与大脑蛋白的比例(%)auc最后(p):血浆药物浓度-时间曲线下的总面积(药物施用后时间零点到1小时)(小时*ng/ml)auc最后(b):脑药物浓度-时间曲线下的总面积(药物施用后时间零点到1小时)(小时*ng/ml)kp:脑/血浆药物浓度比(auc最后(b)/auc最后(p))kpuu:未结合的脑/未结合的血浆药物浓度比(如下计算:fu(b)*auc最后(b)/fu(p)*auc最后(p))采用0到24小时中的4个时间点来进行类似实验。结果在以下表10中示出。表10:小鼠脑摄取试验结果-0到24小时,4个时间点实例39:用于在对雄性sd大鼠静脉-口服施用后确定脑和血浆的化合物浓度的药代动力学和脑渗透实验生命概述:研究设计包含2个组(24只动物和18只动物)以及施用药物[静脉:3mg/kg(1.5ml/kg),通过足背静脉],[口服:10mg/kg(5ml/kg),通过口服强饲法]以及在0.25、0.5、1、4、8和24小时通过血浆、脑和csf的末端出血采集样品。以2mg/ml在50mm柠檬酸盐缓冲液(ph4.0)中制备静脉和口服给药溶液。如下执行血液采集:在指定的时间点手动限制动物,通过心脏穿刺静脉将约150μl血液样品采集到edta-2k管中。血液样品首先被保持在湿冰中并离心以在取样后15分钟内获得血浆(2000g,4℃,5分钟)。如下执行脑采集:在动物头皮上做中线切口并且将皮肤缩回。使用小型骨切割器和咬骨钳,去除覆盖脑的头骨。用抹刀去除脑,并且用冷盐水冲洗。将脑置于有螺旋盖的试管中,并且然后储存在-70℃下,直到分析。如下执行csf采集:采用气泡尾静脉注射,在深度麻醉下使动物安乐死。使用枕骨和寰椎翼作为界标,通过蝴蝶针直接刺穿小脑延髓池来采集csf。在采集过程中,将一张白纸用作背景以监测样品的仅在针之上的颜色变化。在观察颜色变化后,快速夹紧颜色变化上方的pe管材并切断仅在夹紧位点上方的pe管材。将清晰的样品吸入到注射器中。血浆样品制备:将30μl样品的等分试样加入到含有100ng/mlis(地塞米松)的100μlmecn中。将混合物涡旋10分钟并在5800rpm下离心10分钟。将40μlh2o加入到40μl上清液的等分试样中并将混合物涡旋5分钟。注入2μl上清液的等分试样用于lc-ms/ms分析。脑样品制备:使用3体积(v/w)的pbs将样品均质化。将30μl样品的等分试样加入到含100ng/mlis(地塞米松)的100μlmecn中。将混合物涡旋10分钟并在5800rpm下离心10分钟。将40μlh2o加入到40μl上清液的等分试样中并将混合物涡旋5分钟。注入2μl上清液的等分试样用于lc-ms/ms分析。csf样品制备:将10μl样品的等分试样加入到10μlmeoh/h2o(1/1)以及含有200ng/mlis(地塞米松)120μlh2o的40μlacn中。将混合物涡旋5分钟。注入2μl上清液的等分试样用于lc-ms/ms分析。分析方法:在以下条件下对uplc-ms/ms-02(三重四级杆tm4000(triplequadtm4000))进行样品分析:使用地塞米松作为内标进行阳离子、esi、mrm检测。hplc条件:流动相a:h2o-0.1%fa,流动相b:mecn-0.1%fa,acquityuplchsst3(2.1×50mm,1.8μm)柱上,60℃下。在表11中,f%表示口服生物利用度(结合的蛋白质和游离部分的总数)。表11:大鼠脑摄取试验结果-0到1小时,3个时间点实例40:用于在对雄性c57bl/6小鼠口服施用后确定脑和血浆的化合物浓度的mtd、药代动力学和脑渗透实验生命概述:研究设计有2组(18只动物和24只动物),由以下组成:施用药物[口服-50,100,150,225,300mg/kg,经口服强饲法]以及在0.25、0.5、1、4、8和24小时通过血浆、脑和csf的末端出血收集样品。在50mm柠檬酸盐缓冲液(ph4.0)中制备所有口服给药溶液。表12:两个测试组的化合物施用安排表第1组:单次施用:口服:50mg/kg(10ml/kg),通过口服强饲法(n=18)第2组:多次施用:口服-第1天:50mg/kg(10ml/kg),通过口服强饲法(n=24)口服-第2天:100mg/kg(10ml/kg),通过口服强饲法(n=24)口服-第3天:150mg/kg(10ml/kg),通过口服强饲法(n=24)口服-第4天:225mg/kg(10ml/kg),通过口服强饲法(n=24)口服-第5天:300mg/kg(10ml/kg),通过口服强饲法(n=24)如下执行血液采集:在指定的时间点手动限制动物,通过心脏穿刺静脉将约500μl血液样品采集到edta-2k管中。全部血液需要分为两部分;对应地,一部分置于含有edta-2k的管中用于血浆产生,另一部分用于血液学测定。用于血浆产生的血液样品首先被保持在湿冰中并离心以在取样后15分钟内获得血浆(2000g,4℃,5分钟)。如下执行脑采集:在动物头皮上做中线切口并且将皮肤缩回。使用小型骨切割器和咬骨钳,去除覆盖脑的头骨。用抹刀去除脑,并且用冷盐水冲洗。将脑置于有螺旋盖的试管中,并且然后储存在-70℃下,直到分析。如下执行csf采集:在颈部做中线切口。切割皮肤下的肌肉以暴露小脑延髓池。使用一根毛细管的尖端穿透小脑延髓池(灼烧毛细管一端使其变尖)。csf自发吸入到毛细管中。血浆样品制备:将30μl样品的等分试样加入到含100ng/mlis(地塞米松)的100μlmecn中。将混合物涡旋10分钟并在5800rpm下离心10分钟。将40μl上清液的等分试样加入到40μlh2o中并将混合物涡旋5分钟。注入2μl上清液的等分试样用于lc-ms/ms分析。脑样品制备:将30μl脑匀浆(脑:pbs=1:3,w/v)样品的等分试样加入到含100ng/mlis(地塞米松)的100μlmecn中。将混合物涡旋10分钟并在5800rpm下离心10分钟。将40μl上清液的等分试样加入到40μlh2o中并将混合物涡旋5分钟。注入2μl上清液的等分试样用于lc-ms/ms分析。csf样品制备:将3μl样品的等分试样加入到6μlcsf、9μlmeoh/h2o(1/1)、含有200ng/mlis(地塞米松)的40μlmecn以及116μlh2o的混合物中。将混合物涡旋5分钟。注入4μl的等分试样用于lc-ms/ms分析。分析方法:在以下条件下对uplc-ms/ms-02(三重四级杆tm4000)进行样品分析:使用地塞米松作为内标进行阳离子、esi、mrm检测。hplc条件:流动相a:h2o-0.1%甲酸,流动相b:mecn-0.1%甲酸:acquityuplchsst3(2.1×50mm,1.8μm)上,60℃下。表13:单次施用组的小鼠mtd表14:多次施用组的小鼠mtd实例41:小鼠的7天毒理学研究毒理学概述在7天重复口服给药高达100mg/kg后,在临床观察、体重或食物消耗方面无明显毒性迹象。在尸检时,一只小鼠在30mg/kg剂量下具有肾肿大。在100mg/kg剂量下观察到白血细胞持续增加。表15:毒理学研究设计测试系统c57bl/6小鼠,5周龄,18到20g,雄性,n=12食物状态自由获取食物和水施用第1组:0mg/kg/天(10ml/kg/天),通过口服强饲法(n=3)第2组:10mg/kg/天(10ml/kg/天),通过口服强饲法(n=3)第3组:30mg/kg/天(10ml/kg/天),通过口服强饲法(n=3)第4组:100mg/kg/天(10ml/kg/天),通过口服强饲法(n=3)体重观察图1中示出了四组小鼠的体重观察结果。体重在研究期间保持稳定。图2中示出了食物消耗观察结果。血液学在第8天,最后一次给药24小时后采集血液样品。结果在以下表16中示出。表16:血液学结果毒代动力学概述图3示出了在雄性c57bl/6小鼠(5周龄)中以30mg/kg单次口服施用后i-3的平均血浆、脑和csf浓度-时间曲线(n=3/时间点)。图4示出了在雄性c57bl/6小鼠(5周龄)中以30mg/kg重复口服施用后第7天i-3的平均血浆、脑和csf浓度-时间曲线(n=3/时间点)。下表17示出了该研究的pk参数的概述。表17:pk参数概述生命概述:本研究设计(36只动物,c57bl/6小鼠)由以下组成:施用药物[化合物i-3;口服:30mg/kg/天(10ml/kg/天),通过口服强饲法]以及在0.025、0.5、1、4、8和24小时通过血浆、脑和csf的末端出血采集样本。以3mg/ml在50mm柠檬酸盐缓冲液(ph4.0)中制备口服给药溶液。如下执行血液采集:使用异氟醚麻醉动物。通过用于末端出血的心脏穿刺将大约500μl的血液/时间点采集到k2edta管中。将约200μl血液样品置于冰上并离心,以在采集15分钟内获得血浆样品(2000g,4℃下5分钟)。将约300血液样品用于血液学测定。如下执行脑采集:在动物头皮上做中线切口,并且将皮肤缩回。去除覆盖脑的头骨。采集全脑,用冷盐水进行冲洗,在滤纸上干燥,称重并通过放置在干冰中进行急冻。在样品萃取之前,使用3体积的pbs(ph7.4)通过研磨珠均质器将样品均质化2分钟。血浆样品制备:将10μl样品的等分试样加入到含有10ng/mlis(格列吡嗪)的200μlmecn中。将混合物涡旋10分钟并在6,000rpm下离心10分钟。注入1μl组成物的等分试样用于lc-ms/ms分析。csf样品制备:将3μl样品的等分试样加入到含有10ng/mlis(格列吡嗪)的70μlmecn中。将混合物涡旋2分钟并在14,000rpm下离心5分钟。注入1μl组成物的等分试样用于lc-ms/ms分析。组织样品制备:使用3体积(v/w)的pbs将样品均质化。将10μl样品的等分试样加入到含有10ng/mlis(格列吡嗪)的200μlmecn中。将混合物涡旋10分钟并在6,000rpm下离心10分钟。注入1μl组成物的等分试样用于lc-ms/ms分析。分析方法:在以下条件下对lcmsms-28(三重四级杆6500+)进行样品分析:施用格列吡嗪作为内标进行阳性离子、esi、mrm检测。hplc条件:流动相a:h2o/0.025%fa和1mmnh4oac,流动相b:meoh/0.025%fa和1mmnh4oac,沃特世x型桥behc18(2.1×50mm,2.5μm)柱上,60℃下。以下表18和19中示出了额外计算的pk参数。表18:7天研究的第1天的额外pk参数表19:7天研究的第7天的额外pk参数实例42:雄性比格尔犬静脉或口服施用后化合物的药代动力学生命概述:该研究可以如下进行。在一个实施例中,研究设计(9只动物,禁食过夜,给药4小时后开始喂食)由以下组成:施用药物[静脉:1mg/kg,通过头静脉注射],[口服:3mg/kg和10mg/kg,通过口服强饲法]以及在0.03、0.08、0.25、0.5、1、2、4、8、24、48和72小时通过血浆的插管出血采集样品。分别以0.5mg/ml、1.5mg/ml和5mg/ml在50mm柠檬酸盐缓冲液(ph4.0)中制备静脉和口服给药溶液。可以如下执行血液采集:将手动限制动物,并将大约0.5ml血液/时间点从头静脉采集到预冷却的k2edta管中。将血液样品放置到湿冰上并在4℃下离心,以在样品采集15分钟内获得血浆。将所有样品储存在大约-70℃下直至分析。血浆样品制备:将30μl样品的等分试样加入到含有200ng/mlis(地塞米松)的100μlmecn中。将混合物涡旋10分钟并在5,800rpm下离心10分钟。将30μl上清液的等分试样加入到60μlh2o中并将混合物涡旋5分钟。注入4μl上清液的等分试样用于lc-ms/ms分析。分析方法:将在以下条件下使用uplc-ms/ms-02(三重四级杆tm4000)进行样品分析:使用地塞米松作为内标进行阳离子、esi、mrm检测。hplc条件:流动相a:h2o-0.1%fa,流动相b:mecn-0.1%fa,acquityuplchsst3(2.1×50mm,1.8μm)柱上,60℃下。尽管我们已经描述了本发明的许多实施例,但明显的是,可以改变我们的基本实例以便提供利用本发明的化合物和方法的其它实施例。因此,应理解本发明的范围由所附权利要求书而不是通过举例表示的特定实施例来限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1