一种土元多肽精华液及其制备方法与流程
本发明涉及日化产品技术,特别是指一种土元多肽精华液及其制备方法。
背景技术:
土鳖虫又称土元,其主要活性成分包括多种活性蛋白(酶)、氨基酸、不饱和脂肪酸、微量元素、生物碱和脂溶性维生素等。土鳖虫蛋白质含量很高,据报道,以干重计,蛋白质含量高达60%以上,是典型的高蛋白食品。周彦钢等对土鳖虫氨基酸成分分析结果表明,土鳖虫所含的氨基酸成分种类齐全,几乎包含了构成蛋白质的所有氨基酸。其中人体必需的8种氨基酸占氨基酸总量的34.5%,含量最高的前6种氨基酸依次是甘氨酸、谷氨酸、天冬氨酸、酪氨酸、精氨酸和赖氨酸。而张勤利用酶法水解土鳖虫所制取的氨基酸中,人体必需的8种氨基酸占氨基酸总含量的45.9%,含量最高的前8种氨基酸是丙氨酸、亮氨酸、缬氨酸、天冬氨酸、谷氨酸、赖氨酸、苏氨酸和丝氨酸。土鳖虫所含的氨基酸成分直接参与蛋白质、酶的合成,在抗氧化中起着一定的作用。
研究人员常将土鳖作为药物进行内服,来取得增强免疫功能、调节血脂、保护血管内壁的功效,尚未有人将土鳖做为护肤产品应用,CN105561285一种土鳖虫生物活性小肽组合物中虽然公开了土鳖中小肽的提取方法及应用,但其主要用途是与当归总酸酚、甘草总黄酮配合做成不同中药剂型用于治疗色斑、美白皮肤和减少色素生成,其制备工艺复杂,制备工艺中不可避免的会增加不少有毒物质,如采用乙酸乙酯进行萃取,且过多的工艺会造成有效成分的流失。该专利主要侧重点在于作为药的应用,添加剂比较多,不适合长期的涂抹。
《土鳖虫胃仿生酶解物纯化分离及其物质基础研究》中公开了土鳖虫酶解分离工艺的优化及纯化,该文章中测试了使用人工肠液、人工胃液、胰蛋白酶和胃蛋白酶水解土鳖虫的酶解效果,并分析了酶解后酶解物及纯化物的理化性质和药效实验结果。该文献主要用于研究土鳖虫酶解物对PT/APTT、血小板聚集率及凝血-纤溶的实验效果,但土鳖虫的药用功效远不止于此,有诸多未知的效果仍有待研究人员去探索去发掘。
如新的研究发现土鳖虫中还含有抗氧自由基的作用,对血液流变性各参数的改善作用最强,不仅能有效的降低全血黏度和血浆纤维蛋白原,抑制血栓形成,抑制血小板聚集,且能增加红细胞表面电荷,改善红细胞变形能力,在虫类活血化瘀药中作用最优。土元作为一种常见中药材仍存在诸多未知功能有待探究。
技术实现要素:
本发明提出一种土元多肽精华液及其制备方法,解决了烈日暴晒后的皮肤老化、胶原蛋白流失的问题。
本发明的技术方案是这样实现的:
一种土元多肽精华液,所述精华液包括功能成分、保湿成分、抗炎抗氧化成分、增稠剂、防腐剂、螯合剂和水,其中功能成分为土元多肽和肌肽,以土元多肽精华液质量为基准,土元多肽的质量百分数为2%-8%、肌肽的质量百分数为1%-5%。
所述保湿成分包括丙二醇、丁二醇、甘油、透明质酸、甜菜碱和海藻糖,以土元多肽精华液质量为基准,丙二醇的质量百分数为1%-5%、丁二醇的质量百分数为1%-5%、甘油的质量百分数为1%-5%、透明质酸的质量百分数为0.1%-1%、甜菜碱的质量百分数为0.1%-3%、海藻糖的质量百分数为0.1%-3%。
所述抗炎抗氧化成分包括阿魏酸和尿囊素,以土元多肽精华液质量为基准,阿魏酸的质量百分数为0.1%-1%、尿囊素的质量百分数为0.05%-0.5%。
所述增稠剂包括黄原胶和卡波姆,以土元多肽精华液质量为基准,黄原胶的质量百分数为0.01%-0.5%、卡波姆的质量百分数为0.01%-0.5%。
所述螯合剂为EDTA-二钠,以土元多肽精华液质量为基准,EDTA二钠的质量百分数为0.01%-0.1%。
所述防腐剂为苯氧乙醇,以土元多肽精华液质量为基准,苯氧乙醇的质量百分数为0.05%-0.5%。
所述土元多肽由以下方法制成:取适量土元粉碎过80目,加20倍量水煮沸15min,待冷至40℃,以稀盐酸溶液调节pH至1.5-2.0,加入2%土元量的胃蛋白酶,40℃保温酶解1h,以20%氢氧化钠溶液调节pH至7.5-8.0,加入2%土元量的胰蛋白酶,40℃保温酶解3h,加热煮沸15min后,冷却至室温,5000r/min离心15min,取上清液,即为土元多肽酶解液,烘干即得土元多肽。
所述稀盐酸溶液的浓度为1mol/L。
土元多肽精华液的制备方法,步骤如下:
(1)按比例称取土元多肽、肌肽、丙二醇、丁二醇、甘油、透明质酸、甜菜碱、海藻糖、黄原胶、卡波姆、阿魏酸、尿囊素、EDTA-二钠、苯氧乙醇备用;
(2)将甘油、丁二醇、透明质酸、黄原胶、卡波姆、阿魏酸、尿囊素、EDTA-二钠依次倒入水中,搅拌条件下加热至80-90℃,搅拌均匀后恒温搅拌30min,至溶解无颗粒,得溶液Ⅰ;
(3)待溶液Ⅰ降温至45-50℃时,搅拌条件下,加入苯氧乙醇、甜菜碱、海藻糖加入,持续搅拌30min,得溶液Ⅱ;
(4)待溶液Ⅱ降温至37℃时,加入土元多肽和肌肽,搅拌均匀即得土元多肽精华液。
本技术方案能产生的有益效果:
1、土元样品中包含15种氨基酸,种类丰富的氨基酸是构成活性多肽的物质基础;其中羟脯氨酸是胶原蛋白的特征氨基酸之一,羟脯氨酸的含量在一定程度上可以反映皮肤中胶原蛋白的含量,而胶原蛋白是皮肤的主要结构蛋白之一;涂抹精华液的对照组小鼠同正常组小鼠相比,其皮肤中的羟脯氨酸含量显著降低,说明紫外辐射会引起小鼠皮肤中胶原蛋白的流失。而多肽对小鼠皮肤中的胶原蛋白流失有补给作用,土元多肽低剂量给药时,紫外照射小鼠皮肤中的羟脯氨酸含量略有增加,而中剂量、高剂量给药时,小鼠皮肤中的羟脯氨酸含量显著提高。结果表示土元多肽可显著抑制紫外诱导的胶原蛋白损坏。
2、土元多肽酶解液体外抗氧化活性研究实验表明,土元多肽酶解液对DPPH·清除能力随浓度增加而增加,在浓度为1mg/mL时,对DPPH·的清除能力达到88.7%,可见酶解液对DPPH·有较强的清除能力。
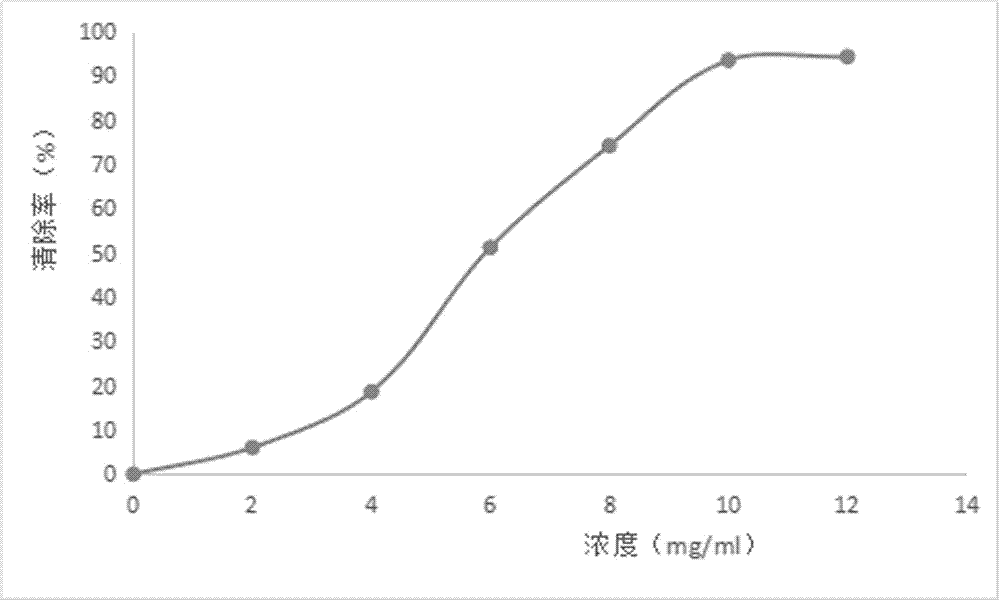
3、超氧根阴离子(O2-.)自由基清除能力测定结果表明,土元多肽酶解液能明显降低邻苯三酚自氧化的速率,呈剂量关系,随着酶解液浓度增加,抑制率迅速增高,但随着浓度增加到一定值后,抑制率不再随浓度增大而继续大幅度提高,在浓度为10mg/mL时,对超氧根阴离子自由基的清除率达到93.5%,可见酶解液对超氧根阴离子有较强的清除作用。
4、羟自由基清除能力测定结果表明,酶解液对羟自由基清除能力随浓度增加而增加,在浓度为2mg/mL时,对羟自由基的清除能力达到100%,可见酶解液对羟自由基有较强的清除能力。
5、还原力测定结果表明,酶解液的浓度与吸光度成一定的线性关系y=0.0786x+0.0073,R2=0.9993,可见还原力与酶解液的浓度是成正比的,随着酶解液浓度的增加,还原力增加,抗氧化能力也同时增加。
6、将土元多肽制备成高中低三种不同浓度的精华液的药效实验表明,模型组小鼠皮肤出现较深皱纹,皮肤松她,显现红斑,皮革样外观,甚至伴有损伤,提示模型造模成功。低剂量组小鼠皮肤出现粗皱纹,有的表现出红色红斑;中剂量组小鼠皮肤除了一些浅皱纹外无损伤。高剂量组小鼠皮肤表面光滑,无明显皱纹;表示土元多肽局部给药可抑制UV诱导的皮肤表观损伤。
7、精华液的细胞学实验表明,a.正常组小鼠清晰可见弹性纤维清晰的网状结构,呈分枝状,排列整齐;模型组小鼠弹性纤维结构和分布情况相似,即大量的弹性纤维破碎,排列紊乱,表明小鼠皮肤经UV照射后引起弹性纤维增粗、断裂、扭曲,部分聚集、缠绕,排列不规则;低剂量组与模型组比较弹性纤维的结构和分布情况没有显著差别。中剂量组可见弹性纤维破裂情况开始恢复,虽有较多粗短的弹性纤维,但出现少量细长旳弹性纤维,排列亦较整齐。高剂量组肉眼可见细长的弹性纤维堆积物,排列较整齐;b.小鼠皮肤中丙二醛含量监测实验显示,经过紫外照射后,小鼠皮肤中MDA的含量升高,随着多肽给药剂量的增加,小鼠皮肤内MDA的含量逐渐降低,结果表明土元多肽可以抑制紫外辐照引起的小鼠皮肤中的MDA含量的异常增多;c.土元多肽对光老化皮肤中SOD、GSH-Px、CAT活力的检测试验表明,土元多肽能够显著增加光老化皮肤中SOD、GSH-Px、CAT的含量,并抑制皮肤中的水分流失。
附图说明
图1为土元样品的色谱图,其中A为空白溶剂的HPLC;B为17种氨基酸混合标准品HPLC;C为土元样品HPLC图。
图2为土元多肽酶解液对DPPH清除效果图。
图3为土元多肽酶解液对超氧根阴离子清除效果图。
图4为土元多肽酶解液对羟自由基的清除效果图。
图5为土元多肽酶解液的还原能力图。
图6为五组小鼠涂抹不同浓度的精华液的效果图。
图7为HE染色法观察五组小鼠涂抹不同浓度的精华液的皮肤组织结构图。
图8为醛品红着色法观察五组小鼠涂抹不同浓度的精华液的皮肤弹性纤维结构图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一、土元多肽的提取工艺研究
利用仿生酶解方法提取土元,仿生酶解法即将土元先后以胃蛋白酶、胰蛋白酶在最佳酶解条件下酶解,所得的酶解液即为仿生酶解液。为了确定多肽提取的最佳条件,根据加水量,加酶量,酶解时间对多肽含量的影响以正交表进行设计,因素水平见表1。
表1酶解工艺正交实验因素水平
酶解工艺的正交实验结果见表2.
表2正交实验表
由表2分析可得以所得多肽含量与浓度为1mg/ml时对DPPH自由基的清除率为筛选指标,优选出最佳的工艺处方,即取适量土元药材粉碎过80目,加20倍量水煮沸15min,待冷至40℃,以稀盐酸溶液调节pH1.5-2.0,加入2%土元量的胃蛋白酶,40℃保温酶解1h,以20%氢氧化钠溶液调节pH7.5-8.0,加入2%土元量的胰蛋白酶,40℃保温酶解3h,加热煮沸15min,5000r/min离心15min,取上清液,即为土元酶解液,烘干后即得土元多肽。
二、土元多肽氨基酸种类及含量分析
2.1实验方法
取土元粉末2g,置于烧瓶中,加入10ml 6mol/L盐酸溶液,抽真空后充氮气,反复3次,密封,110℃烘箱内放置24h,反应结束后将水解液过滤,定容至50ml,精密吸取1ml真空干燥,再用0.1mol/L盐酸溶液定容至5ml,即为酸水解供试品溶液。精密吸取样品溶液200μl、标准品200μl,分别加入OPA衍生化试剂1000μl、500μl,于涡旋混合器上振荡2min,经0.22μm微孔滤膜过滤后取样分析。
2.2实验结果
2.2.1土元多肽的HPLC色谱图
空白溶剂,17种氨基酸标准品,土元样品的色谱图如图1所示。
1为Asp天冬氨酸2.Glu谷氨酸3.Ser丝氨酸4.His组氨酸5.Gly甘氨酸6.Thr苏氨酸7.Ala丙氨酸8.Arg精氨酸9.Tyr酪氨酸10.Cys半胱氨酸11.Val缬氨酸12.Met蛋氨酸13.Phe苯丙氨酸14.Iso异亮氨酸15.Leu亮氨酸16.Lys赖氨酸17.Pro脯氨酸
2.2土元中氨基酸含量测定
土元样品中包含15种氨基酸,种类丰富的氨基酸是构成活性多肽的物质基础,由于在酸性条件下,组氨酸、色氨酸容易被破坏,没有检测出来。
表3土元的氨基酸含量(mg/1g)
三、仿生酶解土元多肽体外抗氧化活性研究
3.1DPPH·清除能力测定
用无水乙醇配制1×10-4mol/L的DPPH·溶液,避光保存备用。分别取2mL酶解液于试管中,加入2mL所配制的DPPH溶液,混合均匀,室温30min后倒入光径为1cm的比色皿中在517nm处测定其吸光度,同时测定样品空白以及不加酶解液的空白样的吸光度。按下式计算其对DPPH·的自由基清除率:
清除率(%)=(1-(Ai-Aj)/A0)×100%
其中:Ai=2mL DPPH·溶液+2mL样品液的吸光度;Aj=2mL样品液+2mL乙醇的吸光度;A0=2mL DPPH·溶液+2mL样品溶剂的吸光度。
1,1-二苯基-2-三硝基苯肼自由基(DPPH·)是一种稳定的自由基,溶于乙醇后为深紫色,在517nm下有最大光吸收值。DPPH当有抗氧化剂存在情况下,其孤对电子被配对,紫色减弱,光吸收值随之减弱或消失。通过测定光吸收值减弱的程度,可评价抗氧化剂的清除活性。测定结果如图2所示,表明酶解液对DPPH·清除能力随浓度增加而增加,在浓度为1mg/mL时,对DPPH·的清除能力达到88.7%,可见酶解液对DPPH·有较强的清除能力。
3.2超氧阴离子(O2-.)自由基清除能力测定
a.邻苯三酚氧化速率的测定:取pH8.2,50mmol/L的Tris-HCl缓冲液5mL于比色管中,再加入1mL水,于25℃恒温10min,再加入25℃恒温的6mmol/L邻苯三酚溶液0.15mL,混匀,3min后迅速于1cm比色皿中320nm波长测光吸收值A0。
b.酶解液活性测定:步骤与1相同,只是用1mL一定浓度的酶水解液代替1mL水,混匀,3min后迅速于320nm波长处测光吸收值Ai。
c.酶解液颜色的干扰:步骤与1相同,只是用1ml一定浓度的酶解液代替1ml水,0.15ml10mmol/L HCl代替0.15ml邻苯三酚,混匀,3min后迅速于320nm波长处测光吸收值Aj.
清除率(%)=(1-(Ai-Aj)/A0)×100%。
结果如图3所示,土元多肽酶解液能明显降低邻苯三酚自氧化的速率,呈剂量关系,随着酶解液浓度增加,抑制率迅速增高,但随着浓度增加到一定值后,抑制率不再随浓度增大而继续大幅度提高,在浓度为10mg/mL时,对超氧根阴离子自由基的清除率达到93.5%,可见酶解液对超氧根阴离子有较强的清除作用。
3.3羟自由基清除能力测定
取1.0mL浓度为1.865mmol/L邻二氮菲的无水乙醇溶液于带塞试管中,分别加入浓度为0.2mol/L的pH 7.4磷酸盐缓冲液2ml和1ml不同浓度的样品,充分混匀后加入1.0ml浓度为1.865mmol/L的FeSO4·7H2O溶液,再次混匀后加入1.0ml 0.03%(v/v)的H2O2,于37℃恒温水浴,60min后,在536nm下分别测量各组混合溶液的吸光度值得As,以蒸馏水代替样品作为空白组测吸光度值得Ab,以蒸馏水替代H2O2作为损伤组,测其吸光度值An。
清除率(%)=[(As-An)/(Ab-An)]×100%。
邻二氮菲可与Fe2+形成络合物,此络合物在536nm处有最大吸收峰,其颜色变化反映溶液氧化还原状态的改变。H2O2/Fe2+体系可通过Feton反应产生羟基自由基,邻二氮菲-Fe2+水溶液被羟自由基氧化为邻二氮菲-Fe3+后,其536nm最大吸收峰消失,如果反应体系中同时存在羟自由基清除剂,则Fenton反应产生的羟自由基将被此清除,邻二氮菲-Fe2+络合物受到的破坏将会减少。
如图4所示,酶解液对羟自由基清除能力随浓度增加而增加,在浓度为2mg/mL时,对羟自由基的清除能力达到100%,可见酶解液对羟自由基有较强的清除能力。
3.4还原力的测定
将酶解液溶于0.2mol/L pH6.6的磷酸缓冲溶液,配成0、1、2、4、6、8、10mg/ml样品溶液。取样品溶液0.25ml,加入0.25ml0.2mol/L pH6.6的磷酸缓冲溶液和0.25ml1%的铁氰化钾(K3Fe(CN)6)于1.5mL离心管中混合均匀,50℃水浴20min后加入0.25ml10%三氯乙酸溶液,5000r/min离心10min。取上清液0.5ml,加入2.5ml蒸馏水和0.1ml 0.2%三氯化铁(FeCl3)溶液,混匀,室温下反应10min,于700nm下检测吸光值。
还原能力是表示抗氧化物质提供H的重要指标,抗氧化物质通过提供H可使自由基变为稳定的分子,从而失去活性。以普鲁士蓝[Fe4(Fe(CN)6)3]的生成量作为指标,将K3Fe(CN)6还原成K4Fe(CN)6,K4Fe(CN)6再利用Fe3+形成普鲁士蓝,由700nm处吸光值变化测定还原力大小,样品在700nm处的吸光值越大,其总还原能力越强,而样品的抗氧化能力也就越强。
如图5所示,酶解液的浓度与吸光度成一定的线性关系y=0.0786x+0.0073,R2=0.9993,可见还原力与酶解液的浓度是成正比的,随着酶解液浓度的增加,还原力增加,抗氧化能力也同时增加。
四、土元多肽精华液的制备及药效研究
4.1.a土元多肽精华液的制备方法,步骤如下:
(1)按比例称取土元多肽5%、肌肽2%、丙二醇3%、丁二醇3%、甘油3%、透明质酸0.3%、甜菜碱2%、海藻糖2%、黄原胶0.1%、卡波姆0.1%、阿魏酸0.5%、尿囊素0.1%、EDTA-二钠0.05%、苯氧乙醇0.2%,余量为水,备用;
(2)将甘油、丁二醇、透明质酸、黄原胶、卡波姆、阿魏酸、尿囊素、EDTA-二钠依次倒入水中,搅拌条件下加热至85℃,搅拌均匀后恒温搅拌30min,至溶解无颗粒,得溶液Ⅰ;
(3)待溶液Ⅰ降温至48℃时,搅拌条件下,加入苯氧乙醇、甜菜碱、海藻糖加入,持续搅拌30min,得溶液Ⅱ;
(4)待溶液Ⅱ降温至37℃时,加入土元多肽和肌肽,搅拌均匀即得土元多肽精华液。
4.1.b土元多肽精华液的制备方法,步骤如下:
(1)按比例称取土元多肽2%、肌肽5%、丙二醇1%、丁二醇1%、甘油1%、透明质酸0.1%、甜菜碱0.1%、海藻糖0.1%、黄原胶0.01%、卡波姆0.01%、阿魏酸0.1%、尿囊素0.05%、EDTA二钠0.01%、苯氧乙醇0.05%,余量为水,备用;
(2)将甘油、丁二醇、透明质酸、黄原胶、卡波姆、阿魏酸、尿囊素、EDTA-二钠依次倒入水中,搅拌条件下加热至80℃,搅拌均匀后恒温搅拌30min,至溶解无颗粒,得溶液Ⅰ;
(3)待溶液Ⅰ降温至45℃时,搅拌条件下,加入苯氧乙醇、甜菜碱、海藻糖加入,持续搅拌30min,得溶液Ⅱ;
(4)待溶液Ⅱ降温至37℃时,加入土元多肽和肌肽,搅拌均匀即得土元多肽精华液。
4.1.c土元多肽精华液的制备方法,步骤如下:
(1)按比例称取土元肌肽8%、肌肽1%、丙二醇5%、丁二醇5%、甘油5%、透明质酸1%、甜菜碱3%、海藻糖3%、黄原胶0.5%、卡波姆0.5%、阿魏酸1%、尿囊素0.5%、EDTA二钠0.1%、苯氧乙醇0.5%,余量为水,备用;
(2)将甘油、丁二醇、透明质酸、黄原胶、卡波姆、阿魏酸、尿囊素、EDTA-二钠依次倒入水中,搅拌条件下加热至90℃,搅拌均匀后恒温搅拌30min,至溶解无颗粒,得溶液Ⅰ;
(3)待溶液Ⅰ降温至50℃时,搅拌条件下,加入苯氧乙醇、甜菜碱、海藻糖加入,持续搅拌30min,得溶液Ⅱ;
(4)待溶液Ⅱ降温至37℃时,加入土元多肽和肌肽,搅拌均匀即得土元多肽精华液。
4.2药效学实验
实验方法:健康小鼠,雌性,30只,25g左右,动物均饲养在自然光暗周期的条件下,且饲养于温度为23±2℃,湿度为50%±10%的环境中。动物自由进食进水,正常饲养7天后随机分组,分为以下5组:正常组、模型组、土元多肽低剂量组、土元多肽中剂量组、土元多肽高剂量组,每组6只。
供试液的制备:将4.1.a中制备的精华液制备成高浓度为6%、中浓度为4%、低浓度为2%的精华液。
造模及给药:
各组小鼠称重,做标记,开始如下处理:
备皮:在小鼠背部正中位置皮肤处先用手术剪刀剪去长毛后,再用电动剃毛器轻轻推剪以去除绒毛,使其形成约3cm×3cm大小的裸露区域。
照射光源:UVA灯管1根和UVB灯管2根并列穿插安装到自制模拟日光箱中。
照射条件及最小红斑剂量(MED)的确定:将小鼠置于平整的圆形自制不锈钢鼠罩内,紫外灯保持距离鼠罩30cm处照射,灯管预热15min,待强度稳定才可开始照射,取除正常组外的其他各组小鼠,每组小鼠同一部位照射按上述条件进行短时照射,照射后24h对小鼠照射部位进行肉眼观察,以首先产生淡红斑的照射时间对应的剂量作为MED,其照射时间可作为照射剂量的控制指标,以三名实验人员同时观察,以同时获得2名以上人员认可的剂量为依据。
照射方式:经MED预试的小鼠皮肤恢复7天后才能开始试验。照射强度第一周为1MED,第二周起每周增加1MED增加到第四周,之后从第五周至第十周维持每周4MED。每周照射4次(星期一、三、五除外);总辖射剂量约为9.52J/cm2。整个实验期间,每天需仔细观察小鼠背部皮肤表观,若有水疱、糜烂出现则立即停止照射直至该性状消失为止。、
给药方法:将土元多肽精华液制备成高中低三种不同的浓度。各组小鼠在紫外线照射前2小时,在背部裸露皮肤上涂抹相应浓度的精华液,每天1次,共计8周。
实验结果:
如图6所示,模型组小鼠皮肤出现较深皱纹,皮肤松她,显现红斑,皮革样外观,甚至伴有损伤,提示模型造模成功。低剂量组小鼠皮肤出现粗皱纹,有的表现出红色红斑。中剂量组小鼠皮肤除了一些浅皱纹外无损伤。高剂量组小鼠皮肤表面光滑,无明显皱纹。提示土元多肽局部给药可抑制UV诱导的皮肤表观损伤。
4.3土元多肽对小鼠光老化模型保护作用的机制研究
长期在烈日下曝晒是引起和促进皮肤光老化最重要的环境因素,根据Harman的自由基理论,衰老与自由基、脂质过氧化有关,Harman认为衰老是由于细胞正常代谢过程中产生的自由基有害作用造成的。常见的自由基清除因子主要有一些大分子的物质如SOD、GSH等和小分子的维生素类物质。多肽作为一种皮肤的基本结构,不但具有一定的抗氧化作用而且对老化皮肤中胶原蛋白的流失有供给作用。
4.3.1实验方法
10%组织匀浆的制备:小鼠脱颈椎处死后,准确称量皮肤的重量,加入9倍于小鼠皮肤重量的预冷生理盐水,将皮肤组织剪碎后冰浴匀浆,8000r/min离心20min,取上清液冷冻备用。
组织标本的制备及HE染色:切片复水后用苏木素染液染色5min,用1%的盐酸进行快速分色后用自来水冲洗数分钟直至组织染色变蓝,用1%的伊红染液染色1s,分别用95%的乙醇溶液分色3min,100%的乙醇分色3min,最后将切片放入二甲苯中直至脱水完全,在二甲苯中透明后用中性树胶封片。
皮肤中弹性纤维的变化:切片脱蜡至水,0.5%高锰酸钾水溶液处理5min,水洗,2%草酸漂白l-2min,流水冲洗5min,随即用70%乙醇洗1min,碱性品红液浸染lOmin,70%乙醇分化至切片不再脱色为止,水洗,0.5%橙黄G液滴染约30s,切片经常规脱水、透明,中性树胶封固(同HE染色部分)后于光镜下观察并拍摄记录。
如图7所示,正常组小鼠皮肤组织结构完整,皮肤组织分层清晰,表皮厚度正常,真皮层的纤维组织呈波浪状并且排列有序;对照组小鼠皮肤组织层可见明显的表皮局部增厚,变得厚薄不均,胶原纤维成团,皮肤中附属器官排列紊乱,皮肤分层不明显;低剂量组小鼠皮肤表皮厚度相对正常组有所增加,胶原纤维有一定的修复;中剂量组小鼠表皮增厚现象减轻,胶原纤维束增多变厚,紧密交织;高剂量组小鼠表皮厚度显著减轻,胶原纤维束显著增厚,增多,排列紧密有序。如图8所示,正常组小鼠清晰可见弹性纤维清晰的网状结构,呈分枝状,排列整齐;模型组小鼠弹性纤维结构和分布情况相似,即大量的弹性纤维破碎,排列紊乱,表明小鼠皮肤经UV照射后引起弹性纤维增粗、断裂、扭曲,部分聚集、缠绕,排列不规则;低剂量组与模型组比较弹性纤维的结构和分布情况没有显著差别。中剂量组可见弹性纤维破裂情况开始恢复,虽有较多粗短的弹性纤维,但出现少量细长旳弹性纤维,排列亦较整齐。高剂量组肉眼可见细长的弹性纤维堆积物,排列较整齐。
皮肤中羟脯氨酸含量的变化:空白管中加入双蒸水1ml,备用;标准管加入5μg/ml的标准应用液1ml,备用;测定管加入1ml检测液,备用。以上三管中均依次加入试剂一0.5ml,混匀静置10min,再加入试剂二0.5ml,混匀静置5min,加入试剂三0.5ml,混匀,于60℃水浴15min冷却后,3500r/min离心10min,取上清液于550nm处,1cm光径,以双蒸水调零,测各管吸光度值。
羟脯氨酸是胶原蛋白的特征氨基酸之一,羟脯氨酸的含量在一定程度上可以反映皮肤中胶原蛋白的含量,而胶原蛋白是皮肤的主要结构蛋白之一。从表4中可见,
表4小鼠皮肤中羟脯氨酸含量的变化(平均值+标准偏差)
对照组小鼠同正常组小鼠相比,其皮肤中的羟脯氨酸含量显著降低,说明紫外辐射会引起小鼠皮肤中胶原蛋白的流失。而多肽对小鼠皮肤中的胶原蛋白流失有补给作用,土元多肽低剂量给药时,紫外照射小鼠皮肤中的羟脯氨酸含量略有增加,而中剂量、高剂量给药时,小鼠皮肤中的羟脯氨酸含量显著提高。结果提示土元多肽可显著抑制紫外诱导的胶原蛋白损坏。
皮肤中丙二醛含量的变化:取样品空白管中依次加入无水乙醇0.15ml和试剂一0.15ml,混匀后依次加入试剂二3ml和试剂三1ml,备用;标准管依次加入10nmol/ml的MDA标准液0.15ml和试剂一0.15ml,混匀后再依次加入试剂二3ml和试剂三1ml,备用。测定管中依次加入制备的10%组织匀浆0.15ml和试剂一0.15ml,混匀后再依次加入试剂二3ml和试剂三1ml,备用;对照管中依次加入样品液0.15ml和试剂一0.15ml,混匀后再依次加入试剂二3ml和50%冰醋酸1ml,备用;上述四管均置于旋涡混匀器混匀,试管口用保鲜薄膜扎紧,用针头剌一小孔,95℃沸水浴40min,取出后流水冷却,然后4000转/min离心10min,取上清液,532nm处,1cm光径,以蒸馏水调零,测定各管吸光度0D值。
丙二醛(MDA)是脂质过氧化的最终产物,在一定程度上可以评估脂质过氧化对细胞的损伤程度。经过紫外照射后,小鼠皮肤中MDA的含量升高,从表5可以看出,
表5小鼠皮肤中MDA含量的变化(平均值+标准偏差)
对照组同正常组相比MDA含量存在显著差异,随着多肽给药剂量的增加,小鼠皮肤内MDA的含量逐渐降低,结果表明土元多肽可以抑制紫外辐照引起的小鼠皮肤中的MDA含量的异常增多。
皮肤中抗氧化指标的测定:皮肤中SOD活力的测定方法:严格按照超氧化物歧化酶SOD试剂盒(南京建成)说明书配制各种所需试剂。测定管中依次加入试剂一1.0ml,制备的10%的组织匀浆O.05ml,试剂二0.1ml,试剂三0.1ml,试剂四0.1ml,用涡旋混匀器充分混匀,置37℃恒温水浴40分钟,备用。对照管中依次加入试剂一1.0ml,蒸馏水0.05ml,试剂二0.1ml,试剂三0.1ml,试剂四0.1ml,用涡旋混匀器充分混匀,置37℃恒温水浴40分钟,备用。以上两管各加入显色剂2ml,混匀,室温放置10min,于波长550nm处,1cm光径,以蒸馏水调零,测定各管吸光度0D值。
抗氧化酶通常被认为是评价机体抗氧化水平的指标,如图表6所示,对照组与正常组相比较,SOD含量显著降低,而低剂量组、中剂量组、高剂量组与正常组相比较,SOD含量无显著性差异,甚至还有所提高,说明土元多肽能够显著增加光老化皮肤中SOD的活力。
表6土元多肽对光老化皮肤中SOD活性的影响
抗氧化酶通常被认为是评价机体抗氧化水平的指标。
皮肤中GSH-PX活力的测定:严格按照谷胱甘肽过氧化物酶GSH-PX试剂盒(南京建成)说明书配制各种所需试剂,按试剂盒的说明书步骤进行酶促反应和显色反应。取上述四管,于412nm处,1cm光径,以双蒸水调零,测定各管吸光度OD值。结果如表7所示:
表7土元多肽对光老化皮肤中GSH-Px活力的影响
对照组与其他组相比较GSH-Px的活力显著降低,低剂量组GSH-Px活力高于对照组,中剂量组、高剂量组GSH-Px活力高于低剂量组,说明土元多肽能够显著增加光老化皮肤中GSH-Px的活力。
皮肤中CAT活力的测定:严格按照过氧化氢酶CAT试剂盒(南京建成)说明书配制各种所需试剂。按照试剂盒中操作步骤操作。
CAT活力测定操作表
将各管混合均匀,于波长405nm处,光径0.5cm,蒸馏水调零,测定各管的吸光度值。
结果如表8所示:
表8土元多肽对光老化皮肤中CAT(过氧化氢酶)活力的影响
皮肤组织中水份含量的变化:将小鼠脱颈椎处死后,取0.2g左右的皮肤,采用国标GB/T5009.3-2010烘干法,干燥至完全,测定皮肤中水分的含量。土元多肽对小鼠皮肤中含水量的影响:皮肤在长时间的紫外辐射下,会加速其中的水份流失,造成皮肤干燥,加速了皮肤的老化及褶皱的产生。如表9所示,对照组与正常组相比皮肤含水量显著降低,说明紫外辐射会引起皮肤中水份含量的降低。
表9土元多肽对小鼠皮肤中含水量的影响
低剂量组与对照组相比,小鼠皮肤中含水量有所增加,中剂量组与高剂量组小鼠皮肤中的含水量显著增加,说明土元多肽可以抑制皮肤中的水份流失。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!